Синдром Маллори—Вейсса
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
В статье представлен клинический случай фатального синдрома Меллори- Вейсса, внезапно развившегося у 86-летней пациентки с новой коронавирусной инфекцией COVID-19, осложненной двухсторонней полисегментарной пневмонией. В анамнезе у пациентки не было сведений о наличии гастроэзофагеальной рефлюксной болезни, язвенной болезни желудка или двенадцатиперстной кишки. Уровень Д-димера при поступлении был повышенным, но пациентке была назначена редуцированная доза антикоагулянтов (гепарина). Несмотря на первоначальную положительную динамику состояния, у больной наблюдалось волнообразное течение COVID-19 с последующим развитием синдрома МеллориВейсса, крайне тяжелой постгеморрагической анемии и полиорганной недостаточности, которые и стали причиной летального исхода.
Ключевые слова
Об авторах
Федеральное государственное бюджетное образовательное учреждение высшего образования «Иркутский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
Гома Татьяна Владимировна, ассистент кафедры факультетской терапии, к. м. н.
ул. Красного Восстания, 1, Иркутск, Иркутская область, 664003
Федеральное государственное бюджетное образовательное учреждение высшего образования «Иркутский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
Козлова Наталия Михайловна, заведующая кафедрой факультетской терапии, д. м. н.
ул. Красного Восстания, 1, Иркутск, Иркутская область, 664003
Федеральное государственное бюджетное образовательное учреждение высшего образования «Иркутский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
Быков Юрий Николаевич, заведующий кафедрой нервных болезней, д. м. н., профессор
ул. Красного Восстания, 1, Иркутск, Иркутская область, 664003
Список литературы
1. Al- Samkari H., Karp Leaf R. S., Dzik W. H., et al. COVID-19 and coagulation: bleeding and thrombotic manifestations of SARS-CoV-2 infection. Blood. 2020;136:489–500. Doi:10.1182/blood.2020006520
2. Чередников Е. Ф., Малеев Ю. В., Черных А. В. и соавт. Современные взгляды на этиологию и патогенез разрывно- геморрагического синдрома (синдрома Меллори- Вейсса). Журнал анатомии и гистопатологии. 2016;5(1):86–98. doi:10.18499/2225–7357–2016– 5–1–86–98
3. Белобородов В. А., Кожевников М. А., Кель чевская Е. А. и соавт. Пищеводные геморрагические синдромы. Acta Biomedica Scientifi ca. 2019;4(3):81–88. doi:10.29413/ABS.2019–4.3.10
4. Blevins C.H., Iyer P. G., Vela M. F., Katzka D. A. Th e Esophageal Epithelial Barrier in Health and Disease. Clinical gastroenterology and hepatology. 2018;16(5):608– 617. Doi:10.1016/j.cgh.2017.06.035
5. Zhang H., Penninger J. M., Li Y., et al. Angiotensinconverting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive care medicine. 2020;46(4):586–590. Doi:10.1007/ s00134–020–05985–9
6. Драпкина О. М., Маев И. В., Бакулин И. Г. и соавт. Временные методические рекомендации: «Болезни органов пищеварения в условиях пандемии новой коронавирусной инфекции (COVID-19). Профилактическая медицина. 2020;23(3): 2120–2152. Doi:10.17116/profmed202023032120
9. Mao R., Qiu Y., He J. S., et al. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis. Th e lancet. Gastroenterology & hepatology. 2020;5(7):667–678. Doi:10.1016/S2468–1253(20)30126–6
10. Pan L., Mu M., Yang P., et al. Clinical Characteristics of COVID-19 Patients With Digestive Symptoms in Hubei, China: A Descriptive, Cross- Sectional, Multicenter Study. The American journal of gastroenterology. 2020 May;115(5):766–773. Doi:10.14309/ ajg.0000000000000620
11. Meloy P., Bhambri A. Esophageal Rupture Associated With COVID-19: A Novel Case Report. Cureus. 2020 Dec 24;12(12): e12256. Doi:10.7759/cureus.12256
Синдром Маллори—Вейсса
Центральная городская клиническая больница, г. Великий Новгород
ГБУЗ "Александровская больница", Санкт-Петербург
Клиника №1 Центральной городской клинической больницы, Великий Новгород
ГБУЗ "Александровская больница", Санкт-Петербург
Кафедра последипломного образования Института международных отношений Новгородского университета им. Ярослава Мудрого
Эффективность применения эндоскопических технологий при синдроме Маллори-Вейсса
Центральная городская клиническая больница, г. Великий Новгород
Статья посвящена рассмотрению эффективности применения эндоскопических методов гемостаза при синдроме Маллори-Вейсса. Для этой цели был проведен анализ лечения 549 пациентов, которые были разделены на 2 группы : с 2000 по 2004 г. - в лечении не использовались эндоскопические методы и с 2005 по 2011 г. - в диагностике и лечении такие методы использовались. Констатировано значительное снижение оперативной активности и общей летальности в связи с широким применением эндоскопических методов.
Центральная городская клиническая больница, г. Великий Новгород
ГБУЗ "Александровская больница", Санкт-Петербург
Клиника №1 Центральной городской клинической больницы, Великий Новгород
ГБУЗ "Александровская больница", Санкт-Петербург
Кафедра последипломного образования Института международных отношений Новгородского университета им. Ярослава Мудрого
Синдром Маллори—Вейсса (СМВ) — состояние, при котором возникает развитие острых различной степени выраженности продольных разрывов слизистой оболочки абдоминального отдела пищевода или кардии желудка, проявляющееся выраженным пищеводно-желудочным кровотечением. Данная нозология занимает 3—4-е место среди причин кровотечения из верхних отделов желудочно-кишечного тракта [1] и характеризуется высоким риском развития рецидива, наблюдающимся, по данным различных авторов, в 20—35% случаев; общая летальность при этом составляет 5—10% [1, 2]. Эти данные отражают нерешенную проблему лечения больных с данной патологией, актуальность которой остается значимой наряду с другими причинами кровотечений из верхних отделов желудочно-кишечного тракта, такими как гастродуоденальные язвы и синдром портальной гипертензии.
Основной причиной, предрасполагающей к возникновению разрывов пищеводно-желудочного перехода, является злоупотребление алкоголем с последующей рвотой [3]. Тяжесть кровотечения зависит от глубины разрывов стенки этих органов, когда могут быть повреждены различные по диаметру сосуды подслизистого сплетения, а также сосуды мышечного и субсерозного слоев пищевода и желудка [4].
Хирургическое лечение больных с СМВ включает остановку кровотечения путем применения широкой лапаротомии, гастротомии и ушивания разрывов. В наши дни благодаря широкому внедрению малоинвазивных технологий и применению эндоскопического оборудования открылись новые возможности лечения таких больных путем комбинированного воздействия на очаг кровотечения различных способов эндоскопического гемостаза с одновременным применением общих мероприятий, направленных на остановку кровотечения, подавление секреции желудочного сока и кровезамещение [5, 6]. Успешность применения эндоскопических методов во многом зависит от применения грамотного и обоснованного алгоритма действий с использованием критериев оценки возможностей эндоскопического гемостаза, учета прогноза возможного рецидива, сопутствующей патологии и динамического состояния у каждого пациента.
Целью исследования явилась оценка эффективности лечения СМВ в условиях стационара неотложной помощи при преимущественном использовании эндоскопических способов гемостаза.
Материал и методы
Для решения поставленных задач был проведен анализ лечения 549 пациентов с кровотечением из зоны разрыва пищеводно-желудочного перехода, поступивших в хирургическую клинику в экстренном порядке в период с 2000 по 2011 г.
Нами ретроспективно были проанализированы истории болезней 207 пациентов с СМВ, пролеченных до широкого применения эндоскопии, с 2000 по 2004 г. При этом 156 пациентов с клинической картиной кровотечения легкой и средней степени кровопотери лечили консервативно. В экстренном порядке на фоне неэффективности консервативных методик, с признаками нестабильной гемодинамики и с тяжелой кровопотерей традиционно прооперирован 51 пациент.
С 2005 по 2011 г. одновременно с внедрением лечебной эндоскопической практики мы изучили 342 случая СМВ. Все эндоскопические исследования выполнены в пределах 3 ч после поступления больных в стационар. Всех их помещали в блок критических состояний, размещенный на уровне приемного отделения, с целью подготовки верхних отделов пищеварительного тракта к эндоскопическим манипуляциям (промывание желудка и пищевода холодным изотоническим раствором натрия хлорида до светлых вод, введение прокинетиков для быстрого опорожнения желудка), введения седативных средств неспокойным пациентам, восполнения объема циркулирующей крови и одновременного дополнительного обследования с осмотром необходимых специалистов, нивелирования последствий алкогольного опьянения. Все исследования проводили под адекватным обезболиванием в условиях палаты интенсивной терапии под наблюдением реанимационной бригады.
При первичной эндоскопии выявить источник кровотечения удалось в 73,4%. Эндоскопические вмешательства продолжались от 10 до 40 мин в зависимости от перечисленных выше факторов. Продолжающееся кровотечение было выявлено у 177 (51,8%) больных, при этом струйное — у 84 (24,6%) и диффузное — у 93 (27,2%). Продолжающееся кровотечение отсутствовало у 165 (48,2%) больных.
Эндоскопический гемостаз посредством инъекционного метода (0,005% раствор адреналина, изотонический раствор натрия хлорида) осуществлен у 171 пациента, у 83 — термические (диатермокоагуляция и аргоноплазменная коагуляция) и у 26 — механические методы (эндоскопическое клипирование кровоточащего сосуда и эндоскопическое лигирование зоны разрыва латексными кольцами). Комбинированные методы эндоскопического гемостаза применили у 62 больных (инъекционный метод и механический, инъекционный и термический).
В случае отсутствия продолжающегося кровотечения (165 больных) при эндоскопии выполняли профилактические аппликации в виде инъекционного метода либо диатермокоагуляции.
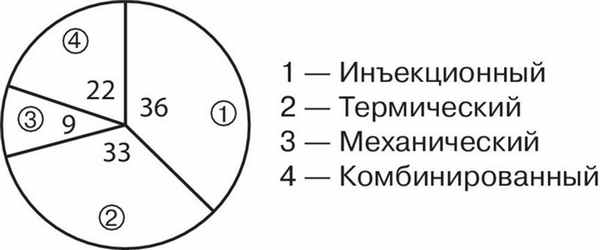
Эффективность того или иного способа эндоскопического гемостаза оценивали по таким показателям, как устойчивость гемостаза и отсутствие рецидивов в раннем периоде (рис. 1). Рисунок 1. Частота возникновения рецидивов синдрома Маллори—Вейсса после применения эндоскопических методов лечения (%).
Как показал наш опыт, наиболее эффективными и дающими мало рецидивов методами эндоскопического гемостаза при СМВ оказались механические и комбинированные виды аппликаций. Менее эффективными были моновариантные методы эндоскопического гемостаза, инъекционный и термический, при которых рецидивы кровотечения возникали чаще.
Размеры выявленных повреждений варьировали от 5 до 50 мм, ширина от 2 до 10 мм, глубина разрывов от 2 до 7 мм. Для оценки степени глубины разрывов использовали классификацию H. Bellmann, основанную на оценке глубины разрывов: I степень выявлена у 211 (61,7%) больных, II степень — у 129 (37,7%), III степень — у 4 (1,2%).
Статистический анализ полученных результатов проведен методом вариационной статистики. Достоверность различий оценивали при помощи параметрических и непараметрических критериев. Различия считали достоверными при значении р≤0,05.
Результаты и обсуждение
У больных 1-й группы, пролеченных за 2000—2004 гг., которым с целью достижения устойчивого гемостаза выполняли гастротомию с прошиванием зоны разрывов, показаниями к операции служили признаки тяжелой кровопотери, продолжающееся кровотечение, рецидивы кровотечения на фоне безуспешной консервативной терапии. У ряда больных в послеоперационном периоде наступили различные осложнения, умерли 14. Таким образом, общая летальность у больных с СМВ, пролеченных до широкого использования эндоскопических методик, составила 6,8%.
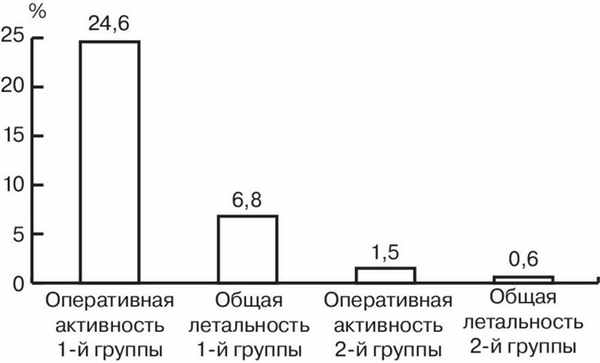
С 2005 г. лечебную эндоскопию выполняли всем больным, даже в отсутствие признаков продолжающегося кровотечения. У 39 (11,4%) больных выявлен рецидив кровотечения, в связи с чем выполняли повторный эндоскопический гемостаз, при этом, как правило, использовали комбинированные способы гемостаза. Традиционным способом прооперированы 5 больных. Умерли 2 больных с алкогольным циррозом печени и печеночной недостаточностью. Общая летальность составила 0,58% (рис. 2). Рисунок 2. Летальность в сравниваемых группах больных.
Оперативная активность в 1-й группе составила 24,6%, во 2-й — 1,5%. Стоит отметить, что во 2-й группе больных практически во всех случаях удавалось добиться гемостаза при помощи эндоскопических методик, и хирургические вмешательства выполняли при выявлении глубоких разрывов III степени в связи с опасностью перфорации желудка, а также при развитии рецидивов кровотечения, не подвергшемуся остановке повторным применением эндоскопического метода.
Выводы
Эндоскопические методы позволяют добиться устойчивого гемостаза при СМВ, а в случае развития рецидивов хорошие результаты дает применение комбинированных эндоскопических методик.
Внедрение эндоскопических технологий способствует снижению оперативной активности и общей летальности при СМВ.
Эндоскопические методы помогают произвести оценку степени разрыва СМВ и темпа кровотечения и, в случае глубоких разрывов, помогают добиться временного контролируемого гемостаза с целью адекватного проведения предоперационной подготовки.
Комплексное лечение больных с синдромом Маллори-Вейсса Текст научной статьи по специальности «Клиническая медицина»
Аннотация научной статьи по клинической медицине, автор научной работы — Мухаммадзода Р., Гульмурадов Ташпулат Гульмурадович
Похожие темы научных работ по клинической медицине , автор научной работы — Мухаммадзода Р., Гульмурадов Ташпулат Гульмурадович
Complex treatment of patients with Mallory-Weiss syndrome
Текст научной работы на тему «Комплексное лечение больных с синдромом Маллори-Вейсса»
отделениях Городской клинической больницы №5 и ГКБ скорой помощи г.Душанбе.
Для объективности исследования больные с СМВ были распределены в две группы: контрольную - 68 пациентов (49 мужчин; 19 женщин), которые получали лечение по общепринятым методам (ретроспективный анализ) и основную (проспективное исследование) -73 больных (59 и 14), которым проведено комплексное лечение с применением программного эндоскопического гемостаза (склеротерапия, орошение дефекта слизистой препаратом «Лифузоль» и клеевая аппликация). Возраст больных колебался от 19 до 78 лет.
Больным с СМВ основной и контрольной групп (п=141) консервативную терапию начинали с постановки назогастрального зонда и промывания желудка ледяной водой.
Инфузионно-трансфузионную терапию при СМВ начинали с переливания солевого раствора со скоростью 5-10 мл/мин., при тяжёлой кровопотере - в объёме 1-2 литра со скоростью 100 мл/мин. до стабилизации гемодинамики. При продолжающемся кровотечении и нестабильности гемодинамики показано переливание коллоидных растворов свежезамороженной плазмы и эритроцитарной массы.
Всем больным основной группы, до и после эндоскопического гемостаза был назначен препарат «Октре-отид» (Сандостатин «ЫОУАВИБ»), который вызывает сужение артерий брюшной полости, уменьшает возврат крови в портальную систему и снижает давление в воротной вене на 15-30%, что в свою очередь, способствует остановке кровотечения. При этом указанный эффект позволяет применять этот препарат для остановки кровотечения из верхних отделов желудочно-кишечного тракта.
Всем пациентам в схему комплексной терапии включили октреотид по 100 мкг подкожно 3 раза в день.
Результаты и их обсуждение. Нами у 47 больных основной группы изучены результаты эрадикаци-онной терапии, включающей ингибитор протонной помпы, омепразол, амоксициллин и кларитромицин. Результаты применения этой схемы представлены в таблице 1.
Эффективность достигнутой эрадикации через 7 дней составила 87,2%, через 14 дней - 93,6%. Таким образом, эффективность предложенной схемы анти-хеликобактерной терапии, зависела от её длительности. Оптимальная продолжительность эрадикаци-онной терапии составила 14 дней.
Оперативные методы остановки кровотечения применялись нами после безуспешной консервативной терапии и эндоскопических методов остановки кровотечения, а так же при возникновении рецидивов кровотечения.
Среди 73 пациентов основной группы комплексное лечение оказалось неэффективным у 5 (6,9%), у 4 (5,4%) - наступил рецидив кровотечения, в связи с чем им было проведено хирургическое лечение. В контрольной группе больных комплексное лечение было неэффективным у 10 (14,5%), а у 11 (16,2%) -наступил рецидив кровотечения, в связи с чем им потребовалось оперативное лечение.
В целом, в основной и контрольной группах прооперированы, соответственно, 9 (12,3%) и 21 (30,1%) пациентов (табл. 2). Среди оперированных больных преобладали лица мужского пола.
ТАБЛИЦА 1. ЭФФЕКТИВНОСТЬ ЭРАДИКАЦИОННОЙ ТЕРАПИИ У БОЛЬНЫХ С СМВ
Режимы Эрадикационная терапия (п=47)
Дозировка Омепразол по 40 мг х 2 р. Амоксициллин по 1000 мг х 2 р. Кларитромицин по 500 мг х 2 р.
Длительность 7 дней 14 дней
Эффективность эрадикации 41 (87,2%) 44 (93,6%)
ТАБЛИЦА 2. ЧИСЛЕННОСТЬ ПРООПЕРИРОВАННЫХ БОЛЬНЫХ С СМВ
Больные Основная группа Контрольная группа
Мужчины 8 10,9 19 27,9
Женщины 1 1,3 2 2,9
Всего 9 12,3 21 30,1
ТАБЛИЦА 3. ХАРАКТЕР ПРОВЕДЁННЫХ ОПЕРАТИВНЫХ ВМЕШАТЕЛЬСТВ У БОЛЬНЫХ С СМВ
Вид оперативных Основная группа Контрольная
вмешательств (п=9) группа(п=21)
Гастротомия, 6 16
ушивание разрыва желудка
Гастротомия+ ушивание разрыва 3 5
По поводу рецидива кровотечения оперированы 15 пациентов. Рецидив кровотечения из зон разрыва наступил на 3-5 сутки у 4 (5,4%) больных основной группы и у 11 (16,1%) - контрольной, который сопровождался тяжёлой кровопотерей у большинства пациентов. При гастротомии у этих больных были установлены множественные дефекты слизистой оболочки (в среднем, размером 1,0х0,3см), на дне которых обнаружены кровоточащие сосуды.
Следует отметить, что у всех оперированных больных с СМВ наблюдалась тяжёлая кровопотеря из множественных разрывов слизистой оболочки. Все пациенты (п=30)основной и контрольной групп оперированы на высоте кровотечения, на фоне проводимой интенсивной инфузионно-трансфузи-онной терапии. Характер выполненных оперативных вмешательств представлен в таблице 3.
Показанием к экстренному оперативному вмешательству явилось отсутствие эффекта от проведённых консервативных процедур и нарастание клинической картины острой кровопотери. Среди 30 оперированных пациентов обеих групп послеоперационный рецидив кровотечения возник у 2 (6,7%) больных контрольной группы, которым удалось консервативным лечением остановить кровотечение.
Следует отметить, что 9 (12,3%) пациентам основной группы во время оперативного вмешательства после ушивания дефекта слизистой кардии желудка для профилактики возникновения кровотечения, изнутри произведя расчёт размера ушитой раны слизистой, произведена дополнительная герметизация линий швов тонкой пластиной «Тахокомб» фирмы «ИУСОМБО», Австрия (адсорбирующее гемостатиче-
ское средство для склеивания тканей и гемостаза, эффективная комбинация коллагеновой пластины и компонентов фибринового клея).
Послеоперационная интенсивная инфузионно-трансфузионная терапия проводилась с учётом тяжести кровопотери. При лёгкой степени кро-вопотери (дефицит ОЦК до 15%) вводили только кристаллоиды (физ. раствор, раствор Рингера). При кровопотере средней тяжести (15-30% ОЦК) вводили растворы кристаллоидов и коллоидов в соотношении 3:1. При тяжёлой кровопотере (более 30% ОЦК), для восстановления кислородно-транспортной функции крови наряду с растворами кристаллоидов и коллоидов, вводили компоненты крови - свежезамороженную плазму и эритроцитарную массу (отмытые эритроциты) в соотношении 3:1, соотношение растворов кристаллоидов и коллоидов составило 2:1. Применение свежезамороженной плазмы предшествовало переливанию эритроцитарной массы, благодаря чему быстро и качественно пополнялись плазменные факторы гемостаза.
Осложнения ближайшего послеоперационного периода обеих исследуемых групп представлены в таблице 4. В основной группе среди 9 оперированных больных у 4 - развились неспецифические осложнения с 1 (11,1%) летальным исходом. Следует отметить, летальность среди 21 оперированного больного с СМВ контрольной группы составила 14,2%.
ТАБЛИЦА 4. ПОСЛЕОПЕРАЦИОННЫЕ ОСЛОЖНЕНИЯ У БОЛЬНЫХ С СМВ
Основная Контрольная Осложнения группа (п=9) группа (п=21)
Острая сердечно-сосудистая и полиорганная недостаточность Примечание: в скобках указано количество умерших пациентов
ТАБЛИЦА 5. РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ КОМПЛЕКСНЫХ МЕТОДОВ ЛЕЧЕНИЯ БОЛЬНЫХ С СМВ
Методы лечения Основная группа(п=73) Контрольная группа(п=68)
Хороший Удовлетв. Неудовлетв. Хороший Удовлетв. Неудовлетв.
гемостаз+медикамент. 42 13 - - - -
Медикамент. терапия 9 15 17 15
Хирургическое лечение 5 2 2 (1) 5 8 8 (3)
ТАБЛИЦА 6. ЭНДОСКОПИЧЕСКАЯ КАРТИНА СЛИЗИСТОЙ ПИЩЕВОДА И ЖЕЛУДКА ЧЕРЕЗ 1 МЕСЯЦ ПОСЛЕ ЛЕЧЕНИЯ
Основная группа(п=41) Контрольная группа(п=37)
Локализация дефекта Одиночный Множественные Одиночный Множественные
нежный рубец грубые рубцы нежный рубец грубые рубцы
Пищеводно-кардиальный 3 1 2 3
Абдоминальный отдел пищевода 7 2 4 7
Кардиальный отдел желудка 25 3 9 12
Всего 35 6 15 22
Результаты применения комплексных методов лечения больных с СМВ основной и контрольной групп показаны в таблице 5.
Эндоскопический гемостаз и медикаментозная терапия дали хорошие и удовлетворительные результаты у 42 и 13 больных основной группы (76,4 и 23,6%, соответственно). После хирургического лечения больных основной группы (п=9), у 5 наблюдался хороший, у 2 - удовлетворительный и 2 - неудовлетворительный результаты. В то время как, в контрольной группе среди оперированных пациентов (п=21) хороший результат получен у 5, удовлетворительный - у 8. При этом у 8 оперированных больных наблюдался неудовлетворительный результат, с тремя летальными исходами. Хороший и удовлетворительный результаты в этой группе наблюдались при медикаментозной терапии 15 и 17 больных, соответственно.
Результаты контрольного эндоскопического исследования 78 больных основной и контрольной групп через 1 месяц после лечения приведены в таблице 6.
Контрольное эндоскопическое исследование (через 1 месяц) показало, что в основной группе количество больных с грубыми рубцами после перенесённого СМВ меньше, и они выявлены у 6 (14,6%) пациентов, что касается контрольной группы, то грубые рубцы обнаружены у 22 (59,5%) больных.
Представленные данные свидетельствуют об эффективности проведённого программного эндоскопического гемостаза в сочетании с рациональной медикаментозной терапией с применением октре-отида и ингибиторов протонной помпы. Оперативное вмешательство применено после безуспешной консервативной терапии и эндоскопических методов остановки кровотечения. В основной группе оперативному вмешательству подвергнуты 9 (12,3%) больных, в контрольной - 21 (30,1%). Выжившие пациенты обеих групп (п=26) были обследованы клиническими методами.
Хирургическое лечение СМВ обладает рядом недостатков из-за высокого операционного риска во время острой и массивной кровопотери, направленно на остановку только кровотечения и не снижает вероятность рецидива 15.
Таким образом, сравнительный анализ результатов лечения больных с СМВ показывает, что программный эндоскопический гемостаз в сочетании с применением октреотида даёт лучшие клинические результаты, снижая рецидив кровотечения с 30,1% до 12,3%, а летальность - с 44,0% до 13,3%.
Оперативные методы остановки кровотечения применялись после безуспешной консервативной терапии и эндоскопических методов остановки кровотечения, а так же при возникновении рецидивов.
1. Алгоритм программного эндоскопического инъекционного гемостаза в лечении язвенных гастродуоденальных кровотечений /А.В.Быков, Е.О.Захарова// Вестник Волгоградского госмеду-ниверситета. - 2012. - №2(42). -С.89-42.
2. Баткоев А.Р. Комплексное лечение неязвенных гастродуоденальных кровотечений с использованием внутрипросветной эндоскопии: автореф. дис. д-ра мед. наук /А.Р.Баткоев. - Воронеж. -2010. -С.32.
3. Борисов Д.Н. Эндоскопическая диагностика и лечение больных с синдромом Маллори-Вейсса, осложнённым кровотечением: дис.. канд. мед. наук /Д.Н.Борисов. -2001. -124 с.
4. Захарова Е.О. Программный эндоскопический гемостаз как метод выбора при язвенных гастродуоденальных кровотечениях: автореф. дис. канд. мед. наук /Е.О.Захарова. Волгоград.-2012.-С.26.
5. Оганесян Е. Эндоскопическая диагностика и лечение синдрома Маллори-Вейсса: автореф. дис.. канд. мед. наук /Е.Оганесян. М., - 2002. -24 с.
6. Мумладзе Р.Б. Применение эндоскопического радиоволнового воздействия на источник кровотечения при пищеводно-желудочных кровотечениях у больных с синдромом Маллори-Вейсса / Р.Б.Мумладзе// Анналы хирургии. - М. - 2007. - №5. - С.29-33.
8. Панцырев Ю.М. Эндоскопическое лечение кровотечений, обусловленных Маллори-Вейсса /Ю.М. Панцырев, Е.Д. Фёдоров// Хирургия. -2003.-№10. -С.35-40.
9. Соловьёв А.С. Применение сочетанных эндоскопических методов гемостаза при пищеводно-желудочных кровотечениях у больных с синдромом Маллори-Вейсса /А.С.Соловьёв// Анналы хирургии.-2007.-№1.-С.29-34.
11. Endoscopic hemoclip placement and epinephrine injection for Malllory-Weiss syndrome with active bleeding / S.P. Huang [et al.]// Gastrointest. Endose. -2009. - Vol. 55. -№7. - P. 842-46.
12. Evaluation of endoscopic hemostasis in upper gastrointestinal bleeding related to Mallory-Weiss syndrome / I.K. Chung, E.J. Kim, K.Y. Hwang // Endoscopy. 2009. - Vol. 34. -№ 6. - P. 474-479.
13. Tanabe S. Mallory-Weiss syndrome / S. Tanabe, K. Saigenji// Nippon Rinsho. 2008. - Vol. 56, № 9. - P. |332-335.
Complex treatment of patients with Mallory-Weiss syndrome
R. Muhammadzoda, T.G. Gulmuradov
Chair of Cardiovascular and Reconstructive Surgery of TIPDTMW
The results of a comprehensive examination and treatment of 141 patients with the syndrome Mallory-Weiss (MWSS) are given in article.
For objectivity study patients with MWSS were divided into two groups: control group - 68 patients (49 men, 19 women) who were treated by conventional methods and basic group - 73 patients (59 and 14), which carried out a comprehensive treatment using programmedendoscopic hemostasis in combination with a preparation «Octreotide». Age of patients ranged from 19 to 78 years.
Comparative evaluation of the treatment results of patients with MWSS shows that endoscopic hemostasis software provides better clinical outcomes, reducing rebleeding from 30,1 to 12,3%, and the mortality rate - from 44,0% to 13,3%.
Key words: Mallory-Weiss syndrome, programmedendoscopic hemostasis, gastrotomy
АДРЕС ДЛЯ КОРРЕСПОНДЕНЦИИ:
Ближайшие осложнения после видеоэндоскопических методов нефрэктомии при доброкачественных заболеваниях почек
З.А. Кадыров1, А.Ю. Одилов1,2, А.А. Багдасарян1, А.С. Колмаков1
' Кафедра эндоскопической урологии факультета повышения квалификации медработников Российского университета дружбы народов; 2 Республиканский научно-клинический центр «Урология» МЗ СЗН РТ
В статье обобщены результаты анализа данных обследования и лечения 144 пациентов после традиционных, лапароскопических и ретроперитонеоскопичес-ких нефрэктомий.
Проведённые клинические исследования показали, что при точном определении показаний и противопоказаний к проведению вмешательства, соблюдения мер профилактики и правильной технике выполнения операции, практически можно избежать осложнений при видеоэндоскопических методах удаления почки. Интра- и ближайшие послеоперационные осложнения после традиционных, лапароскопических и ретроперитонеоскопических нефрэктомий отмечались, соответственно, у 16 (40,00%), 15 (37,50%) и 12 (18,75%) больных.
Ключевые слова: открытая нефрэктомия, ретроперитонеоскопическая нефрэктомия, лапароскопическая нефрэктомия, нефроуретерэктомия, видеоэндоскопические методы нефрэктомии, доброкачественные заболевания почек
Введения. Нефрэктомия остаётся сложным оперативным вмешательством, который может сопровождаться тяжёлыми осложнениями. К наиболее грозным из них относят повреждения нижней полой вены, печени, кишечника, селезёнки. При этом большое значение имеет оперативный доступ к почке. При традиционной нефрэктомии используют ретро-перитонеальный, абдоминальный и торакальный доступы. В последние два десятилетия видеоэндоскопические операции получили широкое применение в урологии. Главными преимуществами ретропери-тонеоскопической нефрэктомии перед традиционным открытым способом являются косметичность, короткий послеоперационный период и быстрое возвращение больных к обычной жизни 1.
В зарубежной литературе описано множество различных осложнений после лапароскопических [5,6] и ретроперитонеоскопических 7 методов нефрэктомии, особенно на этапе их внедрения. В то же время, у пациентов, перенёсших операцию лапароскопическим или ретроперитонеоскопическим методом удаления почек при их доброкачественных заболеваниях, в доступной нам российской и отечественной литературе данный показатель изучался в единичных случаях 11.
Цель исследования: сравнительное изучение ближайших осложнений после традиционных и видеоэндоскопических методов нефрэктомии.
Материал и методы. Основу настоящей работы составили результаты анализа данных обследования и лечения 144 пациентов с доброкачественными заболеваниями почек, которые находились под нашим наблюдением с 2003 по 2013 гг. на кафедрах хирургии и онкологии, и эндоскопической урологии факультета повышения квалификации медицинских работников РУДН на базе 3 городских клиник и НИИ урологии г.Москвы и урологического отделения МБУЗ ГБ №2 г.Краснодара, а также Республиканского научно-клинического центра «Урология» г.Душанбе.
Основную группу составили 104 больных, которым выполнили видеоэндоскопические методы нефрэктомии (ВЭН), из них лапароскопическую нефрэктомию (ЛН) - 40 (27,8%) (I группа) и ретропе-ритонеоскопическую нефрэктомию (РН) - 64 (44,4%) (II группа). Контрольную группу составили 40 (27,8%) больных (III группа), у которых ретроспективно проанализировали применение традиционного метода - открытую нефрэктомию (ТН) с 2004 по 2012 гг. Возраст больных варьировал от 18 до 83 лет и составлял, в среднем, 56,4±6,22 года. Среди оперированных было 77 (52,1%) пациентов мужского и 67
Синдром Маллори—Вейсса
Синдром Маллори – Вейсса (желудочно-кишечный разрывно-геморрагический синдром) – разрыв слизистой оболочки желудка или терминального отдела пищевода, сопровождающийся кровотечением или пенетрацией в средостение, с сопутствующим медиастинитом. В исследуемой группе мужчины составили 87,9 %, женщины – 12,1 %. Возрастной состав пациентов с СМВ был следующим: в возрасте 21–60 лет было 83,7 %; лица до 20 лет – 3,1 %, старше 60 лет – 13,2 %. Основные этиологические факторы: рвота на фоне алкогольной интоксикации; диафрагмальная грыжа; атрофический гастрит; эзофагит. В некоторых случаях синдром Маллори – Вейсса развивался без видимых причин. Исследование, представленное в настоящей работе, направлено на оптимизацию лечебно-диагностического алгоритма у больных с синдромом Маллори – Вейсса (СМВ). Авторы предлагают ориентироваться на клинико-анатомическую стадию и детализировать степень активности кровотечения. Важнейшую роль в диагностике СМВ играет эндоскопическое исследование. Наиболее тяжелые и активные формы кровотечения (F-la, F-ld и F- 1с) встретились при II и III стадиях синдрома. Консервативное лечение было проведено в 71,3 % от общего числа пациентов. В нашем исследовании рецидивы кровотечения после хирургического лечения отмечены у 2 (15,3 %) из 13 больных, после местного орошения области разрывов – у 14,6 %. Общая летальность после использования всех способов лечения составила 3,4 %.
1. Дуданов И.П., Шаршавицкий Г.А., Меженин A.M. и др. Хирургическая тактика при синдроме Маллори - Вейсса // Вестник хирургии. - 1998. - Т.157, № 3. - С. 67-69.
2. Магниех М.М. Выбор лечебной тактики при синдроме Mallory-Weiss: Автореф. дис. канд. мед. наук. - Ст.-Петербург, 1999. - 23 с.
3. Подшивалов Б.Ю. Эндоскопическая диагностика и лечение кровоточащих и перфоративных гастродуоденальных язв: Дис. . д-ра мед. наук. - Челябинск, 2006. - 277 с.
4. Тимербулатов Ш.В., Тимербулатов В.М., Хасанов А.Г. и др. Особенности лечебной тактики при синдроме Маллори - Вейсса // Хирургия. - 2009. - № 4. - С. 33-37.
5. Чудинов А.А. Репин В.Н., Полетаева И.В. Зубарева Н.А., Тваладзе И.М., Рыжаков А.П., Костин В.А. Возможности эндоскопического гемостаза при синдроме Маллори - Вейсса // XI Съезд хирургов России, 2010.
6. Cho Y. S., Chae H. S., Kim H. K. et. al. Endoscopic band ligation and endoscopic hemoclip placement for patients with Mallory - Weiss syndrome and active bleeding // World J. Gastroenterol. - 2008. - №7. - Р. 2080-2084.
7. Guo S. B., Gong A. X., Leng J. et. al. Application of endoscopic hemoclips for nonvariceal bleeding in the upper gastrointestinal tract // World J. Gastroenterol. - 2009. - № 14; 15(34). - Р. 4322-4326.
8. Kryshen V., Trofimov N. Clinical and Morphological Parallels at the Mallory - Weiss Syndrome. Acta Chirurgica Belgica. [Supp. 105]. - 2005. - 5; 51: 50.
Введение
Рецидивы кровотечения при СМВ отмечаются в 20-30 % наблюдений, послеоперационная летальность составляет 10-17 %, общая - 0,4-1,8 %. Эндоскопическое оборудование открывает новые возможности лечения таких больных, поэтому продолжается поиск новых и модернизация уже известных методик остановки кровотечения при синдроме Маллори - Вейсса путем комбинированного воздействия на очаг кровотечения различных способов эндоскопического гемостаза с параллельным применением общих мероприятий гемостатического, антисекреторного, кровезамещающего действия.
Возникает необходимость дальнейшего изучения действенности применяемых методов эндоскопических вмешательств, которые позволяют осуществлять гемостаз и профилактику рецидивов внутриполостных кровотечений на всех этапах лечения. Это позволит значительно снизить процент экстренных операций и улучшить конечные результаты лечения больных с синдромом Маллори - Вейсса.
Цель настоящего исследования. Оптимизация лечебно-диагностического алгоритма у больных с синдромом Маллори - Вейсса.
Материал и методы исследования
В исследование вошло 332 пациента с СМВ, госпитализированных в НХЦ МЗ КР в период 2009-2012 гг. Мужчины в группе составили 87,9 %, женщины - 12,1 %. Возрастной состав исследуемой группы пациентов с СМВ был следующим: в возрасте 21-60 лет было 83,7 %; лица до 20 лет - 3,1 %, старше 60 лет - 13,2 %. За последние 12 лет СМВ был причиной кровотечений в 28,7 % наблюдений, причем за последние 3 года прослеживалась отчетливая тенденция к росту количества таких наблюдений. Необходимо также отметить, что большинство больных (84,9 %) были госпитализированы в состоянии алкогольного опьянения. Данное обстоятельство является отягощающим в плане организации экстренной диагностики, выбора более сложных методов интенсивной терапии.
Особенностью больных с СМВ является также высокая частота сопутствующих заболеваний - до 88,6 %, причем у 37,6 % выявлено 3 заболевания и более: грыжи пищеводного отверстия диафрагмы (41,1 %), заболевания печени (хронический гепатит, цирроз) и желчных путей (54,3 %), хронический панкреатит (45,4 %), хронические гастриты, язвенная болезнь желудка (по 26,1 %), заболевания сердечно-сосудистой системы (43,4 %). Необходимо отметить особенности СМВ в последние годы - нередкое сочетание нескольких причин кровотечения: с варикозным расширением вен пищевода и желудка, эрозивным эзофагитом и гастритом, язвой кардиального отдела желудка. В такой ситуации возникают особые сложности в диагностике ведущей причины кровотечения и соответственно в выборе способа гемостаза.
Результаты исследования и их обсуждение
Диагностические мероприятия на этапе госпитализации при СМВ осуществлялись в следующей последовательности. После оценки степени тяжести кровопотери больным выполнялась эзофагогастроскопия. Ее выполнение нередко усугубляет состояние больного за счет возобновления уже остановившегося кровотечения, появления новых разрывов (судорожные позывы к рвоте во время эндоскопии) или увеличения уже имеющегося разрыва пищевода. Поэтому больным с клинической картиной СМВ такое исследование необходимо выполнять после введения противорвотных препаратов и внутривенной седатации.
По клинико-анатомическим признакам мы используем классификацию Ш. В. Тимербулатова и соавт. [4], в которой выделяют следующие стадии синдрома Маллори -Вейсса:
I. Разрыв (трещины) слизистой нижней трети пищевода, кардиоэзофагеального перехода;
II Разрыв (трещина) слизистой, подслизистого слоя;
III. Разрыв (трещина) с вовлечением циркулярного мышечного слоя. Зона разрыва не спазмируется, не смыкается, наблюдается интенсивное кровотечение;
IV. Разрыв всех слоев пищевода, кардиоэзофагеального перехода, сопровождается пневмотораксом, пневмомедиастинумом, медиастинитом - при разрыве грудного отдела и перитонитом - при разрыве абдоминального отдела пищевода.
В отличие от классификации В. Bellmann выделение дополнительной стадии (III) считаем принципиально важным как с точки зрения клинико-морфологической оценки глубины повреждения стенки пищевода и желудка, так и для обоснования возможностей использования различных методов гемостаза. Как было отмечено выше, в диагностике СМВ основное значение имеет эндоскопическое исследование.
При СМВ диагностические мероприятия сводятся к установлению: 1) факта кровотечения; 2) продолжения или его остановки; 3) источника кровотечения. Эти вопросы, а также необходимость дифференцированного подхода к выбору из множества консервативных, эндоскопических, хирургических методов наиболее надежного способа требуют большей детализации эндоскопических критериев кровотечения по классификации J. Forrest. По аналогии с классификацией гастродуоденальных язвенных кровотечений В. Ю. Подшивалова [3] считаем целесообразным дополнение степени активности кровотечения при СМВ двумя характеристиками:
F-lc - фиксированный сгусток в области дна разрыва или по краю разрыва (разрывов) с подтеканием крови из-под сгустка;
F-ld - интенсивное кровотечение без возможности локализовать, визуализировать источник кровотечения.
По нашим наблюдениям, стабильность гемостаза и опасность возобновления кровотечения зависят от величины сосудов по краям разрывов: чем крупнее сосуды (>1 мм), тем вероятнее опасность рецидива. Риск повторного кровотечения велик при свежем рыхлом кровяном сгустке, а также при больших (>5 см) и множественных разрывах.
При эндоскопической картине остановившегося кровотечения (F-2a, F-2b, F-2c) или при эндоскопическом надежном гемостазе больных госпитализировали в отделение реанимации и интенсивной терапии для проведения инфузионно-трансфузионной терапии.
При осуществлении гемостаза придерживались следующих положений:
- Показания к хирургическому лечению (продольная гастротомия с ушиванием разрывов) устанавливали (3,7 %) при кровотечениях F-ld, при невозможности (неудачных попытках) эндоскопического гемостаза при F-la и рецидивах кровотечения при F-lc.
- Основными методами эндоскопического гемостаза явились: инфильтрационный - субмукозное введение этоксисклерола, этанола, разведенного адреналина - с обеих сторон трещины (до 4 точек). Доза 1 % этоксисклерола составляла от 2 до 15 мл, а при множественных трещинах - до 25 мл. При неуверенности в окончательном гемостазе дополнительно в края разрывов вводили один из инъекционных препаратов. Учитывая довольно высокий риск рецидива кровотечения при СМВ, для профилактики рецидива и при F-2a, F-2b применяли инфильтрационный метод.
Необходимо отметить, что тактика ведения больных при СМВ в различных клиниках разная и во многом зависит от принятой доктрины, решения организационных вопросов (например, наличие круглосуточной эндоскопической помощи), материально-технического оснащения эндоскопических отделений, накопленного клинического опыта диагностики и лечения и др.
Из общего числа больных консервативное лечение было проведено у 71,3 %, местное орошение раствором нитрата серебра у 14,3 %, препаратом «Капрофер» у 5,8 %, инфильтрационный метод у 49,1 %, хирургическое лечение - у 3,7 %. Местное орошение использовалось при кровотечениях активности F-1b и СМВ I и II стадий. Рецидивы кровотечения после хирургического лечения отмечены у 2 (15,3 %) из 13 больных, после местного орошения области разрывов - у 14,6 %. Общая летальность после использования всех способов лечения составила 3,4 %.
Заключение
Таким образом, выделение клинико-анатомических стадий синдрома Маллори -Вейсса и детализация степени активности кровотечения позволяют более дифференцированно выбрать методы лечения больных.
Рецензенты:
Ниязов Б.С., д.м.н., профессор, заведующий кафедрой хирургии ФУВ, Кыргызский государственный медицинский институт переподготовки и повышения квалификации, г. Бишкек.
Алыбаев Э.У., д.м.н., профессор кафедры госпитальной хирургии с курсом оперативной хирургии, Кыргызская государственная медицинская академия, г. Бишкек.
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10
Общие сведения
Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.
Причины синдрома Меллори-Вейса
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
- Рвота, неукротимая икота. У 80-85% пациентов развитие рвоты связано с алкогольным опьянением. Провоцирующими факторами также становятся рвота беременных, диспепсические расстройства при патологии пищеварительного тракта (язвенной болезни, панкреатите, холецистите), отравления, уремия.
- Длительный интенсивный кашель. В редких случаях разрывно-геморрагический синдром провоцируется острыми и хроническими респираторными заболеваниями. Линейное повреждение слизистой пищевода, верхних отделов желудка может осложнить коклюш, ОРВИ, хронический бронхит, бронхиальную астму.
- Ятрогенные воздействия. Повреждение стенки пищевода, желудка возможно при грубом выполнении эндоскопических манипуляций (гастроскопии, эзофагогастродуоденоскопии), введении желудочного зонда. Иногда разрывы слизистой возникают при проведении сердечно-легочной реанимации.
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
- I стадия. Повреждение слизистой желудочно-пищеводного перехода и дистальной трети пищевода. Встречается у 36-37% пациентов. В большинстве случаев кровотечение прекращается спонтанно.
- II стадия. Дефекты расположены в той же зоне, однако их глубина достигает подслизистого слоя. Выявляется у 52-53% больных. Обычно проводится консервативная гемостатическая терапия.
- III стадия. Глубокие зияющие разрывы с вовлечением мышечной оболочки и интенсивным кровотечением. Наблюдаются в 9-11% случаев. Необходим эндоскопический или хирургический гемостаз.
- IV стадия. Редко диагностируемое тяжелое повреждение с разрушением всех оболочек гастроэзофагеального участка ЖКТ. Осложняется медиастинитом, перитонитом, пневмотораксом.
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
- Эзофагогастроскопия. Введение гибкого эндоскопа через ротовую полость позволяет оценить состояние эпителиальной оболочки верхних отделов ЖКТ и обнаружить линейные разрывы, которые обычно локализованы в области перехода пищевода в желудок. С помощью визуального осмотра удается установить глубину поражения стенки пищевода или желудка.
- Обзорная рентгенография брюшной полости. Проведение рентгенологического исследования информативно при подозрении на разрыв полого органа. Основной признак перфорации – наличие свободного газа в полости брюшины (симптом «серпа»). На рентгенограмме также можно обнаружить другие болезни ЖКТ, которые являются первопричиной патологии Меллори-Вейса.
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
- Инфузионная терапия. При умеренной кровопотере проводятся внутривенные вливания коллоидных и кристаллоидных растворов. При массивном кровотечении переливается эритроцитарная масса или взвесь, нативная и свежезамороженная плазма, реже — донорская кровь.
- Гемостатические препараты. Для медикаментозного гемостаза используют стимуляторы свертывающей системы крови. Эффективность кровоостанавливающей терапии повышается при парентеральном введении препаратов кальция, синтетических аналогов витамина К.
- Эндоскопический гемостаз. При продолжающемся кровотечении с помощью эндоскопа обкалывают место повреждения средствами с сосудосуживающим эффектом, вводят склерозанты, лигируют или клипируют сосуды. Возможно выполнение аргоноплазменной или электрокоагуляции.
- Терапевтическая эмболизация. Для прекращения кровотечения из поврежденных сосудов в них под контролем ангиографии вводят смесь эмболов с физиологическим раствором. Альтернативным методом является редко применяемое внутриартериальное вливание жировых суспензий.
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
2. Лечение разрывно-геморрагического синдрома (синдрома Маллори-Вейсса) в специализированном Центре: автореферат диссертации/ Чередников Е.Е. – 2011.
Читайте также:
