Синдром ретроградной артериальной перфузии. Акардия у одного из близнецов
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Существует два вида близнецов:
Однояйцовые(монозиготные)- развиваются из одной яйцеклетки, они имеют
одинаковые пол, генотип, группу крови и похожи друг на друга.
Двуяйцовые(дизиготные)-близнецы развиваются из разных яйцеклеток,
оплодотворенных разными сперматозоидами. Они находятся в той же
генетической зависимости, что и родные братья и сестры.
В зависимости от плацентарно-мембранных взаимоотношений многоплодная
беременность бывает:
монохориальной биамниотической- оба
бихориальной биамниотической каждый плод имеет собственные
хорион и амнион, перегородка
между ними состоит из четырех
листков - двух амнионов и
лежащих между ними двух гладких
хорионов, при этом плацента может
быть раздельная или слившаяся
амниона заключены в один общий хорион,
перегородка между плодами состоит из двух
листков амниона
монохориальной моноамниотическойамниотическая полость общая для двух плодов,
перегородки нет
4. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Наследственность.
Возраст беременной (от 35 лет и выше), чем старше, тем чаще
встречается многоплодная беременность.
Риск наступления многоплодной беременности увеличивается в течение
первого месяца после отмены оральных контрацептивов, принимаемых
не менее 6 мес.
Вспомогательные репродуктивные технологии (ЛС, стимулирующие
овуляцию, ЭКО, посадка эмбриона) значительно повышают этот риск.
Двуяйцовая двойня возникает:
-при оплодотворении одновременно двух созревших яйцеклеток в одном или обоих
яичниках (в одном фолликуле могут созреть несколько яйцеклеток) сперматозоидами
одного или разных мужчин;
-оплодотворении яйцеклетки, овулировавшей на фоне уже существующей беременности в
пределе одного менструального цикла ;
-оплодотворении яйцеклетки, овулировавшей на фоне уже существующей беременности во
время следующего менструального цикла.
Разнояйцовые близнецы могут быть одного (75%) или разного пола. Их генотип не
идентичен.
Однояйцовая двойня возникает:
-при оплодотворении многоядерной яйцеклетки;
-атипичном дроблении концептуса (преэмбриона) - одна яйцеклетка, оплодотворенная
одним сперматозоидом, превращается в два зародыша (полиэмбриония).
Однояйцовые двойни встречаются реже, чем двуяйцовые.
При дизиготной двойне оплодотворенные яйцеклетки развиваются независимо
друг от друга. После имплантации у каждого эмбриона образуются свой амнион
и свой хорион
каждый плод имеет свою плаценту, их системы
кровообращения разделены. Все дизиготные двойни являются
бихориальными.
Если имплантация эмбрионов произошла на некотором расстоянии друг от
друга, их плаценты не соприкасаются.
При имплантации на близком расстоянии эмбрионы имеют общую
децидуальную оболочку, края плацент соприкасаются, перегородка между их
плодными мешками состоит из четырех оболочек (двух хорионов и двух
амнионов).
Каждая плацента имеет собственную сосудистую сеть, но иногда между
сосудами плацент образуются анастомозы, что может быть причиной
осложнений.
две плаценты, два хориона, два
амниона
одна плацента, один хорион, два
амниона
две слившиеся плаценты, два
хориона, два амниона
одна плацента, один хорион,
один амнион
9. КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клинические признаки многоплодной
беременности во II и в III триместрах
беременности:
--опережающее увеличение размеров
матки по сравнению с предполагаемым
сроком беременности(используют
гравидограмму);
--в поздние сроки -выявление при
наружном акушерском исследовании трех
крупных частей плодов и более;
--прослушивание сердцебиения плода в
двух точках и более, с зонами молчания
между ними.
УЗИ позволяет дифференцировать
многоплодную беременность от многоводия, пузырного заноса, опухоли матки
(миома), крупного плода.
«Золотым стандартом» диагностики
многоплодной беременности остается
УЗИ, которое позволяет с помощью
трансвагинального датчика
визуализировать несколько плодных яиц в
полости матки при задержке менструации
на несколько дней.
В ранние сроки иногда рекомендуют
определять содержание ХГ в моче или
крови беременной. При многоплодной
беременности уровень ХГ будет выше,
чем при одноплодной в этом же сроке
гестации.
10. ОСЛОЖНЕНИЯ
Со стороны матери связаны с адаптацией организма к беременности несколькими
плодами. Из-за большой нагрузки на организм отмечают повышенную утомляемость,
одышку, нарушение мочеиспускания, запор. Перинатальная смертность при многоплодных
родах в 3-4 раза выше, чем при одноплодных.
В 1 триместре наиболее частое осложнение- угроза прерывания и рвота беременных.
Во 2 триместре-из-за выраженной гиперволемии (за счет физиологической гемодилюции)
частота анемии в 2-3 раза выше, выше риск гестационного диабета: при двойне частота
7%, при тройне -9%, при четверне -11%. В 1,5 раза увеличивается реализация инфекции
мочевых путей. Часто варикозное расширение вен и повышается риск тромбообразования.
ПЭ в 4 раза чаще. В большинстве случаев многоплодие сопровождается многоводием.
Феномен «исчезнувшего близнеца» -редукция одного эмбриона- в I триместре
беременности. В поздние сроки может быть антенатальная гибель одного из плодов, в
результате один плод мумифицируется, а второй развивается нормально и рождается в
срок. Если антенатальная гибель до срока 22 нед, используют термин «несостоявшаяся
двойня».
Фето-фетальный трансфузионный синдром (ФФТС)- между сосудами
кровеносных систем близнецов формируются анастомозы, градиент
давления в сосудах, один плод донор, другой- реципиент. Метод диагности
ки ФФТС - УЗИ, критерии развития ФФТС:-у плода-реципиента: многово
дие, водянка (подкожный отек более 5 мм, плевральный, перикардиальный
выпот, асцит); -у плода-донора: маловодие, задержка роста.
Разница в массе плодов может достигать 20% и более. Такие близнецы называют
дискордантными. Вспомогательный метод диагностики - цветное допплеровское
картирование.
Способы лечения ФФТС:
-амниоредукция - серия амниоцентезов, снижающих внутриамниотическое давление у
плода-реципиента;
-септостомия - перфорация амниотической перегородки, околоплодные воды циркулируют
между двумя амниотическими полостями.
-селективная эвтаназия плода - не очень приемлемый способ лечения. Однако он имеет
право на существование, если гибель одного из плодов неизбежна;
-эндоскопическая лазерная коагуляция сосудистых анастомозов плаценты патогенетически оправданный метод («золотой стандарт»). С помощью комбинированной
(эндоскопической и эхографической) визуализации.
Обратная артериальная перфузия (акардиальный монстр, ацефальная акардия)
Патогенез не ясен, но возникающие на ранних этапах эмбриогенеза анастомозы между
артериями пуповин приводят к ретроградной циркуляции крови в артериях одного из
плодов (реципиента) и вторичным нарушениям морфогенеза. Кровь от плаценты течет к
реципиенту не по пупочной вене, а по артериям, всл. чего кровоснабжение верхней
половины туловища плода-реципиента становится недостаточным (такой плод
нежизнеспособен).У реципиента-аномалии развития в любом органе (отсутствие головного
мозга, конечностей, грудной клетки, сердца, легких, пищевода, печени). Плод-донор
морфологически здоров, но в рез. перегрузки сердца- водянка, гипотрофия, кардиомегалия,
гепатоспленомегалия. Смертность плодов-реципиентов составляет 100%, плодов-доноров 50%
12. Выбор времени и метода родоразрешения.
Госпитализацию в дородовое
Показания к плановому оперативному
отделение осуществляют за 2 нед до
родоразрешению:
срока родов (в 36 нед) для обследования
• моноамниотическая двойня;
беременной и определения срока и метода • три плода и более;
родоразрешения. При
• тазовое предлежании или неправильное
трех плодах и более стационарное
положение первого плода (поперечное,
наблюдение рекомендовано с 26 нед
косое).
до срока родоразрешения.
Поворот плода на ножку с последующим
70% многоплодных беременностей
извлечением или кесарево сечение
заканчиваются преждевременными родами,
- методы выбора при необходимости
которым предшествует несвоевременное
экстренного родоразрешения.
излитие вод.
Тяжелые осложнения беременности со
Роды при многоплодной беременностистороны матери (тяжелая ПЭ, декомпенсация
преждевременные, поэтому при
экстрагенит. заболев.), со стороны плодов
оперативном родоразрешении
(декомпенсиров. плацентарная
рекомендуется извлекать новорожденных
недостаточность, приводяшая к задержке
в плодном пузыре
роста, острая гипоксия плодов, ФФТС ),
требуют экстренного родоразрешения.
Индуцируют роды при двойне не позднее
При отсутствии экстренных показаний выбор 38 нед беременности. Перинатальная
метода планового родоразрешения зависит
смертность и неонатальная заболев.
от положения и предлежания первого
наименьшие в «идеальный» срок
плода, предполагаемой массы и состояния
родоразрешения: при двойне - 36-37 нед,
плодов, гестационного срока.
при тройне - 34-35 нед
13. ТЕЧЕНИЕ И ВЕДЕНИЕ РОДОВ
При дородовом излитии вод, во время
латентной фазы (раскрытие зева менее 4
см) преждевременных родов при сроке
менее 34 нед- начинают токолитическую
терапию (нифедипин, Вадреномиметики,
ингибиторы окситоциновых рецепторов),
чтобы отсрочить роды на 24-48 ч.
В это время проводят профилактику РДС
дексаметазоном и госпитализируют
пациентку в акушерский стационар.
Показание к токолитической терапии в
активной фазе родов - профилактика
быстрых и стремительных родов,
а также «внутриутробная реанимация».
Дородовое излитие вод при
недоношенной беременности требует
назначения АБ терап.- профилактика
хориоамнионита и неонатальной
инфекции.
«Золотой стандарт»
обезболивания родов - ЭДА со
строго индивидуальным
подходом.
Осложнения многоплодных родов:
• выпадение мелких частей плода и
пуповины при неконтролируемом
излитии околоплодных вод;
• неправильные положения плодов;
• слабость родовой деятельности;
• гипоксия плодов;
• ПОНРП после рождения первого
плода.
В связи с высоким риском развития
острой гипоксии плодов
роды необходимо вести под
постоянным кардиомониторным
контролем. Т.к. высока частота
аномалий родовой деятельности регистрируют сократительную
активность матки с помощью
монитора и раскрытие маточного зева в
первом периоде родов (необходимо
ведение партограммы).
Во втором периоде родов возникает
слабость потуг, для
профилактики слабости родовой
деятельности в периоде изгнания вводят
Окситоцин в/в кап. со скоростью 0,0002
МЕ/кг в минуту. После рождения 1 плодапережимают пуповину и производят
влагалищное исследование. При головном
предлежании 2 плода- вскрывают
плодный пузырь, сокращение
перерастянутой матки ,что является
профилактикой преждевременной
отслойки плаценты.
Сцепление близнецов- редкое
осложнение, при тазовом предлежании 1
плода и головном 2 плода. Роды
протекают без осложнений
до рождения туловища 1 плода, головка 1
плода- над входом в малый таз и не может
родиться, т.к. между его
головкой и телом вклинивается головка 2
плода. При этом требуется экстренное КС,
головки расцепляют, 2 плод извлекают, а 1
рождается через естественные пути
Особенно опасны третий период родов и
ранний послеродовой период из-за
развития гипотонического кровотечения.
Для профилактики кровотечения
используют введение утеротонических
препаратов в течение 2 ч после родов и
внимательно наблюдают за состоянием
родильницы.
После рождения последа-его осматривают
для выяснения целости долек и оболочек,
подтверждения хориальности и
определения зиготности близнецов.
Рождение разнополых детей-двуяйцовая
беременность. При рождении однополых
детей при бихориальной беременности
зиготность неустановлена до
генетического исследования. После родов
при осмотре последа необходимо
подтвердить вид многоплодной
беременности. При одной плаценте и двух
листках в перегородке можно говорить о
монохориальной биамниотической двойне,
при четырех- о бихориальной двойне при
слившихся плацентах.
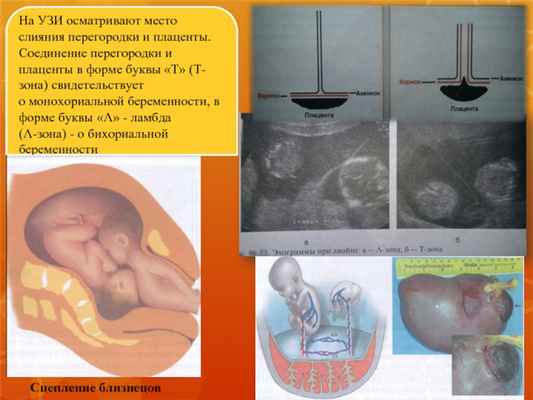
На УЗИ осматривают место
слияния перегородки и плаценты.
Соединение перегородки и
плаценты в форме буквы «Т» (Тзона) свидетельствует
о монохориальной беременности, в
форме буквы «Λ» - ламбда
(Λ-зона) - о бихориальной
беременности
Сцепление близнецов
Синдром ретроградной артериальной перфузии. Акардия у одного из близнецов
Синдром ретроградной артериальной перфузии. Акардия у одного из близнецов
Секвенция ретроградной артериальной перфузии (РАП) является редкой патологией, которая, как сообщалось, встречается в 1 % монохориальных беременностей двойней (0,3 на 10 000 родов), и возникает на фоне сосуществования нормально развивающегося плода (плода-«помпы») и плода с акардией.
Пораженный плод характеризуется патологическими изменениями или полным отсутствием цефалических отделов организма, а также сердца, верхних конечностей и многих внутренних органов.
Нижние конечности относительно хорошо сохраняются, хотя часто встречаются косолапость и аномалии пальцев стоп. Картина этого состояния настолько па-тогномонична, что диагноз легко устанавливается уже начиная с 10-й нед беременности. Пуповина, имеющая только два сосуда, является практически правилом (66%) при этом заболевании. Развитие мембраны, разделяющей близнецов, происходит не всегда, и ее вид варьирует от полной перегородки до отдельных тяжей из оболочек.
В ряде случаев артерия пуповины у плода с акардией анастомозирует с верхней подчревной артерией (вместо подвздошной), что является свидетельством персис-тирования «примитивного» желточного типа кровоснабжения.
Предполагаемыми механизмами развития этого состояния являются сочетание наличия парных артерио-артериальных и вено-венозных анастомозов в плаценте и замедленное развитие структур и функции сердца у одного из плодов на ранних сроках беременности. Некоторые исследователи также предполагают в качестве этиологического фактора анеуплоидию, которая может приводить к более медленному развитию пораженного плода из двойни по сравнению со здоровым. Хромосомные нарушения были обнаружены у 33% близнецов с акордией. Если один из плодов развивается медленнее, то дисбаланс артериального давления между близнецами будет приводить к ретроградной трансфузии крови от здорового к пораженному плоду.
Ретроградный поток плохо оксигенированной крови, протекающий через развивающееся сердце, оказывает влияние на его формирование у больного плода, которое редко продолжается далее стадии трубчатого сердца, приводя к состоянию, которое получило название «акардия». Верхняя часть тела плода с акардией бывает чрезвычайно плохо развита, а иногда вообще не сформирована. Голова, шейный отдел позвоночника и верхние конечности обычно отсутствуют. Часто встречаются отек и эхонегативные зоны в подкожной области верхней части тела, обусловленные наличием кистозной гигромы. Напротив, нижняя часть тела, хотя и имеет аномалии, развита значительно лучше. Такая модель патогенеза может объясняться механизмом перфузии плода с акардией.
Кровь, которая поступает в брюшной отдел больного плода, является деоксигенированной и оттекает от здорового близнеца. Возникающие аномалии обусловлены особенностями кровоснабжения тканей деоксигенированной кровью, направляющейся в общие подвздошные артерии и нижние ветви аорты. Большая часть оставшегося доступным кислорода извлекается сразу при поступлении крови в тело плода, что позволяет в какой-то степени развиваться его нижним отделам и нижним конечностям. Низкое давление в ретроградно кровоснабжае-мой верхней части тела и низкое насыщение кислородом ухудшают развитие этой области.
Таким образом, можно сказать, что плод с акардией является в определенном смысле «паразитом». Для продолжения своего развития он нуждается в крови, забираемой у здорового плода, что приводит к риску острой сердечной недостаточности у плода-«помпы». Этот риск напрямую зависит от размеров плода с акардией: чем больше его масса, тем выше риск сердечной недостаточности и смерти здорового плода из двойни. В целом в таких случаях выживает только 50% здоровых плодов, а смертность у пораженных плодов составляет 100%.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тактика ведения беременности при синдроме обратной артериальной перфузии
Цель исследования. Сравнить эффективность оперативной и консервативной тактики ведения беременности, осложненной СОАП.
Материал и методы. Проведен ретроспективный анализ перинатальных исходов 47 пациенток с многоплодной беременностью, осложненной СОАП, проходивших обследование и лечение в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России с 2010 по 2017 годы. В зависимости от предложенной тактики ведения беременности пациенты были разделены на группы: в первую группу вошли 17 пациенток с консервативным ведением беременности; вторую группу составили 28 беременных, которым выполнялось внутриутробное лечение. Вторая группа в зависимости от типа выполняемой операции была разделена на две подгруппы А и В. В подгруппу А вошли 22 пациентки, которым проводилась интерстициальная лазерная коагуляция сосудов пуповины плода с акардией под контролем эхографии. В подгруппу В было включено 6 случаев монохориальной моноамниотической многоплодной беременности, при которых проводилась лазерная коагуляция и пересечение пуповины акардиального плода под контролем фетоскопии. Полученные данные были обработаны с использованием методов описательной статистики.
Результаты. В первой группе пациентов с консервативной тактикой ведения неблагоприятный исход наблюдался в 9 случаях (52,9%), преимущественно за счет прогрессирования кардиомиопатии плода-помпы и многоводия. Средний срок родоразрешения в данной группе составил 32,3±5,4 недели. Во второй группе благоприятный исход наблюдался в 78,6% случаев, в подгруппе А – в 77,3%, в подгруппе В – в 83,3%. Средний срок родов во второй группе составил 34,5±3,1 недели.
Заключение. Частота благоприятного исхода беременности осложненной СОАП была достоверно выше в группе с внутриутробным лечением, чем в группе с консервативной тактикой ведения, 78,6% и 47,1% соответственно (P=0,0023).
Синдром обратной артериальной перфузии (СОАП) — редкое осложнение монохориальной многоплодной беременности, с частотой встречаемости 1 случай на 35000 родов, характеризующееся наличием грубых пороков развития и отсутствием функционирующего сердца одного из плодов (плод акардиакус); при этом его кровоснабжение обеспечивается за счет второго плода (плода-помпы). Неблагоприятный исход беременности, осложненной СОАП, наблюдается в 60—85 %.
Патогенез данного состояния до конца не ясен. Предположительно, плод с акардией развивается в условиях существования двух доминантных анастомозов в монохориальной плаценте [1]. По артерио-артериальному анастомозу плод-помпа перекачивает кровь плоду с акардией, а по вено-венозному она возвращается. Таким образом, плод-помпа обеспечивает кровообращение акардиального плода с противоположно направленным кровотоком. Фактически, развитие недостаточности большинства систем органов аномального плода связано с гемодинамическими нарушениями, проявляющимися тем, что к нему под небольшим давлением поступает кровь с низким содержанием кислорода [2, 3].
К основным ультразвуковым признакам СОАП относятся: отсутствие нормально функционирующего сердца и реверсный (обратный) кровоток в артерии пуповины у аномально сформированного плода по данным допплерометрии. К дополнительным признакам относят широкий спектр различных аномалий развития плода с акардией: отсутствие или недоразвитие головы, конечностей, внутренних органов, утолщение воротникового пространства, отек мягких тканей, единственная артерия пуповины, выраженное несоответствие фетометрических параметров плодов [4]. В первом триместре беременности акардиальный плод может быть ошибочно принят за погибшего близнеца, особенно если присутствуют структуры черепа. Однако при последующих ультразвуковых исследованиях при СОАП будет отмечаться рост «погибшего» плода. Дифференциальная диагностика также проводится с тератомой. В отличие от тератомы, акардиальный плод всегда имеет связь с плацентой посредством пуповины [5].
Осложнения беременности при СОАП вызваны активным ростом плода с акардией, что является отражением его чрезмерного кровоснабжения плодом-помпой. Прогрессивно нарастающий объем крови в «общей» системе циркуляции приводит к развитию кардиомиопатии, сердечной недостаточности и в финале — к внутриутробной гибели плода-помпы. В свою очередь, многоводие, возникающее из-за полиурии, приводит к преждевременному излитию околоплодных вод и преждевременным родам [6].
Ключевым вопросом ведения беременности является оценка риска развития неблагоприятного исхода, лежащая в основе выбора тактики ведения беременности. В случае выявления СОАП в сроке до 12 недель рекомендуется проинформировать женщину о высокой вероятности неблагоприятных перинатальных исходов и предложить прерывание беременности. При более поздней диагностике беременность пролонгируется. Лечебную тактику подразделяют на консервативную и оперативную. С целью улучшения перинатальных исходов беременности, осложненной СОАП, предпринимаются различные внутриутробные вмешательства, направленные на прекращение поступления крови к плоду с акардией. В настоящее время остается нерешенным вопрос о том, следует ли выполнять внутриутробное вмешательство всем пациентам с СОАП, так как операция не лишена рисков – гибели плода-помпы и прерывания беременности. С другой стороны, при отсутствии выраженного кровоснабжения и роста плода с акардией возможна консервативная тактика ведения беременности.
В связи с этим является актуальным проведение исследования, направленного на определение оптимальной тактики ведения монохориальной многоплодной беременности, осложненной СОАП, и четких показаний к проведению оперативного лечения в антенатальном периоде.
Цель исследования: Сравнить эффективность оперативной и консервативной тактики ведения беременности, осложненной СОАП.
Материалы и методы исследования
С 2010 по 2017 годы на базе ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России проходили обследование и лечение 47 пациенток с многоплодной беременностью, осложненной СОАП. Нами проведен ретроспективный анализ перинатальных исходов в группах исследования.
Пренатальная диагностика СОАП основывалась на выявлении монохориальной многоплодной беременности и наличии выраженных аномалий развития одного из плодов, ретроградного кровотока в артерии пуповины по данным допплерометрии и отсутствия нормально функционирующего сердца. Прогрессирование СОАП устанавливалось при подтверждении увеличения размеров плода с акардией по данным динамического ультр.
Введение

Зарождение жизни — это всегда очень захватывающий процесс. Недаром все мировые религии и более-менее серьезные философские учения сравнивали человека с микрокосмом по аналогии с макрокосмом — вселенной. Однако даже если во вселенной есть воля случая, то тем более от нее не застрахован человек, обреченный в поте лица добывать хлеб и в мучении рождать детей. И если одни случайности полезны — например, мутагенез в Т-клеточном рецепторе или в антителах, а другие — являются данностью и не сильно мешают нам жить, как цвет глаз или предрасположенность к облысению, то третьи случайности приносят нам неудобства и опасности.
Беременность двойней — это случайность. Не в наш век продвинутых технологий, повышающих шанс на двойню, правда, но все же. Однако не всегда эта случайность может быть хорошей. По славной традиции, заложенной Каином и Авелем, Иаковом и Исавом, один близнец пытается убить другого, даже не выйдя из утробы матери. Такое явление ученые назвали ишиопаг, или близнец-паразит. Близнец-паразит не способен жить самостоятельно, поэтому, как правило, рождается уже мертвым, но до родов он получает питание за счет здорового близнеца, попутно доставляя ему неприятности, вплоть до риска мертворождения.
Наиболее редкая форма ишиопага — это акардия, когда здоровый близнец то ли был вынужден поставлять кислород и питательные вещества менее способному сородичу, то ли, наоборот, победил его и «накормил до смерти». Но обо всем по порядку.
Историческая справка
«Четвертого декабря 1551 года, в пятницу… родились трое детей… Один из них был маленьким мальчиком, который умер вскоре после крещения… Изображенный здесь третий имел удивительно редкую и устрашающую форму. Ибо у него не было ни головы, ни рук, можно было различить только туловище и ступни. Это был мертворожденный ребенок. Поскольку такие устрашающие чудовища без сомнения указывают на гнев Бога, весь христианский люд должен каяться и молиться… чтобы предотвратить наказание».
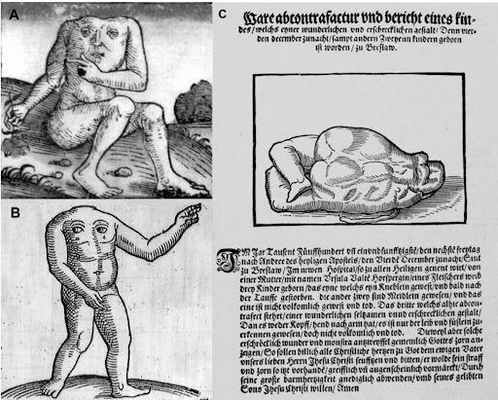
A — «Безголовый блеммии» из Нюрнбергской хроники Хартмана Шеделя, 1493. B — Рисунок из «Хроники чудесных и знаменательных событий» Конрада Ликосфена, 1557. C — Иллюстрация «Пугающее чудовище» в брошюре из польского города Вроцлав, 1551.
Неонатальные патологии, в частности акардические новорожденные, известны с древности. Так, свидетельства об этом встречаются и в Талмуде (III–V век), и у Геродота (V век), и в других средневековых европейских источниках. В одних источниках отмечалось, что это мертворожденные дети, в других же, как у Геродота, подчеркивалась жизнеспособность подобных объектов [3].
Почти каждый деформированный выкидыш тогда называли moon-calf, подразумевая негативное влияние Луны на беременность. Наиболее известный пример moon-calf — персонаж Калибан, уродливый слуга герцога Просперо из пьесы Шекспира «Буря». Однако безголовый плод был из ряда вон выходящим событием.
Несмотря на то, что акардия — довольно редкая патология, народная молва и мистический ужас перед безголовыми младенцами сильно раздули проблему, поэтому священник и врач Франческо Кангиамило постановил в 1745 году, что подобных новорожденных, не имеющих головы, не нужно крестить, так как у них нет души, которая, «как всем известно, в мозгу». Кангиамило не был первым, потому как еще Аристотель связывал человеческую душу с когнитивными процессами. Таким образом, можно сделать вывод, что с акардией человечество было знакомо давно.
Но несмотря на такое давнее знакомство, только в 1812 году врач Иоганн Фридрих Меккель-младший пришел к выводу, что акардия каким-то образом связана с близнецами, но как именно, он так и не понял. Лишь его племянник, Генрих, 38 лет спустя смог объяснить патогенез акардии, тогда как народ и некоторые ученые связывали рождение безголового плода с тем, что беременная женщина наблюдала, как приговоренному отрубали голову.
Патогенез и классификация
Со времен Меккеля нам известно, что акардия — это патология, встречающаяся у моноплацентарных близнецов. Другое название — TRAP, twin reversed arterial perfusion, или синдром близнецовой ретроградной артериальной перфузии. Здоровый близнец «накачивает» своего менее удачливого брата дезоксигенированной кровью, от чего тот и становится акардическим. Но каков патогенез этого явления? Почему вдруг здоровый эмбрион перекачивает кровь не обратно в плаценту, а в другого близнеца?
На данный момент известны две гипотезы, и обе связаны с артерио-артериальными анастомозами [2, 6].
Первая гипотеза связывает явление с артерио-артериальным анастомозом между близнецами. Напомним кровоснабжение нормального плода, чтобы понять патогенез акардии в данном случае.
Начинается плацентарное кровообращение с входящей в состав пупочного канатика пупочной вены, которая впадает в печень. Из органа кровь поступает в венозный проток, сообщающийся с нижней полой веной. По нижней полой вене богатая кислородом кровь попадает в правое предсердие, откуда через овальное окно попадает последовательно в правое предсердие и правый желудочек, откуда уже через аорту доставляется во все органы. Отток дезоксигенированной крови происходит через пупочные артерии, тоже входящие в состав пупочного канатика.
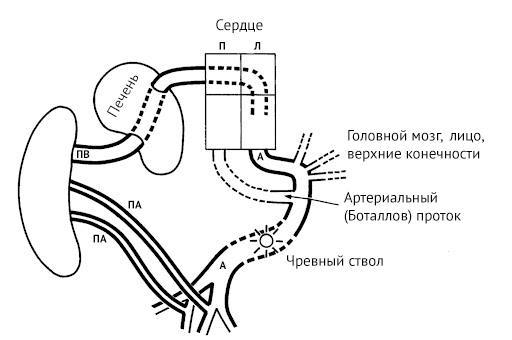
Первая гипотеза объясняет, почему нижние конечности у акардического близнеца развиты лучше, чем верхние: частично оксигенированная кровь идет по подвздошным артериям по обратному пути [7]. И напротив, низкое давление в ретроградно кровоснабжаемой верхней части тела и низкое насыщение кислородом ухудшают развитие этой области.
В пользу этой гипотезы говорят данные о том, что при уменьшении площади плаценты или снижении кровенаполнения ее сосудов кардиомиоциты развиваются намного медленнее, чем в норме [1].
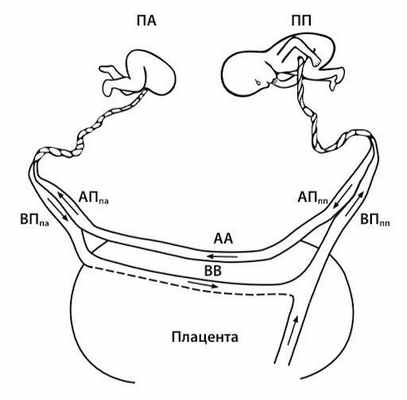
ПА — плод-акардиус, ПП — плод-помпа, АППА — артерия пуповины плода-акардиуса, АППП — артерия пуповины плода помпы, ВППА — вена пуповины плода-акардиуса, ВППП — вена пуповины плода-помпы.
Источник: Михайлов А.В с соавт. Синдром обратной артериальной перфузии: патофизиологические аспекты и принципы диагностики. Таврический медико-биологический вестник, 2018.
Другая гипотеза связывает акардию с врожденными патологиями сердца. В отличие от первой гипотезы, где сердце атрофируется в результате ретроградного тока, эта гипотеза утверждает, что именно пороки сердца в эмбриогенезе дают возможность обратной перфузии, а не наоборот, хотя дальнейшее описание патогенеза мало чем отличается. Из-за пороков сердца давление в пупочной артерии акардического близнеца ниже, чем у здорового (называемого насосным), что и приводит к обратной перфузии. Если кровяное давление здорового близнеца превышает систолическое желудочковое давление близнеца с пороком сердца, сердце второго не может перекачивать кровь в достаточном объеме и атрофируется [7]. Во второй гипотезе акардический близнец не жертва со стороны своего собрата по утробе, а скорее паразит, использующий анастомозы для частичного выживания.
Несмотря на то, что исследователи находят у акардических близнецов кариотипы, отличные от здоровых близнецов, этиология таких отличий в геноме остается не до конца ясной, чтобы делать какие-то выводы касательно верности одной из двух вышеуказанных гипотез.
Таким образом, для формирования синдрома обратной артериальной перфузии необходимо выполнение следующих условий:
- наличие сосудистого артерио-артериального анастомоза между артериями пуповины двух плодов;
- относительный градиент давления крови в артериальных системах гемоциркуляции на ранних этапах эмбрионального развития монохориальной многоплодной беременности.
Помимо наличия двух гипотез, которые основаны на сходном наборе данных и приводят к диаметрально противоположным выводам о причинах развития такой патологии, акардия поражает нас еще и большим выбором вариантов, словно мы оказались в патологическом гастрономе [2].
Так, среди акардических близнецов есть ацефалы, не имеющие головы, но у них могут быть сформированы конечности. Органы грудной клетки у таких близнецов обычно отсутствуют, и их место занимают аморфные ткани. Это, пожалуй, самый распространенный тип акардических близнецов.
Если этого недостаточно, то природа может предоставить анцепсов, имеющих большинство частей тела, пусть и плохо сформированных, или акормусов, представляющих одну голову с пуповиной. Если и этого покажется мало, то есть и аморфусы, крайне редкая форма акардического близнеца. Как следует из названия, такой близнец напоминает скорее аморфный кусок тканей с кровеносными сосудами, а не что-то человеческое.
Синдром фето-фетальной трансфузии
Говоря о патогенезе, стоит ответить на вопрос: какую роль играет плацента в развитии сердца плода? Плацента, как всем известно, очень важный орган в эмбриогенезе. Именно плацента является поставщиком кислорода и питательных веществ для эмбриона и барьером для ксенобиотиков. А поскольку экспрессия генов в эмбриогенезе — очень чувствительный и тонкий процесс, именно плацента может влиять на дифференцировку кардиомиоцитов и морфогенез сердца [8].
В течение первых недель беременности спиральные артерии матери, которые в конечном итоге будут кровоснабжать плаценту, претерпевают сильные изменения, которые включает потерю эластина и утрату активности (или полную атрофию) гладких миоцитов из их стенок и расширение конечных сегментов, которые открываются в межворсинчатое пространство. С нарушением перестройки сосудов связывают такие патологии, как преэклампсия, преждевременные роды или выкидыши.
Когда речь заходит о близнецах, все немного иначе. Так как акардия в основном встречается у монозиготных близнецов, то в этиологии пороков сердца также есть две гипотезы [5]. Одна из гипотез утверждает о взаимосвязи между процессом разделения близнецов в эмбриогенезе и восприимчивостью к другим повреждающим факторам, так что нарушается развитие сердца по крайней мере у одного близнеца. Другая гипотеза настаивает на том, что существует неравное деление массы эмбриональных клеток, что создает заведомо неравный потенциал для развития.
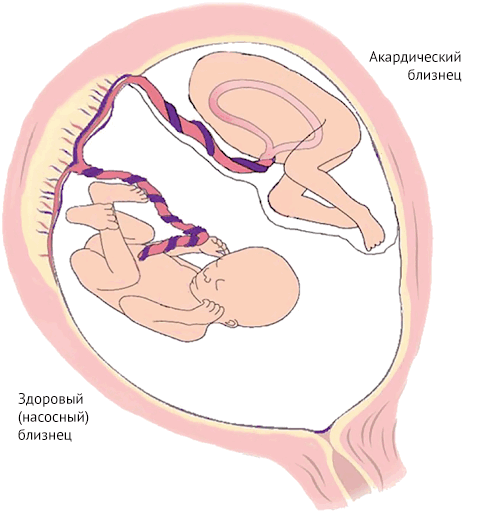
Этиология врожденных пороков сердца у близнецов изучена недостаточно. Можно только сказать, что такие поражения сердца являются следствием гемодинамических аномалий, которые могут возникнуть в результате синдрома фето-фетальной трансфузии (СФФТ), когда из-за общей плаценты монозиготные плоды могут иметь общее кровоснабжение [4]. Несмотря на тот факт, что каждый имеет свое место в плаценте, в ней могут образовываться анастомозирующие сосуды, кровь по которым способна перетекать от одного плода к другому, вызывая диспропорцию в ее объемах. В зависимости от направления тока крови, один из плодов становится «донором», второй — «реципиентом».
Ничего не напоминает? Да, TRAP — это один из вариантов СФФТ, наиболее серьезный. И соответственно работает по тому же принципу, когда один из близнецов — донор, а другой — реципиент. Отличаться будет только жизнеспособность обоих плодов.
Да, именно обоих. Акардический близнец шансов выжить не имеет, независимо ни от чего. Как только близнецы появляются на свет и пуповины перерезают, он жить более не способен. Однако СФФТ и акардия в том числе не просто так находятся в списке ишиопагов. Так как всю работу по перекачке крови за двоих делает лишь один близнец, то это грозит ему сердечной недостаточностью и многоводием [9]. Поэтому для здорового близнеца вероятность умереть составляет около 55 %, что, конечно, добавляет азарта ситуации, но угрожает здоровью матери. Причем риск развития сердечной недостаточности для насосного близнеца растет вместе с акардическим близнецом, который, как правило, превышает размеры своего здорового родственника [10]. Более того, помимо развития сердечной недостаточности у насосного плода может развиться и гипоксия тканей: так как ток крови в акардическим плоде обратный, то дезоксигенированная кровь отводится им через пупочную вену в плаценту, откуда может поступать в кровоток насосного [9]. Поэтому принято проводить хирургическое вмешательство: рассечение анастомозов в первые 16 недель, когда риски для насосного близнеца не так высоки.
Что еще более интересно и заслуживает отдельного внимания, так это морфология акардического близнеца, которая способна повлиять на внутриутробную смерть насосного: так, среди наиболее опасных критериев является формирование у акардиуса почек [11, 12]. И стоит объяснить, почему это так.
Так как циркуляция амниотической жидкости сопряжена с мочевыделением и обратным заглатыванием жидкости (трансмембранный путь реабсорбции в работе van Gemert считается незначительной), почки играют решающую роль в этом процессе наряду с глотательным рефлексом. А так как при акардии не развивается головной мозг, то глотательные движения невозможны, что снижает реабсорбцию амниотической жидкости при сохранившемся выделении и приводит к многоводию. И напротив, если почки у акардического плода не развиты, то это может привести к его отеку и увеличению массы, что тоже угрожает здоровому плоду и матери. Согласно данным работам, более дифференцированный вид акардиака несет больше вреда для насосного близнеца.
Заключение
Таким образом, акардиальный плод, словно камикадзе, вредит здоровому близнецу всеми доступными — и довольно ограниченными — способами. И хотя данная патология довольно редка, в наш век развития вспомогательных репродуктивных методик, которые повышают возможность монозиготной многоплодной беременности, не стоит недооценивать риски.
Сегодня акардический плод более не внушает мистический ужас и не связывается больше ни с фазами Луны, ни с гневом бога, ни с тем, что мать ребенка видела казнь. Однако несмотря на развитие науки и наше сегодняшнее понимание патогенеза, все равно остается много белых пятен и спорных вопросов, которые еще не решены.
Так, нет окончательного ответа касательно гипотезы возникновения ретроградной перфузии. И хотя большинство ученых склоняется к версии, что сердце развивается нормально и лишь потом атрофируется из-за ретроградного тока, у второй гипотезы тоже есть большое число сторонников. Генетические факторы до конца не ясны. К тому же нет четкого мнения об этиологии сердечной недостаточности у монозиготных близнецов, что делает сложным окончательное решение данных дилемм.
Презентация на тему Многоплодная беременность. Этиология и патогенез
Слайды и текст этой презентации

Выполнила- ст-ка Климок В.И.
Гр. МЛ-606
Многоплодная беременность - одновременное развитие двух или большего числа плодов.

Существует два вида близнецов:
Однояйцовые(монозиготные)- развиваются из одной яйцеклетки, они имеют одинаковые пол, генотип, группу крови и похожи друг на друга.
Двуяйцовые(дизиготные)-близнецы развиваются из разных яйцеклеток, оплодотворенных разными сперматозоидами. Они находятся в той же генетической зависимости, что и родные братья и сестры.
В зависимости от плацентарно-мембранных взаимоотношений многоплодная беременность бывает:
бихориальной биамниотической -каждый плод имеет собственные хорион и амнион, перегородка между ними состоит из четырех листков - двух амнионов и лежащих между ними двух гладких хорионов, при этом плацента может быть раздельная или слившаяся
монохориальной биамниотической- оба амниона заключены в один общий хорион, перегородка между плодами состоит из двух листков амниона
монохориальной моноамниотической- амниотическая полость общая для двух плодов, перегородки нет

ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Наследственность.
Возраст беременной (от 35 лет и выше), чем старше, тем чаще встречается многоплодная беременность.
Риск наступления многоплодной беременности увеличивается в течение первого месяца после отмены оральных контрацептивов, принимаемых не менее 6 мес.
Вспомогательные репродуктивные технологии (ЛС, стимулирующие овуляцию, ЭКО, посадка эмбриона) значительно повышают этот риск.
Двуяйцовая двойня возникает:
-при оплодотворении одновременно двух созревших яйцеклеток в одном или обоих яичниках (в одном фолликуле могут созреть несколько яйцеклеток) сперматозоидами одного или разных мужчин;
-оплодотворении яйцеклетки, овулировавшей на фоне уже существующей беременности в пределе одного менструального цикла ;
-оплодотворении яйцеклетки, овулировавшей на фоне уже существующей беременности во время следующего менструального цикла.
Разнояйцовые близнецы могут быть одного (75%) или разного пола. Их генотип не идентичен.

Однояйцовая двойня возникает:
-при оплодотворении многоядерной яйцеклетки;
-атипичном дроблении концептуса (преэмбриона) - одна яйцеклетка, оплодотворенная одним сперматозоидом, превращается в два зародыша (полиэмбриония).
Однояйцовые двойни встречаются реже, чем двуяйцовые.
При дизиготной двойне оплодотворенные яйцеклетки развиваются независимо друг от друга. После имплантации у каждого эмбриона образуются свой амнион и свой хорион каждый плод имеет свою плаценту, их системы кровообращения разделены. Все дизиготные двойни являются бихориальными.
Если имплантация эмбрионов произошла на некотором расстоянии друг от друга, их плаценты не соприкасаются.
При имплантации на близком расстоянии эмбрионы имеют общую децидуальную оболочку, края плацент соприкасаются, перегородка между их плодными мешками состоит из четырех оболочек (двух хорионов и двух амнионов).
Каждая плацента имеет собственную сосудистую сеть, но иногда между сосудами плацент образуются анастомозы, что может быть причиной осложнений.
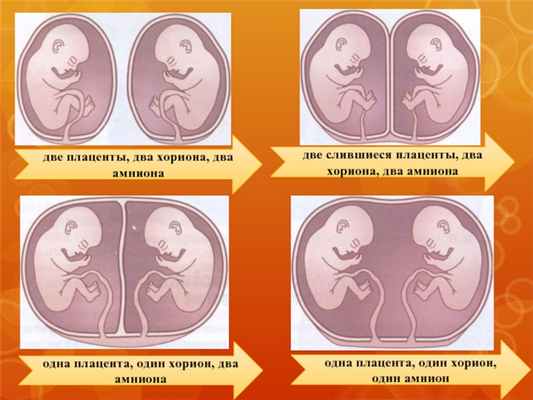
две плаценты, два хориона, два амниона
две слившиеся плаценты, два хориона, два амниона
одна плацента, один хорион, два амниона
одна плацента, один хорион, один амнион

Типы плацентарного комплекса влияют на течение и исход беременности: перинатальнаясмертность при монохориальной беременности выше, чем при бихориальной . При моноамниотической двойне пуповины обоих плодов прикрепляются к одной плаценте (близко друг от друга), что может привести к их перекручиванию и гибели обоих плодов. Есть риск формирования сросшихся (сиамских), близнецов.
Название сросшимся близнецам дают в зависимости от места их слияния: краниопаги (голова), торакопаги (грудной отдел), омфалопаги (брюшной отдел), пигопаги (ягодицы и нижние отделы позвоночника), также возможны их сочетания (торакоомфалопаги).
Одна треть сросшихся близнецов рождаются мертвыми или умирает в 1-е сутки жизни. В зависимости от места и степени сращения возможно хирургическое разделение.


КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клинические признаки многоплодной беременности во II и в III триместрах беременности:
--опережающее увеличение размеров матки по сравнению с предполагаемым сроком беременности(используют гравидограмму);
--в поздние сроки -выявление при наружном акушерском исследовании трех крупных частей плодов и более;
--прослушивание сердцебиения плода в двух точках и более, с зонами молчания между ними.
УЗИ позволяет дифференцировать многоплодную беременность от много- водия, пузырного заноса, опухоли матки (миома), крупного плода.
«Золотым стандартом» диагностики многоплодной беременности остается УЗИ, которое позволяет с помощью трансвагинального датчика визуализировать несколько плодных яиц в полости матки при задержке менструации на несколько дней.
В ранние сроки иногда рекомендуют определять содержание ХГ в моче или крови беременной. При многоплодной беременности уровень ХГ будет выше, чем при одноплодной в этом же сроке гестации.

Со стороны матери связаны с адаптацией организма к беременности несколькими плодами. Из-за большой нагрузки на организм отмечают повышенную утомляемость, одышку, нарушение мочеиспускания, запор. Перинатальная смертность при многоплодных родах в 3-4 раза выше, чем при одноплодных.
В 1 триместре наиболее частое осложнение- угроза прерывания и рвота беременных.
Во 2 триместре-из-за выраженной гиперволемии (за счет физиологической гемодилюции) частота анемии в 2-3 раза выше, выше риск гестационного диабета: при двойне частота 7%, при тройне -9%, при четверне -11%. В 1,5 раза увеличивается реализация инфекции мочевых путей. Часто варикозное расширение вен и повышается риск тромбообразования. ПЭ в 4 раза чаще. В большинстве случаев многоплодие сопровождается многоводием.
Феномен «исчезнувшего близнеца» -редукция одного эмбриона- в I триместре беременности. В поздние сроки может быть антенатальная гибель одного из плодов, в результате один плод мумифицируется, а второй развивается нормально и рождается в срок. Если антенатальная гибель до срока 22 нед, используют термин «несостоявшаяся двойня».
Фето-фетальный трансфузионный синдром (ФФТС)- между сосудами
кровеносных систем близнецов формируются анастомозы, градиент
давления в сосудах, один плод донор, другой- реципиент. Метод диагности
ки ФФТС - УЗИ, критерии развития ФФТС:-у плода-реципиента: многово
дие, водянка (подкожный отек более 5 мм, плевральный, перикардиальный
выпот, асцит); -у плода-донора: маловодие, задержка роста.

Разница в массе плодов может достигать 20% и более. Такие близнецы называют дискордантными. Вспомогательный метод диагностики - цветное допплеровское картирование.
Способы лечения ФФТС:
-амниоредукция - серия амниоцентезов, снижающих внутриамниотическое давление у плода-реципиента;
-септостомия - перфорация амниотической перегородки, околоплодные воды циркулируют между двумя амниотическими полостями.
-селективная эвтаназия плода - не очень приемлемый способ лечения. Однако он имеет право на существование, если гибель одного из плодов неизбежна;
-эндоскопическая лазерная коагуляция сосудистых анастомозов плаценты - патогенетически оправданный метод («золотой стандарт»). С помощью комбинированной (эндоскопической и эхографической) визуализации.
Обратная артериальная перфузия (акардиальный монстр, ацефальная акардия) Патогенез не ясен, но возникающие на ранних этапах эмбриогенеза анастомозы между артериями пуповин приводят к ретроградной циркуляции крови в артериях одного из плодов (реципиента) и вторичным нарушениям морфогенеза. Кровь от плаценты течет к реципиенту не по пупочной вене, а по артериям, всл. чего кровоснабжение верхней половины туловища плода-реципиента становится недостаточным (такой плод нежизнеспособен).У реципиента-аномалии развития в любом органе (отсутствие головного мозга, конечностей, грудной клетки, сердца, легких, пищевода, печени). Плод-донор морфологически здоров, но в рез. перегрузки сердца- водянка, гипотрофия, кардиомегалия, гепатоспленомегалия. Смертность плодов-реципиентов составляет 100%, плодов-доноров - 50%

Выбор времени и метода родоразрешения.
Госпитализацию в дородовое
отделение осуществляют за 2 нед до
срока родов (в 36 нед) для обследования
беременной и определения срока и метода родоразрешения. При
трех плодах и более стационарное
наблюдение рекомендовано с 26 нед
до срока родоразрешения.
70% многоплодных беременностей заканчиваются преждевременными родами,
которым предшествует несвоевременное излитие вод.
Тяжелые осложнения беременности со стороны матери (тяжелая ПЭ, декомпенсация экстрагенит. заболев.), со стороны плодов (декомпенсиров. плацентарная недостаточность, приводяшая к задержке роста, острая гипоксия плодов, ФФТС ), требуют экстренного родоразрешения.
При отсутствии экстренных показаний выбор метода планового родоразрешения зависит от положения и предлежания первого
плода, предполагаемой массы и состояния плодов, гестационного срока.
Показания к плановому оперативному родоразрешению:
• моноамниотическая двойня;
• три плода и более;
• тазовое предлежании или неправильное положение первого плода (поперечное,
косое).
Поворот плода на ножку с последующим извлечением или кесарево сечение
- методы выбора при необходимости экстренного родоразрешения.
Роды при многоплодной беременности- преждевременные, поэтому при оперативном родоразрешении рекомендуется извлекать новорожденных
в плодном пузыре
Индуцируют роды при двойне не позднее 38 нед беременности. Перинатальная смертность и неонатальная заболев. наименьшие в «идеальный» срок родоразрешения: при двойне - 36-37 нед, при тройне - 34-35 нед
ТЕЧЕНИЕ И ВЕДЕНИЕ РОДОВ
При дородовом излитии вод, во время латентной фазы (раскрытие зева менее 4 см) преждевременных родов при сроке менее 34 нед- начинают токолитическую терапию (нифедипин, Вадреномиметики,
ингибиторы окситоциновых рецепторов), чтобы отсрочить роды на 24-48 ч.
В это время проводят профилактику РДС дексаметазоном и госпитализируют пациентку в акушерский стационар. Показание к токолитической терапии в
активной фазе родов - профилактика быстрых и стремительных родов,
а также «внутриутробная реанимация».
Дородовое излитие вод при недоношенной беременности требует назначения АБ терап.- профилактика хориоамнионита и неонатальной инфекции.
Осложнения многоплодных родов:
• выпадение мелких частей плода и пуповины при неконтролируемом излитии околоплодных вод;
• неправильные положения плодов;
• слабость родовой деятельности;
• гипоксия плодов;
• ПОНРП после рождения первого плода.
В связи с высоким риском развития острой гипоксии плодов
роды необходимо вести под постоянным кардиомониторным
контролем. Т.к. высока частота аномалий родовой деятельности -регистрируют сократительную
активность матки с помощью монитора и раскрытие маточного зева в
первом периоде родов (необходимо ведение партограммы).
«Золотой стандарт» обезболивания родов - ЭДА со строго индивидуальным
подходом.

Во втором периоде родов возникает слабость потуг, для
профилактики слабости родовой деятельности в периоде изгнания вводят
Окситоцин в/в кап. со скоростью 0,0002 МЕ/кг в минуту. После рождения 1 плода-пережимают пуповину и производят влагалищное исследование. При головном предлежании 2 плода- вскрывают плодный пузырь, сокращение перерастянутой матки ,что является профилактикой преждевременной
отслойки плаценты.
Сцепление близнецов- редкое осложнение, при тазовом предлежании 1 плода и головном 2 плода. Роды протекают без осложнений
до рождения туловища 1 плода, головка 1 плода- над входом в малый таз и не может родиться, т.к. между его
головкой и телом вклинивается головка 2 плода. При этом требуется экстренное КС, головки расцепляют, 2 плод извлекают, а 1 рождается через естественные пути
Особенно опасны третий период родов и ранний послеродовой период из-за развития гипотонического кровотечения.
Для профилактики кровотечения используют введение утеротонических
препаратов в течение 2 ч после родов и внимательно наблюдают за состоянием родильницы.
После рождения последа-его осматривают для выяснения целости долек и оболочек, подтверждения хориальности и определения зиготности близнецов. Рождение разнополых детей-двуяйцовая беременность. При рождении однополых детей при бихориальной беременности зиготность неустановлена до генетического исследования. После родов при осмотре последа необходимо подтвердить вид многоплодной
беременности. При одной плаценте и двух листках в перегородке можно говорить о монохориальной биамниотической двойне, при четырех- о бихориальной двойне при слившихся плацентах.
На УЗИ осматривают место слияния перегородки и плаценты.
Соединение перегородки и плаценты в форме буквы «Т» (Т-зона) свидетельствует
о монохориальной беременности, в форме буквы «Λ» - ламбда
(Λ-зона) - о бихориальной беременности
Читайте также:
