Синдром Рубинштейна-Тейби - этиология, клиника, диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Синдром Рубинштейна (Rubinstein) - синонимы, авторы, клиника
Синоним синдрома Рубинштейна. S. Rubinstein—Taybi.
Определение синдрома Рубинштейна. Своеобразное расстройство развития со слабоумием, черепно-нижнечелюстно-лицевой дисморфией и пороками развития конечностей. Относится к синдромам дуги нижней челюсти и синдромам черепно-нижнечелюстно-лицевой дисморфии. По-видимому, синдром близок с S. Silver и S. Russell.
Авторы. Rubinstein J. Н. — современный американский детский психиатр, Цинцинатти, штат Огайо. Taybi Hooshang — современный американский рентгенолог, Индианаполис, штат Индиана. Впервые синдром описали в 1962 —1963 гг. Rubinstein и Taybi совместно; Coffin в 1964 г. предложил название «S. Rubinstein».
Симптоматология синдрома Рубинштейна:
1. Малый рост.
2. Значительная задержка умственного развития, а также нарушения статических и психомоторных функций. Интеллектуальный уровень значительно ниже нормы.
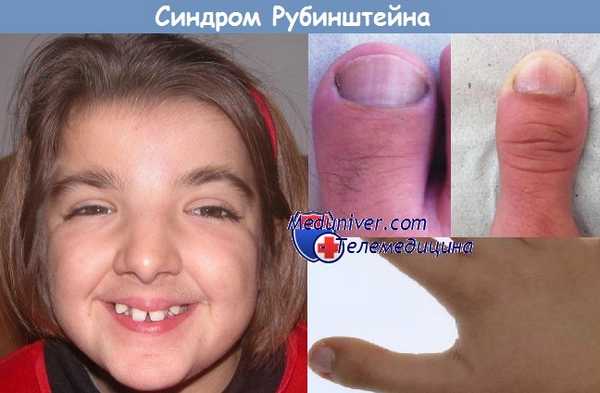
3. Своеобразное характерное лицо резко выступающий «клювовидный нос» с выдающейся спинкой носа, гипертелоризмом, страбизмом, птозом (преимущественно односторонним), выступающим лобным бугром, асимметрией бровей, глубоким расположением ушных раковин, умеренно выраженной дисплазией, часто с naevus flammeus, убегающей подбородочно-ротовой линией, аномалиями расположения зубов и прикуса, готическим расположением неба.
4. Глаза: гиперметропия, астигматизм; наблюдают также катаракту, колобом радужной оболочки, одностороннюю экзофтальмию и атрофию зрительного нерва.
5. Череп: микроцефалия; длинный, длительное время не закрывающийся большой родничок.
6. Характерные изменения кистей и стоп (дифференциально-диагностический признак): расширение, укорочение и уплощение фаланг больших пальцев кистей и стоп; иногда клинодактилия I и V пальцев, радиальная полидактилия. Паронихии.
7. Аномалии скелета: задержка развития костей, аномалии позвонков, ребер и таза со сколиозом, pectus excavatum или carinatum, дисплазия грудной клетки и др.
8. В части случаев имеются также пороки развития внутренних органов, например, врожденные пороки сердца, фиброз эндокарда, дисплазия почек и мочевого пузыря, крипторхизм, дисплазия полового члена и др.
9. Общая гипотония мускулатуры, повышение коленных рефлексов, слабость осанки.
10. Анамнестические данные: в отдельных случаях отмечают недостаточный вес при рождении, слабость сосания груди, позднее развитие зубов.
11. Отсутствие хромосомных аномалий (дифференциально-диагностический признак).
Дифференциальный диагноз. S. Russel (см.). S. Silver (см.). S. Lejeune (см.). S. Franceschetti I (см.). S. Hallermann (см.). S. (Cornelia) de Lange I (см.). S. Freeman—Sheldon (см.). Брахидактилия. S. Grob (см.). S. Papillon-Leage—Psaume (см.). S. Waardenburg (см.). S. Weyers (см.). S. Ulbrich— Frichtiger (см.). Синдром черепно-нижнечелюстно-лицевой дисморфии. S. Patau (см.). S. Holt—Oram (см.). S. Edwards (см.). Синдромы дуги нижней челюсти.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Рубинштейна-Тейби
Синдром Рубинштейна-Тейби – генетически гетерогенное (по последним данным) наследственное заболевание, характеризующееся поражением центральной нервной системы, деформациями костей скелета и рядом других пороков развития. Симптомами этого состояния являются прогрессирующая умственная отсталость, низкий рост, расширение фаланг пальцев, полидактилия на ногах, разнообразные нарушения со стороны внутренних органов. Диагностика синдрома Рубинштейна-Тейби производится на основании данных настоящего статуса пациента, молекулярно-генетических анализов и других исследований. Специфического лечения данной патологии не существует, применяют симптоматическую терапию в зависимости от типа пороков и нарушений.
Общие сведения
Синдром Рубинштейна-Тейби – генетическое заболевание, которое сопровождается нарушениями интеллектуального и физического развития, а также разнообразными пороками скелета и внутренних органов. Впервые данная патология была выявлена в 1963 году и описана американскими педиатрами Дж. Рубинштейном и Г. Тейби – сами исследователи назвали заболевание «синдромом широкого первого пальца кистей и стоп, специфического лица и умственной отсталости». Дальнейшие исследования в области генетики подтвердили, что синдром Рубинштейна-Тейби является аутосомно-доминантной патологией, но подавляющее большинство случаев возникает вследствие спонтанных мутаций различного типа. Встречаемость составляет порядка 1:100 000-125 000, мальчики и девочки поражаются примерно с одинаковой частотой. Особенностью синдрома Рубинштейна-Тейби является повышенный риск развития различных онкологических заболеваний – главным образом, некоторых типов лейкозов, опухолей мозговых оболочек и нервных тканей.
Причины синдрома Рубинштейна-Тейби
Синдром Рубинштейна-Тейби обладает выраженной генетической гетерогенностью, однако различные типы этого заболевания не имеют каких-либо особенностей клинического течения. Наиболее часто причиной этой патологии выступают повреждения гена CREBBP, который расположен на 16-й хромосоме. Он кодирует так называемый CREB-связывающий белок, являющийся важным транскрипционным фактором, контролирующим экспрессию огромного количества генов. Появление в гене CREBBP различных изменений (точечных мутаций, транслокаций, микроделеций в 16-й хромосоме) приводит либо к образованию дефектного белка, неспособного выполнять свои функции, либо к полной блокировке его выделения. Это становится причиной развития синдрома Рубинштейна-Тейби.
В последние годы молекулярно-генетические исследования данной патологии подтвердили, что в ее развитии играют роль и мутации гена EP300, который располагается на 22-й хромосоме. Продуктом экспрессии данного гена является протеин p300, который, как и CREB-связывающий белок, относится к группе транскрипционных факторов. По данным исследований, идентифицировать характер генетического дефекта при синдроме Рубинштейна-Тейби удается в 55-60% случаев, примерно у половины пациентов обнаруживаются мутации гена CREBBP, еще у 40-45% выявляются делеции и другие хромосомные перестройки, затрагивающую 16-ю хромосому, и лишь у 3% больных наблюдаются мутации гена EP300. Все это указывает на возможность участия других генов в развитии этого заболевания.
Дефект белка-фактора транскрипции или его малое выделение (по причине гаплонедостаточности) приводит к многочисленным нарушениям, обусловленным недостаточной стимуляцией ряда других генов. Это можно заметить по характерной клинической картине синдрома Рубинштейна-Тейби. Оба транскрипционных фактора влияют на активность образования новых связей между нейронами, формирование долговременной памяти, стимуляцию иммунного ответа, развитие репродуктивной системы. Недостаточность этих белков ведет к целому каскаду патологических процессов в организме, что и составляет клинику синдрома Рубинштейна-Тейби. Кроме того, вышеуказанные транскрипционные факторы также влияют на активность антионкогенов, поэтому при их дефекте значительно возрастает риск развития злокачественных новообразований.
Симптомы синдрома Рубинштейна-Тейби
Симптоматика синдрома Рубинштейна-Тейби характеризуется значительным разнообразием у разных больных, что отражается на тяжести течения заболевания и его прогнозе. Обычно уже при рождении можно обнаружить некоторые признаки этой патологии – деформации лица и черепа (микро- или брахицефалия, расширение переносицы, эпикант, клювовидный нос), высокое арковидное нёбо, изменение формы и положения ушных раковин, расширенные фаланги пальцев, особенно первых. На ногах у больных синдромом Рубинштейна-Тейби нередко выявляется полидактилия. Иногда уже при рождении определяются признаки пороков развития внутренних органов – бледность или цианоз (при поражении легких или сердца), длительная желтуха новорожденных, крипторхизм.
При дальнейшем течении синдрома Рубинштейна-Тейби отмечается прогрессирующее отставание ребенка в физическом и умственном развитии от здоровых сверстников, затрудненное развитие речи и моторных навыков. Также наблюдается косоглазие, миопия. Выражение лица больных характеризуется гримасой, напоминающей улыбку, возникает гирсутизм, примерно у половины пациентов определяется наличие красного невуса в области лба, затылка или шеи. В старшем возрасте у больных синдромом Рубинштейна-Тейби выявляются искривления позвоночного столба различного характера и низкий рост (не более 150-160 сантиметров). Могут определяться деформации грудной клетки и (реже) другие скелетные аномалии, у мальчиков в большинстве случаев отмечается крипторхизм.
Постоянным признаком синдрома Рубинштейна-Тейби является умственная отсталость. Как правило, диагностируется ЗПР, олигофрения, значительная задержка речевого развития по сравнению со здоровыми сверстниками. Отмечаются нарушения концентрации внимания, больные легко отвлекаются на посторонние раздражители при выполнении какого-либо задания, возможны резкие перепады настроения. При этом лица с синдромом Рубинштейна-Тейби хорошо идут на контакт, легко социализируются. Среди других неврологических симптомов заболевания нередко обнаруживается плохая координация движений, изредка наблюдаются судорожные приступы.
Синдром Рубинштейна-Тейби может также проявляться различными нарушениями со стороны внутренних органов – головного мозга, сердца, почек и мочевыделительных путей, терминальных отделов пищеварительной системы. Кроме того, у таких больных значительно повышается риск возникновения онкологических заболеваний, в основном развивающихся в раннем возрасте. К ним относят различные формы лейкозов, меланому, некоторые типы лимфом. Поэтому до пубертатного периода больные синдромом Рубинштейна-Тейби должны периодически проходить обследования у онколога для ранней диагностики злокачественных новообразований.
Диагностика и лечение синдрома Рубинштейна-Тейби
Для выявления синдрома Рубинштейна-Тейби используют данные общего осмотра больного, рентгенологических исследований и молекулярно-генетических анализов, вспомогательную роль могут играть УЗИ и МРТ. При осмотре определяются характерные для этого заболевания аномалии развития лица (изменение формы и размеров черепа и носа, антимонголоидный разрез глаз), укорочение и расширение фаланг больших пальцев на руках и ногах, иногда – полидактилия. У взрослых больных синдромом Рубинштейна-Тейби также выявляют уменьшение роста, глубокую умственную отсталость, искривления позвоночника. На рентгенограммах можно увидеть изменения костей фаланг, позвоночника и грудной клетки, костный возраст несколько отстает от фактического.
Молекулярно-генетическая диагностика синдрома Рубинштейна-Тейби выполняется врачом-генетиком, который может использовать множество методов для определения этого заболевания. Точечные мутации в генах CREBBP и ЕР300 выявляются посредством прямого автоматического секвенирования кодирующей последовательности. Методика FISH используется в том случае, когда подозревается наличие делеций или транслокаций на 16-й хромосоме, также приводящих к развитию синдрома Рубинштейна-Тейби. Так как на основании фенотипических данных крайне сложно определить возможный тип генетического дефекта, в рамках диагностики этого заболевания нередко приходится применять сразу несколько техник современной молекулярной генетики.
Вспомогательные методы диагностики позволяют выявить сопутствующие нарушения внутренних органов при синдроме Рубинштейна-Тейби. К таким методам относят ультразвуковые исследования (УЗИ почек и мочевыделительных путей, ЭхоКГ), электрокардиографию, магнитно-резонансную томографию и другие методики. Нередко у больных синдромом Рубинштейна-Тейби диагностируют врожденные пороки сердца (открытый Боталлов проток, дефект межжелудочковой перегородки), аритмии, аномалии почек (удвоение, гипоплазия) и мочевыделительных путей (атрезии на различных участках). Также при этом заболевании нарушается формирование мозолистого тела головного мозга, что определяется при помощи магнитно-резонансной томографии. У части больных синдромом Рубинштейна-Тейби отмечаются пороки развития легких и пищеварительной системы.
Специфического лечения данной патологии на сегодняшний момент не существует, все терапевтические мероприятия сводятся к облегчению симптомов, коррекции аномалий и пороков развития, угрожающих жизни больных. Назначаются ноотропные средства, препараты кальция и витамина Д, для уменьшения выраженности умственной отсталости рекомендуют специализированную психологическую помощь. В ряде случаев при синдроме Рубинштейна-Тейби применяют хирургические методы лечения – для устранения пороков сердца, аномалий развития прямой кишки и мочевыделительных путей, крипторхизма. Также может потребоваться лечение у офтальмолога, а при признаках развития злокачественного новообразования – консультация и лечение у онколога.
Прогноз и профилактика синдрома Рубинштейна-Тейби
Согласно мнению большинства специалистов, прогноз синдрома Рубинштейна-Тейби чаще всего неопределенный или неблагоприятный. Это связано с тем, что данное заболевание характеризуется значительным спектром разнообразных нарушений – от относительно безопасных для жизни (легкие скелетные аномалии, умственная неполноценность) до ярко выраженных, способных привести к смерти в раннем возрасте (тяжелые пороки развития сердца, легких, почек). Кроме того, значительно повышен риск развития онкологических патологий. Поэтому прогноз синдрома Рубинштейна-Тейби составляется строго индивидуально, исходя из конкретной клинической картины и общего состояния больного. Каких-либо специфических методов профилактики этого заболевания из-за его частого спонтанного развития на сегодняшний день не разработано.
Синдром Корнелии де Ланге ( Амстердамская карликовость , Амстердамский нанизм , Синдром Брахмана де Ланге )
Синдром Корнелии де Ланге – это генетически опосредованное мультисистемное заболевание, включающее множественные аномалии развития и олигофрению. Фенотипические признаки синдрома представлены микробрахицефалией, заниженной линией роста волос, тонкими сросшимися бровями, широкой запавшей переносицей, микрогенией и др. Характерна низкорослость, возможны врожденные пороки (ВПС, мочеполовые аномалии, пилоростеноз, диафрагмальная грыжа). При диагностике учитываются клинические критерии и результаты генетического тестирования. Дети с данной патологией нуждаются в симптоматической терапии, дефектологической помощи.
МКБ-10
Синдром, характеризующийся комплексом стигм дизэмбриогенеза, пороками развития и умственной неполноценностью, был описан в 1916 г. доктором медицины В. Брахманом. Однако свое официальное название заболевание получило в честь педиатра из Амстердама Корнелии де Ланге, которая подробно описала сразу два клинических наблюдения в 1933 г. В литературе наряду с общепринятым – синдром Корнелии де Ланге – встречаются названия «синдром Брахмана де Ланге», «амстердамская карликовость/нанизм». Патология регистрируется с частотой 1:10000–1:30000, распространенность не имеет географических, расовых и гендерных различий.
Причины
Синдрому свойственна генетическая неоднородность, на данный момент известно три гена, ответственных за данную патологию. Около 50% описанных случаев связано с дефектами в гене NIPBL, кодирующем белок делангин (5p13.2), около 5% – с мутациями гена когезинового комплекса SMC1A (Xp11.22). Один известный случай ассоциирован с нарушением другой субъединицы когезина, кодируемой SMC3 (10q25). Примерно в 40% наблюдений синдром Корнелии де Ланге вызывается неизвестными мутациями, которые еще только предстоит вычислить.
Большая часть мутаций NIPBL являются вновь возникшими, поэтому чаще больные дети рождаются от генетически здоровых родителей. Однако известны наблюдения семейных случаев с аутосомно-доминантным наследованием. Ген SMC1A расположен на половой Х-хромосоме – при его дефектах наследование сцеплено с полом (болеют мужчины, женщины выступают гетерозиготными носительницами).
Факторы риска
Спонтанные патологические изменения генетического материала могут быть обусловлены следующими факторами:
- интоксикациями и инфекциями беременной, перенесенными в первом триместре;
- эндокринопатиями беременной;
- лекарственным (в т. ч. цитостатическим), радиационным воздействием на плод;
- близкородственным браком;
- поздними родами (у женщин старше 35 лет).
При отсутствии генных мутаций у родителей риск повторного рождения ребенка с синдромом Брахмана де Ланге в одной семье равен 2-5%.
Патогенез
Молекулярную основу патологии составляет нарушение функционирования белков когезинового комплекса. Когезины играют важнейшую роль в процессе клеточного деления. Они располагаются внутри хромосомы, сцепляя и удерживая между собой две сестринские хроматиды. Другие, не менее важные функции когезина – это репарация ДНК и регуляция экспрессии генов.
По всей видимости, воздействие различных мутагенных факторов в критические периоды приводит к неправильному делению клеток и закладке органов. Патологоанатомическое исследование выявляет значительные изменения головного мозга: аплазию оперкулярной коры, недоразвитие роландовой борозды, запаздывающую миелинизацию и и миелодегенерацию. Также обнаруживаются пороки развития почек, надпочечников, гонад, сердца, гипоплазия тимуса.
Классификация
По степени выраженности фенотипических проявлений выделяют 2 варианта синдрома Корнелии де Ланге. Они различаются как проявленностью внешней симптоматики, так и витальным прогнозом:
- классический: значительная задержка развития плода, грубые пороки развития и выраженная умственная неполноценность;
- доброкачественный: лицевые и скелетные аномалии без грубых пороков внутренних органов, пограничная ЗПР. Дефекты генов SMC3 и SMC1A коррелируют с доброкачественным течением синдрома.
Симптомы
Физическое развитие
Младенцы с синдромом Корнелии де Ланге рождаются с низкими росто-весовыми показателями: средняя масса составляет 2100-2300 г. Они малоактвны, редко выражают свои потребности криком. С первых дней отмечается вялое сосание груди, частые срыгивания, диспепсические расстройства. Такие проблемы нередко вынуждают кормить ребенка через назогастральный зонд или гастростому. Дети часто страдают рецидивирующими респираторными инфекциями. Физическое и психомоторное развитие отстает от возрастной нормы.
Фенотипические признаки
Внешний вид ребенка очень своеобразный. Перечисленные черепно-лицевые дисморфии входят в число основных критериев при диагностике патологии:
- аномалии черепа и лицевого скелета: микро- и брахицефалия, готическое небо, небные расщелины, микрогнатия;
- черты лица: тонкие сросшиеся брови, длинные ресницы, широкая переносица с седловидной деформацией и широкими ноздрями, низко посаженные уши, тонкие губы с опущенными вниз уголками;
- аномалии кожи и ее придатков: на голове ‒ густые волосы с низкой линией роста, на теле – гипертрихоз, мраморная кожа.
Скелетные аномалии
Пациенты имеют воронкообразную грудную клетку, короткую шею. В области позвоночного столба могут обнаруживаться такие дефекты, как Spina bifida, люмбализация или сакрализация позвонков. Присутствует гипоплазия кистей и стоп, дефекты развития пальцев (клинодактилия, синдактилия, олигодактилия), суставные контрактуры, дисплазия и врожденный вывих бедра. Отставание в росте сохраняется и во взрослом возрасте: мужчины с амстердамским нанизмом имеют рост около 156 см, женщины ‒ 131 см.
Неврологические и психопатологические проблемы
Больные с классической формой синдрома Корнелии де Ланге имеют интеллектуальные нарушения в степени имбецильности или глубокой дебильности. При мягкой форме интеллектуальный дефект выражен нерезко – больные имеют диагноз ЗПР. У четверти пациентов эпизодически отмечается судорожный синдром.
Поведенческие особенности представлены синдромом гиперактивности, тревожностью, признаками ОКР. Отмечается агрессивность по отношению к окружающим, аутоагрессия и самоповреждающее поведение, стереотипные действия. Речевые расстройства носят системный характер, страдает вербальная коммуникация, при небных расщелинах возникает ринолалия.
Зрительные нарушения
Распространенными проблемами со стороны зрительной системы выступают миопия, птоз века, блефарит. Реже диагностируется косоглазие, микрокорнеа, в единичных наблюдениях выявлены катаракта и глаукома. При тяжелом варианте синдрома Корнелии де Ланге высок риск отслойки сетчатки и атрофии зрительного нерва.
Пороки внутренних органов
Почти в половине случаев синдрому сопутствуют врожденные кардиальные пороки: дефекты перегородок сердца (аортолегочной, межжелудочковой, межпредсердной), коарктация аорты, тетрада Фалло. Аномалии развития ЖКТ чаще всего представлены гастроэзофагеальным рефлюксом (90%), может выявляться диафрагмальная грыжа (2%), пилоростеноз (4%), незавершенный поворот кишечника (10%). Частыми патологиями мочеполовой системы выступают поликистозная или подковообразная почка, гидронефроз, двурогая матка, неопущение яичек, гипоспадия. Характерна задержка полового развития.
Осложнения
Тяжелые варианты синдрома ассоциированы с пороками развития, несовместимыми с жизнью, и гибелью новорожденных вскоре после рождения. При более мягком течении тормозить развитие ребенка могут рецидивирующие синуситы, отиты с последующим развитием кондуктивной тугоухости. На фоне гастроэзофагеального рефлюкса нередко возникает анемия, аспирационная пневмония, стеноз пищевода, иногда − пищевод Барретта, аденокарцинома. В бытовом плане пациенты с синдромом Корнелии де Ланге нуждаются в уходе, всесторонней помощи. Им требуется специальное обучение и дефектологическое сопровождение.
Диагностика
При рождении диагностическая гипотеза о наличии у ребенка синдрома Корнелии де Ланге может быть выдвинута на основании визуально определяемых дефектов. Новорожденный должен быть осмотрен неонатологом, детским кардиологом, хирургом, неврологом. В плановом порядке проводятся консультации челюстно-лицевого хирурга, эндокринолога, ортопеда, логопеда. Диагностическая тактика включает:
- Антропометрию. При рождении и на протяжении всего раннего детства проводится регулярное измерение длины (роста), массы тела, окружности головы. Все антропометрические показатели находятся ниже возрастных норм (
- Обследование сердечно-сосудистой системы. Выявить наличие сердечных пороков позволяет ЭхоКС, ЭКГ. При необходимости могут потребоваться инвазивные исследования: катетеризация сердца, вентрикулография и др.
- Обследование ЖКТ. Для обнаружения ГЭРБ и морфологических изменений пищевода показана ЭГДС под наркозом. С целью исключения возможных аномалий кишечника необходима рентгенография с барием.
- Психоневрологическую диагностику. При первичном осмотре определяются рефлексы, тонус мышц, уровень психомоторного развития. В дальнейшем исследуется НСГ, ЭЭГ, выполняется рентгенография костей черепа, МРТ головного мозга.
- Прочие обследования. В целях выявления аномалий органов осуществляется УЗИ брюшной полости, почек, гениталий. Обязательна проверка функции зрения (рефрактометрия, офтальмоскопия, биомикроскопия), слуха (отоскопия, аудиограмма, слуховые ВП). С помощью рентгена костей и позвоночника выявляются скелетные аномалии.
- Молекулярное тестирование. Генодиагностика синдрома предполагает консультирование семьи генетиком с проведением кариотипирования больного ребенка, поиском мутаций в генах NIPBL, SMC1A.
Выявление синдрома возможно на дородовом этапе в рамках пренатального УЗИ-скрининга и фетометрии плода. Эхографическими маркерами патологии служат ЗВУР, особенности черепа, аномалии конечностей. С помощью УЗИ могут быть обнаружены ВПС, диафрагмальная грыжа и другие аномалии органов плода.
Дифференциальная диагностика
При проведении обследования необходимо исключить другие заболевания, имеющие сходные фенотипические черты:
- алкогольный синдром плода;
- трисомию 3q;
- синдром Фринса;
- синдром Нунан;
- синдром Прадера-Вилли;
- синдром Рубинштейна-Тейби.
Лечение синдрома Корнелии де Ланге
Тактика зависит от комплекса выявленных пороков, степени их влияния на качество жизни ребенка, его социализацию. В первую очередь осуществляется лечение тех патологий, которые могут привести к дестабилизации состояния:
- Желудочно-пищевой рефлюкс: разработка диеты, прием антацидов и H2-гистаминоблокаторов, по показаниям – фундопликация.
- Пороки сердца: ушивание/пластика дефектов перегородок, дилатация или резекция коарктации аорты, коррекция тетрады Фалло.
- Неврологические нарушения: прием противосудорожных препаратов, анксиолитиков, СИОЗС, лечение средой.
- Аномалии мочеполовой системы: орхипексия, коррекция гипоспадии, пластика гидронефроза, коррекция пузырно-мочеточникового рефлюкса.
- Расщелины неба: уранопластика, велофарингопластика.
- Скелетные аномалии: лечебная физкультура, массаж, физиотерапия с целью предотвращения суставных контрактур.
Коррекция тугоухости проводится с помощью слуховых аппаратов, аномалий зрения – с использованием очков, аппаратных методик. В программу педагогического сопровождения ребенка обязательно включаются занятия с дефектологом, психологом, логопедом. Терапия гормоном роста неэффективна.
Прогноз и профилактика
Ввиду большого количества аномалий развития средняя продолжительность жизни лиц с синдромом Корнелии де Ланге ниже, чем в популяции. Однако при благоприятном варианте пациенты могут дожить до 50-60 лет. Больным необходима социально-психологическая поддержка, трудовая реабилитация, помощь в самообслуживании. Вследствие имеющегося иммунодефцита критически важным является предупреждение инфекций.
Профилактика генетического синдрома требует исключения кровнородственных браков и ответственного планирования беременности. Беременным обязательно прохождение лабораторного и ультразвукового скрининга, а при необходимости – инвазивной пренатальной диагностики.
2. Синдром Корнелии де Ланге: клиника, диагностика, лечение (случай из практики)/ Бугаенко О.А., Сиротченко Т.А., Бондаренко Г.Г., Вельковская М.М.// Медицинский вестник Юга России. – 2018.
Спиноцеребеллярные атаксии
Спиноцеребеллярные атаксии – группа генетически разнородных наследственных заболеваний неврологического характера, которые проявляются различными расстройствами работы мозжечка и иногда базальных ядер головного мозга. Симптомами этого состояния являются: развитие атаксии и неустойчивой походки, нарушение координации движений и другие неврологические проявления. Диагностика спиноцеребеллярных атаксий производится на основании данных неврологического осмотра, изучения наследственного анамнеза больного, магнитно-резонансной томографии и молекулярно-генетических исследований. Специфического лечения этой патологии на сегодняшний момент не существует, для сохранения оптимального качества жизни больного используют методы поддерживающей и симптоматической терапии.
Спиноцеребеллярные атаксии – группа наследственных неврологических состояний, характеризующихся развитием прогрессирующей дегенерации клеток мозжечка и иногда базальных ядер вплоть до их полной атрофии. Впервые одно из заболеваний этой группы было описано еще в 1891 году немецким невропатологом П. Менцелем, который выявил развитие атаксии, офтальмоплегии и других неврологических нарушений в рамках одной семьи. Дальнейшие исследования показали, что это состояние (известное сейчас как спиноцеребеллярная атаксия 1-го типа) наследуется по аутосомно-доминантному механизму.
Причины и классификация спиноцеребеллярных атаксий
Несмотря на значительное генетическое и отчасти клиническое разнообразие спиноцеребеллярных атаксий, молекулярные механизмы генетических нарушений при этих заболеваниях очень сходны. Основная причина патологии заключается в изменении количества тринуклеотидных последовательностей (CAG) в кодирующей части ассоциированных с заболеванием генов. Это приводит к увеличению количества аминокислоты глутамина в полученном белке, что изменяет физико-химические свойства протеина и нарушает его функции. В ряде случаев вышеуказанные белки прямо или косвенно участвуют в метаболизме нервной ткани, поэтому изменение их структуры приводит к спиноцеребеллярной атаксии. В настоящее время лучше всего изучены молекулярные механизмы 6 основных разновидностей этого заболевания – данные формы патологии встречаются наиболее часто и в совокупности составляют более 90% случаев спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 1-го типа считается самым распространенным и самым изученным вариантом данной патологии. Ее причиной выступают мутации в гене ATXN1, который располагается на 6-й хромосоме. В норме данный ген имеет не более 36 CAG-повторов, увеличение их количества приводит к развитию заболевания. Продуктом экспрессии гена ATXN1 является особый ДНК-связывающий белок, активно участвующий в метаболизме клеток Пуркинье мозжечка – при наличии мутантной разновидности гена это приводит к появлению агрегантов и постепенной дегенерации, что и становится причиной спиноцеребеллярной атаксии.
Спиноцеребеллярная атаксия 2-го типа – менее распространенный вариант заболевания, этиология не так тщательно изучена. Причиной патологии является увеличение количества CAG-повторов в гене ATXN2, локализованном на 12-й хромосоме. В здоровом варианте гена количество вышеуказанных последовательностей составляет от 15 до 36, тогда как при спиноцеребеллярной атаксии их может быть свыше 100. Функции белка, который кодируется геном ATXN2, на сегодняшний момент неизвестны.
Спиноцеребеллярная атаксия тип 3 (другое название – болезнь Мачадо-Джозефа в честь двух больных, у которых впервые было описано данное состояние) – причиной этого варианта патологии выступают нарушения в гене ATXN3, расположенном на 14-й хромосоме. В норме количество CAG-повторов в этом гене не превышает 47, при развитии заболевания обнаруживается от 53 до 68 повторов. Данный ген кодирует белок, который предположительно участвует в энергетическом обмене нейронов мозжечка и базальных ядер.
Спиноцеребеллярная атаксия тип 6 – сравнительно редкий вид заболевания, обусловленный дефектами в гене CACNA1A, локализованном на 19-й хромосоме. Для развития патологии достаточно очень незначительного увеличения количества CAG-повторов – если в нормальном варианте гена их обнаруживают 5-20, то при наличии атаксии – 21-26. Ген CACNA1A кодирует белок-субъединицу кальциевых каналов, расположенных на нейронах мозжечка. Помимо спиноцеребеллярной атаксии, нарушения в гене CACNA1A обуславливают развитие эпизодической атаксии и некоторые наследственные формы мигрени.
Спиноцеребеллярная атаксия тип 7 – данная разновидность патологии вызывается нарушениями структуры гена ATXN7, который располагается на 3-й хромосоме. У здорового человека количество CAG-повторов составляет не более 35, тогда как при заболевании их количество может достигать нескольких сотен. Функции белка, который кодирует ген ATXN7, на сегодняшний момент изучаются.
Спиноцеребеллярная атаксия тип 8 обусловлена генетическим дефектом гена ATXN8, расположенного на 13-й хромосоме. Как и в других случаях, суть генетического дефекта при этом состоянии заключается в изменении количества тринуклеотидных последовательностей CAG – обычно их около 15-50, тогда как при патологии количество повторов может составлять свыше 1200.
Практически при любом типе спиноцеребеллярной атаксии патологическая форма белка, чрезмерно богатая глутамином, формирует отложения в ядрах или цитоплазме нейронов мозжечка и базальных ядер в виде плотных агрегатов. Этот процесс идет тем быстрее, чем сильнее количество CAG-повторов в ключевом гене отличается от нормы. Этим же объясняется механизм антиципации симптомов спиноцеребеллярной атаксии – в процессе мейоза при образовании половых клеток количество вышеуказанных тринуклеотидных последовательностей может увеличиваться, что приводит к усилению симптомов.
Так как подобное явление чаще имеет место при формировании мужских половых клеток, это становится причиной так называемой «отцовской передачи», когда антиципация регистрируется только при передаче заболевания от отца потомству. Многие врачи-генетики полагают, что основная причина спиноцеребеллярных атаксий лежит не в увеличении «гистидиновых» тринуклеотидов, а в делеции так называемых регулирующих триплетов, разделяющих участки CAG-повторов. Например, при первом типе заболевания это CAT, при втором CAA – они регулируют количество CAG-повторов и сохраняют стабильность их количества во время мейоза.
Симптомы спиноцеребеллярных атаксий
Чаще всего развитие спиноцеребеллярной атаксии начинается с появления простой неуклюжести в движениях, особенно при ходьбе, беге. В дальнейшем возникает тремор рук, нарушения походки, паралич глазодвигательных мышц (офтальмоплегия), изменяется почерк больного (становится крупнее, строки неровные). В конечном итоге заболевание приводит к выраженной мозжечковой атаксии, расстройствам пирамидальных и экстрапирамидальных путей, паркинсонизму. Некоторые формы патологии характеризуются выраженными нарушениями зрения – развитием атрофии зрительного нерва, пигментной дегенерации сетчатки и других процессов.
Выявление спиноцеребеллярной атаксии производится на основании данных неврологического осмотра, изучения наследственного анамнеза, магнитно-резонансной томографии головного мозга и молекулярно-генетических исследований. При осмотре больных на разных стадиях развития патологии определяются различные по выраженности неврологические нарушения – тремор конечностей, атаксия, изменения речи и голоса, на конечных этапах – дисфагия. Некоторые формы спиноцеребеллярной атаксии сопровождаются достаточно быстрым развитием нарушений зрения, приводящим к полной слепоте. Многолетнее наблюдение за такими больными подтверждает неуклонно прогрессирующее течение заболевания. При изучении наследственного анамнеза могут определяться характерные признаки спиноцеребеллярной атаксии – аутосомно-доминантное наследование, наличие антиципации при передаче болезни от отца.
На МРТ головного мозга при спиноцеребеллярной атаксии обнаруживаются очаги демиелинизации и нейродегенерации в области полушарий, червя мозжечка и базальных ядер. На терминальных стадиях развития заболевания может отмечаться полная атрофия мозжечка. Молекулярно-генетические исследования при спиноцеребеллярной атаксии сводятся к поиску патологически увеличенного количества CAG-повторов в генах, ассоциированных с этим заболеванием. В настоящее время большинство лабораторий мира осуществляет поиск этого дефекта в генах, наиболее часто приводящих к развитию патологии – ATXN1, ATXN2, ATXN3, ATXN7, ATXN8 и CACNA1A.
Лечение спиноцеребеллярной атаксии
Специфическое лечение патологии отсутствует, поддерживающая терапия способна несколько замедлить развитие спиноцеребеллярной атаксии, но единого мнения по поводу ее эффективности на сегодняшний момент нет. Применяют витаминотерапию (Е, А, группы В), ноотропные средства, стимуляторы обмена веществ (рибоксин) и метаболизма в нервной ткани. При развитии непроизвольных движений рекомендуют использовать клоназепам и галоперидол. Важную роль в сдерживании прогрессирования спиноцеребеллярной атаксии играет лечебная физкультура – регулярное выполнение правильно подобранного комплекса упражнений позволяет укрепить мышцы и снизить выраженность расстройств равновесия. С этой же целью рекомендуют проведение сеансов лечебного массажа, процедуры электромиостимуляции.
В долгосрочной перспективе прогноз любой формы спиноцеребеллярной атаксии неблагоприятный – это заболевание характеризуется выраженным прогрессирующим течением и со временем приводит сначала к инвалидизации, а затем к смерти больного. Однако в конкретном случае прогноз может быть и менее негативным – например, при развитии патологии в пожилом возрасте и своевременно начатом поддерживающем лечении большинство тяжелых симптомов попросту не успеет проявиться. Если спиноцеребеллярная атаксия возникла в молодом или детском возрасте, продолжительность жизни таких больных даже при интенсивном лечении и тщательном уходе будет резко снижена.
Профилактика осуществляется методом медико-генетического консультирования родителей, наследственный анамнез которых отягощен по этому состоянию, и генетической пренатальной диагностики. При этом необходимо учитывать аутосомно-доминантный характер наследования спиноцеребеллярной атаксии и такие особенности ее передачи, как антиципация.
IX Международная студенческая научная конференция Студенческий научный форум - 2017

Синдром Рубинштейна-Тейби – аутосомно-доминантное заболевание с сочетанием характерных симптомов: аномалий пальцев, отставания в физическом и психическом развитии, черепно-лицевых аномалий. Болезнь известна также в качестве «синдрома широких пальцев с лицевыми аномалиями». Первое описание заболевания относится к 1963 году, его авторство принадлежит Рубинштейну и Тейби. Ученые описали синдром, при котором наблюдались специфические особенности внешности, запоздание умственного развития и другие характерные симптомы. Анализ хромосом выявил делеции в гене CREB (расположен в полосе 16p13, кодирует цАМФ-зависимый транскрипционный фактор). Относительно недавно у больных с данным синдромом ученые обнаружили мутации в гене EP300, в полосе 22q13.
Механизмы развития и причины синдрома Рубинштейна-Тейби окончательно не установлены. На сегодняшний день есть предположение о генетической обусловленности патологии. На это указывают некоторые случаи семейного характера. Аномалии могли передаваться доминантным способом или рецессивным. Во всех исследованных случаях хромосомный набор (кариотип) был нормальным.
У части пациентов были обнаружены мутации в гене, который кодирует CREB-связывающий белок (СВР). Ученые выделили его 20 лет назад. CBP принимает участие в основных клеточных функциях (клеточном росте, репарации ДНК, дифференцировке, апоптозе, супрессии опухолей) и разных сигнальных путях. При молекулярном анализе мутации были выявлены у 56% пациентов с синдромом. Делеции в гене имеют около 10-12% больных, у некоторых обнаружены цитогенетические перестановки в области хромосомы 16p (именно она содержит данный ген). У 3% пациентов имеются мутации в EP300, что указывает на генетическую гетерогенность болезни.
Хромосомные микроделеции в диапазоне 50-650 кб становятся причиной полной или частичной блокировки синтеза белка CBP. Остальные гены в данной зоне не оказывают воздействия на определение фенотипа. Значительные хромосомные перестройки типа инверсий или транслокаций встречаются у небольшого процента больных (менее 1%) и обнаруживаются в зоне 16p13.
Базовые одиночные изменения (точечные мутации) в гене CBP составляют незначительную часть выявляемых мутаций. Большая их часть провоцирует усечение белка. Не фиксируются и фенотипические различия между больными с точечными мутациями и большими делециями. Этот факт согласуется с теорией об аутосомно-доминантном типе наследования и 50-процентным риском перехода дефектного гена от одного из родителей к ребенку.
В 1968 году появилась новая теория, в соответствии с которой синдром Рубинштейна-Тейби носит вторичный характер по отношению к патологии зародыша. Иными словами, это эмбриональная болезнь, но о моменте и причинах поражения эмбриона предположений пока нет. Синдром относится к очень редким патологиям: согласно статистике, его частота составляет не более одного случая на 25000.
В большинстве случаев заболевание обнаруживается почти непосредственно после рождения ребенка. Настораживающими являются такие характерные признаки, как широкий большой палец и крупный нос.
К основным признакам синдрома относятся:
аномалии развития пальцев;
отставание в психофизическом развитии.
Умственная отсталость отмечается в 100% случаев, задержка речевого и моторного развития, глубокая олигофрения – очень часто.
Подобные аномалии у пациентов включают в себя:
поздно закрывающийся большой передний родничок;
низкое расположение линии роста волос;
антимонголоидный разрез глаз;
дугообразные приподнятые брови;
широкую спинку носа;
гипоплазию крыльев носа;
клювовидный нос (с загнутым книзу кончиком);
гипоплазию верхней челюсти;
стрельчатое высокое небо;
гримасу наподобие улыбки;
косоглазие (отмечается в 79% случаев);
низкую посадку ушей, стертость складок (84%);
деформация ушных раковин, их увеличение или уменьшение;
аномалии рефракции (у 58% пациентов).
Синдром Рубинштейна-Тейби выражается в следующих характерных признаках:
расширение, уплощение, укорочение ногтевых фаланг больших пальцев рук и ног (встречается практически у всех пациентов);
аналогичные изменения терминальных фаланг остальных пальцев рук (наблюдаются у 60% больных);
вальгусная деформация межфаланговых суставов;
удвоение ногтевой фаланги больших пальцев ног (встречается в 30% случаев);
частичная синдактилия стоп и кистей;
удвоение проксимальной фаланги (меньше чем в 25%);
Изменения дерматоглифов (конфигурации кожных узоров) не являются характерными, но достаточно показательны. К ним относятся:
наличие множества извилин больших пальцев кистей и стоп;
патологическое изменение конфигурации возвышений больших и малых пальцев, а также первого межпальцевого пространства;
маленькая ладонная складка.
Наиболее частыми проявлениями патологии являются:
отставание костного созревания (примерно до 50% случаев);
аномалии грудины, ребер;
уплощенность крыльев костей таза;
К распространенным порокам развития внутренних органов относятся:
дефекты межжелудочковой перегородки сердца;
незаращение артериального протока;
дефект межпредсердной перегородки;
аномалии двустворчатого аортального клапана;
нарушение лобуляции легких;
агенезия или аплазия мозолистого тела (выявляется при пневмоэнцефалографии);
расширение или сужение мочеточника;
дивертикул мочевого пузыря;
Наблюдается отставание и в развитии веса, и в росте (гармоничный нанизм). Может проявляться с различной интенсивностью. Средний рост мужчин достигает примерно 153 см, женщин – 147 см.
Умственное и психологическое развитие
Отставание в интеллектуально-психологическом плане фиксируется во всех случаях, но различается по интенсивности. Умственный дефицит может варьироваться в пределах от 15 до 90% относительно нормы.
Наблюдается позднее речевое развитие.
Коэффициент интеллекта находится в пределах от 30 до 79. IQ более половины больных ниже 50.
Общительность и аффективность не изменены или изменены незначительно.
Аномалии на электроэнцефалограмме фиксируются в 30% случаев.
У отдельных пациентов было выявлено:
частичное или полное отсутствие каллезного тела;
отсутствие средних и больших пирамидальных клеток коры.
Все эти факторы указывают на определенную степень инактивности ЦНС.
Синдром Рубинштейна-Тейби выявляют посредством следующих диагностических исследований:
анализ гена СВР для выявления мутаций;
Рентген позволяет выявить расширение концевых фаланг пальцев, незначительное утолщение и сужение запястья и плюсны.
Лабораторные тесты не обнаруживают характерных биогуморальных изменений.
В силу широкой изменчивости заболевания комплекс лечебных мероприятий разрабатывается индивидуально с учетом симптоматики и общего состояния пациента.
Лечение синдрома Рубинштейна-Тейби в младенческом и раннем детском возрасте в дальнейшем дополняется специальными образовательными программами и физической терапией, носящей оздоравливающий и общеукрепляющий характер.
Что касается специфической терапии, на сегодняшний день ее нет. Очень часто появляется необходимость в проведении определенных хирургических вмешательств. Все они включены в «Федеральную программу предоставления бесплатной высокотехнологичной медицинской помощи».
Трудности при кормлении больных детей приводят к возникновению проблем с развитием.
В первые годы жизни основными причинами смерти становятся врожденные заболевания сердца и респираторные инфекции.
Ответ на вопрос, сколько живут пациенты с синдромом Рубинштейна-Тейби, неоднозначен. У большей части больных выживаемость достаточно хорошая.
1. Описаны характерные черты синдрома Рубинштейна – Тейби: синдром широкого I пальца конечностей и терминальных фаланг пальцев кистей и стоп; специфическое лицо в виде антимонголоидного разреза глаз и макростомии; умственная отсталость; отставание в росте.
2. Для подтверждения диагноза: синдрома Рубинштейна – Тейби требуется генетическое обследование. Учеными выявлена мутации в локусе 16p13.3 хромосомы.
3. Синдром был описан Рубинштейном и Тейби в 1963 году. Встречается в популяции 1 на 25-30 тысяч, с равной вероятностью среди мужчин и женщин. Аутосомно-доминантный тип наследования.
4. Данный клинический случай отражает самые частые заблуждения и ошибки при лечении пациентов с синдромом Рубинштейна – Тейби.
4.1. Учитывая тот факт, что механизмы биохимического осуществления синдрома Рубинштейна-Тейби в настоящее время не изучены, представляется неоправданной интенсивная терапия случайно выбранными ноотропами. Это может привести к усилению стереотипий и спровоцировать эпилептические припадки (симптоматическая эпилепсия встречается у 23% детей с синдромом Рубинштейна — Тейби).
2. «Наследственные синдромы и медико-генетическое консультирование», С. И. Козлов, Е. С. Еманова.
Читайте также:
