Синхронизированная с электрокардиограммой ОФЭКТ. Планарное изображение перфузии миокарда
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Радионуклидная диагностика (сцинтиграфия) это раздел лучевой диагностики, в котором для получения информации о строении и функции органа используется специальное вещество – радиофармпрепарат. Радиофармпрепарат в очень маленькой дозе, чаще всего это десятые доли миллилитра, вводится внутривенно в организм ребенка. Данное исследование позволяет получить уникальную информацию о функции органа, которую нельзя получить никаким другим способом.
Для проведения исследования применяется специальный аппарат – гамма-камера, которая имеет, так называемые, головки. Головки размещены на круглом основании – гентри гамма-камеры. Сама гамма-камера во время исследования не излучает никакой энергии и не шумит. В ее головки вмонтированы специальные приемники – детекторы, которые улавливают энергию от радиофармпрепарата. Специальное программное обеспечение преобразовывает эти импульсы в изображения.
Во время исследования ребенок лежит на столе гамма-камеры. Головки гамма-камеры могут располагаться под разными углами по отношению к ребенку (например, при нефросцинтиграфии они расположены сверху и снизу) или вращаться вокруг (при выполнении однофотонной эмиссионной компьютерной томографии, например, при сцинтиграфии миокарда). Само исследование, как и введение радиофармпрепарата, не сопровождается никакими субъективными ощущениями. Важно, чтобы ребенок сохранял неподвижность. Мы не используем наркоз для своих исследований. Самым маленьким пациентам исследования проводятся в состоянии сна.
ЭКГ — синхронизированная перфузионная ОФЭКТ миокарда в покое (перфузионная сцинтиграфия миокарда).
ЭКГ- синхронизированная перфузионная ОФЭКТ миокарда в покое малоинвазивный метод исследования, позволяющий оценить миокардиальную перфузию и сократимость в рамках одного исследования. Для проведения перфузионной сцинтиграфии миокарда мы применяем технециевый комплекс — 99mTc – метилизобутил изонитрила (99mТс – МИБИ). Данный препарат включается в миокард и печень, но из печени он быстро выводится, при этом уровень его захвата миокардом сохраняется неизменным в течение трех часов. Длительная фиксация препарата в миокарде связана с тем, что он включается в митохондрии кардиомиоцитов, пропорционально функциональной активности мышечной ткани. Оптимальные сцинтиграфические изображения получают через 60-90 минут после внутривенного введения препарата. Время записи томографического изображения на нашем аппарате составляет 33 минуты.
Показания к проведению перфузионной сцинтиграфии миокарда: кардиомиопатии различных фенотипов, некомпактный миокард, врожденные пороки сердца, воспалительные заболевания миокарда, состояния после оперативных вмешательств на сердце.
Диагностические возможности ЭКГ — синхронизированной перфузионной ОФЭКТ миокарда в покое: оценка перфузии миокарда на клеточном уровне, определение конечного систолического и диастолического объемов, определение фракции выброса левого желудочка, оценка подвижности сердечной стенки, выявление зон гипо-, акинеза и дискинеза, определение систоло-диастолического утолщения миокарда. Таким образом, данное исследование применяется для: оценки жизнеспособности миокарда, выявления признаков воспалительных изменений, определения характера и степени нарушения перфузии миокарда левого желудочка, выявление очагов фиброза, наблюдение в динамике для оценки эффективности терапии и определения прогноза заболевания.
Мы проводим исследование без наркоза, что накладывает ограничение по минимальному возрасту детей – целесообразно проводить данное исследование, начиная с пятилетнего возраста. В ряде случаев можно сделать исключение, тогда исследование выполняется в состоянии естественного сна.
Статическая нефросцинтиграфия
Статическая нефросцинтиграфия применяется для оценки размера, формы и расположения почек. В результате данного исследования оценивается количество функционирующей паренхимы как для обеих почек, так и для каждой отдельно. По равномерному или неравномерному включению радиофармпрепарата можно определить наличие очаговых изменений, которые могут быть связаны с рубцовыми изменениями почечной паренхимы. Проводится оценка жизнеспособности почки, наличия признаков ее функционирования. Показанием к проведению статической нефросцинтиграфии является: воспалительные заболевания почек, повреждение почек при нарушении уродинамики (пузырно-мочеточниковый рефлюкс и связанная с ним нефропатия), хронические инфекции мочевыделительной системы, аномалии развития мочевыделительной системы (гипоплазия почки, подковообразная почка, дистопированная почка и др.).
Для проведения исследования внутривенно вводится радиофармпрепарат 99мТс ДМСА (2,3-димеркаптоянтарная кислота). Особенностью этого препарата является его длительная фиксация в функционирующей почечной ткани. Исследование проводится через два-три часа после внутривенной инъекции радиофармпрепарата. Это время необходимо, чтобы препарат накопился в ткани почек. Длительность самого исследования составляет 20 минут. В результате мы получаем изображение почек в трех проекциях.
Мы проводим исследование без наркоза. Самым маленьким пациентам исследование выполняется в состоянии естественного сна.
Динамическая гепатобилисцинтиграфия
(динамическая сцинтиграфия печени с определением функции желчевыводящих путей)
Гепатобилисцинтиграфия проводится натощак, с пробным желчегонным завтраком на 30-й минуте (сливки 20%, для грудных детей — сцеженное молоко или смесь). Исследование начинается сразу в момент введения радиофармпрепарата (в количестве менее одного миллилитра). Внутривенно вводится радиофармпрепарат, который захватывается клетками печени и показывает функцию желчевыведения. Само исследование длится 60 минут. Такая продолжительность необходима для оценки функции печени и желчных проток. В случаях с нарушением оттока желчи может потребоваться дополнительный досмотр без повторного введения радиофармпрепарата.
Показаниями к проведению гепатобилисцинтиграфии являются: диффузные заболевания печени (гепатит, цирроз), состояния после трансплантации, заболевания желчного пузыря и желчевыводящих путей, нарушение транспорта желчи, склерозирующий холангит, желтухи, пороки развития печени, желчного пузыря, атрезия желчевыводящих путей.
В результате данного малоинвазивного исследования получаем уникальную информацию о проходимости желчных протоков, функционировании ткани печени, сократимости желчного пузыря, нарушении в работе сфинктеров.
Если у Вас возникли вопросы, Вы можете позвонить в наше отделение, и мы с радость на них ответим. Телефон: 8 (499) 132-34-29 с 10 до 15 часов.
Синхронизированная с электрокардиограммой ОФЭКТ. Планарное изображение перфузии миокарда
Синхронизированная с ЭКГ ОФЭКТ стала клиническим методом, используемым для оценки функции желудочков. При нормальной регионарной систолической функции усиливается яркость отображения стенок во время систолы. Происходит утолщение стенок и очевидное движение эндокардиальной поверхности. Оценка регионарной функции ЛЖ при синхронизированной с ЭКГ ОФЭКТ основана на феномене, известном как частично объемный эффект, иногда называемым эффектом коэффициента восприятия.
Когда визуализируемый объект по объему меньше определенного порогового объема, количество регистрируемых импульсов (или фотонов), исходящих от него, зависит не только от концентрации РФП в самом объекте, но и от его размеров. При ОФЭКТ обычно все миокардиальные стенки по толщине выходят за эти пределы в связи с тем что концентрация РФП в миокарде остается постоянной во время получения синхронизированной с ЭКГ ОФЭКТ, количество импульсов (а вследствие этого и яркость объекта визуализации) зависит от размера (толщины) миокарда.
Следовательно, во время систолического укорочения ЛЖ кажется ярче и больше по объему, даже если концентрация изотопа в I г миокарди-альной ткани реально не изменяется. Этот принцип лежит в основе синхронизированной с ЭКГ ОФЭКТ.
Регионарную миокардиальную функцию обычно оценивают визуально, подобно тому, как это происходит при ЭхоКГ. Области с неизмененной яркостью имеют нормальную систолическую функцию, а те, яркость которых снижена, рассматривают как гипокинетичные. Очень бледные зоны определяют как гииокинетичные, а совсем темные — как акинетичные. Регионарную функцию можно также оценивать количествен но и представлять в виде диаграмм.
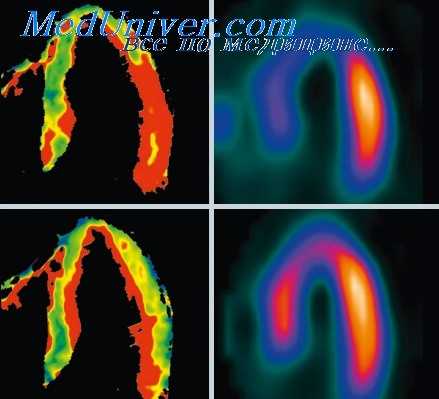
Планарное изображение перфузии миокарда
До широкого распространения томографических методов визуализации перфузии (например, ОФЭКТ) стандартным считали планарное исследование. При пленарной визуализации после введения РФП и его фиксации в миокарде с помощью гамма-камеры получают три отдельных двухмерных изображения. Стандартными проекциями являются передняя, левая передняя косая и боковая. При пленарном исследовании проекции стандартные, поэтому врач, выполняющий процедуру, должен использовать дополнительные проекции для оценки регионарных нарушений. Напротив, вследствие того, что при ОФЭКТ срезы реконструируются перпендикулярно и параллельно определенной продольной оси, на ОФЭКТ-изображения не влияют индивидуальные особенности расположения сердца, и они более ориентированы на отображение и интерпретацию.
Преимуществом планарной визуализации перед ОФЭКТ является простота. Каждая из трех проекций может быть получена за 5-8 мин, причем пациент лежит на столе с руками, вытянутыми вдоль тела. Планарная визуализация менее зависима от движений пациента по сравнению с ОФЭКТ. Обработка планарных исследований не столь сложна и трудоемка, как при ОФЭКТ, при которой существует много причин для потенциальных ошибок и артефактов. Однако изначальная двухмерная природа планарных изображений ведет к тому, что в каждой из стандартных проекций присутствует существенное перекрывание зон миокарда и меньшая возможность определения небольших и не очень выраженных дефектов перфузии. Более стандартная ориентация при ОФЭКТ обеспечивает легкость в определении локализации нарушений перфузии.
Изначально данные о чувствительности и специфичности визуализации при ИБС, как и прогностическая ценность, рассчитывались по результатам планарных исследований, а затем были перепроверены данными ОФЭКТ. В современной практике планарная визуализация может быть использована у пациентов, которые не могут выдержать длительного статического положения, необходимого для ОФЭКТ, и у тех, кто испытывает неудобства при нахождении громоздкого детектора гамма-камеры в непосредственной близости от тела, а также у пациентов, размеры и масса тела которых превышают возможности ОФЭКТ-систем.
Методы количественного анализа, например круговой профиль, изначально были созданы для планарных исследований. Многие литературные источники свидетельствуют о повышении чувствительности количественной обработки планарных исследований при диагностике ИБС с многососудистым поражением.
- Вернуться в оглавление раздела "Кардиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Перикард и перикардиальный выпот на рентгенограмме. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) сердца
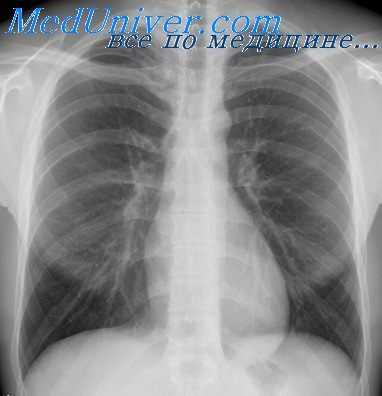
Плевра и перикард также требуют системного изучения. Перикард редко удается различить на обзорных снимках грудной клетки, но его можно увидеть в двух случаях: при выпоте и констрикции. При значительном перикардиальном выпоте париетальный и висцеральный листки перикарда расходятся. Поскольку каждый из листков связан с жировой подушкой, иногда на боковом снимке можно различить две параллельные линии просветления, расположенные обычно в области верхушки сердца, с затемнением (жидкостью) между ними.
Тем не менее ЭхоКГ, МРС и КТ значительно более эффективны при определении перикардиального выпота. Если на рентгенограмме грудной клетки отмечается увеличение тени сердца, необходимо проведение исследования специальными методами. Несмотря на то что сердечная дилатация и болезни клапанов — наиболее частые причины, нужно обращать серьезное внимание на неожиданное появление выпота. Классически при наличии выпота в перикарде сердце имеет форму грелки, но сама но себе форма не является диагнозом.
Рентгенограмма грудной клетки дает много ценной анатомической и физиологической информации, поэтому играет центральную роль в обследовании и лечении пациентов с ССЗ и другими заболеваниями. Портативные рентгенограммы грудной клетки нужно выполнять как можно реже, т.к. информация на них ограничена и даже может запутать врача (например, при определении кардиомегалии или исключении пневмоторакса или выпота).
Нo стандартные прямые и боковые снимки грудной клетки с расстояния 1,82 м практически всегда полезны. Если их изучать тщательно, используя систематический подход и сравнивая с предыдущими рентгенограммами (когда это возможно), они твердо сохраняют свою значимость даже с применением традиционных технологий.
Эра неинвазивной радионуклидной визуализации сердца человека началась в 70-х годах XX в., когда появились первые работы по неинвазивному изучению миокардиального кровотока у пациента в состоянии покоя. С того времени технические возможности получения изображения при исследовании физиологии и патофизиологии сердца, включая визуализацию миокардиального кровотока, метаболизма и функции желудочков, выросли. Клиницисты научились использовать полученную информацию для принятия правильных клинических решений и ведения больных.
Однофотонная эмиссионная компьютерная томография миокардиальной перфузии — одна из наиболее часто назначаемых процедур для получения изображений в ядерной кардиологии. После введения выбранного радиофармпрепарата (английский термин «radiotracer» в русской транскрипции как «радиотрейсер» не используют. Его эквивалентами служат: «радиофармпрепарат» (РФП) — биологически активные соединения разных классов; «радиоактивный препарат» (PAП) — изотопы или их соединения, которые вводят в организм (in vivo) или в биологические среды (in vitro)) изотоп извлекается из крови жизнеспособными кардиомиоцитами и задерживается в них на некоторое время.
Миокард излучает фотоны пропорционально количеству поглощенного РФП, которое, в свою очередь, зависит от величины перфузии. Используемая в ядерной кардиологии стандартная камера (гамма-камера) захватывает фотоны гамма-лучей и преобразует эту информацию в цифровом режиме в величину поглощения и точку эмиссии. На траектории своего полета излучаемые фотоны сталкиваются с кристаллом детектора. Здесь фотоны гамма-лучей абсорбируются и вызывают видимые световые явления (сцинтилляции). Гамма-лучи, селективно прошедшие сквозь коллиматор, прикрепленный к передней части детекторной системы камеры, подвергаются захвату и количественной оценке. В большинстве случаев используют коллиматоры с параллельными отверстиями, поэтому захватываются только фотоны, направленные перпендикулярно головке камеры и параллельные коллимационным отверстиям. Это позволяет с большей точностью локализовать точку эмитированных гамма-лучей.
Фотоэлектронные умножители (последний основной компонент гамма-камеры) чувствительны к явлению мерцания и преобразуют его в электрические сигналы, которые впоследствии обрабатываются. Результатом ОФЭКТ является создание множественных томограмм, или срезов, исследуемого органа, которые представляют собой цифровое отображение распределения РФП по всему органу. При визуализации миокардиальной перфузии (ВМП) с помощью ОФЭКТ отображается распределение перфузии в миокарде.
Для создания трехмерной модели сердца необходимы данные миокардиальной перфузии, собранные под многочисленными углами со 180° или 360° проекции вокруг пациента. Собираются множественные изображения, каждое из которых содержит от 20 до 25 сек эмиссионных данных. Изображение каждой проекции представляет собой двухмерный кадр миокардиальной перфузии, снятый под определенным углом. Затем все данные визуализации методом образной проекции передаются на матрицу, что позволяет реконструировать обследуемый орган. Читатель может более подробно ознакомиться с техническими аспектами ОФЭКТ и реконструкцией изображений в детальных обзорах.
Легочный захват таллия-201Tl. Транзиторная ишемическая дилатация левого желудочка (ТИД)
Существуют и могут быть выявлены другие нарушения (не только перфузии миокарда), которые дают дополнительную информацию. К ним относятся легочный захват РФП (особенно 201Тl) и транзиторная ишемическая дилатация (ТИД) ЛЖ.
У некоторых пациентов после нагрузки обнаруживают существенное накопление РФП по всем легочным полям, которое отсутствовало в покое. Пациенты с таким легочным захватом чаще всего имеют тяжелое многососудистое поражение, подъем давления заклинивания легочных капилляров и снижение фракции выброса при нагрузочной пробе, что предполагает наличие выраженной ишемии миокарда.
Вполне возможно, что повышение давления в левом предсердии и ЛА замедляет легочный транзит РФП и обеспечивает достаточное дополнительное время для его экстракции или транссудации в интерстициалыюе пространство легких, обеспечивая формирование такого признака.
Легочный захват 201Tl исследован более подробно по сравнению с захватом меченных 201Tl sestamibi и tetrofosmin. Обычно фоновое или накопление в мягких тканях после инъекции таллия при нагрузке невелико, что позволяет собрать информацию в более ранние сроки. Кроме того, свойства перераспределения галлия требуют начинать сбор данных как можно раньше после нагрузки, т.к. легочный захват может быть более выраженным.
При использовании перфузионных радиофармпрепаратов, меченных 99Tc печеночный захват более выражен, по сравнению с сердечным, непосредственно после введения препарата, поэтому сбор данных целесообразно начинать через 15-30 мин после физической нагрузки и через 30-60 мин после фармакологической нагрузки. Таким образом, легочный захват, даже если он произошел сразу после нагрузки, может быть пропущен при использовании меченных 99mTc РФП из-за более отсроченного начала процедуры визуализации по сравнению с таллием.
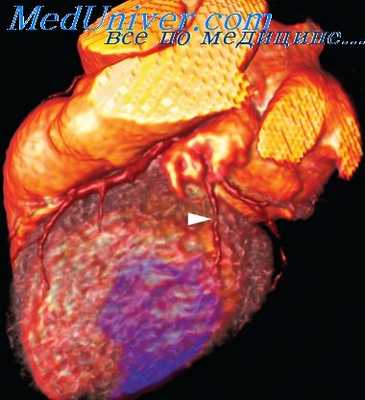
Транзиторная ишемическая дилатация левого желудочка
ТИД—визуальный признак, который отражает видимое расширение полостей ЛП или ЛЖ при нагрузке по сравнению с покоем. Патофизиология изменений у пациентов с общим увеличением ЛЖ при нагрузке, вероятно, связана С большими зонами ишемии и длительной постишемической диастолической дисфункцией, что в результате приводит к дилатации и дисфункции ЛЖ во время нагрузки по сравнению с покоем.
У некоторых пациентов эпикардиальные контуры ЛЖ выглядят одинаковыми и при нагрузке, и в покое, но наблюдается расширение его полости. Возможно, проявляется диффузная субэндокардиальная ишемия (относительно сниженный захват в субэндокарде создает впечатление увеличенной полости ЛЖ), которая ассоциируется с более выраженной и распространенной ИБС. Современные системы обработки определяют ТИД автоматически.
Как легочный захват, так и ТИД информируют о более выраженной ИБС, чем определяют только по одним перфузионным данным. Оба этих признака ассоциируются с ангиографически более распространенной и тяжелой ИБС с неблагоприятным долгосрочным прогнозом, поэтому относятся к факторам высокого риска.
Однофотонная эмиссионная компьютерная томография миокарда является радионуклидным методом исследования, предназначенным для оценки кровоснабжения миокарда на уровне микроциркуляции. Метод основан на оценке распределения в сердечной мышце внутривенно введенного РФП, который включается в неповрежденные кардиомиоциты пропорционально коронарному кровотоку. Области миокарда с нормальным кровоснабжением создают картину равномерного распределения РФП, а участки миокарда с относительным или абсолютным снижением кровотока вследствие ишемии или рубцового повреждения имеют снижение включения РФП за счет дефектов перфузии.
Распределение РФП в миокарде зависит как от самой перфузии, так и от целостности сарколеммы и сохранности клеточного метаболизма (жизнеспособности). Благодаря сходству распределения в миокарде калия и используемых РФП, имеется возможность комбинированной оценки раннего и отсроченного включения РФП. Ранний паттерн распределения пропорционален потоку крови, в то время как последний паттерн распределения указывает на ткань с неповрежденным внутри-экстраклеточным градиентом, что позволяет дифференцировать жизнеспособный и нежизнеспособный (рубец, некроз) миокард.
Среди РФП, меченных99mTc, наибольшее распространение получил МИБИ, известный в зарубежной литературе, как Сестамиби, который подобно калию, поступает в кардиомиоциты посредством K-Na-АТФ-насоса. Жизнеспособность миокарда определяется по увеличению накопления изотопа как на отсроченных изображениях, так и при повторном его введении. Для участков жизнеспособного миокарда характерны, так называемые, полустабильные дефекты перфузии. Они характеризуются возвращением изображения миокарда к норме на поздних отсроченных сцинтиграммах и после реинъекции РФП в покое. Если область гипоперфузии сохраняется, то эта зона, соответствует нежизнеспособным участкам миокарда. В ряде работ показана высокая информативность в оценке наличия жизнеспособного миокарда перфузионной сцинтиграфии в сочетании с фармакологической пробой с добутамином.
Наиболее часто для верификации жизнеспособного миокарда применяется введение синтетического бета-1-адреностимулятора добутамина, который в малых дозах (5-10 мкг/кг/мин) способен повышать сократимость жизнеспособного миокарда без существенного повышения частоты сердечных сокращений. Однофотонная эмиссионная компьютерная томография миокарда выполненная с добутаминовым тестом оценивает степень жизнеспособности миокарда, чувствительность метода сцинтиграфии (от 89% до 100%).
На рисунке 1-3 представлены сцинтиграфические исследования миокарда больного 58 лет находившегося на стационарном лечении в РНПЦ «Кардиология» с диагнозом ХСН, атеросклероз сосудов сердца. Была выполнена ОФЭКТ миокарда по однодневному протоколу с нагрузочным фармакологическим тестом с добутамином, затем через 3 часа ОФЭКТ миокарда в покое (рис.1-2). При анализе полученной информации полученной после введения добутаминаопределяется, неравномерное накопление РФП по миокарду левого желудочка с различной степенью процентного соотношения в сегментах сердечной мышцы. Перфузия медиально-базального отдела задней, латеральной стенки и межжелудочковой перегородки миокарда левого желудочка имеет признаки выраженной ишемии 20 % миокарда всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 49 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 46,5% и LeftanteriorDescending 0.1%
Рис.1 ОФЭКТ миокарда больного 58 лет с фармакологической пробой с добутамином
При повторном исследовании через 3 часа в покое наблюдается увеличение процентного показателя зон гипоперфузии в миокарде левого желудочка. 34.5 % миокарда всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 81,7 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 51% и LeftanteriorDescending 10,9%.
Рис. 2 ОФЭКТ миокарда больного 58 лет с ХСН в покое.
В последствии выполнена операция АКШ, через 6 месяцев выполнена ОФЭКТ миокарда (Рис.3) в покое нет заметно выраженного повышения процентного показателя зон гипоперфузии в миокарде левого желудочка. Общий составил 22.7 % миокарда от всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 58,1 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 26,6% и LeftanteriorDescending 3,4%.
Рис. 3 ОФЭКТ миокарда больного 58 лет после АКШ
Примененная нами проба в диагностических целях с фармакологическим препаратом добутамином (дипиридамолом) при ОФЭКТ позволяет выявлять участки жизнеспособного миокарда.
РАДИОНУКЛИДНАЯ ДИАГНОСТИКА В ИССЛЕДОВАНИИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИОКАРДА
Благодаря развитию новых высокоинформативных компьютерных технологий на сегодняшний день в кардиологии широко используются современные неинвазивные радионуклидные методы исследования. Развитию и совершенствованию радионуклидных методов исследования сердечно-сосудистой системы способствовала как разработка радиофармацевтических препаратов (РФП), обладающих специфической тропностью к здоровому или ишемизированному миокарду, так и устройств, представляющих информацию о прохождении индикатора не только в графической, но и в визуальной форме. Основным прибором в радионуклидной диагностике является созданная в 1963 году H. Anger гамма – камера.
Прогрессирующее развитие ядерной кардиологии обусловлено созданием гамма-томографов с высокой скоростью счета, привлечением компьютерной техники для сбора и обработки информации. В кардиологии радионуклидные методы исследования направлены на изучение:
- состояния внутрисердечной гемодинамики, аорты, крупных сосудов с оценкой характера тока крови в них;
- перфузии миокарда с оценкой ее локальных нарушений;
- сократительной функции миокарда;
- определения регионарной метаболической активности миокарда.
Из радионуклидных методов для оценки функционального состояния миокарда в настоящее время в мировой практике наиболее широко применяются радионуклидная томовентрикулография (РТВГ), перфузионная однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ).
Однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ).
Особое место среди методов ядерной медицины занимает перфузионная однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ), позволяющая получать уникальную информацию о кровоснабжении миокарда на уровне микроциркуляции и применяется в мировой практике уже на протяжении более 20 лет.
ОФЭКТ миокарда – радионуклидный метод исследования, основанный на оценке распределения в миокарде внутривенно введенного РФП, которое происходит пропорционально коронарному кровотоку. ОФЭКТ миокарда предназначен для выявления областей относительного или абсолютного снижения кровотока, возникающего вследствие ишемии или рубцового повреждения миокарда. Для визуализации перфузии миокарда применяют РФП, которые экстрагируются и удерживаются миокардом в течение различных временных интервалов.
В настоящее время используют следующие РФП: таллия хлорид (201Tl), 99мTc-MIBI (2,4,метоксиизобутилизонитрил, «Технетрил» российского производства, “Cardiolite” США) и 99мTc-TF (тетрофосмин), 99мTc-ТЕБО («тебораксим»).
Применение 201Tl основано на его биологическом сходстве с калием, после внутривенного введения он быстро покидает кровеносное русло и поступает в клетки в количествах, пропорциональных исходной величине кровотока. Около 4% введенной дозы на некоторое время проникает в миокард, и благодаря этому сердце хорошо видно на фоне низкой фоновой активности легких. 99мTc-MIBI интенсивно концентрируется в симпатических нервных рецепторах и так как миокард хорошо иннервируется симпатическими волокнами, снижение включения в них 99мTc-MIBI - является показателем дисфункции миокарда.
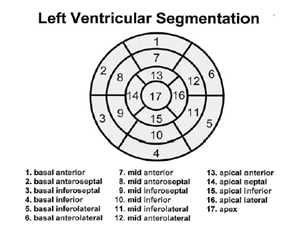
Локальные нарушения перфузии миокарда при проведении однофотонной эмиссионной компьютерной томографии оцениваются по проценту накопления РФП в сегментах миокарда или по 4-х бальной шкале 13–20-ти сегментарной модели ЛЖ: при этом ЛЖ делится на 13 – 20 сегментов по четырем стенкам: передняя, боковая, нижняя и перегородка, и 3 областям: верхушка, средняя треть и основание (рис.1.).
Рис. 1. Перфузионная 17-ти сегментарная карта.
При анализе нарушений локальной сократимости 0 баллов оценивается как нормальная аккумуляция РФП, 1 балл – немного сниженная аккумуляция РФП с захватом более 75% от максимального включения в миокард, 2 балла – от 50 до 75% включения изотопа, 3 балла – значительно выраженные дефекты перфузии менее 50%, 4 балла – от 0 до 25% включения изотопа (рубцовые зоны).
Перфузионнуюсцинтиграфию миокарда выполняют в покое и в сочетании с различными нагрузочными пробами, проведение которых необходимо для выявления бассейна артерии, которая не в состоянии обеспечить адекватное увеличение коронарного кровотока в ответ на увеличение работы сердца.
Показания к применению перфузионной ОФЭКТ миокарда.
Поскольку распределение РФП в миокарде происходит пропорционально коронарному кровотоку и включение его в неповрежденные кардиомиоциты, является отражением нормального кровотока миокарда и при этом будет равномерное изображение распределения РФП в ЛЖ. Отражением ограничения кровотока и ишемического или рубцового повреждения сердечной мышцы будет снижение распределения РФП в той или иной области миокарда, дефект перфузии.
Таким образом, перфузионнаясцинтиграфия миокарда позволяет определить наличие, локализацию, распространенность и тяжесть рубцового или ишемического повреждения миокарда, функциональную значимость анатомического поражения коронарных артерий, выявленного при ангиографии, оценить жизнеспособность миокарда.
С помощью перфузионной сцинтиграфии миокарда возможны:
- диагностика атеросклеротического поражения коронарных артерий (наличие, локализацию, распространенность);
- оценка степени стеноза коронарных артерии и его влияния на регионарную перфузию миокарда;
- оценка жизнеспособности миокарда (ишемические или рубцовые изменения, предсказание об улучшении функции после реваскуляризации);
- оценка (прогноз) степени риска у пациентов: после инфаркта миокарда, для предоперационной оценки степени риска перед большими хирургическими вмешательствами у больных с высоким риском развития коронарных осложнений;
- контроль и оценка эффективности лечения после: коронарной реваскуляризации; медикаментозной терапии сердечной недостаточности или стенокардии, проведения мероприятий по изменению образа жизни.
Нагрузочные пробы, наиболее часто применяемые в сочетании сперфузионной ОФЭКТ миокарда.
Применение нагрузочных проб значительно повышает чувствительность, специфичность и точность диагностики ИБС. В качестве нагрузочных проб применяют пробу с физической нагрузкой, а также фармакологические пробы. У больных со сниженным коронарным кровотоком вследствие нарушения реактивности сосудов или стенозирующего повреждения определяется область сниженной концентрации РФП в зоне сниженной перфузии. Если зона сниженной концентрации РФП появляется или увеличивается при введении его во время физической нагрузки или после введения положительных инохронотропных адренергических препаратов (по сравнению с покоем), то вероятной причиной является ишемия. Если зона сниженной концентрации РФП не меняется ни при нагрузке, ни в покое, наиболее вероятной причиной этого следует считать рубцовое повреждение миокарда.
Перфузионнаясцинтиграфия миокарда в сочетании с пробой с физической нагрузкой (ПФН).
ПФН обычно выполняют на велоэргометре либо на бегущей дорожке (тредмил). Больным с предполагаемой высокой толерантностью к физической нагрузке заранее подбирают начальную ее мощность с тем, чтобы общее время проведения физической нагрузки не превышало 12-15 мин. Во время проведения исследования регистрируют ЭКГ и АД. При достижении критериев прекращения пробы внутривенно вводят РФП, после чего больной продолжает выполнять физическую нагрузку еще в течении 2 мин. для достижения ишемического равновесного состояния, так называемого ischemicsteadystate. При возникновении приступа стенокардии, не купируемого в покое, по возможности вводят РФП до приема нитроглицерина и других антиангинальных препаратов для исключения маскирующего ишемию эффекта. При выполнении ПФН в отсутствии появления достоверных критериев положительной пробы, важным является достижение ЧСС не менее 120-135 уд/мин.
Перфузионнаясцинтиграфия миокардав сочетании с фармакологическими пробами.
При проведении фармакологических проб применяют следующие препараты:
а) препараты, вызывающие вазодилатацию и приводящие к коронарной гиперемии (дипиридамол и аденозин);
б) положительные ино-хронотропные адренергические препараты (добутамин и арбутамин) с целью увеличения потребности миокарда в кислороде.Сосудорасширяющий эффект дипиридамола при проведении фармакологической пробы связан с повышением содержания внеклеточного аденозина и простациклина, в результате чего уменьшаются тонус мелких миокардиальных артерий и артериол и коронарное сосудистое сопротивление, пик которого наступает через 2-5 мин. после внутривенного введения дипиридамола.
Дипиридамол вводят внутривенно медленно в дозе 0,56 мг/кг в течение 4 мин. в положении больного лежа на спине. РФП вводят внутривенно до достижения критериев прекращения пробы. При отсутствии показаний к немедленному купированию эффекта дипиридамола, эуфилин вводится не ранее чем, через 5 мин после введения РФП. Следует учитывать, что побочные эффекты могут возникать в течение 30 мин. после введения дипиридамола.
Пробы с дипиридамолом или аденозином не следует проводить больным с указаниями в анамнезе на бронхоспазм, заболевания легких (бронхиальная астма и легочная гипертензия), интубацию по поводу тяжелой легочной патологии, выраженную гипотонию (систолическое АД менее 90 ммртст), тяжелый клапанный порок сердца и повышенную чувствительность к аденозину и дипиридамолу, а также не следует проводить больным постоянно принимающих метилксантины по поводу бронхообструктивногосндрома, больным с ативентрикулярной блокадой II-III степени или синдромом слабости синусового узла, с ОИМ давностью не более 2-х сут, нестабильной стенокардией с последним приступом, возникшим не более чем за 48 часов до начала исследования.
При использовании препаратов, увеличивающих потребность миокарда в кислороде в качестве нагрузочного теста в клинической практике отдают предпочтение добутамину, синтетическому катехоламину с выраженным действием на β1-рецепторы и слабым влиянием на α- и β2-адренорецепторы. При применении малых доз добутамина (до 10 мг/кг/мин) отмечается отчетливое положительное инотропное действие, обусловленное стимуляцией ?1- и ?-рецепторов. При применении высоких доз (20-40 мг/кг/мин) прогрессивно увеличивается ЧСС за счет стимуляции β1- адренорецепторов. При этом системное АД повышается незначительно за счет увеличения сердечного выброса, а периферическое сопротивление уменьшается. В областях миокарда, снабжаемых кровью артерий с критическим стенозом, вследствие неадекватного притока крови в условиях повышенной потребности миокарда в кислороде, возникает регионарная ишемия, выявляемая при сцинтиграфии. При этом с целью оценки жизнеспособности миокарда добутамин применяют в малых дозах (до 20 мг/кг/мин), а ишемии миокарда – в больших дозах (до 40 мг/кг/мин).
Пробы с инохронотропными препаратами не следует проводить больным с желудочковыми тахиаритмиями, в ранний период ИМ, нестабильной стенокардией, обструктивной гипертрофической кардиомиопатией.
Перфузионнаясцинтиграфия миокардав сочетании с черезпищеводной электрической стимуляцией предсердий (ЧПЭС).
ЧПЭС является безопасной альтернативой ПФН. ЧПЭС проводят в положении больного лежа на спине до достижения ЧСС 160 уд/мин или до появления критериев прекращения стимуляции, после чего в/в вводят РФП. При отсутствии клинической и ЭКГ – критериев ишемии миокарда продолжительность ЧПЭС на последней ступени составляет около 2 мин. После прекращения стимуляции ЧСС практически немедленно возвращается к исходной и признаки ишемии миокарда уменьшаются или исчезают быстро. Поэтому при проведении ЧПЭС в сочетании с перфузионной ОФЭКТ миокарда стимуляцию после введения РФП продолжают не менее 3 мин.
К ограничению пробы относят побочные эффекты виде жжения или болезненной пульсации в подложечной области, или в нижней трети грудины, противопоказана больным с заболеваниями пищевода.
Меры предосторожности при проведении перфузионнойсцинтиграфия миокарда в сочетании с фармакологическими пробами.
Нагрузочные пробы выполняют в радионуклидных отделениях, оснащенных набором инструментом и препаратов для проведения реанимационных мероприятий, исследования должны; проводится в присутствии врача, прошедшее специальное обучение реанимационным мероприятиям. Необходимо постоянное наблюдение за показателями гемодинамики (АД и ЧСС), регистрация ЭКГ в 12 отведениях.
Применение ОФЭКТ миокарда
Чувствительность метода ОЭКТ с 99мTc-MIBI и 201Tl для диагностики ИБС с использованием нагрузочных проб составляет более 90%. Этот метод может быть использован не только для диагностики ишемии миокарда, но и для определения функциональной значимости стеноза коронарных артерий или коллатерального кровотока, обнаруженных при ангиографии. Другое важное применение данного исследования – это оценка прогноза больных с острым инфарктом миокарда, поскольку этот метод позволяет выявить не только степень нарушения перфузии, но и распространенность рубцевания в связи с предыдущими инфарктами миокарда. Особенно информативна ОЭКТ с 99мTc-MIBI и 201Tl при ведении больных, получающих сердечные гликозиды, с блокадой ножек пучка Гиса, т.е. в тех случаях стандартной пробе с нагрузкой не удается провести анализ сегмента ST.
Доказана возможность ОФЭКТ с 99мTc-МИБИ прогнозировать отдаленные исходы заболевания у больных, перенесших острый инфаркт миокарда, так называемую стратификацию риска возникновения коронарного синдрома.
Использование ОФЭКТ с 99мTc-МИБИ с добутаминовым тестом в диагностике постинфарктной аневризмы ЛЖ выявляет не только наличие аневризмы, но и жизнеспособного миокарда в «переходной» ишемизированной зоне.
Доказана информативность сцинтиграфии миокарда с 99мTc-MIBI или 201Tl и эхокардиографии, выполненных в сочетании с введением низких доз допамина, для выявления жизнеспособного миокарда в областях постинфарктного кардиосклероза и прогнозирования восстановления их сократимости после реваскуляризации. Чувствительность выявления жизнеспособности миокарда в областях акинезии методами эхокардиографии и ОФЭКТ с 99мTc-MIBI, выполненных в покое и в сочетании с допаминовой пробой составляет 85% и 92% соответственно. Следовательно, перфузионная ОФЭКТ является не только высокоинформативным методом определения степени и распространенности нарушения кровообращения в миокарде, но и позволяет определять жизнеспособность диссинергичного (гибернирующего) миокарда.
Читайте также:
- Неходжкинская лимфома лимфатических узлов шеи - лучевая диагностика
- Симптом Голдена на рентгенограмме органов грудной клетки
- Спиральный орган. Строение спирального органа. Гистофизиология слуха.
- Митохондрии. Строение и функции митохондрий клетки.
- Признаки перелома диафизов большеберцовой и малоберцовой костей
