Синтез фосфолипидов в клетке - цикл Кеннеди
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
В гл. 10 мы представили два главных класса мембранных фосфолипидов: глицерофосфолипиды и сфинголипиды. Можно сконструировать множество различных молекул фосфолипидов, комбинируя разные жирные кислоты и полярные головные группы (полярные «головки») с глицериновой или сфингозиновой основой (см. рис. 10-9, 10-13). Все пути биосинтеза следуют нескольким основным шаблонам. В целом, сборка фосфолипидов из основных предшественников требует (1) синтеза основополагающей (скелетной) молекулы (глицерин или сфингозин); (2) присоединения жирной кислоты (кислот) к скелету через сложноэфирную или амидную связь; (3) присоединения к скелету гидрофильной «головки» фосфодиэфирной связью; и, наконец, в некоторых случаях (4) изменения или замены полярной «головки» с образованием конечного продукта — фосфолипида.
В клетках эукариот синтез фосфолипидов происходит прежде всего на поверхности гладкого эндоплазматического ретикулума и на внутренней мембране митохондрий. Часть вновь синтезированных фосфолипидов остается в месте синтеза, но большинство предназначено для других отделов клетки. Процесс, при котором нерастворимые в воде фосфолипиды передвигаются от места синтеза к месту их последующего функционирования, не вполне понятен, но мы завершим этот раздел обсуждением некоторых механизмов, выясненных в последние годы.
Клетки используют две стратегии присоединения полярных «головок» фосфолипидов
Первые стадии синтеза глицерофосфолипи- дов те же, что при синтезе триацилглицеринов (рис. 21-17): два остатка жирной кислоты образуют сложноэфирные связи при атомах С-1 и С-2 L-глицерин-3-фосфата, давая фосфатидную кислоту. Обычно считают, что при С-1 — насыщенная жирная кислота, а при С-2 — ненасыщенная. Второй путь, приводящий к фосфатидной кислоте, — фосфорилирование диацилглицеринов специфической киназой.
Полярная «головка» глицерофосфолипидов присоединяется фосфодиэфирной связью, при образовании которой каждый из двух спиртовых гидроксилов (один на полярной «головке», а другой на С-3 глицерина) образует сложный эфир с фосфорной кислотой (рис. 21-23). Сначала один из гидроксилов активируется присоединением нуклеотидцитидиндифосфата (CDP). Затем при нуклеофильной атаке другим гидроксилом цити- динмонофосфат (СМР) замещается (рис. 21-24). CDP присоединяется либо к диацилглицерину, образуя активированную фосфатидную кислоту и CDP-диацилглицерин (стратегия 1), либо к гидроксилу «головки» (стратегия 2). Клетки эукариот используют обе стратегии, в то время как прокариоты используют только стратегию 1. Ведущая роль цитидиннуклеотидов в биосинтезе липидов была открыта Юджином Кеннеди в начале 1960-х гг.
Юджин П. Кеннеди

Рис. 21-23. Присоединение полярной «головки». Полярная «головка» в фосфолипиде присоединяет диацилглицерин фосфодиэфирной связью при конденсации фосфорной кислоты с двумя спиртовыми группами (две молекулы Н2O отщепляются).
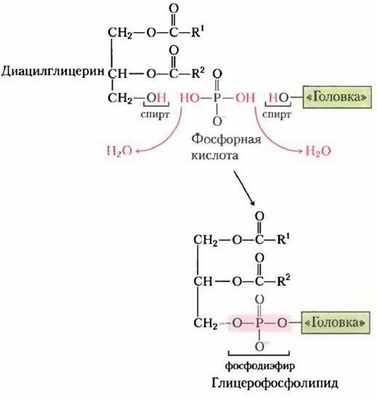
Рис. 21-24. Две главные стратегии образования фосфодиэфирной связи в фосфолипидах. В обеих стратегиях фосфатную группу для фосфодиэфирной связи предоставляет СDР.
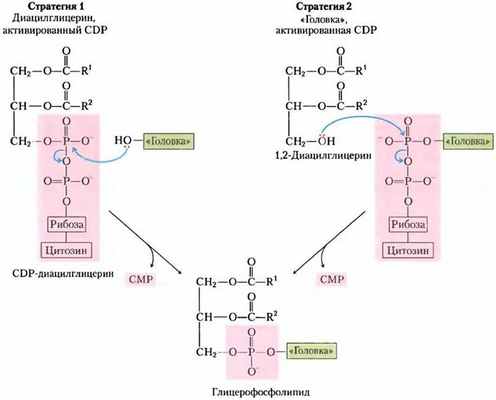
Для синтеза фосфолипидов у Е. coli служат CDP-диацилглицерины
Первую стратегию присоединения полярной «головки» иллюстрирует синтез фосфатидилсерина, фосфатидилэтаноламина и фосфатидил- глицерина у Е. coli. Диацилглицерин активируется при конденсации фосфатидной кислоты цитидинтрифосфатом (СТР) с образованием CDP-диацилглицерина, при этом отщепляется пирофосфат (рис. 21-25). Замещение СМР путем нуклеофильной атаки гидроксильной группой серина или гидроксильной группой при С-1 глицерин-3-фосфата дает фосфатидилсерин или фосфатидилглицерин-3-фосфат соответственно. Продукт подвергается дальнейшему превращению путем расщепления фосфатного моноэфира (с высвобождением Рi), образуя фосфатидил-глицерин.
Фосфатидилсерин и фосфатидилглицерин могут служить предшественниками других мембранных липидов у бактерий (рис. 21-25). Декарбоксилирование серинового остатка фосфатидилсерина, катализируемое фосфатидилсериндекарбоксилазой, приводит к фосфатидил- этаноламину. У Е. coli конденсация двух молекул фосфатидилглицерина, сопровождаемая отщеплением глицерина, дает кардиолипин, в котором два диацилглицерина соединены через общую полярную «головку».
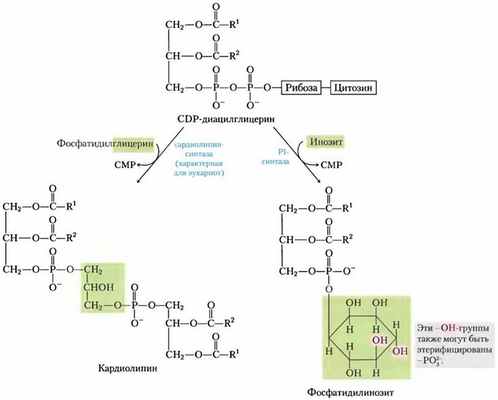
Эукариоты синтезируют анионные фосфолипиды из CDP-диацилглицеринов
У эукариот фосфатидилглицерин, кардиолипин и фосфатидилинозит (все анионные фосфолипиды; см. рис. 10-9, т. 1) синтезируются по той же стратегии, по которой осуществляется синтез фосфолипидов у бактерий. Фосфатидилглицерин образуется в точности так же, как у бактерий. Синтез кардиолипина у эукариот слегка отличается: фосфатидилглицерин конденсируется с CDP-диацилглицерином (рис. 21-26), а не с другой молекулой фосфатидилглицерина, как в случае Е. coli (рис. 21-25).
Фосфатидилинозит синтезируется путем конденсации CDP-диацилглицерина с инозитом (рис. 21-26). Специфические фосфатидилинозиткиназы затем превращают фосфатидилинозит в его фосфорилированные производные (см. рис. 10-17, т. 1). Фосфатидилинозит и его фосфорилированные продукты в плазматической мембране эукариот играют центральную роль в передаче сигналов (см. рис. 12-10,12-16, т. 1).
Рис. 21-25. Образование полярных «головок» фосфолипидов у Е. coli. Сначала при присоединении полярной «головки» (серин или глицерин-3-фосфат) образуется CDP-диацилглицериновый интермедиат (стратегия 1 на рис. 21-24). У всех фосфолипидов, кроме фосфатидил- серина, полярная «головка» подвергается дальнейшей модификации, как показано здесь. PG — фосфатидил- глицерин, PS — фосфатидилсерин.
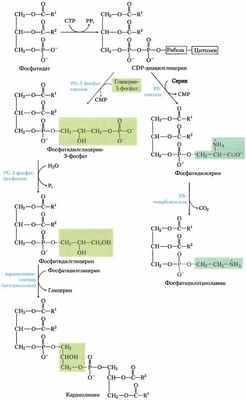
Рис. 21-26. Синтез кардиолипина и фосфатидилинозита у эукариот. Эти глицерофосфолипиды синтезируются по стратегии 1 (рис. 21-24). Фосфатидилглицерин синтезируется так же, как у бактерий (см. рис. 21-25). РI — фосфатидилинозит.
У эукариот метаболические пути образования фосфатидилсерина, фосфатидилэтаноламина и фосфатидилхолина взаимосвязаны
Рис. 21-27. Главный метаболический путь от фосфатидилсерина к фосфатидилэтаноламину и фосфатидилхолину у всех эукариот. А (AdoMet — S-аденозилметионин; adoHcy — S-аденозилгокоцистеин.
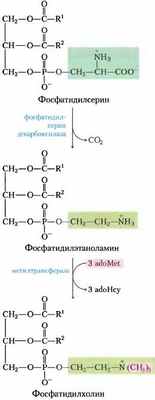
Рис. 21-28. Пути синтеза фосфатидилсерина и фосфатидил- холина у млекопитающих, а — фосфатидилсерин синтезируется в обменной Са 2+ -зависимой реакции, катализируемой фосфатидилсеринсинтазой 1 (РSS2) или фосфатидилсерин- синтазой 2 (РSS2). Фермент первого типа использует в качестве субстрата фосфатидилэтаноламин или фосфатидилхолин. Метаболические пути у бактерий и дрожжей соответствуют рис. 21-27. б — та же стратегия, что продемонстрирована для синтеза фосфатидилхолина (стратегия 2 на рис. 21-24), используется и для усвоения этаноламина в синтезе фосфатидил- этаноламина.
Пока не до конца понятно, каково влияние липидного состава на функции мембран, однако установлено, что этот фактор может оказывать серьезные эффекты. Исследователи получили плодовых мушек с мутациями в гене, который кодирует этаноламинкиназу (аналогична холинкиназе; рис. 21-28, б). Недостаток этого фермента выключает один из путей синтеза фосфатидилэтаноламина, уменьшая таким образом количество этого липида в клеточных мембранах. У мушек с такой мутацией (легко стрес- сируемый генотип) наблюдается временный паралич после электрической стимуляции или механического шока, хотя эти воздействия на дикий тип не влияют.
Рис. 21-29. Общая схема путей синтеза основных фосфолипидов. У организмов различных классов метаболические пути синтеза фосфолипидов различаются. Метаболические пути млекопитающих выделены желтым цветом, а те, что используются бактериями и дрожжами, выделены розовым. Оранжевым обозначены зоны перекрывания путей. У млекопитающих фосфатидилэтаноламин и фосфатидилхолин синтезируются из диацилглицеринов и подходящей группы СDР-производного «головки». Превращение фосфатидилэтаноламина в фосфатидилхолин у млекопитающих происходит исключительно в печени. Пути синтеза фосфатидилсерина у организмов различных классов подробно проиллюстрированы на рис. 21-27 и 21-28.
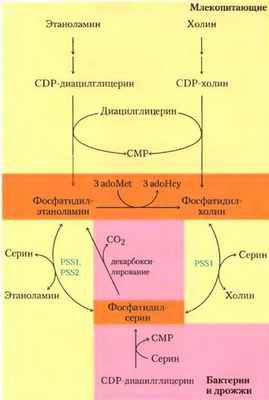
Синтез плазмалогенов требует образования связанного простой эфирной связью жирного спирта
Метаболический путь биосинтеза эфирных липидов, в том числе плазмалогенов и фактора активации тромбоцитов (см. рис. 10-10, т. 1), включает замещение этерифицированной жирноацильной группы на длинноцепочечный спирт с образованием простой эфирной связи (рис. 21-30). За этим следует присоединение головной группы по механизму, очень похожему на механизм образования обычных фосфолипидов со сложноэфирной связью. Наконец, характерная двойная связь в плазмалогенах (выделена голубым на рис. 21-30) вводится действием оксидазы со смешанной функцией, сходной с оксидазой десатурации жирных кислот (рис. 21-13). Пероксисомы являются главным участком синтеза плазмалогенов.
Рис. 21-30. Синтез эфирных липидов и плазмалогенов. Вновь образуемая простая эфирная связь выделена розовым цветом. Интермедиат 1-алкил-2-ацилглицерин- 3-фосфат — простой эфир фосфатидной кислоты. Механизмы присоединения полярных «головок» к эфирным липидам в целом те же, что и для их аналогов со сложноэфирной связью. Характерная двойная связь в плазмалогенах (выделена голубым) вводится на конечной стадии с помощью системы оксидазы со смешанной функцией, сходной с показанной на рис. 21-13.
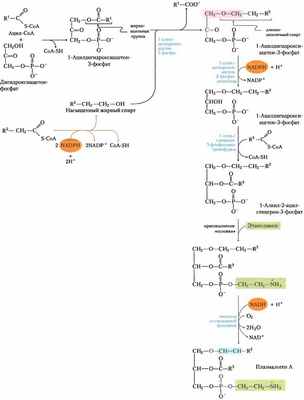
В синтезах сфинголипидов и глицерофосфолипидов некоторые предшественники и некоторые механизмы общие
Рис. 21-31. Биосинтез сфинголипидов. Конденсация пальмитоил-СоА и серина (с образованием β-кетосфинганина), сопровождаемая восстановлением с помощью NADРН, дает сфинганин, который затем ацилируется с образованием N-ацилсфинганина (церамида). У животных двойная связь (выделена розовым) образуется действием оксидазы со смешанной функцией, а в конце присоединяется полярная «головка»: фосфатидилхолин — при образовании сфингомиелина; глюкоза — при образовании цереброзида.
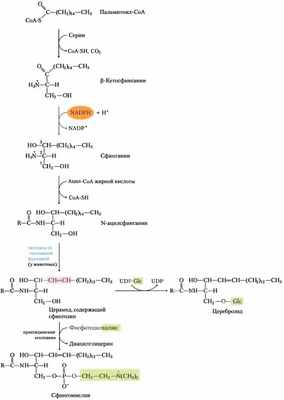
Этот метаболический путь имеет несколько особенностей, как и пути, ведущие к синтезу глицерофосфолипидов: восстанавливающую способность, обеспечивает NАDРН, а жирные кислоты вводятся в виде активированных СоА- производных. При образовании цереброзида сахара вводятся в виде активированных нуклеотидных производных. Выявлено несколько новых аспектов присоединения полярной «головки» при синтезе сфинголипидов. Скорее всего, фосфатидилхолин, а не СDР-холин служит донором фосфохолина при синтезе сфингомиелина.
В гликолипидах, цереброзидах и ганглиозидах (см. рис. 10-12, т. 1) сахар «головки» связывается непосредственно с гидроксилом при С-1 сфингозина, причем более вероятно, что образуется гликозидная связь, чем фосфодиэфирная. Донором сахара выступает UDР-сахар (UDР-глюкоза или UDР-галактоза).
Полярные липиды локализуются в специальных клеточных мембранах
После синтеза на гладком эндоплазматическом ретикулуме (ЭР) полярные липиды, в том числе глицерофосфолипиды, сфинголипиды и гликолипиды, включаются в специфические клеточные мембраны в определенных соотношениях по непонятным до сих пор механизмам. Мембранные липиды нерастворимы в воде, так что они не могут просто диффундировать от места их синтеза (ЭР) к месту внедрения в мембрану. Они поступают в мембранные пузырьки, которые отпочковываются от комплекса Гольджи, затем перемещаются и сливаются с мембраной-мишенью (см. рис. 11-22, т. 1). Нельзя сказать, что все детали этих метаболических путей полностью известны, хотя многое уже прояснилось. Белок с молекулярной массой 68 кДа, названный CERT (от англ. ceramide transport), переносит церамид от эндоплазматического ретикулума к аппарату Гольджи.
Цитозольные белки также связывают фосфолипиды и стерины и переносят их между клеточными мембранами, благодаря всем этим механизмам мембраны разных органелл имеют характерный для них липидный состав (см. рис. 11-2, т. 1).
Краткое содержание раздела 21.3 Биосинтез мембранных фосфолипидов
■ Диацилглицерины — главные предшественники глицерофосфолипидов.
■ У бактерий фосфатидилсерин образуется путем конденсации серина с СDР-диацилглицерином; при декарбоксилировании фосфатидилсерина получается фосфатидилэтаноламин. Фосфатидилглицерин образуется при конденсации СDР-диацил глицерина с глицерин-3-фосфатом, после чего следует отщепление фосфата от сложноэфирной связи.
■ У дрожжей пути синтеза фосфатидилсерина, фосфатидилэтаноламина и фосфатидилглицерина похожи на пути у бактерий; фосфатидилхолин образуется путем метилирования фосфатидилэтаноламина.
■ В клетках млекопитающих существуют некоторые пути, сходные с бактериальными, но пути синтеза фосфатидилхолина и фосфатидилэтаноламина до некоторой степени отличаются. Спирт головной группы (холин или этаноламин) активируется в виде СDР-производного, затем конденсируется с диацилглицерином. Фосфатидилсерин получается только из фосфатидилэтаноламина.
■ Синтез плазмалогенов включает образование характерной для них двойной связи с помощью оксидазы со смешанной функцией. Головные группы сфинголипидов присоединяются посредством специфических механизмов.
■ Фосфолипиды перемещаются к местам их назначения внутри клетки в виде транспортных везикул или с помощью специфических белков.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Синтез фосфолипидов в клетке - цикл Кеннеди
• Основные клеточные фосфолипиды синтезируются в мембране ЭПР, главным образом, со стороны цитозоля.
• Регуляция синтеза новых липидов контролируется локализацией ферментов, участвующих в этом процессе.
• Биосинтез холестерина регулируется протеолизом фактора транскрипции, который интегрирован в мембрану ЭПР.
Наряду с транслокацией и подготовкой белков к секреторному процессу, эндоплазматический ретикулум (ЭПР) функционирует как место первичного образования клеточных фосфолипидов. Эти молекулы синтезируются в мембране эндоплазматического ретикулума (ЭПР) и затем распределяются по отдельным мембранам и органеллам внутри клетки. К их числу относится плазматическая мембрана, митохондрии и органеллы секреторного пути.
При возникновении необходимости клетка должна обладать способностью увеличивать количество мембран. Наиболее очевидно это проявляется при удвоении плазматической мембраны и всех органелл, которое происходит в ходе клеточного цикла. Наряду с этим, при гиперфункции, отдельные органеллы могут увеличиваться в размерах. Например, при созревании предшественников В-лимфоцитов в плазматические клетки, секретирующие антитела, ЭПР сильно увеличивается, что соответствует потребностям усиленного транспорта белков по секреторному пути.
Образование фосфолипидов из растворимых предшественников de novo происходит, главным образом, на мембране ЭПР со стороны цитоплазмы, в ходе процесса, называемого цикл Кеннеди. Как показано на при росте мембраны ЭПР две молекулы жирных кислот, связанные с ацетил КоА, реагируют с глицерин-3-фосфатом, образуя диацилглицерин (ДАТ). В отличие от своих предшественников, ДАГ достаточно гидрофобен для того, чтобы интегрироваться в мембрану ЭПР.
Попав в мембрану, ДАГ взаимодействует с «головой» будущей молекулы фосфолипида. Как показано на рисунке ниже, основные фосфолипиды различаются, главным образом, природой «головы» молекулы. Все они образуются при присоединении «головы» к ДАГ. Вначале происходит ее фосфорилирование, а затем присоединение к цитидиндифосфату (ЦДФ). После этого «голова» с одной из фосфатных групп переносится на ДАГ, и синтез завершается.
Присоединение головной группы холина к ЦЦФ с образованием фосфатидилхолина иллюстрирует использование клеткой субклеточной локализации белков для регуляции процессов биосинтеза. В этой реакции участвует фермент цитидилтрансфераза (ЦТ), и она контролирует скорость всего процесса синтеза фосфатидилхолина. В клетке ЦТ находится в двух различных формах: в неактивной, в цитозоле, и в активной, с цитозольной стороны мембраны ЭПР.
Механизм, который обеспечивает существование двух этих форм фермента, представляется не вполне ясным. Очевидно, однако, что условия внутри клетки, которые сигнализируют о необходимости усиления синтеза фосфатидилхолина, могут контролировать переход ЦТ из одной формы в другую. Например, увеличение в клетке концентрации свободного ДАТ или жирных кислот вызывает миграцию ЦТ на мембрану ЭПР, где эти компоненты реагируют с холином. В то же время, когда в клетке содержится много фосфатидилхолина, ЦТ локализуется в цитозоле. Таким образом, предотвращается синтез фосфатидилхолина.
Наряду с фосфатидилхолином, который является наиболее распространенным мембранным фосфолипидом, в цикле Кеннеди также образуются фосфатидилэтаноламин и фосфатидилинозитол. У дрожжей S. cerevisiae синтезируется фосфатидилсерин. У животных, однако, этот фосфолипид образуется за счет другой реакции, которая не требует участия ЦЦФ, однако также протекает с цитозольной стороны мембраны ЭПР.
Интересная особенность синтеза фосфатидилэтаноламина заключается в том, что хотя этот фосфолипид образуется в цикле Кеннеди, он также может синтезироваться в митохондриях. В этих органеллах он образуется при модификации фосфатидилсерина, который образовался в ЭПР. Образование фосфатидилэтаноламина в клеточных компартментах, отличающихся от тех, в которых синтезируется его предшественник, предполагает существование механизма транспорта липидов между двумя компартментами.
Имеются данные, позволяющие предполагать, что этот транспорт осуществляется посредством специального субдомена ЭПР, который называется мембраной, связанной с митохондрией (МСМ). МСМ представляет собой участок ЭПР, который физически ассоциирован с митохондрией. Он характеризуется плоской поверхностью и тесным контактом с органеллой. В МСМ находятся ферменты синтеза фосфатидилсерина. Возможно, что область контакта мембраны с митохондрией обеспечивает быстрый перенос фосфатидилсерина в органеллу, хотя механизм этого переноса остается неясным.
Наряду с участием в синтезе фосфолипидов, эндоплазматический ретикулум (ЭПР) является местом синтеза стеринов. К числу основных стеринов мембран клетки относится холестерин; его биосинтез осуществляется в несколько этапов. Первые несколько реакций происходят в цитозоле, а остальные в мембране ЭПР. Также в ЭПР находятся элементы, необходимые для регуляции образования холестерина. Ключевыми медиаторами этого регуляторного пути являются белки, связывающиеся с регуляторным стеринреспонсивным элементом (SREBP).
Эти белки обычно интегрированы в мембрану эндоплазматического ретикулума (ЭПР) и со стороны люмена содержат небольшую петлю, соединяющую два трансмембранных домена, N- и С-концевые участки которых ориентированы в сторону цитозоля. Также в ЭПР находится белок SCAP (белок, активирующий разрезание SREBP). Этот белок контролирует уровень внутриклеточного холестерина. Когда возникает необходимость в повышенном синтезе холестерина, SCAP транспортирует SREBP из ЭПР в аппарат Гольджи. Там происходит разрезание SREBP, и N-терминальный участок молекулы высвобождается в цитозоль. (В реакции участвуют те же протеазы, которые расщепляют АТФ 6 при возникновении стрессорных условий в ЭПР. Затем N-терминальный домен SREBP мигрирует в ядро, где действует как фактор транскрипции, активируя экспрессию генов в каскаде реакций биосинтеза холестерина.
При объединении водорастворимых цитоплазматических компонентов (глицерин-3-фосфата, ацил КоА и полярной головки) образуется молекула фосфолипида.
Новая растворимая в липидах молекула включается в мембрану. Основные мембранные фосфолипиды различаются по составу головок.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль Уридина в организме человека
Роль Уридина в организме человека 25.10.2019 10:30
Уридин - нуклеозид, содержит урацил, прикрепленный к кольцу рибозы (известному как рибофураноза) с помощью β-N1 - гликозидной связи. Урацил, присоединенный к кольцу дезоксирибозы, образует дезоксиуридин. Уридин – это нуклеозид, который используется для повышения синтеза клеточных мембран, а также для других неврологических целей. Он обладает потенциальными способностями улучшать когнитивный процесс. Исследователи из Гарварда сообщают, что добавки уридина и EPA / DHA омега-3 жирных кислот у крыс.
Уридин в гликолизном пути: Уридин играет важную роль в гликолизном пути галактозы. Не существует катаболического процесса для метаболизма галактозы. Таким образом, галактоза превращается в глюкозу и метаболизируется в общем глюкозном пути. После преобразования поступающей галактозы в галактозу-1-фосфат (Gal-1-P), она участвует в реакции с UDP-глюкозой, молекулой глюкозы, присоединенной к молекуле UDP (уридин-ди-фосфат). Этот процесс катализируется ферментом галактоза-1-фосфат уридилтрансферазы, и передает UDP к молекуле галактозы. Конечным результатом является молекула UDP-галактозы и молекула глюкоза-1-фосфата. Этот процесс продолжается для осуществления гликолиза молекулы галактозы.
Фармакология : Уридин поглощается из кишечника посредством либо облегченной диффузии, либо специальных транспортировщиков причина. Уровень уридина в сыворотке в состоянии покоя колеблется в диапазоне 3-8микромоль. 10) Эритроциты содержат энзим уридин-дифосфат-глюкозу, который входит в систему P450; при необходимости, данный энзим может быть лизирован для обеспечения в организме чистого уридина и глюкозы, когда содержание уридина израсходовано.
Неврология (Механизмы)
Уридин известен в качестве обходного пути гематоэнцефалического барьера 11) , и подхватывается одним из двух транспортировщиков, один класс которых называется равновесные 12) (семейство SLC29; например, транспортировщики ENT1, ENT2 и ENT3), обладающие низким сродством (диапазон 100–800микромоль) и независимые от натрия, и сосредоточивающие (семейство SLC28, состоящее из ENT4, а также CNT1, 2 и 3), которые представляют собой независимые от натрия активные транспортировщики с высоким сродством (1-50микромоль). 13)
Уридин играет роль питательной среды в синтезе фосфатидилхолина в цикле Кеннеди (также известен как путь цитидиндифосфатхолина, фосфатидилэтаноламин также вырабатывается данным способом). 14) В этом способе холин киназа катализирует холин в фосфохолин, в процессе поглощая молекулу АТФ 15) , при этом она обладает незначительным сродством (таким образом, большая часть клеточного холина немедленно преобразуется в фосфохолин), и хотя это не единственный возможный способ производства фосфохолина (распад сфингомиелина также дает фосфохолин), он является наиболее совершенным способом и первым шагом синтеза фосфохолина посредством цикла Кеннеди, при этом концентрация фосфохолина непосредственно находится под влиянием растущего поглощения холина. 16) В других зонах, фосфохолин цитидилилтрансфераза преобразует цитидинтрифосфат в цитидиндифосфатхолин плюс пирофосфат (используя ранее созданный фосфохолин в качестве источника холина). Эта стадия наиболее медленная в цикле Кеннеди и ограниченная по скорости, однако ее деятельность определяет весь синтез фосфохолина. 17) Обычно в клеточных культурах наблюдается большое количество фосфохолина и недостаток цитидиндифосфатхолина, при этом ограничение по скорости на этой стадии определяется усвояемостью цитидинтрифосфата. Данный энзим также отрицательно регулируется мозговыми фосфолипидами, и это основные механизмы, обусловливающие гомеостаз фосфолипидов и предотвращающие избыточный синтез фосфолипидов. 18) В конечном итоге, холин фосфотрансфераза (не путать с карнитин-пальмитоилтрансферазой, которая имеет аналогичную аббревиатуру) транспортирует фосфохолин от цитидиндифосфатхолина до диациглицерина. Здесь также участвует энзим под названием холин–этаноламин фосфотрансфераза, который обладает двойной специфичностью для цитидиндифосфатхолина и цитидиндифосфатэтаноламина (и особенно для последнего), отдача фосфохолина диациглицерину в конечном итоге создает фосфолипиды наподобие фосфатидилхолина (другие энзимы, использующие цитидиндифосфатэтаноламин взамен этого создают фосфатидилэтаноламин). Этот энзим не стимулируется инкубацией с уридином, но стимулируется нервным ростовым фактором (НРФ). 19) Уридин и цитидин преобразуются в фосфолипиды с помощью цикла Кеннеди, в вышеуказанном цикле имеет место ограничение по скорости непосредственно вслед за энзимом CCT. Обеспечение воздействия энзима на цитидин – это то, что определяет скорость. Уридин используется в качестве питательной среды, из которой синтезируется цитидиндифосфатхолин (хотя и перед ограниченным по скорости этапом) косвенно за счет цитидина. Обеспечение цитидина (синтезированного из уридина) ограничено по скорости в вышеуказанном процессе, при этом обеспечение дополнительного цитидина клеткам или срезам мозга при достаточной концентрации холина ускоряет синтез цитидиндифосфатхолина. 20) Уридин продемонстрировал аналогичное свойство за счет преобразования в цитидин путем первоначального преобразования в уридин трифосфат (УТФ) и затем в цитидинтрифосфат, что было подтверждено на живой модели. В то время как уридин создает УТФ в количестве 5микромоль, он стимулирует максимальный синтез цитидиндифосфатхолина в 50микромоль в лабораторных условиях; производство цитидиндифосфатхолина из уридина было подтверждено на живом организме при пероральном приеме уридина. 21) Добавление уридина или цитидина к клеточным культурам увеличит уровень цитидина в клетках и преодолеет ограничение скорости, что приведет к выработке фосфолипидов. Относительно фосфатидилхолина была выдвинута гипотеза[54], что недостаточность роста связана с быстрым накоплением фосфатидилхолина в мембранах фосфолипидов; гипотеза связана с предыдущим исследованием, отметившим снижение концентрации фосфатидилхолина за счет уридина или пропрепаратов уридина. Пероральный прием внутрь уридина увеличивает уровень предшественников мозговых фосфолипидов у здоровых людей, в особенности фосфатидилэтаноламина. Хотя рост фосфатидилхолина не может быть исключен, он не был достоверно выявлен у людей.
Рецепторы P2: Рецепторы P2 – это метакласс рецепторов, которые реагируют на внеклеточные пурины и пиримидины (такие как АТФ[58]) и содействуют так называемой пуринэргической нейропередаче. 23) Данный класс рецепторов аналогичен по строению аденозиновым рецепторам (до такой степени, что они обычно называются так же) и разделяется на классы P2Y и P2X (которые отличаются тем, что рецепторы P2Y являются сопряжёнными с G-белком, в то время как P2X – это лиганд-управляемые ионные каналы). Уридин представляет собой агонист рецепторов P2, особенно подкласса P2Y, из которых состоят восемь известных человеческих рецепторов P2Y (1,2,4,6 и 11-14) и остальное количество не относящихся к млекопитающим рецепторов, при этом фосфорилированный уридин обладает сродством в основном с рецепторами P2Y2[64], и в меньшей степени с P2Y4, P2Y6 и P2Y14. 24) Нервная система также представлена семью рецепторами P2X, казалось бы, не связанными с уридином. Уридин имеет свой собственный комплект рецепторов, на которые он может воздействовать, а именно рецепторы P2, где он оказывает большее влияние на P2Y2, P2Y4, P2Y6 и P2Y14. Когда уридин не задействован в качестве питательной среды для синтеза фосфолипидов, он действует подобно новому нейротрансмиттеру с помощью пуринэргических рецепторов Рецепторы P2Y2 имеют структурные элементы, которые способствуют взаимодействию с интегринами и росту управляющих рецепторов, и активация данных рецепторов приводит к активации передачи сигнала фактора роста нервной ткани/тропомиозин-рецепторной киназы A и является в основном нейропротективной. 25)
Синаптогенез: Уридин полезно влияет на синаптические функции за счет увеличения уровня мозгового фосфатидилхолина, который является составляющей мембран дендритов. Предполагается, что он приносит пользу людям, страдающим от ослабления синаптической функции или регуляции, как при болезни Альцгеймера, где ослабление синаптической функции является следствием обычных бета амилоид соединений, оказывающих токсическое воздействие на синапсы нейронов и дендритные шипики. 26) За счет обеспечения фосфатидилхолина, уридин предположительно способствует образованию мембран и дендритов, которые могут содействовать синаптической функции. Исследования, изучающие синаптическую конструкцию под действием приема уридина, предпочитают рассматривать дендритные шипики, что связано со сложностью количественной оценки синаптической функции самой по себе, а дендритные шипики представляют собой наиболее надежный биомаркер за счет того, что 90% дендритов формируют синапсис. 27) Кормление животных комбинацией уридина, холина и жирных кислот омега-3 (из рыбьего жира) привело к росту синаптического образования и функции и продемонстрировало улучшения у группы людей (n=221) с легкой болезнью Альцгеймера. 28)
Рост аксонов и нервных волокон: Пурины и пиримидины увеличивают клеточную дифференцировку в нейронах 29) , при этом уридин приводит к росту нейронной дифференцировки и разрастанию за счет активации передачи сигнала фактора роста нервной ткани посредством его рецептора тропомиозин-рецепторной киназы A(широко известной увеличением роста нейронов) благодаря воздействию на его собственный рецептор P2Y2. Удаление рецептора P2Y2 препятствует соответствующей передаче сигнала фактора роста нервной ткани посредством тропомиозин-рецепторной киназы A, при этом два рецептора воздействуют друг на друга как при коиммунопреципитации. 30) В этом смысле агонисты P2Y2 повышают передачу сигнала фактора роста нервной ткани за счет увеличения разрастания нейронов благодаря чувствительности нейронов к фактору, это было обнаружено и в отношении агониста P2Y2 уридина (трифосфата). Активация рецептора P2Y2 способствует действию фактора роста нервной ткани посредством его собственного рецептора (тропомиозин-рецепторной киназы A), и в конечном счете ведет к тому, что агонисты рецептора P2Y2 увеличивают вызванный фактором рост нейронов. 6 недель, но не 1 неделя, кормления 330мг/кг (1ммоль/кг) уридина стареющих крыс увеличило уровень нейрофиламента -70 (+82%) и нейрофиламента-M (+121%), двух белков цитоскелета, вовлеченных в рост аксонов и использующихся в качестве биомаркеров 31) , что ранее было вызвано в лабораторных условиях фактором роста нервной ткани в дифференцированных нейронных клетках PC12 под действием уридина, был выявлен рост аксонов , а так же быстрое восстановление поврежденной миелиновой оболочки. Примечательно, но исследование в лабораторных условиях выявило, что уридин может действовать с помощью рецептора P2Y с целью регенерации поврежденных нервных окончаний.
Катехоламин: Рацион стареющих крыс, обогащенный 2.5% двунатриевого уридина (500мг/кг, либо 330мг/кг уридина, при этом человеческий эквивалент составляет около 50мг/кг), не повлиял в состоянии покоя на уровень допамина в нейронных срезах крыс, но увеличил вызванное K+ высвобождение допамина, при этом 1 и 6 недель приема увеличили средний уровень допамина на 11.6-20.5% без разницы во временном снижении потенциала действия, при том не оказывая влияния на концентрацию ДОФУК или ГВК. 32) Прием уридина увеличивает уровень допамина, выводимого из активированных нейронов, не оказывая значительного влияния на общий уровень допамина
Болезнь Альцгеймера: Уридин может способствовать лечению болезни Альцгеймера за счет поддержания синаптических соединений, которые ослабевают при болезни Альцгеймера. 33) За счет разрастания синапсиса, прием уридина может применяться в терапевтических целях при болезни Альцгеймера .Одно исследование отметило значительное облегчение симптомов болезни Альцгеймера у крыс с ускоренным образованием β-амилоиды (и, тем самым, у предрасположенных к болезни Альцгеймера), но было в значительной степени запутано использованием других нутриентов для обеспечения действия уридина.
Биполярное расстройство: При 6-недельном приеме уридина в открытом исследовании биполярного расстройства у детей было отмечено, что прием причина был связан с облегчением симптомов депрессии по сравнению с исходными (со среднего значения 65.6 по шкале оценки детской депрессии до 27.2 с эффективностью в пределах недели); маниакальные симптомы не оценивались. Триацетилуридин (ТАУ) применялся в исследовании биполярного расстройства взрослых по 18г ежедневно в течение 6 недель, при этом было отмечено значительное облегчение симптомов депрессии.
Сердечная ткань: Уридин способен оказывать неотложный кардиозащитный эффект при ишемии миокарда, предварительная нагрузка которого ликвидируется блокированием калиевых каналов митохондрии (посредством 5-гидроксидеканоата); это означает, что предварительная нагрузка уридина сохраняет уровень энергетических метаболитов (АТФ, креатин фосфат и уридин) и в дальнейшем снижает липопероксидацию. 34)
Список использованной литературы:
1 Almeida C, et al. Composition of beer by 1H NMR spectroscopy: effects of brewing site and date of production. J Agric Food Chem. (2006)
2) Thorell L, Sjöberg LB, Hernell O. Nucleotides in human milk: sources and metabolism by the newborn infant. Pediatr Res. (1996)
3) Inokuchi T, et al. Effects of allopurinol on beer-induced increases in plasma concentrations of purine bases and uridine. Nucleosides Nucleotides Nucleic Acids. (2008)
4) Shetlar MD, Hom K, Venditto VJ. Photohydrate-Mediated Reactions of Uridine, 2'-Deoxyuridine and 2'-Deoxycytidine with Amines at Near Neutral pH. Photochem Photobiol. (2013)
5) Eells JT, Spector R, Huntoon S. Nucleoside and oxypurine homeostasis in adult rabbit cerebrospinal fluid and plasma. J Neurochem. (1984)
6 ) Weinberg ME, et al. Enhanced uridine bioavailability following administration of a triacetyluridine-rich nutritional supplement. PLoS One. (2011)
7) Pizzorno G, et al. Homeostatic control of uridine and the role of uridine phosphorylase: a biological and clinical update. Biochim Biophys Acta. (2002)
8) Venhoff N, et al. Uridine pharmacokinetics of mitocnol, a sugar cane extract. AIDS. (2005)
9) Ashour OM, Naguib FN, el Kouni MH. 5-(m-Benzyloxybenzyl)barbituric acid acyclonucleoside, a uridine phosphorylase inhibitor, and 2',3',5'-tri-O-acetyluridine, a prodrug of uridine, as modulators of plasma uridine concentration. Implications for chemotherapy. Biochem Pharmacol. (1996)
10) Kretschmar C., Kaumeier S., Haase W. Medical treatment of alcoholic polyneuropathy. A randomised three-armed double-blind study comparingefficacy and tolerability of two vitamin B combinations and a nucleotide combination // Fortschr Med. 1996; 32: 439/53–443/57.
11) Gallai V., Mazzotta G., Montesi S., Sarchielli P., Del Gatto F. Effects of uridine in the treatment of diabetic neuropathy: an electrophysiologicalstudy // Acta Neurol Scand. Italy. 1999; 86: 3–7.
12) . De Mora E., Monfort R. Estudio multicentrico de una asociacion de nucleotidos en el tratamiento del dolor neuromuscular //Phronesis 1991; 12(1): 46–50.
1 3 ) Connolly GP, Duley JA. Uridine and its nucleotides: biological actions, therapeutic potentials. Trends Pharmacol Sci. (1999)
1 4 ) Cornford EM, Oldendorf WH. Independent blood-brain barrier transport systems for nucleic acid precursors. Biochim Biophys Acta. (1975)
1 5 ) Baldwin SA, et al. The equilibrative nucleoside transporter family, SLC29. Pflugers Arch. (2004)
16) Podgorska M, Kocbuch K, Pawelczyk T. Recent advances in studies on biochemical and structural properties of equilibrative and concentrative nucleoside transporters. Acta Biochim Pol. (2005)
17) Fagone P, Jackowski S. Phosphatidylcholine and the CDP-choline cycle. Biochim Biophys Acta. (2013)
1 8 ) Wu G, Vance DE. Choline kinase and its function. Biochem Cell Biol. (2010)
1 9 ) Millington WR, Wurtman RJ. Choline administration elevates brain phosphorylcholine concentrations. J Neurochem. (1982)
20) Kent C. Regulatory enzymes of phosphatidylcholine biosynthesis: a personal perspective. Biochim Biophys Acta. (2005)
21 ) Baburina I, Jackowski S. Cellular responses to excess phospholipid. J Biol Chem. (1999)
22 ) Araki W, Wurtman RJ. Control of membrane phosphatidylcholine biosynthesis by diacylglycerol levels in neuronal cells undergoing neurite outgrowth. Proc Natl Acad Sci U S A. (1997)
23) G-Coviella IL, Wurtman RJ. Enhancement by cytidine of membrane phospholipid synthesis. J Neurochem. (1992)
2 4 ) Cansev M, et al. Oral uridine-5'-monophosphate (UMP) increases brain CDP-choline levels in gerbils. Brain Res. (2005)
2 5 ) Babb SM, et al. Chronic citicoline increases phosphodiesters in the brains of healthy older subjects: an in vivo phosphorus magnetic resonance spectroscopy study. Psychopharmacology (Berl). (2002)
26) Burnstock G. Physiology and pathophysiology of purinergic neurotransmission. Physiol Rev. (2007)
2 7 ) Harden TK, et al. Signalling and pharmacological properties of the P2Y receptor. Acta Physiol (Oxf). (2010)
2 8 ) Weisman GA, et al. Neuroprotective roles of the P2Y(2) receptor. Purinergic Signal. (2012)
2 9 ) Spires-Jones TL, et al. Impaired spine stability underlies plaque-related spine loss in an Alzheimer's disease mouse model. Am J Pathol. (2007)
30) Harms KJ, Dunaevsky A. Dendritic spine plasticity: looking beyond development. Brain Res. (2007)
31) The efficacy of Souvenaid in mild Alzheimer’s disease: a randomized, controlled, double-blind, parallel group, multi-centre, multi-country clinical trial
32 ) Neary JT, et al. Trophic actions of extracellular nucleotides and nucleosides on glial and neuronal cells. Trends Neurosci. (1996)
3 3 ) Chuang HH, et al. Bradykinin and nerve growth factor release the capsaicin receptor from PtdIns(4,5)P2-mediated inhibition. Nature. (2001)
31) Lee V, Trojanowski JQ, Schlaepfer WW. Induction of neurofilament triplet proteins in PC12 cells by nerve growth factor. Brain Res. (1982)
32) Broersen LM, et al. A Specific Multi-Nutrient Diet Reduces Alzheimer-Like Pathology in Young Adult AβPPswe/PS1dE9 Mice. J Alzheimers Dis. (2012)
33) Jensen JE, et al. Triacetyluridine (TAU) decreases depressive symptoms and increases brain pH in bipolar patients. Exp Clin Psychopharmacol. (2008)
34) Krylova IB, et al. Effect of uridine on energy metabolism, LPO, and antioxidant system in the myocardium under conditions of acute coronary insufficiency. Bull Exp Biol Med. (2012)
35) Nolan D, et al. Mitochondrial DNA depletion and morphologic changes in adipocytes associated with nucleoside reverse transcriptase inhibitor therapy. AIDS. (2003)
36) McComsey GA, et al. Mitochondrial function, inflammation, fat and bone in HIV lipoatrophy: randomized study of uridine supplementation or switch to tenofovir. Antivir Ther. (2012)
37) Choi JH, Ji YG, Lee DH. Uridine Triphosphate Increases Proliferation of Human Cancerous Pancreatic Duct Epithelial Cells by Activating P2Y2 Receptor. Pancreas. (2013)
38) Silver AF, Chase HB. The incorporation of tritiated uridine in hair germ and dermal papilla during dormancy (telogen) and activation (early anagen). J Invest Dermatol. (1977)
39) Greig AV, Linge C, Burnstock G. Purinergic receptors are part of a signalling system for proliferation and differentiation in distinct cell lineages in human anagen hair follicles. Purinergic Signal. (2008)
Citicoline (CDP холин) Ноотропные исследования, Эффекты & Обзор безопасности

CDP-холин (Цитидин-5′-дифосфат холин, citicoline) эндогенные органические молекулы.
Он известен прежде всего как промежуточные соединения в биосинтеза фосфатидилхолина фосфолипиды мембраны (процесс обычно называется цикл Кеннеди).
Таким образом, CDP-холин и ее продукты гидролиза (холин и Цитидин, который метаболизируется в уридина в организме человека) играть важную роль в синтеза фосфолипидов для поддержки формирования мембраны и ремонт.
Экзогенные CDP-холин (citicoline) было отмечено, на выставке холинэргические и нейропротекторной действия.
Citicoline был использован для лечить целый ряд нейродегенеративных расстройств, особенно в отношении ишемического инсульта, травмы головы, связанных с возрастом ухудшение когнитивных и болезни Альцгеймера. [1]
Экзогенных citicoline гидролизуется в тонком кишечнике сформировать холин и Цитидин, оба из которых являются легко впитывается и рассеяны по всему организму.
Холин и Цитидин может пересечь гематоэнцефалический барьер (BBB), где они заново синтезированные в CDP-холин.[2]
В организме человека, Цитидин метаболизируется в уридина амино кислоты, которые также могут пересечь BBB и поддержки биосинтез фосфолипидов.
Название продукта: Citicoline, CDP-холин
Химическое название: Цитидин-5′-дифосфат холин
Формула: C14H26N4O11P2
Молекулярная масса: 488.33; Мононатриевый соль CDP-холин: 510.31
Память
Фокус
Здоровье мозга
- Поддержка памяти, фокус & ясность ума
- Увеличивает уровень ацетилхолина медиатора
- Пропагандирует здоровье клеток мозга & коммуникации
Лучшие товары Citicoline * ❯
Просмотр пользователя рейтинги * ❯
Химическая структура
Citicoline (C14H26N4O11P2) Поляризованные мононуклеотид состоит из рибозы, цитозин, пирофосфорнокислый, и холин. [3]
Экзогенных citicoline подвергается гидролизу в тонком кишечнике сформировать холин и Цитидин. В организме человека результате Цитидин метаболизируется до уридина.
Холин группируется с витаминами и trimethylated азотистых база. Холин участвует в осуществлении ряда метаболических, включая лиц, ответственных за синтез фосфолипидов и синтез ацетилхолина. [4]
Цитидин является общим компонентом РНК и преобразуется в цитоплазме сформировать цитидинтрифосфатом (CTP).
В мозге, Холин катализируемой холина киназа энзим сформировать фосфорилхолин.
Фосфорилхолин сочетает в себе CTP в форме citicoline, который сочетает диацилглицерол (ГРУППЫ ДОСТУПНОСТИ БАЗЫ ДАННЫХ) для формирования phosphatidlycholine (Этот биосинтетических путь известен как цикл Кеннеди).
Фармакокинетика
Citicoline является водорастворимые соединения, эффективно поглощается организмом, как при приеме внутрь и внутривенно; Перорального citicoline почти полностью всасывается.[5]
В организме человека, данные свидетельствуют о том, что только один процент устно, потребляемая citicoline экскретируется через фекалии.[6]
В целом, citicoline выводится в организме человека через Co2 дыхания и выведения мочи. [6]
Как было отмечено, citicoline гидролизуется в тонкой кишке в форме Холин и Цитидин. Администрация citicoline было отмечено, для повышения уровня плазмы холином. [7][8]
Однако, CDP-холин потребления была показана для увеличения уровней уридина в организме человека и не Цитидин уровней, предлагая Цитидин, выпустили через гидролиз citicoline превращается в циркулирующих уридина.[7]
Как Цитидин, уридина могут пересекать BBB и преобразуется в уридинтрифосфатом (UTP).
UTP могут быть преобразованы в цитидинтрифосфатом (CTP) по синтазы CTP фермента. Также было отмечено, что уридина преобразовать непосредственно в CTP в PC-12 клеток.[7]
В сумме, циркулирующих субстратов, через которые экзогенных CDP-холин СПИДа в синтезе phosopholipid в мозгах людей является уридина и холин, в отличие от Цитидин и холин как найдено в модели крыс.[7]
Citicoline механизмы действий
Citicoline его роль в качестве прекурсора для биосинтеза фосфатидилхолина фосфолипидного была показана в исследованиях на животных.
Экзогенные citicoline иллюстрировал сломать холин и цистин, который наблюдается увеличить холин и uridin сыворотке крови в организме человека.[7]
В том же исследовании было отмечено уридина, чтобы быть прямо преобразован в CTP. Таким образом, citicoline гипотеза для поддержки здоровья нейрональных мембран, предоставляя необходимые компоненты для синтеза фосфолипидов.
Экзогенных citicoline также полагают, чтобы помочь защитить целостность нейрональных мембран, предоставляя дополнительные холина магазины, которые помогают предотвратить нервные мембраны деградации, когда эндогенными уровнями холина становится слишком низким.[4]
Исследовано Citicoline для лечения ишемического инсульта. Во время ишемии, фосфатидилхолин разбивается на свободные жирные кислоты, которые затем преобразуются в свободных радикалов.
Считается, что экзогенных citicoline медленно или предотвратить распад фосфатидилхолин, вызванной ишемической эпизодов. [9]
Citicoline также служит посредником в производстве мембранных фосфолипидов, известный как сфингомиелин. Citicoline наблюдается восстановление сфингомиелин предварительно гладить уровни в пациентов, которые испытали ишемического инсульта. [10]
Доказательства эффективности citicoline в лечении болезни Альцгеймера (ОБЪЯВЛЕНИЕ) ограничен и предварительные. Некоторые данные свидетельствуют о том, что citicoline может также быть в состоянии противостоять депозит нейротоксическое белок, который играет роль в развитии AD.[4]
Citicoline для инсульта восстановление
Citicoline в основном используется для лечения цереброваскулярных расстройств.[11] В Европе и Японии, citicoline является отпускаемых по рецепту лекарств, в основном используется для лечения инсульта. [7]
Citicoline наблюдается улучшить восстановление пациентов, которые испытывают ишемического инсульта.
Исследования показывают, что инсульт пациентов, которые получают 500-2000 мг citicoline в день (устно) в рамках 24 Часы острого ишемического инсульта, выше вероятность сделать полное восстановление в три месяца, по сравнению с группой плацебо.[12]
Ставки возмещения, в соответствии с количеством citicoline ведении.
Наибольшая разница была между людьми как получил 2000 мг citicoline против плацебо: 27.9% пациентов, получавших 2000 мг citicoline/день сделал полное восстановление в три месяца, по сравнению с 20.2% в группе плацебо. [12]
Лечение когнитивных нарушений
Citicoline наблюдается улучшить словесной памяти у людей в возрасте 50-85 кто показали, потеря памяти, связанных с возрастом или слабоумием.[13]
Лица, характеризуются как имеющие ' неэффективных памяти’ было установлено, что улучшение вербальной памяти, функционирования с citicoline терапией. [13]
В другом исследовании было отмечено, что 1000MD/день citicoline за 4 недельный период улучшилась память напомнить в группе пожилых людей по сравнению с группой плацебо. [1]
Исследование, опубликованное в 2000 рассмотрел использование citicoline для лечения когнитивных нарушений или потеря памяти из-за черепно-мозговой травмы.
Исследователи отметили, принимая 1000 мг/сут citicoline улучшение памяти, возможность обучения и словесные. [14]
Болезнь Альцгеймера (ОБЪЯВЛЕНИЕ)
Исследование влияния citicoline на результат здоровья для лиц с AD все еще находится в стадии предварительного производства.[15]
Обзор исследований было сосредоточено на когнитивных и поведенческих нарушений, связанные с хроническими расстройствами мозгового отметил, что есть некоторые свидетельства того, что администрация CDP-холин имеет положительное влияние на память и поведения на коротких и средних срок.[11]
A 1999 исследование фокусируется на лиц с болезнью Альцгеймера наблюдается 1000мг/сут citicoline улучшение когнитивных функций, среди прочих мер.[1]
Глаукома
Считается, что замедление нервной проводимости в зрительных путей головного мозга играть определенную роль в визуальных эффектов открытоугольной глаукомы.
1000citicoline мг/день, перорально было отмечено, для улучшения визуального вызванные потенциалы в некоторых пациентов глаукомы.[16]
Безопасность и побочные эффекты
Citicoline потребление связано с низкой токсичности в организме человека.[4]
Однако, некоторые нежелательные эффекты отмечались периоды citicoline администрации, включая тошнота, рвота, diarrhrea, брадикардии, тахикардия, гипотония.[15]
ЛД50 внутривенно поставленный citicoline было отмечено, чтобы быть 4, 600 мг/кг для мышей и 4,150 мг/кг для крыс.
ЛД50 устно попадает citicoline остается неизвестным, потому что высоких доступных дозировка не вызывать каких-либо смерть в подопытных животных.[17][4]
ЦДФ-холиновый путь - CDP-choline pathway
В ЦДФ-холиновый путь, впервые идентифицированный Юджином Кеннеди в 1956 году, является преобладающим механизмом, с помощью которого клетки млекопитающих синтезируют фосфатидилхолин (ПК) для включения в мембраны или сигнальные молекулы, полученные из липидов. [1] [2] Путь ЦДФ-холин представляет половину того, что известно как Путь Кеннеди. Другая половина - это ЦДФ-этаноламинный путь который отвечает за биосинтез фосфолипидов фосфатидилэтаноламин (ПЭ). [1]
Путь ЦДФ-холин начинается с поглощения экзогенного холин в камеру. Первая ферментативная реакция катализируется холинкиназа (СК) и включает фосфорилирование холина с образованием фосфохолин. Затем фосфохолин активируется добавлением ОСАГО катализируется ограничивающим скорость ферментом, CTP: фосфохолинцитидилилтрансфераза формировать ЦДФ-холин. Заключительный этап пути включает добавление головной группы холина к диацилглицерин (DAG) каркас для формирования ПК, катализируемый холин / этаноламин фосфотрансфераза (СЕПТ). [1]
На фосфатидилхолин могут действовать фосфолипазы с образованием разных метаболитов.
Содержание
Транспорт холина
Клетки млекопитающих не могут синтезировать холин de novo и поэтому должны полагаться на экзогенные источники из рациона. Поглощение холина происходит преимущественно за счет высокоаффинного натрийзависимого транспортер холина (CHT) и требует АТФ как источник энергии. С другой стороны, холин может проникать в клетку посредством активации низкоаффинных, независимых от натрия органические белки-переносчики катионов (OCT) и / или переносчики карнитина / органических катионов (OCTN) и не требуют АТФ. Наконец, холин может проникать в клетку через транспортеры с промежуточным сродством, которые включают холиновый транспортер-подобный белок 1. (CTL1). [3]
Судьба интернализованного холина зависит от типа клетки. В пресинаптические нейроны большая часть холина будет ацетилирована ферментом холина ацетилтрансфераза сформировать нейротрансмиттер ацетилхолин. Mst другие клетки будут фосфорилировать холин с помощью фермента холинкиназы, первого коммитированного этапа пути CDP-холин.
Холинкиназа (CK)
Холинкиназа (CK) - это цитозольный белок, катализирующий следующую реакцию: [1] : 418
Помимо фосфорилирования холина, CK также фосфорилирует этаноламин, предшественник другого важного глицерофосфолипида, фосфатидилэтаноламин. CK функционирует как димер, состоящий из субъединиц α1, α2 или β. Каждая изоформа СК повсеместно выразил во всех тканях, однако CKα обогащен в семенниках и печени, тогда как CKβ обогащен в печени и сердце. Гомозиготная делеция CKα приводит к летальному исходу для эмбриона примерно через 5 дней, тогда как делеция CKβ - нет.
В нормальных условиях холинкиназа не является ограничивающий шаг пути ЦДФ-холин. Однако быстро делящиеся клетки, наблюдается повышенная экспрессия и активность CK в результате повышенной потребности в синтезе PC.
CTP: фосфохолинцитидилилтрансфераза (CCT)
CTP: фосфохолинцитидилилтрансфераза (CCT), фермент, ограничивающий скорость метаболизма, является ядерным / цитозольным ферментом и катализирует следующую реакцию: [1] : 422
CCT функционирует как димер субъединиц α и β, кодируемых Pcyt1a и Pcyt1b, соответственно. CCTα имеет четыре домена; а Сигнал ядерной локализации (NLS), α-спиральный мембранный связывающий домен, каталитический домен и домен фосфорилирования. Основное различие между изоформами α и β состоит в том, что CCTβ не содержит NLS, что приводит к преимущественно цитозольному пулу CCTβ. С другой стороны, присутствие NLS приводит к преимущественно ядерному пулу CCTα. CCTα перемещается между ядром (где он считается неактивным) в цитоплазму, где он связывается с мембранами и активируется в ответ на липидные активаторы или во время прохождения клеточного цикла, когда потребность в PC высока.
CCTα представляет собой амфитропный фермент, что означает, что он существует либо в неактивной растворимой форме, либо в активной форме, связанной с мембраной. Связан ли CCTα с мембраной или нет, во многом определяется относительным составом мембран. Если в мембранах мало PC и они относительно обогащены анионными липидами, диацилглицерином или фосфатидилэтаноламином, CCT вставляется в бислой мембраны через свой связывающий мембрану домен. Это событие связывания снимает ограничение автоингибирования каталитического домена, что приводит к снижению Км для фосфохолина.
Холин / этаноламинфосфотрансфераза (CEPT)
Холин / этаноламин фосфотрансфераза (CEPT), или холинфосфотрансфераза (CPT), последняя ферментативная реакция в пути ЦДФ-холин, катализирует следующую реакцию: [1] : 423
- ЦДФ-холин + 1,2-диацилглицерин ⇌ фосфатидилхолин + ЦМФ
Последний этап пути ЦДФ-холин катализируется либо СРТ, либо СЕРТ и локализуется в Гольджи или же эндоплазматический ретикулум, соответственно. CPT и CEPT кодируются отдельными генами, которые разделяют 60% сходство последовательностей. Обе изоформы содержат 7 трансмембранных сегментов и α-спираль рядом с каталитическим доменом, который необходим для связывания ЦДФ-спирт.
CPT распознает только CDP-холин, тогда как CEPT распознает как CDP-холин, так и CDP-этаноламин. Причина этой двойной специфичности неизвестна. CEPT в значительной степени считается ферментом, ответственным за большую часть синтеза PC, при этом CPT играет исключительную роль в Golgi, где он может контролировать уровни предшественника DAG, важного вторичного посредника.
Ни CPT, ни CEPT не считаются ограничивающими скорость, но могут быть, если DAG ограничен.
Читайте также:
