Что такое мозаицизм? Соматический мозаицизм и мозаицизм по половым клеткам
Добавил пользователь Владимир З. Обновлено: 17.01.2026
Юров Ю.Б. 1, 2, 3 Зеленова М.А. 1, 2 Ворсанова С.Г. 1, 2, 3 Демидова И.А. 1, 2, 3 Колотий А.Д. 1, 2 Воинова В.Ю. 1, 2, 3 Юров И.Ю. 1, 2, 4
2 Обособленное структурное подразделение ГБОУ ВПО РНИМУ им. Н.И. Пирогова «Научно-исследовательский клинический институт педиатрии» Минздрава России
Хромосомная нестабильность представляет собой феномен, происходящий за счет неравномерного распределения ДНК по дочерним клеткам в ходе митоза, что приводит к анеуплоидии и другим хромосомным аномалиям. Мозаицизм означает наличие двух или более популяций клеток с разными генотипами, появившихся из одной оплодотворенной яйцеклетки. Современные исследования соматического мозаицизма показали, что структурные мозаичные хромосомные нарушения могут обуславливать умственную отсталость, врожденные пороки развития и аутизм, так же как и низкопроцентная мозаичная анеуплоидия. В настоящей работе мы представляем семейный случай хромосомной нестабильности и структурного хромосомного мозаицизма. Кариотипирование девочки 8 лет с микроцефалией, умственной отсталостью, аутизмом, большими верхними резцами, маленькой нижней челюстью, гипертрихозом и воронкообразной деформацией грудной клетки выявило мозаичную делецию в коротком плече хромосомы 8. Метод array CGH позволил уточнить геномную локализацию, размер и генный состав делетированного участка. Кариотипирование матери пробанда тридцативосьмилетней женщины, планирующей новую беременность, выявило нестабильность хромосомы X в 20% клеток. FISH анализ 1000 интерфазных ядер и 150 метафазных пластинок позволил обнаружить хромосомную нестабильность по хромосоме Х в 10,9% и 8% клеток соответственно. Полученные результаты позволяют сделать предположение о связи между двумя наблюдаемыми аномалиями генома. Мы предполагаем, что хромосомная нестабильность у родителей может являться причинным фактором структурных перестроек у детей. Последнее предположение, однако, нуждается в дальнейших исследованиях. Необходимо также учитывать, что механизм, лежащий в основе нестабильности хромосомы Х у матери в данном случае, неизвестен и в случае выявления мог бы пролить свет на корреляцию между двумя наблюдаемыми нарушениями генома.
1. Ворсанова С.Г., Юров И.Ю., Соловьев И.В., Юров Ю.Б. Гетерохроматиновые районы хромосом человека: клинико-биологические аспекты. – M.: Медпрактика, 2008.
2. Юров И.Ю., Ворсанова С.Г., Юров Ю.Б. Геномные и хромосомные болезни центральной нервной системы: молекулярные и цитогенетические аспекты. – M.: Медпрактика, 2014.
3. Ballarati L., Cereda A., Caselli R., Selicorni A., Recalcati M.P., Maitz S., Finelli P., Larizza L., Giardino D. Genotype-phenotype correlations in a new case of 8p23.1 deletion and review of the literature // Eur J Med Genet. — 2011. - 54(1). – P. 55-59.
4. Burnside R.D., Pappas J. G., Sacharow S., Applegate C., Hamosh A., Gadi I.K., Jaswaney V., Keitges E., Phillips K.K., Potluri V.R., Risheg H., Smith J.L., Tepperberg J.H., Schwartz S., Papenhausen P. Three cases of isolated terminal deletion of chromosome 8p without heart defects presenting with a mild phenotype // Am J Med Genet A. – 2013. — 161A(4). — P. 822-828.
5. Iourov I.Y., Vorsanova S.G., Kurinnaia O.S., Zelenova M.A., Silvanovich A.P., Yurov Y.B. Molecular karyotyping by array CGH in a Russian cohort of children with intellectual disability, autism, epilepsy and congenital anomalies // Molecular Cytogenetics. – 2012. - №5. — С. 46.
6. Iourov I.Y., Vorsanova S.G., Yurov Y.B. Chromosomal mosaicism goes global // Molecular Cytogenetics. — 2008. - №1. — C. 26.
7. Iourov I.Y., Vorsanova S.G., Yurov Y.B. Somatic Genome Variations in Health and Disease // Current Genomics. —2010. - №11. — Т.6. —С. 387-396.
8. Iourov I.Y., Vorsanova S.G., Voinova V.Y., Kurinnaia O.S., Zelenova M.A., Demidova I.A., Yurov Y.B. Xq28 (MECP2) microdeletions are common in mutation-negative females with Rett syndrome and cause mild subtypes of the disease // Molecular Cytogenetics. – 2013. - №6. — С. 53.
9. Vorsanova S.G., Iourov I.Y., Voinova-Ulas V.Y., Weise A., Monakhov V.V., Kolotii A.D., Soloviev I.V., Novikov P.V., Yurov Y.B., Liehr T. Partial monosomy 7q34—qter and 21pter—q22.13 due to cryptic unbalanced translocation t(7;21) but not monosomy of the whole chromosome 21: a case report plus review of the literature // Molecular Cytogenetics.— 2008. - №1.— С. 13.
10. Yurov Y.B., Vorsanova S.G., Iourov I.Y., Demidova I.A., Beresheva A.K., Kravetz V.S., Monakhov V.V., Kolotii A.D., Voinova-Ulas V.Y., Gorbachevskaya N.L. Unexplained autism is frequently associated with low-level mosaic aneuploidy // Journal of Medical Genetics — 2007.— T.44. - №8.— С. 521-525.
11. Yurov Y.B., Vorsanova S.G., Iourov I.Y. GIN'n'CIN hypothesis of brain aging: deciphering the role of somatic genetic instabilities and neural aneuploidy during ontogeny // Molecular Cytogenetics. – 2009. - №2. — С. 23.
Одним из факторов, приводящих к анеуплоидии, является хромосомная нестабильность, возникающая по причине неравного распределения ДНК по дочерним клеткам в ходе митоза. Анеуплоидия представляет собой потерю или появление дополнительных хромосом. Хромосомная нестабильность может накапливаться с возрастом или быть маркером различных заболеваний [7, 11]. Данное нарушение может быть унаследовано за счет генетических или эпигенетических механизмов, или приобретено в онтогенезе и обусловлено внешними воздействиями (например, ионизирующей радиацией). Хромосомный мозаицизм – наличие двух или более популяций клеток с различными генотипами, развившихся из одной оплодотворенной яйцеклетки. Наличие мозаицизма может быть обусловлено различными факторами, в том числе нерасхождением хромосом, задержкой движения хромосом в анафазе или эндорепликацией [2]. Выделяют два типа мозаицима: гонадный (нарушение наблюдается только в половых клетках) и соматический (мозаицизм в соматических клетках). Современные исследования соматического мозаицизма продемонстрировали, что как мозаичные структурные геномные перестройки (хромосомные аномалии), так и малопроцентная мозаичная анеуплоидия являются частой генетической причиной умственной отсталости, врожденных аномалий и аутизма [1, 5]. В настоящей статье представлен семейный случай хромосомной нестабильности и мозаицизма.
Цель работы
Целью работы явилось исследование геномных вариаций у ребенка с умственной отсталостью и пороками развития, а также исследование матери пациента с помощью различных молекулярно-генетических методов.
Материалы и методы
В настоящей работе была исследована девочка 8 лет с умственной отсталостью, аутистическими чертами, микроцефалией, крупными верхними резцами, маленькой нижней челюстью, гипертрихозом и воронкообразной грудной клеткой. Для исследования пациентки применялись методы классического кариотипирования и array CGH (молекулярного кариотипирования). Метод array CGH проводился согласно ранее описанному протоколу [5, 8] с использованием SNP/олигонуклеотидной микроматрицы (разрешение не менее 1 тысячи пн). Был также проведен FISH анализ [9] и кариотипирование матери пробанда, тридцативосьмилетней женщины без признаков нарушения психического развития, планирующей новую беременность.
Результаты исследования и обсуждения
Цитогенетический анализ девочки (рис. 1) показал наличие делеции короткого плеча хромосомы 8 в 60% клеток (46,XX,del(8)(p23.1)[10]/46,XX[7]).
Рис. 1. Результаты цитогенетического исследования методом G-окрашивания (делеция 8p).
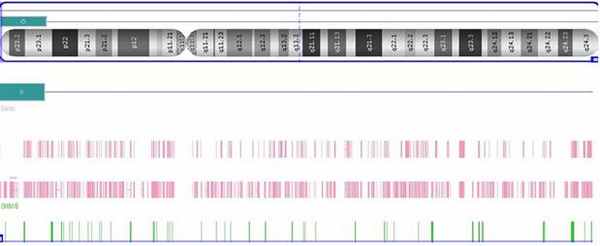
Рис. 2. Мозаичная терминальная делеция, обнаруженная с помощью молекулярного кариотипирования.
Соотношение сигналов пациента и донора при проведении SNP/олигонуклеотидной CGH позволило определить наличие данной делеции только в 48% клеток. Клинические проявления у пациентки частично соответствуют регулярной делеции в хромосомном участке 8p23, при которой наблюдаются микроцефалия, умственная отсталость различной степени тяжести, пороки сердца и врожденная диафрагмальная грыжа [3, 4]. Несмотря на то что у девочки были похожие проявления (легкая степень умственной отсталости, микроцефалия и лицевые дисморфизмы), было также отмечено расстройство аутистического спектра, что нетипично для регулярной делеции в данном участке; также в регулярную делецию, как правило, вовлечен ген GATA4, играющий ключевую роль в развитии сердца, тогда как описываемая делеция его не затронула. Последнее объясняет отсутствие сердечной патологии у девочки. Примечательно, что у данной пациентки локусы, фланкирующие точки разрыва мозаичной делеции, делетированы во всех клетках. Эти локусы соответствовали кластеру генов обонятельного рецептора (OR7E158P, OR7E161P, OR7E160P) и кластеру генов бета-дефенсина (DEFB137, DEFB136, DEFB134). Данные литературы свидетельствуют о том, что рекомбинация кластеров различных семейств генов (включая кластеры генов обонятельного рецептора) участвует в процессах образования хромосомных перестроек [1, 2, 9]. Исходя из проанализированной литературы, мы предположили, что в данном случае неправильная рекомбинация в локусах вышеуказанных генных кластеров явились молекулярной причиной возникновения перестройки хромосомы 8. Следует отметить, что случай мозаичной делеции 8p, выявленный с помощью SNP/олигонуклеотидной CGH и вызванный рекомбинацией генов кластера обонятельных рецепторов, ранее не описывался. Было также проведено кариотипирование и FISH анализ его матери, тридцативосьмилетней женщины, без признаков нарушений развития. Стандартное кариотипирование показало нестабильность по хромосоме Х в 20% клеток (кариотип: 45,X [3]/47,XXX[1]/46,XX[12]). FISH анализ 1000 интерфазных клеток позволил выявить 10,9 % аномальных клеток с одним, двумя, тремя, четырьмя и пятью сигналами на хромосому Х (Xcen(D1XZ1×1)[66]/Xcen(D1XZ1×3)[38]/Xcen(D1XZ1×4)[4]/Xcen(D1XZ1×5)[1]/Xcen(D1X1×2)[891]). FISH анализ 150 метафазных пластинок обнаружил 8% аномальных клеток с одним, двумя, тремя, четырьмя и пятью сигналами соответствующими хромосоме Х (45,Х.ish.Xcen(DXZ1×1)[8]/47,XXХ.ish.Xcen(DXZ1×3)[2]/48,ХXXX.ish.Xcen(DXZ1×4)[1]/49,ХXXXX.ish.Xcen(DXZ1×5)[1]/46,ХX.ish.Xcen(DXZ1×2)[138]).
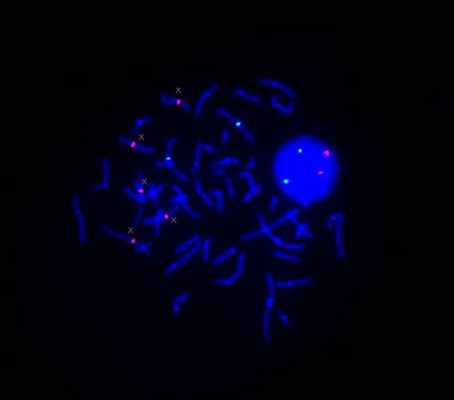
Рис. 3. FISH исследование матери пробанда. Метафазная пластинка. Красным цветом обозначены сигналы, маркирующие хромосому Х, зеленым – контрольную хромосому 3.
Для того чтобы получить более полное представление о роли соматических структурных геномных вариаций при данном нарушении, мы проанализировали 202 пациента с умственной отсталостью, врожденными пороками развития и аутизмом с использованием SNP/олигонуклеотидного array CGH (две платформы array CGH с разрешением 1 и 15 тысяч пн). Малопроцентная мозаичная анеуплоидия, не имеющая ярко-выраженных фенотипических последствий, была обнаружена в 2 случаях (1%) и представляла собой дополнительную хромосому Y в примерно 5% клеток. Мозаичные структурные геномные перестройки, ассоциированные с фенотипическими проявлениями (согласно оригинальной биоинформатической технологии) были обнаружены в 14 случаях (6,9 %) [1].
Заключение
Исследование пациентки 8 лет с микроцефалией, умственной отсталостью, аутизмом и дисморфическими чертами с помощью классического кариотипирования и метода SNP array CGH позволило обнаружить делецию в участке 8p23.3p23.1, а также уточнить ее размеры, геномную локализацию и геннонасыщенность. Кариотипирование и FISH анализ матери пациентки позволили выявить нестабильность хромосомы Х. Полученные результаты позволяют нам сделать предположение о связи между двумя наблюдаемыми аномалиями. Значения, полученные нами для нестабильности хромосомы Х у матери ребенка, находятся на уровне значительно выше пороговых для данной возрастной группы, что позволяет исключить вероятность случайного сочетания двух наблюдаемых нарушений [6, 10]. Таким образом, мы предполагаем наличие связи между хромосомной нестабильностью у матери и структурными перестройками у ребенка. Безусловно, такое предположение нуждается в дополнительном подтверждении и дальнейших исследованиях подобных случаев. Необходимо также отметить тот факт, что механизм, лежащий в основе хромосомной нестабильности у матери в данном случае, неизвестен, а его выявление могло бы идентифицировать взаимосвязь между обнаруженными аномалиями.
Исследование выполнено за счет гранта Российского Научного Фонда (проект №14-15-00411).
Что такое мозаицизм? Соматический мозаицизм и мозаицизм по половым клеткам
Что такое мозаицизм? Соматический мозаицизм и мозаицизм по половым клеткам
Мозаицизм — присутствие в организме или ткани по крайней мере двух генетически отличающихся клеточных линий, производных от одной зиготы. Хотя мы имеем обыкновение считать, что при формировании клеток они получают одинаковый набор генов и хромосом, это упрощенное представление. Мы уже ввели понятие мозаицизма, вызванного инактивацией Х-хромосомы, формирующей две различных популяции соматических клеток у женщин, с активной отцовской или материнский Х-хромосомой.
Чаще мутации, возникающие в единственной клетке во внутриутробной или послеродовой жизни, могут вызывать линии клеток, генетически отличающихся от зиготы, поскольку однажды произошедшая мутация может передаваться всем потомкам клетки. Мозаицизм по числовым или структурным аномалиям хромосом — клинически важный феномен, а соматические мутации признают основными причинами многих типов опухолей.
Мозаицизм по мутациям в одном гене, в соматических или половых клетках, объясняет множество необычных клинических наблюдений, например сегментный нейрофиброматоз, когда кожные проявления появляются не по всему телу, а участками, или повторное рождение у здоровых родителей двух или более детей с несовершенным остеогенезом, высокопенетрантной аутосомно-доминантной болезнью.
Популяция клеток, несущих мутацию у мозаичного пациента, теоретически может присутствовать в некоторых тканях тела, но не в гаметах (чистый соматический мозаицизм), ограничиваться только гаметами (чистый половой мозаицизм) или присутствовать как в соматических, так и в половых клетках, в зависимости от того, когда произошла мутация в ходе эмбрионального развития. Включает ли мозаицизм только соматические ткани, только половые клетки или и те, и другие, зависит от времени появления мутации в эмбриогенезе — до или после разделения половых и соматических клеток.
Если до, то и соматические, и половые клетки будут мозаичными, а мутация может передаваться потомству и проявляться соматически в мозаичной форме. Мутацию, произошедшую позже, обнаруживают только в половых клетках или части соматических тканей. Таким образом, например, если мутация произошла в предшественнике половых клеток, часть гамет будет нести мутацию. До мейоза половые клетки проходят около 30 митотических делений у женщин и несколько сотен у мужчин, допуская массу возможностей для мутаций, происходящих в течение митотических этапов развития гаметы.
Выявление мозаицизма по мутации только в половых или соматических клетках может быть трудным, поскольку отсутствие мутации в клетках из легкодоступных соматических тканей (например, лейкоцитов периферической крови, кожи или клеток слизистой оболочки рта) не доказывает, что мутация не присутствует где-нибудь еще, включая половые клетки. Охарактеризовать распространенность соматического мозаицизма еще труднее, если мутантный аллель у мозаичного эмбриона встречается исключительно во внезародышевых тканях (т.е. в плаценте) и не присутствует в самом эмбрионе.
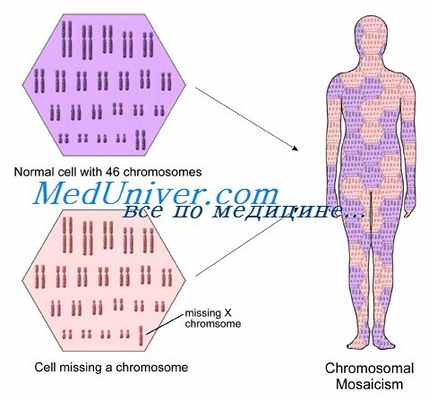
Соматический мозаицизм
Мутации, влияющие на морфогенез и проявляющиеся в ходе эмбрионального развития, могут быть обнаружены как сегментные или пятнистые аномалии, в зависимости от этапа, в котором произошла мутация, и происхождения соматической клетки. Например, нейрофиброматоз I типа иногда может проявляться как сегментный, влияя только на одну часть тела. Сегментный нейрофиброматоз I типа вызван мозаицизмом по мутации, произошедшей после зачатия. В таких случаях родители пациента здоровы, но если он (или она) рожает больного ребенка, фенотип у ребенка полный, т.е. не сегментный.
В таких случаях мутация находится в гаметах пациента и, по-видимому, произошла до разделения половой и соматической линии клеток.
Мозаицизм по половым клеткам
Существуют, тем не менее, хорошо подтвержденные примеры, когда фенотипически здоровые родители с отрицательными тестами на носительство имеют более чем одного ребенка с высокопенетрантным аутосомно-доминантным или Х-сцепленным заболеванием. Такие необычные родословные могут объясняться половым мозаицизмом. Половой мозаицизм хорошо подтвержден почти в 6% летальных форм аутосомно-доминантного несовершенного остеогенеза, когда мутации в гене коллагена I типа приводят к формированию аномального коллагена, ломким костям и частым переломам.
Родословные, которые могут объясняться половым мозаицизмом, также отмечены при нескольких других заболеваниях, например гемофилии А, гемофилии В и мышечной дистрофии Дюшенна, но очень редко встречаются при других доминантных болезнях, например ахондроплазии. Точно измерить частоту полового мозаицизма сложно, но приблизительно считают, что самая высокая встречаемость отмечена при мышечной дистрофии Дюшенна, при которой до 15% матерей в изолированных случаях не имеют подтверждения мутации в их соматических тканях при наличии мутации в половых клетках.
Теперь, когда феномен полового мозаицизма признан, генетики и генетические консультанты отдают себе отчет о потенциальной погрешности прогноза, что специфический аутосомно-доминантный или Х-сцепленный фенотип, кажущийся новой мутацией, имеет незначительный риск повторения в потомстве. Очевидно, для болезней с доказанной возможностью полового мозаицизма фенотипически здоровым родителям ребенка, у которых предположительно болезнь возникла вследствие новой мутации, нужно сообщать, что риск повторения не настолько незначительный.
Кроме того, родители ребенка с любым аутосомно-доминантным или Х-сцепленным заболеванием имеют риск повторения 3-4%, даже если половой мозаицизм не доказан и если известно, что они не носители мутации. Таким парам следует предложить доступную пренатальную диагностику. Точный риск повторения оценить трудно, поскольку он зависит от доли мутантных гамет.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Геномное многообразие: мозаицизм

Как камни в сложной мозаике, клетки нашего организма могут генетически различаться. Изначально развиваясь из одной общей зиготы, клетки могут претерпевать изменения во время последовательных этапов онтогенеза, то есть подвергаться различным постзиготическим мутациям, которые наследуют все дочерние клетки. Это явление известно как мозаицизм.
Многоклеточный организм, в структуре которого присутствуют генетически разнородные популяции клеток, произошедшие из общей зиготы, называется мозаик. Мозаицизм может существовать как в соматических клетках, так и в клетках зародышевой линии (рис. 1) [1].

Рисунок 1 | Период возникновения постзиготической мутации влияет на распределение мутантных клеток в организме.
А) Мутации, возникающие во время первого митоза, приводят к поражению примерно половины клеток;
B) Мутации, возникающие до определения лево-право висцеральной асимметрии, могут затрагивать обе стороны индивидуума;
C) Мутации, возникающие после дифференциации правой и левой половин организма, могут быть ограничены только одной стороной индивидуума;
D) Мутации, возникающие после дифференцировки первичных половых клеток, будут отсутствовать в соматических тканях. Молекулярные исследования для выявления такого гонадного мозаицизма должны включать непосредственное изучение зародышевых клеток [1].
Если мозаицизм встречается только в популяции соматических клеток, фенотипический эффект будет зависеть от размера популяции мозаичных клеток и сроков возникновения мутаций. Такой признак не будет передан потомству[1].

Рисунок 2 | Фенотипические проявления мозаичных мутаций.
А) Воспалительные невусы, поражающие левую половину тела 1-месячного ребенка с синдромом CHILD (congenital hemidysplasia with ichthyosiform erythroderma and limb defects, врожденная гемидисплазия с ихтиоподобной эритродермией и дефектами конечностей);
B) Церебриформные соединительнотканные невусы на подошвенной поверхности стопы у 11-летнего ребенка с синдромом Протея;
C) Аксиальное Т2-взвешенное изображение: увеличение левого полушария головного мозга у новорожденного с гемимегалэнцефалией;
D) Гиперпигментация по линиям Блашко (отображают миграцию и пролиферацию эпидермальных клеток во время развития эмбриона, невидимы при отсутствии патологии, проявляются в виде характерного для каждой области тела человека рисунка при некоторых типах дерматозов) у индивидуума с линейным и завитым типами невоидного гипермеланоза [1].
А если мозаицизм встречается только в популяции клеток зародышевой линии, индивидуум не будет иметь фенотипических проявлений, но его потомки унаследуют данный признак. Также возможно, что в случае индукции мозаицизма в раннем онтогенезе как соматические, так и клетки зародышевой линии будут мозаичны [2].
Существует множество возможных механизмов развития мозаицизма: соматические мутации, эпигенетические изменения, нарушения структуры и/или количества хромосом [1].
Менделевские беспорядки и мозаика
Моногенные (или менделирующие — наследуемые по законам Менделя) заболевания обусловлены генетическими нарушениями, вызванными изменениями в одном гене. Если для экспрессии признака необходима только одна копия гена (1 аллель), этот признак является доминирующим, если 2 копии гена (2 аллели) — рецессивным. Исключением являются Х-сцепленные заболевания. Поскольку у мужчин отсутствуют парные аллели, способные компенсировать влияние аллелей на Х-хромосоме, аллель единственной X-хромосомы экспрессируется (проявляется фенотипически), даже если признак является рецессивным [2].
В таблице 1 приведены моногенные заболевания, которые связаны с соматическим мозаицизмом [3, 4].

Неменделевские расстройства, связанные с соматическим мозаицизмом
Канцерогенез рассматривается как многоступенчатый процесс, во время которого клетки постепенно накапливают мутации в генах-супрессорах опухолей и онкогенах, что в конечном итоге приводит к безудержному росту и пролиферации клеток. Популяции опухолевых клеток образуют гетерогенный мозаичный участок, который отличается от соседних популяций неопухолевых клеток. Мозаицизм в злокачественно-трансформированных клетках может быть обусловлен как генетическими, так и эпигенетическими изменениями [4].
Неменделевские расстройства, связанные с митохондриальным мозаицизмом
Помимо ядерной ДНК, в митохондриях наших клеток также присутствует ДНК. Каждая митохондрия содержит десятки копий собственного кольцевого генома, а большая часть клеток человека в свою очередь содержит многочисленные митохондрии. Таким образом, в клетках организма находится несколько тысяч копий митохондриального генома. В митохондриальном геноме наблюдается более высокая частота мутаций. При делении клетки ее митохондрии распределяются по двум дочерним клеткам. Но митохондриальная сегрегация (расхождение) происходит случайным образом и не так хорошо организована, как строго регулируемый процесс митотической сегрегации хромосом. Следовательно, клетки будут получать похожие, но не идентичные популяции митохондриальной ДНК [5]. Митохондриальные мутации приводят к значительным изменениям клеточного метаболизма, особенно в тех тканях, которые имеют высокие энергетические потребности (нервная, поперечно-полосатая и гладкая мускулатура, сетчатка) [5].
Хромосомный мозаицизм
Хромосомный мозаицизм обусловлен изменениями количества или структуры хромосом в данной клеточной популяции. Только три формы аутосомной трисомии совместимы с жизнью. Это трисомия 13 (синдром Патау), 18 (синдром Эдвардса) и 21 (синдром Дауна). При всех этих заболеваниях отмечены мозаичные формы. В этом случае фенотипические проявления болезни несколько мягче, так как численность популяции трисомных клеток организма меньше [2].
Постзиготические мутации охватывают различные участки генома в диапазоне от единичных нуклеотидов до целых хромосом. Фенотипические последствия мозаицизма зависят от многих факторов, таких как время возникновения мутации в онтогенетическом развитии, тип и размер вовлеченной популяции клеток и патофизиологический эффект мутации.
Мозаицизм
С появлением новых технологий для проведения ПГТ-А, таких как aCGH и NGS, стало возможным детектировать количество копий каждой хромосомы. Благодаря этому теперь есть возможность выявлять эмбриональный мозаицизм. Эмбриональный мозаицизм — это явление, характеризующееся наличием двух или более генетически различных клеточных линий (клонов клеток), обычно одна с хромосомной аномалией, а другая — с нормальным хромосомным набором.
Все клетки эмбриона происходят из одной оплодотворенной клетки-зиготы, но не все из них могут в дальнейшем иметь одинаковый набор хромосом. Различия в хромосомном наборе среди клеток обусловлены митотическими ошибками (рис.1),
которые могут возникнуть в процессе развития эмбриона. В зависимости от того на каком этапе постзиготического развития эти ошибки возникли, мозаицизм может затрагивать разные части бластоцисты.
Для исследования ПГТ-А проводят биопсию 5-10 клеток трофэктодермы на стадии бластоцисты, в то время как внутриклеточная масса (ВКМ) остается нетронутой. В некоторых случаях эмбрионального мозаицизма в процессе оценки конкретного биоптата могут возникнуть ошибки. Например, при биопсии эмбриона с мозаицизмом в клетках ВКМ, клетки трофэктодермы будут всегда отличаться, что приведет к неправильному результату. При биопсии эмбриона с мозаицизмом ВКМ/ТЭ — результат исследования будет отражать только статус трофэктодермы (эуплоид/анеуплоид), когда ВКМ будет содержать противоположный клон клеток (анеуплоид/эуплоид).
Даже у эмбрионов с мозаичной трофэктодермой обнаружение мозаицизма будет зависеть от места биопсии в соответствии с различным распределением эуплоидных и анеуплоидных клеток. Поэтому при детекции мозаицизма в клетках трофэктодермы, процент мозаицизма в конкретной биопсии не может быть экстраполирован на весь эмбрион. Следовательно, результат, полученный при конкретной биопсии, следует рассматривать как относящуюся только к самой биопсии.
На стадии бластоцисты было описано несколько видов мозаицизма клеток (рис. 2):
1. Полный мозаицизм — мозаицизм присутствует во внутриклеточной массе и в клетках трофэктодермы.
2. Мозаицизм ВКМ — мозаицизм присутствует только во внутриклеточной массе. Такой мозаицизм невозможно детектировать.
3. Мозаицизм трофэктодермы (ТЭ) — мозаицизм присутствует только в клетках трофэктодермы.
4. Мозаицизм ВКМ/ТЭ (тип 1) — клетки трофэктодермы эуплоидные, а клетки ВКМ — анеуплоидные. Такой мозаицизм невозможно детектировать.
5. Мозаицизм ВКМ/ТЭ (тип 2) — клетки ВКМ эуплоидные, а клетки трофэктодермы — анеуплоидные. Такой мозаицизм невозможно детектировать.
Научные исследования показывают, что при проведении нескольких биопсий одного и того же эмбриона уровень конкордантности мозаицизма достигает 95-100 % (Johnson DS, Cinnioglu C, Ross R, Filby A, Gemelos G, Hill M, et al. Comprehensive analysis of karyotypic mosaicism between trophectoderm and innercell mass. Mol Hum Reprod, 2010) . Кроме того, исследователи также проанализировали ВКМ одних и тех же эмбрионов, чтобы оценить частоту несоответствий между клеточными линиями. TЭ и ВКМ при мозаицизме различаются всего лишь в 3–4% (Capalbo A, Wright G, Elliott T, Ubaldi FM, Rienzi L, Nagy ZP. FISH reanalysis of inner cell mass and trophectoderm samples of previously array-CGH screened blastocysts shows high accuracy of diagnosis and no major diagnostic impact of mosaicism at the blastocyst stage. Hum Repro, 2013) . Таким образом, биопсия трофэктодермы считается хорошим методом диагностики мозаицизма эмбриона.
Благодаря методу NGS появилась возможность более аккуратно детектировать мозаицизм в клетках трофэктодермы, что предоставляет возможность принять решение о переносе мозаичных эмбрионов при отсутствии эуплоидных. Следует отметить, что исследований, посвященных клиническим исходам после переноса мозаичных эмбрионов, мало.
Для того чтобы оценить реальную частоту и возможные последствия переноса мозаичного эмбриона, следует оценивать результаты ПГТ-А с учетом трех составляющих: качество эмбриона; количество проанализированных клеток; частота имплантации, выкидышей и живорождение для мозаицизма по данной конкретной хромосоме.
Не так давно было проведено исследование ( Spinella, F, Fiorentino, F, Biricik, A, Bono, S, Ruberti, A, Cotroneo, E, Baldi, M, Cursio, E, Minasi MG, Greco E. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril, 2018) , в котором перенос мозаичных эмбрионов осуществляли пациентам, которые не смогли получить эуплоидные эмбрионы в программе ВРТ. Всего было проведено 77 эмбриотрансфера, из них 44 переноса — эмбрионы с процентом мозаицизма ниже 50%, 33 переноса – эмбрионы с процентом мозаицизма выше 50 %. Данные показывают, что практически половина (48.1%) переносов привела к биохимической беременности, 38.5% привело к имплантации, одна треть (30.8%) переносов мозаичных эмбрионов привело к живорождению.
Однако, если сравнивать группы эуполидных и мозачных эмбрионов по исходам, данные исследования говорят о большем проценте имплантации (54.6% vs 38.5%), беременности (46.4% vs 30.0%) и живорождения (46.6% vs 30.8%) при переносе эуплоидных эмбрионов, в отличие от мозаичных, что вполне логично. Интересно, что при переносе эмбрионов с меньшим процентом мозаицизма ( < 50%), такие показатели как биохимическая беременность, индекс имплантации и коэффициент живорождения были выше, чем в случае, чем с высоким процентом мозаицизма (>50%), что может говорить о том, что в ряде случаев низкоуровневый мозаицизм может быть вызван артефактами амплификации (см. «Технические особенности») . (Spinella, F, Fiorentino, F, Biricik, A, Bono, S, Ruberti, A, Cotroneo, E, Baldi, M, Cursio, E, Minasi MG, Greco E. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril, 2018)
В другом похожем исследовании (Victor, AR, Tyndall, JC, Brake, AJ, Lepkowsky, LT, Murphy AE, Griffin, DK, McCoy RC, Barnes, FL, Zouves, CG, Viotti, M. One hundred mosaic embryos transferred prospectively in a single clinic: exploring when and why they result in healthy pregnancies. Fertil Steril, 2019) было перенесено 100 мозаичных эмбрионов с различными хромосомными нарушениями: мозаичные моносомии/трисомии, сегментарные нарушения и мозаично-анеуплоидные эмбрионы (2 и более хромосом), процент анеуплоидных клеток составлял от 20 до 80%. Данные показали, что мозаичные эмбрионы с одиночными сегментарными нарушениями показали лучшие результаты в отношении достижения биохимической беременности (57.6% vs 49.0%) и имплантации (45.5% vs 38.0%), чем все остальные группы эмбрионов. Однако к переносу эмбрионов с мозаичными сегментарными нарушениями следует относиться с особой осторожностью ввиду более высокого риска врожденных пороков развития, ассоциированных с живорождением.
Уровень мозаицизма, полученный в ходе ПГТ-А конкретного биоптата как решающий критерий приоритетности переноса мозаичного эмбриона использовать всё-таки не рекомендовано. Важную роль играет характер хромосомного нарушения: полная хромосома или ее сегмент, а также то, какая хромосома была задействована.
Следует также отметить, что низкий или высокий процент мозаицизма в ходе ПГТ-А может быть следствием шумного профиля из-за различных технических причин, что может привести к ложным результатам (Preimplantation Genetic Diagnosis International Society. “PGDIS POSITION STATEMENT ON THE TRANSFER OF MOSAIC EMBRYOS IN PREIMPLANTATION GANETIC TESTING FOR ANEUPLOIDY (PGT-A).” PGDIS, 2019) . Такие причины могут возникнуть на этапе биопсии трофэктодермы эмбриона: некачественная биопсия, при которой отбирается слишком мало клеток с повреждением или частичным разрушением и потерей клеточной ДНК, что влияет на профили хромосом. Также на этапе генетического анализа: при построении библиотеки низкое качество исходной ДНК (неравномерная амплификации всего генома) может привести к недостаточному или избыточному представлению хромосом (мозаицизм всей хромосомы) или хромосомных регионов (сегментарный мозаицизм). Алгоритмы биоинформатического анализа, используемые при нормализации бинов картирования хромосом, также могут потенциально изменять профили. В нашей лаборатории используется усовершенствованный биоинформатический алгоритм, кроме того, лаборатория отслеживает процент мозаичных эмбрионов как среди всех полученных результатов, так и для конкретных эмбриологов.
Пациенты, рассматривающие возможность переноса мозаичных эмбрионов, должны пройти генетическое консультирование, изучив возможные риски и исходы, связанные с переносом таких эмбрионов (8). На консультации пациенту должно быть разъяснено, что в случае достижения беременности при переносе мозаичного эмбриона, рекомендовано подтверждение кариотипа плода инвазивной пренатальной диагностикой, предпочтительно с помощью амниоцентеза.
Международное общество преимплантационной генетической диагностики (PGDIS) опубликовало обновленные рекомендации для специалистов в 2019 году. Основные положения:
1. Специалистам (репродуктологам, эмбриологам, генетикам) следует информировать пациентов о том, что генетический тест, в данном случае ПГТ-А, основанный на отборе образца одной или небольшого количества клеток эмбриона, не может быть на 100% точным, учитывая технические и биологические факторы, включая мозаицизм хромосом.
2. При переносе мозаичных эмбрионов, пациентам необходимо разъяснить все потенциальные риски, о которых будет указано в форме информированного согласия.
3. Перенос эуплоидных эмбрионов должен быть приоритетным в сравнении с переносом мозаичных эмбрионов.
4. В случае рассмотрения возможности переноса мозаичного эмбриона следует обсудить следующие варианты с пациентом:
- инициирование следующего цикла ЭКО с ПГТ-А для увеличения вероятности получения эуплоидного эмбриона для переноса;
- Перенос бластоцисты с мозаицизмом более низкого уровня после соответствующей консультации.
Специалистам следует настоятельно рекомендовать пациентам пренатальную диагностику плода и плаценты любой установленной беременности после ПГТ-А, особенно после переноса мозаичного эмбриона. Анализ в ходе амниоцентеза (с 14 недели) в настоящее время считается наиболее репрезентативным для изучения хромосомного статуса плода. Из более ранних исследований (с 10 недели) можно также рассмотреть НИПТ, который анализирует количество копий всех 24 хромосом у плода — стандартные 5-хромосомные тесты НИПТ для хромосом 21, 18, 13 X и Y могут не подходить. Также должно быть использовано ультразвуковое исследование для выявления аномалий плода, в то время как скрининг PAPP-A и ультразвуковая допплерография также могут быть использованы для выявления нарушений функции плаценты.
1. Capalbo A, Wright G, Elliott T, Ubaldi FM, Rienzi L, Nagy ZP. FISH reanalysis of inner cell mass and trophectoderm samples of previously array-CGH screened blastocysts shows high accuracy of diagnosis and no major diagnostic impact of mosaicism at the blastocyst stage. Hum Reprod 2013; 28.
2. Johnson DS, Cinnioglu C, Ross R, Filby A, Gemelos G, Hill M, et al. Comprehensive analysis of karyotypic mosaicism between trophectoderm and inner cell mass. Mol Hum Reprod 2010; 16:944–9.
3. Martinez MC, Mendez C, Ferro J, Nicolas M, Serra V, Landeras J. Cytogenetic analysis of early nonviable pregnancies after assisted reproduction treatment. Fertil Steril 2010; 93:289–92.
4. Hassold T. Mosaic trisomies in human spontaneous abortions. Hum Genet 1982; 61:31–5.
5. Maria Vera-Rodriguez, Ph.D. and Carmen Rubio, Ph.D. Assessing the true incidence of mosaicism in preimplantation embryos . Fertil Steril, 2017; 107, 5, 0015-0282
6. Besser AG, Mounts EL. Counselling considerations for chromosomal mosaicism detected by preimplantation genetic screening. Reprod Biomed Online 2017; 34:369–74.
7. Francesca Spinella, Ph.D., Francesco Fiorentino, Ph.D., Anil Biricik, Ph.D., Sara Bono, Ph.D.,Alessandra Ruberti, B.Sc., Ettore Cotroneo, Ph.D., Marina Baldi, Ph.D., Elisabetta Cursio, B.Sc., Maria Giulia Minasi, B.Sc., and Ermanno Greco, M.D. Extent of chromosomal mosaicism influences the clinical outcome of in vitro fertilization treatments. Fertil Steril, 2017, 0015-0282.
8. Preimplantation Genetic Diagnosis International Society. “PGDIS POSITION STATEMENT ON THE TRANSFER OF MOSAIC EMBRYOS IN PREIMPLANTATION GANETIC TESTING FOR ANEUPLOIDY (PGT-A).” PGDIS, 27, May 2019
Научная электронная библиотека

1) хромосомный мозаицизм часто встречается в клетках плода человека;
2) мозаицизм может быть ограничен экстраэмбриональными тканями (плацента) или эмбриональными тканями (центральная нервная система и ткани яичника).
Вполне резонно предположить, что последнее – один из основных источников тканеспецифичной патологии, либо полисистемных заболеваний (включая те, что возникают из-за сбоев в мейозе), что было показано (Hulten et аl., 2008). Для понимания того, есть ли у хромосомного мозаицизма возможность способствовать межклеточному разнообразию, следует обратиться к исследованиям, проводимым для оценки реального состояния численной хромосомной вариабельности в здоровых тканях человека (Kаlоusek, Dill, 1983). Следует отметить, что почти во всех тканях при тщательном молекулярно-цитогенетическом анализе удаётся обнаружить анеуплоидные клетки. Таким образом, можно преодолеть основные трудности в исследованиях, нацеленных на оценку воздействия хромосомного мозаицизма, определив пороговый непатогенный уровень анеуплоидии в данной ткани (Yurov et al., 2007). Таким образом, ассоциация между хромосомным мозаицизмом и изменениями физиологии клеток и тканей требует тщательного контроля путём проверки клеток различных тканей здоровых индивидуумов.
При фокусировании на заболеваниях, ассоциированных с хромосомным мозаицизмом, можно отметить весьма широкий спектр патологии, связанной с этим типом соматических вариаций генома, от хромосомных синдромов до сложных нейропсихических и иммунных заболеваний. Хультен с коллегами добавили анеуплоидию мейотического происхождения в «список заболеваний хромосомного мозаицизма» (Hulten et аl.,
2008). Более того, вполне резонно предположить, что самой обычной генетической причиной пренатальной смерти может быть хромосомный мозаицизм. Можно прийти к заключению, что ограниченный определённой тканью мозаицизм – причина дисфункции этой ткани, как это было продемонстрировано на примере заболеваний головного мозга, на мозге плодов и тканях яичника (Юров и др., 2004; Yurov et al., 2001; Iourov et al., 2006 a, б). Следовательно, при поиске роли хромосомного мозаицизма в патологии нужно напрямую изучать ткани, подвергшиеся патологическим изменениям. К сожалению, из-за ограниченной доступности большинства тканей человека для обширных генетических исследований и сложности молекулярно-цитогенетических анализов, исследования анеуплоидии низкого уровня редки. В настоящее время только нервная ткань и ткани яичника были обследованы с помощью молекулярно-цитогенетических технологий высокого уровня разрешения. Тем не менее, ткани (типы клеток), обычно используемые для цитогенетических исследований (лимфоциты крови, фибробласты кожи, ворсины хориона), также могут быть пригодны для подтверждения гипотезы о том, что хромосомный мозаицизм – возможный генетический механизм, лежащий в основе различных заболеваний человека. Более того, смежные исследования пролили свет на проблему природы некоторых моногенных заболеваний, которые отмечены у лиц мужского пола, несмотря на их летальность (синдром Ретта и др.) (Ворсанова и др., 1998; 2013 а, б, в; 2014 а, б; 2015; Юров и др., 2004; Vorsanova et al., 1996; 2004; 2010 а, б; Iourov et al., 2013 а, в; 2015 а, б, в). Достижения в изучении хромосомного
мозаицизма велики, но всё-таки это недостаточно изученный феномен. Всё же, несмотря на многие задачи, которые ещё предстоит решить в этой области исследований, уже можно сделать определённые выводы: будучи патологическим состоянием, анеуплоидия вызывает пренатальную смерть и/или хромосомные синдромы, ассоциированные с тяжёлой задержкой развития, плохо совместимой с жизнью. При развитии центральной нервной системы анеуплоидия должна быть элиминирована, или же возникает патологическое состояние (Iоurоv et аl., 2008 а, в). Следовательно, в организме человека, действительно, идёт процесс «антианеуплоидизации», необходимый для того, чтобы зародыш развился, а затем нормально существовал в постнатальном периоде. Но, вероятно, антианеуплоидизация замедляется с возрастом, что, возможно, ассоциировано со старением и малигнизацией. Эти предположения поддерживаются результатами последних исследований старения и канцерогенеза (Duesberg, 2007; Russel et аl., 2007; Yurov et al., 2009; Yurov, Iourov, 2010). Таким образом, развитие анеуплоидизации есть своего рода каскад обширных процессов, ведущих к патологическому состоянию, которым противостоит противоположный процесс, названный «антианеуплоидизацией». И наоборот, баланс между анеуплоидизацией и антианеуплоидизацией помогает организму нормально развиваться до тех пор, пока не замедляется антианеуплоидизация. Предполагается, что анеуплоидизация ткани – ключевой процесс возникновения дисфункции. Будучи ограниченной пределами какой-либо специфической клеточной популяции, она может вызывать образование опухолей, тогда как, если вся ткань подвержена анеуплоидии, то эта ткань должна подвергнуться дегенерации. Это частично подтверждается данными исследований заболеваний головного мозга (Mоsсh et аl., 2007). Говоря о мозаицизме как причине патологических состояний, в том числе психических заболеваний, нужно упомянуть и о мозаичных структурных перестройках хромосом (Hаlder et аl., 2008; Mаnоlаkоs et аl., 2008), среди которых нередки малые сверхчисленные маркерные хромосомы, встречающиеся, вероятно, гораздо чаще, чем считалось ранее. Говоря о таких маркерных хромосомах, дополнительно нужно отметить, что мозаицизм может быть «скрытым» и «динамическим» (Fiсkelsсher et аl., 2007; Sаntоs et аl., 2007; Iоurоv et аl.,
2008 б, в, г). Термин «скрытый» мозаицизм существует ни одно десятилетие, с тех пор как начались молекулярно-цитогенетические диагностические исследования. «Скрытым» мозаицизм называют так потому, что в подобных случаях только дополнительные молекулярно-цитогенетические исследования могут подтвердить его после обычного цитогенетического анализа (Ворсанова, 1991; Ворсанова и др., 1989; 1991). «Динамическим» мозаицизмом называют случаи возникновения нового генетического дисбаланса в уже аномальной клетке либо мозаицизм возникает благодаря «особенностям поведения» перестроенной хромосомы. В настоящее время для изучения этих двух типов хромосомного мозаицизма требуются молекулярно-цитогенетические технологии высокого разрешения, такие как subсenM-FISH или многоцветовое окрашивание (МСВ) (Fiсkelsсher et аl., 2007; Sаntоs et аl., 2007; Iоurоv et аl., 2008 а, б, в, г). Вообще изучение хромосомного мозаицизма на нынешнем уровне развития науки без этих технологий представляется практически невозможным. В свете вышесказанного важно упомянуть исследования с применением аrrаy СGH. Такие молекулярно-цитогенетические технологии обладают огромными возможностями для определения точек разрыва в хромосомах, идентификации новых микроделеционных синдромов и обнаружения вариаций генома в норме и патологии (Jаquemоnt et аl., 2006; Iоurоv et аl., 2008 а, б, г). Таким образом,
1) межклеточные вариации, проявляющиеся в виде хромосомного мозаицизма, вероятно, участвуют в формировании генетического разнообразия;
2) многие патологические состояния ассоциированы с хромосомным мозаицизмом;
3) хромосомный мозаицизм – всё ещё недостаточно принимаемый во внимание биомедицинский феномен, требующий дальнейших исследований;
4) современная молекулярная цитогенетика обладает достаточными технологиями для определения роли хромосомного мозаицизма в развитии различных нарушений психического развития.
Самые ранние цитогенетические исследования, проводившиеся среди новорождённых, показали, что анеуплоидия бывает только по 3 из 22 аутосом, причём наблюдалась только трисомия, а моносомии не было вообще. Хотя методология цитогенетических исследований с тех пор значительно прогрессировала, результаты первых работ оставались относительно неизменными. Наиболее частой трисомией у новорождённых является трисомия хромосомы 21, которая встречается у 1 из 650–830 живорождённых. Другие трисомии новорождённых включают в себя трисомию хромосомы 18, или синдром Эдвардса (около 1:7500 живорождённых), трисомию хромосомы 13, или синдром Патау (1:22700), а также очень редкие случаи трисомии 22 и трисомии 8, все мозаичные. Вскоре после открытия этих хромосомных анеуплоидных заболеваний цитогенетики обнаружили, что встречаемость анеуплоидии аутосом у человека не ограничивается хромосомами 13, 18 и 21, а может быть и по всем остальным аутосомам с клиническими последствиями, несовместимыми с жизнью. Для проверки этой гипотезы были инициированы исследования по определению наличия анеуплоидии аутосом в тканях спонтанных абортусов (Ворсанова и др., 2010; Vorsanova et al., 2003; 2005; 2010 в, г). Хромосомные анализы таких тканей (в I триместре) показали наличие трисомий с участием почти всех аутосом. Интересно, что трисомия хромосомы 16 встречалась почти в трети абортусов с трисомией
аутосом в I-м триместре беременности. Также часто наблюдались в клетках этих тканей трисомии хромосом 2, 7, 8, 18 и всех акроцентрических хромосом. Авторы объясняли отличия между частотами трисомий действительными различиями в предрасположенности хромосом к аномальной сегрегации или селекции, отражающей собой выживаемость при дисбалансе разных хромосом; либо же обоими этими факторами. Для того чтобы дифференцировать эти два возможных объяснения, данные об анеуплоидиях стали анализировать по гаметам.
В наиболее ранних исследованиях анеуплоидии гамет изучали метафазные хромосомы ооцитов или сперматозоидов. Исследователи применяли в этих экспериментах методы высокого разрешения (первично FISH, но потом ещё и СGH). Результаты этих исследований показали, что у человека наблюдается относительно высокий уровень анеуплоидии гамет по сравнению с другими видами. Более того, частота анеуплоидии в сперматозоидах, как было показано, проявляется разными хромосомами, что заставляет предположить, что хотя бы некоторая часть вариаций (анеуплоидий) отражает действительные различия аномальной сегрегации аутосом, а не ограничена только селективным отбором. Половые различия также были отмечены по частоте анеуплоидии аутосом; в ооцитах анеуплоидия встречалась чаще, чем в сперматозоидах. Однако технические проблемы ухудшили возможности исследователей установить уровень аутосомной анеуплоидии различных хромосом в ооцитах. Одним из факторов, который, как полагают, повлиял на повышенную частоту анеуплоидии в ооцитах по сравнению со сперматозоидами, стали способы оценки. Большинство ооцитов, доступных для исследований, были те, что считались непригодными для процедуры искусственного оплодотворения (например, IVF (in vitrо оплодотворение), что вело к отклонению результатов, связанных с материнским возрастом либо с морфологическими аномалиями. Однако стоит отметить, что исследования неродственных человеку млекопитающих, не ограниченные этими отклонениями оценки, также показали заметное увеличение частоты анеуплоидии в ооцитах по сравнению со сперматоцитами. Этиологические факторы, которые сформулированы как влияющие на повышение уровня анеуплоидии в оогенезе включают в себя:
1) нарушение мейотического деления в профазе I, когда деление начинается пренатально, но не завершается до овуляции, что происходит десятилетия спустя;
2) различия в происхождении ошибок в мейозе у мужчин по сравнению с женщинами;
3) различия в частоте и локализации мейотических рекомбинаций на хромосомах;
4) эпигенетические различия в реакции на воздействия окружающей среды и стрессорные факторы.
Читайте также:
