Системные антибиотики в ветеринарии. Профилактика появления антибиотикоустойчивых микроорганизмов
Добавил пользователь Alex Обновлено: 28.01.2026
Антибиотики в ветеринарии. Применение антибиотиков при гнойных заболеваниях
К настоящему времени установлено, что необоснованное применение антибиотиков, несмотря на их исключительное терапевтическое и профилактическое значение, приносит больше вреда, чем пользы. Так, длительное применение антибиотиков внутрь может привести к дисбактериозу в желудочно-кишечном тракте, особенно у рогатого скота, и возникновению устойчивых микробов. Безусловным показанием к их применению являются: прежде всего сепсис; закрытые гнойно-некротические очаги, сопровождающиеся выраженными признаками гнойно-резорбтивной лихорадки, а также инфекционные поражения анатомических полостей; анаэробная инфекция; актиномикоз и некоторые другие грибные инфекции.
Раннее применение антибиотиков с учетом чувствительности к ним возбудителя инфекции позволяет достигнуть высокой терапевтической эффективности. Она еще более повышается, если предварительно провести хирургическую обработку раны и дренирование ее, а также аспирацию гноя из закрытых полостей и тщательное промывание их. Эффективность антибиотика значительно возрастает, если внутримышечно ввести 0,5%-ный продигиозан (мелким животным 10—15 мкг, крупным 250—300 мкг), который активирует неспецифический и специфический иммунитеты и образование интерферона. Вводить антибиотики следует тем дольше, чем тяжелее инфекционный процесс.
Оптимальная концентрация антибиотиков в инфицированном очаге достигается при введении их в регионарные артерии. Однако нужно иметь в виду, что слишком высокая концентрация антибиотиков в организме, особенно при длительном применении, угнетает тканевое дыхание, затормаживает репаративные процессы и снижает естественный иммунитет. Недопустимо вводить заниженные дозы антибиотиков, так как это способствует появлению устойчивых рас микробов. Длительное применение какого-либо антибиотика или сочетаний их может способствовать развитию суперинфекции.
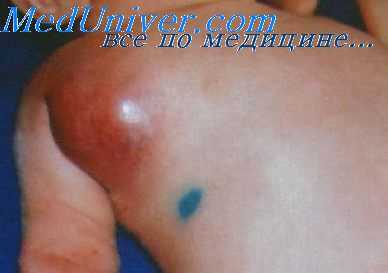
Чтобы не допустить этого, следует менять антибиотики через 5—7 дней и более с учетом микробиологического контроля перед их сменой. При стафилококковой инфекции и неизвестном возбудителе целесообразно применять полусинтетические пенициллины (оксациллин или метициллин, фузидин) с антибиотиком, действующим на грамотрицательную флору (ампициллин, мономицин, канамицин, гентамицин). Наиболее активными антибиотиками по отношению к синегнойной палочке являются полимексин, канамицин, особенно гентамицин и карбенициллин и их сочетания. При местной и общей инфекции, вызванной кишечной палочкой и протеем, более эффективными являются комбинации ампициллина с левомицетином, канамицином или колистином.
Местное применение антибиотиков осуществляется путем орошений, использования марлевых дренажей и аппликаций марлевыми салфетками, обильно пропитанными растворами или эмульсиями антибиотиков, а также путем припудривания стенок гнойных полостей и ран после хирургической обработки (иссечения мертвых тканей). Особенно часто антибиотики применяют с новокаиновым или гемоновокаиновым растворами для создания инфильтрата вокруг инфицированного очага. Желательно, чтобы раствор был введен и под его основание. Новокаин-пенициллиновые и другие растворы и эмульсии антибиотиков целесообразно вводить в закрытые инфекционные (септические) очаги после предварительного промывания и эвакуации из них гноя или ихорозного экссудата.
Внутрисуставные, внутрисухожильно-влагалищные, внутрикостные, внутриартериальные, внутривенные инъекции новокаин-антибиотиковых растворов в сочетании с хирургическими приемами, а в начальных стадиях даже без них нередко обеспечивают хороший лечебный эффект.
При лечении животных с хирургической инфекцией целесообразно сочетать антибиотики с сульфаниламидами (необходимо учитывать, что последние несовместимы с новокаином). Действуя на разные стороны обмена микробной клетки, сульфаниламиды влияют на нее как синергисты антибиотиков, взаимно усиливая их антимикробное действие. Обильная присыпка антибиотиками анатомических полостей вызывает сильное раздражение и приводит к сращениям, а в брюшной полости — к спаечной болезни. Засыпка остеомиелитических и других патологических костных очагов целесообразна, так как ускоряет заполнение их соединительной тканью.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Системные антибиотики в ветеринарии. Профилактика появления антибиотикоустойчивых микроорганизмов
Общее применение антибиотиков оказывается наиболее эффективным при внутрикожном, внутримышечном, внутривенном, особенно внутриартериальном и внутриаортальном введении их растворов. Большинство антибиотиков растворяют в 0,5—0,25%-ном растворе новокаина. При внутримышечных инъекциях к последнему целесообразно добавлять собственную кровь больного, что способствует пролонгированию антибиотика и позволяет вместо трех ограничиваться двумя инъекциями в сутки. Кроме того, к лечебному эффекту антибиотика присоединяется аутогемотерапев-тический эффект.
Заслуживает внимания внутрисосудистое введение: 1) растворов новокаин-бензилпенициллин-натриевой соли; 2) новокаин-морфоциклина (10—20 мл за 4—5 мин); 3) ристомицина сульфата в изотоническом растворе натрия хлорида по 250000 ЕД в 125 мл крупным животным 6 000 000—8 000 000 ЕД (вводить капельно 2—3 ч); 4) эритромицин-аскорбината в изотоническом растворе натрия хлорида или 5%-ном растворе глюкозы (1 мг в 1 мл раствора), инъецируют в течение 7—10 мин крупным животным в дозе 1—2 г 2—3 раза в сутки; 5) олеандомицина в 5%-ном растворе глюкозы (2 мг в 1 мл), вводят 3—4 г капельно 3 раза в сутки.
Внутрикожное введение растворов антибиотиков повышает содержание их в регионарных лимфатических путях и лимфатических узлах (Б. А. Башкиров). Тетрациклины, всасываясь в лимфатическую систему, могут создавать в ней на границе живой и мертвой тканей, в зоне воспаления и опухолях более высокие концентрации. Ярко-желтая флюоресценция тетрациклина в ультрафиолетовой части спектра имеет диагностическое значение, особенно при выявлении опухолей, залегающих в глубине тканей.
Внутримышечное или подкожное введение мономицина, канамицина и гентамицина обеспечивает быстрое всасывание их в кровь и поступление в цереброспинальную, перитонеальную, синовиальную и плевральную жидкости и поэтому заслуживает применения не только при местной хирургической инфекции, но и при сепсисе. Особое значение при сепсисе приобретают внутривенные введения морфоциклина на 5%-ном растворе глюкозы (вводить медленно).
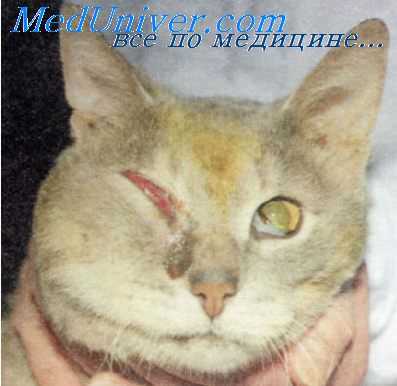
Профилактика появления антибиотикоустойчивых микроорганизмов
Широкое применение в ветеринарии антибиотиков с лечебной целью без достаточного врачебного контроля и строгих показаний, а также включение их в премиксы и использование в качестве стимуляторов роста при откорме животных привело к возникновению стойких рас микроорганизмов к этим средствам. Кроме того, у крупного рогатого скота ан-. тибиотики вызывают ареактивность и значительно подавляют регенеративно-восстановительные процессы. Учитывая изложенное, антибиотики с лечебной целью необходимо применять под строгим ветеринарным контролем.
Следует подбирать их с учетом чувствительности инфекта, вызвавшего инфекцию; использовать оптимальные дозы и пути введения, обеспечивающие высокую терапевтическую концентрацию препарата в организме и инфицированном очаге; сочетать антибиотикотерапию с сульфаниламиде- и витаминотерапией. Недопустимо бесконтрольное использование антибиотиков как стимуляторов роста животных.
Определение чувствительности микробов к антибиотикам методом «бумажных дисков». Этот способ наиболее доступен для практических целей. В стерильные чашки Петри диаметром 10—11см наливают по 20 мл агаровой питательной среды с рН 7,1—7,3. Можно взять 2%-ный мясопептонный агар, а также 1%-ный или 2%-ный агар на переваре Хоттингера, содержащий 110—130 мг% аминного азота. Для получения равномерного «бактериального газона» в чашки Петри с застывшим агаром наливают 1 мл двухмиллиардной суспензии испытуемой культуры (по бактериальному стандарту). Жидкость равномерно распределяют по агару покачиванием чашки Петри.
Избыток жидкости отсасывают пастеровской "пипеткой, затем чашки подсушивают. В них можно высевать гной и другой испытуемый материал, который равномерно распределяют стерильным ватным тампоном или шпателем. На поверхность засеянного агара стерильным пинцетом на равном удалении друг от друга и 2 см от стенки чашки накладывают по одному «бумажному диску» с испытуемым антибиотиком. Каждый «бумажный диск» обозначают начальной буквой испытуемого антибиотика. Чашки Петри с бумажными дисками выдерживают при комнатной температуре в течение 1 ч, затем вкладывают под крышку кружок стерильной фильтровальной бумаги или перевертывают чашки и помещают их в термостат с температурой 37 °С на 16—18 ч.
Зону задержки роста микробов определяют с помощью линейки или миллиметровой бумаги, которыми измеряют диаметр зон роста микробов вокруг дисков. Отсутствие зон задержки роста микробов указывает на устойчивость их к данному антибиотику. Наличие зоны задержки роста в диаметре 15 мм означает малую чувствительность микроба к антибиотику, более 24 мм — высокую чувствительность. Описанный метод дает 80 % совпадений в сравнении с клиническими результатами лечения. Несмотря на неполное совпадение, метод позволяет правильнее подобрать антибиотик и предупреждать образование устойчивых рас микробов.
- Вернуться в оглавление раздела "Биология"
Лечение при гнойной инфекции. Консервативное лечение гнойной инфекции
Лечение при гнойной инфекции должно быть комплексным и соответствовать стадии развития гнойного воспаления с учетом нормергического, гиперергического или гипоергического его проявления, а также биологических особенностей возбудителя. Независимо от стадии развития гнойно-инфекционного процесса комплекс лечебных мер должен включать:
- местные и общие антипатогенетические воздействия на больного животного, основанные на принципе охранительной терапии;
- противомикробные и антитоксические воздействия, направленные на подавление микробного фактора и удаление токсических продуктов из патологического очага и из организма;
- оперативное или консервативное удаление мертвых тканей, которое, так же как и дезинтоксикация организма, влияет на течение инфекционного процесса;
- меры симптоматического воздействия, направленные на улучшение функционального состояния того или иного жизненно важного органа;
- витаминотерапию и полноценное кормление при сбалансированном ощелачивающем рационе;
- дозированный моцион и более широкое применение физиотерапевтических процедур на стадии выздоровления.
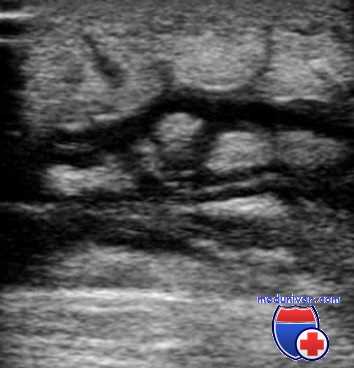
В начальных стадиях развития гнойной инфекции (стадии воспалительного отека и клеточковой инфильтрации) целесообразна короткая блокада 0,25%-ным раствором новокаина в сочетании с гидрокортизоном и одним или двумя антибиотиками, например, с натриевой (калиевой) солью бензилпенициллина и стрептомицинсульфатом либо с мономицином или с канамицином, но эффективнее с гентамицином. Раствор вводят вокруг развивающегося инфекционного очага и по возможности под него. На инфицированный очаг накладывают спиртовысыхающие повязки или спиртовые согревающие компрессы, используя 70%-ный этиловый, ихтиоловый, камфорный спирт, и организуют другие тепловые процедуры.
На стадии воспалительного отека такое лечение предупреждает перераздражение нервных центров, нормализует воспалительную реакцию, трофику, повышает активность физиологической системы соединительной ткани, способствует фиксации, локализации и подавлению возбудителей. В результате этого начавшийся инфекционный процесс нередко обрывается и наступает выздоровление.
На стадии клеточной инфильтрации, как и на стадии абсцеди-рования, целесообразно дополнительно внутримышечно применять антибиотики широкого спектра действия. Особого внимания заслуживают внутривенные введения 0,25%-ного новокаина с соответствующим'антибиотиком или сульфаниламидом. Более эффективны внутриартериальные введения их в магистральную артерию, доставляющую с кровью введенный раствор непосредственно в инфекционный очаг (глубокая антисептика).
Некоторые авторы рекомендуют применять при этих стадиях и даже на стадии абсцедирования местную гипотермию. Но это допустимо лишь на стадии воспалительного отека и притом кратковременно в виде наложения резинового пузыря со снегом или толченым льдом на 10—15 мин, 2—3раза; с такими же перерывами либо на такой же срок накладывают охлаждающие повязки. Допустимо орошать зону инфицированного очага хлорэтилом через легкую бинтовую повязку или марлевую салфетку в течение 20—30 с при передвижении струи со скоростью 1—2 см в 1 с. Процедуру повторяют 2—3 раза с интервалом 1—1,5 ч. Местная гипотермия уменьшает боль, предупреждает чрезмерную проницаемость сосудов, снижает отек и внутритканевое давление. Однако при длительном применении она понижает фагоцитарную реакцию, способствует некротизации и активизации возбудителя. Поэтому мы рекомендуем применять ее осторожно и только на стадии отека при фурункулезе и быстропрогрессирующих воспалительных отеках (гиперергическое развитие острогнойного воспаления).
Описанный комплекс лечения на стадии клеточной инфильтрации нормализует в инфекционном очаге трофику, активирует физиологическую систему соединительной ткани, фагоцитоз и ферментолиз, обеспечивает формирование клеточного барьера, предупреждает генерализацию, снижает и даже подавляет активность возбудителя. Инфекционный процесс купируется и приобретает благоприятное течение.
На стадии абсцедирования целесообразны также короткая новокаиновая блокада, спиртовысыхающие повязки, внутривенные и внутриартериальные введения антибиотиков и сульфаниламидов на 0,25%-ном растворе новокаина, облучение лампами соллюкс, Минина, но недопустимо применять согревающие компрессы, особенно припарки, горячие ванны, парафиновые и озокеритовые аппликации. Использование их допустимо лишь на стадии клеточковой инфильтрации преимущественно при анергической воспалительной реакции. Такие тепловые процедуры, особенно при гиперергическом воспалении, усиливают отек и внутритканевое давление, в результате чего ухудшается кровообращение и лимфоотток, расширяется зона некроза, создаются условия для проникновения гноя и возбудителя в здоровые ткани или анатомические полости.
Исследование Проблема микробной антибиотикорезистентности в животноводстве

Первый антибиотик – пенициллин – был изобретён Александром Флемингом в 1928 году. С тех пор на его основе было разработано около 7 тыс. препаратов. Часть из них уже давно не применяется из-за устойчивости микрофлоры, развившейся к противомикробным препаратам, или микробной антибиотикорезистентности (МАР). Согласно аналитическим исследованиям в 2020 году в мировом животноводстве было использовано более 160 тыс. тонн антибиотиков. К 2030 году эта цифра может достигнуть более 200 тыс. тонн. Можно ли сократить использование антибиотиков в животноводстве, и почему МАР с каждым годом становится все более глобальной проблемой, читайте в новом материале «Эксперт Молоко».
Что такое МАР и почему она возникает
Согласно данным официальной статистики ЕС соотношение антибиотиков, применяемых в медицине и животноводстве, существенно отличается для разных стран, но в среднем потребление антибиотиков в медицине лидирует.
Новые антибиотики продолжают изобретать, поэтому МАР практически стремительно ускоряется.
Согласно исследованию ВОЗ до пандемии 2020 года, ежегодно около 700 тыс. человек по всему миру умирало от бактериальных инфекций, вызванных резистентными патогенами. К 2050 году эта цифра может вырасти до 10 миллионов. МАР постепенно переходит в разряд глобальных проблем человечества, в том числе создающих серьезные препятствия на пути поддержания ветеринарного благополучия.
Заражение людей резистентными микроорганизмами приводит к серьезным заболеваниям и длительной госпитализации, увеличению расходов на здравоохранение, повышению затрат на лекарства и сбоям в лечении.
Причиной возникновения МАР, лежащей на стыке медицинской и ветеринарной науки, является бесконтрольное применение антибиотиков в животноводстве и передача устойчивых микроорганизмов человеку при непосредственном контакте с животными-носителями и/или через продукты питания. К этой категории микоорганизмов относятся возбудители пищевых токсикоинфекций (сальмонеллы, кампилобактерии и листерии) и зооантропонозов (болезней общих для человека и животных), вызванных мульти/панрезистентными энтерококками, синегнойной и различными типами кишечных палочек и пр.
Кишечная палочка – наиболее убиквитарный микроорганизм в медицинской инфекционной и неинфекционной патологии. Именно она является наиболее частым клиническим изолятом у пациентов амбулаторных и стационарных отделений согласно интегральным данным 9 крупных клинических лабораторий Германии. Второе и третье места делят коагулазонегативный и золотистый стафилококки.
Кишечная палочка – наиболее часто встречаемый микроорганизм и в животноводстве. Ее содержание в составе микрофлоры кишечника и поверхности тушек птицы после убоя достигает 50%, впрочем, как и в структуре прижизненной патологии.
До относительно недавних пор было принято считать, что птичьи полирезистентные кишечные палочки — Escherichia coli (E. Coli) — не представляют серьезной угрозы для других видов животных и человека, однако исследования показали, что потенциальным источником заболевания для человека служат продукты животноводства, среди которых мясо птицы является основным (79%), значительно реже в этой роли выступают свинина (17%) и говядина (3%).
Частота обнаружения МАР у E.coli в мясной продукции растет с каждым годом. Исследование МАР 2015 года в Италии показало, что примерно 70% бактерий E.coli, обнаруженных в свиноводческой отрасли, оказались продуцентами бета-лактамаз широкого спектра действия (ESBL), а значит обладают множественной (пан)резистентностью в отношении антибиотиков.
Причины формирования МАБ
- Массированное применение антибиотиков для интенсификации промышленного животноводства всех видов и направлений продуктивности.
- Применение антибиотиков в современном птицеводстве.
Одной из основных причин развития МАР в животноводстве считается использование антибиотиков в субтерапевтических дозировках с целью профилактики заболеваний – именно к такому в первую очередь и относится применение АСР – Антибактериальных стимуляторов роста.
Британцы были одними из первых в Европе, кто широко использовал антибиотики в качестве стимуляторов роста. Объединенный Комитет по использованию антибиотиков в животноводстве и ветеринарии установил, что возникновение резистентных штаммов бактерий при использовании антибиотиков у сельскохозяйственных животных создает определенную опасность для здоровья человека и животных.
Основная рекомендация Комитета заключается в том, что антибиотики должны быть классифицированы на «кормовые» и «терапевтические» и что только «кормовые» антибиотики могут быть доступны без рецепта для использования в кормах. Комитет должен был определить перечень «кормовых» антибиотиков, применение которых гарантирует безопасность для здоровья человека. Таким образом, было рекомендовано запретить использование пенициллина и тетрациклинов в кормах, а доступность терапевтических препаратов ограничить рецептурным назначением. Примеру Соединенного Королевства последовали другие европейские страны.
В ожидании запрета 2006 года большинство Европейских производителей кормов начали искать замену АСР, сравнивая результаты применения антибиотиков и их альтернатив в разных отраслях животноводства. За период 2003–2006 гг. было разработано и испытано большое количество альтернатив, число которых растет и по сей день.
Однако фермеры и ветврачи убеждены, что успех был достигнут не только благодаря альтернативам АСР, но в существенной степени - за счет изменений в технологии содержания, ужесточения правил биозащиты, ветеринарно-санитарных мероприятий и технологической дисциплины.
Хотя основной целью запрета использования антибиотиков у продуктивных животных было снижение развития МАР у зоонозных бактерий и их потенциала для заражения человека, количество инфекционных заболеваний у животных, выращиваемых без АСР, в некоторых странах значительно возросло, а производственные показатели ощутимо упали. Это привело к компенсаторному увеличению использования терапевтических антибиотиков как для лечения, так и с целью профилактики заболеваний.
Результаты программы контроля применения антибиотиков в Великобритании согласно данных Альянса ответственного использования лекарственных средств в сельском хозяйстве (RUMA) также обнадеживают: за период 2012–2020 годы удалось сократить количество антибиотиков на 74,2%, в том числе критически важных – на 95,5%, фторхинолонов – на 97,2%. В птицеводстве – на 66,5% для кур и на 88% - для индеек.
Напротив, рынок противомикробных препаратов в России за период 2005–2009 гг. вырос в 2,3 раза, 2008–2012 гг. - в 1,8 раза. По оценке экспертов ВТО, использование антибиотиков в животноводстве РФ ежегодно растет примерно на 35–40% и к 2020 году мы должны были обогнать по этому показателю США. Однако соотношение суммарного объема потребления антибиотиков в РФ и США и их потребление в мг/кг усредненной живой массы при 4-кратной разнице в объемах производства мяса – необъяснимы…
Ветеринария
08.11.2012
Антибиотикорезистентность микроорганизмов и современная стратегия использования антибактериальных препаратов
Ветеринарные специалисты, вынужденные сосредоточиться на решении тактических задач обеспечения эпизоотического благополучия, невольно упускают из виду тот факт, что любой патологический процесс инфекционной природы есть результат взаимодействия трех обязательных компонентов — макроорганизмов (хозяев), микроорганизмов (патогенов) и окружающей среды.
Более того, вмешательство в любой инфекционный патологический процесс — это вмешательство в сообщество микроорганизмов, которое в той или иной степени отражается на всех представителях сообщества. Поддержание эпизоотического благополучия осложняется такими сопутствующими факторами, как несоблюдение основных принципов антимикробной терапии, недостаточная прослеживаемость технологической цепочки, а также проблемы с достоверностью результатов лабораторно-диагностических и мониторинговых мероприятий.
Скорость развития устойчивости микрофлоры и степень выраженности этого явления связаны в первую очередь с природой возбудителя. Большинство исследований показывают, что по скорости формирования резистентности бактерии можно условно подразделить на две группы: быстро вырабатывающие устойчивость и медленно вырабатывающие устойчивость. Так, наиболее быстро устойчивость развивается у эшерихий, сальмонелл, микоплазм, протея, синегнойной палочки; менее интенсивно этот процесс протекает у гемофильной палочки, пастерелл, стрептококков. Природой возбудителя также обусловлены механизмы антибиотикоустойчивости: модификация чувствительной мишени, образование капсул, самоорганизация в биопленки, переход бактерии в метаболически слабоактивное состояние, инактивация антибиотика, активное выведение антибиотика из микробной клетки (эффлюкс), нарушение проницаемости внешних структур микробной клетки.
Основа для формирования резистетности микроорганизмов — мутации в их генетическом аппарате, при этом антибактериальные препараты играют роль селективного фактора. Соответственно, при использовании комплекса из нескольких антибиотиков будут выживать микроорганизмы, которые обладают универсальными механизмами устойчивости, направленными против большого количества антибактериальных препаратов. Селективный прессинг антибиотиков снижает количество только чувствительных микроорганизмов, давая возможность устойчивым популяциям активно размножаться.
Для решения проблемы формирования антибиотикорезистентных популяций микроорганизмов компанией КРКА (Словения) был предложен комплексный подход к решению данного вопроса, который вобрал в себя следующие основные направления:
— разработку новых и совершенствование методов синтеза существующих антибактериальных препаратов с оптимизацией технологии производства готовых лекарственных форм;
— снижение общей бактериальной обсемененности объектов внешней среды путем проведения эффективной и качественной дезинфекции;
— внедрение препаратов, препятствующих формированию плазмидной устойчивости либо обеспечивающих элиминацию плазмид из резистентных бактерий;
— циклическое (ротационное) использование антимикробных средств в комбинированных схемах, под которыми подразумеваются различные подходы и типы терапии: стартовая и ступенчатая терапия, курсовое использование антибиотиков разных групп, этиотропная, патогенетическая и симптоматическая терапия.
Для решения проблемы антибиотикоустойчивости компания КРКА первой зарегистрировала в РФ новый антибиотик группы амфениколов — Флорон. Неоспоримым преимуществом Флорона явилась высокая чувствительность микрофлоры, уже приобретшей устойчивость к другим группам антимикробных препаратов, что позволило с уверенностью рекомендовать его для широкого использования в отношении контроля за мультирезистентными штаммами. Важно помнить, что появление принципиально новых антибактериальных препаратов — весьма нечастое явление, поэтому стоимость таких продуктов не может быть низкой, и задача ветеринарного специалиста — максимально эффективно использовать существующие препараты.
Следующий этап в решении проблемы мультирезистентных патогенных микроорганизмов — снижение общей численности патогенов во внешней среде путем проведения качественной дезинфекции и регулярной санации с использованием дезинфицирующего препарата Экоцид С, который относится к группе окислителей, но принципиально отличается от других представителей данного класса особенностями механизма действия. Циклическое течение реакции разложения действующего вещества в растворе Экоцида С приводит к образованию свободных радикалов (хлора, кислорода и гидроксония), обладающих обеззараживающим действием, а саморегенерация раствора позволяет сохранять высокие дезинфицирующие свойства препарата на протяжении 60 минут, в то время как распад перекиси происходит за 15–30 минут. При этом содержание активного кислорода достигает 10,5%, что обеспечивает выраженное микробиоцидное действие растворов Экоцида С. Низкая токсичность, высокая активность в отношении широкого спектра эпизоотически значимых возбудителей, безопасность для окружающей среды и производственного оборудования — всё это позволяет использовать Экоцид С на всех этапах технологического процесса.
Самым перспективным, но недостаточно изученным методом контроля над развитием и распространением мультирезистентных штаммов микроорганизмов является ротация антибактериальных препаратов. Чередование и смена антибиотиков с учетом их химико-фармацевтических свойств и механизма действия позволяет снизить селективное давление на микроорганизмы и предотвращает формирование антибиотикорезистентности. На сегодняшний день можно говорить о следующих основных принципах ротационного использования антибиотиков:
• Исследование чувствительности существующей микрофлоры к антибактериальным препаратам и мониторинг тенденций к ее изменению. При анализе результатов бактериологических исследований на предприятиях промышленного типа с высокой концентрацией поголовья установлено, что при интенсивном использовании антимикробных средств устойчивость микроорганизмов (в особенности энтеробактерий) развивается уже за 4–6 месяцев. На продолжительность данного периода существенное влияние оказывает частота и кратность использования антибиотиков, качество применяемых препаратов, ветеринарно-санитарное состояние производства.
• Подбор антибиотиков для циклического использования согласно эпизоотическому состоянию в хозяйстве и фармакокинетическим свойствам препаратов, их курсам и дозам. Выбор между антибиотиками широкого и узкого спектра действия должен осуществляться с учетом имеющихся условий производства. В промышленном птицеводстве мы рекомендуем использовать не более 2–3 антибиотиков разного механизма действия в течение одного цикла (например Флорон и Гиракса, Энроксил и Эгоцин, Трисульфон и Флубактин). Это позволит достичь максимального терапевтического эффекта с одновременным сокращением затрат на антибактериальные обработки. Если говорить о промышленном свиноводстве, то ротация антимикробных средств должна осуществляться в соответствии с технологическими этапами производства (например, при санации супоросных свиноматок Эгоцином его дальнейшее терапевтическое применение на этом же поголовье против ММА будет нецелесообразным, поэтому необходимо выбрать подходящий антибиотик из другой группы, например Энроксил), а также с учетом ранее использовавшихся препаратов (например, если для контроля актинобациллезной плевропневмонии на откормочном поголовье используется Флорон, то наилучшим выбором антибиотика для ротации будет препарат из другой группы, активный в отношении A. pleuropneumoniae, например Мизоксин или Квестигин).
• Постоянный мониторинг эпизоотического состояния и отслеживание частоты встречаемости резистентных штаммов микроорганизмов. Поскольку любое производство не застраховано от заноса новых мультирезистентных штаммов извне, необходимо проводить постоянный мониторинг чувствительности микрофлоры к антибактериальным препаратам. Для систематизирования подобных данных на популяционном уровне в гуманной медицине используются компьютерные базы данных (WHONET и подобные ей), и сейчас предпринимаются активные попытки создать аналогичную базу данных для ветеринарной медицины.
Конечно, решение проблемы формирования и распространения мультирезистетных штаммов — задача не одного дня. Для этого требуется не только системный подход, но и объединение усилий ветеринарных специалистов на всех уровнях — от производителей антибактериальных препаратов до врачей на производстве. Первые шаги уже сделаны, и результаты показывают, что выбрано правильное направление: рационализация антимикробной терапии не только минимизирует эпизоотические риски, но и позволяет стратегически планировать ветеринарные мероприятия для эффективной защиты поголовья.
Читайте также:
