Методика экстренной чрескожной декомпрессии желудка
Добавил пользователь Евгений Кузнецов Обновлено: 19.01.2026
Парез желудка — состояние, приводящее к нарушению эвакуации содержимого из желудка. Имеющиеся методы лечения не обладают достаточной эффективностью. Желудочная пероральная эндоскопическая миотомия (G-POEM) на основании публикаций является высокоэффективным вмешательством с хорошими перспективами. В статье рассматриваются особенности выполнения вмешательства и его результаты.
Введение:
Парез желудка — хроническое симптоматическое заболевание, связанное с задержкой опорожнения желудка при отсутствии механической обструкции желудка или проксимальных отделов тонкой кишки [1]. К сожалению, существующие в настоящее время варианты лечения, включая различные диеты, прием лекарственных препаратов, введение ботулотоксина в привратник, электрическую стимуляцию желудка и хирургическое вмешательство, не всегда имеют клиническую эффективность [4, 12, 17, 21-23]. Эффективным методом лечения пареза желудка является пероральная эндоскопическая миотомия с рассечением привратника, известная как Gastric POEM (Gastric peroral endoscopic myotomy, G-POEM), — эндоскопическая пилоротомия, или пероральная пилоромиотомия [2].
Enter the password to open this PDF file:
Полный текст статьи:
Парез желудка — патологическое состояние, приводящие к нарушению эвакуации пищи из желудка. Это набор симптомов, включающих в себя тошноту, регургитацию, рвоту, чувство переполнения в желудке, дискомфорт в эпигастральной области и боль, снижение аппетита, вздутие живота. Примерно у 90% пациентов с парезом желудка причинами являются сахарный диабет и ранее перенесенное хирургическое вмешательство. Возможен идиопатический вариант заболевания [3]. В эвакуации пищи из желудка принимают участие блуждающий нерв, гладкая мускулатура желудка, интерстициальные клетки и кишечные нейроны, которые регулируют сокращения антрального отдела желудка и расслабление привратника [4, 23]. Патофизиология пареза желудка до конца не выяснена. По мнению ряда авторов следует учитывать, что вовлечение одного или нескольких звеньев, участвующих в сокращении желудка, в патологический процесс. При патоморфологическом исследовании обнаруживаются нарушения морфологии нейронов тонкой кишки, гладкой мускулатуры желудка, интерстициальных клеток. При этом в тканях стенки желудка отмечается воспалительный процесс [5, 6]. Слабое сокращение дна желудка, нарушение моторики антрального отдела, пилороспазм, нарушение антропилородуоденальной координации, нарушение работы желудка и автономная нейропатия, создают нарушения для эвакуации содержимого из желудка и разнообразие клинических симптомов [7].
Постваготомический пилороспазм встречается у 15–50% пациентов после экстирпации пищевода с пластикой желудка и может приводить к аспирационной пневмонии, постоянной тошноте и рвоте, которая влечет снижение массы тела и ухудшение качества жизни [1, 8, 26]. В свою очередь это приводит к росту заболеваемости и смертности у данной категории пациентов.
Эффективность пилоротомии как профилактического метода постваготомических расстройств не совсем ясна. Из-за сложности понимания патофизиологии пареза желудка все лечение является эмпирическим и паллиативным.
Тоннельные вмешательства (POEM и G-POEM)
Техника вмешательства. G-POEM и POEM технически не отличаются друг от друга. Оба вмешательства выполняются с соблюдением принципов POEM: подслизистая инъекция, рассечение слизистой, формирование тоннеля в подслизистом слое, миотомия и закрытие дефекта слизистой оболочки [10, 17, 22, 23]. Вмешательство проводится под общим обезболиванием с использованием инсуффляции углекислого газа (CO2), необходимого для минимизации риска возникновения напряженного пневмоперитонеума и возможности чрескожной хирургической декомпрессии: углекислый газ в 160 раз быстрее азота (является основным компонентом атмосферного воздуха) подвергается резорбции [18]. Во время выполнения вмешательства пациент может находиться в положении на спине или на левом боку.
Перед выполнением подслизистой инъекции желудок должен быть отмыт от содержимого. При выполнении вмешательства лучше применять стандартный гастроскоп с водной помпой для дополнительной ирригации. На дистальном конце эндоскопа находится колпачок для лучшей визуализации. После предварительного введения в подслизистый слой 3–5 мл раствора хлорида натрия, подкрашенного метиленовым синим или индигокармином, на 5 см проксимальнее привратника на 5 часах условного циферблата выполняется разрез слизистой длиной 1,2–2 см при помощи ножа для диссекции [17, 23, 26].
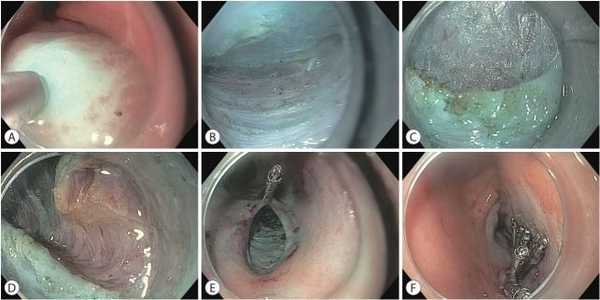
Рисунок 1. Пероральная желудочная миотомия, выполненная пациенту с идиопатическим парезом желудка (источник фото):
a — подслизистая инъекция выполнена на 5 см проксимальнее привратника на 5 часах условного циферблата;
b — подслизистый тоннель сформирован до кольца привратника;
c — определяется привратник;
d — пилоротомия выполнена с использованием ножа и без повреждения стенки двенадцатиперстной кишки;
e, f — дефект слизистой оболочки закрыт с использованием клипс.
Клинические результаты. Клинические результаты были оценены у 130 пациентов в пяти исследованиях [2, 16, 19–21]. Все исследования были ретроспективными. При этом не было ни одного проспективного или рандомизированного контролируемого исследования (табл. 1) [26]
Таблица 1. Обзор результатов вмешательства
Длитель-ность наблю-дения, мес.
Этиология пилорос-
пазма, %:
диабетичес-кий (Д) идиопати-ческий (И), послеопера-ционный
(П)
Методика экстренной чрескожной декомпрессии желудка
Больница Центросоюза Российской Федерации, Москва, кафедра эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
Кафедра эндоскопической хирургии факультета последипломного образования Московского государственного медико-стоматологического университета
кафедра эндоскопической хирургии ФПДО МГМСУ
Современные представления о хирургических методах лечения больных с варикозно-расширенными венами пищевода и желудка
Журнал: Эндоскопическая хирургия. 2016;22(5): 43‑48
На сегодняшний день кровотечение из варикозно-расширенных вен пищевода и желудка у больных циррозом печени — главная причина летального исхода и самое грозное осложнение портальной гипертензии. В связи с этим необходимость своевременного лечения и проведение профилактики данного заболевания являются основным показанием к хирургическому вмешательству.
Варикозное расширение вен пищевода и желудка встречается у 90% больных циррозом печени, в 35% случаев оно осложняется кровотечениями. В механизме развития варикозной трансформации вен пищевода и желудка важную роль играет затруднение оттока крови по воротной вене, в результате чего формируются 4 основные группы портокавальных анастомозов: 1) гастроэзофагеальные; 2) забрюшинные; 3) между левой ветвью воротной вены и сосудами передней брюшной стенки; 4) между прямокишечным сплетением и нижней полой веной. Но для клиницистов наиболее важен гастроэзофагеальный коллатеральный путь, предопределяющий основное направление хирургического лечения портальной гипертензии [1].
Важно помнить, что хирургические методы лечения портальной гипертензии имеют паллиативный характер, они не направлены на лечение основного заболевания. Их цель — профилактика и ликвидация одного из серьезных симптомов портальной гипертензии — кровотечения из варикозно-расширенных вен пищевода и желудка. Единственный радикальный метод лечения портальной гипертензии у больных циррозом печени на сегодняшний день — трансплантация печени.
Существует 3 подхода к предупреждению кровотечений из варикозно-расширенных вен пищевода и желудка [1].
Вторым подходом в предупреждении кровотечений из варикозно-расширенных вен пищевода и желудка является декомпрессия портальной системы с помощью формирования сосудистых портокавальных анастомозов (дистальный спленоренальный анастомоз, проксимальный спленоренальный анастомоз, Н-спленоренальный анастомоз), а также эндоваскулярный способ формирования шунта — операция TIPS (Transjugular intrahepatic portosystemic shunt, трансъюгулярное внутрипеченочное портосистемное шунтирование) [1].
Существуют 3 вида открытых сосудистых операций по формированию портокавальных шунтов: 1) тотальное шунтирование; 2) парциальное шунтирование; 3) селективное шунтирование [4].
При тотальном шунтировании формируется портокавальный анастомоз большого диаметра (15—25 мм) между нижней полой и воротной, селезеночной или верхней брыжеечными венами. Наиболее распространенная операция при этом — проксимальный спленоренальный анастомоз (анастомоз между селезеночной и левой почечной веной конец в бок) в сочетании со спленэктомией. Одним из условий для формирования шунта является длина селезеночной вены не менее 4—6 см. При выполнении данной операции могут быть получены удовлетворительные результаты, однако летальность составляет 10—35%, энцефалопатия развивается у 3,5—28% больных, возможно развитие послеоперационного панкреатита, а рецидивы кровотечений возникают у 10—27% в связи с тромбозом анастомоза и неполной декомпрессией бассейна воротной вены [2, 5].
При селективном шунтировании происходит избирательная декомпрессия селезеночного и гастроэзофагеального бассейнов. При данном типе шунтирования формируется дистальный спленоренальный анастомоз (операция W. Warren). В литературе имеются работы с описанием данной операции, выполненной лапароскопическим доступом [6]. Селезеночную вену мобилизуют по всему периметру с целью сохранения разобщенности желудочно-селезеночного и брыжеечного бассейнов, однако это чревато повреждением поджелудочной железы и развитием послеоперационного панкреатита, который приводит к тромбозу анастомоза и рецидиву кровотечения из варикозных вен. Сохранение воротного кровотока позволяет снизить частоту развития острой печеночной недостаточности и энцефалопатии в раннем послеоперационном периоде. Поэтому данная операция характеризуется более высокой эффективностью и меньшим процентом осложнений, чем при тотальном шунтировании [5, 7].
При парциальном портокавальном шунтировании формируют анастомоз бок в бок или Н-типа малого диаметра (8—15 мм), выполняемые с использованием любого сосуда портальной системы, кроме воротной вены. При данном типе операции формируется Н-спленоренальный анастомоз, который считается лучшим из всех парциальных портокавальных анастомозов, так как именно в этом случае происходит декомпрессия портальной системы (на 25% интраоперационно снижается давление в портальной вене), а также сохраняется редуцированный кровоток для поддержания функции печени [5, 8].
Операция TIPS впервые разработана J. Rosch в 1969 г. в эксперименте на животных [9]. Впервые в клинической практике операцию TIPS в современном виде выполнил G. Richter в 1998 г. [10]. Данная операция заключается в малоинвазивном способе снижения портального давления путем создания внутрипеченочного соустья между крупными печеночными венами и ветвями воротной вены при помощи чрескожной имплантации металлического стента. Основные показания для данного вмешательства — безуспешность консервативного и эндоскопического методов лечения кровотечений из варикозно-расширенных вен пищевода и желудка, асцит, рефрактерный к диуретической терапии, синдром Budd—Chiari. Одним из серьезных осложнений данной операции являются стенозирование и тромбоз шунта, приводящие к рецидивам кровотечений [11, 12].
Третий подход в профилактике кровотечений из варикозно-расширенных вен пищевода и желудка заключается в разобщении портокавальных связей с помощью хирургических операций, в том числе и малоинвазивных, в целях уменьшения притока крови к варикозно-расширенным венам кардиоэзофагеальной области. К этим операциям относятся деваскуляризация пищевода и желудка, транссекция пищевода и желудка, прошивание варикозных узлов желудка и нижней трети пищевода, резекция пищевода и желудка. К малоинвазивным вмешательствам относятся эндоскопическое склерозирование и лигирование варикозно-расширенных вен пищевода и желудка, эндоваскулярные операции (редукция селезеночного кровотока, редукция печеночного кровотока, эмболизация кардиальных вен желудка, операция BRTO (Balloon-occluded Retrograde Transvenous Obliteration) — ретроградная окклюзия варикозных вен желудка и пищевода) [1].
Впервые оперативное вмешательство по поводу деваскуляризации желудка и нижней трети пищевода в сочетании со спленэктомией выполнил С. Henschen в 1938 г. Классической операцией данного типа является операция M. Hassab (1967), которая заключается в обширной деваскуляризации желудка и нижнего отдела пищевода, включая наддиафрагмальные вены, в сочетании со спленэктомией [2]. Y. Ni и соавт. [13] сравнили широко использующуюся методику деваскуляризации пищевода желудка в сочетании со спленэктомией и без таковой. Для исследования были отобраны 55 пациентов с синдромом портальной гипертензии: 27 из них выполнена деваскуляризация желудка и нижней трети пищевода без спленэктомии (группа А) и 28 пациентам выполнялась данная операция в сочетании со спленэктомией (группа В). Таким образом, портальное давление было снижено на 20% в послеоперационном периоде в обеих группах. Частота возникновения тромбоза в портальной вене в группе, А была значительно ниже, чем в группе В (р=0,032). Частота развития рецидивов кровотечения из вен пищевода и желудка в период послеоперационного наблюдения 1 и 3 года в группе, А составляла 0 и 4,5%, в группе В — 0 и 8,7% соответственно (р=0,631). Таким образом, было доказано, что частота осложнений и возникновение тромбоза в воротной вене у пациентов, оперированных без спленэктомии, ниже, чем у пациентов, оперированных в сочетании со спленэктомией. Однако в настоящее время данная операция чаще всего сочетается с эндоскопическим лигированием варикозно-расширенных вен пищевода, а также без спленэктомии [14].
Операцию транссекции пищевода и желудка впервые предложил N. Tanner (1949), который выполнил транссекцию желудка в поперечном направлении, тем самым разъединив систему воротной вены и верхней полой вены с целью ликвидации кровотечения из варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией. Суть операции заключается в мобилизации нижнего отдела пищевода и кардии желудка, перевязке левой желудочной артерии и вены через торакоабдоминальный доступ в седьмом и восьмом межреберье слева. Желудок пересекают на 5 см ниже кардии и вновь сшивают. Однако анализ отдаленных результатов операции показал ее неэффективность в связи с рецидивами кровотечений вследствие реваскуляризации в зоне транссекции. В научной литературе описаны работы, в которых данная операция выполнялась лапароскопическим доступом [15, 16]. В 1973 г. М. Sugiura и S. Futagawa разработали комбинированную операцию азигопортального разобщения, которая представляла собой трансторакальную транссекцию пищевода, спленэктомию, деваскуляризацию абдоминального отдела пищевода и верхнего отдела желудка, селективную проксимальную ваготомию и пилоропластику. Спленэктомию, пилоропластику, деваскуляризацию желудка, селективную проксимальную ваготомию выполняют из абдоминального доступа, обширную параэзофагеальную деваскуляризацию до уровня нижних легочных вен и транссекцию пищевода до уровня пищеводного отверстия диафрагмы — из торакального доступа. Данная операция в последнее время претерпела различные модификации (А.А. Шалимов, В.И. Оноприев, О.С. Васнев), в том числе с использованием лапароскопической техники, и аппаратной транссекции пищевода с помощью EEA-stapler, и получила широкое распространение в мире.
Методику прошивания варикозно-расширенных вен пищевода впервые предложил Берем в 1949 г. в случаях экстренного оперативного вмешательства при кровотечениях из вен пищевода. Он прошивал расширенные вены пищевода отдельными узловыми швами и вводил в просвет вен между наложенными лигатурами раствор глюкозы с целью тромбообразования в них. Крайль в 1950 г. прошивал варикозно-расширенные вены пищевода непрерывным кетгутовым швом. Позднее эта операция получила название «операция Берема—Крайля», при этом какие-либо вмешательства на варикозно-расширенных венах желудка не производились. Результаты данной операции показали, что кровотечения могут повторяться как в ближайшем, так и в отдаленном послеоперационном периоде, причем чаще всего (в 40—70% случаев) источником кровотечения являлся разрыв варикозных узлов кардиального отдела желудка. Кроме того, основной причиной смерти при операции Берема—Крайля были несостоятельность швов пищевода с последующим развитием медиастинита и эмпиемы плевры, а также декомпенсация функции печени, приводившие к летальному исходу в 30—70% случаев [1]. В 1967 г. М.Д. Пациора предложила прошивать варикозные узлы желудка и нижней трети пищевода через трансабдоминальную гастротомию в проксимальном отделе желудка в косопоперечном направлении [4, 17]. Суть данной операции заключается в прошивании всех варикозных узлов в кардиальном отделе желудка, а затем прошивании варикозных узлов нижней трети пищевода, в результате чего значительно снижается приток крови к венам пищевода. Данная операция менее травматична, чем операция Берема—Крайля, с низкой частотой летальности, рецидивов кровотечения и осложнений (7,6—15,4%). Однако с развитием малоинвазивных оперативных вмешательств (эндоскопическое лигирование) значимость выполнения полостной операции на варикозно-расширенных венах пищевода снизилась [18—20].
Говоря о пищеводно-желудочных резекциях, следует отметить, что эти операции являются операциями резерва для тех больных, кто ранее многократно был оперирован по поводу рецидива кровотечений из вен пищевода и желудка. Одна из таких операций — частичная эзофагогастрэктомия с инвагинацией пищеводно-желудочного анастомоза по способу К.Н. Цацаниди. Также применяются различные модификации данной операции с интерпозицией сегмента толстой или тонкой кишки. Однако данная операция применяется лишь в исключительных случаях ввиду большого количества осложнений (30—40%), таких как агастральная астения тяжелой формы и рецидивы кровотечения из эрозий культи желудка в послеоперационном периоде [18, 21].
На сегодняшний день малоинвазивные вмешательства — более перспективные методы остановки и профилактики кровотечений из варикозно-расширенных венах пищевода и желудка. Эндоскопическое склерозирование вен пищевода впервые выполнили С. Crafoord и Р. Frenckner в 1939 г. При этой методике интравазально либо паравазально с помощью иглы, проведенной через инструментальный канал эндоскопа, вводят склерозанты (производные жирных кислот — натрия морруат, синтетические вещества — этоксисклерол, тромбовар, а также этиловый спирт, фенол, гистоакрил) в целях образования рубцовой ткани и тромбоза сосудов данной области. Эффективность методики составляет 70—90% [19, 22, 23]. Однако данная операция характеризуется большим количеством осложнений, таких как изъязвления слизистой оболочки пищевода (14%), стриктуры пищевода, плевральные осложнения (9%), субфебрильная температура (6,4%), некроз слизистой пищевода и его перфорация (6,25%), перикардиты (0,4%) [2]. Наиболее частое (65%) и серьезное осложнение — стойкая дисфагия пищевода на фоне выраженных рубцовых стриктур, возникновение которых зависит от количества инъекций и введенного склерозанта [24]. В связи с этим многие клиницисты в последнее время отдают предпочтение эндоскопическому лигированию варикозно-расширенных вен пищевода. Впервые эндоскопическое лигирование варикозно-расширенных вен пищевода выполнил G. Stiegmann в 1986 г., применив латексные кольца. Данную операцию выполняют с помощью многозарядного лигатора фирмы «Wilson-Cook» при лигировании вен пищевода или нейлоновой петли фирмы «Olympus» — при необходимости лигирования вен желудка. Эндоскоп с фиксированным на конце колпачком проводится к выбранному варикозному узлу. Лигирование начинают с кардиоэзофагеального перехода чуть выше зубчатой линии в шахматном порядке по спирали. После аспирации варикозного узла в цилиндр более чем на половину его высоты сбрасывают лигирующее кольцо. Через 6—7 сут начинается отторжение некротизированных узлов, на месте которых образуются поверхностные язвы. Язвы заживают в течение 3 нед, на их месте образуются рубцы без стенозирования просвета пищевода. Наиболее частыми осложнениями данной операции являются аллергическая реакция на латекс, боли при глотании в первые дни, кровотечения из поверхностных язв на фоне отторжения некротизированных узлов. Эта методика позволяет остановить продолжающееся кровотечение в 78—95% случаев, однако рецидив кровотечения отмечается у 28—35% пациентов [25]. Методика эндоскопического лигирования варикозно-расширенных вен пищевода и желудка оказалась более эффективной операцией при кровотечениях из вен пищевода, а также как способ профилактики, чем эндоскопическое склерозирование варикозных вен, так как при лигировании вен отмечалось снижение количества рецидивов кровотечения на 20% и снижение летальности на 15% [26—28].
Осложнения после обширных хирургических вмешательств предписывают отказаться от формирования прямых портокавальных анастомозов в пользу эндоваскулярных методов лечения. Одной из первых эндоваскулярных операций стала чрескожная чреспеченочная эмболизация кардиальных вен желудка, впервые разработанная А. Lunderquist в 1974 г. Данная операция заключается в эмболизации левой желудочной вены и коротких вен желудка посредством металлических спиралей «Гиантурко» и других эмболизирующих средств [29]. В 1986 г. В.А. Черкасов рекомендовал выполнять одномоментно эмболизацию селезеночной артерии и кардиальных вен желудка (левая желудочная вена, короткие вены желудка) [30]. Данная манипуляция эффективна при кровотечениях из варикозно-расширенных вен желудка, а недостаток заключается в быстрой реканализации тромбированных коллатералей, в результате чего возможны рецидивы кровотечения.
Эндоваскулярная эмболизация селезеночной артерии впервые успешно выполнена F. Madson в 1973 г., однако анализ данной методики выявил большое количество осложнений, таких как абсцесс селезенки, бактериальный перитонит, тромбоз воротной вены [31]. В связи с этим Spigos и соавт. в 1979 г. предложили частичную эмболизацию селезеночной артерии, которая применяется по сей день [32]. Одним из основных показаний к данной операции является панцитопения, вызванная тем, что после эмболизации ветвей селезеночной артерии возникают участки инфарктов и некрозов, которые уменьшают депонирование лейкоцитов и тромбоцитов в селезенке, что соответственно приводит к их увеличению в периферической крови.
Операцию BRTO (Balloon-occluded Retrograde Transvenous Obliteration, баллон-ассистированная ретроградная трансвенозная окклюзия) впервые выполнили H. Kanagawa и F. Chikamori независимо друг от друга в 1996 г. [33, 34]. Суть операции заключается в эндоваскулярном перекрытии из антеградного трансфеморального доступа просвета спленоренального шунта окклюзионным баллон-катетером и введении жидкого склерозанта в варикозные узлы желудка [2]. В последние годы выработаны модификации данной операции: катетеризация через бедренную, левую почечную вены и естественный гастроренальный анастомоз — эмболизация варикозных вен желудка [35, 36]; катетеризация через притоки левого брахиоцефального венозного ствола или непарной вены левой перикардио-диафрагмальной вены [36]. Положительные результаты данной операции отмечены в 84—100% случаев. Осложнения встречаются в 5% случаев, среди них — тромбоз воротной вены, легочная эмболия и почечная недостаточность; рецидив кровотечения регистрируется с частотой до 9%; средний уровень выживаемости составляет 90, 75, 68 и 55% через 1, 2, 3 года и 7 лет соответственно [35, 36].
С учетом вышесказанного проблема портальной гипертензии и ее осложнений остается одной из самых сложных областей абдоминальной патологии, несмотря на большое количество существующих видов оперативных вмешательств. Однако все эти операции не радикальны. Все открытые хирургические оперативные вмешательства (деваскуляризирующие операции и операции с формированием портокавальных анастомозов) слишком травматичны, не всегда переносятся больными и не решают проблемы высокого портального давления радикально, в связи с чем остается высоким риск рецидива кровотечения. Эндоваскулярные методы лечения (в частности, операции TIPS, BRTO), а также эндоскопические малоинвазивные вмешательства высокоэффективны, поскольку результаты именно этих операций в последние годы дают надежную гарантию профилактики кровотечения из варикозно-расширенных вен пищевода и желудка.
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
городская клиническая больница №31, Москва
Научно-образовательный центр абдоминальной хирургии и эндоскопии Российского государственного медицинского университета им. Н.И. Пирогова;
ГКБ №31, Москва
Кафедра госпитальной хирургии №2 с научно-исследовательской лабораторией хирургической гастроэнтерологии и эндоскопии ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова»
Способ декомпрессии брюшной полости при лечении абдоминального компартмент-синдрома у больных деструктивным панкреатитом
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(1): 61‑66
Мыльников А.Г., Паньков А.Г., Чурадзе Б.Т., Усачев О.Ю., Шабрин А.В., Шаповальянц С.Г. Способ декомпрессии брюшной полости при лечении абдоминального компартмент-синдрома у больных деструктивным панкреатитом. Хирургия. Журнал им. Н.И. Пирогова. 2012;(1):61‑66.
Myl'nikov AG, Pan'kov AG, Churadze BT, Usachev OIu, Shabrin AV, Shapoval’yants SG. The abdominal decompression for the treatment of the compartment syndrome in patients with the destructive pancreatitis. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(1):61‑66. (In Russ.).
Абдоминальным компартмент-синдромом (АКС) называют внезапное повышение давления в брюшной полости, которая представляет собой замкнутое пространство, в результате чего возникают глубокие нарушения функций дыхательной и сердечно-сосудистой систем, а также снижается перфузия печени, кишечника, почек и головного мозга [1, 10, 18].
Негативное влияние повышенного внутрибрюшного давления (ВБД) на различные органы и системы организма человека известно уже на протяжении почти 100 лет. Впервые связь между повышенным давлением в брюшной полости и нарушением функции сердечно-сосудистой системы с летальным исходом описал Эмерсон в 1911 г. [4]. Однако понимание того, что брюшная полость является замкнутым пространством, и стройная концепция внутрибрюшной гипертензии, которая может реализоваться в АКС, впервые появились в 80-х годах XX века [19]. Лишь через 10 лет после выявления патофизиологических закономерностей развития данного состояния стали внедряться хирургические методы его коррекции.
В норме ВБД близко к нулю. После лапаротомии оно может подниматься до 10 мм рт.ст., а изменения функции внутренних органов появляются при быстром подъеме давления в брюшной полости выше 15 мм. Таким образом, под термином «внутрибрюшная гипертензия» (ВБГ) понимается увеличение ВБД выше 15 мм рт.ст., что сопровождается начальными явлениями физиологических нарушений в организме [20].
В свою очередь о возникновении АКС можно говорить в том случае, когда ВБГ сопровождается недостаточностью функции одного или нескольких органов [18].
Выделяют 4 степени повышения ВБД: при I давление в брюшной полости составляет 10-15 мм рт.ст., при II - 16-25 мм, при II - 26-35 мм и при IV превышает 35 мм рт.ст., компартмент-синдром чаще возникает при II и IV степенях ВБГ [3, 17, 18].
Для измерения ВБД предложены прямые и непрямые методы. В настоящее время наиболее простым и распространенным является способ непрямой оценки давления в брюшной полости по уровню давления в мочевом пузыре. Метод не требует специальной аппаратуры и позволяет осуществлять мониторинг на протяжении любого необходимого промежутка времени. В группе больных с высоким риском развития ВБГ измерение внутрибрюшного давления проводят каждые 12 ч, а при необходимости и чаще [11, 13]. При этом необходимо обратить внимание на то, что величина давления в мочевом пузыре должна оцениваться только в совокупности с клинико-лабораторными показателями в связи с тем, что существует так называемая хроническая ВБГ. Основными причинами, приводящими к подобному состоянию, являются беременность, асцит, ожирение, крупные опухоли брюшной полости и забрюшинные опухоли. Кардинальное отличие острой ВБГ от хронической заключается в том, что последняя, развиваясь постепенно, не приводит к полиорганной недостаточности (ПОН), т.е. к АКС; у этих пациентов прямой зависимости между ВБД и функцией внутренних органов нет.
Системное влияние ВБГ на организм человека складывается из следующих составляющих: угнетение сердечной и дыхательной функций преимущественно за счет механических факторов (высокое стояние диафрагмы, уменьшение возврата венозной крови к сердцу на фоне компрессии нижней полой вены), снижение диуреза вплоть до анурии вследствие сдавления почечных вен, нарушение барьерной функции кишечника на фоне его гипоксии, что приводит к транслокации микроорганизмов через неповрежденную стенку кишки в воротный кровоток, лимфатические сосуды и брюшную полость с возможным ранним развитием сепсиса при отсутствии очевидного в общепринятом смысле его источника. Кроме того, увеличение объема внутренних органов, связанное с их отеком в условиях сдавления воротной вены, реализуется в дальнейшем повышении ВБД, замыкая таким образом порочный патофизиологический круг [1, 18].

Среди причин, приводящих к острому повышению ВБД и, как следствие, к АКС, выделяют спонтанные, послеоперационные, посттравматические и ятрогенные (см. таблицу).
Причина ВБГ может локализоваться в забрюшинном пространстве в виде отека и воспаления забрюшинной клетчатки или ретроперитонеальной гематомы либо в брюшной полости при непроходимости или парезе кишечника вследствие различных заболеваний, избыточном пневмоперитонеуме, широком тампонировании брюшной полости или ушивании ее с натяжением, например при аутопластическом закрытии дефекта брюшной стенки при больших вентральных грыжах [15, 18].
При остром деструктивном панкреатите (ОДП) наибольшее влияние на уровень ВБД оказывает массивная секвестрация жидкости в забрюшинную клетчатку, что значительно уменьшает объем брюшной полости, вследствие чего давление в ней возрастает; парез кишечника и асцит в этом случае играют значительно меньшую роль. Развитие ВБГ приходится на первую - стерильную - фазу заболевания, точнее - на первые 3-4 сут его течения, когда происходит быстрое накопление экссудата в парапанкреатическом, параколическом, реже в паранефральном клетчаточных пространствах. С учетом морфологической концепции развития панкреонекроза становится ясным, что более обширная деструкция поджелудочной железы (ПЖ) и забрюшинной жировой клетчатки значительно чаще может приводить к развитию ВБГ и соответственно АКС.

Летальность при возникновении АКС даже при своевременном проведении надлежащих лечебных мероприятий весьма высока и достигает 42-68%, а отсутствие адекватной коррекции или ее задержка всего на несколько часов неминуемо приводит к смерти больного [12]. Лечение данного состояния заключается в немедленном снижении ВБД путем декомпрессии брюшной полости, для чего обычно выполняют тотальную срединную лапаротомию (релапаротомию), устраняют причину ВБГ и увеличивают объем брюшной полости различными способами, чаще всего путем подшивания к апоневрозу по периметру раны заплаты из синтетического материала [6, 16, 21], подкожную клетчатку при этом тампонируют, швы на кожу не накладывают (рис. 1). Рисунок 1. Увеличение объема брюшной полости при АКС на фоне перитонита.
Если возникают показания к релапаротомии (например, запланированные санации брюшной полости при распространенном перитоните), последнюю выполняют путем рассечения заплаты, операцию завершают наложением швов на рассеченные края. После стихания проявлений основного заболевания, снижения ВБД и купирования ПОН заплату удаляют, а целостность брюшной стенки восстанавливают окончательно, включая ушивание апоневроза.
Сложность декомпрессии брюшной полости при АКС, возникшем на фоне ОДП, заключается в том, что лапаротомия в первой фазе его течения является крайне нежелательной и даже вредной манипуляцией в связи с практически неизбежным инфицированием еще не подвергшихся секвестрации некротизированных зон, что значительно усугубляет прогноз [9]. Кроме того, в развитии ПОН при панкреонекрозе, кроме АКС, важную роль играет цитокиновая агрессия, быстро устранить которую как хирургическим, так и неоперативным путем невозможно. Это означает, что снижение ВБГ при ОДП ликвидирует лишь одно из звеньев патогенеза ПОН, но не излечивает ее полностью.
На основании этих предпосылок мы пришли к мнению, что при выборе наиболее предпочтительного способа декомпрессии брюшной полости при АКС, возникшем у пациентов с ОДП, необходимо придерживаться следующих критериев:
1) операция должна приводить к максимальному увеличению объема брюшной полости;
2) обязательно сохранение полной герметичности париетальной брюшины;
3) вмешательство по возможности должно быть минимально травматичным.
Всем перечисленным условиям удовлетворяет так называемая фасциотомия, т.е. широкое рассечение апоневроза по белой линии живота. Объем брюшной полости при этой манипуляции увеличивается за счет расхождения прямых мышц живота и растяжения кожи и брюшины, герметичность брюшной полости сохраняется. При этом операция производится из небольших (2-3 см) кожных разрезов.
Нами разработан и впервые применен в клинической практике способ фасциотомии для лечения АКС при ОДП с благоприятным результатом [1] .
Влияние фасциотомии на течение АКС было ранее изучено в эксперименте на свиньях. Оказалось, что в результате операции у наблюдавшихся животных произошло быстрое снижение ВБД и усиление мезентериального кровотока [7].
В литературе удалось найти немногочисленные описания единичных клинических наблюдений фасциотомии, выполненной с целью лечения АКС, в том числе при остром панкреатите [8, 14] и при политравме [5]. Авторы руководствовались схожими предпосылками, однако технические аспекты описанной операции отличаются от разработанных нами, при этом нет указаний на выздоровление больных после ликвидации у них АКС.
Приводим собственное наблюдение.
Больной Б., 32 лет, поступил в клинику через 8 ч после появления симптомов острого панкреатита, которые возникли после употребления большого количества алкоголя. Состояние при поступлении было расценено как тяжелое: бледные кожные покровы с «мраморным» оттенком, тахикардия до 140 ударов в 1 мин, склонность к гипотензии (АД 100/60 мм рт.ст.), гиповолемия с уровнем Нb 192 г/л. Госпитализирован в отделение реанимации, где начата комплексная интенсивная терапия, исходный уровень ВБД был равен 8 мм рт.ст. При УЗИ обнаружены острый панкреатит, небольшое количество свободной жидкости в сальниковой сумке, признаки параколита слева.
Выполнена ЭГДС (выявлен эрозивный гастродуоденит), установлен назоеюнальный зонд, через который осуществляли энтеральное питание и селективную деконтаминацию кишечника.
На 2-е сутки заболевания и лечения на фоне относительно стабильного состояния у пациента отметили увеличение живота в объеме, при этом уровень ВБД составил 14 мм рт.ст. Диагностирована ВБГ I степени, лечение продолжено.
К началу 3-х суток развилась дыхательная недостаточность и энцефалопатия, что потребовало применения искусственной вентиляции легких и медикаментозной седации, в это же время обнаружили двустороннее геморрагическое пропитывание подкожной клетчатки в поясничных областях с переходом на бедра, что явилось свидетельством обширного тяжелого деструктивного процесса.
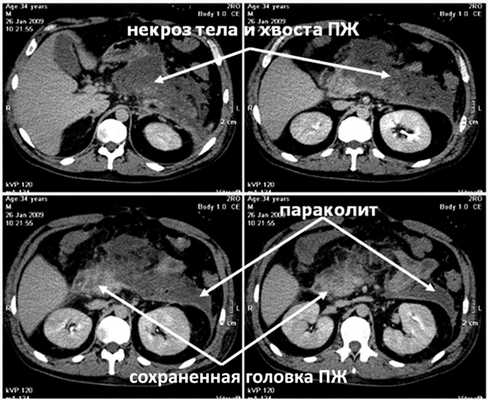
Выполнена КТ с внутривенным контрастным усилением (рис. 3, а), Рисунок 3. Компьютерные томограммы больного Б. а - при поступлении. Субтотальный некроз ПЖ, параколит слева. при которой диагностирован полный некроз тела и хвоста ПЖ с сохранением жизнеспособности только ее головки, парапанкреатит, левосторонний параколит, распространяющийся до подвздошной области.
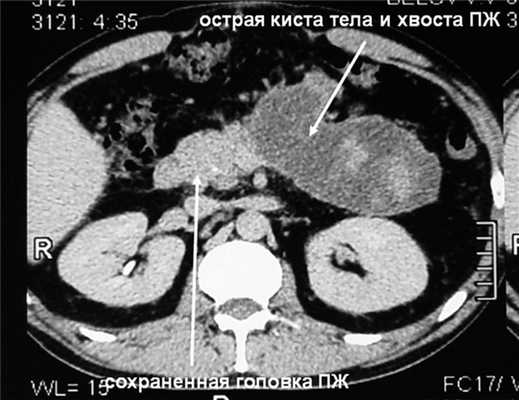
К середине этих же суток на фоне быстрого повышения ВБД до 28 мм рт.ст., что сопровождалось еще более значительным увеличением объема живота, возникли анурия и гипотензия с АД 75/40 мм рт.ст. Начато внутривенное введение дофамина в увеличивающихся дозах, максимально 12 мкг на 1 кг массы тела в 1 мин - без эффекта, затем - адреналина в дозе 0,15 мг на 1 кг массы тела в 1 мин, чем удалось стабилизировать АД на уровне 125/75 мм рт.ст. Проявления дыхательной недостаточности значительно усугубились - на фоне принудительной исскуственной вентиляции легких 100% кислородом индекс оксигенации снизился до критического уровня, составив 115 (нижняя граница нормы 350). Уровни мочевины и креатинина в сыворотке крови в это же время повысились до 32 ммоль/л и 298 мкмоль/л соответственно. Таким образом, на 3-и сутки заболевания и лечения у больного с субтотальным некрозом ПЖ и обширным некрозом забрюшинной жировой клетчатки отмечена развернутая картина прогрессирующей ПОН с недостаточностью функции четырех органов или систем (легких, почек, головного мозга, сердца и сосудов), что произошло на фоне ВБГ III степени. Диагностирован АКС, в связи с чем пациенту экстренно выполнили фасциотомию путем рассечения апоневроза по белой линии живота от мечевидного отростка до лонного сочленения без вскрытия брюшины из двух небольших кожных разрезов длиной по 3 см. Через 30 мин после операции ВБД снизилось с 28 до 19 мм рт.ст., а через 4 ч - до 14 мм рт.ст., после чего восстановился нормальный темп диуреза, показатели гемодинамики позволили прекратить инфузию адреналина, была уменьшена дыхательная поддержка. На 2-е сутки после операции ВБД снизилось до 8 мм рт.ст., на 3-и сутки - до 5 мм рт.ст. и впоследствии не повышалось. Суточный диурез составлял 2-2,5 л, показатели мочевины и креатинина крови к 5-м суткам после декомпрессии брюшной полости снизились до нормы. Постепенно индекс оксигенации повысился до нормальной величины, на 6-е сутки после операции больной был переведен на режим вспомогательной вентиляции, а через 10 сут после фасциотомии - на самостоятельное дыхание. Швы с ран сняты в срок, зажили первичным натяжением. Фазу инфекционных осложнений ОДП удалось миновать путем комплексной профилактики, включающей внутривенное введение тиенама в дозе 3 г в сутки, энтеральное зондовое питание и селективную деконтаминацию желудочно-кишечного тракта. На 14-е сутки лечения больной переведен в хирургическое отделение. Необходимости выполнения чрескожных диагностических и лечебных вмешательств под контролем УЗИ, а также хирургической некрсеквестрэктомии не возникло. В области некротизированных тела и хвоста ПЖ образовалась острая псевдокиста размером 17×7×7 см, параколит регрессировал (см. рис. 3, б). Рисунок 3. Компьютерные томограммы больного Б. б -перед выпиской. Через 29 сут лечения больной был выписан.
Госпитализирован через 3 мес в плановом порядке (рис. 4). Рисунок 4. Вид передней брюшной стенки того же больного перед грыжесечением. При компьютерной томографии (рис. 5) Рисунок 5. Компьютерная томограмма того же больного перед грыжесечением. киста уменьшилась в размерах до 12×5×4 см, начинает замещаться рубцовой тканью, клинические проявления ее отсутствуют, признаков сахарного диабета и экскреторной недостаточности ПЖ нет.
Выполнено грыжесечение с пластикой дефекта в апоневрозе синтетическим аллотрансплантатом, послеоперационный период протекал без осложнений (рис. 6). Рисунок 6. Вид передней брюшной стенки того же больного после грыжесечения.
Представленное наблюдение демонстрирует, с одной стороны, важную роль внутрибрюшной гипертензии в развитии и стремительном прогрессировании полиорганной недостаточности при тяжелом деструктивном панкреатите, с другой - достоинства своевременно выполненного оригинального способа декомпрессии брюшной полости, осуществленного без вскрытия брюшины. Вовремя сделанная фасциотомия и использование современного комплекса интенсивной терапии позволили добиться излечения больного, находившегося в крайне тяжелом состоянии, без выполнения миниинвазивных вмешательств и травматичной некрсеквестрэктомии.
[1] Патент на изобретение№2397715 с приоритетом от 26.03.09 [2]. Выдан Федеральной службой по интеллектуальной собственности.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
ГБУЗ Ярославской области «Областная клиническая онкологическая больница», Ярославль
ГБОУ ДПО "Российская медицинская академия последипломного образования" Минздрава России
Индивидуальный подход к выбору тактики билиарной декомпрессии у больных с опухолями гепатобилиопанкреатодуоденальной зоны
Журнал: Доказательная гастроэнтерология. 2014;3(3): 52‑56
Бурдюков М.С., Гусев Д.В., Гвоздев А.А., Кашин С.В., Нечипай А.М. Индивидуальный подход к выбору тактики билиарной декомпрессии у больных с опухолями гепатобилиопанкреатодуоденальной зоны. Доказательная гастроэнтерология. 2014;3(3):52‑56.
Burdiukov MS, Gusev DV, Gvozdev AA, Kashin SV, Nechipaĭ AM. The individualized approach to the choice of the strategy for biliary decompression in the patients presenting with the tumours in the hepatobiliary and pancreatoduodenal region. Russian Journal of Evidence-Based Gastroenterology. 2014;3(3):52‑56. (In Russ.).
Механическая желтуха [1] достаточно часто осложняет течение заболевания у пациентов с опухолями гепатобилиопанкреатодуоденальной зоны (ГБПЗ). Тяжелым и, нередко, фатальным осложнением механической желтухи (МЖ) является печеночная недостаточность, переходящая (в случае неустранения билиарной обструкции и непринятия иных мер патогенетического лечения) в печеночно-почечную и затем в полиорганную. Печеночная недостаточность, независимо от причины МЖ, протекает однотипно, ее вызывает развивающийся «цитолитический» синдром, а усугубляют — опухолевая интоксикация, холангит, кровотечение. Тяжесть осложнений МЖ зависит от уровня и длительности гипербилирубинемии: уровень свыше 200 мкмоль/л считается угрожающим, а 400 мкмоль/л — критическим для развития печеночной недостаточности, неблагоприятным прогностическим фактором. Поэтому механическая желтуха должна быть, безусловно, устранена путем осуществления желчеотведения одним из известных способов: хирургическим, интервенционно-радиологическим, эндоскопическим, сочетанным. Выбор же наиболее рационального способа во многом зависит от технических и методологических особенностей способа дренирования желчного дерева, от общего состояния пациента на момент обращения и, несомненно, должен проводиться с оглядкой на возможное развитие одного или ряда осложнений из числа их достаточно широкого спектра.
Декомпрессия желчного дерева является приоритетной задачей, которая должна выполняться либо в экстренном, либо в срочном порядке. Ее задачей является стабилизация общего состояния больного для последующего избрания рациональной тактики клинического ведения пациента после его обстоятельного дообследования в условиях устраненной механической желтухи.
Клинический случай
Женщина 72 лет с клиникой механической желтухи, диагноз: опухоль головки поджелудочной железы.
Из анамнеза: год назад была госпитализирована в срочном порядке по поводу механической желтухи в больницу по месту жительства. Выполнено антеградное стентирование общего желчного протока самораскрывающимся металлическим стентом, восстановившее внутренний отток желчи. Установлен диагноз: псевдотуморозный панкреатит. Через 1 мес после установки стента у пациентки развился желчный перитонит, осложнившийся формированием поддиафрагмального абсцесса. По экстренным показаниям выполнена ревизия и дренирование брюшной полости; в ходе операции стент в общем желчном протоке не был найден. Сформирована холецистостома. Через 2 мес после холецистостомии вновь развилась клиника желчного перитонита. По экстренным показаниям выполнена лапаротомия. Ввиду выраженного спаечного процесса в гепатодуоденальной зоне точно установить причину «острого живота» не удалось. Выполнена холедохотомия в видимой среди сращений части общего желчного протока и установлен наружный дренаж с формированием наружного свища. Через 6 мес пациентка вновь госпитализирована в больницу по месту жительства с клиникой острого панкреатита. Проводилась консервативная терапия. При дообследовании в проекции головки поджелудочной железы выявлено патологическое образование, стенозирующее интрапанкреатическую часть общего желчного протока и панкреатический проток.
МРТ: головка поджелудочной железы — 3,3×3,5×3,8 см, тело — 2,1 см, хвост — 1,6 см, расширенный панкреатический проток — до 1,0 см, расширенный общий желчный проток — до 1,6 см, стеноз интрапанкреатической части общего желчного протока, стеноз панкреатического протока на уровне головки поджелудочной железы (рис. 1).
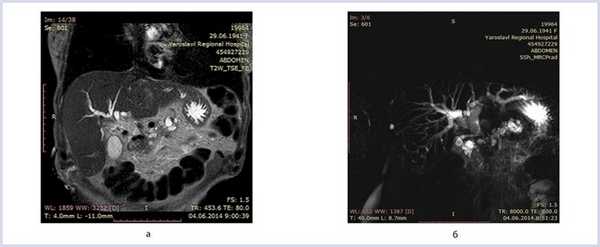
Рис. 1. Магнито-резонансная томография желчных протоков. а — МРТ-картина органов панкреатобилиарной зоны в Т1-режиме; б — магниторезонансная панкреатикохолангиография в Т2-режиме.
При эндоскопическом исследовании в бульбодуоденальной зоне определяется стенотическое сужение просвета двенадцатиперстной кишки (ДПК). Провести эндоскоп в нисходящую ветвь ДПК не представляется возможным.
План вмешательства: 1-й этап диагностический — эндоскопическая ультрасонография (ЭУС) и тонкоигольная пункция (ЭУС-ТИП), 2-й этап лечебный — внутреннее или наружновнутреннее дренирование желчевыводящих путей (рис. 2).
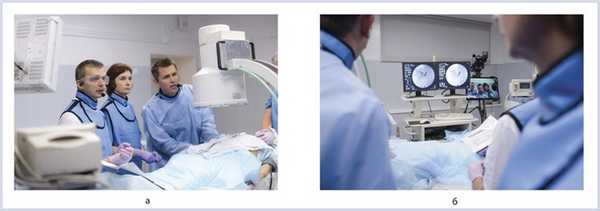
Рис. 2. Установка наружной холангиостомы. а — эксперты в операционной: Торстен Бейна (Дюссельдорф, Германия), М.С. Бурдюков (Москва, Россия), медсестра — Т.Ю. Колесова; б — установка чрескожной чреспеченочной наружно-внутренней холангиостомы под рентгенологическим контролем.
Выполнено ЭУС: УЗ-признаки нарушения желчеоттока на уровне интрапанкреатической части холедоха; признаки компрессии общего желчного и Вирсунгова протока на уровне головки поджелудочной железы (рис. 3). В проекции головки определяется округлое образование с нечеткими контурами до 30 мм в диаметре, пониженной эхогенности. Выполнена ЭУС-тонкоигольная пункция методикой вакуумной аспирации эндоскопической иглой Boston Sсient 22 G.
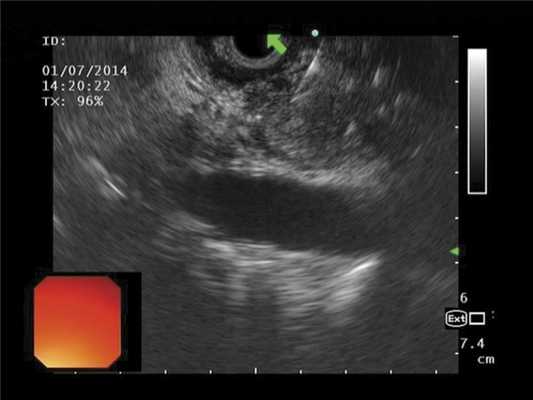
Рис. 3. Выполнение тонкоигольной пункции образования головки поджелудочной железы иглой Boston Scientific диаметром 22 G, под контролем конвексного ультразвукового эндоскопа Олимпус GE-UCT 140.
Цитологическое исследование (рис. 4): деструктивные массы, разрушенные лейкоциты, реактивные изменения протокового эпителия, умеренно выраженный воспалительный процесс, фрагменты стромы.
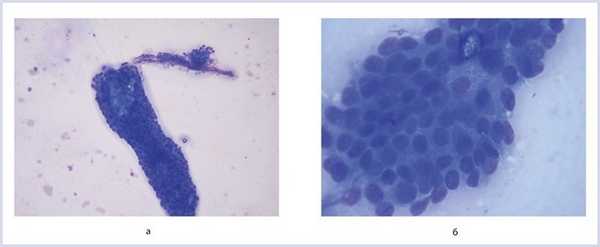
Рис. 4. Цитологический препарат. Окраска азур-эозином по Романовскому—Гимзе. Ув. 20 (окуляр) ×10 (линза) (а) и 20×100 (б).
Учитывая данные эндоскопического обследования, невозможность выполнения эндоскопической ретроградной паткреатохолангиографии (ЭРХПГ) вследствие выраженного стеноза постбульбарного отдела ДПК, для устранения билиарной гипертензии выполнено формирование чрескожной чреспеченочной наружно-внутренней холангиостомы (рис. 5).
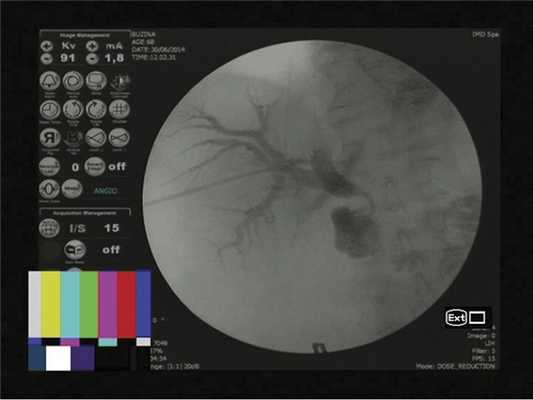
Рис. 5. Рентгенологическая картина установленного наружно-внутреннего дренажа. Контрастное вещество Омнипак в разведении 1:1.
С помощью иглы Chiba по правой аксиллярной линии в межреберье выполнена поисковая пункция правой доли печени, визуализирован правый передний секторальный проток, далее струна-проводник проведена во внепеченочные желчные протоки и просвет ДПК. По ней выполнено бужирование холангиостомического канала до 9 fr, низведен наружно-внутренний дренаж типа pig tail в просвет ДПК, по которому стала выделяться ахоличная желчь с примесями нитей фибрина. Холангиостома проверена на проходимость, фиксирована к коже.
На 2-е сутки после вмешательства отмечался выраженный лейкоцитоз (до 42⋅10 9 /л), состояние пациентки, несмотря на весь комплекс проводимой терапии, ухудшилось, появились перитонеальные симптомы, на 4-е сутки после дренирующей операции на фоне развития полиорганной недостаточности и холангиогенного сепсиса наступила смерть пациентки.
Дискуссия
В настоящее время наиболее широко используемыми методами декомпрессии желчных путей являются антеградный (путем чрескожно-чреспеченочной холангиостомии (ЧЧХС) или холецистостомии [1]) или ретроградный, транспапиллярный [2, 3], как наименее травматичные, малоинвазивные. Также в клиниках, где отсутствует возможность малоинвазивного лечения желтухи, выполняются хирургические дренирующие вмешательства, которые также практикуются при безуспешности малоинвазивных способов декомпрессии желчных путей [4—6]. Однако выполнение хирургических операций на высоте желтухи сопряжено с крайне высоким риском развития осложнений, вплоть до летальных исходов [7]. Частота достижения цели таких вмешательств — 75—100% [8]. В исследовании С.В. Давыдовой [9] оценены результаты декомпрессионных хирургических вмешательств, выполненных по поводу опухолевой МЖ: успешность технического выполнения составила 96,7%, а хороший функциональный эффект, достигнутый в результате проведенных операций, — 85%. В результате комплексного анализа характера и частоты послеоперационных осложнений, летальности, длительности пребывания больных на клинической койке, эффективности дренирующих вмешательств, несмотря на их удовлетворительные результаты и хорошее качество жизни больных, автором сделан вывод о существенном риске хирургического разрешения МЖ для пациентов. Таким образом, хирургическое разрешение МЖ выполнением шунтирующих вмешательств возможно, однако этот способ значительно травматичнее интервенционно-радиологического и эндоскопического, сопровождается большей частотой осложнений и послеоперационной летальностью, не всегда приводит к достижению хорошего дренирующего эффекта. Поэтому в клиниках, располагающих альтернативными малоинвазивными технологиями билиарной декомпрессии, этот метод может быть применен лишь в тех редких случаях, когда попытки эндоскопического либо интервенционно-радиологического восстановления проходимости желчных протоков были безуспешными.
Способ антеградного билиарного дренирования известен с 1956 г., когда I. Remolar [10] предложил методику создания наружного желчного свища путем чрескожной пункции и введения в желчные протоки полиэтиленового дренажного катетера. S. Seldinger [11] в 1957 г. сообщил о выполнении ЧЧХС по методике, предложенной им ранее для катетеризации сосудов. Первое внутреннее дренирование желчи стентированием желчных протоков из чрескожного доступа выполнил R. Pereiras [12] в 1978 г. В основу метода положено формирование холангио- или холецистостомы с последующим решением вопроса о направлении дренирования желчи: наружном или внутреннем. Учитывая травматичность метода, потенциальную возможность развития тяжелых осложнений, нефизиологичность способа желчеотведения и значительное ограничение качества жизни холангиостомированных больных, чрескожное дренирование рядом авторов рассматривалось лишь в качестве метода выбора при безуспешности попыток эндоскопического восстановления внутреннего желчеоттока [13—17]. Salman Fazal [18] также считает антеградный способ малоинвазивного устранения МЖ методом выбора при невозможности выполнения ЭРХПГ и ретроградного дренирующего вмешательства.
Основными показаниями для антеградного дренирования желчных протоков представляются: а) анатомические особенности, при которых выполнить ЭРХПГ технически невозможно (состояние после резекции желудка по Бильроту-2, после операций с формированием межкишечных анастомозов по Ру, выраженная деформация или стенотическая стриктура ДПК, выраженные патологические изменения кишечной стенки в зоне Одди, при которых невозможно визуализировать устье БДС), б) техническая невозможность ретроградной селективной канюляции желчных путей [19, 20].
По данным C. Becker [21], R. Clark [22], J. Ferrucci [23], Harbin W. [24], J. Hamlin [25], J. Lameris [26], H. Yoshimura [27], частота возникновения осложнений после ЧЧХС составляет 5,4—74%, летальность после ЧЧХС, по данным разных авторов, 0,8—33% [28—33].
ЭРХПГ и сопряженные с ней диагностические и дренирующие методики — наиболее сложный раздел эндоскопии. Техническая возможность их выполнения при опухолевых поражениях органов ГБПЗ зависит от ряда факторов. Главными причинами, лимитирующими такую возможность, являются: а) изменения анатомии верхних отделов пищеварительного тракта в результате перенесенных операций (гастрэктомия с формированием Y-образного или конце-петлевого пищеводно-кишечного анастомоза, дистальная резекция желудка по Бильроту-2, гастропанкреатодуоденальная резекция, спаечная деформация начальных отделов тонкой кишки у больных, перенесших указанные операции и др.); б) стенотические сужения пищевода, желудка, ДПК, препятствующие достижению «зоны интереса»; в) деформация зоны Одди, препятствующая визуализации БДС; г) «поглощение» БДС опухолью, не позволяющее идентифицировать его устье и др. В таких условиях выполнение ЭРХПГ либо затруднено, либо же вообще технически невозможно [18]. Успешность выполнения ЭРХПГ зависит и от личного опыта врача-эндоскописта, от количества выполняемых им в течение года ЭРХПГ [34—38]. Техническая возможность выполнения эндоскопического декомпрессионного вмешательства (даже в случаях успешного канюлирования желчных протоков) зависит от уровня их блока: так, по данным М.В. Хрусталевой [39], выполнение дренирующих вмешательств при дистальном, среднем и проксимальном блоках внепеченочных протоков оказалось возможным в 83,3, 100 и 65,8% случаев соответственно.
Выводы: данный случай является одним из наиболее сложных для принятия оптимального решения о тактике клинического ведения больного. Индивидуальные особенности анатомии пациентки не позволили выполнить эндоскопическое дренирование — как наименее травматичное вмешательство. С учетом клинической необходимости было принято решение об альтернативном — антеградном способе билиарной декомпрессии. Изначально этот шаг был сопряжен с крайне высоким риском развития осложнений, так как предыдущие аналогичные вмешательства, так или иначе, сопровождались осложнениями в послеоперационном периоде. В этой связи, а также с учетом отсутствия каких-либо альтернатив, было выполнено антеградное дренирование протоковой системы печени. Несмотря на успешность технического выполнения вмешательства, послеоперационный период осложнился развитием перитонита и холангита, что в конечном итоге привело к летальному исходу.
Поэтому, несмотря на огромный накопленный опыт дренирующих вмешательств при механической желтухе, широкое применение различных малоинвазивных методик устранения билиарной гипертензии и предупреждения развития грозных осложнений механической желтухи, инструментально-технический прогресс, проблема воспомоществования больным с тяжелыми осложнениями опухолевых поражений органов ГБПЗ продолжает остается крайне актуальной и требует скрупулезного, индивидуализированного подхода к каждому конкретному пациенту.
Читайте также:
