Систолический тон изгнания при легочной гипертензии. Шум Грехэм Стила при ДМЖП
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Факторы влияющие на систолический шум при ДМПП. Первый тон сердца при ДМПП
Анализ данных показал, что нет достоверного различия по всем трем показателям между больными с большой и средней, средней и малой, большой и малой амплитудами систолического шума. Таким образом, в соответствии с данными ряда авторов мы считаем необходимым отметить, что амплитуда систолического шума при дефекте межпредсердной перегородки не находится в прямой зависимости от объема артерио-венозного сброса, систолического градиента давления между правым желудочком и легочной артерией, диаметра дефекта. Отсутствие прямой зависимости этого важного звукового признака дефекта межпредсердной перегородки от указанных показателей гемодинамики и диаметра дефекта можно объяснить его своеобразным «функциональным» генезом. Очевидно, что в этих условиях интенсивность шума определяется совокупностью ряда факторов.
Не отмечается достоверного различия по всем трем показателям между больными с пиком систолического шума в первой половине систолы и в середине ее (аналогично амплитуде систолического шума).
При определении протяженности систолического шума также не наблюдается достоверного различия по всем трем гемодинамическим показателям.
Таким образом, мы не установили зависимости параметров систолического шума на легочной артерии от показателей гемодинамики.
Кроме расщепления II тона и систолического шума, при дефекте межпредсердной перегородки определялся ряд дополнительных звуковых симптомов.
Об изменении I тона имеются весьма противоречивые данные. Kjellberg с соавторами (1955), К. Холльдак и Д. Вольф (1964) считают, что он не имеет особенностей. В. Йонаш так же, как Leatham (1954), указывает на усиление I тона за счет усиления закрытия трехстворчатого клапана, a Maciera-Coelho и Guimaraes (1964) подчеркивают, что это обусловлено повышением давления во время изометрического сокращения.
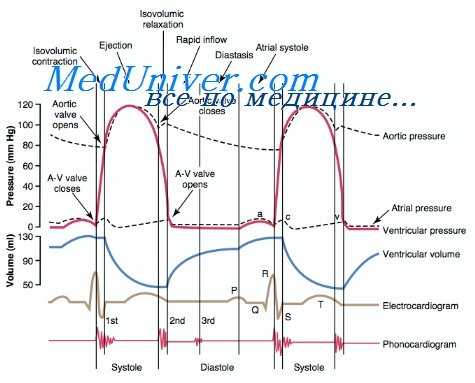
Leatham и Gray (1956), 3. Л. Долобчян (1963), Zuckermann (1963), Н. К. Горянина (1966) отмечают, что расщепление I тона возникает вследствие запаздывания закрытия трехстворчатого клапана в результате более медленного подъема давления в правом желудочке и блокады правой ножки пучка Гиса. Доказательством этого Eisenberg и Hultgren считают тот факт, что расщепление сохраняется после хирургической коррекции порока, так как сохраняется блокада ножки пучка Гиса. Leatham и Gray (1956), кроме того, отмечают, что при наличии легочной гипертензии у больных с дефектом межпредсердной перегородки I тон не был расщеплен. Dimond, Benchimol (1960) не находят коррекции между наличием расщепления I тона и степенью легочной гипертензии.
Ряд авторов подвергает сомнению наличие расщепления I тона за счет запаздывания закрытия трехстворчатого клапана. Они считают, что второй компонент I тона — это систолический тон изгнания, a Barrit с соавторами (1965) связывают его с тоном открытия клапана легочной артерии.
Увеличение амплитуды I тона мы обнаружили у 17 больных, нормальную амплитуду — у 28 и расщепление I тона (0,03—0,04 сек.) — у 8 из 53. Эти изменения I тона сопоставляли с систолическим давлением в правом желудочке.
Анализ данных показал, что имеется достоверное различие между больными с увеличенной и нормальной амплитудой I тона и больными с увеличенной амплитудой и расщепленным I тоном (для обоих случаев р<0,05). Различие между больными с нормальной амплитудой и расщепленным I тоном не достоверно.
Следует отметить, что у всех больных с расщеплением I тона трикуспидальный его компонент был больше, чем митральный.
Таким образом, очевидно, что повышенное систолическое давление в правом желудочке вызывает увеличение амплитуды I тона за счет усиления трикуспидального компонента.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Систолический тон изгнания при легочной гипертензии. Шум Грехэм Стила при ДМЖП
Наряду с большим нерасщепленным II тоном важным признаком легочной гипертензии является систолический тон изгнания на легочной артерии. Этот симптом был обнаружен нами у 5 из 38 больных с дефектом межжелудочковой перегородки, осложненным выраженной легочной гипертензией. Он не был зафиксирован ни у одного из 70 остальных больных, у которых систолическое давление в легочной артерии было нормальным или повышенным, но не более 70% от системного.
Таким образом, систолический тон изгнания является достоверным признаком легочной гипертензии, однако он обнаруживается у небольшого числа больных. Это может быть объяснено тем, что возникновение тона изгнания связано не. только с уровнем давления в легочной артерии, но и со степенью ее растяжения и, изменениями эластичности ее стенки.
Наконец, следует остановиться и на таком признаке легочной гипертензии, как диастолический шум относительной недостаточности клапана легочной артерии (шум Грехэм Стила). При дефекте межжелудочковой перегородки его описывали Dowing, Goldberg (1956), Fuler с соавторами (1958), Bleifer с соавторами (1960), В. С. Савельев и Н. С. Кухарева (1961), Л. А. Вишневский и С. Ш. Харнас (1962), М. В. Муравьев (1966), Gasul с соавторами (1966).
Мы не обнаружили диастолического шума Грехэм Стила ни у одного больного. В то же время установили этот шум у больных с межжелудочковым дефектом, осложненным тяжелой легочной гипертензией с обратным венозно-артериальным сбросом (синдром Эйзенменгера).
Мы сочли целесообразным проанализировать особенности фонокардиограммы по гемодинамическим группам, используя классификацию Л. Р. Плотниковой.
Подобные исследования с выделением групп больных по различным классификациям проведены А. Р. Литвиненко (1963, 1966), Г. М. Соловьевым с соавторами (1964, 1967), Т. Е. Ежовой (1965), Н. К. Горяниной.
Приводим основные гемодинамические показатели, использованные нами для сопоставления с фонокардиографическими данными.
В I группу вошло 25 больных в возрасте 5— 25 лет. Систолическое давление в легочной артерии 21—30 (в среднем 27,1 ±1,3), диастолическое — 4,5—15 мм рт. ст. (в среднем 11,7±1,4). Общелегочное сопротивление не превышало 247 дин•сек•см-5 (в среднем 164,0± ±27,9) и составляло до 19% периферического (в среднем 12,5±1,5). Сброс крови из левого желудочка в правый 26—63% МО малого круга коовообращения (в среднем 36,6 ±5,7).
Систолическое давление в плечевой артерии 81— 160 мм рт. ст. (в среднем 118,0±6,9). Диаметр дефекта 0,5—1,0 см (в среднем 0,8±0,05).
Во II группу включено 45 больных в возрасте 3—34 лет. Систолическое давление в легочной артерии 36—80 (в среднем 47,2 ±3,0), диастолическое — 9— 45 мм рт. ст. (в среднем 20,9 ±2,5). Общелегочное сопротивление у большинства больных не превышало 300 дин-сек-см"5 и только у 2 достигало 400 и 542 дин-сек-см~5, в среднем 243,4±43,1 дин-сек-см-5 и составляло не более 29% от периферического (в среднем 18,6±3,6). Артерио-венозный сброс крови через дефект 42—84% (в среднем 50,5±5,0) МО малого круга кровообращения. Систолическое давление в плечевой артерии 69—120 мм рт. ст. (в среднем 98,8±3,9). Диаметр дефекта 1,0—2,0 см (в среднем 1,4±0,1).
III группа. В подгруппу А вошло 26 больных в возрасте 3—20 лет; 25 из них оперированы. У всех больных была высокая легочная гппертензия: систолическое давление в легочной артерии 60—96 (в среднем 80,0±5,6), диастолическое — 30—72 мм от. ст. (в среднем 45,0±4,6).
Общелегочное сопротивление 238—657 дин•сек•см-5 и только у одного больного оно достигало 1434, в среднем 472,3±71,0 и составляло 16—50% от периферического (в среднем 36,0±5,5). Артерио-венозный сброс крови: 42—74% МО малого круга кровообращения (в соедкем 56,5±4,3). Систолическое давление в плечевой артерии 66—125 мм рт. ст. (в среднем 99.2 + 5,6). Диаметр дефекта 2,0—3,0 см и лишь у одной больной 4,0 см (в среднем 2,5 ±0,4).
В подгруппу Б включено 12 больных в возрасте 4—28 лет, оперировано 6. Систолическое давление в легочной артерии у всех было более 70% системного — 66—120 (в среднем 93,7±11,0), диастолическое — 36— 78 мм рт. ст. (в среднем 65,1 ±9,7). Общелегочное сопротивление 855—2000 дин*сек*см-5 (в среднем 1288,0± ±415,8), что составляло 59—94% от периферического (в среднем 72,4±11,2). В группу была включена больная с общелегочным сопротивлением 59% и артерио-венозным сбросом 40% МО малого круга. Больная погибла после операции, и морфологические данные указывали на необратимый характер изменений сосудов малого круга, что позволило отнести больную в эту подгруппу.
Артерио-венозный сброс крови 19—40% МО малого круга кровообращения, а у 3 больных он был сбалансированным, в среднем составлял 30,7±7,2%. Систолическое давление в плечевой артерии 72—120 мм рт. ст. (в среднем 99,0 ±8,0). Размеры дефекта у 6 оперированных больных составляли 2,0—3,0 см (в среднем 2,4 ±0,4).
Пансистолический шум при дефекте межжелудочковой перегородки. Характеристика систолического шума при ДМЖП
Futura (1961), Hollmann с соавторами (1963) подчеркивали, что при пансистолическом шуме у больных не отмечалось легочной гипертензии, а при коротком систолическом шуме никогда не было нормального давления в легочной артерии.
Зависимость параметров систолического шума от показателей гемодинамики мы определяли у 108 больных с дефектом межжелудочковой перегородки. Всех больных катетеризировали и 101 из них оперировали с коррекцией порока в условиях искусственного кровообращения. Мы изучали следующие соотношения: 1) интенсивность (амплитуда) систолического шума в зависимости от величины сброса крови из левого желудочка в правый, разницы систолического давления в плечевой артерии (соответствует левому желудочку) и правом желудочке, диаметра дефекта; 2) протяженность систолического шума; 3) положение пика шума (максимальных осцилляции) в зависимости от величины сброса и разницы систолического давления между плечевой артерией и правым желудочком.
1. Систолический шум тока крови через дефект, с максимумом в III—IV межреберье у левого края грудины был обнаружен у всех обследованных. При этом у 90 больных он имел большую амплитуду, у 10 —среднюю и у 8 — малую.
У всех больных интенсивность систолического шума сравнивалась с объемом артерио-венозного сброса, разницей систолического давления в плечевой артерии и правом желудочке и у 91 —с диаметром дефекта.
Имеется достоверное различие по объему сброса между больными с систолическим шумом средней и малой, большой и малой амплитуд, по разнице систолического давления между плечевой артерией и правым желудочком между всеми тремя группами больных с систолическим шумом большой, средней и малой амплитуды. Недостоверно различие по объему сброса между больными с систолическим шумом большой и средней амплитуды и по диаметру дефекта.
Таким образом, объем артерио-венозного сброса можно ориентировочно оценивать по интенсивности систолического шума. Особенно четко это различие между группами с систолическим шумом большой и малой амплитуды.
Уменьшение разницы систолического давления между плечевой артерией (resp. левым желудочком) и правым желудочком приводит к уменьшению интенсивности систолического шума. У больных с систолическим шумом малой амплитуды разница систолического давления минимальна.
2. Протяженность систолического шума и гемодинамические показатели. Систолический шум у наших больных занимал от одной трети до всей систолы, причем независимо от гемодинамических показателей у некоторых больных он имел голосистолический характер (не сливался с I и II тонами), а у части — пансистолическии (сливался с I и II тонами).
При сопоставлении протяженности систолического шума с величиной артерио-венозного сброса и разницей систолического давления в плечевой артерии и правом желудочке мы разделили больных на две группы: больные с шумом, занимающим всю систолу, — 93 чел. и больные с шумом, занимающим от 7з до 2/3 систолы, — 15. У больных первой группы объем артерио-венозного сброса составлял 0—78% к МО малого круга кровообращения (50,0±1,5), разница систолического давления в плечевой артерии и правом желудочке — 0— 123 мм рт. ст. (50,0±3,1), у второй группы соответственно 0—72% (35,0±6,4) и 0—27 мм рт. ст. (8,0±2,3).
Таким образом, имеется достоверная зависимость между объемом артерио-венозного сброса и протяженностью систолического шума. Существенное отличие определяется по разнице систолического давления в плечевой артерии и правом желудочке: при укорочении систолического шума она была минимальной и значительно отличалась от группы больных с пан- и голосистолическим шумом.
3. Положение максимальных осцилляции (пика) шума и гемодинамические показатели. Мы обследовали две группы больных: с пиком шума в середине или во второй половине систолы (77 чел.) и с пиком в первой половине ее (31 чел.). У больных первой группы объем артерио;веиозного сброса составил 1-9—84% К МО малого круга кровообращения (49,0±1,6), разница систолического давления в плечевой артерии и правом желудочке 0—123 мм рт. ст. (57,0±3,1), у больных второй группы соответственно 0—72% (4-3,0±4,4) и 0— 29 мм рт. ст. (11,0 ±1,7).
Обращает на себя внимание отсутствие зависимости положения пика систолического шума от объема сброса и четкое отличие по разнице систолического давления в плечевой артерии и правом желудочке (р<0,001). У больных с пиком систолического шума в первой половине систолы эта разница минимальная.
- Таким образом, как видно из проведенных исследований, параметры систолического шума помогают при оценке ряда гемодинамических показателей у больных с дефектом межжелудочковой перегородки.
Кроме систолического шума, при дефекте межжелудочковой перегородки отмечается ряд других важных звуковых симптомов.
Расщепление II тона сердца при ДМПП. Систолический шум при ДМПП
Расщепление II тона определялось нами во II—III межреберье у левого края грудины у 51 больного с дефектом межпредсердной перегородки. Все больные оперированы и всем проведена катетеризация правых отделов сердца. Интервал между аортальным и легочным компонентами (время запаздывания легочного компонента II тона) в пределах 0,03—0,07 сек. У 2 больных определялся большой нерасщепленпый II тон.
Степень расщепления II тона сопоставлялась с объемом артерио-венозного сброса, систолическим давлением в легочной артерии, общелегочным сопротивлением и диаметром дефекта.
Имеется достоверная обратная корреляция между величиной систолического давления в легочной артерии, общелегочным сопротивлением и интервалом IIА—IIP. Чем выше давление в легочной артерии, чем выше общелегочное сопротивление, тем меньше степень расщепления II тона. Не отмечается корреляции степени расщепления II тона с объемом артерио-веиозного сброса и диаметром дефекта.
Полученные нами данные об интервале между аортальным и легочными компонентами II тона позволяют считать этот признак достоверным при решении вопроса о выраженности легочной гипертензии.
Ввиду наличия у больных увеличенного (у 48) и нормального (у 5) легочного компонента II тона, мы решили определить соотношение его с диастолическим давлением в легочной артерии, влияющим, как известно, на интенсивность закрытия клапана легочной артерии.
При увеличенном легочном компоненте II тона диастолическое давление в легочной артерии составляет 6—36 мм рт. ст. (12,8±1,0), при нормальном — 9—18 (11,1 ±1,7). Различие между группами не достоверно.
Очевидно, что наличие гиперволемии малого круга кровообращения у большинства больных с дефектом межпредсердной перегородки обусловливает увеличение легочного компонента II тона независимо от уровня диастолического давления в легочной артерии.
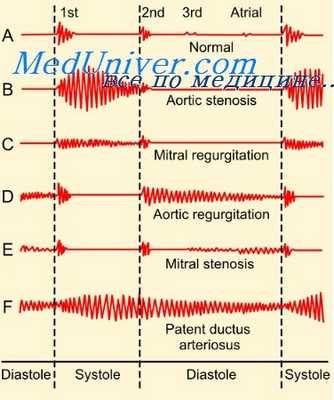
Систолический шум с максимумом во II межреберье слева от грудины при дефекте межпредсердной перегородки обусловлен увеличенным кровотоком через устье легочной артерии (относительный стеноз ее). Этот генез шума подтвержден исследованиями Feruglio, Sreenivasan (1959), которые при записи внутрисердечной фонокардиограммы установили, что шум записывается в легочной артерии с максимумом у ее клапанов. Синхронная запись с наружной фонокардиограммой подтвердила идентичность шумов по форме и продолжительности.
Таким образом, систолический шум при межпредсердной дефекте относится к шумам изгнания, имеет веретенообразную или ромбовидную форму, заканчивается до или к аортальному компоненту II тона, пик его располагается в первой половине или середине систолы.
Zuckermann (1963) считал, что сила и продолжительность систолического шума прямо пропорциональны объему шунта и обратно пропорциональны давлению в легочной артерии. Н. И. Комарова и Т. Н. Ежова (1964), Barrit с соавторами (1965) установили, что систолический шум тем больше, чем больше систолический градиент между давлением в правом желудочке и легочной артерии.
Eisenberg и Hultgren (1959) отмечали, что зависимость интенсивности систолического шума от величины шунта слева направо была нечеткой. Сильный систолический шум отмечали Mouquin, Py (1962) при систолическом градиенте более 10 мм рт. ст., большом дефекте и большом шунте. Futura (1961) установил, что время пика систолического шума связано с функциональным градиентом между правым желудочком и легочной артерией.
Систолический шум у наших больных регистрировался с максимумом во II межреберье слева от грудины, имел характерную форму веретена или ромба. Амплитуда систолического шума была большой у 9, средней у 19 и малой у 25 больных; положение пика шума в первой половине систолы у 44 и в середине у 9; окончание шума до аортального компонента у 37, с аортальным компонентом II тона у 16.
Указанные параметры систолического шума сопоставлялись с объемом артерио-венозного сброса (из левого предсердия в правое), систолическим давлением в легочной артерии и систолическим градиентом давления между правым желудочком и легочной артерией.
Дефект межжелудочковой перегородки (Q21.0)
Дефект межжелудочковой перегородки (ДМЖП) - наиболее распространенный изолированный врожденный порок, обнаруживаемый при рождении. Довольно часто ДМЖП диагностируется и во взрослом возрасте.
При наличии показаний, проводят лечение порока в детстве. Нередко наблюдается спонтанное закрытие дефекта.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Выделяют четыре возможные локализации дефекта межжелудочковой перегородки (ДМЖП):
1. Мембранозный, перимембранозный, коновентрикулярный - наиболее частая локализация дефекта, встречается в приблизительно 80 % всех ДМЖП. Дефект обнаруживается в мембранозной части межжелудочковой перегородки с возможным распространением на входной, септальный и выходной отдел перегородки; под аортальным клапаном и септальной створкой трикуспидального клапана; часто развиваются аневризмы Аневризма - расширение просвета кровеносного сосуда или полости сердца вследствие патологических изменений их стенок или аномалии развития
мембранозного отдела перегородки, в результате которых происходит частичное или полное закрытие дефекта.
2. Мышечный, трабекулярный - до 15-20 % случаев всех ДМЖП. Полностью окружен мышцей, может быть локализован в различных участках мышечного отдела межжелудочковой перегородки. Дефектов может быть несколько. Особенно часто наблюдается спонтанное закрытие.
3. Надгребневые, подартериальные, подлегочные, инфундибулярные дефекты выносящего тракта - встречаются приблизительно в 5 % случаев. Дефект локализуется под полулунными клапанами конусовидного или выходного отдела перегородки. Часто сочетается с прогрессирующей аортальной недостаточностью из-за пролапса Пролапс - смещение вниз какого-либо органа или ткани от его нормального положения; причиной такого смещения обычно бывает ослабление окружающих и поддерживающих его тканей.
створок аортального клапана (наиболее часто - правой).
4. Дефекты приносящего тракта (атриовентрикулярного канала) - входной отдел межжелудочковой перегородки непосредственно под местом прикрепления колец атриовентрикулярных клапанов; часто наблюдается при синдроме Дауна.
Чаще встречаются одиночные дефекты перегородки, но бывают и случаи множественных дефектов. ДМЖП также наблюдается при комбинированных пороках сердца, например, тетраде Фалло Тетрада Фалло - врожденный порок сердца: сочетание стеноза устья легочного ствола, дефекта межжелудочковой перегородки, смещения аорты вправо и вторично развивающейся гипертрофии правых отделов сердца
Подробно , корригированной транспозиции магистральных сосудов.
Этиология и патогенез
Формирование сердца с камерами и крупными сосудами происходит к концу первого триместра. Основные пороки развития сердца и крупных сосудов связаны с нарушением органогенеза на 3-8 неделе развития плода.
Внутриутробная гемодинамика при ДМЖП. Внутриутробно малый круг кровообращения (МКК) не функционирует. Вся проходящая через легкие кровь относится к большому кругу кровообращения (БКК). Поэтому внутриутробная гемодинамика плода не страдает. Дефект возможно определить только при ультразвуковом исследовании плода.
Гемодинамика новорожденного при ДМЖП. При рождении сосуды МКК имеют толстую стенку с хорошо выраженным мышечным слоем, за счет чего создается высокое сопротивление крови, проходящей через МКК. В связи с этим отмечается высокое давление в МКК (75-80 мм.рт.ст.), практически соответствующее давлению в левом желудочке и аорте, то есть в БКК. Градиент давления между правым и левым желудочком незначительный, почти отсутствует сброс крови в какую-либо сторону и соответственно отсутствует и шум. Шум и незначительный цианоз (в основном периоральный) могут возникать при крике, кашле, натуживании, сосании, когда может появляться право-левый сброс. Дефекты малого размера могут сами оказывать сопротивление току крови, уменьшая разницу в градиенте между правым и левым желудочком.
Приблизительно ко второму месяцу жизни ребенка снижаются толщина мышечной стенки, сосудистое сопротивление и давление в МКК (до 20-30 мм.рт.ст.). Давление в правом желудочке становится меньше, чем в левом, что приводит к сбросу крови слева направо, а значит и шуму.
Высокое давление в МКК быстро приводит к гипертрофии и дилaтации правого желудочка - развивается правожелудочковая недостаточность. По мере повышения давления в правом желудочке, оно сначала становится таким же, как в левом (шум уменьшается), а затем появляется право-левый сброс (шум возникает вновь).
Таким образом протекают ДМЖП среднего и крупного размера в отсутствие лечения. Средняя продолжительность жизни при этом не превышает 25 лет, большая часть детей гибнет в возрасте до 1 года.
Эпидемиология
Дефект межжелудочковой перегородки является самым распространенным врожденным пороком сердца, обнаруживаемым у 32% пациентов как изолированно, так и в сочетании с другими пороками аномалиями.
Перимембранозные дефекты составляют 61,4-80% всех случаев ДМЖП, мышечные дефекты - 5-20%.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
Синдром кардиомегалии, Синдром легочной гипертензии, систолический шум, парастернальный сердечный горб, одышка по типу тахипноэ, симптомы сердечной недостаточности
Cимптомы, течение
Дефект межжелудочковой перегородки у плода
Изолированный ДМЖП у плода клинически делится на 2 формы в зависимости от его размеров, величины сброса крови:
1. Небольшие ДМЖП (болезнь Толочинова-Роже) - расположенны в основном в мышечной перегородке и не сопровождаются выраженными гемодинамическими нарушениями.
2. ДМЖП достаточно больших размеров - расположены в мембранозной части перегородки и приводят к выраженным нарушениям гемодинамики.
Клиника болезни Толочинова-Роже. Первое (иногда единственное) проявление порока - систолический шум в области сердца, появляющийся в основном с первых дней жизни ребенка. Жалобы отсутствуют, дети растут хорошо, границы сердца - в пределах возрастной нормы.
В III-IV межреберье слева от грудины у большинства больных выслушивается систолическое дрожание. Характерный симптом порока - грубый, очень громкий систолический шум. Шум занимает, как правило, всю систолу, нередко сливается со вторым тоном. Максимум звучания отмечается в III-IV межреберье от грудины. Шум хорошо проводится по всей области сердца, вправо за грудиной, выслушивается на спине в межлопаточном пространстве, хорошо проводится по костям, передается по воздуху и прослушивается, даже если поднять стетоскоп над сердцем (дистанционный шум).
У некоторых детей выслушивается очень нежный систолический шум, который лучше определяется в положении лежа. При физической нагрузке шум значительно уменьшается или даже полностью исчезает. Это объясняется тем, что благодаря мощному сокращению мышц сердца при нагрузке, отверстие в межжелудочковой перегородке у детей полностью закрывается и поток крови через него завершается. Признаков сердечной недостаточности при болезни Толочинова-Роже нет.
ДМЖП у детей старше года. Дефект переходит в стадию затухания клинических признаков за счет интенсивного роста и анатомического развития организма ребенка. В возрасте 1-2 лет наступает фаза относительной компенсации - одышка и тахикардия Тахикардия - повышенная частота сердечных сокращений (более 100 в 1 мин.)
отсутствуют. Дети становятся более активными, лучше прибавляют в весе и растут, реже болеют сопутствующими заболеваниями, многие из них по своему развитию догоняют сверстников.
Объективное обследование выявляет у 2/3 детей центрально расположенный сердечный горб, систолическое дрожание в III-IV межреберье слева от грудины. Границы сердца незначительно расширены в поперечнике и вверх. Верхушечный толчок - средней силы и усиленный.
При аускультации Аускультация - метод физикальной диагностики в медицине, заключающийся в выслушивании звуков, образующихся в процессе функционирования органов.
отмечается расщепление II тона во II межреберье слева у грудины, может наблюдается его акцентуация. Вдоль левого края грудины выслушивается грубый систолический шум с максимумом звучания в III межреберье слева и большой зоной распространения.
У части детей выслушиваются и диастолические шумы относительной недостаточности клапана легочной артерии:
- шум Грэхема - Стилла - появляется в результате усиления легочного кровообращения в легочной артерии и при нарастании легочной гипертензии; выслушивается в 2-3 межреберье слева от грудины и хорошо проводится вверх на основание сердца;
В зависимости от степени нарушения гемодинамики наблюдается очень большая вариабельность клинического течения ДМЖП у детей, которая требует различного терапевтического и хирургического подхода к таким детям.
Диагностика
1. Эхокардиография - является основным исследованием, позволяющим поставить диагноз. Проводится для оценки тяжести заболевания, определения локализации дефекта, количества и размера дефектов, степени перегрузки левого желудочка объемом. При исследовании необходимо проверить наличие недостаточности аортального клапана, возникающей как результат пролапса правой или некоронарной створки (в особенности при дефектах выносящего тракта и высоко локализованных мембранозных дефектах). Также очень важно исключить двухкамерный правый желудочек.
3. Катетеризация сердца проводится при высоком легочном артериальном давлении (по результатам ЭхоКГ) для определения легочного сосудистого сопротивления.
Дифференциальный диагноз
- открытый общий АВ-канал;
- общий артериальный ствол;
- отхождение магистральных сосудов от правого желудочка;
- изолированный стеноз легочной артерии;
- дефект аортолегочной перегородки;
- врожденная митральная недостаточность;
- стеноз аорты .
Осложнения
При высоко расположенных дефектах рано прогрессирующая легочная гипертензия приводит к развитию симптомокомплекса Эйзенменгера, для которого характерны уменьшение интенсивности шума и усиление акцента II тона, появление постоянной одышки и цианоза в результате право-левого сброса крови. Возможно развитие таких осложнений, как затяжной септический эндокардит, рецидивные инфекции дыхательных путей, застойная сердечная недостаточность, стеноз Стеноз - сужение трубчатого органа или его наружного отверстия.
легочной артерии.
Лечение
Тактика лечения дефектов межжелудочковой перегородки (ДМЖП) определяется гемодинамической значимостью дефекта и известным для него прогнозом. Поскольку существует высокая вероятность спонтанного закрытия дефектов (40% - на первом году жизни) или их уменьшения в размерах, у пациентов с сердечной недостаточностью целесообразно сначала прибегнуть к терапии диуретиками и дигоксином. Возможно применение ингибиторов синтеза АПФ, которые облегчают антеградный кровоток из левого желудочка и тем самым уменьшают сброс через ДМЖП.
Следует также обеспечить лечение сопутствующих заболеваний (анемия, инфекционные процессы), энергетически адекватное питание больных.
Для детей, поддающихся терапии, возможна отложенная операция. Хирургическое лечение, как правило, не показано детям с маленькими ДМЖП, достигшим шести месяцев без признаков сердечной недостаточности, легочной гипертензии или задержки развития. Коррекция порока обычно не показана при соотношении легочного и системного кровотоков (Qp/Qs) менее чем 1,5:1,0.
Показания к хирургическому вмешательству - сердечная недостаточность и задержка физического развития у детей, не поддающихся терапии. К операции прибегают, начиная с первого полугодия жизни. У детей старше одного года хирургическое вмешательство показано при Qp/Qs - более чем 2:1. При соотношении сопротивлений легочного и системного русла равном 0,5 или при наличии обратного сброса крови, возможность операции ставится под сомнение и необходим углубленный анализ причин данного состояния.
Оперативные вмешательства
1. Паллиативные - заключаются в сужении легочной артерии для ограничения легочного кровотока. В настоящее время применяют только при наличии сопутствующих пороков и аномалий, затрудняющих первичную коррекцию ДМЖП.
2. Радикальные - заключаются в полном хирургическом закрытии дефекта. Операция выбора - закрытие дефекта в условиях искусственного кровообращения. Госпитальная летальность составляет 2-5%. Риск операции повышается у детей в возрасте до 3 месяцев, при наличии множественных ДМЖП или сопутствующих серьезных аномалий развития (поражения центральной нервной системы, легких, почек, генетические заболевания, недоношенность).
Прогноз
Во внутриутробном периоде дефект межжелудочковой перегородки не влияет на гемодинамику и развитие плода поскольку давление в желудочках равное и большого сброса крови не возникает.
Раннее ухудшение состояния ребенка после рождения маловероятно, поэтому родоразрешение в специализированном учреждении не является обязательным. Порок относится ко 2-й категории тяжести.
Спонтанное закрытие ДМЖП встречается в 45-78% случаев, однако точная вероятность данного события неизвестна. Например, большие дефекты в сочетании с синдромом Дауна или со значительной сердечной недостаточностью редко закрываются самостоятельно. Более часто спонтанно исчезают маленькие и мышечные ДМЖП . Более 40% отверстий закрываются на первом году жизни, но данный процесс может продолжаться и до 10 лет.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
Читайте также:
- Деформация и скорость деформации миокарда левого желудочка
- Лучевые признаки клапанов задней уретры у плода
- Изолированная некомпактность левого желудочка. Диагностика изолированной некомпактности левого желудочка.
- Влияние рибавирина, салицилатов на плод и беременность
- Побочные эффекты лечения флударабином, пентостатином, кладрибином волосатоклеточного лейкоза
