Скрытая несостоятельность кишечного анастомоза.
Добавил пользователь Skiper Обновлено: 28.01.2026
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
Институт хирургии им. А.В. Вишневского Минздрава России, Москва
ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
Институт хирургии им. А.В. Вишневского Минздрава РФ, Москва
Эндоскопическое лечение несостоятельности пищеводных анастомозов с использованием вакуумно-аспирационной системы
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(10): 13‑20
Частота несостоятельности анастомозов верхних отделов желудочно-кишечного тракта составляет от 3 до 25%. С развитием эндоскопических технологий стал доступен новый метод лечения — эндоскопическая вакуумно-аспирационная терапия. Материал и методы. В период с 2015 по 2018 г. на базе хирургического эндоскопического отделения НМИЦ хирургии им. А.В. Вишневского пролечены 10 пациентов с использованием вакуумно-аспирационной системы при несостоятельности анастомозов верхних отделов желудочно-кишечного тракта. Результаты. У 9 пациентов после полного закрытия дефекта система удалена через 2—4 сеанса (в среднем на 11-е сутки). У 1 пациента после 5 сеансов в области несостоятельности образовалась отграниченная полость, заполненная грануляциями, вакуумно-аспирационная система удалена. Выводы. Эндоскопическая вакуумно-аспирационная терапия — инновационный, миниинвазивный, экономически выгодный и успешный способ лечения дефектов анастомозов и их осложнений, который должен быть внедрен в клиническую практику в многопрофильных стационарах.
В структуре заболеваемости злокачественными новообразованиями в России рак желудка и пищевода занимает ведущие позиции [1]. Сегодня наиболее эффективным методом лечения этих заболеваний является хирургический. Однако, несмотря на все возможности современной хирургии, сложность и травматичность проводимых операций влекут за собой ряд осложнений. Одним из самых тяжелых осложнений таких операций является несостоятельность швов эзофагогастроанастомоза и эзофагоеюноанастомоза, что может стать причиной эмпиемы плевры, медиастинита, пищеводно-трахеального свища, сепсиса и летального исхода. По данным последних исследований [2], частота несостоятельности пищеводного соустья составляет от 3 до 25%, а летальность в данной группе пациентов достигает 60%.
Основными задачами лечения несостоятельности шов анастомоза являются закрытие свищевого отверстия, санация полости затека, обеспечение нутритивной поддержки, а также профилактика и лечение гнойных осложнений. В прошедшие годы с развитием эндоскопических технологий для лечения несостоятельности анастомозов применяли различные методики, такие как клипирование, фибриновый клей, ушивание отверстия с использованием эндоскопических устройств, стентирование самораскрывающимися металлическими и пластиковыми стентами [3, 4]. Методом выбора в течение долгого времени служило стентирование с хорошим клиническим результатом до 80% [5]. Однако процедура стентирования имеет ряд осложнений, таких как миграция стента, врастание в окружающие ткани с образованием стриктуры после его удаления [6—8].
С 2006 г. стал доступным новый метод лечения данного осложнения — эндоскопическая вакуумно-аспирационная терапия (ВАТ) [9]. В хирургической практике вакуумная терапия используется с 1950 г. [10] для лечения раневых инфекций. Принцип ВАТ основан на продолжительном локальном воздействии отрицательного давления на рану, что уменьшает локальный отек, способствует усилению местного кровообращения, снижает уровень микробной обсемененности раны, уменьшает раневую полость и приводит тем самым к ускорению заживления раны [11].
Внутрипросветная вакуумная терапия с использованием губки впервые применена для лечения несостоятельности колоректальных анастомозов [12, 13]. В дальнейшем методика получила свое развитие в лечении несостоятельности анастомозов верхних отделов желудочно-кишечного тракта [14, 15] и стала активно применяться отдельными авторами как альтернативный метод лечения [16, 17].
Материал и методы
В 2015—2018 гг. на базе хирургического эндоскопического отделения НМИЦ хирургии им. А.В. Вишневского пролечены 10 пациентов с использованием вакуумно-аспирационной системы (ВАС) при несостоятельности анастомозов верхних отделов желудочно-кишечного тракта. Средний возраст пациентов составил 55,7 года (48—70 лет). По поводу злокачественных новообразований пищевода или желудка оперированы 9 пациентов, из них у 2 выполнена расширенная гастрэктомия с еюногастропластикой, у 4 — субтотальная эзофагэктомия с пластикой изоперистальтической желудочной трубкой, у 1 — проксимальная резекция желудка и нижней трети пищевода с еюногастропластикой, у 2 — резекция пищевода с пластикой желудочной трубкой. Еще у 1 пациента с многочисленными оперативными вмешательствами в анамнезе по поводу рецидивной грыжи пищеводного отверстия диафрагмы выполнены ререзекция желудка с резекцией эзофагогастроанастомоза и еюногастропластика (реконструкция по типу операции Merendino—Dillard).
Несостоятельность эзофагогастро-, эзофагоэнтероанастомоза у данных пациентов диагностирована на 6±2-е сутки после проведенных операций. Всем пациентам предприняли попытку консервативной терапии (с целью самостоятельного закрытия дефекта), однако ввиду ее неэффективности на 14±5-е сутки начали лечение с использованием ВАС.
Методика и техника
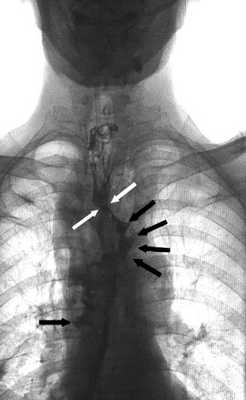
Все манипуляции проводили после тщательного обследования пациента с целью уточнения расположения, размера дефекта анастомоза, а также выявления затеков в средостение, плевральную или брюшную полости. Несостоятельность анастомоза диагностировали при рентгенологическом исследовании верхних отделов желудочно-кишечного тракта с использованием водорастворимого контрастного препарата (рис. 1). Рис. 1. Рентгенограмма верхних отделов желудочно-кишечного тракта с водорастворимым контрастом у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
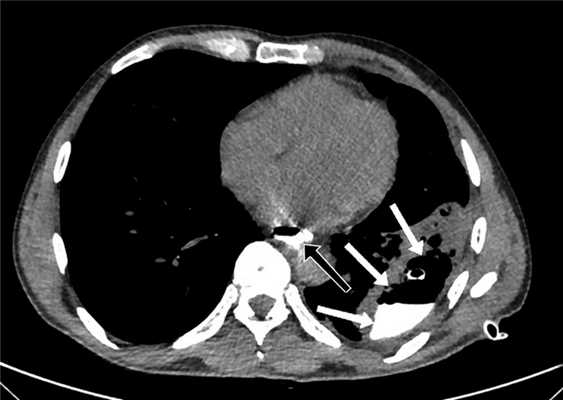
Для определения размера и локализации затеков в средостении, плевральных или брюшной полостях и динамики их уменьшения пациентам выполнена КТ с пероральным контрастированием (рис. 2). Рис. 2. Компьютерная томограмма пациента после низведения желудка, проксимальной резекции желудка с резекцией эзофагогастроанастомоза и еюногастропластики. Желтой стрелкой указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
Помимо этого, для предварительной оценки зоны несостоятельности анастомоза, ее размеров и расположения всем пациентам выполнена ЭГДС (рис. 3). Рис. 3. Эндоскопическая картина у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указан просвет желудочной трубки, черными — зона несостоятельности анастомоза.
Эндоскопическую установку ВАС проводили под общей анестезией с интубацией трахеи в положении пациента лежа на спине. При первичном осмотре определяли уровень пищеводного анастомоза (в см) от резцов и размеры дефекта соустья. При наличии затека по возможности проводили эндоскопическую ревизию полости с оценкой ее размеров.

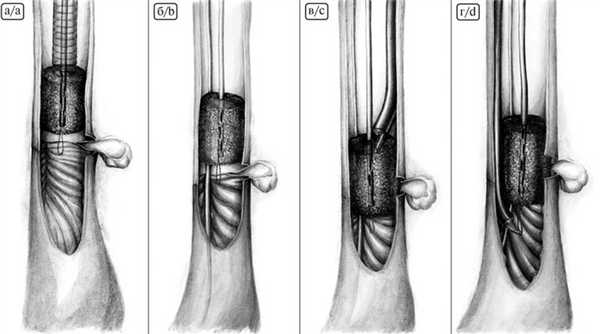
При создании эндоскопической ВАС использовали губчатую систему с открытыми сообщающимися ячейками для лечения осложненных и хронических раневых инфекций размером 10×7,5 см и толщиной 3,3 см (рис. 4, А). Рис. 4. Пошаговое моделирование вакуумно-аспирационной системы. А — губчатая система с открытыми сообщающимися ячейками размером 10×7,5 см и толщиной 3,3 см; Б — моделирование губки в форме цилиндра; В — назогастральный зонд, на котором моделировали систему; Г — фиксация губки на дистальном конце зонда; Д — фиксация губки проксимально; Е — окончательный вид системы. Такие размеры губки позволяли сделать 2 ВАС с использованием стандартного зонда для аспирации содержимого желудка.
Губку моделировали в форме цилиндра диаметром, не превышающим диаметр пищевода, и длиной, перекрывающей минимум на 2 см дистальную и проксимальную границы зоны несостоятельности (см. рис. 4, Б). В губку проводили «желудочный» зонд и фиксировали его 2 швами — на дистальном конце зонда и проксимально (см. рис. 4, В, Д). Здесь же из лигатур формировали 2 петли для позиционирования губки. На рис. 4. Е представлен окончательный вид ВАС.

Для установки ВАС применяли собственную разработанную методику. С этой целью использовали overtube с внутренним полым стилетом, через который можно провести эндоскоп (рис. 5, А—В). Рис. 5. Overtube с внутренним полым стилетом — А и Б; В — внешний вид эндоскопа с надетым на него overtube.
Это приспособление (overtube) под эндоскопическим контролем устанавливали в просвет пищевода до зоны несостоятельности анастомоза. В дальнейшем по нему с помощью внутреннего стилета проводили ВАС (рис. 6, А; Рис. 6. Эндоскопическая картина установки и позиционирования вакуумно-аспирационной системы. А — система проведена в просвет пищевода; Б — вдоль системы проведен зонд для питания; В, Г — эндоскопически ассистированное позиционирование системы. рис. 7, А). Рис. 7. Схема установки и позиционирования вакуумно-аспирационной системы. А — система проведена через overtube в просвет пищевода к зоне анастомоза; Б — overtube извлечен, вдоль системы проведен зонд для питания на противоположной стороне от зоны несостоятельности; В, Г — эндоскопически ассистированное позиционирование системы.
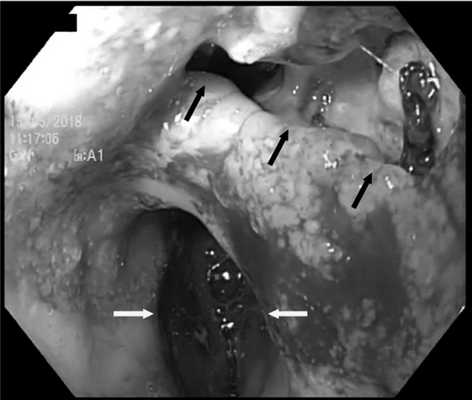
После этого overtube извлекали из просвета пищевода и следующим этапом мимо ВАС через инструментальный канал в просвет тонкой кишки устанавливали зонд для питания, позиционируемый вдоль ВАС с противоположной стороны от зоны несостоятельности (см. рис. 6, Б; 7, Б). Окончательным этапом выполняли эндоскопически ассистированное позиционирование ВАС в область несостоятельности анастомоза таким образом, чтобы зона дефекта располагалась непосредственно посередине губки (рис. 8). Рис. 8. Эндоскопическая картина соотношения вакуумно-аспирационной системы (желтые стрелки) и зоны несостоятельности анастомоза (красные стрелки).
Это достигалось путем захватывания ранее сформированных лигатурных петель на проксимальном и дистальном концах губки с помощью эндоскопической цапки, проведенной через инструментальный канал (см. рис. 6, В, Г; 7, В, Г).
После установки и позиционирования губки проксимальный конец ВАС и несущий ее зонд выводили через нос и подключали к активной аспирации с разрежением 100—110 мм рт.ст.
После установки ВАС пациентов переводили в палаты общего профиля на самостоятельном дыхании. Лечение дополняли антибактериальной и инфузионной терапией, а также энтеральным зондовым питанием.
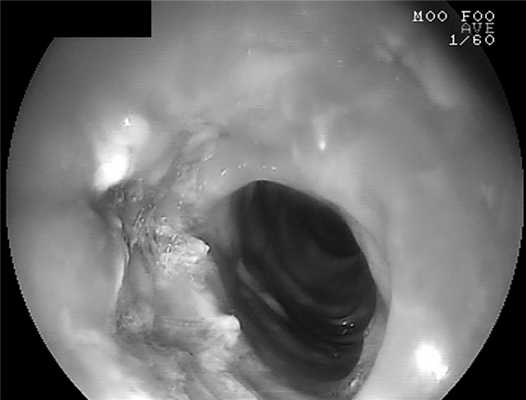
На 3—5-е сутки удаляли аспирационную систему и эндоскопически контролировали динамику размеров дефекта. При визуальном отсутствии несостоятельности (рис. 9) Рис. 9. Эндоскопическая картина у пациента после резекции желудка, нижней трети пищевода, интерпозиции сегмента тощей кишки по типу еюногастропластики, несостоятельности эзофагоеюноанастомоза и 3 сеансов лечения с помощью вакуумно-аспирационной системы. Полное закрытие дефекта в зоне пищеводного соустья. ВАС удаляли и выполняли контрольное рентгенологическое исследование с водорастворимым контрастом. При сохранении дефекта ВАС устанавливали повторно.
Результаты
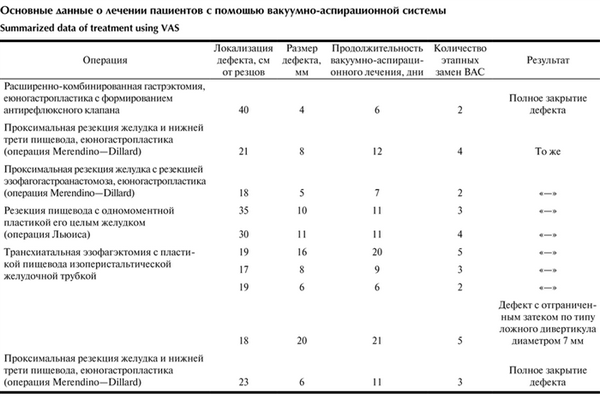
В таблице Основные данные о лечении пациентов с помощью вакуумно-аспирационной системы суммированы основные данные о лечении пациентов с помощью ВАС. Средняя продолжительность первичной манипуляции составила 78 мин. Замену ВАС проводили каждые 3—5 дней, длилась она в среднем около 50 мин.
У 9 пациентов систему удалили после 2—5 сеансов (в среднем на 11-е сутки) с полным закрытием дефекта. У 1 пациента после 5 сеансов в области несостоятельности образовалась отграниченная полость, заполненная грануляциями, ВАС удалена. Эффект лечения у всех пациентов подтвержден рентгеноскопией с пероральным приемом контрастного препарата с визуализацией зоны эзофагоанастомоза. Несостоятельность швов пищеводного соустья ликвидирована у всех больных.
Таким образом, эндоскопическая ВАТ — новый, минимально инвазивный способ лечения несостоятельности пищеводных анастомозов различной локализации. Более того, данная методика может успешно применяться как в гастроинтестинальной, так и в колоректальной, а также в бариатрической хирургии. ВАТ также является экономически выгодной манипуляцией по сравнению не только с повторной операцией, но и с другими минимально инвазивными методами лечения несостоятельности анастомоза.
В целом эндоскопическую ВАТ можно рассматривать как инновационный и перспективный метод выбора в лечении несостоятельности различных анастомозов верхних отделов желудочно-кишечного тракта. Важно отметить, что ВАТ требует большого опыта и навыка команды эндоскопических хирургов, а также анестезиологов-реаниматологов для обеспечения анестезиологического пособия и оказания интенсивной терапии в периоперационном периоде.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Скрытая несостоятельность кишечного анастомоза.
Несостоятельность анастамоза кишечника - причины, диагностика, лечение
Послеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы).
Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%).
а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита).
б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение.
в) Обследование несостоятельности анастамоза кишечника
Необходимый минимальный стандарт:
• Оценка общего состояния больного: тахикардия (изначально может быть единственным симптомом), сепсис с дисфункцией органов, нестабильность гемодинамики, нутритивный статус и т.д.
• Обследование живота: перитонеальные симптомы без четкой локализации, кишечные свищи, состояние раны.
• Несостоятельность заподозрена, но не подтверждена: ирригоскопия с водорастворимым контрастом, КТ.
Сопутствующие факторы, влияющие на принятие решения:
• Ретроспективный анализ интраоперационных трудностей.
• Текущее состояние больного (общее, местное)?
• Несостоятельность: отграниченный или разлитой перитонит?
• Шансы на успех при формировании повторного анастомоза?
• Время, прошедшее после последней лапаротомии?
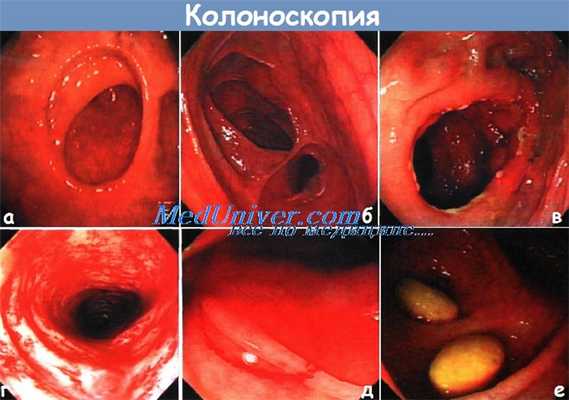
а - Нормальная эндоскопическая картина анастомоза толстой кишки типа «конец в конец».
б - Нормальная конфигурация мешковидного расширения при колоанальной пластике.
в - Образование язвы в области анастомоза после резекции вследствие рака.
Язва доброкачественного характера вызвана шовным материалом, рецидива рака нет.
г - Ложный колит — неспецифическое воспаление дистальнее нефункционирующей стомы, у больного без заболеваний прямой кишки в анамнезе.
д - Обычная травма с кровотечением сразу после неприцельной биопсии слизистой оболочки для исключения микроскопического колита у больного с поносом.
е - При колоноскопии видны нераспавшиеся и невсосавшиеся таблетки.
г) Ведение пациента с несостоятельностью анастамоза кишечника
Консервативное ведение:
• Отграниченная несостоятельность => дренирование абсцесса под контролем КТ => отграниченный свищ.
• Несостоятельность при отключенной кишке => повторное обследование через 6-12 недель.
• Несостоятельность с сепсисом => поддерживающие меры в дополнение к операции: НГЗ, антибиотикотерапия, оптимизация сердечной деятельности и функции дыхания.
Хирургический подход:
• Ранняя симптоматическая несостоятельность ( < 7—10 дней) =>релапаротомия для поиска дефекта:
- Отключение и дренирование.
- Разобщение анастомоза, формирование стомы (по типу операции Гартссмана).
- Повторное формирование анастомоза (с/без отключения).
- Ригидность стенки кишки в результате воспаления => ни резекция, ни формирование стомы не выполнимы => ушивание дефекта/дренирование или установка дренажа в зоне несостоятельности с целью формирования хорошо отграниченного свищевого хода.
• Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии:
- Проксимальная стома (если возможно).
- Попытка воздействия на сепсис => установка дренажей (открытая или под контролем КТ) => попытка формирования хорошо отграниченного свищевого хода.
- Разлитой перитонит/сепсис => санационная лапаротомия с широким дренированием.
Видео промывания желудка через назогастральный зонд у взрослого
(оставленный зонд может использоваться для трансназального питания)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Прошла неделя после экстренной гемиколэктомии по поводу обтурирующей карциномы слепой кишки у вашей пациентки. Она уже находится дома, чувствует себя неплохо и самостоятельно ест, но вдруг у нее вновь возникает приступ болей в правой половине живота, сопровождающийся рвотой.
Пациентку снова доставляют в приемное отделение. У нее лихорадка, в правой половине живота пальпируется болезненный инфильтрат, на обзорной рентгенограмме брюшной полости — картина, заставляющая заподозрить кишечную непроходимость. Лейкоцитоз повышен. Вы подозреваете несостоятельность анастомоза.
С клинической точки зрения, существуют 3 типа несостоятельности кишечного шва, которые можно идентифицировать.
• Свободная утечка. Анастомоз негерметичен, а утечка не отграничена прилежащими структурами. Состояние пациента обычно ухудшается, появляются симптомы диффузного перитонита. Показана экстренная релапаротомия, как уже указывалось выше.
• Отграниченная утечка. В этом случае вытекающее кишечное содержимое частично отграничивается сальником и прилежащими органами. Клинически симптомы раздражения брюшины локализованы. Последствием этого является формирование околокишечного абсцесса.
• Мини-утечка. Подобное незначительное проникновение кишечного содержимого возникает в поздние сроки после операции, когда анастомоз уже в основном сформирован. Абдоминальные симптомы строго локализованы, и у пациента нет каких-либо проявлений интоксикации. Это действительно перианастомозит — воспалительная инфильтрация вокруг анастомоза. Обычно при этом не происходит формирования какого-либо гнойника.
При отсутствии диффузного перитонита вы должны документировать несостоятельность анастомоза и определить лечебную тактику. Толстокишечый анастомоз лучше всего визуализировать с помощью контрастной клизмы с гастрогра-фином. А для исследования анастомозов верхних отделов ЖКТ гастрографин необходимо давать перорально. Мы обычно сочетаем подобные контрастные исследования с КТ, пытаясь выявить проникновение контрастного вещества в свободную брюшную полость либо зафиксировать формирование гнойника в зоне анастомоза.
При этом также возможно несколько вариантов:
• Свободное проникновение контрастного вещества в брюшную полость; большое его количество и жидкость в животе на КТ. Больного необходимо срочно оперировать. Предварительно мы обсудили, что делать во время операции, — лучше всего резецировать участок кишки с анастомозом.
• Отграниченное скопление контрастного препарата — абсцесс на КТ. Остальные отделы брюшной полости интактны.
• Утечки контрастного вещества не отмечено, выявлена лишь перианастомотическая инфильтрация. Такой перианастомозит обычно разрешается после нескольких дней лечения антибиотиками.
Учтите, что заметная локальная утечка контрастного вещества или его мини-утечка связаны с обструкцией анастомоза воспалительным отеком. Такая обструкция обычно разрешается самостоятельно — примерно за 1 нед, после дренирования гноя и уменьшения отека.
Мы показали вам, что несостоятельность анастомоза не является «одной болезнью». Это спектр состояний, требующих дифференцированного подхода. Чтобы не допускать осложнений, соотносите проводимое лечение с конкретными условиями несостоятельности анастомоза, величиной дефекта и состоянием пациента. Но прежде всего помните, что недренированные скопления в брюшной полости кишечного содержимого или гноя — это убийцы, часто «молчаливые».
Мы склонны лучше помнить тех больных, которых едва не погубили; и мы никогда не забываем тех из них, которых мы действительно довели до гибели.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тимербулатов Ш.В., Сагитов Р.Б., Султанбаев А.У., Асманов Д.И. Диагностика ишемических повреждений кишечника при острых хирургических заболеваниях органов брюшной полости // Клиническая и экспериментальная хирургия. 2012. №3. C. 40–52.
Ишемические повреждения играют важную роль в этиологии, патогенезе заболеваний органов брюшной полости, особую актуальность они приобретают в условиях экстренной хирургии в плане диагностики и оценки степени этих нарушений, выбора патогенетически обоснованных методов коррекции и лечения. Под острой ишемией, как правило, понимают резкое ухудшение (неполная ишемия) или полное прекращение (полная, тотальная ишемия) всех трех основных функций локального кровообращения, а именно: доставки в ткани кислорода, доставки в ткань субстратов окисления и удаления из ткани продуктов тканевого метаболизма [1].
В экстренной абдоминальной хирургии до настоящего времени нерешенными остаются проблемы своевременной диагностики, выбора рациональной тактики при острых ишемических поражениях кишечника (острые нарушения мезентериального кровообращения (ОНМК)), несостоятельности анастомозов после различных оперативных вмешательств на полых органах брюшной полости. По данных различных авторов, показатели летальности при этих состояниях остаются высокими и колеблются от 30% до 75% и более. До настоящего времени общепринятой тактикой после резекции кишечника или в сочетании с восстановлением магистрального кровотока по поводу ОНМК остается программированная релапаротомия для ревизии оставшегося кишечника, области реконструкции мезентериальных сосудов [2, 7, 9, 12, 14, 18, 20]. Сама релапаротомия для данного контингента крайне тяжелых больных является дополнительной травмой, у части больных она является непереносимой. После релапаротомии летальность достигает 56,3% и более [12]. Было показано, что летальность после резекции кишечника без восстановления магистрального кровотока и без программированной релапаротомии снизилась до 20% в отличие от группы больных, перенесших релапаротомию, где летальность составила 65% [16]. Вследствие неадекватной оценки жизнеспособности кишечника некроз прогрессирует у каждого второго больного [12]. В развитии несостоятельности анастомозов пищеварительного тракта наряду с перитонитом, большое значение имеет нарушение кровообращения в брыжеечных сосудах [5, 10], а также расстройство кровообращения в микроциркуляторном русле и стенки кишки.
Существенная роль в происхождении нарушений в микроциркуляторном русле играет повышение внутрибрюшного давления [4, 5, 8, 11, 15]. Следствием повышения внутрибрюшного давления >15-18 мм.рт.ст. и нарушения микроциркуляции, может являться тромбоз мелких сосудов, с последующим развитием ишемии кишечной стенки [3], а при показателях давления равном 25 мм.рт.ст. и более наступает выраженная ишемия стенки кишки с транслокацией бактерий и токсинов в мезентериальный кровоток и лимфатические сосуды [15].
Важными и окончательно неразработанными остаются вопросы ранней диагностики ишемических повреждений и послеоперационного мониторинга состояния кровообращения, оставшихся отделов кишечника и анастомозов после операции на органах пищеварительного тракта. В клинической практике для оценки кровообращения органов брюшной полости обычно пользуются визуальными признаками и основываются на анализе цвета, блеска серозной оболочки, пульсации брыжеечных сосудов, наличии перистальтических сокращений, характера выпота в брюшной полости [9, 13]. Главным недостатком данного метода является субъективизм оценки указанных признаков. Известно, что даже при наличии перистальтики и пульсации сосудов может наблюдаться продолженный некроз стенки кишки без видимых наружных изменений. Объективная же оценка жизнедеятельности тканей должна основываться на исследовании регионального кровотока и микролимфоциркуляции, и иметь количественное выражение и высокую точность [17].
Целью исследования явилась оценка возможностей лабораторных, эндоскопических, некоторых инструментальных методов диагностики ишемических нарушений кишечника в эксперименте и клинике.
Материалы и методы
В нашей клинике за последние 10 лет на стационарном лечении находились 238 больных с острой кишечной непроходимостью, в т.ч. 79 больных с явлением выраженной ишемии кишечника (странгуляционная непроходимость - заворот различных отделов кишечника - 5 больных, узлообразование - 2, спаечная непроходимость кишечника -72, острое нарушение мезентериального кровообращения - 124. Всем 79 больным с острой странгуляционной кишечной непроходимостью с некрозом кишечной стенки была выполнена резекция ишемизированных отделов, в т.ч. 68 с формированием первичного анастомоза. Из 124 больных с ОНМК выполнялись резекции различных отделов кишечника в зависимости от распространенности ишемии и некроза кишечной стенки - от сегментарной до субтотальной, обширной резекции тонкой и толстой кишок, в 11 случаях ввиду тотальной гангрены кишечника, ограничились диагностической лапароскопией или лапаротомией.
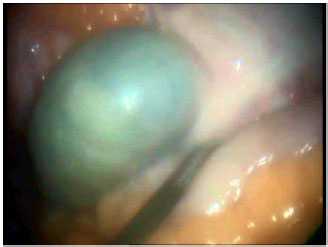
Рис. Острое нарушение мезентериального кровообращения, некроз купола слепой кишки
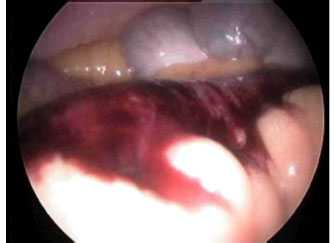
Рис. Сегментарный некроз подвздошной кишки при остром мезентериальном тромбозе
В последние годы в клинике принят диагностический алгоритм в предоперационном обследовании и послеоперационном наблюдении указанных больных. Задачами на диагностическом этапе были: уточнение странгуляционного характера, непроходимости кишечника, наличия и степени распространенности ишемии при ОНМК, синдрома интраабдоминальной гипертензии; в послеоперационном периоде: диагностика послеоперационных осложнений, контроль за состоянием оставшейся части кишечника, ранняя диагностика продолженной ишемии, несостоятельности анастомозов, мониторирование интраабдоминального давления. Для решения указанных задач, на этапе диагностики последовательно проводили следующие методы исследования: определяли уровень лактата крови, pH слизистой оболочки желудка, проводили ультразвуковую доплерографию висцеральных ветвей брюшной аорты, определяли уровень внутрибрюшного давления, одновременно проводили обзорную рентгенографию органов брюшной полости, исследовали показатели коагулограммы. При неясном диагнозе, при невозможности исключения других острых хирургических заболеваний или для уточнения степени и распространенности ишемии кишечника, выполняли диагностическую лапароскопию, последнюю для уточнения степени ишемии дополняли интраоперационной лазерной допплеровской флоуметрией. Для динамического наблюдения в послеоперационном периоде – проведения программированной видеолапароскопии - в зону сомнительных участков кишечника устанавливали разработанное нами видеолапароскопическое устройство (рис. 1).

Рис. 1. Видеолапароскопическое устройство для послеоперационного мониторирования брюшной полости (1-гибкая трубка длиной 40 см из медицинского силикона, на рабочем конце которой размещена миниатюрная видеокамера 2 со светодиодным источником света. Видеокамера соединена с размещенным на противоположном конце трубки дисплеем 3 с выводом изображения на его экран. Трубка снабжена также каналом для подачи воздуха и аспирации 4)
В послеоперационном периоде также проводили исследования уровня лактата крови, pH слизистой оболочки желудка, мониторинг уровня внутрибрюшного давления, программированную видеолапароскопию «опасной» зоны при помощи разработанного нами устройства.
Исследование рН слизистой оболочки проводили при помощи эндоскопического рН-метрического зонда и ацидогастрометра "АГМ-03".
Внутрибрюшное давление у больных определяли путем измерения давления / в мочевом пузыре или в желудке аппаратом фирмы «Spiegelberg» (Германия), у экспериментальных животных прямым методом, через оставленные в брюшной полости с датчиком давления, катетеры. Для программированной видеолапароскопии, после завершения лапароскопии или резекции кишечника в зону межкишечного анастомоза или сомнительных участков кишечника устанавливали гибкую трубку устройства для видеолапароскопии из медицинского силикона, на рабочем конце которой размещена миниатюрная видеокамера со светодиодным источником света. Осмотр «опасной» зоны проводили по мере необходимости (до 4-5 дней) на экране утсройства. При необходимости расширения зоны осмотра, фиксации конца трубки фибрином, через рабочий канал устройства в брюшную полость вводили воздух до приемлемого обзора.
Описанная манипуляция проводилась без дополнительной анестезии и седатации в условиях палаты и позволила исключить т.н. программированную релапаротомию и контрольно-динамическую лапароскопию (рис. 2).
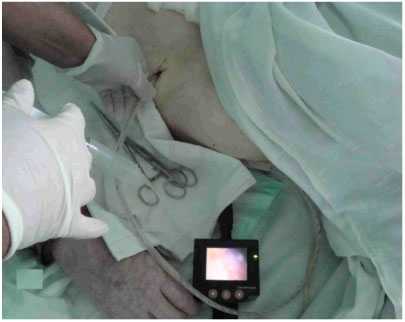
Рис.2. Послеоперационное видеолапароскопическое мониторирование брюшной полости. Исследование микроциркуляции серозной оболочки кишечника проводилось лазерным анализатором капиллярного кровотока ЛАКК-02
Исходя из анализа результатов диагностики лечения, обобщения опыта клиники, в неотложной абдоминальной хирургии, можно выделить три группы наиболее значимых ишемических повреждений, имеющих различной степени важности этиологическое, патогенетическое значение и требующих также дифференцированных подходов к диагностике и лечению.
I группа ишемических повреждений, как правило, связана с нарушениями проходимости сосудов органа (острая окклюзия - из-за эмболии, тромбоза) - первичная ишемия, которая как вариант локальной ишемии, может быть глобальной (по М.В. Биленко [1]), включающей весь орган или регионарной (включает часть органа). Примерами первичной ишемии органов являются острый тромбоз пузырной артерии с развитием / острого гангренозного бескаменного холецистита у лиц старческого возраста и долгожителей с сердечно-сосудистыми системными заболеваниями, развитие острого нарушения мезентериального кровообращения (эмболия, тромбоз верхней и нижнебрыжеечной артерий) с развитием сегментарного некроза до гангрены кишечника, по такому же механизму развитие инфаркта селезенки, почки, иногда гангренозного аппендицита.
II группа ишемических повреждений, может быть определена как вторичная ишемия органов, обусловленной экстравазальной компрессией и по распространенности и тяжести процесса она практически аналогична ишемии I группы. Примерами ишемии этой группы является острая странгуляционная кишечная непроходимость (заворот, спаечная странгуляция), завороты других органов (желудка, селезенки)), сдавления органных сосудов опухолевидными образованиями, синдром интраабдоминальной гипертензии, абдоминальный компартмент синдром. Особенностью вторичной ишемии следует считать последовательное развитие внутрисосудистого компонента, как правило, в виде тромбоза сосудов среднего и мелкого калибра.
При развитии ишемии III группы, ишемические нарушения не являются определенным этиологическим фактором, их следует рассматривать как отягощающие факторы в развитии патологических процессов и чаще осложнений последних, или послеоперационного периода (например, несостоятельность анастомозов, внутрибрюшная гипертензия и др.).
Результаты и обсуждение
По нашим данным, исследования уровня лактата в крови, является достоверным методом определения наличия и распространенности ишемических процессов в кишечнике. В норме лактат крови составил 1,38±1,3 ммоль/л. ( n= 28 обследованных).
Как известно, молочная кислота (лактат) является точным маркером кислородной недостаточности и его накопление в сыворотке крови свидетельствует о недостаточной оксигенации тканей органов [19, 21], повышение уровня лактата отражает серьезную циркуляторную недостаточность и является важным показателем тканевой перфузии [6].
На этапе диагностики, у больных с острой странгуляционной кишечной непроходимостью, содержание лактата составило 6,55±1,73 ммоль/л (n=77 больных), острым нарушением мезентерального кровообращения - 8,5±2,6 ммоль/л (n=73 больных). В послеоперационном периоде, при благоприятном его течении, уровень лактата начинает снижаться со 2-х суток, на 4-е сутки составляет в среднем 2,5±2,8 ммоль/л, и нормальных величин достигает на 7-8 сутки. При осложненном течении послеоперационного периода, прогрессировании ишемии кишечной стенки, лактат удерживается постоянно на высоком уровне (5-6 ммоль/л).
Лапароскопия является точным методом диагностики при наличии достаточно выраженных визуальных изменений стенки кишки, сложности возникают при начальных стадиях ишемии (при транзиторной ишемической атаке кишечника). В сомнительных случаях полезным является исследование микроциркуляции серозной оболочки кишечника лазерным анализатором капиллярного кровотока в течение лапароскопии (рис. 3, 4).
Рис. 3. Аппарат для измерения микроциркуляции ЛАКК-02 (Лазма, Россия)
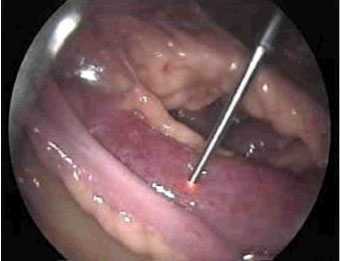
Рис. 4. Острая спаечная кишечная непроходимость. Измерение микроциркуляции ишемизированной тонкой кишки
Лазерная допплеровская флоуметрия (ЛДФ) дает интегральную информацию по очень большому количеству эритроцитов (~3,4-104) одновременно находящихся в зондируемом объеме тканей и регистрируемый сигнал характеризует кровоток в микрососудах в объеме 1-1,5 мм3 ткани. Характеристика капиллярного кровотока, регистрируемая при ЛДФ, представляет собой параметр (показатель) микроциркуляции (ПМ), которой является функцией от концентрации эритроцитов в зондируемом объеме ткани (№3р) и их усредненной скорости (Vcp): ПМ=№Зр • Vcp. Величина ПМ измеряется в относительных, перфузионных единицах.
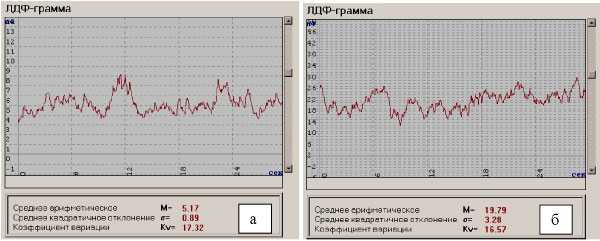
Рис. 5. Показатели микроциркуляции ишемизированной тонкой кишки (а) и после восстановления кровообращения после устранения (б) острой спаечной тонкокишечной непроходимости
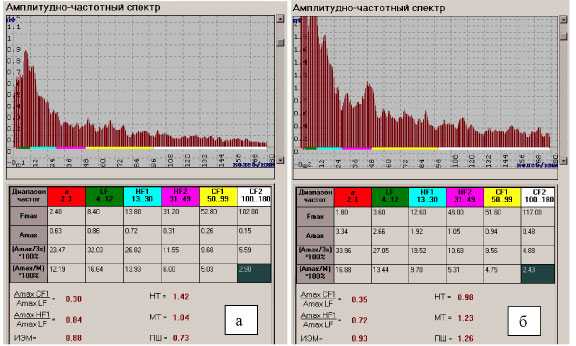
Рис. 6. Показатели АЧС. Показатели микроциркуляции ишемизированной тонкой кишки (а) и после восстановления кровообращения после устранения (б) острой спаечной тонко-кишечной непроходимости
Показатели микроциркуляции кишечника по данным ЛДФ при отсутствии острой хирургической патологии органов брюшной полости и c ишемией кишечника представлены в табл. 1.
За последние десятилетия, несмотря на усовершенствование техники соединения тканей, применение многочисленных методов прогнозирования, профилактики и ранней диагностики, в решении проблемы несостоятельности швов кишечных анастомозов (НШКА) радикальных изменений не наблюдается. Проблема приобретает особую актуальность при экстренной и неотложной резекции кишки на фоне острой кишечной непроходимости (ОКН), распространенного перитонита (РП), раковой и гнойной интоксикации, сочетанной травмы органов брюшной полости, у больных пожилого и старческого возраста.
Не менее сложно определить причины возникновения данного осложнения, среди которых имеют особое значение технические погрешности при формировании анастомоза [8], нарушение кровоснабжения сшиваемых тканей [9], вовлечение в воспалительный процесс стенки кишки, прилегающей к анастомозу, снижение ее защитно-барьерной функции для флоры, вегетирующей в просвете кишечника [10], анемия [13], повышение внутрикишечного давления [3, 14], наличие злокачественного новообразования и его распространенность [11, 17], проведение предоперационной лучевой терапии [11, 18].
Для профилактики данного осложнения используют различные методы и средства, такие как укрепление кишечных швов фибрин-коллагеновой субстанцией ТахоКомб [16], применение аутофибринового клея [5], биоклея ЛАБ [7], укрепление зоны анастомоза демукозированным сегментом подвздошной кишки [15], парамезентериальное введение иммуномодулятора [12], введение препарата энтеросана [6], интубационная декомпрессия, санация и гастроэнтеросорбция с полифепаном [4], перманентная внутрибрыжеечная блокада и лимфотропная терапия [1], лазермагнитотерапия зоны анастомоза [2], санация области анастомоза [10].
Цель работы - профилактика НШКА у больных после экстренной и неотложной резекции кишки при ОКН и РП различной этиологии.
Материал и методы
Проанализированы результаты лечения 576 больных, оперированных в экстренном и неотложном порядке в период с 1990 по 2008 г. Из 576 больных 332 составили основную группу (ОГ) и 244 - группу сравнения (ГС).
Из 332 больных ОГ 143 (43,07%) произведена резекция различных сегментов тонкой и толстой кишки по поводу осложненных форм раковой опухоли, 189 (56,93%) - по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 143 больных, оперированных в экстренном и неотложном порядке по поводу осложненных раковых опухолей, 112 (78,32%) проведены радикальные, 31 (21,68%) - паллиативные вмешательства. При радикальных операциях у 73 (65,18%) больных вмешательство завершилось наложением первичных анастомозов, у 39 (34,82%) - формирование энтеро- и колостомы.
Из 189 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 43 (22,75%) диагностирована ущемленная грыжа различной локализации, у 6 (3,18%) - тонко-тонкокишечная (1) и тонко-толстокишечная (5) инвагинация; у 49 (25,93%) - заворот кишки, у 6 (3,18%) - тромбоз и тромбоэмболия мезентеральных сосудов, у 34 (17,99%) - спаечная ОКН, у 15 (7,94%) - перфорация кишки различной этиологии, у 8 (4,23%) - колото-резаные раны, у 10 (5,29%) - огнестрельные ранения, у 17 (8,99%) - закрытые повреждения, у 1 (0,53%) - стеноз анастомоза. Из них у 162 (85,71%) операция завершилась наложением первичных анастомозов, у 27 (14,29%) - формированием энтеро- и колостомы. У 6 больных с первичными анастомозами в левой половине толстой кишки была сформирована разгрузочная цекостома.
Больным ОГ первичных анастомозов было наложено 235 (70,78%): тонко-тонкокишечных - 110 (46,81%), тонко-толстокишечных - 33 (14,04%), толсто-толстокишечных - 92 (39,15%). Проксимальные тонкокишечные анастомозы наложены 24 (10,2%) больным, дистальные тонкокишечные - 65 (27,7%), терминальные тонкокишечные анастомозы - 21 (8,9%), илеоцекоанастомозы - 5 (2,1%), илеоасцендоанастомозы - 6 (2,6%), илеотрансверзоанастомозы - 22 (9,4%), поперечно-поперечноободочные - 3 (1,3%), поперечно-нисходящеободочные - 8 (3,4%), поперечно-сигмовидноободочные - 10 (4,3%), поперечно-прямокишечные - 23 (9,8%), нисходящеободочно-прямокишечные - 48 (20,4%) больным.
Из 244 больных ГС 118 (48,36%) произведены операции по поводу осложненных раковых опухолей тонкой и толстой кишки, 126 (51,64%) - по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 118 больных, оперированных по поводу осложненных раковых опухолей, 71 (60,17%) произведены радикальные и 47 (39,83%) - паллиативные вмешательства. Радикальная операция у 21 (29,58%) больного завершилась наложением 24 первичных анастомозов, у 1 из них с анастомозом на левой половине толстой кишки дополнительно сформирована вспомогательная цекостома. У 50 (70,42%) больных были сформированы энтеро- и колостомы. Из 47 паллиативных операций в 6 (12,77%) были наложены обходные тонко-толстокишечные анастомозы, в 41 (87,23%) - энтеро- и колостомы.
Из 126 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 34 (26,98%) диагностирована ущемленная грыжа различной локализации, у 28 (22,22%) - заворот кишки, у 4 (3,18%) - тромбоз и тромбоэмболия мезентеральных сосудов, у 33 (26,19%) - спаечная ОКН, у 6 (4,76%) - перфорация кишечника различной этиологии, у 5 (3,97%) - колото-резаные раны, у 7 (5,56%) - огнестрельные ранения и у 9 (7,14%) - закрытые повреждения. Из 126 у 80 (63,49%) больных операция завершилась наложением первичного анастомоза, у 46 (36,51%) - формированием энтеро- и колостомы. У 3 больных с первичным анастомозом в левой половине ободочной кишки была сформирована дополнительная разгрузочная цекостома.
Больным ГС произведена резекция тонкой кишки с наложением первичных тонко-тонкокишечных анастомозов в 59 (56,7%) наблюдениях, резекция терминальной части тонкой кишки и правосторонняя гемиколэктомия с наложением илеоколоанастомоза - в 15 (14,4%), резекция толстой кишки с наложением коло-колоанастомоза - в 30 (28,9%). Проксимальные тонкокишечные анастомозы наложены 10 (9,6%) больным, дистальные - 42 (40,4%), терминальные - 7 (6,7%), илеоцекоанастомозы - 1 (0,96%), илеоасцендоанастомозы - 2 (1,9%), илеотрансверзоанастомозы - 12 (11,5%), поперечно-поперечноободочные - 3 (2,9%), поперечно-нисходящеободочные - 2 (1,9%), поперечно-прямокишечные - 14 (13,5%), нисходяще-прямокишечные - 11 (10,6%) больным. В 6 наблюдениях, в которых произведена паллиативная операция, были сформированы обходные илеотрансверзоанастомозы.
Таким образом, у 244 больных ГС было сформировано 110 (45,08%) первичных анастомозов и 141 (57,38%) - энтеро- и колостома. Из 110 первичных анастомозов 80 были наложены больным с неопухолевыми заболеваниями, 30 анастомозов наложены 27 больным со злокачественными опухолями. Среди последних 27 больных 21 произведены радикальные операции (наложено 24 первичных анастомоза, причем в 3 наблюдениях одномоментно сформированы тонко-тонкокишечные и толсто-толстокишечные анастомозы с резекцией тонкой и толстой кишки по поводу инвазии раковой опухоли толстой кишки в тонкую) и 6 больным наложены обходные илеотрансверзоанастомозы.
Из 141 кишечной стомы 49 были сформированы больным с неопухолевыми заболеваниями, причем 3 из них с первичными анастомозами в левой половине ободочной кишки была наложена вспомогательная цекостома. 92 наружных свища были сформированы у больных с осложненной формой рака тонкой и толстой кишки. У 51 больного кишечные стомы были сформированы после радикальных операций и у 41 - после паллиативных.
При соединении концов кишки нами в основном были использованы анастомозы по типу бок в бок. Из 235 анастомозов 175 (74,47%) были наложены по типу бок в бок, 60 (25,53%) - по типу конец в конец. У больных ГС из 110 анастомозов 37 (33,64%) были наложены по типу бок в бок, 68 (61,82%) - по типу конец в конец и 5 (4,55%) - по типу конец в бок.
Для прогнозирования НШКА и определения жизнеспособности резецируемых сегментов кишечника нами были использованы трансиллюминационная ангиотензиометрия и пульсомоторография по М.З. Сигалу и З.М. Сигалу. Для профилактики данного осложнения проводили назоинтестинальную и трансанальную интубацию тонкой и толстой кишки с интра- и послеоперационной декомпрессией, санацию, гастроэнтеросорбцию с полифепаном, перманентную внутрибрыжеечную блокаду и лимфотропную терапию и лазермагнитное облучение области швов анастомоза как во время операции, так и в послеоперационном периоде чрескожно с помощью приборов Орион и двухканального Мустанг-2000.
Результаты и обсуждение

В ОГ НШКА наблюдалась у 8 (3,40%) из 235 больных, в ГС - у 17 (15,46%) из 110 (см. таблицу), что связано с внедрением комплексных мероприятий по прогнозированию и профилактике ранних послеоперационных осложнений у больных, которым выполнена неотложная резекция кишечника.
Методы трансиллюминационной ангиотензиометрии и пульсомоторографии позволили с высокой точностью определить состояние интрамуральной гемодинамики анастомозируемых приводящего и отводящего концов кишки и перистальтической активности кишечника. Первичные анастомозы были наложены больным с максимальным интрамуральным артериальным давлением не ниже 8 кПа (60 мм рт.ст.) с пульсовым кровотоком и амплитудой пульсовой волны более 3 мм.
Для профилактики ранних послеоперационных осложнений больным ОГ проводили комплексные мероприятия. С целью интраоперационной и послеоперационной декомпрессии, санации и гастроэнтеросорбции выполняли назоинтестинальную и трансанальную интубацию желудочно-кишечного тракта. Для назоинтестинальной интубации были использованы зонды: желудочно-кишечный одноканальный и двухканальный силиконовый №25 с наружным диаметром 8,2 мм, длиной 2,5 м, для трансанальной интубации - №33 с наружным диаметром 11,2 мм, длиной 1,4 м. Для гастроэнтеросорбции использовали полифепан. Он положительно влияет на перистальтику кишечника, оказывает адсорбирующее, детоксикационное, антиоксидантное действие, повышает фагоцитарную активность ретикулоэндотелиальной системы, снижает протромбиновый индекс, повышает концентрацию IgA, ускоряет репаративные процессы, стимулирует регенерацию. Препарат не травмирует слизистую желудочно-кишечного тракта, что дает возможность его длительного применения. Сеансы гастроэнтеросорбции проводили 3-4 раза в день. В емкость помещали 300 мл изотонического раствора натрия хлорида, добавляли 20-30 г полифепана (из расчета 0,5-1 г на 1 кг массы тела больного в сутки) и перемешивали жидкость. С помощью шприца Жане вводили раствор с полифепаном фракционно в назоинтестинальный зонд 3-4 раза в день по 200-300 мл с последующим пассивным, а при необходимости активным выведением через 20-30 мин. Больным с тяжелым эндотоксикозом дополнительно проводили сеансы толстокишечного сорбционного диализа.
В послеоперационном периоде выполняли перманентную внутрибрыжеечную блокаду и лимфотропную терапию через катетер, введенный и фиксированный в корне брыжейки тонкой кишки, лекарственным составом, включающим местный анестетик новокаин 0,5% (по 7 мл/кг в сутки), антикоагулянт гепарин (по 150 ЕД/кг в сутки), антихолинэстеразный препарат прозерин (по 0,03 мг/кг в сутки) и антибиотик цефтриаксон (по 15 мг/кг в сутки). Это позволяет блокировать патологическую симпатическую и болевую импульсацию в стенке кишечника, ликвидировать спазм баугиниевой заслонки, быстрее восстановить перистальтику кишечника, что приводит к раннему уменьшению внутрикишечного давления, улучшает крово- и лимфообращение в области швов анастомоза, способствует его заживлению и тем самым предотвращает НШКА.
Для профилактики НШКА проводили также лазермагнитное облучение области швов анастомоза во время операции и в послеоперационном периоде, что способствует улучшению микроциркуляции, ликвидации отека в тканевом шовном валике и первичному заживлению кишечных анастомозов.
Таким образом, экстренная и неотложная резекция кишки должна проводиться с обязательным определением состояния интрамуральной гемодинамики анастомозируемых сегментов объективными методами исследования.
Для профилактики несостоятельности швов у больных с первичными анастомозами на фоне острой кишечной непроходимости и распространенного перитонита целесообразно проведение перманентной внутрибрыжеечной блокады, лимфотропной терапии и местной лазермагнитотерапии.
Проведение назоинтестинальной и трансанальной интубационной декомпрессии, санация и гастроэнтеросорбция полифепаном положительно влияют на процесс заживления анастомозов на фоне перитонита.
Внедрение разработанного комплекса мероприятий по профилактике несостоятельности швов кишечных анастомозов после экстренной и неотложной резекции кишки позволило уменьшить частоту осложнения на 12,06% у больных основной группы по сравнению с контрольной.
Читайте также:
