Обзор фармакодинамики
Добавил пользователь Евгений Кузнецов Обновлено: 24.01.2026
Кафедра терапии, клинической фармакологии и скорой медицинской помощи Московского государственного медико-стоматологического университета им. А.И. Евдокимова, Москва, Россия
Диосмин в лечении венозной патологии: основы фармакокинетики и фармакодинамики
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(3): 135‑140
Описаны вопросы всасывания диосмина, бактериального метаболизма в кишечнике, печеночного метаболизма. Приведены основные метаболиты препарата, указаны пути их элиминации. Дано описание основных терапевтических мишеней и механизмов воздействия на течение заболевания, реализуемых через влияние на тонус венозной стенки и ее проницаемость, лимфатический дренаж, воспаление и оксидативный стресс.
Диосмин относится к химической группе флавоноидов — полифенольных соединений, в основе которых находится флавоновая структура. Впервые описан в 1925 г. [1], а биологическая роль выделенных из красного перца флавоноидных соединений была изучена в 1936 г. Альбертом Сент-Дьерди, американским биохимиком венгерского происхождения, получившим в 1937 г. Нобелевскую премию за исследования биологического окисления и открытие витамина С. Флавоноидные производные в эксперименте уменьшали проницаемость сосудов, поэтому изначально они были названы витамином P (от англ. permeability — проницаемость). Название это закрепилось и просуществовало до начала 50-х годов, когда достаточно подробно были описаны различия в структуре и метаболизме различных соединений этой группы, в частности флавоноидов (диосмина, гесперидина, эриодиктиола, кверцетина и т. д.), а также изначально причисляемых к витамину P антоцианов и L-катехинов [2].
К настоящему моменту выделено и описано более 5000 соединений, относящихся к классу биофлавоноидов. Основными источниками этих веществ являются растения. Особенно богаты ими листья чая, цветы и листья гречихи, софоры японской, плоды цитрусовых, шиповника и черноплодной рябины (эти растения служат сырьем для производства медицинских препаратов).
Физиологическое значение биофлавоноидов в растительном мире по сей день остается не до конца выясненным, возможно, они предохраняют растения от тли и некоторых грибов, а также, поглощая ультрафиолет на длине 330—350 нм, защищают растения от избыточной радиации. Флавоноиды представлены только в растительном мире и не синтезируются в организме животных и человека, поэтому они могут рассматриваться как необходимый компонент пищи.
Отдельные попытки применения флавоноидов в медицине относятся к середине 40-х годов, когда различные препараты этой группы назначались для лечения артериальной гипертензии, стенокардии, а также ревматоидного артрита и других воспалительных заболеваний суставов [3, 4].
Общим недостатком используемых в те годы биофлавоноидных препаратов было отсутствие четкого понимания соотношения входящих в них компонентов — применяемые смеси биофлавоноидов не были стандартизованы по конкретным фракциям входящих в них молекул, что, естественно, не позволяло судить о вкладе того или иного вещества в получаемый эффект.
В дальнейшем флавоноидные препараты начали производиться в виде стандартизованных по содержанию одного или нескольких веществ, при этом другие входящие в состав препарата вещества того же химического класса могли иметь разброс в количественном и качественном составе (нестандартизованные добавки) при условии, что их количество было на 1—2 порядка меньше, чем содержание основных компонентов.
Производство препаратов, содержащих диосмин, в основном представлено двумя технологическими подходами. Первый — использование стандартизованной по содержанию диосмина (90%) и гесперидина (10%) фракции флавоноидов, в которую, помимо этих компонентов, входят количественно не стандартизованные фракции изороифолина и линарина — веществ, предположительно не имеющих собственной активности в связи с их низким содержанием в лекарственной форме.
Вторым подходом является использование диосмина, получаемого путем его выделения и очистки из исходного растительного сырья, содержащего как диосмин, так и гесперидин, из которого получают диосмин, — так называемый метод химического полусинтеза.
Как и в случае с витамином P, первое применение диосмина в клинике было связано с эмпирическими представлениями о механизмах его воздействия (уменьшение проницаемости сосудов). Описание его использования при синдроме «тяжелых ног» у женщин в постменопаузе относится к 1971 г. [5]. В дальнейшем препарат назначался для лечения отеков нижних конечностей у беременных, а потом стал применяться при варикозной болезни вен нижних конечностей [6].
Сходство некоторых звеньев патогенеза варикоза и геморроя позволило начать использование этого вещества при лечении последнего [7].
Несмотря на то что опыт применения диосмина скоро будет насчитывать 50 лет, фармакокинетика и фармакодинамика этого вещества остаются не до конца изученными, по-прежнему по некоторым аспектам фармакологии отсутствует единое и общепринятое представление, поэтому исследования свойств этого лекарства продолжаются.
Фармакокинетика
Абсорбция
По своей химической природе диосмин представляет собой соединение полициклической флавоновой структуры с дисахаридом — 7-О-рамнозил-глюкозид диосметина. Свойства этого соединения таковы, что оно достаточно плохо проникает через фосфолипидный бислой клеточных мембран и его всасывания в кишечнике в неизмененном виде практически не происходит. Однако под влиянием ферментов кишечной микробиоты α-рамнозидаз и β-глюкозидаз от диосметина (так называемого агликонового основания) отщепляются углеводные компоненты, которые в дальнейшем могут служить пищей для обитающих в кишечнике сапрофитных микроорганизмов. Диосметин, являясь молекулой примерно в 2 раза меньшего размера, а также обладая большей липофильностью, легче проходит через клеточные мембраны и попадает в системный кровоток. Всасывание диосметина отсрочено в связи с необходимостью прохождения этапа бактериального метаболизма и начинается примерно через 1—1,5 ч после приема. Время достижения максимальной плазменной концентрации (Cmax) составляет 5 ч [8].
Сходные свойства имеет входящий в состав биофлавоноидной фракции гесперидин, который в виде пролекарства представлен 7-О-рутинозидом, также подверженным ферментативному расщеплению с последующим всасыванием агликона гесперитина.
Исследования фармакокинетики препарата, проводимые с помощью использования радиоактивной углеродной метки С 14 , продемонстрировали биодоступность диосметина в пределах 30—50%, что является удовлетворительным показателем для препаратов, назначаемых перорально [9].
Последние исследования показали, что не всосавшаяся в кишечнике фракция диосметина может быть подвержена дальнейшему бактериальному метаболизму. В частности, при инкубации диосмина in vitro в присутствии бактерий, относящихся к родам Escherichia, Enterococcus и Bacillus, было обнаружено превращение диосметина в лютеолин и акацетин [10].
Кроме того, полученные в ходе фармакокинетического исследования у человека результаты позволяют предположить, что диосметин может превращаться в гесперитин. Об этом говорит нарастающая в плазме с 4-го часа после приема диосмина концентрация гесперитина [11]. Механизм такого превращения, кишечный бактериальный метаболизм или метаболизм первой фазы с участием ферментативных систем гепатоцитов и/или энтероцитов, на сегодняшний день остаются неясными.
Достаточно спорными выглядят опубликованные в 2018 г. данные об «особой» форме диосмин-гесперидин содержащей фракции флавоноидов, — так называемом препарате μSMIN. Согласно этим опубликованным данным, используемая технология микронизации позволяет увеличить биодоступность в 3—5 раз, что с учетом как минимум 30% биодоступности диосметина, продемонстрированной в эксперименте с радиоактивной меткой, позволяет подвергнуть утверждения обоснованным сомнениям [12]. В целом процесс микронизации исходной субстанции в случае применения биофлавоноидных препаратов, вероятно, не имеет критического значения, так как всасывание зависит не столько от степени диспергированности вещества, сколько от степени и скорости кишечного бактериального метаболизма. Кроме того, клиническое сопоставление результатов, полученных при применении таблетированной формы диосмина и диосмина в саше, не выявило значимых различий во влиянии на основные клинические точки [13].
Несмотря на то что теоретические преимущества микронизации субстанции сохраняются, что было подтверждено в эксперименте по изучению фармакокинетики метаболитов C 14 -меченого препарата [9], не удалось найти данных исследований, в которых бы проводилось прямое сравнение биодоступности диосмина, входящего в состав различных лекарственных форм. В целом проведение таких исследований затруднено ввиду особенностей абсорбции препарата и дополнительных факторов, влияющих на его метаболизм, о чем будет сказано ниже.
Метаболизм
Основные превращения диосметина относятся к так называемой второй фазе метаболизма. После всасывания и попадания в системный кровоток диосметин подвергается быстрой конъюгации при первом прохождении через печень. При изучении содержания свободного диосметина в плазме человека это вещество либо не выявляется, либо его детекция крайне затруднена ввиду предельно малых концентраций. Основным соединением диосметина, которое может быть подвергнуто количественному определению, является 3-О-глюкуронид, составляющий до 90—95% процентов всех метаболитов. Около 2% приходится на 3,7-О-глюкуронид. Кроме того, в плазме могут быть выявлены диосметина сульфат (не более 5%), а также сульфатированные глюкурониды диосметина (до 10%) [14].
Кроме конъюгатов, в крови обнаруживаются и другие метаболиты диосметина, происхождение которых связывается как с процессами ферментативного превращения в гепатоцитах (метаболизм первой фазы), так и с бактериальным метаболизмом. К таким молекулам относится 3-(3-гидроксифенил)пропионовая кислота (3,3-ГПК), которая определяется в крови в основном в виде ее глюкуроната. Другие метаболиты определяются в основном в моче. Это 3-гидрокси-4-метоксибензойная кислота, 3,4-дигидроксибензойная кислота и 3-метокси-4-гидроксифенолуксусная кислота. Эти метаболиты, вероятно, появляются вследствие расщепления С-кольца флавоновой структуры в результате воздействия на молекулу диоксигеназ и СоА-лигаз [15].
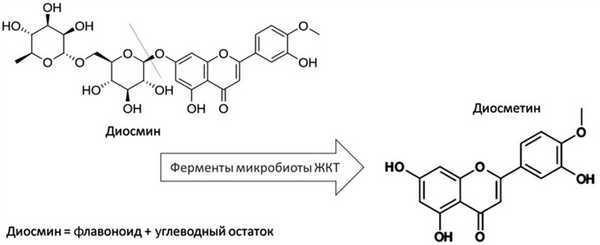
Самостоятельное значение этих метаболитов диосметина в настоящее время только изучается, однако есть данные о том, что они могут обладать фармакодинамической активностью. В частности, 3,3-ГПК в экспериментах приводит к расслаблению препарированной крысиной аорты, снижает артериальное давление, а также подавляет формирование β-амилоидных бляшек. Дегидробензойная кислота обладает антиоксидантным, нейропротективным и противовоспалительным эффектами, а также понижает уровень глюкозы крови [16, 17]. Метаболизм диосмина представлен на рис. 1. Рис. 1. Метаболизм диосмина.
Выведение
Согласно данным, полученным в эксперименте с участием здоровых добровольцев, выведение диосмина осуществляется в первую очередь в виде глюкуронида с мочой. Кроме того, в моче выявляются другие производные бензойной кислоты, также являющиеся метаболитами этого вещества.
Неабсорбированная из кишечника часть диосмина выводится как с калом в виде непреобразованного вещества, так и в виде диосметина и диосметина глюкуронида. Последний представлен незначительно и является выделенным с желчью метаболитом. В связи с этим любопытным было бы изучение выведения с калом производных бензойной кислоты, что дало бы окончательный ответ на вопрос, являются ли они также продуктами бактериального метаболизма. Однако в настоящее время публикаций, содержащих такие данные, найти не удалось [11, 15].
В связи с различными методиками определения диосметина в плазме данные по периоду полувыведения препарата различаются и составляют от 9—12 до 26—43 ч. Это связано с длительной циркуляцией диосметина-глюкуронида, который используется для количественного определения действующего вещества. В то же время в экспериментальных данных не было выявлено способности препарата кумулировать в организме.
Проникновение через плаценту и в грудное молоко
Несмотря на то что диосметин способен проникать через гематоплацентарный барьер, последний менее проницаем для его конъюгированных форм, что наряду с отсутствием данных о тератогенности препарата позволяет применять диосмин во время беременности. Данные о проникновении других метаболитов диосметина через плаценту, а также данные о попадании препарата и его метаболитов в грудное молоко отсутствуют.
Фармакодинамика
Клинический эффект диосмина складывается из нескольких точек приложения этого препарата.
Регулирование тонуса и проницаемости венозной стенки:
— улучшение лимфатического дренажа;
— уменьшение проницаемости капилляров.
— уменьшение адгезии лейкоцитов к эндотелию и выброса в кровь сигнальных молекул.
— оксигенация тканей венозной стенки;
— уменьшение свободнорадикального повреждения клеточных структур и активности матриксных металлопротеиназ.
Влияние на процессы свертывания:
— подавление локальной агрегации тромбоцитов;
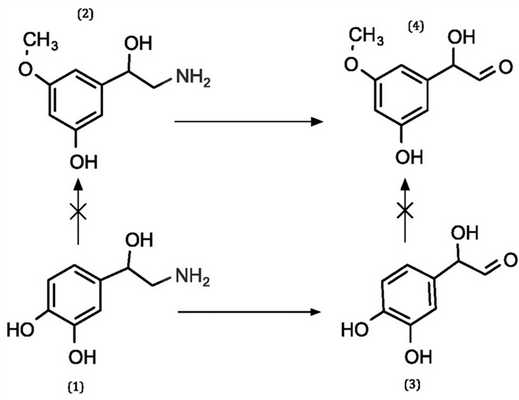
Особенности распределения препарата в организме и его тропность к тканям таковы, что наибольшее количество препарата после введения обнаруживается в препаратах вен. Поэтому повышение тонуса сосудистой стенки реализуется в первую очередь на этом уровне, не приводя к таким системным эффектам, как увеличение общего периферического сопротивления сосудов и повышение артериального давления. Предположительно механизм данного эффекта связан со способностью диосмина ингибировать фермент катехоламин-О-метилтрансферазу, ответственный за превращение норадреналина в норметадреналин (рис. 2). Рис. 2. Деградация норадреналина: норадреналин (1), норметадреналин (2), норадреналин альдегид (3), норметадреналин альдегид (4). Избирательное накопление норадреналина не только приводит к увеличению венозного тонуса и улучшению лимфатического оттока, но и уменьшает проницаемость капилляров (исторически первый выявленный эффект биофлавоноидов — витамина P). Клинически эти эффекты препарата могут приводить к уменьшению отеков конечностей [18].
Неясным остается механизм выявленного в эксперименте повышения чувствительности миоцитов к ионам кальция. Действуя как кальциевый синсезист, диосмин при наращивании его концентрации в среде вызывал усиление сокращения под влиянием кальция изолированной бедренной вены крысы [19].
Противовоспалительный эффект диосметина обусловлен его способностью модулировать взаимодействие лейкоцитов и моноцитов с эндотелием. За счет уменьшения способности иммунокомпетентных клеток к адгезии на стенке сосуда тормозятся тромбоцитзависимые и комплементзависимые механизмы поступления в кровоток сигнальных молекул системного воспалительного ответа и гистамина. На мембране лейкоцитов снижается количество экспрессируемых белков — L-селектина и интегрина. В крови уменьшается количество молекул адгезии сосудистой стенки ICAM-1 (inter-cellular adhesion molecule, молекула клеточной адгезии) и VCAM-1 (vascular cell adhesion molecule, сосудистая молекула клеточной адгезии), позволяющих форменным элементам крови фиксироваться на стенках сосудов. Все перечисленные механизмы приводят как к локальному уменьшению проницаемости сосудов, так и прерывают порочный круг запуска системного воспалительного ответа [20].
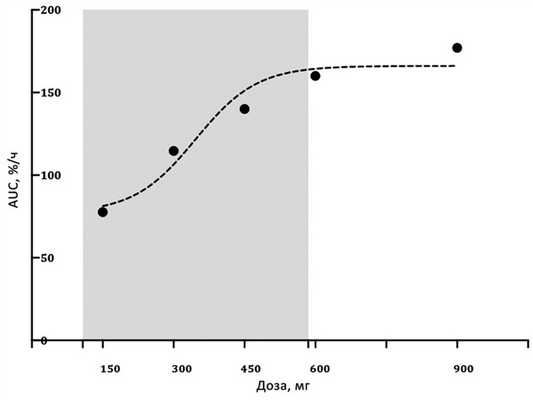
Выбор оптимального режима дозирования диосмина у человека был осуществлен на основании данных изучения резистентности венозной стенки у здоровых добровольцев после однократного применения препарата. При сопоставлении нарастающих доз от 150 до 900 мг была получена типичная S-образная кривая фармакодинамического ответа (рис. 3). Рис. 3. Влияние диосмина на прирост венозного сопротивления. Модель доза—ответ построена с помощью пакета GraphPad Prism 8.0. При использовании препарата в дозировках от 150 до 600 мг отмечалось возрастание сопротивления венозной стенки внешней компрессии, при этом характеристика нарастания зависимости доза—эффект была ближе к линейной. При использовании доз выше 600 мг линейная зависимость исчезала, кривая переходила в асимптотическую фазу, когда дальнейшее наращивание дозы не приводило к адекватному приросту эффекта [22].
Заключение
Диосмин и комбинация диосмина с гесперидином в настоящее время занимают ведущее место среди назначаемых при хронической венозной патологии препаратов. Теоретически подкрепленные фармакодинамические свойства нашли отражение в клинических исследованиях в виде доказанного влияния на симптоматику заболевания, его течение и клинические исходы. Близость патогенетических механизмов обусловила и другое показание к назначению диосмина — острый и хронический геморрой.
Препараты диосмина хорошо переносятся пациентами и, несмотря на теоретическую возможность активации системы цитохромов печени, не имеют клинически выраженных взаимодействий с другими лекарственными препаратами.
Невзирая на широкое применение и достаточно большое количество исследований препаратов, содержащих диосмин, некоторые аспекты их фармакологии остаются по-прежнему недостаточно изученными. Не до конца ясным остается значение метаболитов диосмина, в частности производных бензойной кислоты. Также в связи с особенностями фармакокинетики препарата затруднительным является проведение сравнительных фармакокинетических исследований, что делает сложной интерпретацию доказательной базы, на основании которой на фармацевтическом рынке появляются воспроизведенные препараты, содержащие диосмин.
Основы фармакодинамики

Фармакодинамика – это один из основных разделов фармакологии, изучающий особенности действия лекарственных средств на организм человека и животных. В сфере внимания данной дисциплины находятся как сами фармакологические эффекты препаратов, так и механизмы их развития.
ПРИНЦИПЫ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
При назначении определенного лекарственного средства большое значение имеет не только конечный эффект, который оно вызывает, но и то, каким образом активное вещество стимулирует развитие, реализацию этого эффекта. В любом варианте действие лекарственного препарата провоцируется его контактом с определенным биологическим субстратом (так называемой «мишенью»). В качестве «мишени» при этом могут выступать различные клеточные элементы: рецепторы, ионные каналы, ферменты, транспортные системы, гены. Рассмотрим каждую из этих «мишеней» поближе.
Рецепторы – активные группировки макромолекул субстратов, на которые нацелены действующие вещества лекарственных средств. Рецепторы проявляют селективную (избирательную) чувствительность к определенным химическим соединениям.
Препараты, которые возбуждают или повышают функциональную активность рецепторов, называют агонистами. Например, наркотический анальгетик фентанил является агонистом опиоидных мю-рецепторов ЦНС, спинного мозга и периферических тканей, а известное гипотензивное лекарство клонидин (Клофелин) - агонистом альфа-2-адренорецепторов сосудодвигательного центра головного мозга. В свою очередь вещества, связывающиеся с рецепторами, но не вызывающие их стимуляции и препятствующие действию агонистов, называются антагонистами. Скажем, средство налтрексон служит специфическим антагонистом тех же опиоидных рецепторов всех типов, а антигипертензивный препарат лозартан – антагонистом рецепторов ангиотензина II (полипептидный гормон, повышающий артериальное давление).
Если антагонисты взаимодействуют с теми же рецепторами, с которыми контактируют агонисты, то они называются конкурентными. В качестве иллюстрации здесь можно привести противорвотное средство трописетрон, которое выступает конкурентным антагонистом 5-HT3-серотониновых рецепторов кишечника и ЦНС. Если же антагонисты взаимодействуют с другими участками макромолекулы, не относящимися к специфическому рецептору, но взаимосвязанными с ними, то такие антагонисты именуются неконкурентными. К примеру, диуретический препарат спиронолактон служит неконкурентным антагонистом рецепторов альдостерона (гормон коры надпочечников). Заметим, что действие конкурентного антагониста может быть устранено большими дозами вещества-агониста или естественного медиатора.
Те или иные соединения могут проявлять повышенное сродство к определенному виду рецепторов. Подобное сродство определяется термином «аффинитет». Вещества могут оказывать действие только на определенный вид рецепторов, не влияя на другие типы. Действие таких средств называют избирательным. Например, ацетилхолин действует исключительно на холинорецепторы, а гистамин на определенный вид рецепторов, которые получили название «Н-гистаминорецепторы» (Н-рецепторы). Заметим, что существуют не только различные виды, но и подвиды рецепторов. Те же Н-рецепторы делятся на три подвида – Н1, Н2 и Н3. Лекарственные средства проявляют избирательность не только в отношении определенного вида рецепторов, но и его подвида и при этом оказывают различное фармакологическое действие. Так, антигистаминные средства (хлоропирамин, лоратадин, цетиризин и др.), блокирующие преимущественно Н1-гистаминорецепторы, используются при аллергических состояниях, а вот блокаторы Н2-гистаминорецепторов (циметидин, ранитидин, фамотидин) применяются в лечении гиперацидных расстройств.
Еще одной «мишенью» для действия лекарственного средства могут служить ионные каналы, определяющие трансмембранный электрический потенциал. Существуют Na+-каналы, Са2+-каналы, К+-каналы, которые регулируют множественные функции организма; соответственно, перекрытие этих каналов приводит к изменениям в работе тканей, органов и их систем. Например, вещества, блокирующие потенциал-зависимые Na+-каналы (лидокаин, прокаин и др.), проявляют местно-анестезирующее действие. Активные компоненты, блокирующие так называемые «медленные» Са2+-каналы (верапамил, дилтиазем и др.), реализуют множественные эффекты и широко применяются в клинике как антигипертензивные, антиаритмические и антиангинальные средства, а также как препараты для улучшения мозгового кровотока. Блокаторы К+-каналов (амиодарон, соталол и др.) используются в качестве антиаритмических средств.
Ферменты, транспортные системы и гены
Некоторые лекарственные препараты инициируют фармакологические эффекты за счет изменения активности определенных ферментов. Например, Физостигмин и Прозерин вызывают эффекты, характерные для стимуляции парасимпатической системы, за счет ингибирования фермента холинэстеразы. Действие ипразида и ниаламида опосредуется через угнетение активности фермента моноаминооксидазы и соответствующего накопления катехоламинов. Ацетазоламид (Диакарб) блокирует реабсорбцию натрия в почечных канальцах и вызывает диуретическое действие за счет блокады фермента почек карбоангидразы.
Еще одной из возможных «точек приложения» действия лекарственных веществ являются транспортные системы для полярных молекул, ионов, мелких гидрофильных молекул. Эти системы представлены специфическими транспортными белками, переносящими вещества через клеточную мембрану. Транспортные белки имеют «распознающие участки» для эндогенных веществ; некоторые лекарственные средства могут взаимодействовать с этими участками и нарушать перенос соответствующих эндогенных соединений. Так, трициклические антидепрессанты блокируют нейрональный захват норадреналина (амитриптилин, имипрамин и др.) и/или серотонина (сертралин и др.), а резерпин – блокирует депонирование норадреналина в везикулах.
Наконец, следует сказать, что в настоящее время большое значение приобретают лекарственные вещества, которые в качестве «мишеней» избирают специфические гены человека. Этой проблемой занимается специальное направление в фармакологии – генная фармакология.
Фармакология. Конспект лекций для вузов

Представляем вашему вниманию книгу содержащую более 80-и конспект лекций по "Фармакологии" В их числе: Фармакокинетика и фармакодинамика. Основные понятия Основные вопросы фармакокинетики Взаимодействие лекарственных средств Средства для наркоза Спирт этиловый Снотворные средства Противопаркинсонические средства Противосудорожные средства Средства, влияющие на функции органов дыхания Кардиотонические средства Рвотные и противорвотные средства и многие другие.
Оглавление
- Лекция 1. Фармакокинетика и фармакодинамика. Основные понятия (часть 1)
- Лекция 2. Фармакокинетика и фармакодинамика. Основные понятия (часть 2)
- Лекция 3. Основные вопросы фармакокинетики (часть 1)
- Лекция 4. Основные вопросы фармакокинетики (часть 2)
- Лекция 5. Основные вопросы фармакокинетики (часть 3)
- Лекция 6. Основные вопросы фармакодинамики (часть 1)
- Лекция 7. Зависимость фармакотерапевтического эффекта от свойств лекарственных средств и условий их применения
- Лекция 8. Взаимодействие лекарственных средств (часть 1)
- Лекция 9. Взаимодействие лекарственных средств (часть 2)
Приведённый ознакомительный фрагмент книги Фармакология. Конспект лекций для вузов предоставлен нашим книжным партнёром — компанией ЛитРес.
Лекция 6. Основные вопросы фармакодинамики (часть 1)
Основная задача фармакодинамики — выяснить, где и как действуют лекарственные вещества, вызывая те или иные эффекты, то есть установить мишени, с которыми взаимодействуют лекарства.
1. Мишени лекарственных средств
В качестве мишеней лекарственных средств выступают рецепторы, ионные каналы, ферменты, транспортные системы, гены. Рецепторами называют активные группировки макромолекул субстратов, с которыми взаимодействует вещество. Рецепторы, обеспечивающие проявление действия вещества, называют специфическими.
Выделяют 4 типа рецепторов:
рецепторы, осуществляющие прямой контроль за функцией ионных каналов (Н — холинорецепторы, Г АМКА-рецепторы);
рецепторы, сопряженные с эффектором через систему «G-белки-вторичные передатчики» или «G-белки-ионные каналы». Такие рецепторы имеются для многих гормонов и медиаторов (М — холинорецепторы, адренорецепторы);
рецепторы, осуществляющие прямой контроль функции эффекторного фермента. Они непосредственно связаны с тирозинкиназой и регулируют фосфорилирование белков (рецепторы инсулина);
рецепторы, осуществляющие транскрипцию ДНК. Это внутриклеточные рецепторы. С ними взаимодействуют стероидные и тиреоидные гормоны.
Сродство вещества к рецептору, приводящее к образованию с ним комплекса «вещество — рецептор», обозначается термином «аффинитет». Способность вещества при взаимодействии со специфическим рецептором стимулировать его и вызывать тот или иной эффект называется внутренней активностью.
2. Понятие о веществах-агонистах и антагонистах
Вещества, которые при взаимодействии со специфическими рецепторами вызывают в них изменения, приводящие к биологическому эффекту, называют агонистами. Стимулирующее действие агониста на рецепторы может приводить к активации или угнетению функции клетки. Если агонист, взаимодействуя с рецепторами, вызывает максимальный эффект, то это полный агонист. В отличие от последнего частичные агонисты при взаимодействии с теми же рецепторами не вызывают максимального эффекта.
Вещества, связывающиеся с рецепторами, но не вызывающие их стимуляции, называют антагонистами. Их внутренняя активность равна нулю. Их фармакологические эффекты обусловлены антагонизмом с эндогенными лигандами (медиаторами, гормонами), а также с экзогенными веществами-агонистами. Если они оккупируют те же рецепторы, с которыми взаимодействуют агонисты, то речь идет о конкурентных антагонистах; если другие участки макромолекулы, не относящиеся к специфическому рецептору, но взаимосвязанные с ним, то говорят о неконкурентных антагонистах.
Если вещество действует как агонист на один подтип рецепторов и как антагонист — на другой, оно обозначается как агонист-антагонист.
Выделяют и так называемые неспецифические рецепторы, связываясь с которыми вещества не вызывают возникновения эффекта (белки плазмы крови, мукополисахариды соединительной ткани); их еще называют местами неспецифического связывания веществ.
Взаимодействие «вещество — рецептор» осуществляется за счет межмолекулярных связей. Один из наиболее прочных видов связи — ковалентная связь. Она известна для небольшого количества препаратов (некоторые противобластомные вещества). Менее стойкой является более распространенная ионная связь, типичная для ганглиоблокаторов и ацетилхолина. Важную роль играют вандерваальсовы силы (основа гидрофобных взаимодействий) и водородные связи.
В зависимости от прочности связи «вещество — рецептор» различают обратимое действие, характерное для большинства веществ, и необратимое действие (в случае ковалентной связи).
Если вещество взаимодействует только с функционально однозначными рецепторами определенной локализации и не влияет на другие рецепторы, то действие такого вещества считают избирательным. Основой избирательности действия является сродство (аффинитет) вещества к рецептору.
Другой важной мишенью лекарственных веществ являются ионные каналы. Особый интерес представляет поиск блокаторов и активаторов Са2+-каналов с преимущественным влиянием на сердце и сосуды. В последние годы большое внимание привлекают вещества, регулирующие функцию К+-каналов.
Важной мишенью многих лекарственных веществ являются ферменты. Например, механизм действия нестероидных противовоспалительных средств обусловлен ингибированием циклооксигеназы и снижением биосинтеза простогландинов. Антибластомный препарат метотрексат блокирует дигидрофолатредуктазу, препятствуя образованию тетрагидрофолата, необходимого для синтеза пуринового нуклеотида-тимидилата. Ацикловир ингибирует вирусную ДНК-полимеразу.
Еще одна возможная мишень лекарственных средств — транспортные системы для полярных молекул, ионов и мелких гидрофильных молекул. Одно из последних достижений в этом направлении — создание ингибиторов пропионового насоса в слизистой оболочке желудка (омепразол).
Важной мишенью многих лекарственных веществ считаются гены. Исследования в области генной фармакологии получают все более широкое распространение.
Обзор фармакодинамики
Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского Минздрава России, Москва, Россия, ФГБОУ ВПО Институт медико-социальных технологий, Москва, Россия, Психиатрическая клиническая больница №1 им. Н.А. Алексеева, Москва, Россия
ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия
Государственный институт усовершенствования врачей Министерства обороны РФ, Москва
ООО «Микротесты в биологии, медицине и ветеринарии», Москва, Россия
ООО «Генотек», Москва;
Институт общей генетики им. Н.И. Вавилова РАН, Москва
Перспективы применения фармакогенетических тестов в психиатрии и неврологии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(9): 131‑135
Статья представляет собой обзор, посвященый современному состоянию фармакогенетических исследований и возможностям их применения в области психиатрии. Перечислены основные гены, ответственные за фармакодинамику и фармакокинетику лекарственных средств, применяемых в клинической психиатрии. Представлен анализ соответствующих зарубежных фармакогенетических клинических рекомендаций и результатов их внедрению в медицинскую практику в различных странах Европы и США. Поставлен вопрос о необходимости создания российских клинических рекомендаций по фармакогеномике для повышения эффективности лечения пациентов и осуществления персонифицированного подхода к терапии.
Фармакогеномика занимается изучением той части генетической информации, которая определяет вариабельность метаболизма лекарственных средств в организме, их терапевтические и побочные действия [1, 2]. Раздел молекулярной диагностики и фармакологии, занимающийся исследованием отдельных генов, оказывающих влияние на эффект лекарственного средства, называют фармакогенетикой [3]. Накопленные этими науками данные позволили создать для некоторых препаратов список генов, способных влиять на их фармакокинетику (посредством изменения абсорбции, распределения, метаболизма и элиминации препарата) и фармакодинамику (посредством изменения мишени или сигнальных путей, определяющих чувствительность к препарату).
Важнейшим и перспективным для клинической практики результатом достижений современной фармакогенетики становится разработка и внедрение специальных тестов на выявление генотипов, ассоциированных с вариантами фармакологического ответа пациента [1]. Проведение фармакогенетических тестов позволяет выявить конкретные генетические вариации, которые могут повлиять на распределение в организме, накопление, выведение и взаимодействие с различными молекулами определенных лекарственных средств. Генетические вариации могут, например, увеличить риск токсичности препарата или привести к его низкой эффективности. Таким образом, фармакогенетические исследования помогают персонально подобрать лучший препарат и определить его наиболее эффективную дозу. Несмотря на то что фармакогенетика как наука существует уже в течение нескольких десятилетий, внедрение ее методов в непосредственную психиатрическую практику происходит очень медленно.
Фармакогенетические тесты могут быть подразделены на реактивные и предварительные. Реактивные тесты проводят при наличии у пациента побочных эффектов от конкретного препарата или при его неэффективности. Предварительный тест проводят 1 раз, и его результаты могут быть затем использованы по необходимости: перед назначением лекарственного препарата с целью выбора наиболее подходящего или определения наиболее соответствующей дозировки.
Воздействие лекарственного средства на организм определяется генетическими особенностями организма. По различным оценкам, генетические варианты определяют от 20 до 95% вариабельности ответа в зависимости от лекарственного средства [4]. Варианты, влияющие на реакцию лекарственного средства, в основном расположены в генах, кодирующих ферменты и транспортеры для метаболизма лекарств (ADME-гены), в генах лекарственных мишеней и аллелях антигенов лейкоцитов человека.
Для всех заболеваний, кроме онкологических и инфекционных, фармакогенетические вариации генома представляют собой прежде всего герминативные изменения, либо унаследованные от родителей, либо изменения de novo, которые модулируют функцию генных продуктов. При раке как наследственные, так и соматические вариации генома могут оказывать влияние на эффект противораковых препаратов. Для инфекционных заболеваний геномная вариация самих инфекционных агентов может изменить их чувствительность к противомикробным препаратам [5].
Широко обсуждается применение фармакогенетических исследований для оптимизации лечения депрессии и биполярных расстройств [6]. По данным Всемирной организации здравоохранения, в 2017 г. более чем у 300 млн человек по всему миру была выявлена клиническая депрессия. При этом назначение правильного антидепрессанта является очень трудной задачей для врача из-за гетерогенности заболевания и большого количества различных препаратов. Кроме того, ремиссия (полное исчезновение депрессии) наблюдается только у одной трети пациентов после лечения одним препаратом, а результаты ухудшаются при последующих попытках [7, 8]. Однако есть хорошо изученные гены, отвечающие за распределение, абсорбцию, метаболизм и разрушение антидепрессантов, и учет имеющихся в них известных вариаций может значительно повысить эффективность правильно подобранного лечения [1].
Для фармакогеномики важны 3 процесса, происходящие с препаратом в организме: поглощение, распределение в организме и терапевтический эффект лекарственного средства. Первые два относятся к фармакокинетике, третий — к фармакодинамике. Сответственно гены, которые исследуют при проведении фармакогенетического тестирования, могут быть подразделены на гены, вовлеченные в регуляцию процессов фармакодинамики, и гены, вовлеченные в регуляцию процессов фармакокинетики. Большинство коммерческих тестов основаны на анализе генов, определяющих параметры фармакокинетики лекарственных препаратов.
Генетические аспекты фармакодинамики антидепрессантов
Наиболее изучаемым в психиатрии является полиморфизм промотора гена транспортера серотонина (5-HTTLPR). Существуют различные, иногда противоречивые результаты, но в целом высокоэкспрессированные аллели 5-HTTLPR связаны с увеличением связывания переносчика серотонина в головном мозге [9]. Большинство антидепрессантов, используемых сегодня, являются ингибиторами обратного захвата моноаминов и действуют на уровне пресинаптических транспортеров. Поэтому переносчики моноаминов, такие как 5-HTTLPR, которые стимулируют пресинаптический перехват секретируемых аминов, являются наиболее логичными генами-кандидатами в фармакогенетических исследованиях лечения антидепрессантами.
Также показали связь с эффектом лечения антидепрессантами следующие гены: гидроксилаза триптофана 1 (ТРН1, генотип 218С/C), мозговой натрийуретический фактор (BDNF, 66Val/Met полиморфизм), рецептор серотонина 2А (HTR2A, 1438G/G) [10], а также главный комплекс гистосовместимости HLA-B [11].
Генетические основы фармакокинетики антидепрессантов
Для фармакокинетики лекарственных препаратов наиболее важными являются надсемейства генов CYP450 (cytochrome P450, цитохром Р450-зависимая монооксигеназа) и ферментов-транспортеров АТФ-связывающих кассет (АВС). Первое надсемейство регулирует деградацию лекарственных средств, второе — прохождение препаратом гематоэнцефалического барьера. Было идентифицировано 6 генов CYP, участвующих в метаболизме антидепрессантов: CYP2D6, CYP2C19, CYP3A4 и CYP1A2 [1]. Наиболее важным и изученным является CYP2D6 с более чем 78 функциональными аллельными вариантами. Варианты аллелей могут приводить к синтезу фермента с измененной активностью. В результате повышается или понижается скорость метаболизма ряда лекарственных средств (приблизительно 25% от всех лекарственных средств) [12]. Человек может обладать ультрабыстрым, быстрым, промежуточным или медленным уровнем метаболизма лекарственных средств. У быстрых метаболизаторов происходит быстрая биодеградация лекарственного препарата, и он не успевает оказывать терапевтического эффекта. У медленных метаболизаторов препарат накапливается в кровотоке и приводит к развитию побочных эффектов при нормальной дозе. Медленным метаболизаторам необходимо назначать препараты в меньшей дозе в связи с большим риском побочных эффектов, быстрым и ультрабыстрым — в большей. У последних терапевтический эффект часто не достигается даже при назначении максимально допустимых суточных доз. Различные полиморфизмы CYP2D6, определяющие тип метаболизма, встречаются с разной частотой в разных этнических группах [13]. Примерно 7—10% людей европейской расы являются медленными метаболизаторами CYP2D6, а 2—3,5% относятся к ультрабыстрым метаболизаторам [1]. Таким образом, эффективность и вероятность развития побочных эффектов при применении антидепрессантов и некоторых других лекарственных средств (бета-блокаторы, нейролептики, производные морфина) определяется индивидуальными характеристиками CYP2D6. Кроме того, некоторые селективные ингибиторы обратного захвата серотонина (СИОЗС) для лечения депрессии, такие как Paxil (пароксетин), Prozac (флуоксетин) и Celexa (циталопрам), ингибируют активность CYP2D6, что может в конечном итоге изменить тип метаболизации.
Также за метаболизм некоторых антидепрессантов (циталопрам, имипрамин) отвечает CYP2C19. Было выявлено более 16 вариаций CYP2C19, связанных с недостаточной, уменьшенной, нормальной или повышенной активностью фермента. Генотипы CYP2C19*2 и CYP2C19*3 характеризуются плохим уровнем метаболизации. Вариант CYP2C19*17 связан с ультрабыстрой метаболизацией и был выявлен у шведов, эфиопов и китайцев [14]. Фармакогенетическое тестирование для определения полиморфизмов CYP2D6 и CYP2C19 рекомендовано для назначения трициклических антидепрессантов [15].
АТФ-связывающие вещества подразделяются на 7 белков, которые транспортируют молекулы через наружные и внутренние мембраны клетки. В психиатрии наибольший интерес представляет Р-гликопротеин, который регулирует распределение антидепрессантов в головном мозге. Р-гликопротеин, также известный как белок множественной лекарственной устойчивости 1, кодируется геном ABCB1 (MDR1) и использует гидролиз АТФ для активного транспорта молекул субстрата против градиента концентрации. Было показано, что субстратами для Р-гликопротеина является, например, трициклический антидепрессант имипрамин, тогда как большинство антидепрессантов (амитриптилин, дулоксетин, флуоксетин, миртазапин) не являются субстратом Р-гликопротеина [16]. Транспорт с участием Р-гликопротеина через гематоэнцефалический барьер может оказаться ключевым аспектом терапевтического эффекта и объяснить тот факт, что у некоторых пациентов наблюдается высокая концентрация антидепрессантов в крови, но они не реагируют на лечение. В частности, выявлен полиморфизм (rs2032583), который коррелирует с ответом на антидепрессанты, являющиеся субстратом Р-гликопротеина [17, 18].
Применение фармакогенетических тестов в психиатрии
Существует много исследований эффективности применения фармакогенетического тестирования перед назначением препаратов для лечения психических расстройств. Так, на выборке пациентов с депрессивным расстройством провели сравнение нескольких доз препарата дезвенлафаксин. Оказалось, что доза, которая была определена для пациента по результатам генетического анализа, статистически не отличалась от дозы, которая приводила у этого пациента к ремиссии заболевания [19]. В крупнейшем рандомизированном двойном слепом клиническом исследовании был выявлен более высокий процент пациентов с ремиссией депрессии после выбора препарата с учетом данных фармакогенетического теста по сравнению с пациентами, которым препарат был назначен в ходе стандартного протокола (35 и 13% соответственно) [20].
Применение фармакогенетических тестов также необходимо для предотвращения развития побочных реакции при назначении одного или нескольких препаратов разных фармакологических групп вследствие их взаимодействия [21]. Особенно это наблюдается при использовании препаратов, являющихся субстратами одних и тех же ферментов метаболизма. В ряде случаев происходит «наслоение» побочных эффектов препаратов и вследствие этого их утяжеление.
Эффективность применения фармакогенетических тестов в психиатрической практике была показана в единичных, как зарубежных [22], так и в российских исследованиях [23].
Несмотря на исследования, подтверждающие эффективность внедрения фармакогенетических тестов в широкую медицинскую практику, есть и ряд ограничивающих факторов, например низкая осведомленность врачей, которые не являются генетиками [24], сложность интерпретации результатов теста и постоянное обновление генетической информации. Для устранения этих проблем активно ведутся разработки систем, помогающих врачу с принятием решения о назначении лекарственного средства на основании данных фармакогенетического теста [25]. Кроме того, значительно облегчило бы интерпретацию результатов фармакогенетического теста создание клинических рекомендаций с четким описанием связи ген—препарат и алгоритма принятия решения.
Клинические фармакогенетические рекомендации
В клинических рекомендациях содержится информация фармакогенетических отношений между генами и лекарственными средствами, а также руководство по интерпретации результатов тестов: как преобразовать генотип в фенотип, как сменить препарат или его дозу на основании этих результатов с уровнем доказательности для каждой рекомендации. Определение клинически применимой пары ген—лекарство происходит на основании ряда данных. Прежде всего к ним относятся данные клинических исследований, а также данные функциональных исследований in vivo и in vitro, описания случаев развития побочных эффектов [37].
В недавнем исследовании [38] были проанализированы данные из открытых источников и создана минимальная фармакогенетическая панель для психиатрии. Эта панель включает 16 аллелей в генах CYP2D6, CYP2C9, CYP2C19, HLA-A и HLA-B.
Применение фармакогенетического тестирования для назначения лекарственных препаратов приводит не только к улучшению показателей лечения пациентов, но и к снижению затрат на терапию за счет сокращения использования неэффективных лечебных средств [39, 40]. На примере медицинской практики в США было показано, что внедрение фармакогенетического тестирования позволяет сэкономить до 3962 долларов на одного пациента в год [41].
В отличие от ряда зарубежных стран в настоящее время в России нет единого руководства по применению генетических тестов в клинической фармакологии. Создание таких клинических рекомендации позволит начать процесс внедрения фармакогенетических тестов в медицинскую практику и осуществить персонализированный подход к назначению препаратов, что особенно важно в психиатрии в связи трудностями подбора адекватных состоянию больного препаратов и тенденцией к полипрагмазии. Более того, есть основания полагать, что разработка таких рекомендаций может способствовать общему повышению эффективности лечения пациентов и снижению экономического бремени на здравоохранение.
Публикация подготовлена в рамках работы по научному гранту Департамента здравоохранения Москвы.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Как цитировать:
Особенности фармакодинамики лекарственных средств у детей: значение фармакогеномики и фармакогенетики

Данные о безопасности и эффективности большинства применяемых в клинике фармакологических средств изучены у взрослых, и лишь сравнительно небольшое число лекарств, представленных на фармацевтическом рынке, разрешены к применению у детей. Так, в проспективном обсервационном исследовании [1], включавшем педиатрических пациентов в возрасте до 12 лет, госпитализированных в стационар 3-го уровня медицинской помощи, оценивали назначение лекарственных средств off-label. Установлено, что из 1645 прописанных препаратов 1152 (70%) были назначены в режиме off-label по 14 категориям, среди которых наиболее частыми были несоответствие дозировок препаратов и возрастных ограничений пациентов, указанных в инструкции по применению лекарственных средств. Чаще всего не по строгим показаниям назначались препараты для лечения бронхолегочных заболеваний (82%), антибактериальные средства (73%), а также препараты для медикаментозной терапии патологии центральной нервной системы (53%). Показано, что важными предикторами назначения off-label у педиатрических пациентов были возраст до 2 лет (относительный риск (ОР) 1,68 при 95% доверительном интервале (ДИ); р <0,001) и длительность нахождения пациента в стационаре от 6 до 10 дней (ОР 1,91 при 95% ДИ; р<0,001).
Важно отметить, что лекарственные средства для детей являются значительно менее прибыльным сегментом фармацевтического рынка. Большинство выпускаемых лекарственных средств (65-80%) не были протестированы на детях. Производители сталкиваются с экономическими, этическими, техническими и правовыми проблемами при проведении клинических исследований в данной возрастной группе [2]. Однако потребность в безопасных лекарственных средствах для применения в педиатрической практике остается крайне высокой. Показатели фармакокинетики и фармакодинамики лекарственных средств различаются при применении у разных возрастных групп, что может значительно снизить их эффективность и привести к развитию нежелательных реакций при применении у детей. Именно поэтому мы сочли своевременной публикацию тематического раздела, посвященного педиатрическим назначениям. В представленном обзоре рассматриваются вопросы, касающиеся применения лекарственных средств в детской популяции.
Чтобы определить способ применения лекарственных средств у детей, необходимо знать онтогенез всех систем, связанных с воздействием препаратов, и ответную реакцию организма. Основным направлением при разработке препаратов для педиатрических пациентов является установление безопасных и эффективных дозировок лекарственных средств с применением научных методов и рациональных подходов к их использованию (в основном посредством оценки безопасности, эффективности и фармакокинетических исследований в детской популяции). Причем у детей необходимо обеспечить безопасность и эффективность лекарственного средства уже при первом его приеме.
Расчет терапевтической дозы лекарства у детей обычно проводится в соответствии с массой тела или площадью поверхности тела пациента без учета изменения функции органов и систем быстрорастущего организма [3]. Долговременная медикаментозная терапия должна быть индивидуализированной и учитывать особенности фармакокинетических и/или фармакодинамических параметров препарата (рис.). На фармакокинетические параметры препаратов оказывает влияние ряд физиологических (масса и объемы различных тканей и органов организма, скорость кровотока, экскреция почками или с желчью), физико-химических (коэффициент разделения между органом/тканью и кровью) и биохимических факторов (скорость метаболизма лекарственных средств) [4]. Возраст-зависимые изменения абсорбции, распределения, метаболизма и экскреции могут привести к значительным различиям фармакокинетических параметров и реакции на лекарства у новорожденных, детей более старшего возраста и взрослых.
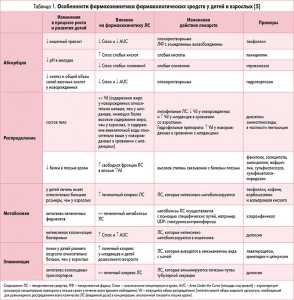
В последние десятилетия при исследовании фармакологических свойств лекарственных средств приоритет отдавался изучению фармакокинетики, а фармакодинамике уделялось меньшее внимание, в частности, в педиатрической популяции, включая ее возрастные особенности. Фармакокинетика лекарственных средств у детей более подробно освещена нами ранее [3]. Суммарно различия фармакокинетических свойств лекарственных средств у детей и взрослых представлены в таблице 1.
Ряд важных мишеней лекарственных средств не описаны у детей, в некоторых случаях информация о фармакодинамике препарата основывается на экспериментальных данных, реже – на исследованиях у взрослых [6]. В то же время данные фармакодинамики имеют большое значение в понимании возрастных особенностей действия и в разработке эффективных лекарственных средств для детей, особенно новорожденных [7]. Так, в эксперименте на животных установлено, что максимальная экспрессия ряда рецепторов отмечается сразу после рождения [8].
Фармакодинамика
Фармакодинамика – это раздел фармакологии, изучающий биохимические и физиологические эффекты препарата и механизмы его действия на организм человека [9]. При этом свойства и способ введения лекарственного средства определяют возможность воздействия лишь в определенной части тела (ткани-мишени). Терапевтический эффект достигается в результате взаимодействия лекарственного средства с органом-мишенью. Однако влияние на другие клетки, ткани или органы способно приводить к появлению нежелательных побочных реакций [10]. Возраст ребенка, а также генетические вариации, наличие патологии и нутрициональный статус могут оказывать влияние на фармакодинамику (и фармакокинетику) и общий клинический ответ на препарат.
Фармакодинамика изучает такие показатели, как мишени к лекарственным средствам (рецепторы, ионные каналы, ферменты, транспортные системы, гены), сигнальные механизмы, эффекторы и химическое взаимодействие [7]. У детей в зависимости от возраста отличается количество рецепторов, их локализация в различных тканях и, соответственно, возможность связывания с препаратом, что оказывает влияние на выраженность основного фармакологического эффекта. Следует подчеркнуть то обстоятельство, что доказанная эффективность у взрослых не гарантирует столь же благоприятный эффект и профиль безопасности у детей, подтверждая необходимость проведения клинических исследований в педиатрической популяции для оценки эффективности и токсичности лекарственного средства. Например, предполагается, что больший кислотосупрессивный эффект лансопразола у детей раннего возраста обусловлен снижением элиминации препарата [11]. Продемонстрировано, что у детей младшего возраста отмечается более высокая гепатотоксичность вальпроевой кислоты, связанная с повышенным образованием гепатотоксических метаболитов [12].
Наряду с фармакокинетическими данными фармакодинамика позволяет объяснить связь между введенной дозой препарата и наблюдаемым ответом и занимает центральное место при определении оптимальных режимов дозирования [13]. Так, результаты клинических исследований [14] позволили установить, что у детей препубертатного возраста отмечается усиленный фармакологический ответ на стандартную дозу варфарина (антикоагулянт непрямого действия, в течение многих лет применяемый в педиатрии) по сравнению с более старшими детьми (12-18 лет) и взрослыми пациентами (37-76 лет). Окончательный механизм большей чувствительности к варфарину остается неизвестным. В ряде проспективных исследований [15] установлено, что при использовании варфарина у детей существуют определенные трудности, в частности, пациентам в возрасте до 12 мес требуются относительно большие дозы для достижения и поддержания международного нормализованного отношения (МНО) в необходимом терапевтическом интервале, более быстрая коррекция терапии при изменении МНО для предупреждения передозировки препарата, более частый лабораторный контроль при подборе дозы, а затем более редкий – при ее поддержании. Нестабильность фармакодинамики препарата, множественные лекарственные взаимодействия, зависимость от диеты пациента требуют более тщательного контроля терапии и нередко коррекции дозы. Кроме того, в связи с отсутствием детских дозировок при низкой массе тела пациента, а также повышенной чувствительности ребенка к данным препаратам, возможно, возникнет необходимость в дроблении дозы препарата и даже его аптечной навеске.
Другим примером является изменение иммуносупрессивного действия циклоспорина в зависимости от возраста детей. Так, в группе детей до 1 года отмечен более выраженный иммуносупрессивный эффект циклоспорина в сравнении со старшими детьми и взрослыми, что, как предполагается, связано с определенной незрелостью иммунной системы у детей и оказывает влияние на терапевтическую эффективность различных дозировок препарата [16]. Кроме того, метаболизм циклоспорина зависит от возраста. Показано, что клиренс циклоспорина у детей в 1,5-2 раза выше, а период полувыведения меньше в сравнении со взрослыми лицами, что обусловливает применение более высоких дозировок циклоспорина в педиатрической практике, чем у взрослых пациентов [17, 18]. Данных об изменении фармакодинамики лекарственных средств в растущем и развивающемся организме ребенка в настоящее время недостаточно. Имеющиеся данные касаются экспрессии рецепторов органов-мишеней к лекарственным препаратам, тесно связанной с возрастом. Вместе с тем в этом направлении необходимы дальнейшие исследования, включая проведение клинических испытаний.
Рецепторы лекарственных средств
С молекулярно-биологической точки зрения термин «рецептор» обозначает белковую структуру, которой присуща способность специфически распознавать природный агонист, активироваться под его воздействием и вызывать передачу сигнала в клетку или между внутриклеточными компартментами [19].
Рецепторы фармакологических средств представляют собой биологические компоненты, локализованные на клеточной мембране (мембранные рецепторы) или в цитоплазме (внутриклеточные рецепторы), селективно связывающиеся с сигнальными молекулами лекарств и инициирующие фармакологический ответ [20]. Установлено 4 основных типа рецепторов.
1. Рецепторы, сопряженные с ионными каналами, обеспечивающие проницаемость мембран для ионов. Так, никотиновые холинорецепторы (Н-холинорецепторы) усиливают проницаемость мембран для ионов Na + , K + , Ca 2+ , вызывая деполяризацию и возбуждение функции клеток [21]. Другим примером являются рецепторы ГАМКА, при активации которых отмечается изменение проницаемости плазматических мембран для ионов Cl–, следствием чего является деполяризация (пресинаптическое торможение) или гиперполяризация (постсинаптическое торможение) [22].
2. Рецепторы, ассоциированные с G-белками (М-холинорецепторы, адренорецепторы, гистаминовые рецепторы). С их помощью осуществляется опосредованное через G-белки влияние на ионные каналы и на активность ферментов, регулирующих образование вторичных мессенджеров (циклические мононуклеотиды: циклический аденозинмонофосфат, циклический гуанозинмонофосфат, инозитолтрифосфат, диацилглицерин и др.) [23]. G-белки регулируют активность протеинкиназ, обеспечивающих внутриклеточное фосфорилирование важных регуляторных белков и формирование разнообразных эффектов.
3. Рецепторы, сопряженные с ферментами. Они связаны с плазматической мембраной клеток, фосфорилируют белки клеток и изменяют их активность. К ним относятся рецепторы к инсулину, лимфокинам, эпидермальному и тромбоцитарному факторам роста.
4. Рецепторы – регуляторы транскрипции ДНК. Они являются внутриклеточными и представляют собой растворимые цитозольные или ядерные белки. Функция рецепторов – активация или ингибирование транскрипции генов. К таким рецепторам относятся: суперсемейство рецепторов с внутренней тирозинкиназной активностью, рецепторы для трансформирующего фактора роста β, рецепторы, сопряженные с JAK-киназами и другими типами тирозинкиназ, рецепторы с гуанилат-циклазной активностью [24].
Первые три типа относятся к мембранным рецепторам и локализованы на цитоплазматической мембране, а четвертый – к цитозольным рецепторам.
Рецепторы, обеспечивающие проявление действия определенных веществ, называют специфическими. Так, рецепторы с тирозинкиназной активностью взаимодействуют с гормонами (инсулин, инсулиноподобный фактор роста) и паракринными/аутокринными регуляторами (тромбоцитарный фактор роста, эпидермальный фактор роста) [25]. В возрасте 1-3 лет полностью завершается формирование и созревание рецепторного клеточного аппарата, в связи с чем на фоне разбалансированности различных звеньев (например, завершение формирования α- и β-адренорецепторов происходит с большим разрывом во времени) высок риск развития извращенных эффектов и характерен неадекватный ответ в виде гиперреакции на введение адреномиметиков.
Результаты экспериментальных исследований на моделях животных позволили установить преобразование экспрессии опиоидных рецепторов в перинатальном периоде. В частности, определенные типы рецепторов более распространены сразу после рождения, а другие появляются у детей постарше [26]. Модификация чувствительности рецепторного звена наблюдается в период полового созревания. Так, чувствительность μ-рецепторов к опиатам возрастает, и для достижения адекватного анальгетического эффекта требуются меньшие дозы наркотических анальгетиков наряду с более быстрым формированием наркотической зависимости. Кроме того, снижается чувствительность М-холинорецепторов, гистаминовых рецепторов; выявлена высокая связывающая способность альбуминов крови к большинству ксенобиотиков [27] (табл. 2).
Фармакогеномика и фармакогенетика
Заключение
Применение лекарственных средств в педиатрической практике должно проводиться с осторожностью, необходимо учитывать физиологические особенности различных возрастных групп. Для проведения эффективной и безопасной фармакотерапии у детей обязательным условием является фундаментальное понимание возрастных особенностей фармакокинетики и фармакодинамики лекарственных средств. Фармакотерапия заболеваний детского возраста должна проводиться с обязательным участием клинического фармаколога, владеющего знаниями в области фармакокинетики, фармакодинамики, а также об эффективности и безопасности лекарственных средств.
Литература
СТАТТІ ЗА ТЕМОЮ Педіатрія
Наукові симпозіуми є своєрідним дзеркалом, яке чітко відображає сучасні події в житті суспільства. Кілька років тому медичне товариство активно розробляло заходи щодо боротьби з COVID-19, нині лікарі обговорюють можливості запобігання та лікування жахливих наслідків, пов’язаних із воєнними діями. Науково-практична конференція «Гастротандем: на стику дисциплін» висвітлювала особливості фармакологічної підтримки дорослих і дітей, які постраждали внаслідок російської агресії.
Читайте также:
