Сортировка белка в поляризованных клетках эпителия
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Транспорт и сортировка лизосомальных ферментов в транс-Гольджи
• Все вновь синтезированные мембранные и секреторные белки следуют по одному транспортному пути до достижения транс-Гольджи сети, где они распределяются в различные транспортные везикулы, в соответствии с местом своего назначения
• Клатриновые везикулы транспортируют лизосомальные белки из транс-Гольджи сети в созревающие эндосомы
• В аппарате Гольджи к растворимым ферментам, предназначенным для лизосом, ковалентно присоединяется манноза-6-фосфат. Из транс-Гольджи сети эти ферменты выходят на путь эндоцитоза при участии рецептора манноза-6-фосфата
• Белки лизосомальных мембран транспортируются из транс-Гольджи сети в созревающие эндосомы, однако для этого используются другие сигналы, чем для растворимых ферментов лизосом
Так же как и другие белки, предназначенные для перемещения по механизму эндо- и экзоцитоза, белки лизосом синтезируются в ЭПР. Растворимые ферменты деградации и трансмембранные белки лизосом транспортируются из ЭПР через аппарат Гольджи в транс-Гольджи сеть, где они отделяются от белков клеточной поверхности и от белков другой внутриклеточной локализации.
В клетках млекопитающих для сортировки растворимых ферментов лизосом в транс-Гольджи сети необходим сигнал, отличающийся от сигналов сортировки цитоплазматических белков, которые рассматривались до сих пор. В данном случае сигнал лизосомальной сортировки называется маннозо-6-фосфатный сигнал (М-6-Ф). Он образуется в люмене при модификации олигосахаридов, ковалентно присоединенных к лизосомаль-ным ферментам.
Этот сигнал был обнаружен при изучении некоторых заболеваний, связанных с нарушениями функционирования лизосом, например при болезни 1-клеток (также называемой муколипидоз II типа). В лизосомах больных, страдающих этим заболеванием, отсутствуют необходимые ферменты, и вместо поступления в лизосомы ферменты экскретируются во внеклеточное пространство.
Поэтому в лизосомах накапливаются непереваренные белки, образующие характерные внутриклеточные включения (называемые «I» при болезни 1-клеток). Аналогичные включения обнаруживаются и при других болезнях накопления, например при болезни Тей-Сакса, при которой в клетке отсутствует фермент гексозаминидаза А.
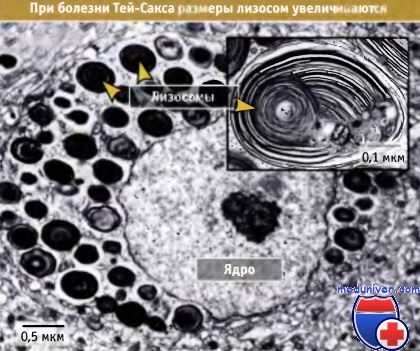
Нейрон головного мозга пациента с болезнью Тей-Сакса.
Отмечается много аномальных лизосом, одна из которых показана при большом увеличении.
Сигнал М-6-Ф образуется в результате фосфорилирования N-терминального маннозного остатка. Как показано на рисунке ниже, N-ацетилглюкозаминфосфат (G1cNAc-P) добавляется к С-6-гидроксильной группе избранного терминального маннозного остатка при участии фермента фосфотрансферазы (при болезни 1-клеток большинство ферментов лизосом не получают М-6-Ф сигнала, поскольку фосфотрансфераза у них отсутствует). Скорее всего, остаток G1cNAc-P добавляется на ранних этапах нахождения белка в аппарате Гольджи.
Затем специальный фермент, который присутствует в транс-Гольджи сети, удаляет остаток G1cNAc, открывая группу М-6-Ф. Таким образом, сигнал сортировки появляется только тогда, когда начинается сам процесс сортировки.
Конечно, для многих белков, транспортируемых по механизму экзоцитоза, характерно присутствие олигосахаридов с высоким содержанием маннозы, причем эти белки не являются ферментами лизосом. Поэтому, наряду с М-6-Ф сигналом сортировки, также должна существовать другая информация, специфичная только для лизосомальных ферментов. Эта информация не заложена в линейной последовательности аминокислот, как в случае многих других сигналов сортировки, а находится в определенном участке молекулы лизосомального фермента.
Вначале, до модификации олигосахаридного остатка, фосфотрансфераза должна узнать этот участок.
М-6-Ф сигнал сортировки узнается рецепторами М-6-Ф (существует два типа этих рецепторов), которые локализованы в транс-Гольджи сети. Цитоплазматические участки обоих типов рецепторов содержат сигналы сортировки, обеспечивающие транспорт в эндосомы. Один из них представляет собой тирозиновый сигнал, он может узнаваться АР-1 клатриновым адаптерным комплексом, расположенным в транс-Гольджи сети.
Другой сигнал, расположенный на цитоплазматической части М-6-Ф рецептора, содержит два остатка лейцина, находящихся в окружении кислых аминокислот. Этот сигнал отличается от таких же сигналов, обеспечивающих захват белков с клеточной поверхности, и взаимодействует с GGA-белком.
GGA относится к семейству белков, названных так потому, что они локализуются в аппарате Гольджи, содержат последовательности гомологичные дополнительному домену у-адаптина, и связываются с фактором АДФ-рибозилирования. Предполагается, что белки GGA являются упаковочными молекулами, которые помогают загружать М-6-Ф-рецепторы, связанные с лизосомальными ферментами, в клатриновые везикулы, отпочковывающиеся от транс-Гольджи сети. По-видимому, GGA передают М-6-Ф-рецептор и клатрин на комплекс АР-1, присутствующий в образовавшейся везикуле.
Как показано на рисунке ниже, образующиеся в транс-Гольджи сети клатриновые везикулы, вероятно, направляются в поздние эндосомы, где происходит диссоциация М-6-Ф-рецептора и связанного с ним фермента, подобно тому, как это осуществляется для комплекса рецептор-лиганд при эндоцитозе. Доставка фермента из транс-Гольджи сети в ранние эндосомы также может происходить более редким путем — через клеточную поверхность. Эндосомы обладают более кислой средой, чем транс-Гольджи сеть, и при кислых pH ферменты отщепляются от М-6-Ф-рецеп-торов, что приводит к накоплению свободных ферментов в люмене эндосом.
Затем М-6-Ф-рецепторы рециклируют из эндосом в транс-Гольджи сеть и повторно участвуют в транспортном процессе. При рециклировании используется другой адаптерный белок, TIP47, который узнает другой сигнал сортировки (содержащий фенилаланин/триптофан или остатки гидрофобных аминокислот) в цитоплазматическом участке М-6-Ф-рецептора. TIP47 отличается от других известных адаптеров тем, что он концентрирует в образующихся везикулах, которые возвращают М-6-Ф-рецепторы в транс-Гольджи сеть, белок Rab9. Rab9 участвует в дальнейшем адресовании этих везикул.
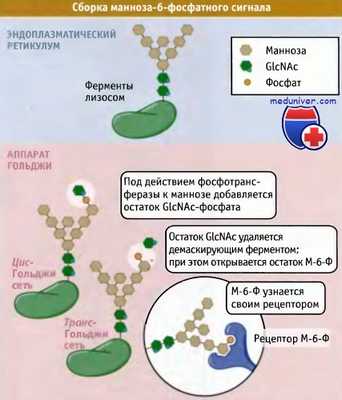
Сборка молекул сигнала сортировки с участием манноза-6-фосфатного рецептора.
Олигосахариды с высоким содержанием маннозы, связанные с ферментами лизосом,
подвергаются модификации в ранних цистернах аппарата Гольджи при добавлении к ним N-ацетилглюкозамин фосфата.
Остаток N-ацетилглюкозамина удаляется в последней из цистерн Гольджи.
При этом демаскируется остаток манноза-6-фосфата, который узнается рецепторами М-6-Ф.
Транспорт растворимых лизосомальных ферментов в эндосомы по механизму экзоцитоза представляет собой часть обычного процесса их созревания. Пока лизосомальные ферменты не достигнут конечного места назначения, они защищены от воздействия ферментов деградации. Существуют, по крайней мере, три механизма, которые обеспечивают активность ферментов только в определенных компартментах:
• Лизосомальные ферменты не проявляют активности при pH, характерном для ЭПР и аппарата Гольджи, и активируются только при кислых значениях pH, свойственных эндосомам и лизосомам. Таким образом, кислое значение pH в эндосомах не только благоприятствует диссоциации М-6-Ф-рецепторов, но и существенно для активации фермента.
• Некоторые лизосомальные ферменты образуются в ЭПР в виде проферментов, в N-терминальной области которых находится короткая последовательность, ингибирующая их активность. Ингибирование сохраняется до тех пор, пока последовательность не отщепится в эндосомах. Нередко отщепление носит «аутокаталитический» характер, т. е. определенная протеаза активируется самостоятельно, при достижении органеллы с достаточно низкой величиной pH.
• Некоторые активирующие ферменты представляют собой фосфатазы, которые расщепляют М-6-Ф-сигналы сортировки. Удаление этих сигналов помогает ограничить выход в транс-Гольджи сеть активных ферментов лизосом за счет предотвращения их связывания с рециклирующими М-6-Ф-рецепторами. Все эти события созревания начинаются на уровне поздних эндосом, при вступлении фермента на путь эндоцитоза. При последующем продвижении ферментов в лизосомы скорость протекания и эффективность этих событий увеличиваются.
Начиная от ранних эндосом и до лизосом происходит постепенное снижение величины pH: от 6,5-6,8 до 4,5-5,0. Поскольку для большинства лизосомальных ферментов оптимальное значение pH составляет < 5, то по мере продвижения по пути эндоцитоза они постепенно увеличивают активность.
Резидентные белки мембран лизосом, например лизосомальные гликопротеины (lgps) и лизосомальные мембранные белки (lamps), транспортируются из транс-Гольджи сети по механизму, независимому от М-6-Ф.
В цитоплазматическом домене этих белков присутствуют тирозин-содержащие сигналы, которые определяют их взаимодействие с одним или несколькими адаптерными комплексами (АР-1 или АР-3) или с GGA-белками. В эндосомы эти белки доставляются из транс-Гольджи сети, вероятно, посредством клатриновых везикул, и накапливаются в лизосомах. В отличие от М-6-Ф-рецепторов они не рециклируют в транс-Гольджи сети, поскольку, вероятно, не способны реагировать с TIP47. Хотя большинство мембранных белков подвергаются в лизосомах деградации, белки lgp и lamp устойчивы к протеолизу.
Они содержат много гликозильных групп, и считается, что последние либо образуют некое защитное покрытие, либо обладают плотной упаковкой, которая обеспечивает устойчивость к ферментам.
Сортировка лизосомальных белков у дрожжей и в клетках млекопитающих происходит различным образом. У дрожжей органеллы, эквивалентные лизосомам, называются вакуоли. В них также содержится набор растворимых гидролитических ферментов, которые поступают туда с участием мембранных рецепторов. Однако транспорт из транс-Гольджи сети в вакуоли не требует узнавания маркера М-6-Ф и происходит без участия М-6-Ф рецепторов, для которых у дрожжей не существует гомологов. Природа сигналов, которые обеспечивают адресование растворимых ферментов в дрожжевые вакуоли, неизвестна, однако не исключено, что ферменты связываются с рецептором на мембране.
Генетический анализ позволяет предполагать, что этот рецептор может взаимодействовать с GGA-белками, что свидетельствует о консерватизме, свойственном стратегии сортировки. Подобно белкам мембран лизосом у животных, транспорт белков мембран вакуолей из аппарата Гольджи происходит у дрожжей с участием клатриновых адаптеров (например АР-3). Однако у дрожжей АР-3 может взаимодействовать с сигналом, содержащим остатки двух лейцинов, а не тирозина.
При образовании в транс-Гольджи сети везикул, покрытых клатрином,
GGA может переносить рецепторы манноза-6-фосфата и клатрин на АР-1 адаптерные комплексы. Манноза-6-фосфатный сигнал сортировки используется для транспорта ферментов лизосом из транс-Гольджи сети на путь эндоцитоза.
Основной путь представляет собой прямой перенос из транс-Гольджи сети в поздние эндосомы.
Существует также дополнительный путь через клеточную поверхность.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сортировка белка в поляризованных клетках эпителия
Механизм созревания эндосом и их превращения в лизосомы
• Транспорт метаболитов от ранних эндосом в поздние эндосомы и лизосомы происходит за счет «созревания»
• Белковые комплексы ESCRT участвуют в сортировке белков в везикулы, которые отпочковываются в люмен эндосом, образуя мультивезикулярные тела, обеспечивающие процесс протеолитической деградации
Превращение ранних эндосом в поздние эндосомы и в лизосомы происходит в ходе процесса созревания, который, по крайней мере, на первый взгляд напоминает созревание цистерн аппарата Гольджи. Вероятно, транспортные везикулы не играют существенной роли в движении белков между эндосомами.
Вместо этого потеря рецепторов за счет их возврата в плазматическую мембрану превращает ранние эндосомы в поздние эндосомы, содержащие диссоциированные лиганды, такие как ЛНП. Транспортные везикулы, содержащие вновь синтезированные ферменты лизосом и мембранные компоненты, происходят из транс-Гольджи сети и сливаются с поздними эндосомами. В ходе этого процесса поздние эндосомы превращаются в лизосомы, и происходит переваривание диссоциированных лигандов.
Образование цилиндрических отростков рециклизации ведет к селективному и постепенному удалению рецепторов из ранних эндосом. Остальные компоненты остаются в везикулярной части ранней эндосомы, которая перемещается в центр клетки вдоль микротрубочек. В конце концов везикулы накапливаются в перинуклеарной части цитоплазмы, примыкающей к центру организации микротрубочек. Одна из причин такого движения везикул заключается в необходимости ограничить их дальнейшее слияние с новыми клатриновыми везикулами, которые отпочковываются от плазматической мембраны.
Однако их слияние с везикулами, которые содержат лизосомальные компоненты и произошли из транс-Гольджи сети, может продолжаться. Таким образом, органеллы, принимающие участие в эндоцитозе, постепенно становятся более «лизосомоподобными» по составу содержащихся в них ферментов, Н+-ионов и мембранных компонентов, таких как v-АТФазы. Это превращение происходит постепенно, с образованием поздних эндосом как промежуточных структур между ранними эндосомами и лизосомами.
Характерная особенность процесса созревания ранних эндосом заключается в образовании мультивезикулярных тел (МВТ). В компартментах, принимающих участие на поздних этапах эндоцитоза (поздние эндосомы и лизосомы), часто присутствуют небольшие везикулярные включения, которые образуются в результате инвагинации мембраны. Таким образом, нередко поздние эндосомы и лизосомы называют МВТ. Функциональная роль этих структур особенно отчетливо проявляется в случае семейства рецепторов тирозинкиназ, например инсулинового рецептора и рецептора эпидермального фактора роста (ЭФР), которые после захвата лиганда деградируют.
Например, десенситизация ЭФР-рецептора происходит потому, что после попадания в ранние эндосомы рецептор селективно включается в участки мембран, которые находятся внутри эндосомы. Мембраны внутренних везикул по своим свойствам отличаются от мембран, ограничивающих эндосомы, и таким образом, рецепторы не попадают в цилиндрические отростки для последующего рециклирования. Вместо этого, совместно с диссоциированными лигандами и другим содержимым ранних эндосом, они поступают в поздние эндосомы и лизосомы, где внутренние везикулы вместе с накопленными рецепторами деградируют под действием липаз (ферментов, разрушающих липиды) и протеаз.
Исследования, проведенные на мутантах дрожжей, дефектных по образованию МВТ, позволили выяснить механизм их образования и отбора белков для мембран внутренних везикул. По-видимому, аналогичный механизм существует и для клеток млекопитающих. Характерной его чертой является метка подлежащих десенситизации рецепторов с помощью ковалентного присоединения к ним убиквитина, небольшого белка, присутствующего в цитоплазме. Молекула убиквитина присоединяется к рецептору с помощью специфических лигаз. Одна из таких лигаз представлена белком Cbl, который кодируется протоонкогеном и содержится в цитозоле. Этот белок катализирует присоединение одного убиквитина к рецептору ЭФР.
Дефект в белке Cbl приводит к нарушению процесса десенситизации ЭФР-рецептора и к неконтролируемому росту клеток. Эти моноубиквитинированные белки узнаются комплексом специальных белков, который обеспечивает их селективный захват во внутренние везикулы, а также участвует в образовании самих везикул. Поскольку эти события начинаются на уровне ранних эндосом, образование МВТ служит этапом на пути созревания ранних эндосом в поздние эндосомы и лизосомы. Исследования образования МВТ у дрожжей и в клетках животных показали, что один из белков цитозоля (Hrs) узнает остатки убиквитина и активирует три дополнительных набора белков, которые называются комплексами ESCRT. Эти комплексы удаляют убиквитин, обеспечивая его последующее использование, и, что более важно, способствуют образованию инвагинирующей внутрь мембранной везикулы с карго, с которого снят убиквинтин.
Важно отметить, что направленность формирования везикул при образовании МВТ имеет противоположный характер, по сравнению с направленностью всех известных на сегодня событий мембранного перемещения. Это объясняется тем, что целью образования МВТ служит выведение отобранных мембранных компонентов из транспортного пути, гарантирующее их последующее переваривание в лизосомах.
По мере созревания ранних эндосом в поздние,
транспортные везикулы доставляют к ним компоненты и рециклируют из них рецепторы. Деградация белков с участием убиквитина происходит в мультивезикулярных тельцах,
представляющих собой поздние эндосомальные компартменты на пути эндоцитоза.
• В поляризованных клетках плазматическая мембрана состоит из отдельных доменов со специфическими наборами белков, и поэтому в этих клетках происходит дополнительная сортировка белков
• В зависимости от типа клеток, сортировка белков поверхности в поляризованных клетках может происходить в транс-Гольджи сети, эндосомах или в одном из доменов плазматической мембраны
• Процесс сортировки белков в поляризованных клетках происходит при участии специальных адаптерных комплексов, а также, вероятно, липидных рафтов (микродоменов) и лектинов
Плазматические мембраны большинства клеток многоклеточных организмов состоят из множества отдельных доменов, расположенных в непрерывном липидном бислое и различающихся между собой по биохимическим, структурным и функциональным характеристикам. Такие клетки считаются «поляризованными». Наиболее типичными примерами таких клеток являются эпителиальные клетки и нейроны.
Эпителиальные клетки выстилают все полости тела (например, кишечник, почки, воздухоносные пути) и, таким образом, обладают двумя поверхностями. Апикальный домен обращен в люмен органа, а базолатеральный граничит с кровью или с примыкающими клетками.
В эпителиальных клетках, специализированных на поглощении питательных веществ (например, клетки эпителия кишечника), на плазматической мембране апикального домена существуют небольшие выросты, которые называются микроворсинки. Они увеличивают общую поверхность клетки, что способствует увеличению поглощения ею питательных веществ.
Апикальная плазматическая мембрана в таких клетках обогащена мембранными белками, которые способствуют захвату клеткой таких питательных компонентов, как аминокислоты, сахара и другие молекулы. Также мембрана богата уникальными гликолипидами.
Напротив, базолатеральный домен содержит большинство мембранных белков (например, ЛНП-рецептор и ЭФР-рецептор) и липидов, находящихся в плазматической мембране неполяризованных клеток. Наряду с этим, переносчики, находящиеся в базолатеральном домене, транспортируют питательные компоненты из клетки в плазму крови.
Межклеточные контактные комплексы, состоящие из плотных контактов, адгезивных контактов и десмосом, разграничивают апикальные и базолатеральные домены. Одна из функций этих комплексов состоит в том, чтобы предотвратить возможность латеральной диффузии компонентов апикальной мембраны в базолатеральный домен, и наоборот.
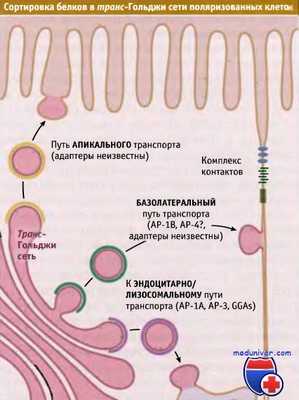
Три типа сортировки, происходящего в транс-Гольджи сети поляризованных клеток эпителия.
Белки сортируются для эндоцитоза и для транспорта через апикальную и базолатеральную мембраны.
Для каждого пути используются свои адаптерные комплексы.
Поэтому липиды и белки должны направляться в соответствующий домен. Транспорт по секреторному механизму и по пути эндоцитоза носит поляризованный характер. Это обеспечивает движение компонентов апикальной и базолатеральной мембран в соответствующих направлениях. Транспорт в базолатеральный домен происходит под действием адресных сигналов, отличающихся от сигналов для апикального транспорта.
В зависимости от того, предназначены вновь образованные мембранные белки для апикальной или базолатеральной поверхности, в транс-Гольджи сети они сортируются по разным типам везикул. Для многих типов поляризованных эпителиальных клеток процесс базолатерального транспорта исследован хорошо. В цитоплазматических доменах большинства базолатеральных белков присутствуют сигналы, содержащие остаток тирозина или два остатка лейцина.
Эти остатки узнаются адаптерными комплексами таким же образом, как это происходит для белков, которые транспортируются по механизму эндоцитоза или направляются в лизосомы. Последовательности, содержащие и иногда не содержащие остатки тирозина, узнаются в транс-Гольджи сети с участием АР-1В, специфичной для эпителиальных клеток изоформы клатринового адаптерного комплекса АР-1. АР-1В связывается с клатрином, образуя транспортную везикулу, ориентированную в базолатеральном направлении. Этот комплекс отличается от широко распространенного комплекса АР-1А только структурой μ-цепи. Субъединицы μ1А и μ1В обладают на 80% одинаковой структурой, однако связывают разные типы сигналов. Причина этих различий не установлена.
Цитоплазматические домены белков, предназначенных для апикальной плазматической мембраны, не содержат специфических сигналов. Вместо этого в домене люмена они содержат критические N- или О-сахарные остатки или имеют особый тип мембранного якорного домена, обеспечивающего их включение в апикально направляющиеся транспортные везикулы. Одним из примеров такого мембранного якоря является GPI, который добавляется к некоторым белкам в эндоплазматическом ретикулуме. Такие везикулы, транспортируемые в апикальном направлении, часто содержат уникальный липидный микродомен, называемый липидный рафт, который накапливает специфические белки, обеспечивая, таким образом, их селективное включение в апикальные везикулы.
Вероятно, этот же механизм в определенной степени позволяет разделять липиды, так что сложные гликолипиды, обнаруженные на апикальной, но не на базолатеральной поверхности эпителиальных клеток, также селективно включаются в эти везикулы.
Для некоторых мембранных белков, в которых отсутствует информация об адресе и которые транспортируются из транс-Гольджи сети и в апикальных, и базолатеральных везикулах, существует третий тип поляризованного адресования. Однако после попадания в плазматическую мембрану эти белки еще могут стать поляризованными. Это происходит в процессе домен-специфического удержания, при котором мембранный белок взаимодействует с предварительно поляризованным цитоскелетом.
Последний содержит белки, которые собираются на мембранных доменах в ответ, например, на такие сигналы, как прикрепление к другой клетке. Часто такой тип цитоскелета собирается в области межклеточных контактов, что обеспечивает асимметричность накопления мембранных белков. Мембранные белки, которые взаимодействуют с таким цитоскелетом, стабилизируются в соответствующем мембранном домене. Однако мембранные белки, попавшие в домен, который не обладает подходящим цитоскелетом, интернализируются путем эндоцитоза, деградируют в лизосомах, или рециклируют.
В последнем случае они получают еще одну возможность попасть в домен с соответствующим цитоскелетом.
Сортировка апикальных и базолатеральных белков также осуществляется в эндосомах. Поскольку эндоцитоз происходит как с апикальной, так и с базолатеральной поверхности эпителиальных клеток, интернализованные белки за счет рециклирования должны вернуться в те домены, из которых они вышли. Очевидно, ранние эндосомы могут вести себя как транс-Гольджи сеть, сортируя апикальные и базолатеральные белки в определенные везикулы рециклирования, которые направляются или к апикальной, или к базолатеральной мембране.
Фактически при сортировке по признаку поляризации в эндосомах используются те же сигналы, что и в транс-Гольджи сети. Чтобы при продолжающемся эндоцитозе эпителиальные клетки могли поддерживать полярность плазматической мембраны, необходимо поляризованное рециклирование содержимого эндосом. Фактически в эндосомах, и в частности, в рециклирующих эндосомах, может происходить биосинтетическая сортировка. Таким образом, в качестве промежуточных звеньев, на пути от транс-Гольджи сети к базолатеральной плазматической мембране, могут использоваться рециклирующие эндосомы. Это, вероятно, объясняет, почему оба пути используют один и тот же набор сигналов.
Эпителиально-мезенхимальный переход: молекулярная симфония для факторов транскрипции.

Когда я думаю об опухолевых клетках, то неизменно вспоминаю «Войну и мир»: мужественные командиры со своими солдатами, победные стратегии своих генералов и провальные походы противника (и наоборот), боевые подвиги и полное разорение, развороченное место недавнего боя и даже своеобразное метафоричное небо над Аустерлицем – не спешат больше бешено экспрессируемые белки на борьбу с диверсантами, защитные механизмы сдают оборону, а некоторые и вовсе переходят на сторону врага, и в звенящей от контузии тишине только мириады клеток разбредаются по организму, готовые создавать новые очаги, которые погубят его. Процесс перехода от мира к войне и наоборот это ведь тоже одна из форм пластичности, пластичности нашей жизни, переход от стабильного состояния к шаткому и неустойчивому, а затем закономерное возвращение к покою. Возможно, в этом и проявляются общие закономерности самой природы жизни, ведь к какому бы уровню организации живого мы ни обращались, всегда можно разглядеть общие фундаментальные идеи, указывающие на то, что все в этом мире взаимосвязано.
В части 1 мы с вами уже рассматривали основополагающие принципы, согласно которым протекает трансформация эпителиальных клеток в мезенхимальные. Обобщив, напомним себе, что как одна из форм эпителиальной пластичности, эпителиально-мезенхимальный переход (или трансформация, ЭМТ) включает в себя определенные изменения морфологии клеток эпителия, являющиеся отражением событий, происходящих на молекулярном уровне. Для эпителиальных клеток характерно наличие постоянных межклеточных контактов и адгезия с подлежащими клетками. Специализированные комплексы поверхностных белков эпителиоцитов формируют межклеточные контакты разных типов, благодаря чему поддерживается целостность эпителия. Все эти типы соединений клеток нам знакомы: субапикальные плотные контакты (tight junctions), адгезивные контакты (adherens junctions), десмосомы и хаотично разбросанные щелевые контакты (gap junctions) между латеральными поверхностями. Мезенхимальные же клетки, в отличие от эпителиальных, имеют непостоянную форму и не формируют подобных контактов друг с другом. Инициация ЭМТ влечет за собой разобщение вышеперечисленных соединений, поскольку задействованные в их формировании белки релокализуются либо подвергаются деградации. Разрывы плотных контактов в ходе ЭМТ сопровождаются снижением экспрессии клаудина и окклюдина, а также уменьшением количества белка zonula occludens 1 - ZO1 (белок плотных контактов, обозначается также как TJP1) в области межклеточных соединений. При дестабилизации адгезивных контактов Е-кадгерин подвергается разрушению в цитоплазматической мембране, что считается одним из решающих направляющих событий в развитии ЭМТ. Также экспрессия Е-кадгерина может быть снижена за счет метилирования промотора гена CDH1, мутаций или изменения обусловленной факторами транскрипции регуляции данного гена, ответственного за синтез Е-кадгерина, вследствие чего процесс транскрипции нарушается и синтезируемая мРНК обрывается. В итоге взаимодействие между Е-кадгерином и β-катенином, находящимся в цитоплазме и играющим роль проводника между трансмембранным кадгерином и актиновыми филаментами цитоскелета, более невозможно, и β-катенину грозит та же участь – разрушение. Однако он может избежать ее, например, если клетка реагирует на WNT-сигналинг, так как в этом случае β-катенин не фосфорилируется киназой гликогенсинтазы GSK-3β и локализуется в ядре, связываясь там с энхансерными факторами транскрипции TCF/LEF. Таким образом, вспоминая материал первой части, можно описать ЭМТ как процесс, в ходе которого полярные фиксированные эпителиальные клетки трансдифференцируются, приобретая характеристики подвижных мезенхимальных клеток.
- Незрелые клетки эпителиального фенотипа, которые превращаются в мезенхимальные, из которых потом формируются клетки эпителия в участках, согласно программе гаструляции и миграции клеток нервного гребня.
- эпителиальные/эндотелиальные клетки заполняют интерстициальные пространства фибробластными клетками.
- ЭМТ как часть метастатического процесса при опухолевой прогрессии, когда эпителиальные клетки покидают первичный очаг, мигрируют и реконструируются во вторичную ткань.
Поддержание ЭМТ осуществляется за счет того, что экспрессия контактных белков транскрипционно снижается. Кроме того, в клетках позвоночных были обнаружены важные белковые комплексы – PAR (включает PAR6, PAR3 и атипичную протеинкиназу С – aPKC) и Crumbs-комплекс (представляет собой белок CRB, ассоциированный с Lin‑7 1 (PALS1) и связанным с ним белком плотных контактов – PATJ), расположенные в апикальной части и определяющие границы верхушечной области клетки за счет образования плотных контактов, а также Scribble-комплекс (включает в себя белки SCRIB, DLG и LGL), определяющий базолатеральный полюс клетки. Снижение экспрессии контактных белков препятствует взаимодействию данных белковых комплексов с мембранными структурами, как, например, подавление экспрессии Е-кадгерина становится причиной того, что SCRIB перестает связываться с базолатеральной мембраной, в результате чего клеточная подвижность только усиливается. Репрессия синтеза прочих белков полярности, как то CRB3 и LGL2, также вносит вклад в дестабилизацию эпителиального фенотипа. (см. Схему 3)
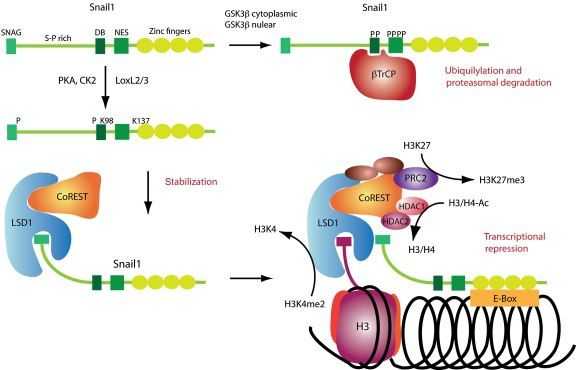
Схема 2.
Важно понимать, что в основе активации мезенхимального фенотипа лежит активность множества факторов транскрипции, которые изменяют генную экспрессию. В настоящем посте мы сконцентрируем внимание на основных регуляторах – транскрипционных факторах SNAIL, TWIST и ZEB – чья экспрессия активируется на самых ранних этапах ЭМТ. Вклад факторов транскрипции в развитие ЭМТ зависит от типа клеток и ткани, задействованных в реализации сигнальных каскадов, потенцирующих ЭМТ. Нередко регуляторы транскрипции оказывают взаимное влияние друг на друга и совершают кооперативную работу по воздействию на таргетные гены. Зачастую одни и те же факторы транскрипции отвечают как за репрессию генов эпителиальных клеток, так и за активацию генов, отвечающих за развитие мезенхимального фенотипа.
Среди транскрипционных факторов SNAIL в клетках позвоночных были идентифицированы SNAIL1 (SNAIL), SNAIL2 (SLUG) и SNAIL3 (Smuc), и все они являются непосредственными активаторами программы ЭМТ как во время физиологического развития организма, так и при фиброзе или опухолевых процессах. Экспрессия генов, обуславливающих основные морфо-функциональные свойства эпителиальных клеток, угнетается за счет связывания фактора транскрипции с мотивом цепи ДНК, называемым E‑box (5′-CANNTG-3′) и имеющимся в составе промоторов целевых генов, что возможно вследствие наличия в структуре транскрипционных факторов высококонсервативных доменов типа «цинкового пальца» на С-терминальном конце. Связываясь с участком E‑box в проксимальной области промотора гена Е-кадгерина, SNAIL1 рекрутирует белковый комплекс PRC2 и связывает его компоненты, благодаря наличию на N-терминальном конце эволюционно консервативного домена SNAG. В состав комплекса PRC2 входят метилтрансферазы гистонов (EZH2, G9a и SUV39H1), корепрессор SIN3A, гистоновые деацетилазы и лизин-специфическая деметилаза (LSD1). Как можно понять из названий, каждый из компонентов комплекса PRC2 направлен на координацию различных модификаций гистонов, в частности – метилирование и ацетилирование гистона H3 по 4-ому остатку лизина, 9-ому и 27-ому (H3K4, H3K9 и H3K27), причем метилирование одних участков препятствует транскрипции хроматина, тогда как ацетилирование этих же участков, напротив, является маркером доступности для осуществления транскрипции. Это крайне важный для понимания момент, поскольку промоторы генов, как и в случае гена Е-кадгерина, имеют обе метки сразу, – и метильную, и ацетильную – что позволяет своевременно активировать ген при поступлении активирующего сигнала и, в то же время, сохранять ген неактивным в отсутствие данного сигнала. Такой двойной контроль промотора гена Е-кадгерина, вероятно, является одой из причин обратимости ЭМТ. (см. Схему 2)
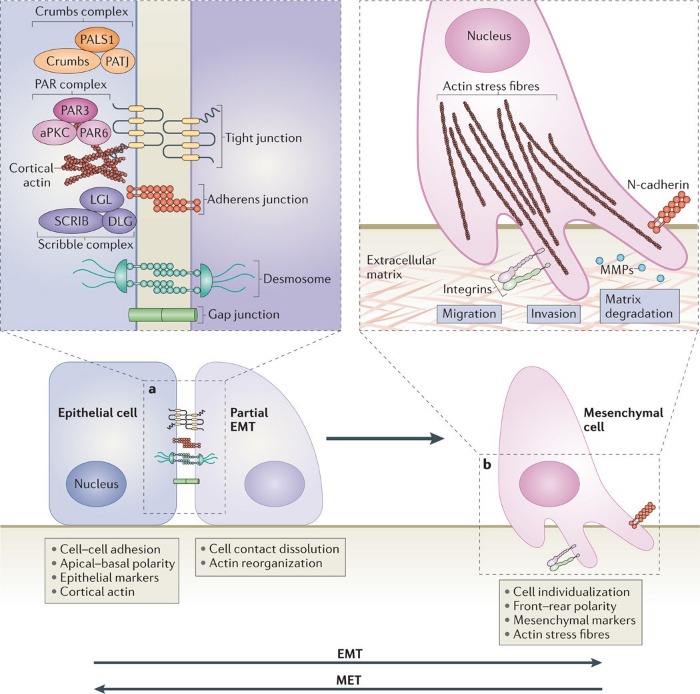
Схема 3.
Вспоминая содержание предыдущего поста, напомним себе, что запуск и поддержание ЭМТ становится возможным именно благодаря сигналам, исходящим из клеточного микроокружения, включая внеклеточный матрикс (коллаген, гиалуроновая кислота). Важную роль в регуляции ЭМТ играют разнообразные растворимые факторы, как, например, эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), фактор роста гепатоцитов (HGF), костные морфогенетические белки (BMPs), трансформирующий фактор роста бета (TGF-β), Notch, Wnt, фактор некроза опухоли альфа (TNF-α) и цитокины. Многие из перечисленных сигнальных молекул индуцируют и экспрессию транскрипционных факторов SNAIL, совершая тем самым еще больший вклад в эпителиально-мезенхимальную трансформацию. Например, рецепторные тирозинкиназы, активированные HGF, FGF или EGF, направляют сигналы по путям RAS-MAPK или PI3K-Akt, что в кооперации с деятельностью TGF-β ведет к активности SNAIL. При этом интересны взаимоотношения между TGF-β и SNAIL: изначально TGF-β индуцирует высокую экспрессию SNAIL, при этом SNAIL позволяет трансформирующимся злокачественным клеткам избегать супрессивного воздействия TGF-β (в частности, обеспечивает уклонение от TGF-β-опосредованного апоптоза), а на поздних стадиях и сам TGF-β становится перебежчиком на темную сторону и уже не подавляет развитие опухоли, а стимулирует ее прогрессию, побуждая активность SNAIL через Smad-зависимые пути.
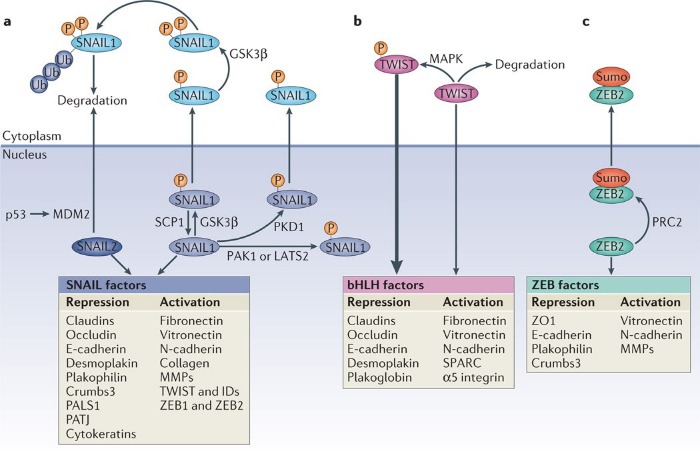
Белки, отвечающие за развитие эпителиального и мезенхимального фенотипа и их регуляция факторами транскрипции SNAIL, TWIST и ZEB в ходе ЭМТ.
В самом начале поста мы упоминали о взаимосвязи между сигнальным путем Wnt, репрессией гена Е-кадгерина и развитием ЭМТ. В этой взаимосвязи есть место и транскрипционным факторам SNAIL. Например, в клетках рака молочной железы каноничный путь Wnt запускает ЭМТ вследствие инициируемой экспрессии внутриклеточного белка Axin2, что стабилизирует уровень SNAIL, а потому, если исключить активность GSK-3β, то сигнальная передача от Wnt может становиться причиной индукции ЭМТ и последующего опухолевого метастазирования, поскольку активность β-катенина и SNAIL сохранится. Синергия в работе между SNAIL и β-катенином позволяет злокачественным клеткам выживать и распространяться также за счет того, что сигнал от Wnt, передаваемый через белки пути β-катенин/TCF4/Snail, приводит к ингибированию митохондриального дыхания, поскольку угнетается активность цитохромоксидазы COX, а также к гликолитическому переходу, так как клетка начинает усиленно потреблять глюкозу и продуцировать лактат.
Активации SNAIL зачастую вторит активность таких факторов транскрипции как ZEB, что нередко происходит под влиянием совместной деятельности SNAIL1 и TWIST1. Экспрессия ZEB точно так же повышается в ответ на сигналы TGF-β и Wnt, а также факторы роста, запускающие путь RAS-MAPK, что характерно и для регуляции SNAIL. В регуляции активности ZEB участвует и уже знакомый нам комплекс PRC2, который сумоилирует ZEB по окончании трансляции, что обуславливет локализацию данного фактора транскрипции в цитоплазме, в результате чего репрессия генов, вызванная ZEB, ослабевает.
Молекулярные основы эпителиально-мезенхимального перехода и его роль в развитии и метастазировании опухоли.

Случалось ли вам когда-нибудь желать себе обладания каким-нибудь сверхъестественным умением? Например, становиться невидимым или проходить сквозь стены? Думаю, многие не раз грезили в детстве о том, какие ловкие штуки могли бы проворачивать, будь у них какая-то эдакая способность, ставящая на порядок выше нашего мира, подчинённого обыденным устоям и правилам. Вероятно, клетки нашего организма тоже не все хотят быть такими же, как большинство, и при определённых обстоятельствах обзаводятся новыми способностями, действительно отличающими их от остальных. Но чем может обернуться такая эгоистичность для целого организма? Как вариант — зарождением опухолевого очага и стремительным распространением клеток, которые уж точно больше не серая масса, а целая гетерогенная популяция, настоящие бунтари, лишённые альтруизма и любви к своим собратьям по организму. И в сегодняшнем посте речь поведём именно о том, каким образом клетки одного типа могут принимать иную форму и какое место это событие занимает в развитии и распространении опухоли.
Под эпителиально-мезенхимальной трансформацией (ЭМТ) понимается процесс, при котором покоящиеся эпителиальные клетки теряют свои межклеточные контакты и принимают мезенхимальную форму. Они приобретают способность к миграции через базальную мембрану, а значит, могут по кровеносному или лимфатическому руслу попасть в любые сколь угодно отдалённые от своего исходного местонахождения ткани, где путём обратной трансформации в эпителиальные клетки (мезенхимально-эпителиальный переход) формируют новые структуры. Физиологически этот процесс играет значимую роль при заживлении ран и в ходе эмбрионального развития организма. Так, например, ЭМТ лежит в основе формирования сердца, закладки большинства краниофациальных структур, а также скелетных мышц и периферической нервной системы. Да и вообще, ни один организм не разовьётся дальше стадии бластулы, не будь эпителиально-мезенхимального перехода. Однако в то же время данное явление находит своё место и в контексте патологической физиологии. ЭМТ способствует прогрессии опухолевых заболеваний за счёт того, что озлокачествленные эпителиальные клетки получают способность к проникновению в сосудистое русло, то есть, им открывается прямой путь к метастазированию. Также эпителиальные клетки, претерпев ЭМТ, могут быть задействованы в фибротических процессах: чрезмерная продукция белков внеклеточного матрикса фибробластоидными клетками может вести к функциональным нарушениям той или иной ткани.
Хотя уже в конце XIX в. эпителиальные и мезенхимальные клетки были известны как два основных типа клеток, а процесс перехода между этими двумя типами был описан в 1908 г., эпителиально-мезенхимальный переход как таковой был идентифицирован как самостоятельный процесс впервые лишь в 1982 г. Вскоре после этого было обнаружено, что если инкубировать эпителиальные клетки в среде, в которой были культивированы фибробласты, то эпителиоциты разобщаются и превращаются в мигрирующие мезенхимальные клетки. Поначалу фактор, определённый как ответственный за данную трансформацию, получил обозначение “scatter factor”, а позднее был назван фактором роста гепатоцитов (HGF), поскольку была обнаружена его роль в качестве митогена для клеток ткани печени, участвующего в регенерации печени. В экспериментах in vitro было указано на то, что HGF опосредует ЭМТ посредством активации тирозинкиназных рецепторов c-Met, кодируемых протоонкогеном. Помимо HGF и другие факторы роста осуществляют вклад в индукцию ЭМТ путём стимуляции тирозинкиназных рецепторов (как in vitro, так и in vivo), как, например, фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF), эпителиальный фактор роста (EGF). Кроме того, большое значение придаётся трансформирующему фактору роста бета (TGF-β), который берёт на себя ключевую роль в инициации и поддержании ЭМТ как в процессе эмбрионального развития, так и при опухолевой прогрессии. Часто перечисленные факторы действуют синергетически, усиливая эпителиально-мезенхимальный переход.
Характеристика пусковых факторов и вовлечённых сигнальных путей имеет огромное значение, поскольку трансформационный процесс рассматривается непосредственно как терапевтическая мишень в контексте разработки лекарственных препаратов, направленных на борьбу с фиброзами и инвазивными опухолями. Целесообразным было бы ингибировать и пути сигнальной передачи, которые наряду с ЭМТ способствуют также ангиогенезу.
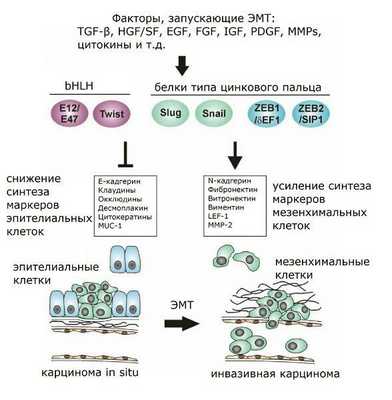
Рисунок 1 | Факторы, запускающие ЭМТ.
Итак, в ходе ЭМТ эпителиальные клетки теряют свою апикобазальную полярность и приобретают фибробластоподобный фенотип. Вследствие потери контактов с соседними клетками эпителиоциты высвобождаются из системы межклеточных связей в организованной эпителиальной ткани. После реструктуризации актинового цитоскелета клетки могут мигрировать через экстрацеллюлярный матрикс, что опосредовано тем, что на этой стадии клетки в состоянии синтезировать характерные мезенхимальные белки, дающие возможность устанавливать клеточно-матриксные связи. Также клетки вырабатывают матриксдеградирующие протеазы, разрушающие базальную мембрану и облегчающие тем самым инвазию трансформированных клеток в кровеносное и лимфатическое русло. Давайте остановимся теперь на каждом пункте чуть подробнее.
Плотные контакты (tight junctions), связывающие клетки в эпителиальных тканях, служат для поддержания целостности ткани, обеспечивают взаимодействие клеток друг с другом, а также выполняют барьерную функцию, принимая участие в регуляции проницаемости эпителия путём ограничения парацеллюлярного транспорта, и придают клеткам полярность благодаря своей организации преимущественно в апикальной области (zona occludens). Формируются плотные контакты за счёт трансмембранных белков окклюдинов и клаудинов, которые связываются с актиновым цитоскелетом через внутриклеточные белки, как например, ZO-1 (zona occludens protein 1). Адгезионные контакты (adherens junctions) представляют собой гомодимерные межклеточные контакты, характеризующиеся связью через классические кадгерины (находятся в зависимости от ионов кальция; типичные примеры — Е-кадгерин, N-кадгерин). Пронизывающие мембрану кадгерины связаны, опять же, с внутренней стороны с цитоскелетом посредством бета- и альфа-катенинов и винкулина или плакоглобина. Десмосомы, распределяющие силы напряжения по всему объёму ткани, противостоят разрывам и смещениям, то есть, важны для стабилизации ткани. Десмосомы соседних клеток связаны друг с другом за счёт трансмембранных десмосомальных кадгеринов (десмоколлины и десмоглеины), а также скреплены с кератиновыми волокнами с помощью цитоплазматических партнёров — плакоглобина и десмоплакина. Десмосомы и адгезионные контакты классификационно причисляются к заякоривающим соединениям, а плотные контакты — к запирающим.
Таким образом, при утрате того или иного соединения какой-либо клетки с окружающими содержание соответствующих контактных белков резко снижено. По этой причине эти белки годятся для трансформационного статуса эпителиальных клеток. Например, в качестве маркеров ЭМТ нередко используются многие из уже упомянутых белков — ZO-1, бета-катенин, Е-кадгерин, а также цитокератин. Снижение экспрессии или функциональной активности Е-кадгерина является крайне важной информацией о развитии опухоли, поскольку наблюдается в канцерогенезе множества злокачественных опухолей и связано с индукцией ЭМТ, а потому представляется и весьма существенным признаком инвазивного роста опухоли. Ослабление адгезионных контактов осуществляется как путём передислокации Е-кадгерина из цитоплазматической мембраны в цитоплазму, так и опосредованно через генетическую регуляцию. Белки типа цинкового пальца Snail и Slug препятствуют транскрипции Е-кадгерина, зацепляясь на специальном сайте связывания промотора гена Е-кадгерина (Е-бокс, Enhancer Box). Также Snail и Slug регулируют активацию TGF-β через Smad3. Кроме того, FGF и HGF оказывают влияние на межклеточные контакты через активирование Slug. Slug (но не Snail) принимает участие и в ЭМТ-ассоциированном заживлении ран, что совпадает с данными по различиям экспрессии гена Slug, полученными в исследованиях культуры иммортализованных нетуморогенных кератиноцитов линии НаСаТ и линии человеческих эпителиоцитов почек НК-2: если в культуре НаСаТ TGF-β индуцировал синтез только Slug, то в ренальных эпителиоцитах контроль был сосредоточен именно на белке Snail.
Среди прочих факторов, оказывающих влияние на экспрессию Е-кадгерина, хотелось бы упомянуть EF1 (энхансер-связывающий фактор гамма-кристаллина), SIP1, c-Fos. EF1 и SIP1 могут управлять как транскрипцией генов белков Smad, так и, аналогично белкам Snail и Slug, напрямую взаимодействовать с промотором гена Е-кадгерина и, блокируя экспрессию Е-кадгерина, провоцировать развитие инвазивного фенотипа клетки. Эктопическая экспрессия c-Fos, например, в эпителии молочной железы, может вести к трансформации. Вообще, при кратковременной активации c-Fos потеря апикально-базальной полярности могла бы быть обратима, однако в этом случае аутокринное воздействие продуцируемого TGF-β становится инструментом поддержания ЭМТ. Так, в клетках линии НаСаТ к началу ЭМТ наблюдалась опосредованная через ERK (extracellular signal-regulated kinases) стимуляция трансформирующим фактором роста бета эктопической активности c-Fos.
Также с промотором гена Е-кадгерина способен связываться белок семейства bHLH (basic helix-loop-helix) E2A. В норме Е2А транскрипционно неактивен и представлен в виде димеров с белками ингибиторами дифференцировки (ID). В культивируемых на микроносителях эпителиальных клетках ID2 и ID3 оказываются целью воздействия TGF-β и ВМР7 (bone morphogenetic protein 7, костный морфогенетический белок): TGF-β сдерживает экспрессию ID2, вследствие чего активируется Е2А, который снижает транскрипцию гена Е-кадгерина; а ВМР7 проявляет себя антагонистически, повышая экспрессию ID2 и защищая тем самым эпителиальные клетки от трансформирующих влияний.
Важным регулятором ЭМТ как in vitro, так и in vivo проявил себя также относящийся к белкам bHLH фактор транскрипции Twist, эктопическая экспрессия которого становится причиной снижения транскрипции опять же Е-кадгерина, альфа-, бета- и гамма-катенинов. Также Twist способствует активности таких мезенхимальных маркеров, как фибронектин, виментин, альфа-гладкомышечный актин (alpha-SMA), N-кадгерин. А некоторые прочие факторы транскрипции, кроме регуляции прочности адгезионных контактов, оказывают влияние и на другие характеристики ЭМТ. Так, ID2 может препятствовать синтезу alpha-SMA; SIP1 регулирует экспрессию виментина, а в некоторых типах клеток наряду с белком Snail повышает экспрессию матриксной металлопротеиназы 2 (ММР-2); Snail может влиять на ряд существенных для ЭМТ генов (было обнаружено в клетках меланомы), среди которых гены ММР-2 и малых G-белков семейства Rho (RhoA).
Разобравшись с потерей межклеточных контактов, обратимся к тому, в чём же заключается реструктуризация цитоскелета. Для эпителиальных клеток в связи с их полярностью характерен так называемый пояс актина, волокна которого участвуют в создании адгезионных и плотных контактов, являя собой мощное дополнение периферическому актину, также задействованному в поддержании межклеточных соединений. В мезенхимальных клетках актин, напротив, представлен в виде филоподий (толстые пучки актина, цилиндроподобно вытянутые в сторону передвижения клетки), ламеллоподий (тонкие сети на переднем конце клетки, инициирующие движение клетки вперёд; придают клеточной мембране характерный внешний вид) и стрессовых волокон (пучки коротких актиновых филаментов с добавлением миозиновых филаментов; простираются параллельно продольной оси тела клетки и, сокращаясь, тоже продвигают клетку вперёд), которые поддерживают миграцию клеток. Актиновые стрессовые волокна связаны со внутренней поверхностью цитоплазматической мембраны посредством интегринов и фокальных адгезионных комплексов, имеющих в своём составе структурные белки (талин, винкулин, альфа-актинин) и некоторые протеинкиназы (например, FAK — киназа фокальных контактов). Полимеризация актина находится под контролем белков семейства Rho, куда относятся, к примеру, Rho, Rac и Cdc42, которые, приобретая активированную форму, инициируют образование как актиновых стрессовых волокон, так и адгезионных комплексов: Rac опосредует формирование ламеллоподий, Cdc42 принимает участие в образовании филоподий. Таким образом, при запуске ЭМТ белки семейства Rho представляют собой наиважнейшие целевые структуры для влияния TGF-β.
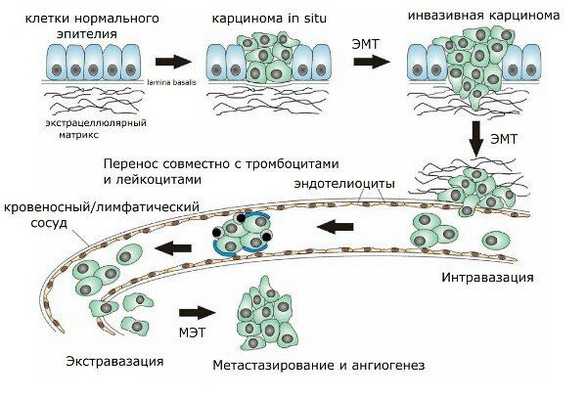
Рисунок 2 | Этапы метастазирования.
После того, как произошло переформирование внутриклеточных актиновых структур, клетка может приступать к миграции сквозь джунгли внеклеточного матрикса. Для этого ей необходимо умение образовывать новые контакты между собственными интегринами и белками матрикса. Интегрины оснащены специальными участками для связывания с матриксными белками, и благодаря RGD-последовательности интегрины распознают белки матрикса. Кроме чисто механического связывания, трансмембранные интегрины могут подвергаться контролю по типу inside-out-signalling: например, внутриклеточные киназы, связываясь с внутриклеточными участками интегринов, могут изменять их внеклеточные участки для связывания с лигандами. Но и наоборот, связывание интегринов с лигандами ведёт к внутриклеточному каскаду взаимодействий, следствием которого может быть активация FAK или белков Rho.
Ещё одна важная черта, характеризующая нормальные эпителиальные клетки — связь с базальной пластинкой посредством гемидесмосом. В ходе эпителиально-мезенхимальной трансформации клетки эпителия отделяются от базальной пластинки и начинают разрушать коллаген IV, ламинин, нидоген, из которых она построена. Для этой цели клетки вырабатывают матриксные металлопротеиназы ММР-2 и ММР-9. Структура всех ММР во многом сходна. Поначалу все ММР синтезируются как неактивные предшественники — Pro-MMPs, которые затем активируются после ферментативного отщепления продомена (эти продомены почти у всех ММР представляют собой консервативные последовательности, в которых присутствует цистеин, ответственный за связывание цинка в активном центре протеазы; поэтому только в отсутствие продомена цинк беспрепятственно связывается с активным центром и активирует протеазу). Также ММР обладают субстратспецифичными связывающими мотивами, на чём основано их разделение на подгруппы.
После такого краткого пробега по основным этапам ЭМТ хотелось бы завершить пост и после прочтения предложить вам ознакомиться с замечательным переводом Медача, посвященным эпителиально-мезенхимальной пластичности и её роли как регулятора опухолевой прогрессии. Перевод читать тут: vk.cc/6AwriY
Читайте также:
