Сосудистые гастродуоденальные повреждения
Добавил пользователь Alex Обновлено: 27.01.2026
Цель: привлечь внимание к отсутствию рекомендаций по профилактике и лечению острых эрозивно-язвенных гастродуоденальных поражений (ОЭГП) и их осложнений, связанных с тяжестью состояния пациента, массивностью антиагрегантной и антикоагулянтной терапии и со степенью риска кровотечения.
Материалы и методы: проведён литературный обзор данных отечественных и зарубежных авторов, посвящённых проблеме патогенеза, клинических проявлений, диагностики, лечения и профилактики поражения верхних отделов желудочно-кишечного тракта при сердечно-сосудистых заболеваниях.
Результаты: нет стандартизированных рекомендаций по профилактике и лечению ОЭГП и их осложнений с учётом индивидуальных особенностей пациента, основанных на доказательных данных.
Заключение: необходимо разработать шкалу, оценивающую риск развития острых эрозивно-язвенных гастродуоденальных поражений и желудочно-кишечных кровотечений при сердечно-сосудистых заболеваниях, методы лечения и профилактики этих состояний с учётом конкретных параметров пациента.
Ключевые слова
Об авторах
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Полянцев Александр Александрович, д. м. н., профессор, зав. кафедрой общей хирургии с урологией, 400131, г. Волгоград, Россия
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Фролов Денис Владимирович, д. м. н., доцент кафедры общей хирургии с урологией, врач сердечно-сосудистый хирург, 400131, г. Волгоград, Россия
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Линченко Диана Владимировна, к. м. н., доцент кафедры общей хирургии с урологией, 400131, г. Волгоград, Россия
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Карпенко Светлана Николаевна, к. м. н., ассистент кафедры общей хирургии с урологией, 400131, г. Волгоград, Россия
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Черноволенко Андрей Андреевич, ассистент кафедры общей хирургии с урологией, 400131, г. Волгоград, Россия
ФГБОУ ВО «Волгоградский Государственный Медицинский Университет» МЗ РФ
Россия
Дьячкова Юлия Александровна, студентка 5 курса Лечебного факультета, 400131, г. Волгоград, Россия
Список литературы
2. Верткин А. Л., Зайратьянц О. В., Вовк Е. И. Поражение желудка и двенадцатиперстной кишки у больных с острым коронарным синдромом // Лечащий врач. – 2005. – № 1. – С. 66–70.
3. Верткин А. Л., Зайратьянц О. В., Вовк Е. И. Окончательный диагноз. – М.: ГЭОТАР-Медиа, 2008.
4. Колобов С. В., Зайратьянц О. В., Попутчикова Е. А. Морфологические особенности острых эрозий и язв желудка у больных инфарктом миокарда при лечении препаратом «Лосек» // Морфологические ведомости. – 2002. – Т. 3, № 4. – С. 80–82.
5. Колобов С. В., Зайратьянц О. В., Хохлова Е. Е., Фролова Ю. В. Острые эрозивно-язвенные поражения желудка при неотложных состояниях у больных терапевтического профиля. Тез. докл. VI Съезда Научного Общества Гастроэнтерологов России. – М. – 2006. – С. 24–25.
6. Колобов С. В., Верткин А. Л., Зайратьянц О. В. и соавт. Острые эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта у больных инфарктом миокарда. Сб. трудов II Съезда Российского общества патологоанатомов. – М. – 2006. – Т. 1. – С. 70–71.
7. Колобов С. В., Зайратьянц О. В., Вовк Е. И. и соавт. Острые эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта. Сб. трудов «Актуальные вопросы морфогенеза в норме и патологии». – М.: НИИ морфологии человека РАМН, 2006. – С. 17–18.
8. Колобов С. В., Зайратьянц О. В., Хохлова Е. Е. Эрозивно-язвенные поражения желудка и двенадцатиперстной кишки и желудочно-кишечные кровотечения у больных инфарктом миокарда. Сб. тез. докл. VII Московской Ассамблеи «Здоровье Столицы». – М. – 2008. – С. 305–306.
9. Маев И. В. Эрозивный гастрит: отдельная нозологическая форма или универсальная реакция слизистой оболочки на повреждение? // Росс. журн. гастроэнтерол., гепатол., колопроктол. – 2005. – Т. 15, № 6. – С. 53–59.
10. Хохлова Е. Е., Колобов С. В., Зайратьянц О. В., Зайратьянц Г. О. Острые эрозивно-язвенные гастродуоденальные поражения и кровотечения у больных терапевтического и неврологического профиля. Сб. трудов III Съезда Российского общества патологоанатомов. – Самара: СамГМУ, 2009. – С. 325.
11. Ярема И. В., Колобов С. В., Зайратьянц О. В. и соавт. Острые эрозивно-язвенные гастродуоденальные поражения у больных ишемической болезнью сердца, цереброваскулярными болезнями и хроническими обструктивными болезнями легких // Хирург. – 2009. – № 12. – С. 5–13.
12. Ивашкин В. Т., Шептулин А. А. Эрозивно-язвенные поражения желудка и двенадцатиперстной кишки, обусловленные нестероидными противовоспалительными препаратами // Врач. – 2001. – № 3. – С. 22–23.
13. Зайратьянц О. В., Колобов С. В., Хохлова Е. Е., Попутчикова Е. А. Острые эрозивно-язвенные гастродуоденальные поражения у терапевтических и неврологических больных // Под ред. Акад. РАН и РАМН В. А. Ткачука. Сб. науч. работ конференции памяти Ю. Л. Перова. – М.: Изд-во МГУ, 2009. – С. 35–43.
14. Зайратьянц О. В., Колобов С. В., Полянко Н. И., Хохлова Е. Е. Острые эрозивно-язвенные кровотечения у больных терапевтического и неврологического профиля. Сб. тез. докл. VIII Московской Ассамблеи «Здоровье Столицы». – М. – 2009. – С. 256–257.
15. Колобов С. В., Зайратьянц О. В., Лоранская И. Д. и соавт. Эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта у больных острым инфарктом миокарда // Неотложная терапия. – 2002. – Т. 3, № 4. – С. 63–67.
16. Колобов С. В., Зайратьянц О. В., Лоранская И. Д. и соавт. Эрозивно-язвенные поражения желудка и двенадцатиперстной кишки при остром инфаркте миокарда // Экспериментальная и клиническая гастроэнтерология. – 2003. – № 1. – С. 95–97.
17. Колобов С. В., Верткин А. Л., Зайратьянц О. В. и соавт. Лечение и профилактика желудочно-кишечных кровотечений у больных с обострением ИБС // Терапевт. – 2006. – № 6. – С. 15–28.
18. Михайлов А. П., Данилов А. М., Напалков А. Н., Шульгин В. Л. Острые язвы и эрозии пищеварительного тракта: Учебное пособие. – СПб.: Изд-во С.- Петерб. Ун-та, 2004.
19. Гельфанд Б. Р., Гурьянов В. А., Мартынов А. Н. и соавт. Профилактика стресс – повреждений желудочно-кишечного тракта у больных в критических состояниях // Consilium Medicum. – 2005. – Т. 7, № 6. – С. 464–471.
20. Стоцко Ю. М., Курыгин А. А., Мусинов И. М. Ваготомия в лечении острых изъязвлений желудка, осложненных тяжелым кровотечением // Вестник хирургии. – 2001. – № 3. – С. 25–29.
21. Чернов В. Н., Мизиев И. А., Белик Б. М. Прогнозирование и профилактика возникновения острых язв и эрозий желудка и двенадцатиперстной кишки у хирургических больных // Вестник хирургии. – 1999. – № 6. – С. 12–15.
22. Шептулин А. А. Гастропатия, связанная с приемом нестероидных противовоспалительных препаратов: факторы риска, лечение, профилактика // Клин. перспективы в гастроэнтерологии и гепатологии. – 2001. – № 1. – С. 27–31.
23. ESC-2017: обновлённые клинические рекомендации. Диагностика и лечение заболеваний периферических артерий // Современная кардиология. – 2017. – Т. 3, № 05. – С. 3.
24. Калинин А. В. Симптоматические гастродуоденальные язвы и язвенная болезнь // Рос. журн. гастроэнтерол, гепатол., колопроктол. – 2004. – № 3. – С. 22–31.
25. Сулейманов З., Гидаятов А., Караев Г. и соавт. Локализация активных ионов водорода в слизистой оболочке желудка // Клиническая медицина. – 2006. – № 9. – С. 66–68.
26. Sachs G., Prinz, C. K. Hersey, S. J. Mechanism of acid secretion. Acidrelated disorders.Palm Beach, Fla.: Sushu Publishing Inc.;1995. – № 2. – P. 63.
27. Соколова Г. Н., Царегородцева Т. М., Ткаченко Е. В., Серова Т. И. Иммунный механизм в пато- и саногенезе при язвенной болезни желудка у лиц среднего и пожилого возраста // Клиническая геронтология. – 2006. – Т. 12, № 1. – С. 34–40.
30. Звенигородская Л. А., Горуновская И. Г. Особенности язвенной болезни у лиц пожилого и старческого возраста // Клиническая геронтология. – 2003. – № 9. – С. 50–51.
31. Черняев, А. Я. Клинико-морфологическая характеристика язвенной болезни у лиц пожилого возраста // Экспериментальная и клиническая гастроэнтерология. – 2002. – № 2. – С. 18–21.
32. Звенигородская Л. А., Кузнецов М. Р., Самсонова Н. Г., Таранченко Ю. В. Хроническая ишемическая болезнь органов пищеварения // Экспериментальная и клиническая гастроэнтерология. – 2002. – № 2. – С. 13–17.
33. Пиманов С. И., Семенова Е. В., Макаренко Е. В., Руселик Е. А. Гастродуоденальные язвы, вызываемые антиагрегантами и нестероидными противовоспалительными препаратами: профилактика по новым рекомендациям // Consilium medicum. – 2009. – Т. 11, № 8. – С. 13–20.
34. Лазебник Л. Б., Звенигородский Л. А. Метаболический синдром и органы пищеварения. – М.: Анахарсис, 2009. – 184 с.
35. Осадчий В. А. Состояние микроциркуляции, симпатоадреналовой и гистаминореактивной систем и влияние их изменений на особенности рецидива язвенной болезни у больных инфарктом миокарда // Клин. мед. – 2005. – № 3. – С. 34–38.
36. Пиманов С. И., Макаренко Е. В. Оптимизированные эрадикационные протоколы: рекомендации Американской коллегии гастроэнтерологов, Маастрихт V/Флорентийского и Торонтского консенсусов // Медицинский совет. – 2017. – № 15. – С. 10–17.
37. Маев И. В., Самсонов А. А. Современные стандарты лечения кислотозависимых заболеваний, ассоциированных с H. pylori (материалы консенсуса Маастрихт-3) // Consilium Medicum. Гастроэнтерология. – 2006. – Т. 8, № 1 (Прил.). – С. 3–8.
38. Старостин Б. Д. Лечение Helicobacter руlогі-инфекции – Маастрихсткий V/Флорентийский консенсусный отчет (перевод с комментариями) // Гастроэнтерология Санкт-Петербурга. – 2017. – № 1. – С. 2–22.
39. Мельников М. В., Сабодаш В. Б., Апресян А. Ю. Состояние слизистой оболочки проксимальных отделов желудочно-кишечного тракта у больных периферическим атеросклерозом // Фундаментальные исследования. – 2013. – № 2. – С. 117–120.
40. Смолькина А. В., Максин А. А., Шабаев Р. М., Рогова Ю. Ю. Сочетание заболеваний гастродуоденальной зоны с критической ишемией нижних конечностей // Ангиология и сосудистая хирургия. – 2012. – № 2 (Прилож.). – С. 363–364.
41. Фокин А. А., Олевская Е. Р., Орехова Л. А. и соавт. Заболевания проксимального отдела желудочно-кишечного тракта у больных с окклюзионно-стенотическими изменениями брюшной аорты и артерий нижних конечностей // Ангиология и сосудистая хирургия. – 1999. – № 2. – С. 114–118.
42. Бельков Ю. А., Шинкевич Э. В., Макеев А. Г. и соавт. Тактика лечения больных с хронической ишемией нижних конечностей при эрозивно-язвенных гастродуоденитах // Хирургия. – 2004. – № 3. – С. 38–41.
47. Gao F., Zhou Y. J., Wang Z. J. et al. Meta-analysis of the combination of warfarin and dual antiplatelet therapy after coronary stenting in patients with indications for chronic oral anticoagulation. Int. J. Cardiol, 2011, V. 148, № 1, P. 96–101.
51. Pipilis A., Lazaros G., Tsakonas G. Triple Antithrombotic Therapy with Aspirin, a Thienopyridine Derivative Plus Oral Anticoagulation in Patients with Atrial Fibrillation Undergoing Coronary Stenting. Hellenic J. Cardiol, 2010, № 51, P. 330–337.
66. Kirchhof P., Benussi S., Kotecha D. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016, V.37, № 38, P. 2893–2962.
68. Енисеева Е. С. Двойная и тройная антитромботическая терапия при фибрилляции предсердий и остром коронарном синдроме // Сибирский медицинский журнал (Иркутск). – 2016. – № 2. – С. 18–22.
74. Moayyedi P., Eikelboom J. W., Bosch J. et al. LB15 – A randomized trial of proton pump inhibitors versus placebo to prevent upper gastrointestinal bleeding in patients receiving Rivaroxaban or Aspirin. United European Gastroenterology Ueg Week, 2018.
Острые эрозивно-язвенные гастродуоденальные поражения у больных сердечно-сосудистыми заболеваниями
Цель обзора: Осветит вопросы патогенеза, диагностики, лечения острых эрозивно-язвенных гастродуоденальных поражений у больных с сердечно-сосудистыми заболеваниями а также их роль в танатогенезе.
Основные положения обзора: Наблюдается рост частоты острых эрозивно-язвенных гастродуоденальных поражений у больных сердечно-сосудистыми заболеваниями и другой соматической патологией. Роль ими обусловленных кровотечений в танатогенезе этих заболеваний недооценена. В патогенезе острых эрозивных гастропатий у пациентов с сердечно-сосудистой и другой соматической патологией суммируются многие факторы, прежде всего, острая или хроническая ишемия гастродуоденальной слизистой оболочки, а также ее возрастная инволюция, хеликобактериоз, рефлюкс-гастрит, полиорганная недостаточность, лекарственные повреждения и т.д.
Выводы: Несмотря на рост частоты ОЭГП, нерешенность вопросов их профилактики, диагностики и лечения, в последние годны наблюдается тенденция к снижению связанных с ОЭГП смертельных ЖКК. Антисекреторная терапия, все чаще проводимая больным с ИБС и ЦВБ в течение периода активного влияния факторов риска, снижает вероятность гастродуоденального кровотечения у терапевтических больных как минимум на 50%.
Множественные кровоизлияния и острые эрозии слизистой оболочки желудка принято объединять под термином острые эрозивные гастропатии. Это групповое понятие нельзя, однако, признать удачным, так как оно объединяет большое количество разнообразных по этиологии и патогенезу нозологических форм и их осложнений -инфекционных, ишемических, лекарственных, онкологических поражений желудка, , требующих применения различных методов диагностики и лечения. Кроме того, часто встречается сочетание эрозивных поражений и острых язв слизистой оболочки, причем не только желудка, но и двенадцатиперстной кишки [1 – 15].
Этиология острых эрозивно-язвенных гастродуоденальных поражений (ОЭГП) чрезвычайно многообразна. К важнейшим этиологическим факторам относят прием некоторых лекарственных препаратов - нестероидных противовоспалительных препаратов (НПВП), цитостатиков, кортикостероидов и др.; алкогольную интоксикацию; химические и физические гастродуоденальные травмы; стресс, шок, ДВС-синдром различной этиологии, тяжелые травмы, ожоги (язвы Курлинга), обморожения; хронический атрофический гастрит, инфекцию Helicobacter pylori и heilmannii; почечную (уремическая гастропатия), печеночную недостаточность (гепатогенные язвы); онкологические заболевания, в т.ч. опухоли желудка; болезни крови (анемии, лейкозы); инфекционные заболевания, хронические болезни легких, заболевания нейро-эндокринной системы, такие, как нейротравмы и другие поражения головного мозга (особенно задней черепной ямки), гипоталамо-гипофизарной системы (язвы Кушинга); гастрин-продуцирующие опухоли (синдром Золлингера-Эллисона), гиперпаратиреоз, сахарный диабет (кома, ульцерогенное действие инсулина) и т.д. Однако в последние годы привлекает к себе внимание повышение частоты ОЭГП и обусловленных ими желудочно-кишечных кровотечений (ЖКК) у больных с сердечно-сосудистыми заболеваниями, прежде всего, ишемической болезнью сердца (ИБС) и церебро-васкулярными болезнями (ЦВБ) [1-7, 16 – 30].
Рост частоты ОЭГП у больных с сердечно-сосудистыми заболеваниями и другой соматической патологией позволяет говорить, фактически, об их эпидемии. По данным разных авторов, частота ОЭГП у таких пациентов достигает 80-90%, а обусловленных ими ЖКК – 45-55%. Широкое распространение ОЭГП связывают с постарением населения, влиянием неблагоприятной экологии, экзогенными (алкоголь и т.д.) и эндогенными интоксикациями, ятрогенными факторами (увеличением числа и объема оперативных вмешательств, приема различных лекарственных средств) [2-11, 19-24, 31].
Так, сопоставление результатов исследований частоты ОЭГП по материалам 6900 патологоанатомических вскрытий умерших от различных заболеваний из групп ИБС и ЦВБ в многопрофильных скоропомощных стационарах с процентом аутопсий не ниже 80% в 2000-2002 гг. (2400 вскрытий) и 2003-2008 гг. (4500 вскрытий) продемонстрировало, что за последнее десятилетие она повысилась примерно на треть, несмотря на внедрение в клиническую практику мер по их профилактике, диагностике и лечению [2-8, 10, 11, 20-24]. Важно отметить, что из этих исследований были исключены наблюдения с заболеваниями, которые могли бы быть самостоятельными причинами развития ОЭГП, помимо сердечно-сосудистых болезней: с хирургической патологией органов пищеварения, хронической алкогольной интоксикацией, хроническими гастритами, онкологическими, эндокринными (кроме сахарного диабета в 2003-2008 гг.), и инфекционно-аллергическими заболеваниями, а также с почечной и печеночной недостаточностью, кахексией, с известным анамнезом приема лекарственных препаратов, вызывающих ОЭГП. Группа ИБС была представлена инфарктами миокарда (32%), крупно- и мелкоочаговым кардиосклерозом (20%); группа ЦВБ - ишемическими инфарктами головного мозга и внутримозговыми нетравматическими гематомами (42%), отдаленными последствиями нарушений мозгового кровообращения (3%). Фоновыми заболеваниями явились артериальная гипертензия (71,6% для ИБС и 86,6% - для ЦВБ), сахарный диабет 2-го типа (соответственно, 4,3 и 1,2%) или их сочетание (18,6 и 9,6%). Комбинированные основные заболевания были представлены сочетанием болезней из групп ИБС и ЦВБ (21%). Соотношение мужчин и женщин составило при ИБС 1 : 1,3, при ЦВБ – 1 : 1,1, средний возраст умерших – 67,5±3,2 лет [2-8, 10, 11, 20-24].
Результаты вышеуказанных исследований показали, что частота ОЭГП составила при инфаркте миокарда в 2000-2002 гг. 10%, а в 2003-2008 гг. – 18%, при хронических формах ИБС с синдромом хронической сердечной недостаточности, соответственно, 6 и 10%, при инсультах – 8 и 14% и при хронических формах ЦВБ – 4 и 9% (Рис. 1). В наблюдениях с сочетанием заболеваний из групп ИБС и ЦВБ ОГЭП обнаруживались значительно чаще, в 21% наблюдений. Рост частоты ОЭГП в 2003-2008 гг. в определенной мере можно объяснить включением в анализируемую группу (по сравнению с 2000-2002 гг.) больных с сахарным диабетом, которые составили 22,7% при ИБС и 10,8% - при ЦВБ [2-8, 10, 11].
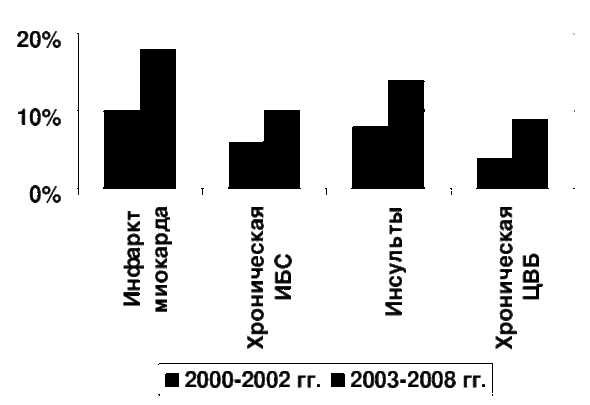
Рис.1 Частота (в %) острых эрозивно-язвенных гастродуоденальных поражений у умерших от заболеваний из групп ИБС и ЦВБ в 2000-2002 (2400 вскрытий, исключено фоновое заболевание – сахарный диабет) и в 2003-2008 гг. (4500 вскрытий, включено фоновое заболевание – сахарный диабет).
У больных ИБС и ЦВБ острые эрозии и язвы локализовались преимущественно в желудке (88 и 74%), в двенадцатиперстной кишке (преимущественно в ее луковице) - у 8 и 12% пациентов, cоответственно, а сочетанное поражение желудка и двенадцатиперстной кишки было выявлено в 4 и 14% наблюдений соотвественно. (Рис. 2). В желудке изменения были более выражены в области тела и малой кривизны (при ИБС – в 52±1,3%, при ЦВБ – в 41,0±0,3%), реже – в фундальном (соответственно, в 21±0,7 и 27±0,5%) и антральном (в 27±1,5 и 25±0,2%) отделах. Как при ИБС, так и при ЦВБ преобладали поверхностные поражения (острые эрозии составили 47,3 – 87,9% наблюдений), а не глубокие, такие как острые язвы [10, 11].
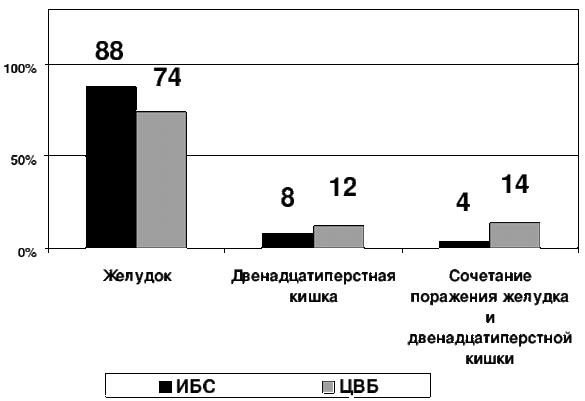
Рис.2 Частота (в %) локализации острых эрозий и язв в желудке или двенадцатиперстной кишки при ИБС и ЦВБ.
Своевременная диагностика ОЭГП представляет собой проблему, не решенную до настоящего времени, что связано с особенностями их клинических проявлений. Для 30-90% больных характерно их бессимптомное течение, для 46-58% - отсутствие типичной и выраженной клинической картины, а у 25-42% пациентов преобладают симптомы основного заболевания. В результате ОЭГП часто остаются не диагностированными, пока неожиданно не проявятся кровотечением, нередко опасным для жизни. При этом частота геморрагических осложнений ОЭГП, вплоть до летальных, составляет 39-47% [3, 9, 11]. У больных ИБС и ЦВБ первым проявлением поражения гастродуоденальной слизистой оболочки ЖКК становятся в 25-55% наблюдений, а в большинстве случаев диагноз впервые устанавливается на аутопсии. Следует отметить, что повсеместное снижение числа патологоанатомических вскрытий, характерное для многих медицинских учреждений, ведет к недооценке частоты и роли ОЭГП в танатогенезе у больных сердечно-сосудистыми заболеваниями. Большинство исследователей согласны с тем, что кровотечения, вызванные ОЭГП, развиваются гораздо чаще, чем выявляются [2-11, 19-24].
Проблема лечения ЖКК при ОЭГП также остается нерешенной. Результаты консервативной терапии острых язв и эрозий, осложненных кровотечением, остаются неудовлетворительными, летальность составляет от 36,4 до 64-80% [1,3]. Исходы хирургического лечения также часто неблагоприятны. Летальность после применения различных способов оперативного вмешательства находится в пределах 24-44% 34. Поскольку ЖКК при ОЭГП нередко протекают субклинически и не приводят к существенным гемодинамическим нарушениям, некоторые авторы полагают, что их клиническое значение не стоит преувеличивать 36. Этому мнению оппонируют данные других исследователей, согласно которым состоявшееся кровотечение удлиняет сроки лечения, в среднем, на 4-8 дней, в 4 раза увеличивает риск повторного массивного кровотечения и в 2-4 раза - риск летального исхода [2-8,36,38].
По данным вышеуказанных патологоанатомических исследований, проведенных в 2002-2008 гг. в многопрофильных скоропомощных стационарах, ЖКК разной степени тяжести, связанные с ОЭГП развивались у 67% умерших с ИБС и 55% - ЦВБ, однако их роль в танатогенезе была различной. Частота смертельных ЖКК (непосредственных причин смерти) составила при инфаркте миокарда в 2000-02 гг. 4%, в 2003-08 гг. – 3%, при хронических формах ИБС с синдромом хронической сердечной недостаточности, соответственно, 2 и 2%, при инсультах – 2 и 1%, хронических формах ЦВБ в 2000-02 гг. - 1%, а в 2003-08 гг. таких летальных исходов выявлено не было (Рис. 3).
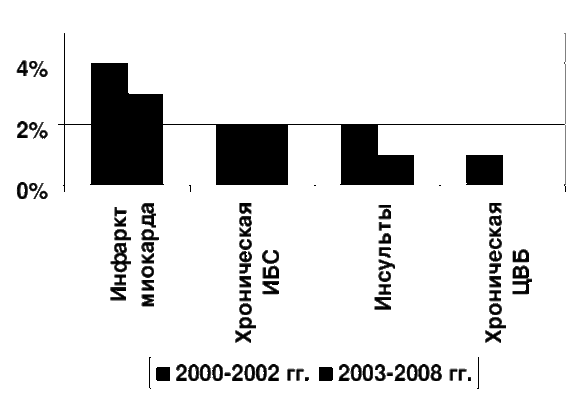
Рис.3 Частота (в %) смертельных кровотечений при острых эрозивно-язвенных гастродуоденальных поражениях у умерших от заболеваний из групп ИБС и ЦВБ в 2000-2002 (2400 вскрытий, исключено фоновое заболевание – сахарный диабет) и в 2003-2008 гг. (4500 вскрытий, включено фоновое заболевание – сахарный диабет).
Таким образом, несмотря на рост частоты ОЭГП, наблюдается тенденция к снижению связанных с ними смертельных ЖКК [10,11,20,21]. Известно, что антисекреторная терапия, все чаще проводимая больным с ИБС и ЦВБ при увеличении рН содержимого желудка до 5,0 – 7,0 ед. в течение периода активного влияния факторов риска, снижает вероятность гастродуоденального кровотечения у терапевтических больных как минимум на 50% [2,3,35]. Хотя удельный вес ЖКК среди причин смерти больных с ИБС и ЦВБ не превысил в 2000-08 гг. 4%, абсолютное число таких умерших достаточно велико, так как нозологические формы из этих групп заболеваний являются ведущими причинами смерти населения. С учетом показателей летальности при этих заболеваниях, от ЖКК погибает 1 из 200 больных с инфарктом миокарда и 1 из 1000 - с ишемическим инфарктом или гематомой головного мозга. В 2009 г. в Москве среди всех причин смерти заболевания из группы ИБС составили 31,6, новообразования – 19,8, а ЦВБ – 18,3%. Среди нозологических единиц лидерами остаются хронические формы ИБС (атеросклеротический и постинфарктный кардиосклероз – 24,1%, инсульты – 6,6% и инфаркт миокарда – 5,5%) (Рис. 4). В результате, в Москве смертность от ЖКК, обусловленных ОЭГП, составляет не менее 1000 больных в год [10,11,20,21].
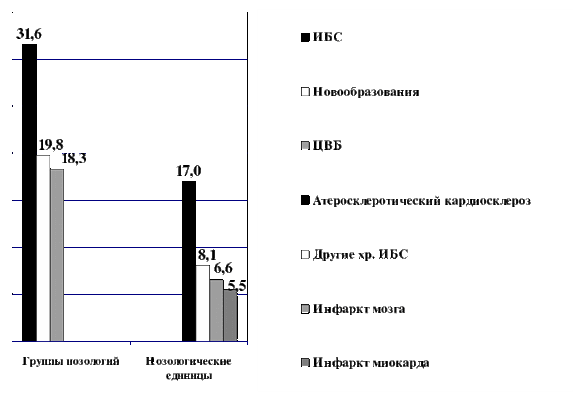
Рис.4 Самые частые (в %) заболевания и их группы (ИБС, ЦВБ, онкологические заболевания) — причины смерти в Москве в 2009 г.
Патогенез ОЭГП у больных сердечно-сосудистыми заболеваниями недостаточно ясен. Ряд авторов полагает, что механизмы развития ОЭГП у больных с различной соматической патологией в целом отражают известный патогенез «стрессового» поражения гастродуоденальной слизистой оболочки, который практически не зависит от особенностей основного заболевания. Следовательно, ОЭГП развивается в результате пептического (кислотного) повреждения слизистой оболочки на фоне ее глубокой ишемии с угнетением всех механизмов гастропротекции: секреции бикарбоната, муцина, пролиферации и регенерации эпителия [10,11,39-41]. Известно, что при хронической недостаточности кровообращения развиваются дистрофические процессы во многих органах, в том числе и в органах пищеварения, особенно в слизистой оболочке желудка, которая теряет свою резистентность [15,28,29]. Развитию ОЭГП могут также способствовать и другие факторы, такие как хеликобактериоз, лекарственные средства, дуодено-гастральный желчный рефлюкс, гастропарез и т.д. [1-3,37]. Тем не менее, многие исследователи настаивают на необходимости рассматривать ОЭГП как острое, ассоциированное с гиперацидностью повреждение гастродуоденальной слизистой, при котором первичным этиологическим фактором является не хеликобактерный гастрит, как при пептической язве и не длительный прием противовоспалительных препаратов, как при НПВП-гастропатии, а тяжелое соматическое заболевание [29]. Морфологическое исследование, проведенное у умерших с ИБС и ЦВБ, с учетом известной роли хронического атрофического гастрита и хеликобактериоза в патогенезе эрозивно-язвенных поражений желудка, не выявило достоверной разницы в их частоте в двух группах наблюдений - осложненных и не осложненных ОЭГП, что указывает на наличие при сердечно-сосудистых заболеваниях других важных патогенетических факторов развития этих осложнений [10,11].
Таким образом, ведущую роль в патогенезе ОЭГП, по-видимому, играют ишемия и микроциркуляторные нарушения гастродуоденальной слизистой оболочки, которые вызывают обратную диффузию Н+, ацидоз, истощение буферных систем, гибель и нарушение регенерации клеток эпителия [2,3,10,11,20,21].
Морфологические исследования показали, что при синдроме хронической сердечной недостаточности у больных ИБС и, нередко, с ЦВБ, в гастродуоденальной слизистой оболочке развиваются хроническое венозное полнокровие, атрофия и склероз всех слоев, склероз и гиалиноз стенок артериол и мелких артерий, образуются кавернозные структуры из резко расширенных вен и венул в подслизистом слое, редукция капиллярного русла, множественные поверхностные мелкие очаги кровоизлияний, ишемического и геморрагического некроза, приводящие к формированию чаще острых эрозий, реже - острых язв. Иммуногистохимическое исследование гастродуоденальной слизистой оболочки у больных ИБС и ЦВБ выявило снижение пролиферативной активности и экспрессии факторов роста и ангиогенеза (ТФР-?1 и СЭФР), свидетельствующие об угнетении регенераторных способностей и снижение защитных функций. Такие изменения, типичные для хронической ишемии, развивались при наличии тяжелого стенозирующего атеросклероза артерий желудка и двенадцатиперстной кишки [10,11,20,21]. У больных с ИБС и синдромом острой сердечной недостаточности, на фоне хронических изменений гастродуоденальной слизистой оболочки отмечаются ее острое венозное полнокровие, выраженный отек подслизистого и мышечного слоев, появление обширных кровоизлияний, крупных очагов ишемического и геморрагического некроза, вплоть до подслизистого слоя. При кардиогенном шоке, часто на фоне хронических ишемических изменений слизистой оболочки, характерны чередование очагов острого венозного полнокровия и малокровия, распространенный тромбоз микроциркуляторного русла, обширные множественные кровоизлияния и сливные поверхностные очаги некроза слизистой оболочки [10,11,20,21]. Такие морфологические изменения желудка и двенадцатиперстной кишки у больных сердечно-сосудистыми заболеваниями позволяют обосновать понятие ишемической болезни желудка и двенадцатиперстной кишки, по аналогии, например, с ишемической болезнью кишечника. Особенностью ишемической болезни желудка и двенадцатиперстной кишки является крайне редкое развитие некроза (инфаркта) всей толщи их стенок, что обусловлено чрезвычайно развитой системой сосудистых анастомозов этих органов, множественных источников кровоснабжения. При этом агрессивная среда желудка, даже при незначительном нарушении кровообращения и ишемии гастродуоденальной слизистой оболочки способствует ее повреждению.
Остается открытым вопрос о патогенетической роли в развитии обострений ИБС и ЦВБ острой постгеморрагической анемии при ЖКК, обусловленных ОЭГП. Специально проведенный ретроспективный анализ медицинских карт стационарных и амбулаторных больных в многопрофильных стационарах показал, даже с учетом неполноты информации, что ЖКК предшествовали развитию инфаркта миокарда у 1,3%, а инсультов – у 0,22% больных, что представляет несомненный интерес в плане взаимосвязи ОЭГП и ишемических поражений сердца и головного мозга [10,11,20,21].
Таким образом, наблюдается рост частоты ОЭГП у больных сердечно-сосудистыми заболеваниями и другой соматической патологией. Роль ЖКК, обусловленных ОЭГП, в танатогенезе этих заболеваний недооценена, нерешенными остаются проблемы их профилактики, диагностики и лечения. ОЭГП у больных сердечно-сосудистыми заболеваниями представляют собой морфологический субстрат ишемической болезни желудка и двенадцатиперстной кишки. При атеросклерозе, артериальной гипертензии и сахарном диабете желудок и двенадцатиперстная кишка становятся одними из органов-мишеней, причем поражение сердца и головного мозга при ИБС и ЦВБ усугубляют тяжесть патологических изменений гастродуоденальной слизистой оболочки. Следует учитывать, однако, что в патогенезе ОЭГП у пациентов с сердечно-сосудистыми заболеваниями и другой соматической патологией суммируются многие факторы: острая или хроническая ишемия гастродуоденальной слизистой оболочки, ее возрастная инволюция и атрофия вследствие хеликобактериоза, рефлюкс-гастрит, лекарственные повреждения и т.д.
Гастродуоденальное кровотечение в пожилом возрасте: стратегия и тактика лечения в практике терапевта
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Е.И. Вовк, кафедра терапии, клинической фармакологии и скорой медицинской помощи МГМСУ
Частота желудочно-кишечных кровотечений в течение последних 20 лет продолжает оставаться причиной 1,4% - 2% летальных исходов городских жителей. У мужчин, пожилых и коморбидных пациентов летальные ЖКК развиваются вдвое чаще. Общая частота ЖКК в странах Евросоюза варьирует в пределах 50-170 случаев, а в США составляет 170 случаев на 100 000 человек взрослого населения. ЖКК являются частым поводом для обращения за скорой медицинской помощью и важнейшей причиной экстренной госпитализации.
Благодаря широкому распространению тактики комбинированной антихеликобактерной терапии, распространенность пептической язвенной болезни - основной причины желудочно-кишечных кровотечений (ЖКК) – как в мире, так и в России неуклонно уменьшается (рис. 1).
На практике причины трудностей в своевременной диагностике ЖКК кроются в неверной стратегии оценки риска эрозивно-язвенного повреждения гастродуоденальной слизистой, а по сути - частоты некомпенсированной гиперацидности желудка и двенадцатиперстной кишки у пациентов старше 60 лет и больных сердечно-сосудистыми заболеваниями. В этой группе ЖКК кислотное повреждение гастродуоденальной слизистой, как правило, развивается вследствие ишемии и нарушения эндогенного ощелачивания, а не высокой секреции соляной кислоты на фоне хеликобактерного гастрита, как это происходит при первичной пептической язвенной болезни. Очевидно, что предикторы высокого риска ЖКК при различной этиологии поражения гастродуоденальной слизистой оболочки также существенно различаются. При пептической язвенной болезни важнейшими предикторами ЖКК являются первичная генетически детерминированная гиперацидность желудка и активный хеликобактерный гастрит, а при ишемических поражениях и НПВП-гастропатии – стойкое нарушение ощелачивания слизистой желудка и двенадцатиперстной кишки (ДПК) в условиях относительно “нормального” кислотообразования. Таким образом, отталкиваясь от распространенной клинико-морфологической классификации причин ЖКК, которая основана на данных эндоскопии при текущем или состоявшемся кровотечении, почти невозможно составить представление об этиологии гастродуоденального поражения, а также гендерных, коморбидных и ятрогенных факторах, имеющих принципиальное значение как для оценки прогноза кровотечения, так и для организации профилактики и ранней диагностики ЖКК в группах риска (рис. 2).
Известно, что пептическая язвенная болезнь чаще развивается у молодых мужчин с некомпенсированной гиперацидностью и хеликобактерным гастритом. Тем не менее, по статистике, около 80% летальных исходов от ЖКК при “язвенной болезни” регистрируется у пациентов старше 65 лет, преимущественно – у женщин в возрасте 62-65 лет, без симптомов гиперацидности и длительного анамнеза пептической язвенной болезни и часто – при отсутствии значимой контаминации хеликобактером [14, 15]. Таким образом, вероятно, значительная доля ЖКК развивается вследствие приобретенной или транзиторной гиперацидности, которая является результатом нарушений ощелачивания, а в пожилом и старческом возрасте еще и сопровождается выраженными нарушениями гемостаза. Причиной развития этих 15-27% ЖКК у пожилых больных является ишемия гастродуоденальной слизистой оболочки при хронической сердечной недостаточности, атеросклерозе чревных артерий, аневризме аорты [3].
- возраст старше 65 лет;
- язвенная болезнь в анамнезе;
- терапия антикоагулянтами;
- женский пол;
- положительный тропониновый тест;
- неконтролируемая артериальная гипертония;
- никотиновая абстиненция;
- сердечная недостаточность;
- дыхательная недостаточность.
Важнейшей причиной эрозивно-язвенных гастродуоденальных поражений и ЖКК является лечение неселективными нестероидными противовоспалительными препаратами (НПВП). Терапия НПВП может привести к нарушениям в различных отделах ЖКТ (рис. 5). Однако поражение гастродуоденальной слизистой развивается наиболее часто и сопряжено с наиболее высоким риском летального исхода вследствие ЖКК. Впервые Rots S.H. и соавт (1986) установили, что 68% больных, систематически принимающих НПВП больше 6 недель имеют геморрагии и эрозии, а 15% - язвы в слизистой оболочке желудка и двенадцатиперстной кишки, и предложили клинический термин «НПВП-гастропатия». В дальнейших исследованиях частота НПВП-гастропатии варьировала от 40% [23] до 81% [24]. У 20-25% больных с НПВП-гастропатией развиваются острые язвы, а более чем у 50% – эрозивное поражение гастродуоденальной слизистой [19, 20, 21, 22, 23]. К началу XXI в. было установлено, что НПВП регулярно принимали более 50% всех пациентов, перенесших ЖКК [18], и что при НПВП-гастропатии ЖКК развиваются в 5 раз чаще, чем у не принимавших НПВП [2].
Установлено, что риск развития НПВП-гастропатии в той или иной степени сопряжен с приемом любого НПВП – неселективного блокатора ЦОГ. По данным метанализа S.C. Lewis и соавт. (2002), наименьшая гастротоксичность и связанный риск ЖКК характерны для ибупрофена (OR 1,7; 95% CI 1,1–2,5), наибольшая – для кетопрофена (34,9; 12,7–96,5). Максимальная опасность развития кровотечения вне зависимости от принимаемого НПВП возникает на первой неделе приема, снижается при продолжении приема НПВП (5,6; 4,6–7,0) и падает через неделю после прекращения приема данных лекарственных средств [25]. Предикторами тяжелого поражения или риска ЖКК при НПВП-гастропатии считают следующие факторы:
- прием НПВП < 3 месяцев
- большая суточная доза НПВП и/или одновременно прием двух неселективных НПВП
- одновременный прием антикоагулянтов, антиаггрегантов и кортикостероидов
- курение
- возраст старше 60 лет
- коморбидная отягощенность [28, 42].
Доказано, что хеликобактерный гастрит не относится к числу прямых предикторов НПВП-гастропатии (рис. 6). Более того, структура слизистой желудка при НПВП-гастропатии напоминает химический гастрит с атрофией, фовеолярной гиперплазией и низкой активностью воспаления, что в известной степени противоположно изменениям слизистой при активном хеликобактерном гастрите [36]. Тем не менее, в рекомендациях по лечению кислотозависимых заболеваний Маастрихт-IV подтверждено, что активный хеликобактериоз увеличивает риск развития ЖКК при НПВП-гастропатии и является относительным показанием для проведения плановой антихеликобактерной терапии.
НПВП-гастропатия может привести к ЖКК в любом возрасте, однако во многих исследованиях показана особая уязвимость пожилых больных, получающих антиаггрегантную терапию низкими дозами ацетилсалициловой кислоты (АСК), и особенно тех, кто одновременно с АСК принимает другие НПВП, глюкокортикоиды и Клопидогрел. В большом эпидемиологическом исследовании Lanas A., et al. (2005), летальное ЖКК развивалось чаще у женщин в возрасте 76 ± 13.5, в 21,6% - с язвенной болезнью в анамнезе, 15,3% которых уже переносили ЖКК, и в 13,5% случаев обращались к врачу ранее в связи с диспепсией. 65,1% больных, умерших от ЖКК, имели клинически верифицированную ИБС и 40% - артериальную гипертонию. Характерно, что накануне госпитализации только 27% впоследствии умерших от ЖКК больных получали ИПП и 10% - другие антациды [22]. В исследовании А.Л.Верткина и соавт. (2007) высокая коморбидная отягощенность, пожилой возраст и отсутствие плановой медикаментозной профилактики также оказались важнейшими предикторами летального исхода при ЖКК у пациентов, госпитализированных с обострением ИБС [17].
Длительная терапия АСК для профилактики и лечения сердечно-сосудистых заболеваний существенно увеличивает гастротоксичность лечения неселективными НПВП. В амбулаторной практике долгое время считалось, что низкие дозы АСК и препараты с медленным высвобождением АСК, которые преимущественно назначают пожилым пациентам, обладают высокой безопасностью и не требуют настороженности в аспекте ЖКК. Тем более что АСК является слабым ингибитором простациклина, обеспечивающего активность гастропротективных механизмов в гастродуоденальной слизистой. Сегодня же, по окончании целого ряда больших исследований, можно уверенно говорить о том, что низкие дозы АСК в условиях длительного приема не только являются гастротоксичными – нет оснований думать, что дальнейшее уменьшение дозы может уменьшить риск ЖКК. По данным мета-анализа плацебо-контролиремых исследований, при длительности терапии АСК в дозе около 150 мг/сут, ЖКК развивается у 2,47% больных в отличие от 1,42% на фоне плацебо (OR 1,68; 95% CI 1,51-1,88) или, другими словами, - как минимум 1 больного из каждых 100 [26]. Длительная монотерапия низкими дозами АСК на 3,8% увеличивает суммарный риск поражения ЖКТ [27]. Сочетанный прием АСК и неселективные НПВП увеличивают риск ЖКК до 5,6%, а комбинация АСК + Клопидогрел – до 7,4% [27].
К настоящему времени доказано, что риск ЖКК у больных, длительно принимающих НПВП, увеличивается под влиянием целого ряда независимых предикторов ЖКК, таких как:
- язвенная болезнь (пептическая язва) и ее осложнения в анамнезе;
- старший возраст;
- высокие дозы НПВП;
- одновременный прием антикоагулянтов;
- одновременный прием кортикостероидов;
- прием неселективных гастротоксичных НПВП;
- сердечно-сосудистые заболевания [18].
Частое бессимптомное течение и высокая концентрация независимых предикторов НПВП-гастропатии в популяции фокусируют усилия по управлению прогнозом ЖКК у пожилых пациентов на своевременном выявлении факторов риска и проведении первичной медикаментозной профилактики гастропротекторами. В этой связи опора на клинико-эндоскопический анализ причин ЖКК и переоценка роли хеликобактерной контаминации в развитии некомпенсированной гиперацидности в пожилом возрасте особенно опасна для амбулаторной практики, поскольку именно в руках терапевта поликлиники и сосредоточены все рычаги по своевременной коррекции гиперацидности и профилактике ЖКК, ассоциированных с гастротоксичной лекарственной терапией. Для выполнения этих задач в 2008 г. в рекомендациях ACCF/ACG/AHA и в 2009 г. в рекомендациях American College of Gastroenterology негативное прогностическое значение предикторов высокого риска ЖКК, ассоциированных с пожилым возрастом и длительной терапией АСК, было уточнено и стратифицировано в зависимости от возможного режима медикаментозной гастропротекции (27, 28) (рис. 7).
Согласно этим рекомендациям, пациентам из группы высокого риска необходимо избегать приема НПВП. При необходимости им следует назначать селективные ингибиторы ЦОГ-2 с одновременным курсом мизопростола или ингибитора протонной помпы (ИПП). Пациентам, которые могут быть отнесены к группе умеренного риска, следует рекомендовать или селективные ингибиторы ЦОГ-2, или неселективные НПВП вместе с мизопростолом или ИПП [28]. Опираясь на данные проведенных в последние годы масштабных рандомизированных исследований (OMNIUM, АSTRONAUT, VENUS, PLUTO и др.) ИПП, безусловно, признаны ведущими препаратами для профилактики тяжелых НПВП-гастропатий, ассоциированных с одновременным приемом АСК и антиагрегантов [23, 28, 29, 30, 37, 42]. ИПП – в начале изучения проблемы это был омепразол – также оказались лучшими препаратами для профилактики ЖКК, т.к. оказались не только высокоэффективны, но и существенно более безопасны, чем мизопростол и Н2-блокаторы [28, 36]. В дальнейших исследованиях эффективность ИПП следующих поколений – эзомепразола, лансопразола, пантопразола и рабепразола для профилактики НПВП-гастропатии оказалась сравнимой с омепразолом. Все указанные препараты одинаково успешно в течение 16 часов удерживали рН > 4, необходимый для защиты от гастродуоденальных повреждений в группе риска ЖКК. В исследовании Regula JA., Butruk EU., Dekkers C., et al. (2006), пантопразол (Контролок) столь же эффективно, как и омепразол, защищал пациентов из группы высокого риска, постоянно принимающих НПВП. Через 6 месяцев лечения на фоне постоянного приема НПВП симптомы НПВП-гастропатии не возникли у 91% больных, получавших 20 мг пантопразола в день; 95% больных, получавших 40 мг пантопразола в день, и у 93% – на фоне терапии 20 мг омепразола в день [31].
В дальнейших исследованиях было показано, что пантопразол вызывает самое устойчивое подавление кислотообразования: после единственного приема 40 мг/сутки значения рН > 3 сохраняются более 19 часов. Это обусловлено специфическим связыванием его цистеином 822, расположенным в транспортном домене желудочного кислотного насоса. Таким образом, поскольку восстановление продукции соляной кислоты при терапии пантопразолом зависит от самообновления белков протонного насоса, а не Т1/2 пантопразола и блокада около 70% Н+/К+-АТФазы развивается в случае приема 40 мг однократно в течение 2-5 суток, а при приеме внутрь 2 раза в сутки - в течение 2-3 суток [32, 33].
При длительном применении у пожилых пациентов с полифармакотерапией и отягощенным коморбидным статусом пантопразол обладает более высокой безопасностью лечения. В отличие от омепразола и эзомепразола, пантопразол не требует коррекции вводимой дозы при нарушении функции печени и почек [11, 15, 34] и не приводит к лекарственному взаимодействию, значимому для пожилых “сосудистых“ пациентов, принимающих непрямые антикоагулянты. В отличие от омепразола (рис. 8) и других ИПП, имеющих широкое лекарственное взаимодействие с ферментами СУР450, пантопразол практически не влияет на активность CYP2C19, метаболизирующей фенитоин, варфарин и не приводит к увеличению риска побочных эффектов этих препаратов. В большом числе исследований показано, что пантопразол клинически значимо не взаимодействует с теофиллином и кофеином, диазепамом, варфарином, диклофенаком, фенитоином, карбамазепином, нифедипином, метопрололом и глибенкламидом [34]. Не было также обнаружено взаимодействия пантопразола с субстратами CYP3A3,4,5, такими как пероральные контрацептивы, и его влияния в дозе 40 мг/сут у здоровых добровольцев на абсорбцию и метаболизм этанола, являющегося субстратом CYP2E1 [15, 32-34]. В отличие от других ИПП, длительный прием пантопразола (Контролок) больными, получающими Клопидогрел после острого инфаркта миокарда, не приводит к уменьшению эффективности антиаггрегантной терапии и возрастанию риска повторного инфаркта [35].
При длительной терапии пантопразолом частота специфичных побочных эффектов (диарея, метеоризм, боли в животе, запор, головная боль и головокружение, гипергастринемия и гиперплазии энтерохромаффинных клеток в слизистой оболочке желудка) не превышают средних для ИПП 1,5-2,5% [15, 34]. Таким образом пантопразол, являясь одним из самых эффективных ингибиторов желудочной секреции, одновременно обладает высоким уровнем безопасности, что позволяет длительно применять его для поддерживающей гастропротективной терапии у пожилых и коморбидно отягощенных больных с высоким риском ЖКК. При появлении симптомов НПВП-гастропатии суточная доза пантопразола (Контролок) для приема внутрь у пожилых составляет 40 мг в течение 2-8 недель. Эффективная суточная доза пантопразола (Контролок) для профилактики ЖКК в группах риска составляет 40 мг/сут в начале лечения с возможностью уменьшения дозы до 20 мг/сут при достижении устойчивого лекарственного действия и в течение длительного времени [31].
Важным преимуществом пантопразола является его доступность в лекарственной форме для внутривенного введения с целью лечения и профилактики раннего рецидива ЖКК. По данным мета-анализа, устойчивый контроль рН в просвете желудка > 6 уже в течение первых суток лечения предотвращает кислотный протеолиз тромба и тем самым предотвращает рецидив кровотечения, уменьшает летальность до 2-3% и резко снижает общую стоимость лечения и потребность в гемотрансфузии [38, 39]. В течение многих лет до появления в медицинской практике раствора пантопразола для инфузий этим требованиям соответствовали только Н2-блокаторы: ранитидин и фамотидин, которые и применялись широко для лечения и профилактики раннего рецидива ЖКК [37]. У госпитализированных больных терапия Н2-блокаторами приводила к 50% снижению риска рецидивов кровотечений, в т.ч. ассоциированных с приемом АСК [40], однако она оказалась значительно менее эффективной, чем внутривенное введение пантопразола (рис. 9) [40, 41, 43].
В дальнейшем было показано, что пантопразол (Контролок) также более эффективно, чем омепразол, снижает частоту ранних рецидивов ЖКК и связанных с ними хирургических вмешательств, а также уменьшает общую длительности госпитализации (рис. 10) [44].
Для предотвращения рецидивирования ЖКК и профилактики острых стрессовых язв/эрозий пантопразол (Контролок) назначают внутривенно по 40 мг каждые 12 часов до стабилизации состояния больного и достижения устойчивого гемостаза по данным эндоскопии. Примерная схема ведения больного со стрессовым эрозивно-язвенным поражением и/или ЖКК: пантопразол (Контролок) в/в 40 мг каждые 12 часов в течение 3-7 дней, затем внутрь в течение 7 дней по 40 мг 2 раза в день, затем по 40 мг 1 раз в день, в течение 4 недель. Таким образом, пантопразол (Контролок) в суточной дозе 40 мг является безопасным и высокоэффективным препаратом выбора для профилактики и лечения гастродуоденальных эрозивно-язвенных поражений и ассоциированных с ними ЖКК у пожилых пациентов с отягощенным коморбидным фоном и одновременным длительным приемом АСК, антиагрегантов и антикоагулянтов.
Сосудистые гастродуоденальные повреждения
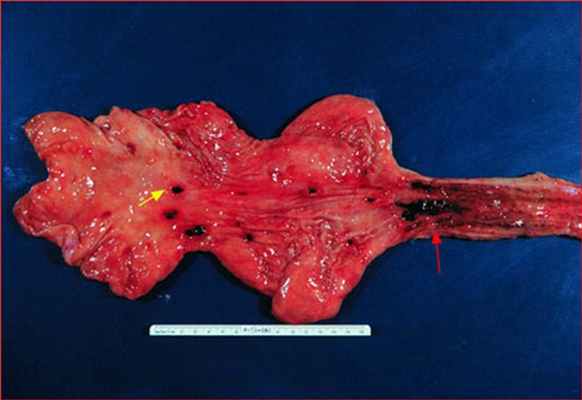
При ряде врожденных и приобретенных состояний наблюдаются изменения сосудов слизистой оболочки и подслизистого слоя желудочно-кишечного тракта. При этом могут наблюдаться рецидивирующие кровотечения, которые редко бывают массивными. Диагноз устанавливается при эндоскопическом исследовании и иногда с помощью ангиографии. Лечение подразумевает эндоскопический гемостаз; в ряде случаев показаны ангиографическая эмболизация или резекция пораженного участка.
Сосудистые эктазии (ангиодисплазии, артерио-венозные мальформации) представляют собой расширенные извитые сосуды, как правило выявляющиеся в слепой и восходящей ободочной кишке. В большинстве случаев они обнаруживаются в возрасте > 60 лет и чаще всего служат причиной кровотечения из нижних отделов желудочно-кишечного тракта Этиология Кровотечение в желудочно-кишечном тракте может развиваться на любом уровне – от ротовой полости до ануса, протекать в явной и скрытой форме. Клинические проявления зависят от локализации источника. Прочитайте дополнительные сведения в этой возрастной группе. Они возникают вследствие возрастных дегенеративных изменений, вне связи с другими изменениями сосудов. Как правило, определяются 2–3 участка эктазии размером 0,5–1,0 см, ярко-красного цвета, уплощенных или слегка приподнятых, покрытых очень тонким слоем эпителия.
Сосудистые эктазии также возникают при некоторых заболеваниях системного характера (например, почечной недостаточности, аортальном стенозе, циррозе, CREST-синдроме [кальцинозе, феномене Рейно, нарушениях моторики пищевода, склеродактилии, телеангиэктазиях]— Патофизиология ПатофизиологияСосудистые эктазии антрального отдела желудка (2арбузный" желудок) представлены крупными расширенными венами, линейно распространяющимися по ходу желудка, что придает ему полосатый вид, сходный по виду с арбузом. Данные изменения наблюдаются преимущественно у пожилых женщин, причины их остаются неясными.
Врожденная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия Наследственная геморрагическая телеангиэктазия является наследственным заболеванием сосудистой мальформации, передаваемым как аутосомно-доминантный признак, и поражает как мужчин, так и женщин. Прочитайте дополнительные сведения (синдром Рэндю–Ослера–Вебера) – аутосомно-доминантное заболевание, при котором наблюдается образование множественных сосудистых очагов поражения в различных участках тела, в т. ч. по всему ЖКТ. Желудочно-кишечное кровотечение, как правило, развивается после 40 лет.
Болезнь Делафуа (язва, образование Делафуа) связана с наличием аномально развитой артерии достаточно крупного калибра, проходящей в стенке органов пищеварения, что при нарушении целостности слизистой может приводить к развитию активного кровотечения. Как правило, источник кровотечения располагается в проксимальной части желудка.
Артериовенозные мальформации и гемангиомы представляют собой редкие врожденные аномалии развития сосудов, локализующиеся по ходу всего ЖКТ.
Симптомы и признаки поражения сосудов ЖКТ
Сосудистые образования не вызывают боли. Как правило, выявляется положительная реакция кала на скрытую кровь либо выделения небольших количеств крови из прямой кишки. Кровотечение обычно носит преходящий характер, нередко с длительными периодами ремиссий. При сосудистых образованиях в верхних отделах желудочно-кишечного тракта может наблюдаться мелена. Активное кровотечение развивается редко.
Диагностика сосудистых поражений ЖКТ
Сосудистые образования обычно выявляются при эндоскопии. Если обычная эндоскопия не дает информации, может потребоваться проведение энтероскопии, капсульной эндоскопии, интраоперационной энтероскопии или ангиографии внутренних органов. Сканирование с эритроцитами, мечеными технецием 99m, обладает меньшей специфичностью, но помогает определить расположение источника, повышая эффективность эндоскопии и ангиографии.
Лечение сосудистых поражений ЖКТ
Эндоскопическая коагуляция (с помощью термозонда, лазера, аргоновой плазмы или методом биполярной электрокоагуляции) эффективна в ликвидации большинства сосудистых образований. Сосудистые эктазии, если они считаются причиной кровотечения, лечат эндоскопической коагуляцией. В части случаев можно прибегнуть к наложению эндоскопических клипс. Для сосудистых эктазий характерны рецидивы; накоплены данные, что пероральный прием препаратов, содержащих комбинацию эстрогена и прогестерона, может уменьшить риск рецидивов.
При небольшом рецидивирующем кровотечении можно просто назначать длительный прием препаратов железа. При более выраженном кровотечении и неэффективности эндоскопических вмешательств прибегают к ангиографической эмболизации или резекции. Все же кровотечение рецидивирует у 15–25% больных, перенесших резекцию.
Основные положения
Разнообразные врожденные и приобретенные сосудистые аномалии могут послужить причиной небольшой и умеренно выраженной кровопотери из желудочно-кишечного тракта (как правило, из нижних отделов).
Предпочтительный метод лечения – эндоскопическая коагуляция измененных участков.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
