Старческое снижение функции яичек. Снижение выработки андрогенов
Добавил пользователь Alex Обновлено: 24.01.2026
Гормональная регуляция простаты. Возрастные изменения яичек
Гормон роста является, возможно, одним из гормонов, который участвует в регуляции роста предстательной железы перед половым созреванием, но не влияет на железу у взрослых (Grayhack, Lebowitz, 1967; Farnsworth, 1970).
Взаимосвязь между надпочечниками (или гормонами, их стимулирующими) и лактикотропной функцией гипофиза, вероятно, реализуется через предстательную железу. По данным Walsh и Gittes (1970), Tissell (1971), АКТГ или кортикостероиды стимулируют вентральную долю предстательной железы неполовозрелых или кастрированных животных. Семенные пузырьки кастрированных неполовозрелых крыс стимулируются одним кортизоном (Klaiber и соавт., 1968). Mobbs и соавторы (1973) установили, что надпочечники стимулируют в большей мере функцию предстательной железы, чем рост.
Tissell (1972), Santti и Jahansson (1973) допускают, что гормоны щитовидной железы выступают в роли медиаторов действия пролактина на предстательную железу.
Связь между гипоталамусом и предстательной железой проследили Г. И. Назаришвили и Г. А. Гачуа (1974). Разрушение супраоптических и паравентрикулярных ядер гипоталамуса уже на 3—7-й день после операции вызвало отек стромы и дистрофические изменения выстилающего эпителия предстательной железы, а через 1 мес — гиперплазию эпителия, стромы и мышечных элементов. По мнению авторов, разрушение ядер переднего гипоталамуса явилось причиной развития аденомы предстательной железы в эксперименте. Это они трактуют как следствие выпадения пролактинтормозящей функции гипоталамуса.
Далее в мембране инхерстициальных клеток яичек под действием гонадотропных гормонов и пролактина активизируются аденилциклазная система и ферменты стероидогенеза. В результате этого происходит запуск биосинтеза половых гормонов, которые селективно захватываются предстательной железой и стимулируют ее рост, развитие и функциональную активность. При этом не исключается и прямое действие гипофизарных гормонов на уровне предстательной железы.
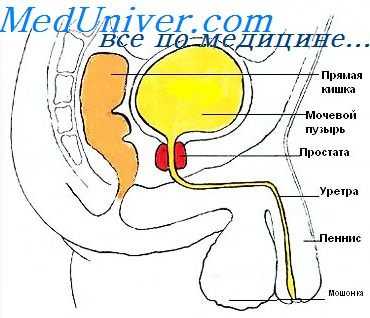
Возрастные изменения яичек
В пожилом и старческом возрасте наблюдается возрастная инволюция гонад, сопровождающаяся снижение их массы (А. А. Топчян, 1972; В. А. Добрынин, С.Б. Петров, 1975). При микроскопическом исследовании в яичках пожилых мужчин и старых животных обнаруживаются характерные возрастные нарушения: дегенеративные изменения эпителиальной ткани и относительное разрастание соединительнотканных компонентов, выраженный склероз сосудов, резкое угнетение или полное прекращение сперматогенеза (Б. В. Троценко, В. И. Мизин, 1973; Mauss, 1975). Количество интерстициального эндокриноцита с возрастом уменьшается; гормонопродуцирующая способность их резко снижается (Pirke, Doerr, 1975; Ihanadian и соавт., 1975).
Длительное время велись дискуссий о содержании половых гормонов у пожилых мужчин. Согласно данным Kent, Acone (1966), Mahoudeau (1974), количество их не меняется до глубокой старости. Однако большинство исследователей отметили зависимость между гормональной продукцией яичек и возрастом.
В связи с установлением возрастных изменений уровня половых стероидов возникает вопрос об адекватности применяемых методрв исследования. Продукцию половых стероидов можно оценить путем определения их в сперматической вене, в циркулирующей крови либо в моче. Мы считаем наиболее информативным, способ определения их в моче. В сперматической вене у старых мужчин уровень тестостерона ниже, чем у молодых (Morer-Fargas и соавт., 1966; Backer, 1976).
Определяя содержание андрогенов в вене яичек у мужчин в возрасте 20—70 лет, Serio и соавторы (1979) отметили не только снижение в старости концентрации этих гормонов, но и изменение соотношения между отдельными фракциями. Так, у мужчин 60—70 лет (по сравнению с 20—40-летними) уменьшение тестикулярной продукции андростендиона выражено в меньшей степени, чем тестостерона. Вследствие этого соотношение тестостерона и андростендиона уменьшалось, что свидетельствует о преобладании менее активного андростендиона.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Мужской климакс - симптомы и лечение
Что такое мужской климакс? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Валерьевича, уролога со стажем в 28 лет.
Над статьей доктора Скатова Бориса Валерьевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Мужской климакс — это возрастное снижение половой функции мужчины, сопровождающееся патологической симптоматикой на фоне изменения концентрации гонадотропных гормонов в крови. Термин впервые был применён доктором Вернером в 1939 году для описания симптомокомплекса 50-летних мужчин, у которых на фоне потери сексуального желания развивалась быстрая утомляемость, депрессия, нервозность, ухудшался сон, снижались внимание и память, возникали приливы «жара» и потливости.
Так как у мужчин, в отличие от женщин, нет определённых возрастных периодов резкого снижения концентрации половых гормонов в организме, отсутствует явное прекращение репродуктивной функции, говорить о «мужском климаксе» не совсем корректно. Дело в том, что слово «climax» в переводе с латинского означает «ступенька на лестнице», что вполне укладывается в быстрое, скачкообразное изменение женского гормонального статуса. Но определение совершенно не отражает подобный эндокринный сдвиг у мужчин, у которых этот процесс имеет размытое начало, характеризуется постепенным характером развития и растягивается на многие годы.
Достаточно широко для определения этого сложного периода в жизни мужчины применяется термин «андропауза» (пауза в мужской функции). Однако данный термин также является не совсем правомочным, так как полного прекращения выработки андрогенов в мужском организме не происходит никогда.
В 1994 году «Австрийское урологическое общество» предложило термин «PADAM» – partial androgen deficiency of aging male, что звучит как «частичная андрогенная недостаточность мужчин пожилого возраста». Именно этот термин стал наиболее приемлемым для определения возрастного андрогенного дефицита. [1]
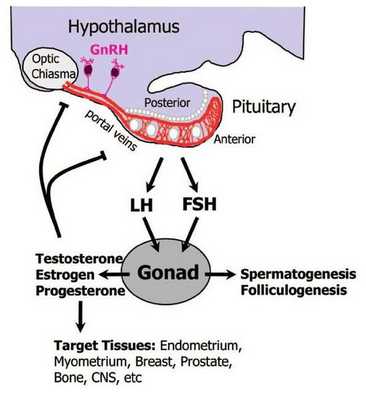
Основная причина мужского климакса — постепенное снижение уровня тестостерона, изменение концентрации других гонадотропных гормонов (либеринов гипоталамуса и лютропинов гипофиза) в результате естественного старения мужского организма.
Кроме того, имеется ряд причин, которые провоцируют ранее развитие мужского климакса:
- вредные привычки (алкоголь, курение, половые излишества, злоупотребление жирной пищей);
- нервный стресс, работа «на износ»;
- повреждения и аномалии половых органов, кастрация;
- различные эндокринные заболевания;
- воспалительные заболевания, в том числе передающиеся половым путём;
- воздействие радиации, различных токсических факторов;
- приём определённых лекарственных препаратов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
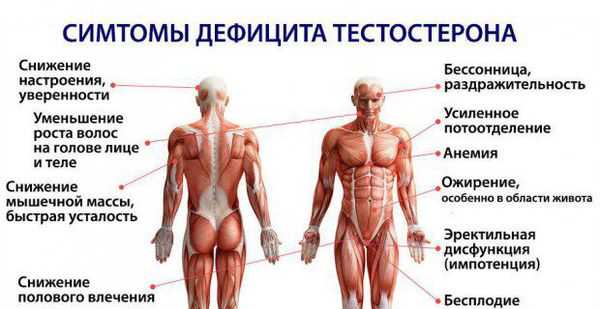
Симптомы мужского климакса
1. По центральной нервной системе:
- быстрая утомляемость;
- нарушение когнитивных (интеллектуальных и творческих) функций;
- депрессии;
- неустойчивость настроения;
- нарушение сна.
2. По сердечно-сосудистой системе:
- неожиданные перебои в работе сердца;
- боли в области сердца без изменений на ЭКГ.
3. По вегетативной нервной системе:
- потливость;
- приливы «жара»;
- выраженная сухость кожных покровов.
4. Кожа, волосы:
- снижение эластичности кожи;
- снижение секреции сальных желёз;
- выпадение волосяного покрова головы, рук, ног, груди;
- появление пигментных пятен в разных участках тела.
5. Мочеполовая система:
6.Опорно-двигательный аппарат:
- уменьшение выносливости и силы;
- уменьшение мышечной массы, даже при физических нагрузках;
- остеопороз, боли в костях.
7. Эндокринная система:
- ;
- гинекомастия (увеличение грудных желёз);
- снижение либидо (полового влечения). [2]
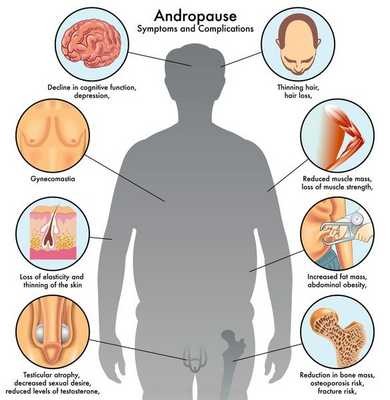
Патогенез мужского климакса
Эндокринные возрастные изменения связаны с процессами естественного старения. Старение является нормальным физиологическим процессом. В этот период происходят изменения всех органов и тканей с общей тенденцией к их атрофии и снижению функциональных резервов. [3]
Причины и механизмы старения до конца не выявлены. Существует ряд теорий:
- Теория запрограммированности:процесс старения предопределён в генах, и смерть есть предопределённое самоубийство. [4]
- Мутационная теория— с возрастом накапливаются спонтанные мутации, особенно в митохондриальной ДНК, которые влияют на все органы и организм в целом. [5]
- Аутоиммунная теория— к старости вырабатываются аномальные вещества, которые распознаются иммунокомпетентными клетками (лимфоцитами, плазматическими, тучными клетками) как чужеродные. В результате образуются специфические антитела, вызывающие необратимые повреждения клеток стареющего организма.
- Теория повреждения клеток кислородными радикалами— образуются в ходе окислительного обмена и повреждают жизненно важные молекулы.
- Теория накопления вредных продуктов метаболизма — к смерти приводит увеличение количества некоторых соединений (например, липофусцина), которые повреждают клетки и ткани.
- Климактерический период мужчины — результат возрастной перестройки всего мужского организма на протяжении его жизни. Постепенно, по мере старения, увеличивается тропность гипоталамуса к тестостерону. Также происходит повышение концентрации в крови гонадотропинов. Основной же причиной снижения тестостерона является снижение кровотока в тканях яичка, что также приводит к резкому снижению рецепторов в тестикулах, а это ещё более усугубляет ситуацию.
Классификация и стадии развития мужского климакса
Следует различать два основных состояния возрастного андрогенного дефицита:
- Абсолютный дефицит тестостерона — снижение общего тестостерона ниже 12 нмоль/л;
- Относительный дефицит тестостерона — снижение уровня основного мужского гормона в динамике, по годам, но не выходящее за референтные значения нормы.
По времени проявления симптомов климакс подразделяется на:
- ранний (до 45 лет);
- обычный (46-60 лет);
- поздний (после 60).
По клиническим проявлениям:
- с сердечно-сосудистой симптоматикой;
- с психоневрологической симптоматикой;
- с эндокринными нарушениями;
- с нарушениями в мочеполовой сфере. [5]
Г.С. Васильченко выделяет 3 варианта протекания мужского климактерического периода:
- спокойное угасание мужской функции (44%);
- экзальтация с ускоренной эякуляцией (30%);
- ажитированно-невротический вариант (26%). [6]
Осложнения мужского климакса
- быстрый набор массы тела;
- развитие заболеваний сердечно-сосудистой системы, гипертонической болезни;
- расстройства памяти на недавние события, неспособность запоминать числа, имена, фамилии;
- снижение слуха, особенно на высокие тона;
- дегенеративные изменения яичек;
- развитие сахарного диабета, подагры;
- развитие пареза кишечника (запоры);
- невротические и психические нарушения, связанные со страхом потери половой функции.
Некоторые из мужчин утрачивают интерес к любимой профессии, семье, а иногда и к жизни (см. художественный фильм с Олегом Янковским «Полёты во сне и наяву»).
Супруга может наблюдать у мужа беспочвенные приступы ревности. В семье появляется ощущение обречённости. Именно в это время статистика выявляет пик разводов. Мужчины, цепляясь за уходящую молодость, оставляют свою семью, уходя к более молодой любовнице, либо бросаются «во все тяжкие». Такой период в жизни мужчины в народе метко окрестили «седина в бороду, бес в ребро».
Диагностика мужского климакса
Диагностика мужского климакса включает в себя следующие обязательные исследования:
- опрос с оценкой симптомов старения мужчины по системе «Aging Males Symptoms»;
- заполнение анкеты «Международного индекса эректильной дисфункции»;
- оценка компонентов копулятивного цикла по шкале «Международного индекса эректильной дисфункции»;
- общий анализ крови (формула);
- общий анализ мочи с микроскопией осадка;
- биохимический анализ крови (мочевина, креатинин, глюкоза, холестерин, триглицериды, липопротеиды высокой плотности, аланинаминотрансфераза, аспартатаминотрансфераза, липопротеиды низкой плотности);
- исследования ПСА (простат-специфического антигена) в крови;
- исследование гормонального статуса (общий и связанный тестостерон, индекс свободного тестостерона, пролактин, ФСГ — фолликулостимулирующего гормона, ЛГ — лютеинизирующего гормона, эстрогенов, ГСПГ и др.);
- определение суточного ритма тестостерона;
- спермограмма;
- проба Риголи-Гольяны на насыщенность организма андрогенами;
- электрокардиограмма;
- дневник артериального давления;
- исследование неврологического статуса у врача-невролога;
- ТРУЗИ простаты (трансректальное исследование предстательной железы);
- УЗИ органов мошонки;
- исследование метаболизма костной ткани;
- МРТ (магнитно-резонансная томография) головного мозга с целью исключения опухоли гипофиза (выявляется в более 10 % случаев, по данным разных авторов). [7]
Лечение мужского климакса
Терапия мужского климакса — процесс непростой и трудоёмкий, зависит от многих факторов: выраженности климактерического периода, характера жалоб и клинических проявлений, симптомов, возраста и т. д. Решается вопрос о назначении разных симптоматических препаратов (улучшающих состояние), физиотерапии, отвлекающей терапии. Тем не менее, врач-андролог должен решить главный вопрос для пациента — о назначении заместительной гормональной терапии. Речь идёт в первую очередь о назначении препаратов тестостерона.
Ещё в далёком 1940 году были предприняты успешные попытки лечения мужского климакса эфиром тестостерона — препаратом «тестостерона пропионат» (Thomas H.B., Hill R.T.). Однако после этого заместительная терапия андрогенами пожилых мужчин не обсуждалась среди врачебного сообщества. Считалось, что изменения, происходящие со зрелым мужчиной, носят естественный «физиологический» характер. Первые препараты тестостерона были несовершенны — обладали токсическим действием на печень, могли вызывать онкологию. На сегодняшний день синтезированы новые формы тестостерона, свободные от этих недостатков, позволяющие проводить полноценную заместительную гормональную терапию. Это прежде всего такой препарат, как «Небидо» и некоторые другие формы тестостерона.
Основной целью заместительной гормональной терапии андрогенного дефицита является уменьшение клинических симптомов, улучшение общего состояния. Данная терапия позволяет повысить физическую активность, улучшить половое влечение, нивелировать психические расстройства, повысить плотность костей и даже нарастить мышечную массу.
Но, повторюсь, вопрос о назначении препаратов тестостерона решается в каждом случае индивидуально, зависит от показателей гормонального фона и многих других факторов с учётом всех показаний и противопоказаний. [8]
Прогноз. Профилактика
Мужской климакс — естественный возрастной этап жизни мужчины, поэтому его чрезвычайно сложно предотвратить. Тем не менее, достижения современной андрологии и геронтологии позволяют существенно улучшить качество жизни пациента с этой проблемой. Залогом мужского и возрастного долголетия является ежегодное профилактическое посещение уролога-андролога, физическая и умственная активность, здоровый образ жизни, отказ от алкоголя и курения. Одной из эффективных составляющих профилактики мужского климакса является регулярная сексуальная активность, это позволяет отодвинуть патологические симптомы на более поздний срок, а то и вовсе «сгладить» возникновение нежелательных проявлений климакса. Профилактика раннего и патологического мужского климакса во многом связана с профилактикой преждевременного старения в целом. [9]
Старческое снижение функции яичек. Снижение выработки андрогенов
Важно отметить, что в старости продукция андрогенов резко снижена в основном за счет выработки мужских половых гормонов в яичках. Такому гормональному фону соответствует увеличение содержания гонадотропных гормонов в гипофизе. Указанные гормональные сдвиги характерны для всех млекопитающих и человека.
Снижение продукции половых гормонов яичками приводит к значительным изменениям в гипоталамо-гипофизарной системе. В частности, у лиц старше 40 лет усиливается секреция фоллитропина и лютропина (Backer, 1976; Hammond и соавт., 1977). У мужчин 56—69 лет повышаются уровень лютропина в крови и содержание андрогена, связанного с протеином (Hallberg и соавт., 1976).
Интересно отметить, что гонадотропин поглощается яичками одинаково у старых и молодых крыс, однако секреция тестостерона при, этом значительно ниже у старых животных (Pirke и соавт., 1979).
Наряду с усилением гонадотропной активности гипофиза в старческом возрасте увеличивается и содержание пролактина. Negro-Vilar и соавторы (1973) доказали, что чувствительность гипоталамо-гипофизарной системы к избыточной продукции тестостерона с возрастом уменьшается. Это может отразиться на функции предстательной железы.
Нервное сплетение предстательной железы с возрастом становится менее выраженным, нервные стволики имеют меньшее количество волокон, уменьшаются число сосудов и их диаметр (Л. Г. Ратнер, 1957).
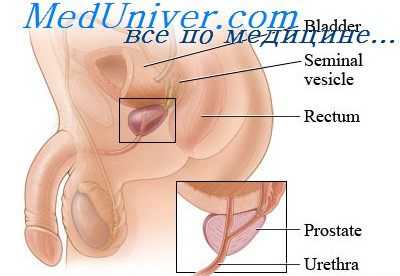
Микроскопически в предстательной железе у стариков наблюдаются дегенеративные изменения железистой паренхимы и миоэпителиальных элементов на фоне разрастания соединительнотканной стромы. Это характерно для склероза органа (Haugen, 1973). При этом уменьшается поглощение тестостерона предстательной железой (Ihanadian и Fotherby, 1975).
Shain и Axelrod (1973) отметили, что связывающая способность цитозоля, продуцируемого предстательной железой старых крыс, ниже, чем выделяемого железой молодых животных.
В пораженной склерозом предстательной железе снижается активность изомеразы, в результате чего уменьшается превращение ДГЭА в тестостерон (Hampl и соавт., 1972). Образование ДГТ из тестостерона в ней составляет всего лишь 2,4 % по отношению к введенному тестостерону, 5а-андростандиола-3бета, 17бета — 2,1%. Однако в основном тестостерон трансформирует 5а-редукцин.
Андростендион в пораженной склерозом железе почти не обнаруживается, что свидетельствует об отсутствии 17-окислительного пути обмена (Hampl и соавт., 1972). В этих условиях снижается содержание РНК и ДНК в предстательной железе, что приводит к уменьшению уровня протеина в предстательных клетках (Ihanadian и Fotherby, 1975). На, фоне угнетения биосинтетических процессов в предстательной железе уменьшается содержание лимонной кислоты, а также кислой и щелочной фосфатаз. Однако в процессе метаболизма тестостерона появляются фенольные стероиды (Hampl и соавт., 1972).
При введении эстрогенов снижается секреторная активность предстательной железы, а спустя 2 нед после начала инъекций прекращается совсем (Johnson и соавт., 1969). При этом атрофируется лишь кортикальная часть предстательной железы, в то время как в мозговой (эстрогенозависимой) зоне пролиферируется соединительная и гладкомышечная ткань. В этих условиях путь обмена тестостерона изменяется на окислительный с преимущественным образованием андростендиона (Leav и соавт., 1971).
Старческие изменения предстательной железы. Влияние кастрации на простату
Структурные и функциональные нарушения в предстательной, железе, наблюдаемые в пожилом и старческом возрасте и могущие иметь патогенное значение, протекают параллельно с изменением гормональной продукции яичек и гипофиза. Снижение уровня андрогенов на фоне относительного увеличения содержания эстрогенов и абсолютного нарастания гонадотропных гормонов в условиях изменения чувствительности к ним могут способствовать развитию гиперплазии предстательной железы.
Эти процессы следуют за гормональными возрастными сдвигами. По мере возрастной инволюции половых желез и системы гипоталамуса—гипофиз увеличивается частота заболеваний предстательной железы у мужчин. До 40 лет гиперплазия этого органа наблюдается очень редко (В. И. Бондаренко, 1956; Л. Я. Шницер, 1959; В. В. Бялик и В. Г. Пинчук, 1977), а у лиц старше 40 лет она выявляется в 42—58 % случаев. После 70 лет бывает у 77—100 % мужчин (В. В. Бялик и соавт., 1968; Haugen, 1972; Franks, 1974).
По данным А. И. Гладковой и соавторов (1977), размеры и функция предстательной железы собак зависят от возраста и гормональной продукции. Увеличивается предстательная железа у старых животных как правило, за счет выраженного разрастания межуточной соединительной ткани при атрофии железистой паренхимы и миоэпителиальных элементов.
Эти изменения характерны для склероза органа и возникают на фоне абсолютного понижения биосинтеза андрогенов в яичках и относительного преобладания секреции андростендиона над секрецией тестостерона, экскрецией этиохоланолона над экскрецией андростерона и фенольных кетостеройдов над 17-кетостероидами. Данные гормонального нарушения сопровождаются склеротическими либо аденоматозными изменениями в предстательной железе. Но при злокачественном перерождении предстательной железы андрогенная активность значительно усилена.
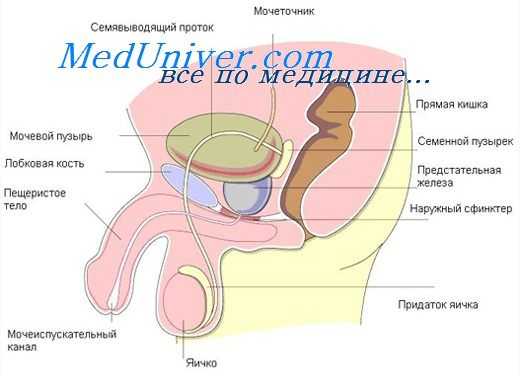
Влияние кастрации на простату
При кастрации ослабляется функциональная активность предстательной железы (Harkin и соавт., 1957). Парапростатические железки теряют свое содержимое (А. Г. Бобков, 1960). Постепенно уменьшается масса цитоплазмы клеток предстательной железы и атрофируются цито плазматические компоненты (Pegg, William-Ashman, 1968).
Кастрация взрослых крыс сопровождается значительным уменьшением массы вентральной доли предстательной железы (Singhal, 1976).
Согласно данным Ю. И. Денисова-Никольского (1972); Moore и Wilson (1973), через 1 мес после гонадзктомии масса предстательной железы составляет лишь 25—30 %. Мы также наблюдали подобные изменения в эксперименте на собаках.
Микроскопическое изучение срезов предстательных желез кастрированных собак показало, что уменьшаются они за счет полной атрофии железистого эпителия и миоэпителиальных элементов. Предстательная железа кастрированной собаки состоит лишь из мощных тяжей фиброзной грубоволокнистой соединительной ткани.
При кастрации резко снижается содержание фолиевой кислоты в предстательной железе и семенных пузырьках, что приводит к нарушению синтеза пуринов и пиримидинов (Marchetti и соавт., 1972). Снижение активности уриказы в предстательной железе кастрированных животных (Anderson и соавт., 1970) указывает на ослабление превращения мочевой кислоты в аллантоин, который необходим при распаде пуринов и утилизации энергии фосфатной связи.
У кастрированных животных снижается активность как НАД-пирофосфорилазы, участвующей в утилизации глюкозы, так и глюкозо-6-фосфатазы, расщепляющей глюкозо-6-фосфат до свободной глюкозы с освобождением энергии (Anderson и соавт., 1970; Singhal и соавт., 1978).
Атрофия яичек ( Первичный гипогонадотропный гипогонадизм , Тестикулярная атрофия )
Атрофия яичек – это уменьшение массы и объема половых желез, сопровождающееся нарушением функции или полным ее прекращением. Симптомы зависят от времени возникновения: в период предпубертата атрофия яичек сопровождается нарушением полового созревания, у взрослых мужчин развиваются эректильная дисфункция и бесплодие, связанные с андрогенной недостаточностью. Диагностические мероприятия коррелируют с клинической ситуацией: оценивают гормональный фон, спермограмму, выполняют УЗИ мошонки, проводят тестирование на ИППП. Лечение назначают с учетом патогенеза, чаще применяют препараты на основе тестостерона.
МКБ-10
Общие сведения
Атрофия яичек (тестикулярная атрофия, первичный гипогонадотропный гипогонадизм) – приобретенная патология. Наиболее часто процесс развивается в результате злоупотребления анаболическими стероидами и наркотическими препаратами, а также после проведения лучевой терапии в ходе лечения опухолевых процессов яичка и органов малого таза. У пациентов старше 60 лет симптомы связаны с естественным уменьшением продукции андрогенов (вариант нормы). Отличием атрофии от гипоплазии является изначально нормальный размер тестикул, наличие полностью развитых клеточных структур и факт их полноценного функционирования.
Причины
Существует много причин, способствующих развитию тестикулярной атрофии; чаще патология связана с внешними факторами. Одним из самых распространенных инициаторов процесса считают гормональный дисбаланс. Иногда нарушение гормонального фона развивается первично, но обычно расстройство является следствием или побочным эффектом приема лекарств либо других методов лечения, например, прохождения лучевой терапии. К состояниям, которые потенциально вызывают атрофию, относят:
- Варикоцеле, перекрут яичка. Расширение вен семенного канатика вызывает избыточный приток крови к яичку. Гибель сперматогенного эпителия и уменьшение размера органа связано с воздействием повышенной температуры. Перекрут семенного канатика при несвоевременной помощи за 6 часов может привести к атрофии яичка из-за прекращения поступления крови.
- Травмы, операции. Травма паховой области, операции на гениталиях или по поводу паховой грыжи при повреждении иннервирующих структур потенцируют трофические расстройства. Иногда отсроченное низведение с орхипексией при двустороннем крипторхизме приводит к гибели функционирующих клеток, уплотнению тестикул. Опасность такого состояния – риск развития опухолевого процесса. Как повреждающий фактор рассматривают прохождение лучевой и химиотерапии.
- Воспалительно-инфекционные процессы. Бактериальный орхит часто развивается при ИППП (хламидиозе, гонорее). К способствующим обстоятельствам относят длительную катетеризацию, рецидивирующие ИМВП. Вирусный орхит чаще диагностируют на фоне эндемического паротита. Атрофия яичек является распространенным явлением при ВИЧ-инфекции и туберкулезном поражении тестикул.
- Заместительная терапия тестостероном. Доказано, что атрофия яичек развивается у лиц, длительно получающих гормональные препараты. Это объясняется тем, что экзогенное введение гормона нарушает работу гипоталамо-гипофизарно-гонадной оси. К эндокринным железам поступает команда не вырабатывать собственный тестостерон, поскольку он уже в достаточном количестве циркулирует в крови.
- Прием анаболических стероидов, эстрогенов. Использование анаболиков для достижения успехов в спорте, наращивания мышечной массы вызывает тот же эффект, что и заместительная гормональная терапия тестостероном. Эстрогены назначают при раке простаты для подавления синтеза андрогенов, поскольку опухоль в большинстве наблюдений гормонозависима от тестостерона.
К предрасполагающим факторам относят ожирение, хроническую алкогольную интоксикацию, способствующие гипоандрогении и повреждению тестикулярных структур. В основе процесса лежит дегенерация зародышевого эпителия с замещением функциональной ткани на соединительную. У мужчин в период андропаузы синтез тестостерона снижается, что влияет на размеры яичек. Процесс считается физиологическим. Менее распространенными причинами патологии являются гипопаратиреоз, гемохроматоз, тяжелые заболевания печени и почек.
Патогенез
Яички состоят из двух разных типов клеток. Сперматогенный эпителий извитых семенных канальцев вырабатывает сперматозоиды, а клетки Лейдига – половой гормон тестостерон. При атрофии один или оба типа клеток постепенно отмирают, что влечет нарушение сперматогенеза (в последующем – бесплодие), способствует появлению симптомов андрогенодефицита и расстройству сперматогенеза. Ядовитые субстанции инициируют клеточную гипоксию, поскольку обладают конкурирующей способностью вытеснять кислород в молекуле гемоглобина при токсическом поражении эритроцитов.
Патологическое влияние на мужские половые железы оказывает инфекционно-токсический фактор. При хронических и острых интоксикациях регистрируют прямое воздействие на генеративные структуры желез и непрямое – из-за нарушения барьерной функции печени, поражения ЦНС. Прием эстрогенов ведет к склерозированию, замещению функциональных структур соединительнотканными элементами. Повреждение подвздошно-подчревного нерва во время грыжесечения или на фоне рубцовых изменений в послеоперационном периоде вызывает атрофию яичек вследствие нарушений иннервации.
Симптомы атрофии яичек
При развитии патологии до наступления пубертата симптомы включают отсутствие вторичных половых признаков: нет оволосения на лице, в лобковой зоне, подмышках, имеет место недоразвитие пениса, отставание в развитии. Если процесс начался после 16 лет, характерно снижение либидо, уменьшение мышечной массы при нормальном размере члена, гинекомастия. Яички мягкие при пальпации, размер не соответствует возрасту. Рост волос на теле выражен слабо. При семяизвержении уменьшен объем эякулята, сперма водянистая, оргастические ощущения стерты.
Гипоандрогенемия проявляется астеническими симптомами: усталостью, склонностью к депрессиям. Пациенты предъявляют жалобы на когнитивные нарушения, типично ухудшение памяти, способности к концентрации внимания. При выраженной андрогенной блокаде периодически возникают приливы, аналогичные таковым у женщин в период менопаузы, сопровождающиеся покраснением лица, обильным потоотделением, сердцебиением. Атрофия одного яичка не приводит к столь значимым клиническим проявлениям, могут наблюдаться некоторые симптомы гипогонадизма.
Осложнения
Последствия длительно существующего дефицита андрогенов включают нарушение сексуальной функции, бесплодие. Неправильный метаболизм, связанный с атрофией желез, приводит к отложению жира в области живота, ягодиц и бедер (ожирение по женскому типу), заболеваниям сердечно-сосудистой системы. Пациенты с симптомами гипогонадизма более подвержены развитию стойкой гипертонии, инфаркта, инсульта. Гипоандрогения в 2-4 раза повышает вероятность присоединения сахарного диабета. При атрофии (чаще на фоне крипторхизма) нередко формируются опухоли яичек.
Осложнением патологического процесса является уменьшение плотности костной ткани (остеопороз), при котором вероятность переломов даже после незначительного травматического воздействия возрастает из-за вымывания кальция. Доказано, что отсутствие адекватной терапии при гипотестостеронемии увеличивает риск смертности мужчин старше 45-50 лет на 78%. Пациенты с недиагностированной патологией часто страдают от депрессивных расстройств.
Диагностика
После анализа жалоб врач-андролог переходит к физикальному осмотру. Специалист обращает внимание на размеры тестикул, их консистенцию, состояние придатков. Мягкие нечувствительные яички свидетельствуют о нарушении функций органа. После перенесенного воспаления может пальпироваться утолщенный придаток. Дистрофии способствуют мошоночные грыжи, кисты больших размеров, двустороннее гидроцеле. Пальпация простаты подтверждает уменьшение ее размеров, тестоватую консистенцию. Диагностика включает:
- Лабораторные анализы. Спермограмма при полной атрофии яичек показывает азооспермию. Патологические формы сперматозоидов подозрительны на генетическую патологию. Для исключения воспалительного генеза выполняют ПЦР-анализы на ИППП, посев эякулята на флору. По показаниям назначают исследование гормонального профиля, биохимию крови. Атрофия яичек подтверждается низким уровнем тестостерона с повышением гормонов ФСГ, ЛГ. Проба с ХГЧ отрицательна.
- Инструментальное обследование. УЗИ органов мошонки визуализирует отклонение размеров половых желез от нормы (длина менее 4-5 см, толщина менее 2,5-2 см для взрослого мужчины). МРТ и КТ более показательны при диагностике двухстороннего опухолевого процесса. Если патология возникла до полового созревания, рентгенография подтверждает отставание костного возраста от паспортного. Денситометрия дает возможность определить минеральную плотность костной ткани.
Дифференциацию проводят с врожденной гипоплазией тестикул, гипогонадизмом центрального генеза (при опухолях гипофиза, гипоталамуса). Физикальный осмотр не позволяет отличить приобретенную атрофию желез от врожденной гипоплазии, поэтому план обследования составляют в зависимости от клинической картины в целом. При подозрении на генетические синдромы, одним из симптомов которых является гипогонадизм, обоснована консультация генетика.
Лечение атрофии яичек
Терапевтические мероприятия зависят от возраста пациента, сопутствующей патологии, степени выраженности гипоандрогении. Лечение обычно направлено на коррекцию основной причины. Тотальная атрофия яичек зачастую необратима, симптомы нивелируются проведением ЗГТ тестостероном. Гормональная терапия противопоказана больным раком грудной железы, простаты (до стабилизации состояния в течение нескольких лет). Возможность последующего использования тестостерона при карциноме предстательной железы до сих пор остается дискутабельной.
Консервативное лечение
Современная фармакология располагает множеством форм для комфортного введения препаратов естественного тестостерона: трансдермальные пластыри, внутримышечные, подкожные инъекции, в том числе с пролонгированным действием. У возрастных пациентов с атрофией яичек в процессе терапии оценивают уровень ПСА – онкомаркера рака предстательной железы, при повышении показателя гормоны отменяют. Для возможности быстрой отмены препарата мужчинам старше 45 лет обычно назначают средства короткого действия. Важно избегать суперфизиологического уровня андрогенов в крови.
Из-за развития полицитемии на фоне терапии в течение первого года показатели крови контролируют каждые 3 месяца, в дальнейшем 1 раз в год. Отсутствие эффекта подразумевает отмену лечения. Некоторым пациентам с сексуальной дисфункцией недостаточно одного проведения ЗГТ, поэтому в схему включают ингибиторы фосфодиэстеразы-5. Как правило, тестостерон стабилизирует эмоциональное состояние больного, при дополнительном приеме антидепрессантов некоторые из них могут отрицательно влиять на сперматогенез.
При использовании половых гормонов на фоне лечения нивелируются симптомы андрогенодефицита, но собственная выработка половых клеток ухудшается. Поэтому при важности перспективы отцовства оптимальные подходы к терапии лучше обсудить с андрологом. Регулярные физические упражнения, достаточное потребление кальция позволяют уменьшить или предотвратить симптомы остеопороза. На прочность костей также влияет витамин Д, прием которого особенно необходим мужчинам, проживающим в районах, обедненных круглогодичным солнечным светом.
Хирургическое лечение
В некоторых случаях прибегают к трансплантации донорского органа, что позволяет пациенту не зависеть от пожизненного приема гормонов. Вариантов местоположения пересаженной мужской половой железы несколько: под кожу бедра или передней брюшной стенки, в прямую брюшную мышцу. При пересадке по Кирпатовскому яичко помещают в мошонку, но кровоснабжение органа осуществляется через более крупные сосуды, которые ранее анатомически не питали железу. Это позволяет добиться лучших результатов, уменьшить риск отторжения трансплантата на фоне ишемии.
Другие виды операций при атрофии яичка направлены на ликвидацию способствующей причины: при крипторхизме выполняют низведение органа, орхопексию (подшивание), при этом важно наблюдение в динамике, поскольку длительное тепловое воздействие на железу в брюшной полости рассматривается как фактор риска возникновения опухоли. При варикоцеле хирургическим путем нормализуют кровообращение в венах семенного канатика. Привычная или острая гидатида подразумевает орхопексию для обеспечения неподвижности яичка.
Прогноз и профилактика
Витальный прогноз благоприятный, но атрофия яичек и развившееся бесплодие в ряде случаев носят необратимый характер. Для некоторых мужчин единственной возможностью стать отцом биологически родному ребенку остаются вспомогательные репродуктивные технологии – ЭКО методом ИКСИ после извлечения сперматозоидов при тестикулярной биопсии. Регулярный прием гормональных препаратов позволяет сохранять нормальное качество жизни.
Профилактика подразумевает отказ от алкоголя, курения. Недопустим самостоятельный прием кортикостероидов для улучшения спортивной карьеры, особенно в период пубертата. Мужчине необходимо максимально ограничить контакт с промышленными ядами: этиламином, аммиаком, органическими перекисями и солями тяжелых металлов. Важны регулярные осмотры уролога и андролога для выявления предрасполагающих состояний. Своевременное обращение к специалисту при синдроме острой мошонки позволяет предотвратить процесс некротизации и атрофии яичек.
1. Клинические рекомендации по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин/ Российская ассоциация эндокринологов – 2016.
2. Андрология. Мужское здоровье и дисфункция репродуктивной системы/ под ред. Нишлага Э., Бере Г.М. — 2005.
4. International web survey shows high prevalence of symptomatic testosterone deficiency in men/ Trinick TR, Feneley MR, Welford H, Carruthers M.// TheAgingMale – 2015 - №1.
Читайте также:
