Старение стволовых клеток. Механизмы самоподдержания стволовых клеток
Добавил пользователь Евгений Кузнецов Обновлено: 25.01.2026
Antiaging — Effect of Stem Cells on Aging and Stem Cell Aging
Jisook Moon and Sang-Hun Bae, College of Life Science, Department of Bioengineering, CHA University, Seoul, Korea.
Глава из сборника Progress in Stem Cell Transplantation
Edited by Taner Demirer, издательство InTech, 2015.
Перевод: Евгения Рябцева
В широком смысле старение является нормальным прогрессирующим процессом, сопровождающимся усугублением предрасположенности к заболеваниям и смерти. Тот факт, что процесс старения неизбежен, но поддается регулированию, делает его привлекательной мишенью для исследований, посвященных изучению ассоциированных с возрастом молекулярных изменений. Основная проблема при этом заключается в расшифровке базовых механизмов старения с помощью традиционных экспериментальных подходов, что обусловлено сложностью процесса старения и множественностью вносящих в него вклад факторов.
Это свидетельствует о необходимости изучения старения одновременно во многих аспектах. По этой причине в настоящее время процесс старения изучается с помощью так называемых «-омик» (OMICS), в том числе геномики, транскриптомики, протеомики и метаболомики, что позволяет проводить многофакторное изучение возрастных изменений. Все это указывает на существование потребности в новых подходах к расшифровке биологических основ старения на различных молекулярных уровнях, результаты которой способны углубить наше понимание фундаментальных аспектов биологического старения и долголетия.
Для процесса старения характерно постепенное кумулятивное повреждение структуры и функций стволовых клеток, происходящее на протяжении всей жизни организма. В данной статье обсуждаются интегративные исследования старения стволовых клеток и терапевтический эффект взрослых стволовых клеток, в том числе клеток пуповинной крови, и основополагающие механизмы этого сложного процесса на различных молекулярных уровнях, конечной целью которых является практическое применение стволовых клеток в терапии пожилых людей для поддержания их здоровья. Помимо этого обсуждается интегративный метод – технологии класса «-омик», – способный помочь нам разобраться в сложной биологии старения.
Старение можно рассматривать как процесс, в котором пул эндогенных стволовых клеток с возрастом прогрессивно утрачивает свою способность замещать поврежденные клетки. Почти для всех живых организмов зависимое от времени угасание регенеративного потенциала стволовых клеток несет ответственность за повышенную предрасположенность к старению и ряду возрастных болезней. Пониженная регенеративная способность эндогенных стволовых клеток частично объясняется повреждениями ДНК, изменениями ниш стволовых клеток и активацией гена-супрессора опухолевого роста. Однако неясно, до какой степени эти факторы способствуют старению человека, в особенности старению стволовых клеток, и определяют продолжительность жизни. Сложность процесса старения обуславливает потребность в новых подходах к прояснению его многофакторных механизмов.
2. Технологии класса «-омик» и старение стволовых клеток
В последние годы для более глубокого погружения в биологию старения применяются новые высокопроизводительные технологии, известные как «-омики», или OMICS. Они применяются в форме различных подходов для изучения сопровождающих старение молекулярных изменений. К «-омикам» относятся технологии, названия которых содержат суффикс «-омик». Эти технологии, в том числе геномика, транскриптомика, протеомика, метаболомика, разработаны для качественного и количественного анализа пулов молекул на разных уровнях. Исследователи применяют «-омики» в экспериментах, целью которых является выявление взаимосвязи между молекулярными изменениями и старением. Однако на сегодняшний день исследования в данной области преимущественно основываются на изучении образцов крови, содержащих различные типы клеток, и обычно используют одну из «-омик», что затрудняет интерпретацию выявляемого феномена или приводит к ошибочной интерпретации сложного процесса старения.
Еще одним фактором, усложняющим проведение исследований, являются возрастные тканеспецифичные изменения генной экспрессии, еще больше усложняющие интерпретацию процесса. Поэтому альтернативным подходом может быть изучение старения стволовых клеток с помощью «-омик».
Стволовые клетки на протяжении взрослой жизни организма выступают в роли эндогенного источника клеток, замещающих клетки, погибающие в ходе гомеостаза или повреждений. Регенеративная способность разных тканей угасает по мере старения и часто перестает соответствовать потребностям развивающих тканей, что приводит к развитию множества возрастных фенотипов или болезней. В результате в процессе старения накопление нарушений функции может проявляться в различных макромолекулах, начиная от ДНК и заканчивая метаболитами, считающихся наиболее приближенными к фенотипам. Поврежденные макромолекулы, в свою очередь, нарушают сигнальные пути, что способствует возникновению сопровождающей старение дисфункции стволовых клеток и формирует порочный круг. Помимо этого сокращение пулов стволовых клеток, по всей вероятности, ассоциировано с сопровождающим старение функциональным угасанием гемопоэза, нейрогенеза и миогенеза. Поэтому можно предположить, что ключом к задержке процесса старения или его обращению вспять является углубление наших знаний о взрослых стволовых клетках.
Так же, как и другие факторы старения, механизмы, индуцирующие зависящее от времени угасание стволовых клеток, до сих пор остаются малопонятными и поэтому нуждаются в интегративном анализе, для проведения которого можно применить технологии класса «-омик». Понимание молекулярных процессов, вовлеченных в нарушение функционирования стволовых клеток, может пролить свет на причины старения, что в конечном итоге приведет к появлению стратегий предотвращения запуска процесса старения или его обращения вспять.
Поддержание жизнеспособности стволовых клеток или их омоложение обладает большим терапевтическим потенциалом в отношении возрастных нарушений. Например, гетерохронный парабиоз – создание общей кровеносной или физиологической системы между молодым и старым организмом – продемонстрировал свою эффективность в устранении возрастных фенотипов посредством улучшения функционирования стволовых клеток. Одно знаковое исследование парабиоза продемонстрировало, что поступление молодых клеток крови в кровоток старых мышей облегчает проявления нарушений познавательной функции, улучшая пластичность синапсов головного мозга. Результаты еще одного эксперимента продемонстрировали, что под действием ниши мышечной ткани молодых мышей у старых животных происходила регенерация поврежденных сателлитных клеток, что обеспечивало восстановление регенеративного потенциала мышечной ткани.
Получаемые в последнее время данные также подтверждают, что снижение регенеративной способности обратимо и что процесс старения можно отсрочить за счет улучшения функционирования стволовых клеток, что способствует восстановлению поврежденных тканей. Это свидетельствует о том, что воздействие на стволовые клетки разного происхождения может обеспечить восстановление ассоциированных с возрастом дефектов посредством замены поврежденных клеток в стареющих тканях.
По мере расширения сферы применения в настоящее время метаболомика превращается в новый подход к расшифровке вовлеченных в старение механизмов регуляции метаболизма. Метаболиты являются продуктами сложных биологических процессов и могут рассматриваться в качестве конечных реакций на внутренние состояния и внешние воздействия, которые, возможно, способны предоставить новые неожиданные данные о том, каким образом угасание функций стволовых клеток влияет на старение человека. Было продемонстрировано, что окислительный метаболизм и поддержание функционирования митохондрий ассоциированы со старением стволовых клеток. В соответствии с этим, метаболическим состояниям стволовых клеток принадлежит ключевая роль в определении судьбы клеток, которые могут либо пролиферировать, либо дифференцироваться. Оба состояния преимущественно ассоциированы с механизмами, регулирующими баланс между гликолизом и окислительным фосфорилированием. Помимо этого, клинические исследования, посвященные изучению взаимосвязи между старением и метаболическими профилями, продемонстрировали существование сильных корреляций между специфичными для возраста метаболитами, некоторые из которых ассоциированы с окислением жирных кислот, что свидетельствует о важности метаболомики для интерпретации процесса старения.
2.1. Анализ транскриптома нервных стволовых клеток в процессе дофаминовой дифференцировки
В своем исследовании авторы в первую очередь проанализировали изменения экспрессии генов в нервных стволовых клетках в процессе дифференцировки в дофаминергические нейроны и по мере пересевов на новый пассаж в пролиферативном состоянии. Оба эти состояния можно рассматривать как старение: дифференцировку – как компонент «хронологического старения», а увеличение пассажей – как «репликативное старение».
В процессе дифференцировки нервные стволовые клетки продемонстрировали специфичные для этой стадии развития профили генной экспрессии, при этом специфичные гены принимали участие в нейрогенезе посредством формирования молекулярной сети ко-экспрессии.
В условиях поддержания пролиферативного состояния стволовые клетки индуцировали экспрессию генов, белковые продукты которых вовлечены в фосфорилирование, пролиферацию клеток, киназный каскад, реакцию на стресс и передачу сигналов.
Для вступления в фазу дифференцировки характерно повышение экспрессии генов, преимущественно вовлеченных в митотический клеточный цикл, митоз и деление клетки. На поздних стадиях дифференцировки происходит повышение экспрессии генов, ответственных за передачу сигналов в синапсах и регуляцию синаптической пластичности.
Полученные результаты четко продемонстрировали, что в старение клеток в состояниях пролиферации и дифференцировки вовлечены разные биологические процессы, скорее всего, приводящие к синтезу метаболитов, специфичных для разных клеточных состояний.
2.2. Анализ транскриптома при влиянии гипоксии на клетки плаценты по мере увеличения пассажей (пересева)
Помимо этого авторы изучали влияние гипоксии и нормоксии на многократно пересеваемые клетки плаценты на основании данных транскриптома. Онтологический анализ генов показал, что большинство генов, для которых характерна повышенная экспрессия в условиях гипоксии, ассоциированы с пролиферацией клеток, синтезом макромолекул, метаболическими и сигнальными путями, а также клеточным гомеостазом. Это было подтверждено полученными in vitro данными, согласно которым условия гипоксии повышают пролиферативную способность культуры клеток. При этом снижение экспрессии в условиях гипоксии было характерно для генов, ассоциированных с клеточной гибелью/апоптозом и агрегацией белков, что поддерживает гипотезу, согласно которой белковый гомеостаз и баланс между пролиферацией и физиологическим старением критичны для старения стволовых клеток.
Эти данные свидетельствуют о том, что в условиях гипоксии стволовые клетки входят в состояние, характеризующееся повышенной пролиферацией и выживаемостью и подавлением механизмов клеточной гибели и способствующих старению сигнальных путей. На поздней стадии культивирования клеток многие из дифференциально экспрессирующихся в условиях гипоксии генов были ассоциированы со сборкой нуклеосом и организацией хроматина, что свидетельствует о вовлеченности эпигенетической регуляции.
И наконец, авторы составили метаболические профили стареющих мышей, которым были трансплантированы клетки плаценты. Большая часть метаболитов, уровни которых повысились в результате клеточной терапии, были ассоциированы с метаболизмом липидов, что, вероятно, ассоциировано с уникальными профилями генной экспрессии после трансплантации клеток и указывает на целесообразность проведения дальнейших исследований с использований интегрированных данных, полученных с помощью «-омик».
Полученные результаты придают вес мнению, согласно которому изучение старения стволовых клеток с помощью «-омик» является эффективным подходом к расшифровке биологических основ процесса старения.
Эти данные подтолкнули авторов к проведению продолжающегося в настоящее время исследования, в рамках которого старым мышам (старше 23 месяцев) переливают пуповинную кровь человека (самую молодую доступную кровь). Помимо этого проводится клиническое исследование результатов переливания пуповинной крови старым людям. Также в качестве потенциального антивозрастного средства изучаются мезенхимальные стволовые клетки плаценты человека. Эксперименты на животных продемонстрировали улучшение познавательной функции через 12 недель после введения таких клеток. Для проведения дальнейших трансляционных исследований в настоящее время проводится аналитические исследования с помощью технологий класса «-омик».
Характерные для старения физиологические изменения и индивидуальные отличия всегда вызывали затруднения у исследователей, пытающихся разобраться в нормальном процессе старения, что свидетельствует о потребности в новых стратегиях, позволяющих проводить интегративное изучение молекулярных изменений вместо применения традиционных экспериментальных подходов. Технологии класса «-омик» позволяют одновременно оценивать динамические молекулярные изменения на разных уровнях с получением большого количества разных типов данных, что облегчает идентификацию биомаркеров старения/омоложения и, соответственно, предотвращение возрастных заболеваний.
Исследования с использованием «-омик» позволили с новых точек зрения взглянуть на то, какие молекулярные механизмы определяют сложный прогрессирующий процесс, несмотря на то, что еще очень многое еще предстоит прояснить. В частности, в комбинации с геномикой, транскриптомикой и протеомикой изучение метаболического профиля может предоставить беспрецедентные данные о старении. В целом интеграция и контекстно-зависимая интерпретация предоставляемых «-омиками» многогранных данных значительно облегчает понимание сложного процесса старения.
Старение стволовых клеток. Механизмы самоподдержания стволовых клеток
Данные доказывают, что стволовые кроветворные клетки обладают способностью к старению, к отсчету числа проделанных ими делений. Для удовлетворения потребностей в кроветворении стволовые клетки используются не случайно, а с учетом их возраста (Rosendaal е. а., 1976). В первую очередь мобилизуются в цикл более старые, т. е. проделавшие большее число делений, стволовые клетки, в значительной мере уже исчерпавшие свои пролиферативные возможности.
После повторных введений оксимочевины, уничтожающей только клетки, находящиеся в периоде синтеза ДНК, все новые стволовые клетки мобилизуются в цикл и погибают в результате следующих введений цитостатика. Сохранившиеся после пяти доз препарата стволовые клетки оказываются более молодыми, судя по их функционально большей эффективности, по большей способности к самоподдержанию и продукции дифференцированного потомства (Rosendaal е. а., 1976).
Механизм такой возрастной организации отдела стволовых клеток для использования не ясен. Он может быть связан с возрастанием чувствительности стволовых клеток к триггирующим их в цикл воздействиям по мере старения либо с наличием структурной организации в кроветворном микроокружении, в котором участки, индуцирующие пролиферацию стволовых клеток, длительное время заняты стволовыми клетками, вплоть до истощения их пролиферативного потенциала.
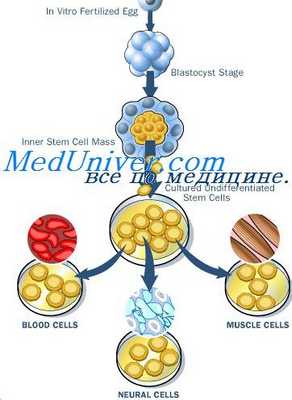
Обнаружение возрастной структуры отдела стволовых клеток ставит важный вопрос о том, можно ли вообще говорить о самоподдержании стволовых клеток. Сам этот термин подразумевает, что после деления исходной клетки образуются две новые клетки, полностью ей идентичные. Между тем из сказанного выше ясно, что это не так — вновь образовавшиеся клетки отличаются от исходной тем, что они в дальнейшем способны проделать на одно деление меньше, и в этом смысле новые клетки иные, более старые, поэтому использование термина «самоподдержание» не должно быть безоговорочным.
Под ним подразумевают поддержание величины отдела стволовых клеток, но качественные характеристики отдела при этом могут меняться. Вопрос этот имеет не просто терминологическое значение. Ранее предполагалось, что обеспечение организма клетками, расходуемыми в течение жизни, может осуществляться двумя путями: либо клетки заготовляются в эмбриогенезе впрок, на всю жизнь, и дальше только постепенно созревают (как, например, яйцеклетки), либо в эмбриогенезе готовится немного клеток, которые в дальнейшем самоподдерживаются. Последний путь использован, например, для стволовых кроветворных клеток.
Обсуждавшиеся выше данные показывают, что различия между этими двумя путями гистогенеза не столь существенны. В обоих случаях исходные клетки заготавливаются в эмбриогенезе впрок. Однако в первом из них заготовленные клетки теряют пролиферативную активность полностью, а во втором они сохраняют высокий пролиферативный потенциал, постепенно теряемый на протяжении жизни.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Самоподдержание стволовых клеток. Пролиферативные способности стволовых клеток
Стволовые кроветворные клетки не представляют собой быстро пролиферирующую популяцию с коротким и относительно постоянным временем генерации. Исследования с ядами, избирательно поражающими делящиеся клетки лишь в определенной стадии клеточного цикла, показали, что средства, вызывающие гибель клеток, находящихся в периоде редупликации ДНК (например, 3Н-тимидин высокой удельной активности, оксимочевина и др, почти не влияют на стволовые кроветворные клетки животных со стабильным кроветворением (Dunn, 1971) и поэтому не снижают защитных способностей кроветворных клеток, лишенных синтезирующих ДНК клеток (Haas е. а., 1972).
Отсюда следует, что при равновесном кроветворении подавляющее большинство (видимо, не менее 90%) стволовых клеток находится вне клеточного цикла (период G0) или в длительном периоде G,. Стабильное поддержание величины отдела стволовых клеток обеспечивается небольшой долей пролиферирую-щих клеток. В случае угнетения отдела в покоящихся стволовых клетках быстро индуцируется пролиферация. Так, после трансплантации в облученный организм стволовые клетки через 3—4 дня находятся в фазе экспоненциального роста. В это время величина тимидинового «самоубийства» их составляет до 50—60%.
Так как продолжительность S-периода для стволовых клеток составляет в это время до 70% от общей длительности клеточного цикла (Hodgson е. а., 1975), ясно, что в условиях гемопоэтического стресса пролиферация может индуцироваться во всей популяции сохранившихся стволовых клеток. В связи с этим время удвоения экспоненциально растущей популяции стволовых клеток оказывается очень коротким, порядка 15—20 час. Возникает вопрос, не исчерпывают ли стволовые клетки в процессе пролиферации способности к самоподдержанию.
Иными словами, это вопрос о том, имеют ли стволовые клетки возрастную структуру, равноценны ли по способности к дальнейшей пролиферации стволовые клетки, проделавшие на протяжении своей предыдущей истории различное число митотических делений.
Систематическое изучение способности к самоподдержанию стволовых клеток от животных разного возраста было осуществлено с помощью метода селезеночных колоний. Не было выявлено различий в содержании КОЕс на колонию при серийных пассажах клеток колоний, продуцированных костным мозгом молодых животных (восемь недель) по сравнению с костным мозгом старых мышей (1,5— 2,5 года); истощение в обоих случаях наступало через три пассажа. КОЕс из печени новорожденной мыши выдерживали четыре пассажа, из печени 10-дневных эмбрионов — шесть пассажей, из желточного мешка 9-дневных эмбрионов — семь пассажей.
Очень приблизительные расчеты (время генерации КОЕс в колонии принято 12 час во все время пассажей) показали, что КОЕс взрослых животных может делиться 28 раз до выявления дефекта в пролиферации, КОЕс новорожденных — 56 раз и КОЕс ранних эмбрионов — 84 раза.
Таким образом, в эмбриональном периоде, когда стволовые клетки интенсивно пролиферируют, пролиферативный потенциал их постепенно снижается. Во взрослом организме, в котором пролиферация стволовых клеток незначительна, дальнейшее снижение способности к пролиферации выявить труднее. Оно было обнаружено в исследованиях с переносом костного мозга к мышам-мутантам W/Wv, у которых дефектны стволовые клетки. Здоровые стволовые клетки при трансплантации необлученным мутантам постепенно заменяют кроветворные клетки реципиента. Это дало возможность вести серийные трансплантации (1 раз в 12—16 мес ) костного мозга от молодых и погибающих от старости мышей в организме мутантов свыше 5 лет (при продолжительности жизни мышей до 2 лет).
Снижение способности к самоподдержанию (по числу КОЕс) у костного мозга от старых мышей (в сравнении с костным мозгом от молодых животных) выявилось лишь после 4-го пассажа, через 63—70 мес от начала опыта (Harrison, 1973).
Еще более четко возможность истощения пролиферативной способности стволовых клеток была выявлена при серийных трансплантациях в облученный организм смеси костного мозга от молодых и старых доноров, несущих различные хромосомные маркеры (Ogden, Micklem, 1976). При первых двух пассажах, производимых один раз в 8—10 недель, эффективно репопулируют около 100 стволовых кроветворных клеток, тогда как при последующих пассажах, несмотря на то, что вводится всегда одно и то же число стволовых кроветворных клеток, способность к клонообразованию сохраняется лишь у двух — пяти из них.
Реактивация стволовых клеток в мозге

Стволовые клетки в мозге производят новые нейроны на протяжении всей жизни, например, в гиппокампе. Эта область мозга играет ключевую роль в функционировании процессов памяти. С возрастом, а также у пациентов, страдающих болезнью Альцгеймера, способность гиппокампа производить новые нейроны неуклонно снижается; вместе с этим снижается и функции памяти.
Распространение возрастных повреждений клеток
Результаты исследования, проведенного группой ученых во главе с Себастьяном Йессбергером, профессором Института исследований мозга при Цюрихском университете, свидетельствуют, как с возрастом нарушается формирование новых нейронов. Белковые структуры в ядрах стволовых нервных клеток служат доказательством того, что вредные белки, накапливающиеся с течением времени, неравномерно распределяются по двум дочерним клеткам при их делении.
По-видимому, это является важной частью способности клеток пролиферировать в течение длительного времени, чтобы обеспечивать функционирование нейронов. Однако с возрастом количество ядерных белков изменяется, что приводит к нарушению распределения вредных белков между двумя дочерними клетками. Это ведет к снижению численности производимых новых нейронов в мозге у старых мышей.
Центральным элементом этого процесса является ядерный белок ламин B1, концентрация которого снижается с возрастом. При искусственном повышении уровня ламина B1 в экспериментах на стареющих мышах деление стволовых клеток улучшилось, а количество новых нейронов выросло.
По словам Хадиша бин Имтиаза, первого автора статьи и кандидата наук, по мере того, как человек стареет, стволовые клетки по всему телу теряют свою способность к пролиферации. Используя генную инженерию и передовые микроскопические технологии, ученые определили механизм, связанный с этим процессом.
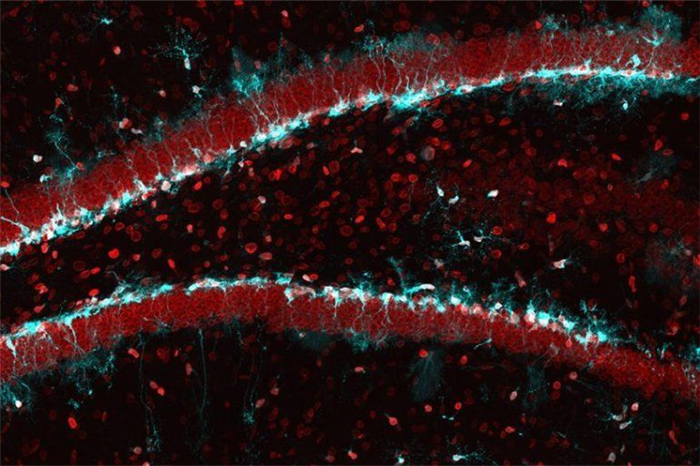
Рисунок 1 | Стволовые клетки в мышином гиппокампе (окрашены в голубой цвет): с возрастом их способность к образованию новых нейронов снижается в той же степени, что и количество ядерного белка ламина В1 (окрашен красным). Фото: Хадиш бин Имтиаз, университет Цюриха.
Остановка процесса старения у стволовых клеток
Исследование является частью нескольких текущих проектов, направленных на реактивацию стареющих стволовых клеток. Способность поврежденных тканей регенерировать с возрастом снижается, что затрагивает почти все типы стволовых клеток в организме. По словам Себастьяна Йессбергера, хотя исследование ученых было ограничено стволовыми клетками головного мозга, аналогичные механизмы, вероятно, будут играть ключевую роль в процессе старения других стволовых клеток.
Эти последние открытия являются важным шагом на пути изучения возрастных особенностей стволовых клеток. Как утверждает Йессбергер, теперь известно, что реактивация стареющих стволовых клеток мозга возможна. Ученые выражают надежду, что эти открытия однажды помогут повысить нейрогенез, например, у пожилых людей или у лиц, страдающих дегенеративными заболеваниями, такими как болезнь Альцгеймера. И пусть даже это случится еще через много лет.
Снижение экспрессии ламина В1 опосредует снижение активности стволовых клеток гиппокампа с возрастом.
Нервные стволовые клетки производят нейроны в течение всей жизни в зубчатой извилине гиппокампа. По мере старения степень нейрогенеза значительно снижается, с чем связывают снижение функции памяти. Однако внутриклеточные механизмы, опосредующие возрастные изменения активности нервных стволовых клеток, остаются в значительной степени неизвестными.
В данной работе ученые показывают, что экспрессия белка ядерной пластинки — ламина B1 — с возрастом подавляется в нервных стволовых клетках гиппокампа мышей. В это же время увеличиваются концентрации белков SUN-домена, содержащего белок 1 (SUN1), который, как было обнаружено ранее, задействован в патологических механизмах при синдроме прогерии Хатчинсона-Гилфорда. Равновесие концентраций ламина B1 и SUN1 в старых нервных стволовых клетках восстанавливает потенциал диффузионного барьера эндоплазматического ретикулума, который в пролиферирующих стволовых клетках ответственен за сегрегацию возрастных факторов. Восстановление экспрессии ламина B1 в старых нервных стволовых клетках с помощью вирусов усиливает активность стволовых клеток in vitro и увеличивает пролиферацию клеток-предшественников нейронов и нейрогенез in vivo.
Таким образом, исследователями определен механизм, опосредующий возрастное снижение нейрогенеза в гиппокампе млекопитающих.
Распределение стволовых клеток по организму после подкожного введения
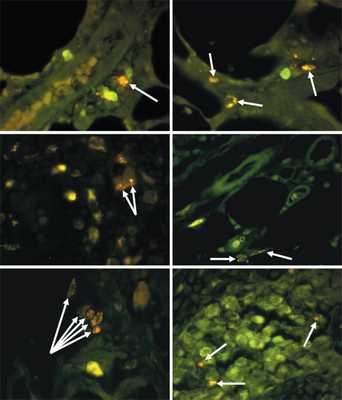
Рис. 1. Легкие и ЛУ животных в различные сроки после подкожного введения ММСК. Результат компьютерного совмещения изображений, полученных в люминесцентном режиме микроскопа с фильтрами Alexa 488 и для родамина. а – через 3 недели в периваскулярно расположенных клетках легкого многочисленные включения значительно ярче флюоресцируют при использовании фильтра для родамина (стрелка). б – в клетках альвеол легкого спустя 3 недели многочисленные включения значительно интенсивнее светятся на фоне применения родаминового фильтра (стрелки). в – аксиллярный ЛУ на 3-й неделе, в клетках в просвете мозгового синуса включения более интенсивно светятся при установке фильтра для родамина (стрелки). г – в клетках, расположенных паравазально рядом с капсулой подмышечного ЛУ, через 4 недели присутствуют единичные включения с несколько более яркой флюоресценцией при использовании родаминового фильтра (стрелки). д – спустя 3 недели отдельные клетки рядом с сосудами паранодальных тканей мезентериального ЛУ светятся более интенсивно на фоне применения фильтра для родамина (стрелки). е – в отдельных клеточных элементах в просвете мозговых синусов брыжеечного ЛУ на 3-й неделе присутствуют включения с более яркой флюоресценцией при установке родаминового фильтра. (Рисунок из обсуждаемой статьи)
Известно, что стволовые клетки применяют в косметологии для улучшения состояния кожных покровов. Считается общепринятым, что при локальном введении клетки остаются в месте применения, а при системном (внутривенном) введении происходит их распространение по всему организму. Российские ученые провели исследование распределения по организму лабораторных крыс стволовых клеток после подкожного введения. Оказалось, что через 1-2 недели после инъекции клетки попадают в кровоток и мигрируют в легкие, где поглощаются макрофагами организма. Несмотря на то, что в печени, почках и селезенке стволовые клетки, введенные подкожно, отсутствуют, в почках подопытных животных обнаруживается прогрессирование восходящей инфекции мочевых путей. Авторы полагают, что последнее может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием стволовых клеток.
Очень часто стволовые или, как их называют официально, мезенхимные стромальные клетки (МСК) применяют в косметологии для улучшения состояния кожных покровов, коррекции возрастных изменений и воздействия на рубцы, шрамы и стрии. Вместе с этим, остается неисследованной вероятность диссеминации введенных в кожу (дерму) или подкожно МСК по другим, удаленным, органам и тканям. Ранее была доказана миграция мультипотентных МСК костномозгового происхождения (ММСК) или их детрита в ближайшие регионарные лимфатические узлы (ЛУ). В связи с этим методом световой люминесцентной микроскопии изучали распределение ММСК по различным отдаленным органам после подкожного введения этих клеточных элементов, меченных Vybrant CM-Dil, в интактные ткани паховой области крыс и на фоне венозного застоя.
После простой инъекции ММСК попадают в кровь через 1–2 недели, о чем свидетельствует присутствие окрашенных Vybrant CM-Dil объектов, являющихся макрофагами, в легких (рис. 1). Количество подобным образом светящихся при воздействии ультрафиолетовым светом фагоцитов в легких нарастает с максимумом на 3 неделе, затем постепенно снижается. Это совпадает с данными литературы, которые сообщают о наиболее выраженном процессе элиминации (удалении) введенных извне ММСК и структур, из них созданных, у крыс через 2–3 недели после трансплантации этих клеточных элементов. Скорее всего, в остальные органы ММСК транспортируются с кровью и уже после фильтрации в легких. Об этом свидетельствует некоторое отставание появления меченых объектов и значительно меньшая их встречаемость в ЛУ. В подмышечных и брыжеечных ЛУ подобные объекты присутствовали в минимальном количестве, очень непродолжительное время и, чаще всего, в краевом синусе и рядом с сосудами околоузловой клетчатки, что указывает на поступление ММСК (или макрофагов с их детритом) в ЛУ как с током лимфы из региона лимфосбора, так и непосредственно из сосудов самих ЛУ и околоузловых тканей. После введения ММСК в ткани на фоне предварительно созданной венозной блокады, окрашенный детрит ММСК попадает в кровеносное русло позже и в меньшем объеме, чем после инъекции ММСК в интактные ткани. Возможно, что такие различия обусловлены венозным застоем и нарушениями микроциркуляции, как вследствие блокады магистральной вены, так и при асептическом воспалительном процессе после хирургического вмешательства. По-прежнему максимальный объем детрита из крови адсорбируется макрофагами легких, и только после прохождения легких дебрис (остатки) ММСК распространяется по всему организму и попадает в подмышечные и брыжеечные ЛУ.
В печени, почках и селезенке ММСК, введенные подкожно, отсутствуют независимо от состояния венозного оттока. По-видимому, эти объекты даже при попадании в кровоток или не доходят до указанных органов, так как оседают в капиллярной сети малого круга кровообращения – в легких, или органные макрофаги в силу каких-то причин не адсорбируют из крови такие антигены, как ММСК и их дебрис. Необходимо особо отметить обнаруженное в почках животных после применения ММСК прогрессирование восходящей инфекции мочевых путей, что может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием этих ММСК. На фоне венозного застоя бактериальная контаминация отмечена позже и не так значительна, что может быть связано с меньшим количеством ММСК, попавших в кровь в условиях нарушенной микроциркуляции. В связи с этим целесообразно тщательно обследовать пациентов перед проведением лечения с применением клеточных технологий для профилактики обострения хронических инфекционных процессов, в том числе и скрытых.
Читайте также:
