Связывание лекарства с рецептором в зависимости от концентрации
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Рецепторы – это макромолекулы, участвующие в передаче химических сигналов как между клетками, так и внутри одной клетки; они могут находится на поверхности клеточной мембраны или в цитоплазме (см. таблицу Некоторые типы физиологических рецепторов и рецепторов лекарственных препаратов Влияние возраста на особенности клинических эффектов некоторых лекарственных препаратов ). Активированные рецепторы прямо или косвенно регулируют клеточные биохимические процессы (например, проводимость ионных каналов, фосфорилирование белков, транскрипцию ДНК, ферментативную активность).
Молекулы (к примеру, лекарственные препараты, гормоны, нейротрансмиттеры), которые связываются с рецептором, называются лигандами. Связывание может быть специфическим и обратимым. Связывание с лигандом может приводить к активации либо инактивации рецептора; активация может стимулировать либо ингибировать ту или иную клеточную функцию. Каждый лиганд способен взаимодействовать с различными подтипами рецепторов. Почти не существует препаратов, абсолютно специфичных к одному рецептору или его подтипу, но большинство из них имеет относительную селективность. Селективность – это степень, с которой лекарственное средство действует на определенный участок относительно других участков; селективность относится в основном к физико-химическому связыванию препарата с клеточными рецепторами. (См. также Обзор фармакодинамики Обзор фармакодинамики (Overview of Pharmacodynamics) Фармакодинамика (под которой понимают то, как препарат действует на организм) - это изучение биохимических, физиологических и молекулярных эффектов лекарственных средств на организм, в том числе. Прочитайте дополнительные сведения ).
Способность лекарственного препарата воздействовать на конкретный тип рецептора зависит от его аффинности (вероятности того, что ЛС займет рецептор в определенный момент времени) и внутренней активности (степени активации рецептора после связывания с лигандом и развития клеточной реакции). Аффинность и внутренняя активность лекарственного вещества в свою очередь определяются его химической структурой.
Фармакологический эффект определяется также длительностью сохранения комплекса "препарат-рецептор" (время удержания). На продолжительность существования комплекса "препарат-рецептор" влияют динамические процессы (изменения конформации), которые контролируют скорость ассоциации и диссоциации лекарственных веществ от своей мишени. Большее время удержания служит объяснением продолжительному фармакологическому действию. К препаратам с длительным временем удержания относятся финастерид и дарунавир. Длительное время удержания может быть потенциальным недостатком, если за этот счет продлевается и токсический эффект препарата. Для некоторых рецепторов транзиторное связывание производит нужный фармакологический эффект, в то время как длительное связывание провоцирует токсичность.
Физиологические функции (такие как сокращение, секреция), как правило, регулируются множественными рецептор-опосредованными механизмами и включают несколько этапов (связывание с рецептором, активация внутриклеточных вторичных мессенджеров и т. д.) между первоначальным взаимодействием лекарственного вещества с рецептором и конечным ответом ткани или органа. По этой причине один и тот же желаемый фармакологический эффект может быть достигнут применением ЛС с разной химической структурой.
На способность препарата связываться с рецептором оказывают влияние внешние факторы, а также внутриклеточные регуляторные механизмы. Исходная плотность рецепторов и эффективность механизмов ответа на стимул варьируют от ткани к ткани. Лекарственные средства, старение, мутации и заболевания могут повышать (активировать) или снижать (подавлять) число и аффинность рецепторов. Например, клонидин снижает активность альфа-2-адренорецепторов; по этой причине быстрая отмена клонидина может спровоцировать гипертонический криз Неотложные состояния К неотложным состояниям относят поражения органов-мишеней (головной мозг, сердечно-сосудистая система и почки) на фоне выраженного повышения АД. Диагностика производится посредством измерения. Прочитайте дополнительные сведения . Длительная терапия бета-блокаторами повышает плотность бета-рецепторов, в связи с чем резкое прекращение приема данного класса препаратов может вызвать развитие тяжелой гипертензии или тахикардии. Стимуляция и ингибирование рецепторов влияют на механизмы приспособления организма к лекарственному средству (например, в виде гипосенсибилизации, тахифилаксии, толерантности, приобретенной резистентности и гиперчувствительности после отмены).
Лиганды связываются с определенными участками на макромолекуле рецептора, называемыми сайтами узнавания. Места связывания лекарственного вещества и эндогенного агониста (гормона или нейротрансмиттера) могут быть идентичными либо различаться. Агонисты, связывающиеся со смежным или другим сайтом, иногда называются аллостерическими агонистами. Также происходит неспецифическое связывание препаратов, т.е. с молекулярными участками, не являющимися рецепторами (например, белками плазмы крови). Связывание лекарственного вещества с подобными неспецифическими участками, например, связывание с белками сыворотки крови, препятствует его связыванию с рецептором, тем самым делая препарат неактивным. Несвязанные препараты способны взаимодействовать с рецепторами и, следовательно, вызывать эффект.
Агонисты и антагонисты
Агонисты активируют рецепторы для реализации желаемого фармакологического эффекта. Традиционные агонисты повышают долю активированных рецепторов. Обратные агонисты стабилизируют рецепторы в их неактивной конформации и действуют аналогично конкурентным агонистам. Многие гормоны, нейротрансмиттеры (например, ацетилхолин, гистамин, норадреналин ) и лекарственные средства (например, морфин, фенилэфрин, изопреналин, бензодиазепины, барбитураты) действуют как агонисты рецепторов.
Антагонисты препятствуют активации рецептора. Предотвращение активации оказывает множество эффектов. Антагонисты усиливают клеточную функцию в том случае, если они блокируют действие вещества, обычно подавляющего данную функцию. Справедлива и обратная закомерность: антагонисты снижают клеточную функцию, если блокируют действие вещества, усиливающего ее.
Антагонисты рецепторов могут быть классифицированы на обратимые и необратимые. Обратимые антагонисты легко диссоциируют от соответствующих рецепторов, необратимые – образуют стабильную, постоянную или почти постоянную химическую связь со своим рецептором (например, при алкилировании). Псевдообратимые антагонисты медленно разрывают связь со своим рецептором.
При конкурентном антагонизме связывание антагониста с рецептором препятствует связыванию с ним агониста.
При неконкурентном антагонизме агонист и антагонист могут связываться одновременно, но связывание антагониста снижает эффект агониста либо препятствует его развитию.
При обратимом конкурентном антагонизме агонист и антагонист образуют кратковременные связи с рецептором, в результате чего достигается равновесное состояние этой трехкомпонентной системы. Такой антагонизм можно преодолеть путем увеличения концентрации агониста. Например, налоксон (антагонист опиоидных рецепторов, структурно схожий с морфином) при введении незадолго до или сразу после введения морфина блокирует действие последнего. Тем не менее конкурентный антагонизм налоксона может быть преодолен с помощью введения морфина в большей дозе.
Такие лекарственные вещества называются частичными агонистами или агонистами-антагонистами. Структурные аналоги молекул агониста часто обладают одновременно свойствами агониста и антагониста. Например, пентазоцин активирует опиоидные рецепторы, но блокирует их активацию другими опиоидами. Таким образом, пентазоцин обеспечивает опиоидное действие, но ослабляет эффект другого опиоида, если последний вводится в период сохранения связи пентазоцина с рецептором. Лекарственное средство, действующее как частичный агонист в одной ткани, может действовать как полный агонист в другой.
Связывание лекарства с рецептором в зависимости от концентрации
Доза-ответ как количественный анализ действия лекарств. Связывание лекарства с рецептором
Количественный анализ действия лекарств важен при разработке новых препаратов, если цель состоит в получении:
• препаратов, селективных по рецепторам, с которыми они взаимодействуют;
• препаратов, селективных по особенности их взаимодействия только с одним подтипом рецептора.
Существует несколько фундаментальных принципов при оценке кривых связывания лекарства с рецептором и доза-ответ. К большинству препаратов, используемых в клинической практике и в эксперименте, могут быть применимы следующие принципы:
• на любой клетке в ткани находятся рецепторы; большинство клеток экспрессируют множество разных типов рецепторов;
• в присутствии препарата постоянно случайным образом создаются комплексы лекарство-рецептор благодаря столкновению движущихся молекул лекарства с неоккупированными рецепторами. Комплексы лекарство-рецептор постоянно разрушаются, освобождая таким образом рецепторы для повторного взаимодействия с лекарством;
• комплексы рецептор-агонист постоянно меняются от неактивной конформации к активной (молекулярный ответ). Последняя вызывает биофизические изменения, например открытие ионных каналов, или биохимические изменения, например активацию G-белков, что ведет к тканевому ответу;
• число рецепторов на клетке может изменяться при патологических процессах или длительном приеме лекарств.
К этим фундаментальным принципам можно добавить два полезных правила:
• субмаксимальный тканевый ответ на агонист пропорционален дозе (концентрации) агониста и числу доступных рецепторов;
• связываясь с рецепторами, антагонист уменьшает число рецепторов, доступных агонисту, независимо от дозы агониста.
Перечисленные ранее фундаментальные принципы отражают действие лекарств с точки зрения связи между эмпирическими наблюдениями и экспериментальными данными и основными химическими и физико-химическими реакциями. Количественные параметры этой теории в различных аспектах проявляются при связывании радиоактивно меченных лигандов с рецепторами в культуре ткани. Поскольку подобные эксперименты легко воспроизводимы и понятны, удобнее рассматривать связывание лекарства с рецептором до изучения кривых доза-ответ.

Связывание лекарства с рецептором
Рецептор можно рассматривать как структуру, которая селективно и специфически связывает лекарство. Для упрощения приведем пример селективного связывания лекарства только с одним определенным центром рецептора.
Согласно самой простой модели обратимого связывания лекарства с рецептором, каждая молекула лекарства (D) может случайно присоединяться к молекуле рецептора (R), формируя комплекс лекарство-рецептор (DR). Этот комплекс впоследствии разрушается, высвобождая молекулу лекарства и неоккупированный рецептор. Согласно закону действия масс, скорость формирования новых DR-комплексов пропорциональна концентрации D и концентрации свободных R, т.е. [D] и [R] соответственно (концентрацию обозначают в квадратных скобках). В то же время скорость, с которой DR-комплексы разрушаются до D и R, пропорциональна концентрации DR, т.е. [DR].
В состоянии равновесия скорость образования DR-комплексов равна интенсивности их разрушения, т.е.: KD [DR] = [D] [R], где KD — константа диссоциации, обычно выражаемая в молях (М). KD зависит от физических факторов, таких как температура, и химической природы взаимодействующих веществ. В данной простой модели KD представляет собой соотношение присоединения и отсоединения. Важно отметить, что сходное уравнение применимо к более сложным моделям, в которых присутствуют сложные конформации R и DR, в комплексных случаях KD зависит от значения всех постоянных, необходимых для описания системы. Тем не менее независимо от количества конформации R и DR рецептор может рассматриваться только в двух формах — R и DR с KD [DR] = [D] [R]. Другая форма уравнения выглядит как [DR] = [D] [R]/KD.
[DR] + [R] является постоянной. Общее количество рецепторов ограничено, поэтому конечная концентрация [DR] + [R] постоянна. Ее обозначают [Rt]. Следовательно: [Rt] = [R] + [DR] = [R] (1 + [D]/KD), если [DR] заменить на [R] [D]/KD.
Объединение этого уравнения с KD [DR] = [D] [R] дает:[DR]/[RJ = ([D]/KD) (1 + [D]/KD) при [DR]/[Rt], указывающее, что только один R в данный момент объединен с D.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Зависимость эффекта лекарства от концентрации
а) Зависимость эффекта лекарства от концентрации. Терапевтический эффект препарата или его токсическое воздействие зависят во многом от реакции одного или нескольких органов; так, например, на кровоток влияет изменение просвета сосудов. Эти эффекты можно изучить подробнее, если изолировать важный орган или ткань из более крупной функциональной системы.
Например, действие сосудосуживающих препаратов можно отслеживать на образцах ткани, содержащих различные участки сосудистого дерева, в частности воротную или подкожную вену, брыжеечные, коронарные или базилярные артерии.
Во многих случаях изолированный орган или часть органа остаются жизнеспособными на протяжении нескольких часов в правильно подобранной питательной среде, при условии достаточного поступления кислорода и поддержания необходимой температуры.
Реакция органа на физиологические или фармакологические воздействия регистрируется с помощью соответствующей аппаратуры. Например, сужение кровеносного сосуда выявляется с помощью двух проволочных петель, создающих давление в сосудах.
Преимущества экспериментов на изолированных органах:
1. Как правило, известна концентрация лекарственного вещества в ткани.
2. Стимулы и эффекты по своей природе более простые; легче соотнести эффект со стимулом.
3. Удается обойти компенсаторные механизмы, которые частично нивелируют первичный эффект в целом организме; например, у человека невозможно продемонстрировать увеличение ЧСС в результате введения в организм норадреналина, т. к. одновременное повышение АД вызывает компенсаторный рефлекс, замедляющий скорость сердечных сокращений.
4. Возможность изучать весь диапазон интенсивности эффекта лекарственного вещества; например, у человека невозможно проследить отрицательное хронотропное влияние на весь организм вплоть до остановки сердца.
Недостатки:
1. Неизбежное повреждение тканей в процессе изолирования органа.
2. Утрата физиологической регуляторной функции в изолированной ткани.
3. Влияние на ткани искусственной среды. Этот фактор менее важен, если изолированный орган используется только для сравнения эффективности различных препаратов.
Еще более упрощенный способ — изучить воздействие препарата на изолированных клетках.
В культурах клеток гораздо легче провести количественную оценку конкретных эффектов лекарственного средства. Еще большая «редукция» заключается в использовании изолированных субклеточных структур: цитоплазматической мембраны, эндоплазматического ретикулума, лизосом. Однако в этом случае экстраполяция на целый организм труднее и менее достоверна.
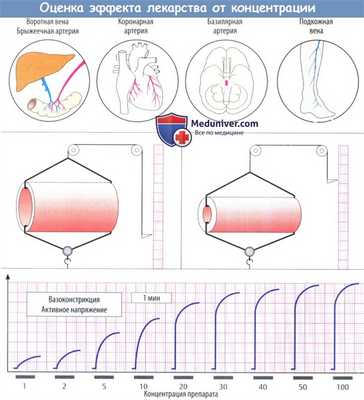
б) Кривые зависимости эффекта лекарства от концентрации. В процессе повышения концентрации под воздействием постоянного фактора степень эффекта постепенно уменьшается, показывая в конце концов нулевой прирост, и концентрация приближается к максимально эффективной.
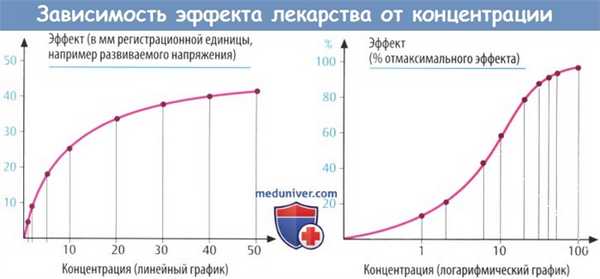
Концентрацию, при которой развивается максимальный эффект, невозможно измерить точно; однако полумаксимальный эффект (ЕС50) легко поддается определению. Его значение обычно соответствует нижней точке на кривой зависимости эффекта от концентрации на полулогарифмическом графике (логарифм концентрации на оси абсцисс).
Полное описание зависимости эффекта от концентрации требует определения ЕС50, максимально возможной реакции (Еmax) и крутизны в нижней точке кривой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Типы связывания лекарства с рецептором
Лекарственное средство изменяет функции организма только в том случае, если входит в контакт с внутренними структурами организма.
а) Ковалентные связи. Ковалентная связь возникает между двумя атомами, если каждый отдает электрон, образующий пару электронов (облако). В структурных формулах это состояние обозначается знаком «тире». Ковалентная связь крепкая, т. е. необратимая или малообратимая. Некоторые препараты ковалентно связываются с биологическими структурами. Поскольку сама связь и, возможно, ее эффект сохраняются длительное время после отмены препарата, терапию сложно контролировать.
Примерами являются алкилирующие противоопухолевые препараты и фосфорорганические соединения. Реакции конъюгации, происходящие при биотрансформации, также представляют собой ковалентные связи (с глюкуроновой кислотой).
б) Нековалентные связи. В процессе формирования нековалентных связей не происходит образования общей пары электронов. Эти связи обратимые и часто встречаются в большинстве взаимодействий лекарство-рецептор. Поскольку препарат обычно прикрепляется к своей точке приложения посредством множества контактов, в этом могут участвовать некоторые типы связей, описываемые ниже.
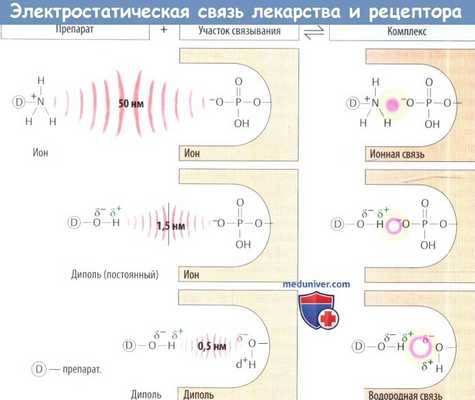
- Электростатическая связь. Положительные и отрицательные заряды притягиваются.
Ионное взаимодействие. Ион — частица, заряженная положительно (катион) или отрицательно (анион), т. е. в атоме имеется соответственно дефицит или избыток электронов. Притяжение между противоположно заряженными ионами обратно пропорционально квадрату расстояния между ними; это — первые силы, влекущие заряженные молекулы препарата к его участку связывания. Для ионного взаимодействия характерна относительно высокая стабильность.
Ион-дипольное взаимодействие. Если связывающие электроны асимметрично распределены вокруг участвующих в связи атомных ядер, один атом несет на себе частично отрицательный заряд (δ-), а его партнер — частично положительный (δ+). Таким образом, молекула находится в положительном и отрицательном поле, т. е. имеет полярность и представляет собой диполь. Частичный заряд может вступать в электростатическое взаимодействие с противоположно заряженным ионом.
Диполь-дипольное взаимодействие — электростатическое притяжение между противоположными частичными зарядами. Когда атом водорода, несущий частичный положительный заряд, связывается с двумя атомами, несущими частично отрицательные заряды,образуется водородная связь.
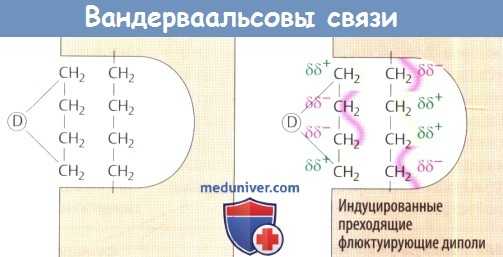
- Вандерваальсовы связи образуются между группами неполярных молекул, оказавшихся на близком расстоянии друг от друга. Спонтанный временный разрыв электронного облака (кратковременное ослабление диполя) может индуцировать образование противоположного диполя в соседней молекуле. Таким образом, вандерваальсовы связи также являются формой электростатического притяжения, хотя и очень малой силы (обратно пропорциональной расстоянию в 7-й степени).
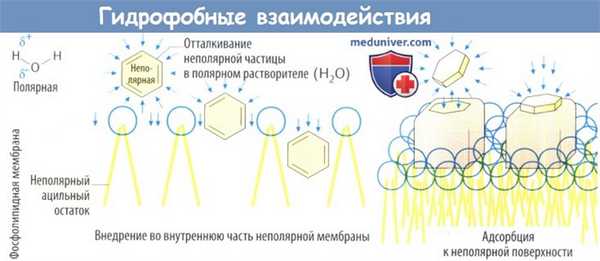
- Гидрофобные взаимодействия. Притяжение между диполями воды достаточно сильное, чтобы препятствовать интеркаляции любых неполярных (незаряженных) молекул. Притягиваясь друг к другу, молекулы Н2О вытесняют неполярные частицы из центра к периферии. Соответственно, в организме неполярные частицы, например цепи жирных кислот клеточных мембран или неполярные участки рецептора, с большей вероятностью могут остаться в безводном неполярном окружении.
Для достижения эффекта молекулы лекарственного вещества должны связываться с клетками органа-эффектора. Связывание обычно происходит в области специфических клеточных структур — рецепторов. Чтобы проанализировать связывание лекарственного вещества с рецепторами, необходимо определить аффинность лигандов, кинетику взаимодействия и характеристики самого участка связывания.
Для изучения аффинности и числа таких участков связывания используются суспензии мембран различных тканей. В основе этого метода лежит предположение, что участки связывания сохранят свои характерные свойства после гомогенизации клеток.
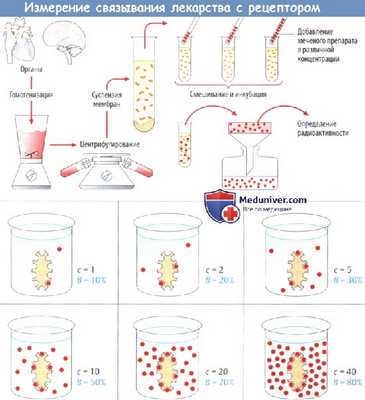
Предположим, участки связывания свободно располагаются в среде, представляющей собой суспензию фрагментов мембран, тогда концентрация лекарственного вещества в точке приложения будет равна концентрации в данной среде. Изучаемый препарат помечают радиоактивным веществом (это позволяет провести количественную оценку при низких концентрациях), которое добавляют к суспензии мембран, позволяя связываться с рецепторами.
Затем фрагменты мембран сепарируют от среды, например, с помощью фильтрации и измеряют количество связанного лекарственного вещества (лигандов). Связывание нарастает пропорционально концентрации до тех пор, пока имеется незначительное снижение числа свободных связывающих участков (с = 1 и В=10% от максимального связывания; с=2 и В=20%).
По мере насыщения участков связывания число свободных участков снижается и нарастание связывания больше непропорционально повышению концентрации (в приведенном примере для повышения связывания на 10-20% требуется повышение концентрации на 1, однако для повышения связывания на 70-80% требуется повышение концентрации на 20).
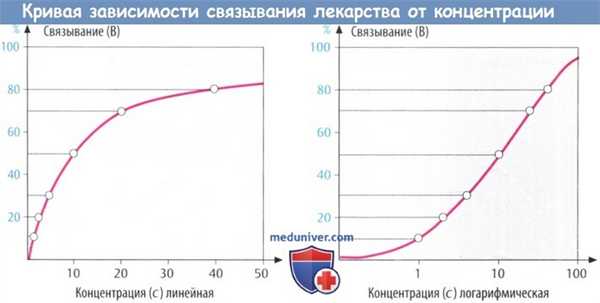
Закон действующих масс описывает гиперболическую зависимость между связыванием (В) и концентрацией лигандов (с). Эти взаимоотношения характеризуются аффинностью лекарственного средства (1/KD) и максимальным связыванием (Вmax), т. е. общее числоучастков связывания на единицу массы гомогената, состоящего из клеточных мембран.
KD — равновесная константа диссоциации, соответствующая концентрации лигандов, при которой вовлечено 50% участков связывания. Величины, приведенные на рис. А и используемые для построения графика зависимости связывания от концентрации (В), являются следствием KD = 10.
Разный аффинитет разных лигандов к участку связывания можно наглядно продемонстрировать с помощью анализа связывания. Несмотря на то что этот метод прост в выполнении, существует трудность четкой корреляции связывающих участков с соответствующим фармакологическим эффектом; это особенно сложно, когда имеется более одной популяции связывающих участков. Следовательно, связывание с рецепторами не считается свершившимся, пока не будет показано, что:
- связывание характеризуется насыщением (насыщаемость);
- связываются только вещества, которые обладают одинаковыми фармакологическими механизмами действия (специфичность);
- связывающая способность различных субстанций соответствует их фармакологической эффективности. Анализы связывания дают информацию о связывающей способности лигандов, но не показывают, является лиганд агонистом или антагонистом.
Меченные изотопами препараты, связавшиеся с соответствующими рецепторами, помогают в очистке и анализе белков рецепторов.
Читайте также:
