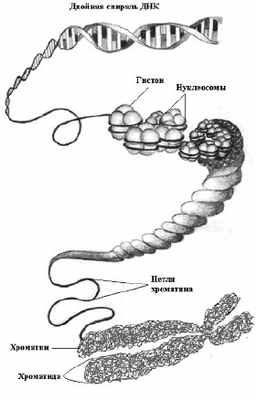
Строение фибрилл хроматина и их нуклеосомы
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Группа исследователей из ИБХ РАН и МГУ совместно с Университетом Юты (University of Utah) при помощи метода FRET-микроскопии впервые показала способность нуклеосом обратимо раскручиваться под воздействием FAСT без затрат энергии. В дальнейшем полученные данные помогут понять, какую роль этот белковый комплекс играет в активно делящихся клетках в опухолевых тканях. Результаты работы опубликованы в журнале Nature Structural & Molecular Biology.
«Данная работа является примером успешного сотрудничества между двумя научными группами, – рассказывает Ксения Кудряшова, кандидат биологических наук, научный сотрудник Отдела биоинженерии ИБХ РАН. – Первую группу возглавляет исследователь нуклеосом с большим стажем Василий Михайлович Студитский, заведующий лабораторией регуляции транскрипции и репликации Московского государственного университета им. М. В. Ломоносова. Вторая научная группа проводила исследования под руководством специалиста по микроскопических методам в биологии Алексея Валерьевича Феофанова, руководителя лаборатории оптической микроскопии и спектроскопии биомолекул Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН».
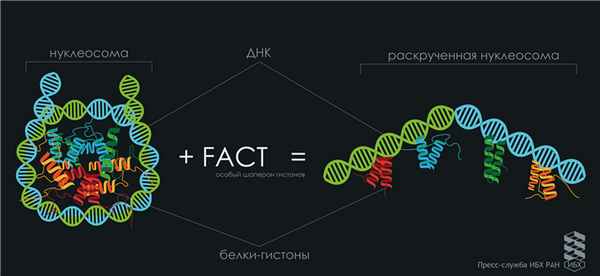
Как известно, молекула ДНК компактно свёрнута в ядрах клеток. Правильность укладки генома обеспечивают специальные белки, которые вместе с ДНК формируют структуру под названием хроматин. Единицей компактизации хроматина является нуклеосома. Нуклеосому часто сравнивают с «катушкой ниток», в которой ДНК-«нитка» намотана на бочонок из белков-гистонов – «катушку». Плотная упаковка хроматина в ядре нарушается при транскрипции, когда идёт активное считывание наследственной информации с ДНК. Облегчить транскрипцию хроматина помогает консервативный белок FACT, который стал объектом пристального внимания учёных. Взаимодействие FACT с нуклеосомой было показано ранее, но впервые удалось выяснить важные детали этого процесса.
Одна из возможных моделей раскручивания нуклеосом белковым комплексом FACT. Автор: Снежана Мажекенова.
Исследователи изучили взаимодействие белкового фактора FACT с нуклеосомой методом spFRET-микроскопии.
«В результате начатой еще в 2010 году плодотворной работы удалось с нуля разработать метод spFRET и применить его для исследования нуклеосом, – объясняет Ксения Кудряшова. – Его основу составляет микроскопия единичных молекул. В соседние витки нуклеосомной ДНК вводятся флуоресцентные метки, одна из которых служит донором энергии, а другая – акцептором. Донора можно возбудить с помощью лазера определённой длины волны. Если донор находится близко к акцептору, то происходит переброс энергии на акцептор. Чем ближе расположены метки, тем ярче сигнал от акцептора. Таким образом, можно следить за расстоянием между соседними витками ДНК и оценивать, насколько нуклеосома компактно свернута. Это уникальная для России разработка. Она позволяет изучать структурные перестройки в нуклеосомных комплексах с разрешением в несколько нанометров, причём информация собирается от каждой молекулы индивидуально».
С использованием этого метода в работе впервые показали способность нуклеосом обратимо раскручиваться под воздействием FACT in vitro (в пробирке) без затрат энергии, что достаточно необычно. Ведь АТФ-зависимые комплексы ремоделирования для перестройки хроматина тратят много энергии.
При образовании комплекса «нуклеосома-FACT» нити ДНК практически полностью распрямляются, но остаются связанными с белками-гистонами. Если убрать FACT из комплекса, то всё возвращается на круги своя: нуклеосомная ДНК снова наматывается на основание из гистонов. Таким образом, FACT – это редкий пример АТФ-независимого (без естественных источников энергии) комплекса ремоделирования хроматина.
По мнению Марии Валиевой, первого автора статьи из МГУ, в клетке способность FACT обратимо менять структуру хроматина, возможно, помогает активировать определённые гены путём перестройки соответствующих участков ДНК. Однако ничего более конкретного нельзя сказать о подобных процессах, происходящих в клетках, так как вопрос ещё недостаточно изучен. Автор отмечает, что изучение этого белкового комплекса важно не только с научной, но и медицинской точки зрения. Это связано с тем, что FACT в большом количестве содержится в опухолевых тканях. Именно поэтому перед учёными стоит вопрос: «Какую роль этот белковый комплекс играет в активно делящихся клетках?».
(автор: Надежда Куликова)
7 декабря 2016 года
© 2009–2022 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Строение фибрилл хроматина и их нуклеосомы
• 10-нм фибриллы хроматина образуются при раскручивании 30-нм фибрилл и состоят из цепочки нуклеосом
• 30-нм фибриллы содержат 6 нуклеосом на один виток и организованы в соленоид
• Для образования 30-нм фибриллы требуется гистон Н1
При исследовании хроматина в электронном микроскопе видны два типа фибрилл: размером 10 нм и 30 нм. Под размером подразумевается диаметр фибрилл (в действительности диаметр 30-нм фибриллы составляет 23-30 нм).
10-нм фибрилла представляет собой непрерывную нить, содержащую нуклеосомы. В некоторых случаях, действительно, такие нити находятся в релаксированных областях хроматина, где нуклеосомы видны как цепочки бусин, нанизанных на нитку. Препараты 10-нм фибрилл получаются при низкой ионной силе, без участия гистона Н1.
Это означает, что образование фибриллы исключительно обусловлено функцией самих нуклеосом. Фибрилла выглядит как непрерывная нить, состоящая из нуклеосом. Остается неясным, существует такая структура in vivo или же она образуется вследствие раскручивания более крупной фибриллы при экстракции in vitro.
При исследовании хроматина в условиях более высокой ионной силы видны 30-нм фибриллы. Пример такой фибриллы представлен на рисунке ниже. Эта фибрилла служит основой структуры хроматина более высокого порядка. На каждый виток фибриллы приходится 6 нуклеосом, что соответствует коэффициенту упаковки порядка 40 (т. е. на каждый мкм фибриллы приходится 40 мкм ДНК).
Для образования такой фибриллы необходимо присутствие гистона Н1. 30-нм фибрилла является основным структурным компонентом как интерфазного хроматина, так и и митотических хромосом.
Наиболее вероятным способом упаковки нуклеосом в фибрилле является соленоид, представляющий собой цилиндрическую структуру, состоящую из спирально закрученных нуклеосомных нитей. Соленоид может существовать в двух формах — одинарного соленоида, образованного одним рядом нуклеосом, и двойного, состоящего из двух рядов нуклеосом.
На рисунке ниже представлена модель двойного соленоида, предложенная на основании результатов, полученных с использованием сшивающих агентов. Модель характеризуется наличием двойного ряда нуклеосом в составе 30-нм фибриллы.
30-нм и 10-нм фибриллы способны к взаимным превращениям при изменении ионной силы. Это предполагает, что при повышении ионной силы и в присутствии гистона Н1, 10-нм фибрилла способна закручиваться в 30-нм фибриллу.
Хотя для образования 30-нм фибриллы необходимо присутствие гистона Н1, информация о его локализации противоречива. Легкость, с которой этот гистон экстрагируется из хроматина, по-видимому, свидетельствует о его локализации на поверхности суперспирализованной фибриллы. Однако данные, полученные при исследовании дифракции, и тот факт, что Н1 гистон обнаруживается в составе 10-нм, а не 30-нм фибрилл, говорит скорее о его локализации внутри фибриллы.
В частично релаксированной фибрилле хроматина 10-нм нить выглядит состоящей из цепочки нуклеосом. 10-нм нить хроматина представлена непрерывной цепочкой нуклеосом. 30-нм фибрилла представляет собой спирализованную ленту,
состоящую из двух параллельных рядов нуклеосом, закрученных в соленоид.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ИСТИНА
Интегративное моделирование укладки нуклеосом в хроматине на основе данных Micro-C НИР
Integrative modeling of nucleosome packing in chromatin based on Micro-C data
- Руководитель НИР: Шайтан А.К.
- Ответственный исполнитель: Армеев Г.А.
- Участники НИР: Грибкова А.К., Князева А.С., Комарова Г.А., Поспелова Ю., Сингх-Пальчевская Л.Р., Тимохин Г.С.
- Подразделение: Кафедра биоинженерии
- Срок исполнения: 2 декабря 2019 г. - 1 декабря 2021 г.
- Номер договора (контракта, соглашения): 20-34-70039Стабильность
- Номер ЦИТИС: АААА-А19-119120390145-0
- Тип: Фундаментальная
- Приоритетное направление научных исследований: Физико-химические основы биологии и биотехнологии
- ПН России: Науки о жизни
- Направление технологического прорыва России: Медицинские технологии и лекарственные средства
- Критическая технология России: Биомедицинские и ветеринарные технологии
- Рубрики ГРНТИ:
- 34.17.15 Молекулярная биофизика
В последние годы благодаря совершенствованию экспериментальных технологий наметилась долгожданная конвергенция методов структурной биологии и методов геномики в изучении организации хроматина на молекулярном уровне. Благодаря успехам крио-электронной микроскопии, мы получаем все больше информации о структуре не только нуклеосом, но и супрануклеосомных структур, а благодаря развитию методов геномики и 3-D геномики все более высокого разрешения, стало возможным определять контакты между локусами ДНК с суб-нуклеосомным разрешением (в частности, методы Micro-C, Micro-C-XL и др.) и определять положение и состав нуклеосом вдоль генома (напр. методы MNase-seq, MNase-ChIP-seq). Возникает необходимость в интерпретации экспериментальных данных и построении физических молекулярных моделей укладки хроматина на супрануклеосомном уровне с учетом реальных геометрических и топологических параметров молекул белков и ДНК, а также динамического характера этих взаимодействий. Решению данного спектра задач и посвящен этот проект. Нами будут разработаны и усовершенствованы оригинальные методы моделирования укладки хроматина на супрануклеосомном уровне, учитывающие топологию, хиральность и кручение молекул ДНК, взаимодействие различных типов нуклеосом между собой, а также их взаимодействия с ядерным микроокружением. Будут разработаны подходы по интеграция различных типов геномных данных суб-нуклеосомного разрешения (Micro-C, MNase-seq, MNase-ChIP-seq и т.д.) в методы построения моделей укладки хроматина. На основе разработанных подходов по экспериментальным данным будут построены структурно-динамические модели укладки хроматина на супрануклеосомном уровне и изучена вариабельность структуры хроматина. Будет проанализирована связь получаемых моделей структуры хроматина с различными эпигенетическими характеристиками геномных локусов и сформулированы выводы о вероятной взаимосвязи между супрануклеосомной структурой и функцией различных областей хроматина. Аналогичные подходы будут применены для изучения изменений в состоянии хроматина в различных типах клеток.
In recent years, due to the improvement of experimental technologies, the long-awaited convergence of structural biology methods and genomics methods in the study of chromatin organization at the molecular level has emerged. Thanks to the success of cryo-electron microscopy, we are receiving more and more information about the structure of not only nucleosomes, but also of supranucleosome structures, and thanks to the development of genomics and 3-D genomics of higher resolution, it has become possible to determine the contacts between DNA loci with sub-nucleosomal resolution (in particular, Micro-C, Micro-C-XL methods, etc.) and determine the position and composition of nucleosomes along the genome (e.g., MNase-seq, MNase-ChIP-seq). There is a need to interpret the experimental data and build physical molecular models of chromatin folding at the supranucleosome level, taking into account the real geometric and topological parameters of protein and DNA molecules, as well as the dynamic nature of these interactions. This project is dedicated to solving this spectrum of problems. We will develop and improve original methods for modeling chromatin folding at the supranucleosome level, taking into account the topology, chirality and twisting of DNA molecules, the interaction of different types of nucleosomes with each other, as well as their interaction with the nuclear microenvironment. Approaches will be developed for integrating various types of subnucleosome resolution genomic data (Micro-C, MNase-seq, MNase-ChIP-seq, etc.) into methods for constructing chromatin folding models. Based on the developed approaches, experimental and structural data will be used to construct structural-dynamic models of chromatin folding at the supranucleosomal level and to study the variability of the chromatin structure. We will analyze the relationship of the obtained chromatin structure models with various epigenetic characteristics of genomic loci and draw conclusions about the likely relationship between the supranucleosome structure and the function of different chromatin regions. Similar approaches will be applied to study the changes in chromatin states in various types of cells.
В результате проекта будут достигнуты следующие результаты: 1. Разработаны алгоритмы мультимасштабного молекулярного моделирования нуклеосомных фибрилл с учетом топологии ДНК и структуры нуклеосом на атомистическом уровне. Предлагаемые к разработке алгоритмы позволят быстро генерировать различные структуры нуклеосомных фибрилл с атомистической точностью, осуществлять поиск оптимальных конформаций или ансамблей конформаций с учетом задаваемых энергетических функций взаимодействия частей системы и различных дополнительных целевых функций на конформацию системы. 2. Разработаны подходы интегративного моделирования структуры и динамики нуклеосомных фибрилл на основе анализа экспериментальных данных 3-D геномики и геномики субнуклеосомного разрешения и их молекулярная интерпретация. Разработанные алгоритмы моделирования фибрилл будут адаптированы для поиска конформаций фибрилл, удовлетворяющих экспериментальным данным о контактах между различными нуклеосомами, определение которых стало недавно возможным с помощью методов класса Micro-C. Отдельной подзадачей будет непосредственный анализ и фильтрация сырых данных Micro-C, а также разработка способов представления определяемых “контактов” в виде физически осмысленных ограничений на положения отдельных компонент моделируемых фибрилл на молекулярном уровне. В дополнение к использованию данных Micro-C, для моделирования реалистичных упаковок нуклеосом будут привлекаться данные методов MNase-seq и MNase-ChIP-seq, которые позволяют определять положения нуклеосом на ДНК, а также наличие гистоновых вариантов и пост-трансляционных модификаций на нуклеосомах. 3. Разработанные методов интегративного моделирования супрануклеосомной структуры хроматина будут применены для анализа экспериментальных данных 3-D геномики и геномики субнуклеосомного разрешения. Разработанные методы и алгоритмы будут применены к реальным экспериментальным данным для анализа строения хроматина на супрануклеосомном уровне. Будут проанализированы получающиеся модели укладки нуклеосом, их вариация и гетерогенность в геноме для клеточных линий различных организмов. 4. Будет изучена взаимосвязь структуры хроматина и его эпигенетических параметров. Будет проанализирована взаимосвязь между получаемой с помощью наших подходов супрануклеосомной структурой хроматина и наличием различных эпигенетических модификаций нуклеосом по экспериментальным данным (различные посттрансляционные модификации гистонов, нуклеосомы с вариантными гистонами, метилирование ДНК). Поскольку различные эпигенетические метки коррелируют с функциональной ролью участков хроматина (напр. области активной экспрессии, области наличия энхансеров и т.д.) данный анализ также поможет пролить свет на функциональную значимость различных типов укладок нуклеосом.
Источник финансирования НИР
Этапы НИР
Прикрепленные к НИР результаты
Для прикрепления результата сначала выберете тип результата (статьи, книги, . ). После чего введите несколько символов в поле поиска прикрепляемого результата, затем выберете один из предложенных и нажмите кнопку "Добавить".
Научная электронная библиотека
![]()
Геном человека – термин, используемый при описании всей генетической информации, закодированной в виде ДНК клеток человека. Клетка человека имеет два генома: сложный ядерный геном (хромосомная ДНК), содержащий более 99,9995 % всей генетической информации, и простой митохондриальный геном, в составе которого находится менее 0,0005 % ДНК. Ядерный геном распределён между 24-мя различными двуспиральными молекулами ДНК, которые в комплексе с различными гистоновыми и негистоновыми белками формируют хромосомы человека. С молекулярной точки зрения каждая хромосома клетки является сложно организованной структурой. Диплоидная клетка человека с интерфазным ядром при диаметре 5–10 мкм содержит около двух метров последовательностей молекул ДНК, которые образуют 23 пары хромосом. Гаплоидный геном человека, который характеризует половые клетки с хромосомами Х или Y, включает 23 различные хромосомы – 22 аутосомы и одну половую хромосому (гоносому) в зависимости от пола: Х – женский или Y – мужской пол. Индивидуальные хромосомы, как было сказано выше, различаются своими морфологическими характеристиками. В среднем, хромосома человека содержит около 130 млн пн, однако содержание ДНК в разных хромосомах варьирует от 40 до 260 млн пн.
Как уже сказано выше, данные о структуре, размерах и количестве митотических хромосом в клеточном ядре определяются как кариотип. Морфологическое строение хромосом на всех уровнях организации (молекулярном, микроскопическом и субмикроскопическом) определяется упаковкой нитей ДНК, организующих хромосому. На микроскопическом уровне нити ДНК формируют спирализованные хромонемы митотических хромосом. Упаковка хромонем по длине хромосом неравномерна. В них закономерно дифференцируются участки с резко выраженной и резко сниженной степенью спирализации хромонем. Последние формируют хромосомные перетяжки. Важным элементом структуры хромосом является первичная перетяжка, в участке которой расположена центромера. Она делит хромосому на два плеча – короткое (р) и длинное (q).
Структура хромосом претерпевает значительные изменения в ходе клеточного деления (клеточного цикла) и, следовательно, не является постоянной. Хромосомы интерфазных ядер (интерфазные хромосомы) в отличие от метафазных хромосом (см раздел, посвященный делению клетки) представляют собой более расправленные и диффузные клеточные структуры. Интерфазные хромосомы содержат одну хроматиду, в составе которой имеется одна двуспиральная молекула ДНК, в то время как метафазные хромосомы образованы двумя хроматидами и двумя молекулами ДНК. Хромосома, как функционирующая клеточная органелла, должна содержать минимум три типа последовательностей ДНК, формирующих её структурные компоненты: центромеру, теломеры и участок начала репликации ДНК.
Индивидуальные хромосомы содержат одну протяжённую двуспиральную молекулу ДНК диаметром 2 нм, которая претерпевает несколько уровней упаковки, формируя хроматин или ДНК-белковый комплекс (дезоксирибонуклеопротеид – ДНП). Элементарной дискретной единицей упаковки хроматина является нуклеосома. Каждая нуклеосома имеет вид глобулы и состоит из четырех пар гистоновых белков Н2А, Н2В, Н3 и Н4, содержащих по 102–135 аминокислотных остатков. Вокруг гистоновой глобулы диаметром 10 нм (октамера) располагается молекула двуспиральной ДНК длиной 146 пн (или 68 нм), образуя виток в 1,75 оборота. Соседние нуклеосомы соединяются так называемой «спейсерной» ДНК длиной около 20 нм, образуя структуры в виде «бус на нитке». На следующем этапе компактизации 10-нанометровые нуклеосомы образуют фибриллы хроматина диаметром 30 нм (в каждом витке примерно 6 нуклеосом), которые образуют большие петли. На стадии метафазы степень компактизации достигает 1 на 10000 от первоначальной длины хромосомной ДНК. Петли 30-нанометровых фибрилл хроматина содержат 20–100 тысяч пн. ДНК на каждой петле прикрепляется к осевой структуре хромосомы (рис. 4). Осевые компоненты метафазной хромосомы состоят из негистоновых белков.
![4.tif]()
Рис. 4. Организация ДНК
Как уже отмечалось, одним из структурных элементов хромосомы является центромера – место присоединения кинетохоров (макромолекулярных структур на белковой основе, участвующих в процессе расхождения хромосом при митотическом делении клетки), и слипания сестринских хроматид. Они также регулируют присоединение хромосом к веретену деления и направляют движение хромосом в ходе мейотического и митотического деления клетки. Хромосомы без центромеры (ацентрические фрагменты) не могут присоединяться к нитям веретена деления и теряются в ходе клеточного деления. У человека центромеры содержат особые типы повторяющихся ДНК, а также специфические «центромерные» белки, обеспечивающие сегрегацию хромосом в ходе митотического и мейотического деления клеток. В зависимости от положения центромеры в хромосоме, как уже сказано выше, она может быть метацентрической, субметацентрической и акроцентрической. В акроцентрических хромосомах довольно часто на коротких плечах видны небольшого размера хроматические тельца, так называемые спутники, и спутничные нити (рис. 5). Они содержат ядрышковый организатор – значимую структуру генома человека. Плечи некоторых хромосом человека содержат вторичные перетяжки.
Рис. 5. Схематическое изображение метафазных хромосом:
1 – метацентрическая хромосома; 2 – субметацентрическая хромосома; 3 – акроцентрическая хромосома. Видны: а – центромеры; б – длинные плечи (q); в – короткие плечи (p); г – теломерные участки; д – спутники; е – спутничные нити
Другими структурными элементами хромосом являются теломеры. Это специализированные структуры, содержащие особые типы ДНК и белки, которые образуют концевые участки хромосом. Теломеры выполняют несколько функций:
1) поддержание структурной целостности хромосомы;
2) обеспечение полной репликации концевых участков хромосомы;
3) поддержание организации хромосом в интерфазном ядре.
Теломеры хромосом человека представляют собой повторы нуклеотидной последовательности ТТАГГГ, общий размер которой варьирует от 3 до 20 тысяч пн. Стабильность теломер поддерживается с помощью фермента теломеразы, нарушение функциональной активности которой приводит к нарушению структуры хромосом и, как следствие, к клеточной гибели. Укорочение последовательностей теломер, которому противодействует теломераза, связано с процессами старения и малигнизации.
ДНК хромосом реплицируется в ходе периода синтеза ДНК клеточного цикла. Каждая хромосома содержит множество элементарных единиц репликации – репликонов, представляющих собой участки автономной репликации. Каждый репликон имеет одну точку инициации репликации, с которой начинается двунаправленный синтез ДНК (см предыдущий раздел, посвященный синтезу ДНК). Размеры репликонов могут различаться друг от друга. Репликоны у человека могут иметь большие размеры, достигая более чем 1 млн пн.
Строение фибрилл хроматина и их нуклеосомы
Кафедра гистологии ХНМУ Histology KNMU запись закреплена
Хроматин. Уровни упаковки хроматина. Строение хромосомы
Хроматин (греч. χρώματα — цвета, краски) — это вещество хромосом, представляющее собой комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК.
До 25—40% сухого веса хроматина составляют гистоновые белки. Гистоны являются компонентом нуклеосом, надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из гистонов четырёх типов: H2A, H2B, H3 и H4. Эти гистоны называются кóровыми. В одну нуклеосому входят по два кóровых гистона каждого типа — всего восемь белков. Линкерный гистон H1, более крупный, чем кóровые гистоны, связывается с ДНК в месте её входа на нуклеосому.
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки.
Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется транскрипционной активностью. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием, фосфорилированием, метилированием и другими модификациями.
Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины.
Хромосо́мы (др.-греч. χρῶμα — цвет и σῶμα — тело) — нуклеопротеидные структуры в ядре эукариотической клетки, в которых сосредоточена бо́льшая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. Хромосомы чётко различимы в световом микроскопе только в период митотического или мейотического деления клетки. Набор всех хромосом клетки, называемый кариотипом, является видоспецифичным признаком, для которого характерен относительно низкий уровень индивидуальной изменчивости.
Хромосома образуется из единственной и чрезвычайно длинной молекулы ДНК, которая содержит линейную группу множества генов. Необходимыми функциональными элементами хромосомы эукариот являются центромера, теломеры и точки инициации репликации. Точки начала репликации (сайты инициации) и теломеры, находящиеся на концах хромосом, позволяют молекуле ДНК эффективно реплицироваться, тогда как в центромерах сестринские молекулы ДНК прикрепляются к митотическому веретену деления, что обеспечивает их точное расхождение по дочерним клеткам в митозе.
Морфология метафазных хромосом
В ходе клеточного цикла облик хромосомы меняется. В интерфазе это очень нежные структуры, занимающие в ядре отдельные хромосомные территории, но не заметные как обособленные образования при визуальном наблюдении. В митозе хромосомы преобразуются в плотно упакованные элементы, способные сопротивляться внешним воздействиям, сохранять свою целостность и форму. Именно хромосомы на стадии профазы, метафазы или анафазы митоза доступны для наблюдения с помощью светового микроскопа. Митотические хромосомы можно увидеть у любого организма, клетки которого способны делиться митозом, исключение составляют дрожжи S.cerevisiae, чьи хромосомы слишком малы. Обычно митотические хромосомы имеют размеры в несколько микрон. Например, самая большая хромосома человека хромосома 1 имеет длину около 7 — 8 мкм в метафазе и 10 мкм в профазе митоза.
На стадии метафазы митоза хромосомы состоят из двух продольных копий, которые называются сестринскими хроматидами и которые образуются при репликации. У метафазных хромосом сестринские хроматиды соединены в районе первичной перетяжки, называемой центромерой. Центромера отвечает за расхождение сестринских хроматид в дочерние клетки при делении. На центромере происходит сборка кинетохора — сложной белковой структуры, определяющей прикрепление хромосомы к микротрубочкам веретена деления — движителям хромосомы в митозе. Центромера делит хромосомы на две части, называемые плечами. У большинства видов короткое плечо хромосомы обозначают буквой p, длинное плечо — буквой q. Длина хромосомы и положение центромеры являются основными морфологическими признаками метафазных хромосом.
В зависимости от расположения центромеры различают три типа строения хромосом:
акроцентрические хромосомы, у которых центромера находится практически на конце, и второе плечо настолько мало, что его может быть не видно на цитологических препаратах;
субметацентрические хромосомы с плечами неравной длины;
метацентрические хромосомы, у которых центромера расположена посередине или почти посередине.
Эту классификацию хромосом на основе соотношения длин плеч предложил в 1912 году российский ботаник и цитолог С. Г. Навашин. Помимо вышеуказанных трёх типов С. Г. Навашин выделял ещё и телоцентрические хромосомы, то есть хромосомы только с одним плечом. Однако по современным представлениям истинно телоцентрических хромосом не бывает. Второе плечо, пусть даже очень короткое и невидимое в обычный микроскоп, всегда присутствует.Дополнительным морфологическим признаком некоторых хромосом является так называемая вторичная перетяжка, которая внешне отличается от первичной отсутствием заметного угла между сегментами хромосомы. Вторичные перетяжки бывают различной длины и могут располагаться в различных точках по длине хромосомы. Во вторичных перетяжках находятся, как правило, ядрышковые организаторы, содержащие многократные повторы генов, кодирующих рибосомные РНК. У человека вторичные перетяжки, содержащие рибосомные гены, находятся в коротких плечах акроцентрических хромосом, они отделяют от основного тела хромосомы небольшие хромосомные сегменты, называемые спутниками. Хромосомы, обладающие спутником, принято называть SAT-хромосомами (лат. SAT (Sine Acid Thymonucleinico) — без ДНК).
Уровни компактизации хромосомной ДНК
Основу хромосомы составляет линейная макромолекула ДНК значительной длины. В молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований. Суммарная длина ДНК из одной клетки человека составляет величину порядка двух метров. При этом типичное ядро клетки человека, которое можно увидеть только при помощи микроскопа, занимает объём около 110 мкм³, а митотическая хромосома человека в среднем не превышает 5 — 6 мкм. Подобная компактизация генетического материала возможна благодаря наличию у эукариот высокоорганизованной системы укладки молекул ДНК как в интерфазном ядре, так и в митотической хромосоме. Надо отметить, что у эукариот в пролиферирующих клетках осуществляется постоянное закономерное изменение степени компактизации хромосом. Перед митозом хромосомная ДНК компактизуется в 105 раз по сравнению с линейной длиной ДНК, что необходимо для успешной сегрегации хромосом в дочерние клетки, в то время как в интерфазном ядре для успешного протекания процессов транскрипции и репликации хромосоме необходимо декомпактизоваться. При этом ДНК в ядре никогда не бывает полностью вытянутой и всегда в той или иной степени упакована. Так, расчётное уменьшение размера между хромосомой в интерфазе и хромосомой в митозе составляет всего примерно 2 раза у дрожжей и 4 — 50 раз у человека.
Упаковка ДНК в хроматин обеспечивает многократное сокращение линейных размеров ДНК, необходимое для размещения её в ядре. Она происходит в несколько этапов. Наиболее изученными являются три первых уровня упаковки: (1) накручивание ДНК на нуклеосомы с образованием нуклеосомной нити диаметром 10 нм, (2) компактизация нуклеосомной нити с образованием так называемой 30-нм фибриллы и (3) сворачивание последней в гигантские (50 — 200 тысяч п. н.) петли, закреплённые на белковой скелетной структуре ядра — ядерном матриксе.
Одним из самых последних уровней упаковки в митотическую хромосому некоторые исследователи считают уровень так называемой хромонемы, толщина которой составляет около 0,1 — 0,3 мкм. В результате дальнейшей компактизации диаметр хроматиды достигает ко времени метафазы 700 нм. Значительная толщина хромосомы (диаметр 1400 нм) на стадии метафазы позволяет, наконец, увидеть её в световой микроскоп. Конденсированная хромосома имеет вид буквы X (часто с неравными плечами), поскольку две хроматиды, возникшие в результате репликации, соединены между собой в районе центромеры.
Читайте также: