Строение и функции полудесмосом
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
- Адгезивные структуры кожи включают десмосомы, фокальные контакты, полудесмосомы и базальные мембраны.
- В первую очередь за адгезию эпидермиса отвечают десмосомы.
- Основными компонентами десмосом являются десмосомальные кадгерины (десмоглеины и десмоколлины), плакины (десмоплакин, энвоплакин и периплакин) и белки семейства Amadillo (плакоглобин и плакофиллины).
- Компоненты полудесмосом включают гомологи плакина, интегрины и коллагенозные трансмембранные белки.
- Все базальные мембраны содержат коллаген IV, ламинины, нидогены и перлекан.
- Функциональная специфичность базальных мембран обеспечивается дополнительными тканеспецифическими гликопротеинами.
- Наряду с выполнением структурной функции, десмосомы, полудесмосомы и базальная мембрана являются биологически активными компонентами клеточной сигнализации.
- Мутации в генах, кодирующих вышеперечисленные белки, вызывают разнообразные наследственные кожные заболевания — от гипотрихоза и кератодермии до буллезного эпидермолиза и синдрома Киндлера.
- Белковые компоненты десмосом, полудесмосом и базальной мембраны являются объектом поражения при аутоиммунных пузырных заболеваниях группы пузырчатки и пемфигоида, а также при приобретенном буллезном эпидермолизе.
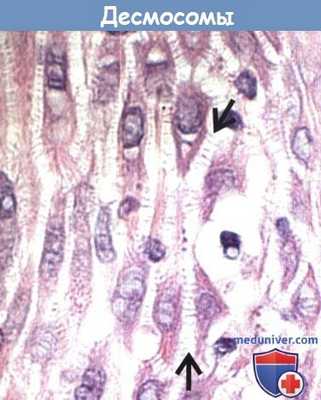
Десмосомы являются основными адгезионными межклеточными контактами в эпидермисе.
Спонгиоз эпидермиса, или межклеточный отек вследствие воспаления, приводит к разъединению кератиноцитов,
соединение между которыми сохраняется только на участках межклеточных мостиков, представляющих собой десмосомальные контакты (стрелки).
Межклеточная адгезия в эпидермисе и адгезия между клетками эпидермиса и базальной мембраной обеспечивает устойчивость кожи к воздействиям внешней среды; целостный эпидермис необходим для защиты всего организма от механических, физических и микробных патологических факторов. Основными клеточными структурами, обеспечивающими межклеточную адгезию в эпидермисе, являются десмосомы.
Адгезия на уровне эпидермально-дермального соединения осуществляется за счет адгезивных комплексов полудесмосом и базальной мембраны и связанных с ними структур. Полудесмосомы напоминают половинки десмосом; однако на молекулярном уровне между ними прослеживаются определенные отличия. Обе эти структуры представляют собой специфически организованные сцепления внутриклеточных и трансмембранных молекул. Десмосомы присоединяют цитоскелетные филаменты к межклеточным контактам, а полудесмосомы присосединяют цитоклеточные филаменты базальных эпителиальных клеток к базальной мембране.
Благодаря значительным достижениям в области молекулярной генетики и протеомики в последние годы, научные представления о молекулах десмосом, полудесмосом и базальной мембраны существенно расширились. Вслед за первоначальной успешной идентификацией белков-аутоантигенов при пузырчатке и пемфигоиде исследователи описали множество подобных молекул (как на белковом, так и на генном уровне), детально охарактеризовав их экспрессию, регуляцию и функции.
Подробно картированы эпитопы антигенов при различных аутоиммунных пузырных заболеваниях. К настоящему времени определены как минимум 24 различных гена, лежащих в основе наследственных заболеваний с нарушением эпидермальной и эпидермально-дермальной адгезии у человека и мыши. В данной главе рассматриваются морфологические, молекулярные и функциональные аспекты указанных адгезивных структур.
Десмосома (лат. macula adherens или пятно сцепления) является основной структурой клеточной адгезии в эпидермисе, которая служит для соединения поверхности клеточных мембран противолежащих кератиноцитов с внутриклеточной сетью промежуточных филаментов кератина. Десмосомы присутствуют во всех эпителиальных тканях, в том числе в ротоглотке, кишечнике, печени, сердце, легких, мочевом пузыре, почках, простате, тимусе, роговице и центральной нервной системе, хотя изоформы десмосомальных белков различаются по клеточному типу. Первоочередная роль десмосом в адгезии клеток эпидермиса подтверждается гистологической картиной при спонгиозе или внутриклеточном отеке эпидермиса, при котором соседние кератиноциты прикрепляются друг к другу только в местах десмосомальных контактов.
Возможность наблюдать эти «межклеточные мостики» в тканях появилась с изобретением светового микроскопа в 19-м веке, и этот термин был самым ранним описанием десмосом. Появление электронной микроскопии в середине 20-го века позволило получить микрографы с высокой степенью разрешения и выяснить ультраструктуру этих межклеточных контактов. И даже в 21 -м веке десмосома лучше всего определяется по электронному микрографическому изображению как электронно-плотная средняя линия в межклеточном пространстве на полпути между противолежащими плазмалеммами, окруженная с обеих сторон двумя парами электронно-плотных цитоплазматических пластинок.
Межклеточное пространство между плазмалеммами назвали десмоглеей (от греческого слова,означающего «десмосомный клей»), поскольку предполагалось, что оно обеспечивает адгезию, удерживающую клетки вместе в точке соединения.
Электронная микрофотография (А) и схематичное изображение (Б) десмосомы (масштаб не соблюден).
dg = десмоглея; dm = плотная средняя линия; dp = десмоплакин;
dsc = десмоколлины; dsg = десмоглеин; idp = внутренняя плотная пластинка; kf = филаменты кератина;
odp = нapyжнaя плотная пластинка; pg = плакоглобин; pkp = плакофиллины; рm = плазмолемма.
- Рекомендуем далее ознакомиться со статьей "Строение белков десмосом и их функции"
Строение и функции полудесмосом
• Так же как и десмосомы, полудесмосомы обеспечивают структурную устойчивость слоев эпителия
• Полудесмосомы расположены на базальной поверхности эпителиальных клеток, где они связывают внеклеточный матрикс с сетью промежуточных филаментов при участии трансмембранных рецепторов
• Полудесмосомы отличаются от десмосом по структуре и содержат, по меньшей мере, шесть уникальных белков
• Мутации в белках полудесмосом вызывают заболевания, близкие к тем, которые связаны с мутациями в генах белков десмосом
• Сигнальные процессы, регулирующие сборку полудесмосом, исследованы недостаточно
Полудесмосома представляет собой клеточный контакт, расположенный с базальной стороны плазматической мембраны эпителиальных клеток. Как показано на рисунке ниже, эта структура является комплексом, содержащим бляшки, переплетенные филаментами, и внешне выглядит как половина десмосомы.
Однако, несмотря на внешнее сходство, полудесмосомы не являются половиной десмосомы. Их основная функция заключается в прикреплении слоев эпителия к базальной ламине. Это служит еще одной чертой, отличающей полудесомому от десмосомы. В то время как обе структуры скрепляют слои эпителия вместе, в клетке они ориентируются под прямым углом по отношению друг к другу и, таким образом, противостоят различным типам механического стресса. Оба типа этих структур, связанные вместе промежуточными филаментами, образуют очень прочную сеть.
Отсутствие полудесмосом вызывает образование волдырей на поверхности ткани разных эпителиев и в том числе на коже, и такие заболевания могут заканчиваться смертельным исходом.
На рисунке ниже схематически представлено строение полудесмосомы. На цитоплазматической стороне «типичной» (тип I) полудесмосомы можно видеть пучок промежуточных филаментов (кератины 5 и 14), прикрепленных к внутренней бляшке. Эта бляшка включает белки ВР230 и HD1/плектин, связанные с белками промежуточных филаментов.
Наружная бляшка содержит два типа трансмембранных белков: интегриновый рецептор (α6β4) и представитель семейства коллагенов (известный как коллаген XVII или ВР180). От плазматической мембраны через lamina lucida в lamina densa тянутся филаменты, выполняющие якорную функцию и состоящие из ВР180 и ламинина-5, который представляет собой белок внеклеточного матрикса).
В lamina densa находится много различных ламинарных белков. Наконец, заякоривающие фибриллы, состоящие из коллагена VII, соединяют lamina densa с суббазальной lamina densa, состоящей из нескольких белков внеклеточного матрикса. В некоторых тканях, например в кишечнике, обнаружены полудесмосомы типа II, в которых белки ВР180 и ВР230 отсутствуют.
Несмотря на критическую роль, которую играют десмосомы в обеспечении поддержания архитектуры ткани, они не представляют собой статических структур. Например, при ранении кожи происходит отсоединение клеток от нижележащей базальной ламины и их перемещение в раневую область. Там они вступают в деление, восстанавливают популяцию клеток в раневой области, и затем снова прикрепляются к базальной ламине и друг к другу. Эти изменения фенотипа предполагают способность клеток к диссоциации и реассоциации контактов с матриксом и между собой. К числу таких контактов относятся полудесмосомы и десмосомы соответственно.
Один из механизмов сборки и разборки полудесмосом подтверждается экспериментами, проведенными с культурой клеток эпителия и на модели заживления раны in vitro. Результаты показывают, что при миграции клеток белки полудесмосом остаются в комплексе, который в ходе эндоцитоза интернализуется. Позже, когда клетки опять присоединяются к базальной ламине, эти комплексы снова поступают на поверхность клетки, и структура полудесмосомы восстанавливается.
Вероятно, критическую роль в сборке полудесмосом играют α6β4 интегриновые рецепторы. При добавлении к клеткам антител, блокирующих связывание α6β4 интегрина с внеклеточным лигандом (ламинином-5), на поверхности клеток не происходит образования полудесмосом. Другими экспериментами показано, что в процессе сборки полудесмосом, видимо, участвует дефосфорилирование α6 цепи интегринового рецептора. В настоящее время ведутся исследования по выяснению природы внутриклеточных сигнальных путей, ответственных за регуляцию фосфорилирования интегринового рецептора и за сборку и разборку полудесмосом.
Полудесмосомы являются специализированными структурами, формирующимися в местах контакта эпителиальных клеток и внеклеточного матрикса, называемого базальной ламиной.
Для полудесмосомы характерно скопление нитчатого материала, который заканчивается плотной бляшкой на поверхности клетки. Полудесмосомы присоединяются к базальной мембране,
которая состоит из базальной ламины и сети коллагеновых фибрилл.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
На ультраструктурном уровне полудесмосомы во многом напоминают половинки десмомом межклеточных соединений эпидермиса. Однако компоненты двух этих структур различны. Антиген буллезного пемфигоида 1 с массой 230 кД (BPAG1 или ВР230) представляет собой суперспиральный димерный белок, гомологичный плакинам, которые связваются с промежуточными филаментами. BPAG1 является основным компонентом внутренней плотной пластинки полудесмосом.
Отсутствие BPAG1 у мышей и человека ассоциируется с простым буллезным эпидермолизом. Антиген буллезного пемфигоида 2 с массой 180кД (BPAG2 или ВР180) является основным антигеном при буллезом пемфигоиде и представляет собой трансмембранный коллаген, известный сейчас как коллаген XVII с внеклеточным коллагенозным доменом. Коллаген XVII фактически служит прототипом нового семейства коллагенозных трансмембранных белков — трансмембранных молекул типа II с одним или несколькими коллагенозными ответвлениями во внеклеточный домен.
Внутриклеточными лигандами коллагена XVII являются плектин, BPAG-1 и интегрин β4, а его внеклеточными лигандами — интегрин α6 и ламинин-332. Белок массой 120 кД представляет собой эктодомен коллагена XVII, который отделяется от клеточной поверхности протеиназами семейства ADAM (аббр. от англ. α disintegrin-like and metallo-proteinase-containing — А-дезинтегрин-подобные, содержащие металлопротеиназу [белки]) вследствие расщепления в юкстамембранном домене NC-16.
Мутации в коллагене XVII инициируют пограничный буллезный эидермолиз, что указывает на то, что коллаген XVII стабилизирует взаимодействия базальных кератиноцитов с базальной мембраной. Удаление у мыши гена Col17α1 привело к умеренному образованию пузырей, аномалиям зубов и поседению волос.
Плектин, еще один димерный гомолог плакина, также является компонентом полудесмосомы. Однако его локализация в ткани не ограничивается содержащими полудесмосомы базальными мембранами. Мутации плектина приводят к простому буллезному эпидермолизу и прогрессирующей мышечной дистрофии, а в некоторых случаях — к пограничному буллезному эпидермолизу с атрезией пилоруса, что говорит о важности плектина для стабильной адгезии клеток с базальной мембраной в различных тканях.
Одним из основных компонентов полудесмосом является интегрин α6β4. Он обладает высокой аффинностью к ламинину-332 и в связи с этим необходим для интеграции полудесмосомы с расположенными под ней базальной мембраной и стромой. Мутации в цепях α6 или β4 приводят к развитию пограничного буллезного эпидермолиза в сочетании с атрезией привратника.
Еще одним компонентом полудесмосомы является CD151 — трансмембранный белок семейства тетраспанинов, представители которого повсеместно экспрессированы на клеточной поверхности. Он образует комплексы с интегринами 3αβ1 и α6β4 у базолатеральной поверхности базальных кератиноцитов и стабилизирует их функции.
Распад комплексов CD151-интегрина приводит к ремоделированию взаимодействий эпителиальных клеток базальной мембраны и предоставляет клеткам возможность мигрировать. Косвенные данные о функциях CD151 были получены в ходе изучения редкого генетического заболевания у человека. CD151 экспрессирован в тканях таких органов, как кожа и почки; кроме того ген CD 151 кодирует MER2 — антиген группы крови на эритроцитах.
Также гомозиготные нулевые мутации CD151 были обнаружены у трех MER-2 негативных пациентов, страдавших наследственным нефритом, сенсорно-невральной глухотой, претибиальным буллезным эпидермолизом и малой β-талассемией. Перечисленные симптомы позволяют предположить, что CD151 является важным компонентом базальной мембраны почек, кожи и внутреннего уха, а также играет определенную роль в эритропоэзе.
Известно, что кроме компонентов полудесмомом на базально-латеральном участке базальных кератиноцитов присутствуют также и другие адгезивные молекулы, например, интегрин α3β1 — рецептор комплекса ламинина 332-311 в базальной мембране между полудесмосомами, а также еще один трансмембранный коллаген типа XIII. Поскольку in vitro указанные белки локализованы в фокальных контактах вместе с винкулином и талином, можно предположить, что они служат связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В ходе недавних генетических исследований был обнаружен новый внутриклеточный компонент этого комплекса — кинд-лин-1. Мутации гена киндлина-1 KINDL1 отмечаются при синдроме Киндлера — заболевании, сопровождающемся образованием пузырей в младенческом возрасте, прогрессирующей пойкилодермией, атрофией кожи, пигментными аномалиями и в некоторых случаях приводящем к раку кожи.
В эпидермисе киндлин-1 экспрессирован на базолатеральной поверхности базальных кератиноцитов, а в культивированных эпителиальных клетках он локализуется вместе с винкулином — маркером клеточно-матричных адгезий, опосредованных интегринами, а также с микрофиламентами актина. Данные факты свидетельствуют о том, что киндлин-1 необходим для стабильности дермо-эпидермального соединения, и что наряду с полудесмосомами сцепление актинового цитоскелета с локусами адгезии клеток и внеклеточного матрикса является альтернативным способом прикрепления базальных эпителиальных клеток к базальной мембране.
Метод иммунофлуоресцентного окрашивания кожи человека сывороткой пемфигоида,
содержащей аутоантитела к коллагену XVII. Гипотетическая модель взаимосвязи между молекулами базальной мембраны дермо-эпидермального соединения.
На рисунке ламинин-332 представлен в виде мостика между трансмембранным интегрином полудесмосомы α6β4 и доменом NC-1 коллагена VII.
Сильная связь ламинина-332 с а6β4 и с коллагеном VII обеспечивает первичную устойчивость к воздействию сил трения.
Ее также поддерживает трансмембранный коллаген XVII, так как и его внеклеточный домен связывает ламинин-332.
В эпителиальной клетке трансмембранные элементы связывают белки плотной пластинки полудесмосом, антиген буллезного пемфигоида (BPAG) 1 и плектин, которые затем соединяются с кератинами.
Коллаген VII связывает BPAG1, интегрин α6β4 и плектин, а интегрин α6β4 вступает в связь с плектином.
Комплекс ламининов 5-6 изображен в базальной мембране между полудесмосомами, он связан интегрином α3β1 и соединен с внутриклеточными белками киндлином, талином и винкулином.
По всей вероятности, данный комплекс поддерживает устойчивость базальной мембраны.
In vitro интегрин α3β1, киндлин, талин, винкулин, а также другой трансмембранный коллаген типа XIII расположены в фокальных контактах, которые могут служить связующим звеном между базальной мембраной и сетью кортикального актина эпителия.
В темной пластинке (lamina densa) сети коллагена IV и перлекана стабилизируются нидогеном. Якорные фибриллы прикрепляются к темной пластинке посредством домена NC-1 коллагена VII.
Фибриллы проникают в дерму и либо оканчиваются в якорной пластинке, либо, образуя петлю, возвращаются назад в темную пластинку.
Сеть якорных фибрилл захватывает дермальные фибриллы, обеспечивая адгезию темной пластинки (lamina densa) к сосочковому слою дермы. В изображении молекул масштаб не соблюден.
- Рекомендуем далее ознакомиться со статьей "Строение якорных филаментов и их функции"
• Основная функция десмосом заключается в обеспечении структурной целостности слоев клеток эпителия за счет связывания их сетей промежуточных филаментов
• Десмосомы являются компонентами контактного комплекса
• В десмосомах находится, по меньшей мере, семь белков. Молекулярный состав десмосом различается в зависимости от типа клеток и тканей
• Десмосомы функционируют как адгезивные структуры и как комплексы передачи сигнала
• Мутации в белках, входящих в состав десмосом, снижают прочность эпителиальных структур. Эти мутации могут оказаться летальными, особенно если они затрагивают структуру кожи
Десмосомы являются компонентом контактного комплекса эпителиальных клеток. Они также присутствуют между клетками неэпителиального происхождения, например клетками миокарда, печени, селезенки и некоторыми клетками нервной системы. В электронном микроскопе можно наблюдать три характерных особенности десмосом:
• Массивные скопления фибрилл, проходящие через щель (в середине десмосомы, около 30 нм в ширину) между плазматическими мембранами двух рядом расположенных клеток.
• Эти фибриллы прикреплены к толстой бляшке электронно-плотного материала, расположенной на цитозольной стороне плазматической мембраны.
• Бляшки, состоящие из электронно-плотного материала, прикреплены к филаментам цитозоля каждой клетки.
Плотный материал, присутствующий на плазматической мембране, состоит из двух структур, внутренней и наружной плотных бляшек. Каждая десмосома довольно мала (средний диаметр составляет около 0,2 мкм), и на участке контакта двух клеток можно видеть несколько десмосом.
Структура десмосомы напоминает подвесной мост: филаменты цитозоля двух соседних клеток связаны между собой посредством внеклеточных филаментов, прикрепленных к «якорным» структурам на плазматической мембране. Поэтому контакт был назван десмосомой, от двух греческих слов: desmos (связь, скрепление, цепь) и soma (тело). Очевидно, что назначение такой структуры состоит в связывании двух клеток друг с другом.
Какими клеточными функциями обладает такой контакт? Вспомним две основные функции контактного комплекса, представленного на рисунке ниже: контроль межклеточного транспорта и обеспечение устойчивости к физическим нагрузкам, которые воздействуют на ткань эпителия. Поскольку десмосомы особенно характерны для клеток, подвергающихся физическим нагрузкам, например для клеток кожи и сердечной мышцы, биологи думали, что в основном им свойственна вторая из вышеуказанных функций.
В соответствии с этим, цитоплазматические филаменты, прикрепленные к плотным бляшкам, были названы тонофиламентами, что должно было отражать приложенную к ним нагрузку (от греч. tonos). Позже оказалось, что эти филаменты являются промежуточными филаментами, т. е. представляют собой основной класс цитоскелетных структур, хотя иногда их все еще называют тонофиламентами.
Помимо фибрилл промежуточных филаментов, в десмосомах идентифицировано, по меньшей мере, еще семь других типов белков, которые организованы в три семейства. Три из них (десмоглеин, десмоколин 1 и десмоколин 2) относятся к подсемейству кадгериновых рецепторов. Эти белки представляют собой основные трансмембранные белки десмосом и являются главными компонентами наружных плотных бляшек.
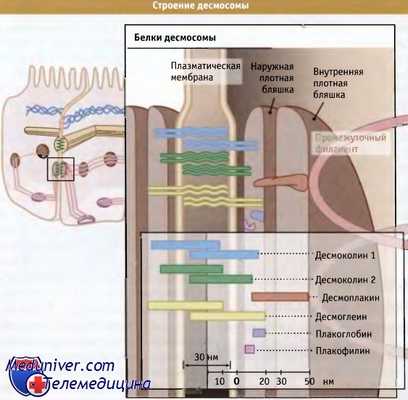
Белки десмосомы распределяются в плазматической мембране и в двух бляшках,
расположенных на поверхности клеток.
Они образуют «связующие филаменты», проходящие через межклеточное пространство, и служат сайтами связывания для цитоплазматических белков, представителей семейства armadillo (плакоглобина, плакофилинов) и семейства плакина (десмоплакина). Десмоплакин, в свою очередь, связывается с белками промежуточных филаментов во внутренней плотной бляшке.
Тонкая структура десмосомы, а также число образующихся десмосом в разных типах клеток варьирует, что отражает разнообразие нагрузок, которые должны выдерживать клетки.
В общем, десмосому можно уподобить «точечной сварке» двух клеток. Наряду с такой структурной ролью, белки десмосомы также играют важную сигнальную роль на поверхности клеток. Например, плакоглобин представляет собой белок, родственный b-катенину, который связывается с «классическими» кадгеринами адгезивного контакта. b-катенин является структурным белком адгезивного контакта, и также способен передавать сигналы в ядро клетки.
Аналогичным образом, при активации сигнальных рецепторов на поверхности клеток, плакоглобин и плакофилины начинают поступать в ядро, а плакоглобин даже непосредственно связывается с рецепторами фактора роста. В результате этого десмосомы могут контролировать экспрессию многих генов и оказывать существенное влияние на функцию внутриклеточных белков, включая белки других контактов.
Наиболее показательным примером, иллюстрирующим значение функционирования десмосом, является нарушение их структуры. В этом случае слои эпителия становятся очень непрочными, что приводит к легкой травмируемости органов, который они покрывают. Особенно это проявляется в случае кожи, склонной к образованию волдырей.
Под микроскопом видно, что, если между эпителиальными клетками отсутствуют десмосомы, то они плохо организованы, не имеют контактных комплексов и расположены небольшими группами, а не образуют единый непрерывный слой.
При разрушении или утрате десмосомальных контактов развивается ряд заболеваний, которые по своей этиологии подразделяются на две группы. Такие генодерматозы, как, например, ладонно-подошвенная кератодерма или контактный буллезный эпидермолиз, развиваются вследствие мутаций в белках десмосом или полудесмосом соответственно. Аутоиммунные буллезные дерматозы, например вульгарная пузырчатка (pemphigus vulgaris) или буллезный пемфигоид (bullous pemphigoid), возникают, когда у больных образуются аутоантитела к белкам своих десмосом или полудесмосом соответственно.
При болезнях обеих групп наблюдаются глубокие нарушения структуры и функции межклеточных контактов, и заболевание может приводить к смертельному исходу.
Для диагностики и лечения этих заболеваний используют комбинацию методов молекулярной генетики и тканевой инженерии. Мутации в генах белков десмосом обнаруживаются при пренатальном скрининге Это возможно по крайней мере при генодерматозных заболеваниях. При анализе образца плодной ткани методом ПЦР амплифицируется изучаемый ген (например, десмоколин-1). Затем с учетом полиморфизма длины фрагмента рестрикции и/или путем Саузерн-блоттинга анализируется ДНК.
Сейчас методы лечения пациентов с этими заболеваниями в основном сводятся к проведению мероприятий по защите кожных покровов и к соблюдению условий, исключающих образование волдырей. Для больных характерно плохое качество жизни. В настоящее время для лечения болезней, связанных с дисфункцией десмосомальных контактов, исследуется возможность применения искусственной кожи. При замещении поврежденных участков кожи лоскутом, представляющим собой слой здоровых клеток, интегрированных в искусственный внеклеточный матрикс, ученые надеются получить более стабильный и устойчивый к травме кожный покров, способный формировать нормальные десмосомы.
Перспективы изучения внеклеточного матрикса и межклеточных контактов
Как отмечалось в статьях на сайте, исследования внеклеточного матрикса и межклеточных контактов за последние 100 лет существенно продвинулись. В настоящее время нам известны основные компоненты этих структур, а также многое об их строении и функциях. Благодаря последним достижениям в области молекулярной генетики мы знаем, каким образом эти молекулы функционируют в процессе развития организмов.
Для того чтобы понять, что необходимо сделать в этой области дальше, давайте обратимся к практическому примеру. Посмотрите на свою руку. Поверните ее, постучите по столу пальцами, пощелкайте ими. Обратите внимание, как они сложно устроены. Ткани, из которых состоит наша рука, включают несколько миллиардов клеток. Эти клетки связываются между собой при участии внеклеточного матрикса и межклеточных контактов. Для того чтобы понять, как работает наша рука, нам необходимо знать, из каких частей она состоит, как они взаимодействуют между собой, и каким образом функционируют.
Такой подход с позиций редукционизма был применен к исследованиям внеклеточного матрикса и межклеточных контактов в таких органах, как сердце и печень.
Пока в результате исследований внеклеточного матрикса и межклеточных контактов было идентифицировано много разных типов структур и белков. Теперь мы знаем, что в этих структурах находятся сотни различных белков, однако это лишь часть от всех белков, входящих в их состав.
По мере нашего приближения к концу этого этапа исследований клеточной биологии, применение генетических методов и методов протеомики позволяет идентифицировать каждый белок и, может быть, даже делать предварительные выводы о его функциях.
Нам важно знать, каким образом взаимодействуют друг с другом различные структуры и белки. Чтобы разобраться в этом, необходимо наблюдать за большими группами взаимодействующих друг с другом клеток, выполняющих одну задачу. После того, как будет идентифицирован каждый белок, в результате применения редукционистского подхода будет достигнут этап, позволяющий in vitro собрать ткани и органы, содержащие эти белки.

Предметом развивающейся области тканевой инженерии является, главным образом, реконструкция тканей в соответствии с основными принципами клеточной биологии. По мере того как мы больше узнаем о механизмах контроля клеточных функций со стороны внеклеточного матрикса и белков зоны межклеточного контакта, мы можем применять эти сведения для лабораторного создания тканей, все больше приближающихся к природным. Уже достигнуты успехи в разработке таких искусственных органов, как кожа, кости, хрящи, печень, роговица, кровеносные сосуды и даже спинной мозг.
Одной из отличительных особенностей следующей стадии исследований внеклеточного матрикса и межклеточных контактов станет расширение основных знаний, полученных ранее, и разработка полностью функциональных органов, способных заменить органы, поврежденные в результате травмы или заболевания.
Внеклеточный матрикс состоит из сотен различных молекул, которые взаимодействуют между собой сложным и высокоупорядоченным образом. Структурная устойчивость и гидрофильное окружение тканей обеспечиваются двумя основными группами молекул внеклеточного матрикса: структурными гликопротеинами (коллагены, эластины, фибронектины, ламинины) и протеогликанами (например гепарансульфатом). Каждая из этих молекул содержит структурные элементы, обеспечивающие присоединение клеточных рецепторов, факторов роста и других молекул внеклеточного матрикса.
Эти молекулы контролируют функциональную активность клеток, обеспечивая их сборку в трехмерные тканевые структуры, активируя процессы внутриклеточной передачи сигнала, и создавая субстрат, на котором происходит миграция клеток. Известно также, что состав компонентов матрикса во времени меняется, и находящиеся в нем клетки обеспечивают его формирование и деградацию в ответ на специфические сигналы.
Идентифицировано, по крайней мере, 100 различных белков, которые, объединяясь, образуют на поверхности клеток специализированные комплексы, участвующие в их прикреплении к внеклеточному матриксу и в формировании межклеточных контактов. Эти комплексы выполняют много специализированных функций.
Плотные и септированные контакты регулируют параклеточный транспорт между слоями эпителия; адгезивные контакты и фокальные адгезии связывают поверхность клеток с актиновым цитоскелетом, тем самым обеспечивая контроль клеточной подвижности; десмосомы и полудесмосомы связывают поверхность клетки с сетью промежуточных филаментов, обеспечивая устойчивость структуры и распределяя напряжение по обширной сети. Многие из этих комплексов содержат сигнальные белки, которые сообщаются с внутренним содержимым клетки, регулируя такие ее функции, как, например, рост. Эти сигнальные сети имеют крайне сложную организацию.
Каким образом объединяются все эти молекулы, образуя самостоятельно функционирующую единицу? Выяснение этого вопроса составляет предмет следующего этапа развития клеточной биологии. Уже становится заметной основная тенденция: в тех случаях, когда идентифицировано большинство молекулярных компонентов структуры (например, базальной ламины), основной упор в дальнейших исследованиях переносится на выяснение того, как взаимодействуют эти компоненты, образуя функционирующую ткань.
Разобрав на составные части такую клеточную структуру, как базальная ламина, мы теперь пытаемся опять собрать их вместе в такую функциональную единицу, как искусственная кожа. На четвертом этапе исследований центральное место в клеточной биологии будет занимать область тканевой инженерии, в которой полученные знания используются для получения биологических структур de novo.
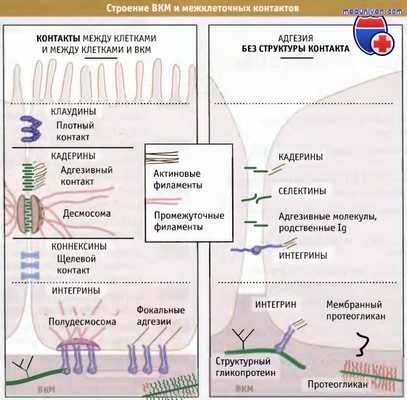
Схемы строения межклеточных контактов эпителиальных клеток (слева),
контактных адгезивных комплексов клеток неэпителиального происхождения (справа) и комплексов клеток с внеклеточным матриксом (внизу).
Показаны также основные классы компонентов внеклеточного матрикса (ВКМ).
Читайте также:
- Влияние алкоголя на атеросклероз. Коронарный атеросклероз при алкоголизме
- Причины дыхательного и метаболического ацидоза. Причины дыхательного алкалоза
- Операция при остром дивертикулите. Принципы операции при остром дивертикулите.
- Советы при кисте и свище шеи
- Советы при гастроэзофагеальном рефлюксе (ГЭРБ, желудочно-пищеводном рефлюксе, ЖПР)
