Строение и функции промежуточных филаментов
Добавил пользователь Евгений Кузнецов Обновлено: 10.01.2026
Промежуточные филаменты состоят из большой группы родственных белков, которую делят на четыре типа. Первый тип – кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярный вес кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходный молекулярный вес (45-53 тыс.). Это – виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин – характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии – в астроциты и некоторые Шванновские клетки. Периферин – входит в состав периферических и центральных нейронов.
Третий тип – белки нейрофиламентов (мол. вес от 60 до 130 тыс.) встречается в аксонах нервных клеток.
И наконец, четвертый тип – белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты, построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином, или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает a-спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину, и не имеют a-спирального строения. Наличие протяженных a-спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому, что приводит к образованию палочковидного димера, длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент, тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы и в конечном итоге в промежуточный полный филамент, состоящий из 8 продольных протофиламентов (рис. 242).
Белки ядерной ламины образуют рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживущим элементам цитоскелета.
Особенности строения и химическая устойчивость промежуточных филаментов определяет их физическую устойчивость. Они служат как бы истинно опорной системой в клетках подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ или нейрофиламенты создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клеток десминовые филаменты входят в состав z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
Промежуточные филаменты: описание, структура, функции и особенности
Промежуточные филаменты – характерная структура эукариотических клеток. Они обладают способностью к самосборке и являются химически устойчивыми. Строение и функции промежуточных филаментов определяются особенностями связей в белковых молекулах. Они служат не только для формирования клеточного каркаса, но и обеспечивают взаимодействие органелл.
Общее описание
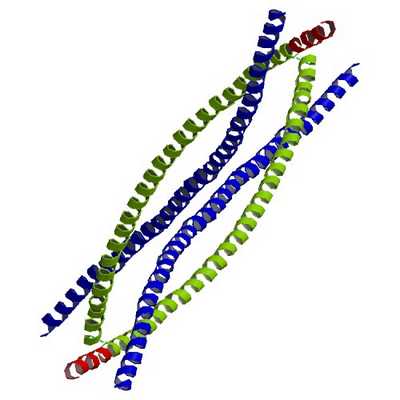
Филаменты – это белковые структуры нитчатого вида, которые принимают участие в построении цитоскелета. В соответствии с диаметром их делят на 3 класса. Промежуточные филаменты (ПФ) имеют среднюю величину в поперечном разрезе – 7-11 нм. Они занимают промежуточное положение между микрофиламентами Ø5-8 нм и микротрубочками Ø25 нм, за что и получили свое название.
Различают 2 типа этих структур:
- Ламиновые. Они находятся в ядре. Ламиновые филаменты есть у всех животных.
- Цитоплазматические. Располагаются в цитоплазме. Имеются у нематод, моллюсков, позвоночных. У последних в некоторых видах клеток могут отсутствовать (например, в глиальных клетках).
Местонахождение
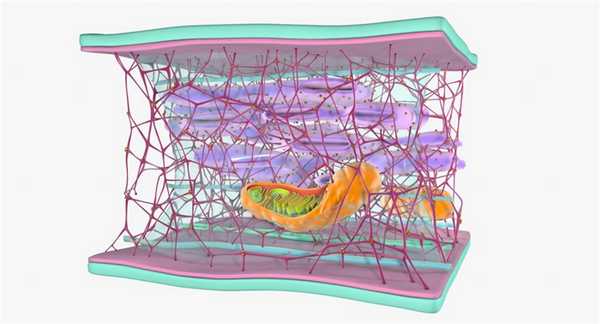
Промежуточные филаменты являются одним из основных элементов цитоскелета живых организмов, клетки которых содержат ядра (эукариоты). У прокариотов также встречаются аналоги этих фибриллярных структур. В клетках растений они не найдены.
Большая часть филаментов находится в околоядерной зоне и пучках фибрилл, которые располагаются под плазматической мембраной и отходят от центра к краям клеток. Особенно их много в тех видах, которые подвергаются механическим нагрузкам – в мышечных, эпителиальных, а также в клетках нервных волокон.
Типы белков
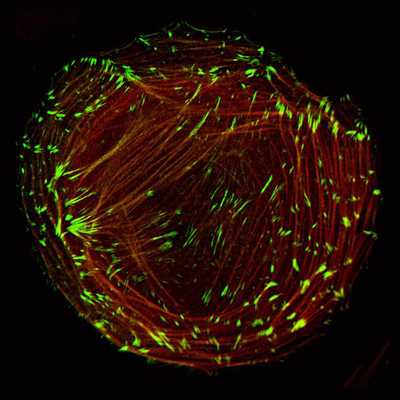
Как показывают исследования, белки, входящие в состав промежуточных филаментов, различают в зависимости от вида клеток и стадии их дифференцировки. Однако все они являются родственными.
Белки промежуточных филаментов делят на 4 типа:
- Кератины. Они образуют полимеры из двух подтипов – кислых и нейтральных. Молекулярная масса этих соединений колеблется в интервале 40 000-70 000 а. е. м. В зависимости от тканевого источника число разнообразных гетерогенных форм кератинов может достигать нескольких десятков. Их подразделяют на 2 группы по изоформе – эпителиальные (наиболее многочисленные) и роговые, из которых состоят волосы, рога, ногти и перья животных.
- Во втором типе объединяют 3 вида белков, имеющих практически одинаковую молекулярную массу (45 000-53 000 а. е. м.). К ним относятся: виментин (соединительная ткань, плоские клетки, выстилающие поверхность кровеносных и лимфатических сосудов; клетки крови); десмин (мышечная ткань); периферин (периферические и центральные нейроны); глиальный фибриллярный кислый протеин (высоко специфичный белок мозга).
- Белки нейрофиламентов, встречающиеся в нейритах – цилиндрических отростках, по которым проходят импульсы между нервными клетками.
- Белки ядерной ламины, подстилающей ядерную мембрану. Они являются предшественниками всех остальных ПФ.
Промежуточные филаменты могут состоять из нескольких видов вышеперечисленных веществ.
Свойства
Характеристики ПФ определяются следующими их особенностями:
- большое число полипептидных молекул в поперечном сечении;
- сильные гидрофобные взаимодействия, играющие важную роль в сборке макромолекул по типу скрученной суперспирали;
- образование тетрамеров с высоким электростатическим взаимодействием.
В результате промежуточные филаменты приобретают свойства прочного скрученного каната – они хорошо гнутся, но не рвутся. При обработке реагентами и сильными электролитами эти структуры последними переходят в раствор, то есть для них характерна высокая химическая стабильность. Так, после полной денатурации белковых молекул в мочевине филаменты могут самостоятельно собираться. Белки, привнесенные извне, быстро встраиваются в уже существующую структуру данных соединений.
Структура
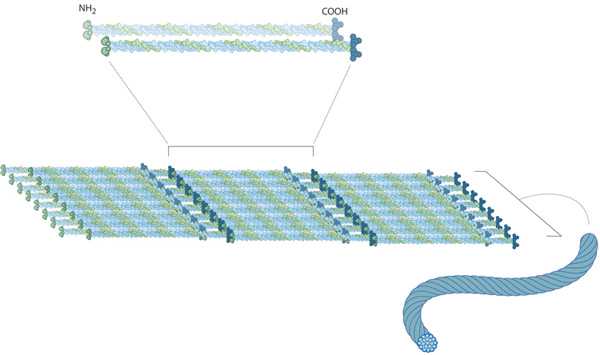
По своему строению промежуточные филаменты представляют собой неветвящиеся полимеры, которые способны как к образованию высокомолекулярных соединений, так и к деполимеризации. Их структурная неустойчивость помогает клеткам изменять свою форму.
Несмотря на то что филаменты имеют разнообразный состав по типу белков, у них существует один и тот же план строения. В центре молекул находится альфа-спираль, имеющая форму правозакрученной винтовой линии. Она образована за счет контактов между гидрофобными структурами. В ее структуре находятся 4 спиральных сегмента, разделенных короткими не спиральными участками.
На концах альфа-спирали расположены домены с неопределенной структурой. Они играют важную роль в сборке филаментов и взаимодействии с клеточными органеллами. Их размеры и белковая последовательность сильно варьируются среди разных видов ПФ.
Строительный белок
Основным строительным материалом для ПФ являются димеры – сложные молекулы, составленные из двух простых. Обычно они включают 2 разных белка, соединенных между собой палочковидными структурами.
Цитоплазматический тип филаментов состоит из димеров, которые образуют нити толщиной в 1 блок. Так как они расположены параллельно, но в противоположном направлении, то полярность отсутствует. Из этих димерных молекул впоследствии могут сформироваться более сложные.
Функции
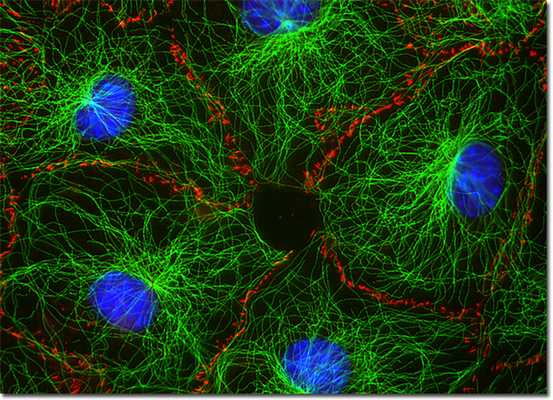
Основными функциями промежуточных филаментов являются следующие:
- обеспечение механической прочности клеток и их отростков;
- адаптация к стрессовым факторам;
- участие в контактах, обеспечивающих прочное соединение клеток (эпителиальная и мышечная ткань);
- внутриклеточное распределение белков и органелл (локализация аппарата Гольджи, лизосом, эндосом, ядер);
- участие в транспортировке липидов и передаче сигналов между клетками.
ПФ также оказывают влияние на функции митохондрий. Как показывают лабораторные эксперименты на мышах, у тех особей, которые лишены гена десмина, нарушается внутриклеточное расположение этих органелл, а сами клетки запрограммированы на меньший срок жизни. В результате снижается потребление кислорода тканями.
С другой стороны, присутствие промежуточных филаментов способствует снижению подвижности митохондрий. Если в клетку ввести искусственно виментин, то можно восстановить сеть ПФ.
Значение в медицине
Нарушения синтеза, накопления и структуры ПФ приводит к возникновению некоторых патологических состояний:
Строение и функции промежуточных филаментов
Промежуточные филаменты хрусталика
• Хрусталик глаза содержит два специфических белка промежуточных филаментов, СР49 и филензин, которые входят в VI группу гомологичных последовательностей
• Эти специфические белки промежуточных филаментов сохранили свою структуру в процессе эволюции позвоночных
Клеткам хрусталика глаза позвоночных свойственны крайне жесткие критерии программы дифференцировки, что необходимо для последующего правильного функционирования ткани. Клетки должны:
• Обладать достаточной упругостью и в то же время эластичностью, которая допускает аккомодацию хрусталика.
• Сохранять полную прозрачность для того, чтобы не затемнять хрусталик.
• Сохранять перечисленные качества на протяжении всей жизни организма.
В клетках хрусталика содержатся два специфических белка, которые образуют «филаменты типа бус». Такое название они получили за характерный профиль поверхности, видимый в электронном микроскопе (остальные промежуточные филаменты имеют гладкую поверхность).
Эти белки называются СР49 (или факинин) и филензин. Они относятся к белкам VI типа. Оба белка имеют структурные характеристики, свойственные другим типам белков, однако их последовательности не гомологичны ни одной последовательности среди белков остальных групп.
Одним из наиболее существенных различий является наличие у них «знаковой» последовательности, свойственной белкам промежуточных филаментов, а именно последовательности на конце спирального участка. У CP49 на конце стержнеобразного домена находится последовательность Tyr-His-Gly-Ile-Leu-Asp-Gly-Glu, в то время как у других белков промежуточных филаментов на этом месте присутствует консервативная последовательность Tyr-Arg-Lys-Leu-Leu-Glu-Gly-Glu.
Гены, кодирующие СР49 и филензин, сильно отличаются от генов, кодирующих другие белки промежуточных филаментов. Такое своеобразие этих генов дает им селективное преимущество перед соответствующими генами других клеток, поскольку высоко гомологичные белки хрусталика сохраняются у всех позвоночных.
Последовательность, соответствующая CP49/факинину, обнаружена в геноме сростночелюстной рыбы Fugu ribripes, позвоночного организма, эволюционно очень далеко отстоящего от млекопитающих. Консервативность структуры проявляется даже у специфической последовательности, находящейся на конце спирального участка СР49/факинина.
Белки клеток хрусталика проявляют особые свойства в силу ряда причин. Во-первых, они обеспечивают развитие максимально прозрачного хрусталика. Во-вторых, поскольку хрусталик должен функционировать в течение всей жизни организма, его полимерные структуры должны обладать исключительной биохимической устойчивостью с тем чтобы не допустить деградации белков и изменений их структуры, которые могут привести к нарушению его физических или оптических характеристик и к утрате функции.
Считается, что специфические последовательности и морфологические особенности CP49 и филензина каким-то образом способствуют поддержанию свойств этих белков. В экспериментах на животных с измененным характером экспрессии белков филаментов хрусталика показано развитие последовательных нарушений функционирования хрусталика глаза. Также показано, что доминантные мутации в CP49 являются причиной развития ранней семейной катаракты у человека.
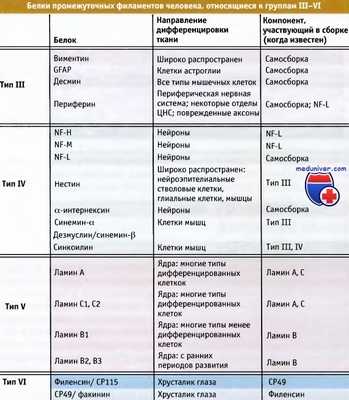
Белки промежуточных филаментов человека, объединенные в типы III—IV по принципу гомологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Промежуточные филаменты представляют собой основные компоненты ядерного и цитоплазматического цитоскелета
• Промежуточные филаменты необходимы для поддержания правильной структуры тканей и их функционирования
• По диаметру промежуточные филаменты находятся между актиновыми филаментами и микротрубочками и образуют прочные сети
• Промежуточные филаменты представляют собой полимеры, состоящие из белковых субъединиц
• Белки, из которых состоят промежуточные филаменты, гетерогенны и кодируются семейством больших и сложно устроенных генов
• У человека более 50 болезней обусловлены возникновением мутаций в белках промежуточных филаментов
Микротрубочки, актиновые филаменты (микрофиламенты) и промежуточные филаменты представляют собой три основные системы белковых филаментов, составляющих цитоскелет. Промежуточные филаменты образуют в цитоплазме и ядре сеть и присутствуют во всех клетках метазоа (животных).
В отличие от микротрубочек и актиновых филаментов, которые необходимы даже для выживания изолированных клеток in vitro, основная функция промежуточных филаментов проявляется на уровне тканевой организации, где они необходимы для надлежащего функционирования тканей и органов. Некоторые типы промежуточных филаментов участвуют в скреплении клеток друг с другом, что необходимо для формирования тканей.
Белки промежуточных филаментов кодируются несколькими большими семействами генов. Эти белки образуют сложную систему филаментов, на долю которых в клетке в нормальных физиологических условиях приходится до 80% общего клеточного белка. Внутриклеточное распределение промежуточных филаментов отличается от характерного для актиновых филаментов и микротрубочек.
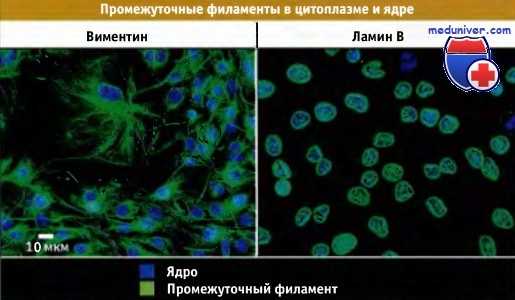
Распределение различных типов промежуточных филаментов в культивируемых фибробластах.
Иммунофлуоресцентное окрашивание на виментин и ламин В. Виментин находится в цитоплазме, а ламины в ядре.
Гистологи обнаружили их (в виде нейрофибрилл нейронов и тонофиламентов клеток эпидермиса) задолго до того, как в 1960-х гг. при электронно-микроскопическом исследовании мышечной ткани были описаны индивидуальные филаменты. В клетках мышц «промежуточные» филаменты занимали по диаметру среднее положение между «толстыми филаментами» миозина-II и «тонкими филаментами» актина. Их средний диаметр составляет около 10 нм, т. е. они толще, чем актиновые филаменты (около 8 нм), и тоньше микротрубочек (около 25 нм). Все три системы филаментов представлены рисунке ниже.
Белки промежуточных филаментов характеризуются общей молекулярной структурой и полимеризуются в филаменты, обладающие высокой механической прочностью. В электронном микроскопе они выглядят одинаково. У высших позвоночных семейство соответствующих белков организовано наиболее сложно, и этот вопрос будет рассмотрен в настоящей главе.
Похожие промежуточные филаменты также обнаружены у беспозвоночных, однако у них количество генов, кодирующих соответствующие белки, значительно меньше, чем у позвоночных. Также промежуточные филаменты беспозвоночных менее гетерогенны и обладают меньшей тканевой специфичностью, чем у млекопитающих. В геноме человека находится порядка 70 генов, кодирующих белки промежуточных филаментов. Принимая во внимание альтернативный сплайсинг для пары из них, общее количество этих белков приближается к 75.
Они представлены гораздо большим числом вариантов и более гетерогенны, чем актиновые или тубулиновые белки. Для всех белков промежуточных филаментов характерна тканеспецифическая экспрессия. Также их экспрессия изменяется в процессе дифференцировки.
Большинство сведений, касающихся экспрессии и биохимических свойств промежуточных филаментов, были получены до того, как были установлены их функции и связь с некоторыми заболеваниями. Сейчас показано, что мутации в генах белков промежуточных филаментов связаны с многими генетическими заболеваниями, которые характеризуются различными фенотипическими проявлениями. Они включают по меньшей мере 50 отдельных болезней, от фликтены до прогерии.
Почти все типы генов белков промежуточных филаментов связаны с той или иной формой проявления хрупкости тканей. Это позволяет предполагать, что для функционирования ткани in vivo необходима надлежащая механическая прочность и что в значительной степени она прямо или опосредованно связана с промежуточными филаментами. Принимая во внимание, что экспрессия генов белков промежуточных филаментов носит тканеспецифический характер, весьма возможно, что все эти белки придают клеткам тканей мельчайшие оттенки различия. Клеткам тканей необходимы различные свойства, такие как прочность, пластичность, быстрота сборки и разборки структур, обеспечивающих прочность.
Может быть, в этом кроется причина того, что в ходе эволюции возникло столь много генов, кодирующих белки промежуточных филаментов.

Основные компоненты цитоскелета в электронном микроскопе.
На ультратонком срезе клетки эпителия почки видны актиновые микрофиламенты, промежуточные филаменты К8/К18 и микротрубочки.
Опорно-двигательная система клетки. Промежуточные филаменты клетки.
Опорно-двигательная система и ее компоненты в качестве каркаса клетки обеспечивают противодействие внешним физическим факторам и вместе с тем легко перестраиваются и изменяют форму клетки, участвуют в регуляции потоков гиалоплазмы и движении органелл.
К компонентам клетки с опорно-двигательной функцией относятся промежуточные филаменты, микрофиламенты, микротрубочки и их специализированные производные (микроворсинки, стереоцилии, реснички и жгутики). С деятельностью этих структур связано выполнение практически всех клеточных функций.
Промежуточные филаменты
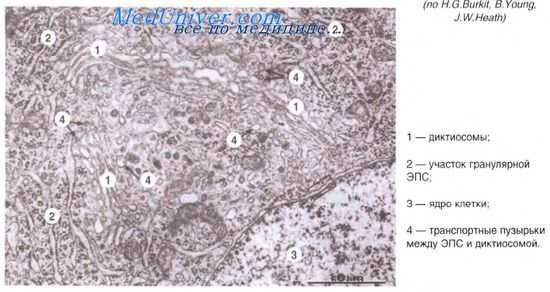
В клетках мезенхимного происхождения (соединительнотканных, эндотелиальных, клетках крови) промежуточные филаменты состоят из виментина. В мышечных клетках белок промежуточных филаментов называется десмином (в поперечноисчерченных мышечных волокнах десминовые филаменты входят в состав Z-линий). В нейронах промежуточные филаменты поддерживают форму отростков нервных клеток и фиксируют трансмембранные белки ионных каналов. В клетках эпидермиса промежуточные филаменты, связываясь с другими белками, формируют роговое вещество, представляющее собой мощный защитный слой кожи, непроницаемый для многих водорастворимых опасных для организма соединений. Наконец во всех клетках в составе ядра находятся белки ядерной пластинки (ламины). В отличие от устойчивых промежуточных филаментов цитоплазмы слои филаментов ядерной пластинки легко разбираются во время митотического деления клетки.
Основными функциями промежуточных филаментов являются: опорная, поддержание формы клетки, участие в формировании межклеточных соединений типа десмосом и полудесмосом, специальные функции в различных типах клеток.
Микрофиламенты и их производные
Это нитевидные сократимые образования толщиной около 5 нм, состоят из белка актина и являются универсальными элементами цитоскелета. В цитоплазме актиновые микрофиламенты располагаются поодиночке, либо в виде сетки и пучков, а с внутренней стороны плазмолеммы образуют сгущение — кортикальный слой клетки, или кортекс. В последнем актиновые филаменты образуют сеть с помощью связывающих (линкерных) белков, одним из которых является филамин. Филаменты актинового кортекса фиксируются к плазмолемме с помощью плазмолеммальных интегральных белков — интегринов. В специализированных участках плазмолеммы и адгезионных контактов актин может становиться трансмембранным белком.
Во всех клетках актиновые филаменты взаимодействуют с модифицированной формой миозина, представленной мономерной структурой — минимиозином. Минимиозин соединен с клеточными органеллами и облегчает их транспорт, а также перемещение везикул вдоль актиновых филаментов. При полимеризации актиновых микрофиламентов возникают локальные перемещения цитоплазмы, необходимые для движения клетки.
Специализированными производными микрофиламентов являются микроворсинки и их уплотненные комплексы — стереоцилии. Микроворсинки — это тонкие (0,1 мкм) и длинные (около 1 мкм) выросты апикальной (верхушечной) части клеток. Внутри каждой микроворсинки располагается пучок актиновых микрофиламентов в количестве 20-30. Одними концами филаменты закреплены на вершине микроворсинки, а нижняя часть филаментов вплетается в актиновый кортекс. Филаменты связываются в пучок поперечно расположенными белковыми молекулами (связками) фасцина и фимбрина. В составе микроворсинок обнаружен и сократительный белок минимиозин, который вызывает укорочение и удлинение микроворсинок.
Основными функциями микрофиламентов являются: поддержание формы и придание жесткости клетке (осуществляется кортексом); участие в формировании межклеточных соединений, участие в транспортных процессах — эндо-, пино-, экзоцитозе (осуществляется кортексом); участие в процессах перемещения клеточных органелл, транспортных и секреторных пузырьков (осуществляется актиновыми микрофиламентами с минимиозином, ассоциированным с поверхностью указанных структур) и в образовании микроворсинок и стереоцилии, в формировании специализированных для мышечных структур акто-миозиновых сократительных комплексов, а также в образовании клеточной перетяжки при цитотомии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
