Строение и функции ламинов
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
Строение и функции ламинов
К типу V белков промежуточных филаментов относятся ламины, которые по ряду своих свойств существенно отличаются от белков цитоплазматических филаментов:
• Они локализуются внутри ядра
• Для них характерен альтернативный сплайсинг
• Они подвергаются модификациям, которые обеспечивают им прикрепление к мембране
• Они обладают стержнеобразными доменами с крайне протяженными спиральными участками 1В. Эту особенность они разделяют с белками промежуточных филаментов беспозвоночных, и
• Для них характерен совершенной иной способ сборки филаментов, и они никогда не образуют сополимеров с белками промежуточных филаментов, не относящимися к типу V.
Ламины образую прочную сеть филаментов на внутренней поверхности ядерной мембраны, где они взаимодействуют с набором специфических белков, включая белки, связывающиеся с ламином, и рецептор ламина В. В результате такого взаимодействия образуется и поддерживается функциональное окружение ядра клетки. У млекопитающих три гена (LMNA, LMNB1 и LMNB2) кодируют синтез шести белков: ген LMNA в результате альтернативного сплайсинга образует три иРНК, соответствующие белкам А, С1 и С2 (известные под общим названием ламины A-типа).
Ген LMNB1 кодирует ламин В, а иРНК ламина В2 в результате сплайсинга может транслироваться в В2 или В3. Ламины В-типа экспрессируются во всех клетках, начиная с раннего эмбионального периода, в то время как образование ламинов A-типа ограничено более дифференцированными клетками. Например, базальные кератиноциты кожного эпидермиса экспрессируют только ламин В2, а по мере их дифференцировки одновременно начинают экспрессироваться ламины A-типа. Экспрессия ламинов С2 и В3 и их гомологов у других позвоночных ограничивается герминативными клетками.
Белки филаментов ламины характеризуются значительными структурными отличиями от белков цитоплазматических промежуточных филаментов. Сборка их в филаменты также отличается от процесса, характерного для цитоплазматических филаментов. У ламинов спирализованный субдомен 1 содержит шесть гептад аминокислот (всего 42 остатка), которые отсутствуют в белках цитоплазматических филаментов позвоночных.
Такой разницы в размерах стержнеобразных доменов ламинов достаточно для предотвращения возможности их сополимеризации с белками других промежуточных филаментов. Длинные спирализованные субдомены 1 также обнаружены в белках промежуточных филаментов цитоплазмы у беспозвоночных, что рассматривается как веское доказательство того, что они являются достаточно «древними» в эволюционном плане.
Иммунофлуоресцентное окрашивание ламина В в фибробластах на разных стадиях клеточного цикла.
Ламин В локализуется в ядерной оболочке в интерфазе, однако в профазе, по мере его фосфорилирования, фрагментирует.
В метафазе ламин В остается в диспергированном состоянии и в телофазе реассоциирует с хроматином,
формируя новую оболочку вокруг каждого дочернего ядра, образующегося при цитокинезе.
Поэтому считается, что ламины относятся к эволюционно наиболее древним формам промежуточных филаментов. Вероятно, создание механизма защиты хрупких нитей ДНК от разрывов явилось ранним и существенным шагом на пути эволюции сложных организмов.
Как показано на рисунке ниже у клеток млекопитающих, в митозе, ядерная оболочка распадается, и для того, чтобы это могло произойти, ядерная ламина должна диссоциировать. В профазе происходит фосфорилирование в головных и хвостовых доменах ламинов. Это осуществляется под действием митотической киназы Cdk1 и приводит к разборке ламины. Хвостовые домены также содержат последовательности, которые специфически направляют ламины в ядро (сигнал ядерной локализации) и удерживают их там (мембранное заякоривание, которое отсутствует у ламинов А-типа).
В митозе ламины А- и В-типа ведут себя по-разному. Ламины В-типа во время всего митоза остаются связанными с фрагментами везикул ядерной мембраны, в то время как ламины A-типа распределяются по всей цитоплазме. В конце митоза, когда вновь формируется ядерная оболочка, ламины постепенно связываются с конденсированным хроматином. Ламины В-типа взаимодействуют с ядерной мембраной посредством посттрансляционной модификации липидов по местам расположения консервативных последовательностей на конце хвостового домена.
В ламинах A-типа этот сайт удаляется при сплайсинге РНК или при посттрансляционном протеолизе. Таким образом, в большинстве клеток лишь В-ламин может непосредственно взаимодействовать с ядерной мембраной. Однако в генеративных клетках (сперматозоиды) С2 ламин обладает дополнительным механизмом заякоривания, который обеспечивает связывание его головного домена с ядерной мембраной.
Выяснение механизмов взаимосвязи между мутациями ламинов и возникновением определенных заболеваний представляет собой трудную задачу. Мутации в ламинах A-типа связаны с разнообразными генетическими нарушениями, которые затрагивают мышечную, нервную и жировую ткань. Эти нарушения варьируют от семейной парциальной липодистрофии (потеря жировой ткани из некоторых участков тела) до различных форм прогрессирующей периферической нейродегенерации (болезнь Charcot-Marie-Tooth типа 2В1) и прогерии. Как показывают эксперименты на культурах клеток, мутации, которые нарушают функции ламинов или полностью их выключают, приводят к снижению прочности ядерной оболочки, которая становится неспособной поддерживать свою форму; у больных развиваются спонтанные грыжи и пониженная устойчивость к механическим нагрузкам.
У человека мутации в ламине В-типа не обнаружены, и, вероятно, они являются летальными, поскольку эти ламины экспрессируются в раннем эмбриогенезе во всех клетках. Однако мыши, в клетках которых экспрессируется укороченный, поврежденный вариант ламина В, характеризуются множественными дефектами развития, напоминающими многие патологии человека, связанные с мутациями в ламинах A-типа, которые вскоре после рождения оказываются летальными. Эта модель поможет прояснить механизмы развития некоторых болезней человека.
Исследование последствий нарушения функций некоторых белков оказывается чрезвычайно информативным для понимания белковых функций вообще, и, конечно, это, в частности, относится и к промежуточным филаментам. Разумеется, мы не может утверждать, что в полной мере выяснили патогенез того или иного заболевания, однако в случае кератинов, десмина, GFAP и белков нейрофиламентов существует интуитивная связь между клиническими его проявлениями и повышенной травмируемостью клеток Однако постоянно пополняющийся список разнообразных «ламинопатий» порождает вопрос, действительно ли все они связаны лишь со снижением эластичности клеток и тканей, имеющей первичную или вторичную природу.
Конечно, на уровне клетки, многие типы физиологического стресса могут переходить в механический стресс. Так, например, воздействие химических соединений может вызвать увеличение осмотического давления. Наоборот, ламинопатии могут отражать ускоренную селективное удаление из ткани поврежденных клеток с первичной тканевой мишенью, определяемой другими, пока неидентифицированными факторами. В этой области предстоит выполнить еще много исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ядерная ламина; структура и функции
Ядерная ламина (ядерная пластинка) — жесткая фибриллярная белковая сеть, образованная белками-ламининами (промежуточными филаментами), подстилает ядерную мембрану, поддерживая ее. Она представляет собой фиброзный слой ядерной оболочки с поровыми комплексами. Связана с интегральными белками слоем, состоящим из переплетенных промежуточных филаментов (ламинов), образующих кариоскелет. К ламине прикреплены нити хромосомной ДНК, т.е. участвует в организации хроматина. Белки поровых комплексов структурно связаны с белками ядерной ламины, которая участвует в их организации. Таким образом, ламина играет очень важную роль в поддержании формы ядра, упорядоченной укладке хроматина, структурной организации поровых комплексов и формировании кариолеммы при делении клеток (дезинтеграция ядерной оболочки в профазе и интеграция в телофазе).
75.Хроматин. Хроматин – мелкие зернышки и глыбки, который обнаруживается в ядре клеток и хорошо воспринимает краситель (хромос), откуда и произошло его название. В химическом плане хроматин состоит из комплекса ДНК и белка (туда также входит РНК) и соответствует хромосомам, которые в интерфазном ядре представлены тонкими нитями и неразличимы как индивидуальные структуры. Хроматин – вещество хромосом. Хроматин состоит из хроматиновых фибрилл, которые могут располагаться в ядре рыхло или компактно. На этом основании различают два вида хроматина: эухроматин - рыхлый или деконденсированный (деспирализованный) хроматин, слабо окрашивается основными красителями и не виден в световой микроскоп, он доступен для транскрипции; гетерохроматин - компактный или конденсированный (спирализованный) хроматин, хорошо окрашивается этими же красителями и виден в световой микроскоп. При подготовке клетки к делению (интерфаза) в ядре происходит спирализация хроматиновых фибрилл и превращение хроматина в хромосомы. После деления в ядрах дочерних клеток происходит деспирализация хроматиновых фибрилл и хромосомы снова преобразуются в хроматин. Следовательно, хроматин и хромосомы представляют собой различные фазы одного и того же вещества. Таким образом, по морфологическим признакам ядра (по соотношению содержания эу- и гетерохроматина) можно оценить активномть процессов транскрипции (синтетическую функцию клетки).При ее повышении это соотношение изменяется в пользу эухроматина, и наоборот.При полном подавлении функции ядра (например, в поврежденных и гибнущих клетках, при ороговении эпителия) оно уменьшается в размерах, содержит только гетерохроматин и окрашивается основными красителями интенсивно и равномерно. Это явление – кариопикноз. Распределение гетерохроматина и соотношение содержания эу- и гетерохроматина характерны для клеток каждого типа, что позволяет осуществлять их идентификацию. Вместе с тем имеются общие закономерности распределения гетерохроматина в ядре: его скопления располагаются под кариолеммой, прерываясь в области пор (что обусловлено его связью с ламиной) и вокруг ядрышка. Более мелкие глыбки разбросаны по всему ядру. Тельце Бара – скопление гетерохроматина, соответствующее одной Х-хромосоме у особей женского пола, которая в интерфазе скручена и неактивна. В большинстве клеток оно лежит у кариолеммы, а в гранулоцитах крови имеет вид маленькой добавочной дольки ядра («барабанной палочки»). Выявление тельца Бара (обычно в эпителиальных клетках слизистой оболочки полости рта) используется как диагностический тест для определения генетического пола.
76.Диффузный и конденсированный хроматин (эу- и гетерохроматин).
Хроматин – мелкие зернышки и глыбки, который обнаруживается в ядре клеток и хорошо воспринимает краситель (хромос), откуда и произошло его название. В химическом плане хроматин состоит из комплекса ДНК, РНК и белка, где ДНК находится в разной степени конденчации, и соответствует хромосомам, которые в интерфазном ядре представлены тонкими нитями и неразличимы как индивидуальные структуры. Хроматин – вещество хромосом. Хроматин состоит из хроматиновых фибрилл, которые могут располагаться в ядре рыхло или компактно. На этом основании различают два вида хроматина: эухроматин - рыхлый или деконденсированный (деспирализованный) хроматин, слабо окрашивается основными красителями и не виден в световой микроскоп, он доступен для транскрипции; гетерохроматин - компактный или конденсированный (спирализованный) хроматин, хорошо окрашивается этими же красителями и виден в световой микроскоп. При подготовке клетки к делению (интерфаза) в ядре происходит спирализация хроматиновых фибрилл и превращение хроматина в хромосомы. После деления в ядрах дочерних клеток происходит деспирализация хроматиновых фибрилл и хромосомы снова преобразуются в хроматин. Следовательно, хроматин и хромосомы представляют собой различные фазы одного и того же вещества. Таким образом, по морфологическим признакам ядра (по соотношению содержания эу- и гетерохроматина) можно оценить активномть процессов транскрипции (синтетическую функцию клетки).При ее повышении это соотношение изменяется в пользу эухроматина, и наоборот.При полном подавлении функции ядра (например, в поврежденных и гибнущих клетках, при ороговении эпителия) оно уменьшается в размерах, содержит только гетерохроматин и окрашивается основными красителями интенсивно и равномерно. Это явление – кариопикноз. Распределение гетерохроматина и соотношение содержания эу- и гетерохроматина характерны для клеток каждого типа, что позволяет осуществлять их идентификацию. Вместе с тем имеются общие закономерности распределения гетерохроматина в ядре: его скопления располагаются под кариолеммой, прерываясь в области пор (что обусловлено его связью с ламиной) и вокруг ядрышка (перинуклеарно). Более мелкие глыбки разбросаны по всему ядру. Тельце Бара – скопление гетерохроматина, соответствующее одной Х-хромосоме у особей женского пола, которая в интерфазе скручена и неактивна. В большинстве клеток оно лежит у кариолеммы, а в гранулоцитах крови имеет вид маленькой добавочной дольки ядра («барабанной палочки»). Выявление тельца Бара (обычно в эпителиальных клетках слизистой оболочки полости рта) используется как диагностический тест для определения генетического пола.
Строение и функции биологических мембран
Биологические мембраны - общее название функционально активных поверхностных структур, ограничивающих клетки (клеточные, или плазматические мембраны) и внутриклеточные органеллы (мембраны митохондрий, ядер, лизосом, эндоплазматического ретикулума и др.). Они содержат в своем составе липиды, белки, гетерогенные молекулы (гликопротеины, гликолипиды)и в зависимости от выполняемой функции многочисленные минорные компоненты: коферменты, нуклеиновые кислоты, антиоксиданты, каротиноиды, неорганические ионы и т. п.
Согласованное функционирование мембранных систем – рецепторов, ферментов, транспортных механизмов - помогает поддерживать гомеостаз клетки и в то же время быстро реагировать на изменения внешней среды.
К основным функциям биологических мембран можно отнести:
· отделение клетки от окружающей среды и формирование внутриклеточных компартментов (отсеков);
· контроль и регулирование транспорта огромного многообразия веществ через мембраны;
· участие в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов;
· преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ.
Молекулярная организация плазматической (клеточной) мембраны у всех клеток примерно одинакова: она состоит из двух слоев липидных молекул с множеством включенных в нее специфических белков. Одни мембранные белки обладают ферментативной активностью, тогда как другие связывают питательные вещества из окружающей среды и обеспечивают их перенос в клетку через мембраны. Мембранные белки различают по характеру связи с мембранными структурами. Одни белки, называемые внешними или периферическими, непрочно связаны с поверхностью мембраны, другие, называемые внутренними или интегральными, погружены внутрь мембраны. Периферические белки легко экстрагируются, тогда как интегральные белки могут быть выделены только при помощи детергенов или органических растворителей. На рис. 4 представлена структура плазматической мембраны.
Внешние, или плазматические, мембраны многих клеток, а также мембраны внутриклеточных органелл, например, митохондрий, хлоропластов удалось выделить в свободном виде и изучить их молекулярный состав. Во всех мембранах имеются полярные липиды в количестве, составляющем в зависимости от типа мембран от 20 до 80% ее массы, остальное приходится главным образом на долю белков. Так, в плазматических мембранах животных клеток количество белков и липидов, как правило, примерно одинаково; во внутренней митохондриальной мембране содержится около 80% белков и только 20% липидов, а в миелиновых мембранах клеток мозга наоборот, около 80% липидов и только 20% белков.
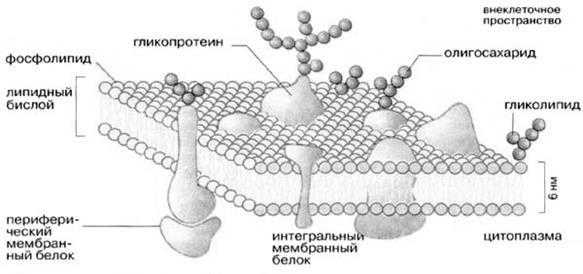
Рис. 4. Структура плазматической мембраны
Липидная часть мембран представляет собой смесь различного рода полярных липидов. Полярные липиды, к числу которых относятся фосфоглицеролипиды, сфинголипиды, гликолипиды не запасаются в жировых клетках, а встраиваются в клеточные мембраны, причем в строго определенных соотношениях.
Все полярные липиды в мембранах постоянно обновляются в процессе метаболизма, при нормальных условиях в клетке устанавливается динамическое стационарное состояние, при котором скорость синтеза липидов равна скорости их распада.
В мембранах животных клеток присутствуют в основном фосфоглицеролипиды и в меньшей степени сфинголипиды; триацилглицеролы обнаруживаются лишь в следовых количествах. Некоторые мембраны животных клеток, в особенности наружная плазматическая мембрана, содержит значительные количества холестерола и его эфиров (рис.5).
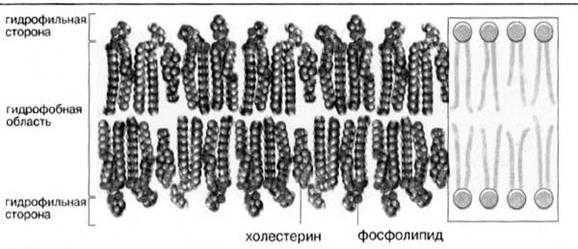
Рис.5. Мембранные липиды
В настоящее время общепринятой моделью строения мембран является жидкостно-мозаичная, предложенная в 1972 году С. Синджером и Дж. Николсоном.
Согласно ей белки можно уподобить айсбергам, плавающим в липидном море. Как уже указывалось выше, существуют 2 типа мембранных белков: интегральные и периферические. Интегральные белки пронизывают мембрану насквозь, они являются амфипатическими молекулами. Периферические белки не пронизывают мембрану и связаны с ней менее прочно. Основной непрерывной частью мембраны, то есть ее матриксом, служит полярный липидный бислой. При обычной для клетки температуре матрикс находится в жидком состоянии, что обеспечивается определенным соотношением между насыщенными и ненасыщенными жирными кислотами в гидрофобных хвостах полярных липидов.
Жидкостно-мозаичная модель предполагает также, что на поверхности расположенных в мембране интегральных белков имеются R-группы аминокислотных остатков (в основном гидрофобные группы, за счет которых белки как бы «растворяются» в центральной гидрофобной части бислоя). В то же время, на поверхности периферических, или внешних белков, имеются в основном гидрофильные R-группы, которые притягиваются к гидрофильным заряженным полярным головкам липидов за счет электростатических сил. Интегральные белки, а к ним относятся ферменты и транспортные белки, обладают активностью только в том случае, если находятся внутри гидрофобной части бислоя, где они приобретают необходимую для проявления активности пространственную конфигурацию (рис.6). Следует еще раз подчеркнуть, что ни между молекулами в бислое, ни между белками и липидами бислоя не образуется ковалентных связей.
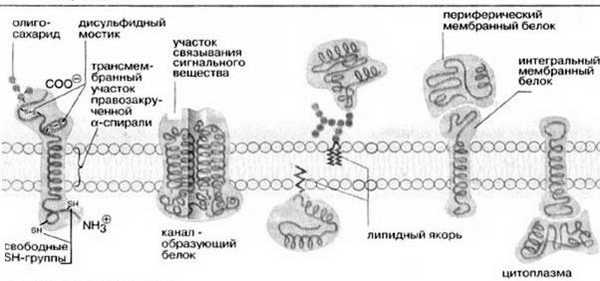
Рис.6. Мембранные белки
Мембранные белки могут свободно перемещаться в латериальной плоскости. Периферические белки буквально плавают на поверхности бислойного «моря», а интегральные белки, подобно айсбергам, почти полностью погружены в углеводородный слой.
В большинстве своем мембраны ассиметричны, то есть имеют неравноценные стороны. Эта ассиметричность проявляется в следующем:
· во-первых, в том, что внутренняя и внешняя стороны плазматических мембран бактериальных и животных клеток различаются по составу полярных липидов. Так, например, внутренний липидный слой мембран эритроцитов человека содержит в основном фосфатидилэтаноламин и фосфатидилсерин, а внешний – фосфатидилхолин и сфингомиелин.
· во-вторых, некоторые транспортные системы в мембранах действуют только в одном направлении. Например, в мембранах эритроцитов имеется транспортная система («насос»), перекачивающая ионы Nа + из клетки в окружающую среду, а ионы К + - внутрь клетки за счет энергии, освобождающейся при гидролизе АТФ.
· в-третьих, на внешней поверхности плазматических мембран содержится очень большое число олигосахаридных группировок, представляющих собой головки гликолипидов и олигосахаридные боковые цепи гликопротеинов, тогда как на внутренней поверхности плазматической мембраны олигосахаридных группировок практически нет.
Ассиметричность биологических мембрам сохраняется за счет того, что перенос индивидуальных молекул фосфолипидов с одной стороны липидного бислоя на другую очень затруднен по энергетическим соображениям. Полярная молекула липида способна свободно перемещаться на своей стороне бислоя, но ограничена в возможности перескочить на другую сторону.
Подвижность липидов зависит от относительного содержания и типа присутствующих ненасыщенных жирных кислот. Углеводородная природа жирнокислотных цепей сообщает мембране свойства текучести, подвижности. В присутствии цис-ненасыщенных жирных кислот силы сцепления между цепями слабее, чем в случае одних насыщенных жирных кислот, и липиды сохраняют высокую подвижность и при низкой температуре.
На внешней стороне мембран имеются специфические распознающие участки, функция которых состоит в распознавании определенных молекулярных сигналов. Например, именно посредством мембраны некоторые бактерии воспринимают незначительные изменения концентрации питательного вещества, что стимулирует их движение к источнику пищи; это явление носит название хемотаксиса.
Мембраны различных клеток и внутриклеточных органелл обладают определенной специфичностью, обусловленной их строением, химическим составом и функциями. Выделяют следующие основные группы мембран у эукариотических организмов:
· плазматическая мембрана (наружная клеточная мембрана, плазмалемма),
· мембраны аппарата Гольджи, митохондрий, хлорпластов, миелиновых оболочек,
У прокариотических организмов помимо плазматической мембраны существуют внутрицитоплазматические мембранные образования, у гетеротрофных прокариот они называются мезосомами. Последние образуются впячиванием внуть наружной клеточной мембраны и в некоторых случаях сохраняют с ней связь.
Мембрана эритроцитов состоит из белков (50%), липидов (40%) и углеводов (10%). Основная часть углеводов (93%) связана с белками, остальная – с липидами. В мембране липиды расположены асимметрично в отличие от симметричного расположения в мицеллах. Например, кефалин находится преимущественно во внутреннем слое липидов. Такая асимметрия поддерживается, по-видимому, за счет поперечного перемещения фосфолипидов в мембране, осуществляемого с помощью мембранных белков и за счет энергии метаболизма. Во внутреннем слое эритроцитарной мембраны находятся в основном сфингомиелин, фосфатидилэтаноламин, фосфатидилсерин, в наружном слое – фосфатидилхолин. Мембрана эритроцитов содержит интегральный гликопротеин гликофорин, состоящий из 131 аминокислотного остатка и пронизывающий мембрану, и так называемый белок полосы 3, состоящий из 900 аминокислотных остатков. Углеводные компоненты гликофорина выполняют рецепторную функцию для вирусов гриппа, фитогемагглютининов, ряда гормонов. В эритроцитарной мембране обнаружен и другой интегральный белок, содержащий мало углеводов и пронизывающий мембрану. Его называют туннельным белком (компонент а), так как предполагают, что он образует канал для анионов. Периферическим белком, связанным с внутренней стороной эритроцитарной мембраны, является спектрин.
Миелиновые мембраны, окружающие аксоны нейронов, многослойны, в них присутствует большое количество липидов (около 80%, половина из них – фосфолипидов). Белки этих мембран важны для фиксации лежащих друг над другом мембранных солев.
Мембраны хлоропластов. Хлоропласты покрыты двухслойной мембраной. Наружная мембрана имеет некоторое сходство с таковой у митохондрий. Помимо этой поверхностной мембраны в хлоропластах имеется внутренняя мембранная система – ламеллы. Ламеллы образуют или уплощенные пузырьки – тилакоиды, которые, располагаясь друг над другом, собираются в пачки (граны) или формируют мембранную систему стромы (ламеллы стромы). Ламеллы гран и стромы наружной стороне мембраны тилакоидов сосредоточены гидрофильные группировки, галакто- и сульфолипидов. Фитольная часть молекулы хлорофилла погружена в глобулу и находится в контакте в гидрофобными группами белков и липидов. Порфириновые ядра хлорофилла в основном локализованы между соприкасающимися мембранами тилакоидов гран.
Внутренняя (цитоплазматическая) мембрана бактерий по структуре сходна с внутренними мембранами хлоропластов и митохондрий. В ней локализованы ферменты дыхательной цепи, активного транспорта; ферменты, участвующие в образовании компонентов мембраны. Преобладающим компонентом бактериальных мембран являются белки: соотношение белок/липид (по массе) равно 3:1. Наружная мембрана грамотрицательных бактерий по сравнению с цитоплазматической содержит меньшее количество различных фосфолипидов и белков. Обе мембраны различаются по липидному составу. Во внешней мембране находятся белки, образующие поры для проникновения многих низкомолекулярных веществ. Характерным компонентом наружной мембраны является также специфический липополисахарид. Ряд белков наружной мембраны служит рецепторами для фагов.
Мембрана вирусов. Среди вирусов мембранные структуры характерны для содержащих нуклеокапсид, который состоит из белка и нуклеиновой кислоты. Это «ядро» вирусов окружено мембраной (оболочка). Она также состоит из двойного слоя липидов с включенными в него гликопротеинами, расположенными в основном на поверхности мембраны. У ряда вирусов (микровирусы) в мембраны входит 70-80% всех белков, остальные белки содержатся в нуклеокапсиде.
Таким образом, мембраны клеток представляют собой очень сложные структуры; составляющие их молекулярные комплексы образуют упорядоченную двумерную мозаику, что придает поверхности мембран биологическую специфичность.
Строение и функции ядерной ламины
• Ядерная ламина состоит из белков промежуточных филаментов, называемых ламинами
• Ядерная ламина расположена за внутренней ядерной мембраной и физически связана с ней интегральными мембранными белками
• Ядерная ламина участвует в сборке ядерной оболочки и может выполнять функции ее физической поддержки
• Ядерная ламина связана с хроматином посредством белков. Это может обусловливать ее роль в репликации и транскрипции ДНК
• У дрожжей и некоторых других одноклеточных эукариот ядерная ламина отсутствует
Наличие ядерной ламины — сети промежуточных филаментов, расположенной за внутренней ядерной мембраной, является характерным признаком, свойственным ядрам клеток Metazoa. Как показано на рисунке ниже, ламина легко выявляется методом непрямой иммунофлюоресценции, с использованием антител к одному из белков, входящих в ее состав.
В электронном микроскопе ламина выглядит как сеть, состоящая из отдельных волокон. На рисунке также представлены типичные неупорядоченные филаменты ламины, расположенные прямо за внутренней ядерной мембраной.
Белки ядерной ламины (называемые ламины) напоминают кератиновые белки промежуточных филаментов цитоплазмы. Так же как и кератины, они называются белками промежуточных филаментов, поскольку образуемые ими филаменты (10-20 нм) по размеру занимают промежуточное положение между актиновыми микрофиламентами (7 нм) и микротрубочками (25 нм). Целостность филаментов ламины нарушается ЯПК, которые прикрепляются к ней.
Наряду с белками промежуточных филаментов, ядерная ламина также содержит набор интегральных мембранных белков, которые называются белками, связанными с ламиной (LAP). Некоторые из этих белков участвуют во взаимодействиях между ламиной и внутренней мембраной ядра. Как показано на рисунке ниже, ламина закрепляется на внутренней ядерной мембране двумя типами связей. Один тип образуется между белками ламины и интегральными белками внутренней мембраны ядра Другой тип возникает при взаимодействии полипептидной цепи ламинов с липидной фарнезильной группой внутренней ядерной мембраны.
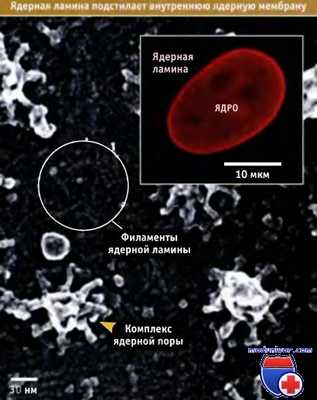
Для визуализации ядерной ламины с помощью флуоресцентной микроскопии использовали антитела к белкам ламины (в рамке).
На фотографии, полученной с помощью электронного микроскопа, видны ядерные корзины ядерных поровых комплексов (ЯПК) и филаменты ядерной ламины.
Геном растений не содержит генов ядерных ламинов, однако растения содержат другие структурные белки, которые выполняют такие же функции, как и ламины клеток млекопитающих. Дрожжи (S. cerevisiae и S. pombe) и некоторые другие одноклеточные эукариоты не содержат ламинов, и поэтому не образуют ламины. С чем это может быть связано?
Существуют, по меньшей мере, две возможные причины, объясняющие отсутствие ламины у одноклеточных различием в величине ядер у клеток дрожжей (около 1 мкм в диаметре) и многоклеточных организмов (порядка 10 мкм в диаметре). Первая возможность заключается в том, что для дрожжевых клеток характерен закрытый митоз, при котором ядерная оболочка в течение всего времени остается интактной. Напротив, в клетках многоклеточных эукариот ядерная оболочка разрушается в начале митоза. После сегрегации хромосом вокруг каждого их набора образуется новая ядерная оболочка. Считается, что в это время ламина играет главную роль в перестройке организации ядра.
Во-вторых, ламина может обеспечивать дополнительную структурную поддержку для более крупной ядерной оболочки в клетках Metazoa.
Наряду с той ролью, которую ядерная ламина выполняет в сборке и поддержании структуры ядра, ее взаимодействие с хроматином может представляться необходимым для протекания репликации ДНК. Данные, свидетельствующие о роли ядерной ламины в репликации, были получены в экспериментах, в которых хроматин сперматозоидов Xenopus laevis добавляли к экстрактам яйцеклеток. При этом вокруг хроматина отмечалось образование ядерной оболочки.
Эти ядра увеличивались в размерах, и происходила деконденсация хромосом, находившихся в ядрах сперматозоидов в конденсированном состоянии (деконденсация маскирует картину, которая наблюдается при оплодотворении, когда ДНК сперматозоида взаимодействует с некоторыми факторами в ооцитах). Затем в этих ядрах происходит репликация ДНК. В экстрактах яйцеклеток в большом количестве содержатся ядерные ламины и LAP.
После удаления ламины из этих экстрактов с помощью иммобилизованных антител к белкам ламины формирование ядерной оболочки вокруг хроматина сперматозоидов еще возможно. Однако ядра маленькие и хрупкие, и репликации ДНК в них не происходит. Эти результаты свидетельствуют о том, что ламина может играть важную роль в организации хроматина и репликации ДНК.
Повышенная хрупкость клеток связана с мутациями, затрагивающими белки промежуточных филаментов. Мутации в ламинах и LAP обусловливают развитие ряда генетических заболеваний, особенно поражающих мышечную систему. Эти заболевания называются ламинопатиями. По-видимому, изменения ламины придают ядру хрупкость и большую чувствительность к повреждениям. Особенно склонны к повреждениям мышечные клетки, поскольку при сокращении мышц ядра их клеток испытывают большую механическую нагрузку, чем ядра клеток других тканей.
Ядерная ламина сцеплена с внутренней ядерной мембраной двумя типами связей. Когда у сперматозоидов Xenopus laevis удаляют плазматическую мембрану и инкубируют их с экстрактом яйцеклеток,
происходит деконденсация хроматина и вокруг него образуется функционально-активная ядерная оболочка.
Флуоресценция обнаруживает локализацию ДНК.
• Ламинины представляют собой семейство белков внеклеточного матрикса, которые находятся практически во всех тканях позвоночных и беспозвоночных
• Основная функция ламининов заключается в создании адгезивного субстрата для клеток и в обеспечении устойчивости тканей к растяжению
• Ламинины являются гетеротримерами, состоящими из трех различных субъединиц, которые закручены вокруг друг друга и находятся в суперспиральной конфигурации
• Гетеротримеры ламинина не образуют фибрилл; они связываются с линкерными белками, которые дают им возможность образовывать во внеклеточном матриксе сложные переплетения
• С ламининами связано много белков, включая более 20 различных поверхностных рецепторов
Ламинины представляют собой обширное семейство больших (> 100 кДа) белков внеклеточного матрикса, находящихся в базальной ламине (отсюда их название) и в других местах локализации внеклеточного матрикса во многих тканях. Ламинины экспрессируются в клетках позвоночных и беспозвоночных, и степень гомологии между разными представителями семейства этих белков довольно низкая. Это позволяет предполагать, что ламинины представляют собой эволюционно древние белки.
Так же как и коллагены, ламинины состоят из трех полипептидных субъединиц, обернутых вокруг друг друга и образующих тройную суперспирализованную структуру. Последовательность, обеспечивающая формирование этой витой структуры у ламининов, составляет семь аминокислот, и в каждой из трех субъединиц находится в многочисленных повторах.
Благодаря образованию витой структуры между субъединицами образуется максимальное количество нековалентных связей и обеспечивается устойчивость образующегося тримера. Когда сформировалась витая структура, происходит ковалентное связывание субъединиц посредством дисульфидных связей. В витую структуру организуется только часть каждой субъединицы; при этом каждая субъединица также формирует выступающие из спирали «отростки», с помощью которых, как показано на рисунке ниже, образуется переплетенная структура.
Ламинины представляют собой гетеротримеры: три субъединицы, содержащиеся в одном белке, являются продуктами различных генов и подразделяются на три группы: а, β и γ. Пока обнаружено пять а, три β и три γ, и некоторые из них за счет дифференциального сплайсинга могут давать дополнительные варианты. Теоретически эти субъединицы могут объединяться, образуя более 100 различных гетеротримерных сочетаний, однако пока их идентифицировано только 15 (они называются изоформы и нумеруются с 1 по 15).
Тем не менее это количество изоформ позволяет образовываться в одном организме множеству сетеобразных структур, состоящих из различных ламининов.
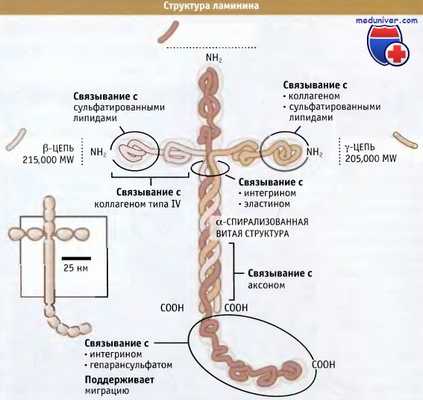
Три цепи, составляющие молекулу ламинина, обернуты вокруг друг друга, образуя центральный кор (ядро или сердцевину).
От него крестообразно отходят N-концевые области каждой цепи.
Карбоксильный участок а цепи выходит из центрального кора, образуя пять глобулярных доменов.
Отмечены основные связывающие сайты.
В отличие от основных классов гликопротеинов, присутствующих во внеклеточном матриксе, ламинины не образуют фибрилл. Они организованы в переплетенные сетеобразные структуры, которые способны противостоять силам растяжения, приложенным к тканям одновременно в нескольких направлениях.
Короткие отростки гетеротримера ламинина, представляющие собой N-концевой участок каждой субъединицы, содержат домены, которые связываются с другими компонентами внеклеточного матрикса, образуя переплетенную паутинообразную структуру. На рисунке ниже представлен показательный пример структуры, образованной ламинином-1 в базальной ламине, где он взаимодействует с такими компонентами внеклеточного матрикса, как энтактин (также называмый нидоген), перлекан и коллаген IV. У некоторых субъединиц ламинина эти домены отсутствуют, и механизм полимеризации таких ламининов остается неизвестным.
Каковы функции ламининов? На основании ранних морфологических и биохимических исследований было установлено, что ламинин-1 в большом количестве присутствует в базальной ламине и поддерживает прикрепление и распространение по ней эпителиальных клеток многих типов, происходящее с участием интегриновых рецепторов. Распространение клеток по ламининовой структуре предполагает, что она должна быть достаточно прочной, чтобы противостоять растяжениям, возникающим при реструктурировании цитоскелета. Многие связанные с ламинином-1 белки (особенно энтактин), играют критическую роль в сборке сетей из этого белка.
В дальнейших исследованиях были идентифицированы участки молекулы ламинина, ответственные за адгезию и миграцию клеток, а также были выяснены роли ламининов в процессах развития. Так же как и в случае фибронектинов, частичное переваривание ламининов протеазами было использовано для расщепления интактной молекулы на небольшие функциональные единицы, которые использовались для изучения их связывания с другими белками.
Пока в результате этих исследований удалось построить функциональную карту доменов ламинина, которая не выглядит столь подробной, как, например, для фибронектина. Затруднение изучения связано с тем, что ламинин образует непрерывную витую структуру, и отдельные участки разрушаются даже при ограниченном протеолизе.
Известно, что с различными областями молекулы ламининов связано большое количество функций и участков связывания с другими белками. Например, для ламинина-1 идентифицировано более 20 разных рецепторов. Кроме того, как показано на рисунке ниже, такие множественные сайты, как глобулярные домены, расположенные на С-концевом участке а-цепи, играют важную роль в регуляции миграции клеток.
Из основных рецепторов ламинина три относятся к интегринам, наряду с неинтегриновым рецептором с мол. массой 67 кДа. В свою очередь, эти рецепторы ассоциированы с различными элементами цитоскелета и связываются с различными сочетаниями сигнальных белков, так что каждый ламининовый рецептор по-разному влияет на поведение клеток. Механизмы регуляции клеточного ответа на связывание ламинина исследованы недостаточно.
В клетках организмов с нарушениями базальной мембраны и образования специфического адгезивного комплекса, называемого полудесмосома, обнаружены мутации в субъединицах ламинина-1 и -5. Эти мутации служат причиной развития многих наследственных кожных заболеваний. В экспериментах с использованием методов обратной генетики, когда в организмах экспрессировались мутантные рекомбинантные ламининовые гены, было показано, что мутации в субъединицах ламинина-2 приводят к нарушениям базальной ламины мышечных клеток, характерной для большинства тяжелых случаев наследственной формы мышечной дистрофии.
Исследования на мышах с нокаутом ламининовых генов продемонстрировали роль этих белков в адресовании нейронов к их специфическим клеточным партнерам, а также в образовании базальной ламины в почках.
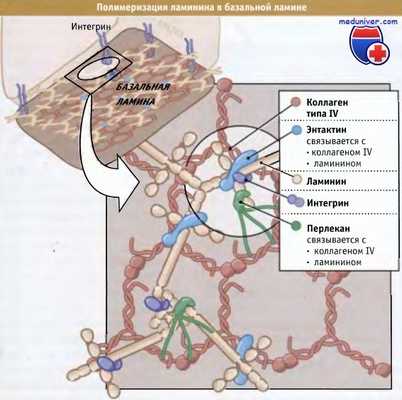
Ламинин связан по меньшей мере с тремя другими белками внеклеточного матрикса, образуя сеть в базальной ламине.
Ламинины также связываются с интегриновыми рецепторами, которые вытягиваются от поверхности клеток, прикрепленных к базальной ламине.
Читайте также:
