Строение и функции витронектина
Добавил пользователь Alex Обновлено: 28.01.2026
Витронектин ( VTN или VN ) - это гликопротеин семейства гемопексинов, который в большом количестве содержится в сыворотке, внеклеточном матриксе и костях . В организме человека он кодируется ВТН гена .
Витронектин связывается с интегрином альфа-V бета-3 и, таким образом, способствует адгезии и распространению клеток . Он также подавляет повреждающий мембрану эффект терминального цитолитического пути комплемента и связывается с несколькими серпинами (ингибиторами сериновой протеазы). Это секретируемый белок, который существует либо в одноцепочечной форме, либо в двухцепочечной форме с обрезанными цепями, удерживаемых вместе дисульфидной связью. Витронектин размышлялось быть вовлеченным в гемостаз и опухоли новообразованиях .
СОДЕРЖАНИЕ
Состав
Витронектин представляет собой гликопротеин массой 54 кДа, состоящий из 478 аминокислотных остатков . Примерно треть молекулярной массы белка состоит из углеводов . Иногда белок расщепляется после аргинина 379 с образованием двухцепочечного витронектина, где две части связаны дисульфидной связью . Никакая структура с высоким разрешением пока не определена экспериментально, за исключением N-концевого домена.
Белок состоит из трех доменов :
- N-концевойсоматомедина область В (1-39)
- Центральные домены с гомологией гемопексина (131-342)
- С-концевой домен (остатки 347-459) , также с гемопексина гомологии.
Сообщалось о нескольких структурах домена Somatomedin B. Первоначально белок был кристаллизован в комплексе с одним из его физиологических партнеров по связыванию: ингибитором активатора плазминогена-1 (PAI-1) и структурой, решенной для этого комплекса. Впоследствии две группы сообщили о ЯМР-структурах домена.
Домен соматомедина B представляет собой сплоченный дисульфидный узел с 4 дисульфидными связями в пределах 35 остатков. Сообщалось о различных дисульфидных конфигурациях для этого домена, но эта неоднозначность была разрешена кристаллической структурой.
Гомологические модели были построены для центрального и С-концевого доменов.
Функция
Домен соматомедина B витронектина связывается с ингибитором активатора плазминогена-1 (PAI-1) и стабилизирует его. Таким образом, витронектин служит для регулирования протеолиза, инициированного активацией плазминогена . Кроме того, витронектин является компонентом тромбоцитов и, таким образом, участвует в гемостазе. Витронектин содержит последовательность RGD (45-47), которая является сайтом связывания для связанных с мембраной интегринов , например рецептора витронектина , которые служат для закрепления клеток на внеклеточном матриксе. Домен соматомедина B взаимодействует с рецептором урокиназы , и это взаимодействие вовлечено в миграцию клеток и передачу сигнала. Было показано, что высокие уровни в плазме как PAI-1, так и рецептора урокиназы коррелируют с отрицательным прогнозом для онкологических больных. Адгезия и миграция клеток непосредственно участвуют в метастазировании рака , что дает вероятное механистическое объяснение этому наблюдению.
Строение и функции витронектина
• Витронектин является белком внеклеточного матрикса, который циркулирует в плазме крови в растворимой форме
• Витронектин может связываться со многими различными типами белков, таких как коллагены, интегрины, факторы свертывания крови и факторы, обусловливающие лизис клеток, а также с внеклеточными протеазами
• При повреждении тканей витронектин способствует образованию кровяного сгустка
• Для того чтобы обеспечить доставку в ткани факторов свертывания крови, витронектин должен перейти из растворимой формы в нерастворимую, которая способна связать эти факторы
Витронектин представляет собой относительно небольшой (75 кДа) многофункциональный гликопротеин внеклеточного матрикса, который присутствует в плазме крови, а также в ранах и в других областях, где происходит формирование ткани. Витронектин содержит много гликозильных остатков: примерно 1/3 его массы приходится на долю N-связанных сахаров.
В отличие от большинства других белков внеклеточного матрикса, которые синтезируются клетками многих тканей, витронектин образуется, главным образом, в печени, откуда непосредственно попадает в кровоток.
Одним из характерных свойств витронектина является его способность связываться со многими типами белков, включая коллагены, интегриновые рецепторы, факторы свертывания крови и факторы иммунной природы, вызывающие лизис клеток, а также протеазы, участвующие в деградации внеклеточного матрикса. Мономеры витронектина могут связываться друг с другом и образовывать высокомолекулярные комплексы.
Специфические сайты связывания были идентифицированы при исследовании связывания друг с другом синтетических пептидных фрагментов витронектина. В результате была получена карта доменов связывания, которые преимущественно находятся на С- и N-концевых участках молекулы белка.
Многие белки, связывающиеся с витронектином, представляют собой ферменты, несвоевременная активация или неправильная локализация которых может иметь серьезные последствия для организма. Например, образование кровяного сгустка в головном мозге приводит к инсульту. Поэтому контроль за местом и временем связывания витронектина с белками играет важную роль. Наиболее распространенный путь такого контроля является также наиболее простым: мономеры витронектина связываются друг с другом, тем самым они как бы «запираются» до тех пор, пока не понадобятся.
Считают, что скручивание молекулы происходит в результате ионных взаимодействий между ее отрицательно заряженным N-концевым участком и положительно заряженным С-концевым участком. Как можно видеть на рисунке ниже, контакт между двумя концами молекулы витронектина может экранировать сайты связывания с другими белками.
Скрученные мономеры витронектина циркулируют в кровотоке, не раскручиваясь. Хотя предполагается, что для инициации процесса связывания с белками молекула витронектина должна частично развернуться, или «разархивироваться», неизвестно, каким образом это происходит. Исследования in vitro препаратов очищенного витронектина показали, что его структура чувствительна к изменениям pH и концентрации ионов.
Это позволяет предполагать, что раскручивание молекулы может инициироваться изменениями в составе плазмы крови. Возможно также, что частичное раскручивание может происходить спонтанно и сопровождаться появлением небольшого количества циркулирующих развернутых мономеров витронектина.
Раскручивание молекул витронектина и демаскирование доменов связывания белков может приводит к различным результатам. Так, витронектин может образовать в крови крупные агрегаты, к которым присоединяются клетки. Витронектин служит в этом случае опорной структурой, обеспечивающей правильную локализацию кровяных сгустков. В частично раскрученных молекулах витронектина открываются сайты связывания интегриновых рецепторов на тромбоцитах, что направляет тромбоциты к местам повреждения сосудов. Связанные тромбоциты активируются и высвобождают другие факторы, способствующие образованию сгустка.
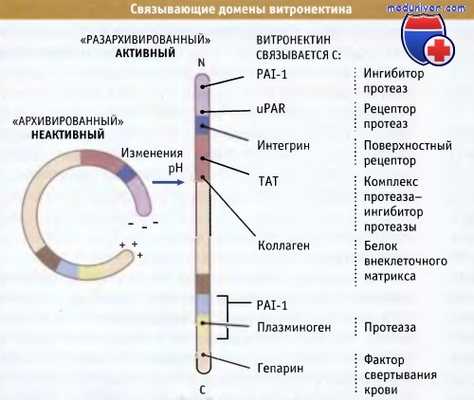
Модель структурной организации витронектина.
Циркулирующий в крови витронектин «архивирован» с тем, чтобы предотвратить его связывание с другими белками.
При изменении внешнего окружения витронектин частично разархивируется, что способствует связыванию этого белка с другими.
Показаны сайты связывания белков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Основная функция фибронектина, белка внеклеточного матрикса, заключается в прикреплении клеток к матрицам, содержащим фиблиллярный коллаген
• Известно, по меньшей мере, 20 различных форм фибронектина. Все они образуются за счет альтернативного сплайсинга одного гена
• Растворимые формы фибронектина присутствуют в жидких тканевых средах, в то время как его нерастворимые формы образуют волокна во внеклеточном матриксе
• Волокна фибронектина состоят из сшитых между собой полимеров гомодимерных форм фибронектина
• Фибронектиновые белки содержат шесть структурных областей, каждая из которых состоит из серии повторяющихся единиц
• Фибрин, гепарансульфат протеогликан и коллаген связываются с различными участками фибронектина и интегрируют его волокна в сеть внеклеточного матрикса
• В некоторых клетках экспрессируются рецепторы интегрина. которые связываются с последовательностью Arg-GLy-Asp (RGD), присутствующей в фибронектине
Фибронектины (от латинского fibra (волокно) и nectere (связывать, соединять)) экспрессируются в соединительной ткани почти у всех животных. Эти белки образуются в клетках нескольких типов, включая фибробласты, гепатоциты, клетки эндотелия, а также некоторые клетки нервной системы, выполняющие структурные функции. У человека по меньшей мере 20 разных фибронектинов образуются за счет альтернативного сплайсинга по четырем сайтам первичного транскрипта единственного фибронектинового гена.
Образующиеся варианты обладают специфичностью, в зависимости от типа клеток. Фибронектины подразделяют на две группы: растворимые (или фибронектины плазмы), которые присутствуют в различных тканевых жидкостях (например, в плазме, цереброспинальной и амниотической жидкости) и нерастворимые (или клеточные), образующие волокна во внеклеточном матриксе почти во всех тканях.
В тканях фибронектины скрепляют клетки с внеклеточным матриксом, регулируют их форму и организацию цитоскелета, способствуют свертыванию крови, а также контролируют функционирование многих клеток в процессе развития и заживления ран. В процессе свертывания крови фибронектин связывается с тромбоцитами на месте повреждения, а позже, при заживлении раны, он поддерживает миграцию новых клеток, по мере того, как они покрывают раневую поверхность. Многие опухолевые клетки также экспрессируют фибронектины, выполняющие роль субстрата для миграции клеток при образовании метастазов.
Фибронектины необходимы для нормального протекания процессов развития: мыши с выключенной функцией соответствующего гена погибают в раннем эмбриогенезе.
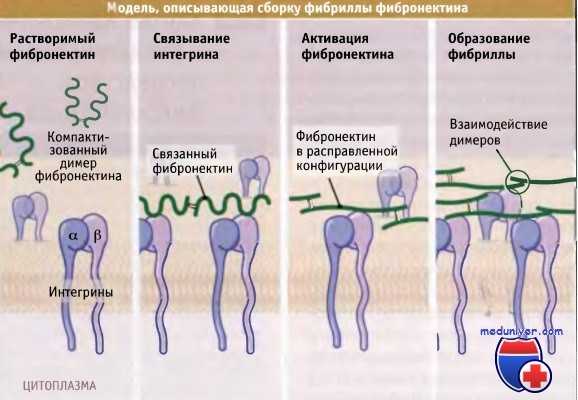
Димеры фибронектина выходят из клетки в скрученной конформации, которая препятствует их ассоциации с другими димерами.
После связывания с интегриновыми рецепторами на поверхности клеток, фибронектиновые димеры расправляются, и открывают сайты связывания, к которым присоединяются другие димеры.
Накопление димеров фибронектина приводит к образованию из них фибриллы, связанной с поверхностью клетки.
Клетки связываются с фибронектином посредством специфических рецепторов, называемых интегринами. Подобно другим интегриновым рецепторам, фибронектиновые рецепторы участвуют в активации внутриклеточных путей передачи сигналов, контролирующих рост, подвижность и дифференцировку клеток.
Зрелый фибронектин, секретируемый клеткой, всегда представляет собой растворимый димер, образованный при участии двух дисульфидных мостиков, и обычно содержит две копии одного варианта фибронектина. Более того, димеризация фибронектина играет существенную роль для правильного образования нерастворимых фибронектиновых волокон. Для сборки растворимых фибронектинов в нерастворимые сети необходимы прямые контакты с клетками. Хотя механизм образования фибронектиновых волокон не совсем понятен, большинство моделей предполагает, что вначале димеры фибронектина связываются с интегриновыми рецепторами на поверхности клеток.
В дальнейшем клетки изменяют свою форму, за счет этого молекулы фибронектина растягиваются, принимая более вытянутую конфигурацию, близкую к линейной. К таким растянутым молекулам дополнительно присоединяются димеры фибронектина, образуя плотную сеть, которая под микроскопом выглядит в виде волокнистых структур, ориентированных вдоль актиновых волокон. Эти фибронектиновые волокна могут связываться с другими компонентами внеклеточного матрикса, превращая его в прочную опорную структуру.
Для выполнения своих функций фибронектины связываются с различными другими белками внеклеточного матрикса. Исследование связывания с использованием фрагментов фибронектина, полученных при ограниченном протеолизе, позволило выяснить функциональную организацию данного белка. Он содержит набор коротких последовательностей, называемых фибронектиновые повторы. Из-за альтернативного сплайсинга порядок расположения этих повторов варьирует. Повторяющиеся последовательности подразделяются на три группы, которые называются тип I, II и III.
Они последовательно нумеруются, начиная с амино-концевого участка белка. На рисунке ниже представлены функции этих повторов.
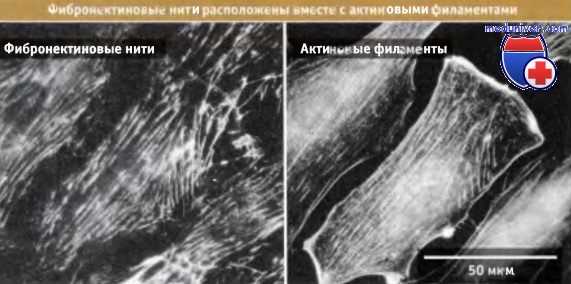
Фотографии клеток, полученные с помощью флуоресцентного микроскопа.
Видны сети связанных фибронектиновых нитей (слева) и актиновых филаментов (справа), которые расположены одинаково.
Окрашивание иммунофлуоресцентным методом на фибронектин и актин соответственно.
Фибронектиновые нити и актиновые филаменты связаны вместе с помощью интегриновых рецепторов и связанных с ними белков.
• Поблизости от концевой аминогруппы расположен остаток глутамина, представляющий собой субстрат для фактора ХШа, фермента, связывающего фибронектин с фибрином, фибриногеном или другими фибронектинами в процессе свертывания крови.
• Повторы, относящиеся к типу I (1-5), которые связываются с фибрином, белком, участвующим в процессе свертывания крови, и с гепарансульфатом протеогликаном.
• Повторы типа I (6-9) и типа II (1-2), связывающиеся с коллагеном.
• Модульный экстрадомен-В (ED-B), который присутствует, главным образом, в фибронектине эмбриональных тканей, при заживлении ран и в ткани опухолей. Это позволяет предполагать, что домен может играть роль при перестройке ткани, происходящей в области интенсивного клеточного роста. В фибронектинах плазмы домен не обнаружен.
• Экстрадомен-А (ED-A), который, подобно ED-B, отсутствует в фибронектинах плазмы. По-видимо-му, он способствует усилению связывания клеток с фибронектином, хотя это является всего лишь предположением.
• Последовательности типа III (12-14), образующие область связывания с гепарансульфатом, который присоединяется к синдекановым рецепторам.
• Сопрягающий сегмент типа III (IIICS), который при сплайсинге образует различные по длине модули и, следовательно, множественные формы фибронектина. У человека идентифицированы, по меньшей мере, пять разных вариантов сплайсинга IIICS. Некоторые из них могут регулировать апоптоз. Этот сегмент связывается с двумя интегрино-выми рецепторами за счет последовательности Leu-Asp-Val.
• Один повтор типа II и три повтора типа III, образующие второй сайт связывания для фибрина, который участвует в свертывании крови.
• Поблизости от концевой карбоксильной группы белка два остатка цистеина образуют дисульфидные связи с другим полипептидом фибронектина.
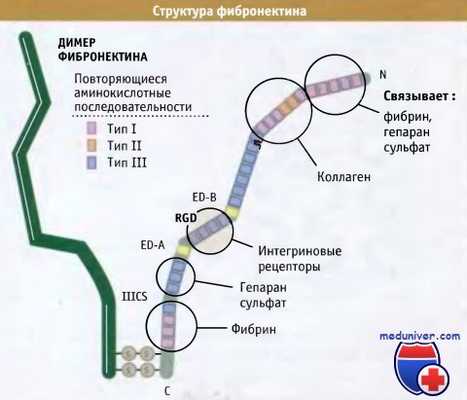
Два полипептида фибронектина ковалентно связаны друг с другом через дисульфидные связи, расположенные у карбоксильного концевого участка.
Каждый полипептид состоит из шести доменов, включающих небольшие повторяющиеся последовательности.
Отмечены основные области связывания.
История изучения внеклеточного матрикса (ВКМ)
• Исследования внеклеточного матрикса и межклеточных контактов миновали четыре исторических этапа. Для каждого этапа была характерна определенная стадия технического прогресса, которая позволяла все более детальное изучение этих структур.
• Современные исследования в этой области направлены на выяснение вопроса, каким образом белки внеклеточного матрикса и межклеточные контакты управляют поведением клеток
Подобно другим разделам клеточной биологии, исследования внеклеточного матрикса и межклеточных контактов прошли через четыре исторических этапа. Первый этап начался в середине XVII в. и был связан с изобретением микроскопа, с помощью которого можно было наблюдать отдельные клетки. По мере разработки все более изощренных методов, позволяющих видеть субклеточные структуры, исследователи пришли к выводу о сложном строении поверхности и содержимого клетки.
Одновременно с развитием клеточной теории биологи начали понимать, насколько важную роль играют клетки в развитии сложных организмов. Стало возможным оценить на структурном уровне невероятную вариабельность форм, размеров и способов организации клеток в ткани. В середине XIX в. оформилась новая область биологии — гистология. Задачей гистологии стало исследование мельчайших структур (часто называемых ультраструктурами), составляющих ткани многоклеточных организмов.
Однако в картине, описывающей архитектуру ткани, отсутствовала одна деталь. Что находится в межклеточном пространстве? Главным образом изучали те структуры, которые можно было наблюдать с помощью микроскопа. Структурам, невидимым в микроскоп, уделяли меньше внимания. Под обычным, световым микроскопом, межклеточное пространство в большинстве тканей выглядело довольно слабо прокрашенным и имело аморфную структуру. В ранних гистологических описаниях о нем вообще нет упоминаний.

Вторая стадия началась в середине XX в., с появлением мощных световых и электронных микроскопов. При анализе в световом микроскопе препаратов тканей, окрашенных гистологическими красителями, было обнаружено, что внеклеточное пространство заполнено жидкой средой. В электронном микроскопе в этом пространстве была заметна сеть, состоящая из структурного материала. Более того, стало ясно, что на поверхности клеток формируются специальные контакты, которые взаимодействуют с этим материалом и друг с другом.
Наконец признали, что ткани состоят из клеток, жидкой среды и этого внеклеточного материала. Этой группе структурных материалов было дано название: внеклеточный матрикс. Однако с помощью микроскопа было невозможно рассмотреть отдельные компоненты внеклеточного матрикса.
Начало третьей стадии пришлось на 1970-е гг., когда было разработано много новых методов, позволяющих фракционировать, выделять и характеризовать отдельные компоненты клетки. По мере использования новых методов биохимии, генетики, молекулярной биологии и микроскопии, клеточная биология начала быстро развиваться. Например, разработка экспресс-методов секвенирования ДНК позволила исследователям секвенировать полностью геном у нескольких организмов. Таким образом, вероятно, что вскоре мы сможем идентифицировать у них каждый ген.
Используя эти методы для идентификации сотен белков, входящих во внеклеточный матрикс и составляющих межклеточные контакты, мы сталкиваемся со следующим важным вопросом: каковы функции этих белков? В настоящее время считается общепризнанным, что внеклеточный матрикс играет критическую роль не только в формировании трехмерной организации тканей, но также контролирует рост, подвижность, дифференцировку и взаимодействие входящих в них клеток.
Более того, эти функции регулируются контактами, посредством которых клетки соединяются друг с другом и с внеклеточным матриксом. В настоящее время основные усилия исследователей в этой области направлены на выяснение молекулярных механизмов, обеспечивающих эти функции, что составляет четвертый этап исследований внеклеточного матрикса и межклеточных контактов. В данной главе мы обсудим основные подходы, позволяющие разобраться в этих механизмах.
Процедура окрашивания красителями позволяет гистологам визуализировать особенности клеток в тканевых препаратах.
На фотографии представлен препарат эпителия, окрашенный гистологическими красителями для выявления формы и расположения клеток в эпителиальном слое. На электронных микрофотографиях видно, что межклеточное пространство заполнено волокнистым материалом.
На фотографиях видны коллагеновые фиблиллы в межклеточном пространстве между фибробластами в соединительной ткани (слева) и в роговице глаза (справа).
Витронектин - Vitronectin
Читайте также:
- От чего болят колени? Заболевания суставов
- Классификация изменений селезенки. Диффузные изменения селезенки.
- Лечение острого аппендицита. Операция при аппендиците
- Глиома зрительного пути - лучевая диагностика
- Случай эмфизематозного пиелонефрита у пациентки с сахарным диабетом, потребовавший нефрэктомии
