Строение и функционирование натрий-калиевой АТФазы
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Теплово́е движе́ние' — процесс хаотического (беспорядочного) движения частиц, образующих вещество. Чаще всего рассматривается тепловое движение атомов и молекул.
Хаотичность — важнейшая черта теплового движения. Важнейшими доказательствами существования движения молекул является броуновское движение и диффузия.
Пассивный транспорт — транспорт, не требующий затрат энергии. Он всегда идет по градиенту концентрации — оттуда, где вещества больше, туда, где его меньше. При этом вещества могут диффундировать через липидный бислой (простая диффузия) или проходить через специальные каналообразующие белки (облегченная диффузия). Иногда пассивный транспорт происходит при участии белков-переносчиков.
Через липидный бислой путем пассивного транспорта проходят малые неполярные молекулы (кислород, углекислый газ, азот, бензол) и полярные молекулы массой до 100 дальтон (глицерин, этанол и др.). ВОда обычно также проходит в клетки и из клеток чеез липдных бислой; в особых случаях, когда транспорт воды нужно резко ускорить, она рпоходит через особые канальные белки - аквапорины.
У человека аквапорины экпрессируются многими клетками - прежде всего, клетками почечных канальцев и эритроцитами. Мутации генов аквапоринов приводят к некоторым наседственным болезням - например. могу вызывать наследственную катаракут и наследственный несахарный диабет. Аквапорины и родственные белки - акваглицеропорины - есть также у растений, грибов, протистов и бактерий. Через акваглицеропорины могут проходить глицерин, мочевина, а также (у растений) ортоборная и ортокрмниевая ислоты и похожие на них соединения.
Частный случай пассивного транспорта —- осмос. Обычно осмосом называют диффузию растворителя через преграду, непроницаемую для растворенных веществ. Такие преграды — это обычно тонкие пленки (например, пленки из целлофана, в которые упаковывают многие сорта сосисок). Типичная полупроницаемая пленка — липидный бислой биологических мембран.
Белки-каналы - порообразующие белки, пронизывающие клеточные мембраны. Они имеют сложную третичную, а часто и четвертичную структуру (многие каналы состоят из 2-6 полипептидных цепей). В центре канала находится водная пора. Самое узкое место поры (селективный фильтр) по диаметру лишь немного превышает диаметр атома. У многих каналов есть "ворота" - участки молекулы, которые могут менять конформацию и закрывать пору. У таких каналов есть как минимум два состояния - открытое и закрытое. Наконец. у части каналов есть дополнительный участок (домен), часто похожий по форме на шарик на подвижной проволочке. который может закрывать канал при определенных условиях, делая его нечуствительным к воздействиям. обычно открывающим канал. Такое состояние канала называется инактивированным.
Большинство каналов пропускает определенные ионы. Некоторые каналы пропускают все ионы одного знака заряда (катионы или анионы. Многие каналы пропускают преимущественно одну разновидность ионов. На мембране большинства клеток есть каналы для ионов натрия, калия, хлора и кальция. Многие натриевые каналы непроницаемы для ионов калия. Это неудивительно, так как ионы калия имеют больший диаметр. Но и многие калиевые каналы непроницаемы для ионов натрия! Лишь недавно удалось понять, как обеспечивается такая избирательность.
Два основных типа каналов - лиганд-зависимые и потенциал-зависимые. Лиганд-зависимые каналы открываются при присоединении к ним извне какого-либо вещества (лиганда). Этим они похожи на белки-рецепторы (такие каналы - то же самое, что ионотропные рецепторы). Потенциал-зависимые каналы открываются или закрываются в зависимости от разности потенциала на мембране клетки.
Существуют и другие типы каналов. Например, многие каналы открываются при воздействии на них циклических нуклеотидов (цАМФ или цГМФ)не извне, а из цитоплазмы, с внутренней стороны мембраны. Есть механочувствительные каналы. Некоторые из них открываются при растяжении мембраны. В других случаях канал при натяжении открывает присоединенный к нему элемент цитоскелета или внеклеточного матрикса (так, например, открываются и закрываются натриевые каналы на волосковых клетках внутреннего уха позвоночных.
[2] Схема и описание прохождения ионов калия через калиевый канал (англ.)
Белки-переносчики — это ещё одна группа транспортных белков. Они участвуют в транспорте веществ, которые не могут пройти сквозь липидный бислой. Белки-переносчики связываются с ионами или молекулами того вещества, которое они переносят, и доставляют их в клетку или из клетки.
От белков–каналов они отличаются тем, что белки-канала - порообразующие белки, они пропускают вещества сквозь заполненную водой пору, а не захватывают и не перетаскивают их на другую сторону мембраны.
Чтобы лучше понять принцип работы белков-переносчиков, рассмотрим работу натрий-калиевой АТФазы. Натрий-калиевая АТФаза присутствует на мембране почти всех клеток человека. Она действует как насос, перекачивая ионы Na + из клетки во внешнюю среду, а ионы К + в клетку. Na + /K + АТФаза отвечает за поддержание мембранного потенциала клетки.
Как же происходит перенос ионов Na + и K + ? Сначала к натрий-калиевой АТФазе присоединяются три иона Na + , из-за чего изменяется конформация АТФазы. Затем АТФаза расщепляет молекулу АТФ на АДФ и фосфат (РО - ³4). При этом фосфат-ион присоединяется к поверхности белка. Энергия, выделившаяся за счёт расщепления АТФ, расходуется на изменение конформации АТФазы. После всех превращений белок „переворачивается“, и три иона Na + оказываются на внешней стороне мембраны, а фосфат заменяется на два иона K + , при этом ионы K + присоединяются не к тому месту, где были ионы Na + , а связываются со своим определённым участком. Из-за этого АТФаза вновь меняет свою конформацию, и ионы К + переносятся на внутреннюю сторону мембраны. Здесь ионы К + отсоединяются от АТФазы.
Кроме натрий-калиевой АТФазы есть также кальциевая АТФаза, хлорная АТФаза и другие. Важная особенность белков-насосов заключается в том, что каждый ион движется из области низкой концентрации в область высокой, то есть каждый ион перемещается против своего градиента концентрации. Это движение называется активным транспортом и может происходить только при помощи расходования АТФ.
Помимо активного транспорта белки-переносчики могут осуществлять пассивный транспорт, перемещая вещества из области высокой концентрации в область низкой. Также этот транспорт называют облегчённой диффузией. Например, поступление глюкозы в эритроциты происходит при помощи облегчённой диффузии.
Активный транспорт обычно обеспечивается белками-переносчиками, которые обладают АТФ-азной активностью.
[3]- Описание строения и работы и анимация натрий-калиевой АТФ-азы (англ.)
Натрий-калиевая аденозинтрифосфатаза
Натрий-калиевая аденозинтрифосфатаза, натрий-калиевая АТФ-аза, Na + /K + -аденозинтрифосфатаза — фермент из группы транспортных аденозинтрифосфатаз (КФ 3.6.3.9), находящийся в клеточной мембране. Он встречается практически во всех клетках человека, а также в клетках других организмов. Основное назначение — поддерживать клеточный потенциал и регулировать клеточный объём.
Принцип действия
Первоначально этот переносчик, осуществляющий антипорт, присоединяет с внутренней стороны мембраны три иона Na + . Эти ионы изменяют конформацию активного центра АТФазы. После такой активации АТФаза способна гидролизовать одну молекулу АТФ, причем фосфат-ион фиксируется на поверхности переносчика с внутренней стороны мембраны. Выделившаяся энергия расходуется на изменение конформации АТФазы, после чего три иона Na + и ион PO4 3− (фосфат) оказываются на внешней стороне мембраны. Здесь ионы Na + отщепляются, а PO4 3− замещается на два иона К + . Затем конформация переносчика изменяется на первоначальную, и ионы К + оказываются на внутренней стороне мембраны. Здесь ионы К + отщепляются, и переносчик вновь готов к работе.
Более кратко действия АТФазы можно описать так:
- Она изнутри клетки «забирает» три иона Na + , затем расщепляет молекулу АТФ и присоединяет к себе фосфат.
- «Выбрасывает» ионы Na + и присоединяет два иона K + из внешней среды.
- Отсоединяет фосфат, два иона K + выбрасывает внутрь клетки.
В итоге во внеклеточной среде создается высокая концентрация ионов Na + , а внутри клетки — высокая концентрация K + . Работа Na + ,K + — АТФаза создает не только разность концентраций, но и разность зарядов (она работает как электрогенный насос). На внешней стороне мембраны создается положительный заряд, на внутренней — отрицательный.
История
Na + /K + -АТФаза была открыта Йенсом Скоу в 1957 году. Он выделил этот фермент из периферических нервов с помощью уабаина — специфически связывающегося с АТФазой гликозида. В 1997 году за это открытие он был удостоен Нобелевской премии по химии.
См. также
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Натрий-калиевая аденозинтрифосфатаза" в других словарях:
Натрий-калиевая АТФ-аза — Натрий калиевая аденозинтрифосфатаза, натрий калиевая АТФ аза, Na+/K+ аденозинтрифосфатаза фермент из группы транспортных аденозинтрифосфатаз (КФ 3.6.3.9), находящийся в клеточной мембране. Он встречается практически во всех клетках человека, а… … Википедия
Водородно-калиевая аденозинтрифосфатаза — Н+/К+ АТФаза Другие названия: Водородно калиевая аденозинтрифосфатаза, протонная помпа, протонный насос Генетические данные Код гена: GO:8900[1] … Википедия
Натрий-калиевый насос — Натрий калиевая аденозинтрифосфатаза, натрий калиевая АТФ аза, Na+/K+ аденозинтрифосфатаза фермент из группы транспортных аденозинтрифосфатаз (КФ 3.6.3.9), находящийся в клеточной мембране. Он встречается практически во всех клетках человека, а… … Википедия
Калий-водородная аденозинтрифосфатаза — Н+/К+ АТФаза Другие названия: Водородно калиевая аденозинтрифосфатаза, протонная помпа, протонный насос Генетические данные Код гена: GO:8900[1] Структура и функция белка Тип белка … Википедия
Н+/К+-АТФ-аза — Н+/К+ АТФаза Другие названия: Водородно калиевая аденозинтрифосфатаза, протонная помпа, протонный насос Генетические данные Код гена: GO:8900[1] Структура и функция белка Тип белка … Википедия
Н+/К+-АТФаза — Другие названия: Водородно калиевая аденозинтрифосфатаза, протонная помпа, протонный насос Генетические данные Код гена: GO:8900[1] Структура и функция белка Тип белка … Википедия
Мембранный транспорт — Мембранный транспорт транспорт веществ сквозь клеточную мембрану в клетку или из клетки, осуществляемый с помощью различных механизмов простой диффузии, облегченной диффузии и активного транспорта. Важнейшее свойство биологической… … Википедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Строение и функционирование натрий-калиевой АТФазы
• Na+/K+-АТФаза относится к АТФазам P-типа, близким к Са2+-АТФазе и Н+-АТФазе
• Na+/K+-АТФаза поддерживает градиент Na+ и К* через плазматическую мембрану
• Na+/K+-АТФаза плазматической мембраны является генератором электрического заряда: она транспортирует из клетки три иона Na+ на каждые два иона К+, которые она закачивает в клетку
• Рабочий цикл Na+/K+-АТФазы описывается схемой Поста-Альберса, согласно которой фермент совершает оборот между двумя основными конформациями
По отношению к окружающей среде все клетки заряжены отрицательно. Это обусловлено присутствием небольшого избытка положительно заряженных молекул во внеклеточном пространстве и противоположной ситуацией в цитозоле. Для нормального функционирования клетки по сторонам плазматической мембраны необходимо наличие электрохимического градиента.
В этом отношении клетка напоминает электрическую батарею с разделенными зарядами, которую можно использовать для выполнения работы. В клетках млекопитающих градиенты концентрации Na+ и К+ представляют собой два основных компонента трансмембранного электрохимического градиента. Внутри клетки, по сравнению с внеклеточной средой, поддерживается более низкая концентрация ионов Na+ и более высокая ионов К+.
Образование и поддержание электрохимического градиента ионов Na+ и К+ в клетках животных происходят с участием Na+/K+-АТФазы, которая представляет собой ионный насос, использующий энергию гидролиза АТФ для транспорта катионов. С помощью этого фермента в клетке устанавливается отрицательный мембранный потенциал покоя, с помощью которого контролируется необходимый уровень осмотического давления, который не позволяет клетке лизироваться или сжиматься и который также обеспечивает Na+-зависимый вторичный транспорт молекул.
Na+/K+-АТФаза относится к группе АТФаз Р-типа, включающей также Са2+-АТФазу саркоплазматического ретикулума, которая рассматривалась в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
АТФазы P-типа представляют собой ферменты, которые при аутофосфорилировании остатка аспарагиновой кислоты в процессе ионного транспорта образуют фосфорилированный промежуточный продукт. В процессе аутофосфорилирования АТФаз P-типа у-фосфатная группа АТФ переносится на активный центр фермента. На каждую гидролизованную молекулу АТФ обмениваются три иона Na+ из цитозоля и два иона К+ из внеклеточной среды. Na+/K+-АТФаза функционирует со скоростью 100 оборотов в 1 с.
По сравнению с потоком ионов через поры каналов такая скорость транспорта представляется низкой. Транспорт через каналы происходит со скоростью 107-108 ионов в 1 с, т. е. близкой к скорости диффузии ионов в воде.
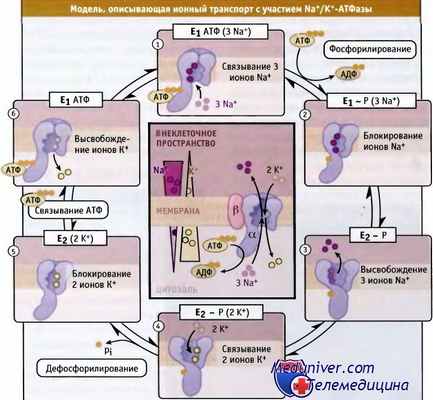
Схема Поста-Альберса для рабочего цикла Na+/K+-ATФаза.
Макроэргическая фосфатная связь обозначена как Е1-Р.
На рисунке в центре представлен весь цикл работы фермента.
Показаны градиенты ионов Na+ и К+ по сторонам плазматической мембраны покоящейся животной клетки.
Были охарактеризованы основные этапы цикла ферментативного транспорта ионов, происходящего с участием Na+/K+АТФазы. Они представлены на схеме Поста-Альберса. Первоначально эта схема была предложена для Na+/K+-АТФазы, а затем использовалась для идентификации специфических состояний молекулы всех АТФаз P-типа. Согласно схеме Поста-Альберса, АТФазы P-типа могут принимать две различные конформации, которые обозначаются как фермент 1 (Е1) и фермент 2 (Е2). Находясь в этих конформациях, они способны связывать, захватывать и транспортировать ионы. Эти конформационные изменения происходят за счет реакции фосфорилирования-дефосфорилирования:
• В конформации внутриклеточный АТФ и ионы Na+ с высоким сродством связываются с АТФазой. При этом фермент переходит в состояние Е1АТФ(3Nа+), происходит АТФ-зависимое фосфорилирование остатка аспарагиновой кислоты и захват трех ионов Na+ в конформации E1 - P(3Na+).
• Дальнейшее изменение конформации приводит к образованию состояния Е2-Р, снижению сродства к ионам натрия, и к выходу их во внеклеточное пространство. Сродство фермента к ионам К+ повышается.
• Связывание с АТФазой ионов К+, находящихся во внеклеточном пространстве, приводит к дефосфорилированию Е2-Р(2К+) и к захвату двух ионов К+ с переходом в состояние Е2(2К+).
• При связывании внутриклеточного АТФ конформация изменяется и ионы К+ отщепляются. При этом возникает состояние Е1АТФ, а связывание внутриклеточного натрия приводит к конформации Е1АТФ(3Na+).
Анализ первичной структуры белков позволяет высказать предположение, что все АТФазы P-типа обладают одинаковой пространственной структурой и транспортным механизмом. Na+/K+-АТФаза состоит из двух субъединиц, каталитической а, одинаковой для всех АТФаз P-типа, и регуляторной субъединицы, b, которая специфична для каждой АТФазы. Более мелкая субъединица b имеет один трансмембранный домен, который стабилизирует а-субъединицу и определяет ориентацию АТФазы в мембране. В клетках некоторых тканей активность Na+/K+-АТФазы, вероятно, регулируется еще одним белком, субъединицей у. Каталитическая субъединица а содержит сайты связывания для АТФ, а также для ионов Na+ и К+.
Эта субъединица в изолированном виде способна осуществлять транспорт ионов, как показано в экспериментах по гетерологичной экспрессии и в электрофизиологических исследованиях.
Структура а субъединицы Na+/K+-АТФазы, построенная по данным криоэлектронной микроскопии, напоминает строение Са2+-АТФазы SERCA. Подобно насосу SERCA, эта субъединица состоит из 10 трансмембранных а спиралей. Внутриклеточный P-домен, расположенный между трансмембранными сегментами 4 и 5, содержит сайт фосфорилирования, который обладает общей структурой для всех АТФаз P-типа. Этот сайт представлен остатком Asp376 в характерной последовательности Asp-Lys-Thr-Gly-Thr-Leu-Thr. Связывание АТФ и ионов Na+ индуцирует существенные изменения конформации петли, соединяющей N- и Р-домены. Эти изменения приводят к сближению сайта связывания АТФ на N-домене и сайта фосфорилирования на Р-домене.
Na+/K+-АТФаза является ионным насосом-генератором. В обычных физиологических условиях свободная энергия гидролиза АТФ (ΔGАТФ) расходуется на транспорт из клетки трех ионов Na+ в обмен на два иона калия, причем ионы переносятся против градиента их концентраций. Таким образом, клетка теряет суммарный положительный заряд. Это способствует росту отрицательного заряда цитозоля по сравнению с внеклеточной средой. В результате по сторонам клеточной мембраны возникает разность потенциалов и осмотический ионный градиент.
АТФазы P-типа представляют собой ионные насосы, использующие энергию гидролиза АТФ для поддержания трансмембранного ионного градиента. Поскольку каждый этап ферментативного цикла носит обратимый характер, АТФазы P-типа в принципе могут продуцировать АТФ, используя энергию трансмембранного потенциала. Таким образом, Na+/К+-АТФаза обладает определенной возможностью функционировать в противоположном направлении. При этом ионы Na+ будут поступать в клетку, а ионы К+ выходить оттуда, что приведет к тому, что поток ионов будет преимущественно направлен в клетку.
Обычный транспорт ионов Na+ из клетки и ионов К+ в клетку происходит, пока величина ΔGАТФ превышает электрохимическую энергию соответствующего ионного градиента. Когда энергия, необходимая для активного транспорта ионов Na+ и К+, становится равной ΔGАТФ, поток ионов прекращается. Эта величина представляет собой потенциал обращения функционирования Na+/К+-АТФазы, т. е. значение мембранного потенциала, ниже которого фермент начинает работать в обратном направлении. Значение потенциала обращения составляет порядка -180 мВ, т. е. он представляет собой гораздо более отрицательную величину, чем мембранный потенциал любой клетки в физиологических условиях. Поэтому маловероятно, что в клетку может поступать поток ионов Na+, имеющий для нее опасные последствия.
Однако все может измениться при снижении кровоснабжения, например при инфаркте миокарда или при интоксикациях, приводящих к недостатку АТФ или к увеличению крутизны ионных градиентов. В конце концов это может вызвать перемену направления транспорта ионов Na+/K+-АТФазой и гибель клетки.
Na+/K+-АТФаза является мишенью для многих токсинов и лекарственных препаратов. Например, растительные стероиды, называемые сердечными гликозидами, такие как уабаин и дигиталис, являются специфическими ингибиторами ионного транспорта, осуществляемого Na+/K+-АТФазой. К числу специфических ингибиторов относятся также другие токсины, например палитоксин из некоторых морских кораллов и сангвинарин из растений. В отличие от сердечных гликозидов, которые подавляют поток ионов через Na+/K+-АТФазу, палитоксин и сангвинарин блокируют АТФазу в открытой конфигурации.
Тем самым ионы получают возможность транспортироваться в направлении их концентрационных градиентов, что приводит к нарушению электрохимических градиентов. Сердечные гликозиды обратимо связываются с сайтами Na+/K+-АТФазы, расположенными вне клетки, при этом ингибируется гидролиз АТФ и транспорт ионов. Тщательно контролируемое ингибирование Na+/K+-АТФазы клеток миокарда сердечными гликозидами, например дигиталисом, применяется при лечении сердечной недостаточности. Частичное ингибирование субпопуляции Na+/K+-АТФаз сердечными гликозидами несколько увеличивает внутриклеточную концентрацию ионов Na+, что приводит к повышению концентрации ионов Са2+, благодаря транспорту через Na+/Са2+-антипортер. Известно, что небольшое увеличение внутриклеточной концентрации ионов кальция усиливает сократимость сердечной мышцы.
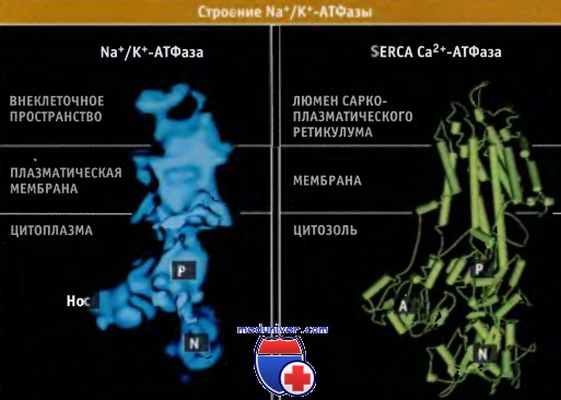
Строение а-субъединицы Na+/К+-АТФазы напоминает Са2+-АТФазу саркоплазматического ретикулума (SERCA).
Структура субъединицы установлена на основании данных крио-электронномикроскопического исследования.
Изображение кристаллической структуры SERCA в конформации Е2 получено на основании данных Protein Data Bank file 1IW0.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
027. Роль Na, К-активируемой АТФазы в переносе ионов через биологические мембраны. Схема функционирования Na, К-АТФазы
В клетках животных наиболее важным механизмом активного транспорта является так называемый натриево-калиевый насос, связанный с разницей в градиенте концентрации ионов К+ и Na+ вне и внутри клетки.
Среди примеров активного транспорта против градиента концентрации лучше всего изучен натрий-калиевый насос. Во время его работы происходит перенос трех положительных ионов Na+ из клетки на каждые два положительных иона К в клетку. Эта работа сопровождается накоплением на мембране разности электрических потенциалов. При этом расщепляется АТФ, давая энергию. В течение многих лет молекулярная основа натрий-калиевого насоса оставалась неясной. В настоящее время установлено, что эта "машина" представляет собой не что иное, как фермент, расщепляющий АТФ. Этот фермент обычно расположен в мембранах и активируется при повышении концентрации ионов натрия внутри клетки или ионов калия в наружной среде.
Na + /K + -АТФ-аза (Na + /K + аденозинтрифосфатаза) — фермент из группы транспортных аденозинтрифосфатаз, встречающийся в плазматической мембране всех клеток животных. Na + /K + -АТФаза была открыта Йенсом Скоу в 1957 году. Он выделил этот фермент из периферических нервов с помощью уабина — специфически связывающегося с АТФазой гликозида. Na + /K+-АТФ-аза переносит ионы К + внутрь клетки, в то время как ионы Na + выбрасываются во внешнюю среду. Фермент не является настоящим антипортером, так как оба катиона транспортируются против электрохимического градиента. Основная функция — поддержание потенциала покоя и регулирование клеточного объёма. На первой стадии фермент присоединяет с внутренней стороны мембраны три иона Na + . Эти ионы изменяют конформацию активного центра АТФ-азы. После этого фермент способен гидролизовать одну молекулу АТФ. Выделившаяся после гидролиза энергия расходуется на изменение конформации переносчика, благодаря чему три иона Na + и ион PO4 3− (фосфат) оказываются на внешней стороне мембраны. Здесь ионы Na + отщепляются, и присоединяются два иона К + . После этого фермент возвращается в исходную конформацию, фосфат-ион и ионы К + оказываются на внутренней стороне мембраны. Здесь ионы К + отщепляются, и переносчик вновь готов к работе.
В итоге во внеклеточной среде создается высокая концентрация ионов Na + , а внутри клетки — высокая концентрация K + . Эта разность концентраций используется в клетках при проведении нервного импульса.
Фермент играет ключевую роль в реализации многочисленных клеточных функций и процессов, сопряженных с ионными градиентами.
Активность Nа + ,К + -АТФазы возрастает при повышении внутриклеточной концентрации ионов натрия. Подавление же ее активности наблюдается при передозировке додиксина, а также при сердечной недостаточности.
Опосредованно повышает активность Na + , К + -АТФазы инсулин. Он способствует входу калия в мышечные клетки и клетки печени, причем этот эффект не связан с влиянием инсулина на транспорт глюкозы. При недостаточности инсулина, напротив, калий выходит из клеток.
При гидролизе молекулы АТР одна молекула АТР-азы может гидролизовать 1ОО молекул АТР в 1 с.
Натрий-зависимое фосфорилирование, вероятно, изменяет конформацию АТР-азы, что каким-то образом приводит к выведению ионов натрия из клетки. Наоборот, калий-зависимое дефосфорилирование обусловливает транспорт ионов калия внутрь клетки и возвращение АТР-азы в первоначальное состояние.
Фосфорилированная форма АТР-азы имеет сильно напряженную конформацию и может релаксироваться, отдавая необходимую энергию и фосфат либо для накачивания ионов калия внутрь теней, либо для синтеза АТР.
Натрий-калиевая-АТР-аза состоит из 2 субъединиц - трансмембранной субъединицы, обладающей каталической активностью (~1ОО ООО дальтон), и ассоциированного с ней гликопротеина (~45 ООО дальтон). Первая субъединица имеет участки связывания для ионов натрия и АТР на цитоплазматической поверхности, а для ионов калия и уабаина на наружной. Кроме того, она обратимо фосфорилируется и дефосфорилируется. Функция гликопротеина неизвестна.
Таким образом, транспортные АТР-азы осуществляют гидролиз АТР, обеспечивающий транспорт ионов.
Белки-каналы, их строение и функции
Белки-каналы - порообразующие белки, пронизывающие клеточные мембраны. Они имеют сложную третичную, а часто и четвертичную структуру (многие каналы состоят из 2-6 полипептидных цепей). В центре канала находится водная пора. Самое узкое место поры (селективный фильтр) по диаметру лишь немного превышает диаметр атома. У многих каналов есть "ворота" - участки молекулы, которые могут менять конформацию и закрывать пору. У таких каналов есть как минимум два состояния - открытое и закрытое. Наконец. у части каналов есть дополнительный участок (домен), часто похожий по форме на шарик на подвижной проволочке. который может закрывать канал при определенных условиях, делая его нечуствительным к воздействиям. обычно открывающим канал. Такое состояние канала называется инактивированным.
Большинство каналов пропускает определенные ионы. Некоторые каналы пропускают все ионы одного знака заряда (катионы илианионы. Многие каналы пропускают преимущественно одну разновидность ионов. На мембране большинства клеток есть каналы для ионов натрия, калия, хлора и кальция. Многие натриевые каналы непроницаемы для ионов калия. Это неудивительно, так как ионы калия имеют больший диаметр. Но и многие калиевые каналы непроницаемы для ионов натрия! Лишь недавно удалось понять, как обеспечивается такая избирательность.
Два основных типа каналов - лиганд-зависимые и потенциал-зависимые. Лиганд-зависимые каналы открываются при присоединении к ним извне какого-либо вещества (лиганда). Этим они похожи на белки-рецепторы (такие каналы - то же самое, что ионотропные рецепторы). Потенциал-зависимые каналы открываются или закрываются в зависимости от разности потенциала на мембране клетки.
Существуют и другие типы каналов. Например, многие каналы открываются при воздействии на них циклических нуклеотидов (цАМФ или цГМФ)не извне, а из цитоплазмы, с внутренней стороны мембраны. Есть механочувствительные каналы. Некоторые из них открываются при растяжении мембраны. В других случаях канал при натяжении открывает присоединенный к нему элемент цитоскелета или внеклеточного матрикса (так, например, открываются и закрываются натриевые каналы на волосковых клеткахвнутреннего уха позвоночных.
Белки-переносчики — это ещё одна группа транспортных белков. Они участвуют в транспорте веществ, которые не могут пройти сквозь липидный бислой. Белки-переносчики связываются с ионами или молекулами того вещества, которое они переносят, и доставляют их в клетку или из клетки.
От белков–каналов они отличаются тем, что белки-канала - порообразующие белки, они пропускают вещества сквозь заполненную водой пору, а не захватывают и не перетаскивают их на другую сторону мембраны.
Чтобы лучше понять принцип работы белков-переносчиков, рассмотрим работу натрий-калиевой АТФазы. Натрий-калиевая АТФаза присутствует на мембране почти всех клеток человека. Она действует как насос, перекачивая ионы Na + из клетки во внешнюю среду, а ионы К + в клетку. Na + /K + АТФаза отвечает за поддержание мембранного потенциала клетки.
Как же происходит перенос ионов Na + и K + ? Сначала к натрий-калиевой АТФазе присоединяются три иона Na + , из-за чего изменяется конформация АТФазы. Затем АТФаза расщепляет молекулу АТФ на АДФ и фосфат (РО - ³4). При этом фосфат-ион присоединяется к поверхности белка. Энергия, выделившаяся за счёт расщепления АТФ, расходуется на изменение конформации АТФазы. После всех превращений белок „переворачивается“, и три иона Na + оказываются на внешней стороне мембраны, а фосфат заменяется на два иона K + , при этом ионы K + присоединяются не к тому месту, где были ионы Na + , а связываются со своим определённым участком. Из-за этого АТФаза вновь меняет свою конформацию, и ионы К + переносятся на внутреннюю сторону мембраны. Здесь ионы К + отсоединяются от АТФазы.
Кроме натрий-калиевой АТФазы есть также кальциевая АТФаза, хлорная АТФаза и другие. Важная особенность белков-насосов заключается в том, что каждый ион движется из области низкой концентрации в область высокой, то есть каждый ион перемещается против своего градиента концентрации. Это движение называется активным транспортом и может происходить только при помощи расходования АТФ.
Помимо активного транспорта белки-переносчики могут осуществлять пассивный транспорт, перемещая вещества из области высокой концентрации в область низкой. Также этот транспорт называют облегчённой диффузией. Например, поступление глюкозы в эритроциты происходит при помощи облегчённой диффузии
6. эндоплазматическая сеть (ЭПС) — внутриклеточный органоид эукариотической клетки, представляющий собой разветвлённую систему из окружённых мембраной уплощённых полостей, пузырьков и канальцев.
Строение
Эндоплазматический ретикулум состоит из разветвлённой сети трубочек и карманов, окружённых мембраной. Площадь мембран эндоплазматического ретикулума составляет более половины общей площади всех мембран клетки.
Мембрана ЭПР морфологически идентична оболочке клеточного ядра и составляет с ней одно целое. Таким образом, полости эндоплазматического ретикулума открываются в межмембранную полость ядерной оболочки. Мембраны ЭПС обеспечивают активный транспорт ряда элементов против градиента концентрации. Нити, образующие эндоплазматический ретикулум, имеют в поперечнике 0,05—0,1 мкм (иногда до 0,3 мкм), толщина двухслойных мембран, образующих стенку канальцев, составляет около 50 ангстрем (5 нм, 0,005 мкм). Эти структуры содержат ненасыщенные фосфолипиды, а также некоторое количество холестерина и сфинголипидов. В их состав также входят белки.
Трубочки, диаметр которых колеблется в пределах 0,1—0,3 мкм, заполнены гомогенным содержимым. Их функция — осуществление коммуникации между содержимым пузырьков ЭПС, внешней средой и ядром клетки.
Эндоплазматический ретикулум не является стабильной структурой и подвержен частым изменениям.
Выделяют два вида ЭПР:
§ гранулярный эндоплазматический ретикулум;
§ агранулярный (гладкий) эндоплазматический ретикулум.
На поверхности гранулярного эндоплазматического ретикулума находится большое количество рибосом, которые отсутствуют на поверхности агранулярного ЭПР.
Гранулярный и агранулярный эндоплазматический ретикулум выполняют различные функции в клетке.
При участии эндоплазматического ретикулума происходит трансляция и транспорт белков, синтез и транспорт липидов истероидов. Для ЭПС характерно также накопление продуктов синтеза. Эндоплазматический ретикулум принимает участие в том числе и в создании новой ядерной оболочки (например после митоза). Эндоплазматический ретикулум содержит внутриклеточный запас кальция, который является, в частности, медиатором сокращения мышечной клетки. В клетках мышечных волокон расположена особая форма эндоплазматического ретикулума — саркоплазматическая сеть.
Агранулярный эндоплазматический ретикулум участвует во многих процессах метаболизма. Также агранулярный эндоплазматический ретикулум играет важную роль в углеводном обмене, нейтрализации ядов и запасании кальция.Ферменты агранулярного эндоплазматического ретикулума участвуют в синтезе различных липидов и фосфолипидов, жирных кислот и стероидов. В частности, в связи с этим в клетках надпочечников и печени преобладает агранулярный эндоплазматический ретикулум.
К гормонам, которые образуются в агранулярном ЭПС, принадлежат, например, половые гормоны позвоночных животных и стероидные гормоны надпочечников. Клетки яичек и яичников, ответственные за синтез гормонов, содержат большое количество агранулярного эндоплазматического ретикулума.
Углеводы в организме накапливаются в печени в виде гликогена. Посредством гликолиза гликоген в печени трансформируется в глюкозу, что является важнейшим процессом в поддержании уровня глюкозы в крови. Один изферментов агранулярного ЭПС отщепляет от первого продукта гликолиза, глюкоза-6-фосфата, фосфогруппу, позволяя таким образом глюкозе покинуть клетку и повысить уровень сахаров в крови.
Гладкий эндоплазматический ретикулум клеток печени принимает активное участие в нейтрализации всевозможных ядов. Ферменты гладкого ЭПР присоединяют к молекулам токсичных веществ гидрофильные радикалы, в результате чего повышается растворимость токсичных веществ в крови и моче, и они быстрее выводятся из организма. В случае непрерывного поступления ядов, медикаментов или алкоголя образуется большее количество агранулярного ЭПР, что повышает дозу действующего вещества, необходимую для достижения прежнего эффекта.
Концентрация ионов кальция в ЭПС может достигать 10 −3 моль, в то время как в цитозоле составляет порядка 10 −7 моль (в состоянии покоя). Под действиеминозитолтрифосфата и некоторых других стимулов кальций высвобождается из ЭПС путем облегченной диффузии. Возврат кальция в ЭПС обеспечивается активным транспортом. При этом мембрана ЭПС обеспечивает активный перенос ионов кальция против градиентов концентрации больших порядков. И приём, и освобождение ионов кальция в ЭПС находится в тонкой взаимосвязи с физиологическими условиями.
Концентрация ионов кальция в цитозоле влияет на множество внутриклеточных и межклеточных процессов, таких как активация или инактивация ферментов, экспрессия генов, синаптическая пластичность нейронов, сокращения мышечных клеток, освобождение антител из клеток иммунной системы.
Особую форму агранулярного эндоплазматического ретикулума, саркоплазматический ретикулум, представляет собой ЭПС в мышечных клетках, в которых ионы кальцияактивно закачиваются из цитоплазмы в полости ЭПР против градиента концентрации в невозбуждённом состоянии клетки и освобождаются в цитоплазму для инициации сокращения.
Гранулярный эндоплазматический ретикулум имеет две функции: синтез белков и производство мембран.
7.Рибосома — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром 100—200ангстрем, состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре —ядрышке.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий ипластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно)
Читайте также:
- Энуклеация инсулином. Вылущивание инсулиномы.
- Конгенитальная амавротическая идиотия. Муколипидоз
- Эпидемиология желтой лихорадки. Распространенность желтой лихорадки
- Как пережить измену мужа? Советы психолога
- Полиморфная экссудативная эритема. Синдром Стивенса—Джонсона. Токсический эпидермальный некролиз.
