Строма костного мозга. Роль стромы костного мозга в регуляции кроветворения.
Добавил пользователь Евгений Кузнецов Обновлено: 23.01.2026
Костный мозг является основным кроветворным органом; общая масса его составляет 1,6—3,7 кг (в среднем 2,6 кг), половина ее приходится на активный красный мозг.
Красный костный мозг находится в губчатом веществе плоских костей, позвонков и метафизах длинных трубчатых костей, желтый — заключен в диафизах трубчатых костей.
По мере роста организма красный костный мозг в трубчатых костях постепенно превращается в жировой. Начинается этот процесс в возрасте 3—4 лет и заканчивается к 14—16 годам.
Костный мозг состоит из соединительнотканной основы — стромы, представленной ретикулярной тканью, паренхимы (клетки крови) и кровеносных сосудов.
Ретикулярная ткань костного мозга располагается между сосудами костного мозга и костными перекладинами (балками), покрытыми эндостом, который образует фиброзную капсулу. Костный мозг богат кровеносными сосудами, проникающими из костей и образующими в нем замкнутую сеть, в которой мелкие артерии переходят непосредственно в венозные синусы (синусоиды). Стенки синусоидов состоят из ретикулярной ткани.
В венозных синусах происходит образование клеток крови, которые, достигнув зрелости, поступают в периферическую кровь. Механизм этого процесса еще не изучен. Незрелые клетки в норме задерживаются в костном мозге (по-видимому, эндотелием венозных синусов) и в периферическую кровь не поступают. При патологических состояниях костного мозга эта функция либо усиливается (при лейкозах), либо ослабляется (при гиперспленизме).
В костном мозге проходит большое количество нервных волокон. Нервные окончания имеются не только в стенках сосудов, но и в ткани мозга. Влияние нервной системы на кроветворение в настоящее время считается установленным фактом. Так, раздражение симпатической части вегетативной нервной системы стимулирует созревание и выход клеток в кровь, а раздражение парасимпатической части угнетает эти процессы.
Основная функция костного мозга - кроветворная. Помимо этого, костный мозг участвует в иммунобиологических и защитных процессах, костеобразовании, промежуточном, белковом, жировом, углеводном и минеральном обмене, выработке лецитина, белковых тел, депонировании фосфатидов, холестерина, аскорбиновой кислоты, а также в метаболизме железа. Кроме того, костный мозг выполняет роль депо крови: при необходимости он увеличивает количество циркулирующей крови на 60 %, уменьшаясь при этом на 20
31.Селезенка — периферический орган кроветворной и иммунной систем. Кроме выполнения кроветворной и защитной функций, она участвует в процессах гибели эритроцитов, вырабатывает вещества, угнетающие эритропоэз, депонирует кровь.
Развитие селезенки. Закладка селезенки происходит на 5-й неделе эмбриогенеза образованием плотного скопления мезенхимы. Последняя дифференцируется в ретикулярную ткань, прорастает кровеносными сосудами, заселяется стволовыми кроветворными клетками. На 5-м месяце эмбриогенеза в селезенке отмечаются процессы миелопоэза, которые к моменту рождения сменяются лимфоцитопоэзом.
Строение селезенки. Селезенка снаружи покрыта капсулой, состоящей из мезотелия, волокнистой соединительной ткани и гладких миоцитов. От капсулы внутрь отходят перекладины — трабекулы, анастомозирующие между собой. В них также есть волокнистые структуры и гладкие миоциты. Капсула и трабекулы образуют опорно-сократительный аппарат селезенки. Он составляет 5-7% объема этого органа. Между трабекулами находится пульпа (мякоть) селезенки, основу которой составляет ретикулярная ткань.
Стволовые кроветворные клетки определяются в селезенке в количестве, примерно, 3,5 в 105 клеток. Различают белую и красную пульпы селезенки.

Белая пульпа селезенки — это совокупность лимфоидной ткани, которая образована лимфатическими узелками (В-зависимые зоны) и лимфатическими периартериальными влагалищами (Т-зависимые зоны).
Белая пульпа при макроскопическом изучении срезов селезенки выглядит в виде светло-серых округлых образований, составляющих 1/5 часть органа и распределенных диффузно по площади среза.
Лимфатическое периартериальное влагалище окружает артерию после выхода ее из трабекулы. В его составе обнаруживаются антигенпредставляющие (дендритные) клетки, ретикулярные клетки, лимфоциты (преимущественно Т-хелперы), макрофаги, плазматические клетки. Лимфатические первичные узелки по своему строению аналогичны таковым в лимфатических узлах. Это округлое образование в виде скопления малых В-лимфоцитов, прошедших антигеннезависимую дифференцировку в костном мозге, которые находятся во взаимодействии с ретикулярными и дендритными клетками.
Вторичный узелок с герминативным центром и короной возникает при антигенной стимуляции и наличии Т-хелперов. В короне присутствуют В-лимфоциты, макрофаги, ретикулярные клетки, а в герминативном центре — В-лимфоциты на разных стадиях пролиферации и дифференцировки в плазматические клетки, Т-хелперы, дендритные клетки и макрофаги.
Краевая, или маргинальная, зона узелков окружена синусоидальными капиллярами, стенка которых пронизана щелевидными порами. В эту зону Т-лимфоциты мигрируют по гемокапиллярам из периартериальной зоны и поступают в синусоидные капилляры.
Красная пульпа — совокупность разнообразных тканевых и клеточных структур, составляющих всю оставшуюся массу селезенки, за исключением капсулы, трабекул и белой пульпы. Основные структурные компоненты ее — ретикулярная ткань с клетками крови, а также кровеносные сосуды синусоидного типа, образующие причудливые лабиринты за счет разветвлений и анастомозов. В ретикулярной ткани красной пульпы различают два типа ретикулярных клеток — малодифференцированные и клетки фагоцитирующие, в цитоплазме которых много фагосом и лизосом.
Между ретикулярными клетками располагаются клетки крови — эритроциты, зернистые и незернистые лейкоциты.
Часть эритроцитов находится в состоянии дегенерации или полного распада. Такие эритроциты фагоцитируются макрофагами, переносящими затем железосодержащую часть гемоглобина в красный костный мозг для эритроцитопоэза.
Синусы в красной пульпе селезенки представляют часть сосудистого русла, начало которому дает селезеночная артерия. Далее следуют сегментарные, трабекулярные и пульпарные артерии. В пределах лимфоидных узелков пульпарные артерии называются центральными. Затем идут кисточковые артериолы, артериальные гемокапилляры, венозные синусы, пульпарные венулы и вены, трабекулярные вены и т. д. В стенке кисточковых артериол есть утолщения, называемые гильзами, муфтами или эллипсоидами. Мышечные элементы здесь отсутствуют. В эндотелиоцитах, выстилающих просвет гильз, обнаружены тонкие миофиламенты. Базальная мембрана очень пористая.
Основную массу утолщенных гильз составляют ретикулярные клетки, обладающие высокой фагоцитарной активностью. Полагают, что артериальные гильзы участвуют в фильтрации и обезвреживании артериальной крови, протекающей через селезенку.
Сокращения этих двух типов мышечных сфинктеров регулирует кровенаполнение синусов. Отток крови из микроциркуляторного русла селезенки происходит по системе вен возрастающего калибра. Особенностью трабекулярных вен являются отсутствие в их стенке мышечного слоя и сращение наружной оболочки с соединительной тканью трабекул. Вследствие этого трабекулярные вены постоянно зияют, что облегчает отток крови.
Возрастные изменения селезенки. С возрастом в селезенке отмечаются явления атрофии белой и красной пульпы, уменьшается количество лимфатических фолликулов, разрастается соединительнотканная строма органа.
Реактивность и регенерация селезенки. Гистологические особенности строения селезенки, ее кровоснабжения, наличие в ней большого количества крупных расширенных синусоидных капилляров, отсутствие мышечной оболочки в трабекулярных венах следует учитывать при боевой травме. При повреждении селезенки многие сосуды пребывают в зияющем состоянии, и кровотечение при этом самопроизвольно не останавливается. Эти обстоятельства могут определить тактику хирургических вмешательств. Ткани селезенки очень чувствительны к действию проникающей радиации, к интоксикациям и инфекциям. Вместе с тем они обладают высокой регенерационной способностью. Восстановление селезенки после травмы происходит в течение 3-4 недель за счет пролиферации клеток ретикулярной ткани и образования очагов лимфоидного кроветворения.
Кроветворная и иммунная системы чрезвычайно чувствительны к различным повреждающим воздействиям. При действии экстремальных факторов, тяжелых травмах и интоксикациях в органах происходят значительные изменения. В костном мозге уменьшается число стволовых кроветворных клеток, опустошаются лимфоидные органы (тимус, селезенка, лимфатические узлы), угнетается кооперация Т- и В-лимфоцитов, изменяются хелперные и киллерные свойства Т-лимфоцитов, нарушается дифференцировка В-лимфоцитов
Строма костного мозга. Роль стромы костного мозга в регуляции кроветворения.
Выход клеток крови из костного мозга. Синусоидальное дерево. Неэффективность эритропоэза. Неэффективный гранулопоэз.
Сосудистая сеть костного мозга начинается от артерии, проникающей в кроветворную ткань через костный канал. Ответвления артерии формируют элементарную морфофункциональную единицу костного мозга — «синусоидальное дерево». Стенка синусоидов состоит из эндотелиальных клеток и лежащих на них со стороны гемопоэтической ткани широких мононукле-арных адвентициальных клеток. Гемопоэтическая ткань распространяется между синусоидами. Созревающие эритроидные и гранулоцитарные клетки, мегакариоциты и макрофаги прилегают к наружной поверхности сосудистых синусов.
Зрелые клетки из костного мозга попадают в кровь через отверстия между эндотелиальными клетками костно-мозговых синусоидов. Диаметр этих отверстий — 2,3 мкм, т. е. много меньше проходящих через них в кровь клеток. Поэтому мигрирующие клетки должны обладать хорошей деформируемостью, чтобы преодолеть барьер и выйти в кровь. Плохо деформирующиеся ригидные ядра эритробластов, миелоцитов, промиелоци-тов не позволяют им мигрировать через отверстия в синусоиде. Напротив, хорошо деформирующиеся ядра зрелых гранулоцитов, моноцитов и лимфоцитов дают им возможность пересекать эндотелий.
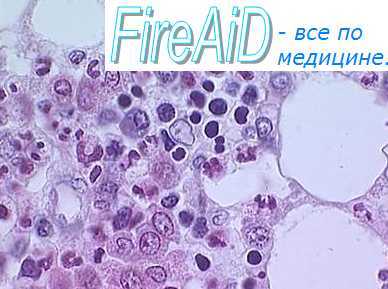
Эритробластический островок
Важным условием миграции клеток в кровь является способность ретикулоцитов и клеток белой крови к движению. Они пересекают узкие отверстия синусоидов, выпуская в них сначала цитоплазматические отростки—псевдоподии. В костномозговых синусоидах края эндотелиальных клеток тесно прилегают друг к другу и не позволяют клеткам проходить через отверстия между ними. Однако миграция клеток через них облегчается ритмичными расслаблениями синусоидов, которые уменьшают перекрытие этими клетками пор. Поверхность эндотелиальных клеток частично покрыта адвентициальными клетками, которые легко скользят по ней благодаря сократительному аппарату, имеющемуся у адвентициальных клеток. Сокращаясь, адвентициальные клетки уменьшают покрываемую ими поверхность костномозговых синусоидов и увеличивают возможность миграции клеток через стенку синусоидов в кровоток.
Выход клеток в просвет синусоида возрастает под влиянием молекулярных регуляторов гемопоэза. Эритропоэтин стимулирует быстрый выход ретикулоцитов, КСФ и бактериальный эндотоксин — нейтрофилов. Эритропоэтин ускоряет «сборку» цитоскелета ретикулоцитов, находящихся в костном мозге, увеличивает их деформабельность, что облегчает их выход через отверстия стенки синусоидов в кровь. Регуляторы облегчают формирование отверстий в эндотелии, уменьшая внешнюю поверхность эндотелия костномозгового синуса, покрытого адвентициальными клетками. Например, инъекция животному эритропоэтина резко уменьшает его адвентициальный покров и ретикулоциты легко пересекают стенку синусоида.
В норме небольшая часть клеток не достигает стадии созревания, погибает в костном мозге и подвергается фагоцитозу макрофагами, располагающимися на наружной поверхности костномозговых синусоидов. Применительно к эритроидному ряду это явление называется неэффективным эритропоэзом, применительно к гранулоцитарному — неэффективным гранулопоэзом. Неэффективный гемопоэз охватывает от 2 до 10 % эритробла-стов и от 10 до 15 % костномозговых гранулоцитов. Их мембраны теряют сиаловые кислоты, в результате уменьшается отрицательный заряд мембраны и макрофаги легко фагоцитируют эти клетки. Неполноценные клетки в кровоток не поступают.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Строма костного мозга [макрофаги, соединительнотканная оболочка, выстилающая костномозговую полость (эндост), костномозговые синусоиды, жировые клетки, соединительная ткань и нервные окончания] создает «ге-мопоэтическое индуцирующее микроокружение», необходимое для пролиферации, дифференциации и фиксации СКК в костном мозге, размножения и созревания миелоидных клеток. Оно включает ростковые факторы, а также экстрацеллюлярный матрикс, содержащий фибронектин, ламинин, коллаген и гликозаминогликаны.
Делящиеся КОК взаимодействуют преимущественно с эндостом, являющимся источником ростовых факторов. Более зрелые клетки располагаются ближе к костномозговым синусоидам, что облегчает выход созревающих клеток крови через стенку синусоида в кровь.
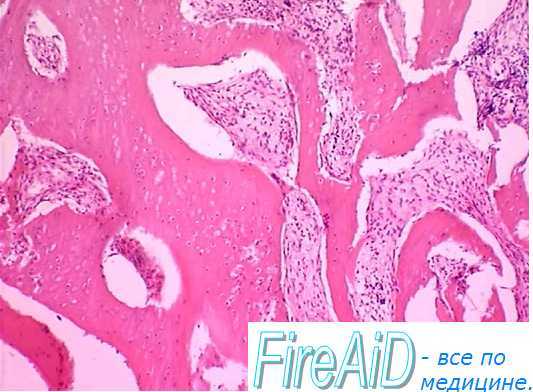
СКК, КОК-ГММЭ и малодифференцированые бипотенциальные клетки постоянно выходят из костного мозга в кровь и транспортируются в другие участки кроветворной ткани. Это обеспечивает постоянный обмен клетками между анатомически разделенными участками кроветворной ткани. Однако пролиферировать и дифференцироваться в клетки крови кроветворные клетки-предшественницы способны лишь в ткани костного мозга, и необходимые для этого условия создает ГИМ. Так, адгезивный гликопротеин — фибронектин выполняет «якорную», фиксирующую функцию в отношении КОК-ГММЭ и эритроидных КОК и одновременно увеличивает их пролиферацию. Особые же микроворсинки ретикулярных и эндотелиальных клеток стромы фиксируют СКК и КОК-ГМ.
Строма костного мозга продуцирует КСФгм, КСФг, КСФмон, ИЛ-6, а также особый фактор — модулятор, «фактор стволовой клетки», который не вызывает пролиферации КОК, но резко усиливает пролиферативный эффект КСФ на эти клетки. При дефекте его воспроизводства стромой возникает нарушение кроветворения.
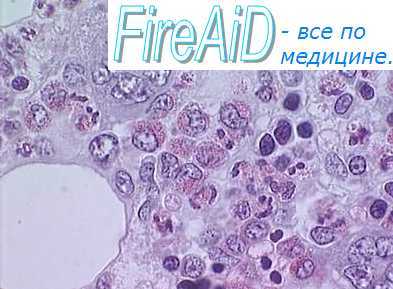
Нейтральные и кислые гликозаминогликаны увеличивают концентрацию цитокинов в непосредственной близости от клеток-мишеней, а также проницаемость мембран гемопоэтических клеток для кальция. Цитокины активируют в КОК формирование гемопоэтических вторичных мессенджеров, получивших название «сигнальные трансдукторы и активаторы транскрипции» (STAT), «ядерные факторы» (NF-E1, NF-E2, NF-kb/REL).
Вторичные мессенджеры обеспечивают быстрое распространение сигнала от возбужденного цитокином рецептора гемопоэтической клетки к ее геному, активируют транскрипцию его участков, ответственных за специализацию клетки-предшественницы, т. е. дифференциацию ее в направлении определенной клеточной линии — эритроидной, моноцитарной, нейтро-фильной и т. д. Нарушение формирования вторичных мессенджеров в КОК, не позволяющее цитокину реализовать регулирующий эффект на кроветворную клетку-предшественницу, приводит к нарушениям кроветворения. Так, нарушение, вызванное мутацией в участке генома, ответственного за синтез одного из транскрипционных факторов — NF-E1 обрывает развитие и влечет гибель эритроидных клеток на стадии проэритроб-ластов.
Роль стромы гемопоэтических органов в регуляции кроветворения.
Важную роль в регуляции кроветворения играет строма костного мозга. К ней относят макрофаги, структуры эндоста — соединительно-тканной оболочки, выстилающей костномозговую полость, костномозговые синусоиды, жировые клетки, соединительную ткань и нервные окончания. Эти структуры формируют "гемопоэтическое индуцирующее микроокружение" (ГИМ), необходимое для пролиферации, дифференциации и фиксации СКК в костном мозге, размножения и созревания миелоидных клеток. Так, механическое повреждение структур стромы костномозговых синусоидов или эндоста в эксперименте тормозит регенерацию костного мозга. С эндостом, покрывающим поверхность костных трабекул, взаимодействуют делящиеся КОЕ. Более же зрелые клетки располагаются у костномозговых синусоидов. Элементы стромы формируют ГИМ, продуцируя ростковые факторы, экстрацеллюлярный матрикс, содержащий фиб-ронектин, ламинин и коллаген, глюкозаминогликаны.
СКК, КОЕ- ГММЭ и малодифференцированные бипотенциальные клетки выходят из костного мозга в кровь и циркулируют в ней. Это обеспечивает постоянный обмен клетками между анатомически разделенными участками кроветворной ткани. Однако, пролифери-ровать и дифференцироваться эти клетки способны лишь в ткани костного мозга, и необходимые для этого условия создает ГИМ. Так, адгезивный гликопротеин — фибронектин выполняет "якорную", фиксирующую функцию в отношении КОЕ-ГММЭ в эритро-идных КОЕ, и одновременно увеличивает их пролиферацию. Особые же микроворсинки ретикулярных и эндотелиальных клеток стромы фиксируют СКК и КОЕ-ГМ.
Строма костного мозга продуцирует особый фактор — модулятор, гемопоэтин-I (Г-I), который не вызывает пролиферации КОЕ, но резко усиливает пролиферативный эффект КСФ на эти клетки.
Активация эритропоэза сочетается с увеличением в нем концентрации нейтральных глюкозаминогликанов (ГАГ), а гранулоцитопоэ-за — кислых ГАГ-ов (гепарансульфата, дерматан сульфата, гиалуро-новой кислоты и др.). Эффект ГАГ реализуется через увеличение проницаемости мембран гемопоэтических клеток для кальция и активацию в них системы циклических нуклеотидов с увеличением концентрации цАМФ. Таким образом, ГАГ способствует формированию вторичных посредников, обеспечивающих быстрое распространение сигнала от рецептора гемопоэтической клетки к ее геному в ходе действия КСФ на КОЕ.
Регуляция выхода клетки из костного мозга. Сосудистая сеть костного мозга начинается от артерии, проникающей через костный канал. От центральных ее ответвлений отходят синусоиды, потом артериолы, направляющиеся к периферии кости и распадающиеся на
капилляры (рис.6.8.). Синусоиды представлены многочисленными разветвлениями и анастомозами, впадающими далее в прямые, а затем в центральные синусоиды, из которых кровь поступает в вены, выхо-дяшие из кости. Каждая связка извитых синусоидов, впадающая в тот же сегмент прямых синусоидов, образует с последним "синусоидальное дерево", являющееся элементарной морфо-функциональной сосудистой единицей костного мозги. Стенка синусоидов состоит из эндотелиаль-ных клеток и лежащих на них со стороны гемопоэтической ткани широких мононуклеарных адвентициальных клеток. Гемопоэтическая ткань располагается между синусоидами, созревающие эритроидные и гранулоцитарные клетки, мегакариоциты и макрофаги прилегают к наружной поверхности сосудистых синусов.
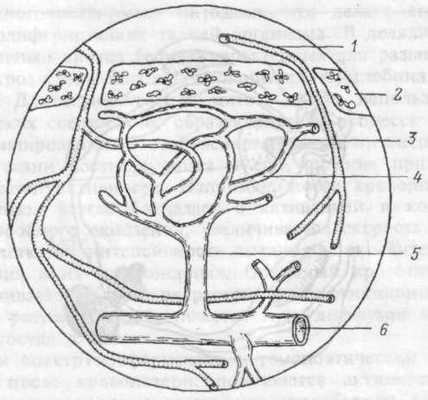
Рис.6.8. Микроциркуляция в ткани костного мозга.
"Синусоидальное дерево" образовано извитыми анастомозирующи-ми синусами, затем прямым синусом. 1 — афферентная артерия, 2 — костная ткань, 3 — извитой синус, 4 — синусоидальное дерево, 5 — прямой синус, 6 — центральный синус.
Высвобождение клеток из костного мозга в кровь связано с их проходом через отверстия между эндотелиальными клетками костномозговых синусоидов. Диаметр этих отверстий 2,3 мкм, т.е. много меньше проходящих через них в кровь клеток. Поэтому мигрирующие клетки должны обладать достаточной деформируемостью, чтобы преодолеть барьер и выйти в кровь. Плохо деформирующиеся, ригидные ядра эритробластов, миелобластов, промиелоцитов не позволяют им мигрировать через отверстия в синусоиде. Напротив, хорошо деформирующиеся ядра зрелых гранулоцитов, моноцитов и лимфоцитов дают им возможность пересекать эндотелий.
Важным условием миграции клеток в кровь является способность ретикулоцитов и клеток белой крови к движению. Они пересекают узкие отверстия синусов, выпуская в них сначала пседоподии. В костно- мозговых синусоидах края эндотелиальных клеток тесно прилегают друг к другу и не позволяют клеткам проходить через отверстия между ними (рис.6.9). Однако, миграция клеток через них облегчается ритмичными расслаблениями синусоидов, которые уменьшают перекрытие этими клетками пор. Поверхность эндотелиальных клеток частично покрыта адвентициальными клетками, которые легко скользят по ней, благодаря сократительному аппарату, имеющемуся у адвентициальных клеток. Сокращаясь, адвентициаль-ные клетки уменьшают покрываемую ими поверхность костно-мозговых синусоидов и увеличивают возможность миграции клеток.
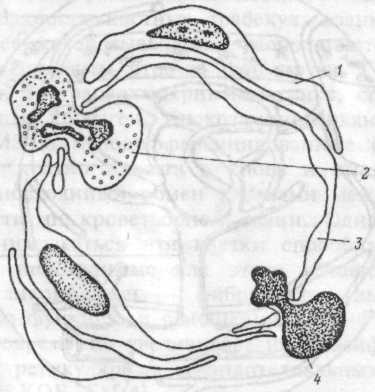
Рис.6.9. Поперечный срез костномозгового синуса.
Сегментоядерный нейтрофил и ретикулоцит пересекают стенку синуса. I — адвентициальная клетка, 2 - нейтрофил, 3 — эндотелиальная клетка, 4 — ретикулоцит.
Выход клеток в просвет синусоида возрастает под влиянием молекулярных регуляторов гемопоэза. Эритропоэтин стимулирует быстрый выход ретикулоцитов, КСФ и бактериальный эндотоксин — нейтро-филов. Эти факторы облегчают формирование отверстии в эндотелии, уменьшая внешнюю поверхность эндотелия костно-мозгового синуса, покрытого адвентициалъными клетками. Например, инъекция животному эритропоэтина резко уменьшает этот адвентициальный покров и ретикулоциты легко пересекают гемато-модулярный барьер.
В норме небольшая часть клеток погибает в костном мозге и подвергается фагоцитозу, не достигнув нормальной стадии созревания. Применительно к эритроидному ряду, это явление называется неэффективным эритропоэзом, применительно к гранулоцитарному — не-
эффективным гранулопоэзом. Неэффективный гемопоэз охватывает от 2 до 10% эритробластов и от 10 до 15% костномозговых гранулоцитов. Их мембраны теряют сиаловые кислоты, отсюда отрицательный заряд их мембраны уменьшается, и макрофаги, располагающиеся на наружной поверхности костномозговых синусоидов, легко фагоцитируют эти клетки. В кровоток неполноценные клетки не поступают.
Особенности метаболизма кроветворной ткани. Массы костного мозга у взрослого человека составляет 4,6% от массы тела или около 3,4 кг, в том числе красного костного мозга около 1,7 кг. Общее количество ядросодержащих клеток достигает в среднем 8,1-10 9 /кг массы тела, а занимаемый ими объем колеблется от 1320 до 4192 мл.
Дифференциация клеток костного мозга сопровождается' одновременно их многочисленными митозами, что делает его одной из наиболее пролиферируюших тканей организма. В делящихся клетках идет интенсивный синтез белков, характерных для развития клеточных линий крови: энзимов в гранулоцитах, гемоглобина в эритроб-ластах и т.д. Для осуществления митоза клетка использует энергию макроэргических соединений, образующихся в процессе окислительного фосфорилирования. Это объясняет наличие интенсивного энергообмена в ткани костного мозга и его усиление при повышении пролиферативной активности. Например, после кровопотери усиление эритропоэза всегда совпадает с активацией в костном мозге процессов аэробного окисления, увеличивается скорость потребления кислорода клетками, интенсивность дыхания и окислительного фосфорилирования в их митохондриях. Объемный кровоток в костном мозге увеличивается, благодаря раскрытию не функционирующих синусоидов, в результате укорачивается путь диффузии кислорода от отдельного сосуда к клетке.
Характерен спектр изоферментов в гемопоэтической ткани костного мозга после кровопотери: повышается активность аэробных изоферментов лактатдегидрогеназы, что способствует большему поступлению Ац КоА в цикл Кребса. При активации гемопоэза в костном мозге возрастает интенсивность синтеза ядерных и мито-хондриальных ДНК, РНК и белков, увеличивается количество митохондрий, поверхность их мембраны, обшее число рибосом, потребление свободных аминокислот. Например, усиление регенерации эритроцитов увеличивает потребление тканью костного мозга лизина, серусодержаших, ароматических аминокислот, глютаминовой кислоты, при их дефиците регенерация красной крови замедляется. Усиление пролиферации гемопоэтичеких клеток требует повышения проницаемости их мембран, что обеспечивается повышением интенсивности перекисного окисления липидов.
Между жировыми и гемопоэтическими клетками костного мозга существуют реципрокные отношения: резорбция жировой ткани предшествует активации и гранулоцитопоэза, и, особенно, эритропоэза. Высвобождающиеся из нее полиненасыщенные жирные кислоты локально реутилизируются в ходе гемопоэза для формирования клеток крови.
1. Белянин В.Л., Цыплаков Д.Э. Диагностика реактивных гиперплазий лимфатических узлов. – СПб – Казань, 1999. – 328 с.
2. Райт Д., Эддис Б., Леонг Э. Морфологическая диагностика патологии лимфатических узлов. – М.: Мед. лит., 2008. – С. 42-86.
3. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. – СПб.: Коста., 2006. – С. 45-48.
4. Шерстнева Е.С., Исаева Н.В., Загоскина Т.П. и др. Клиническое значение внутриклеточного ИЛ-8 у больных В-клеточным хроническим лимфолейкозом // Вестник гематологии. – 2007. – Т. 3, № 2. – С. 49-50.
5. Леенман Е.Е., Мухина М.С. и др. Место дендритных клеток в микроокружении при лимфоме Ходжкина. – СПб, 2010.
6. Киселева М.В. Морфо-функциональное состояние стромы лимфатических узлов при некоторых лимфопролиферативных заболеваниях. Диссертация. Санкт-Петербург, 2001.
7. Semenova N., Bessmeltsev S., Rugal V. Stromal microenvironment lymph nodes in CLL // Haematologica.17 Congress EHA Amsterdam. Abstract Book. – 2012. – Vol. 97, № S1. – Р. 521.
8. Семенова Н.Ю., Ругаль В.И. Морфофункциональные особенности стромы лимфатических узлов при ХЛЛ // Вестник гематологии. – 2011. – Т. VII, № 4. – С.45-46.
9. Tsuda H., Nishimura H., Sawada T., Takatsuki K. The roles of lymph node stromal cells in proliferation of lymphoid leukemia cells // Br.J.Cancer. – 1990. – Vol. 61. – Р. 362-364.
10. Park C-S., Choi Y.S. How do follicular dendritic cells interact intimately with B cells in the germinal centre? // Immunology. – 2005. – Vol. 114. – Р. 2-10.
11. Caligaris-Cappio F. Role of the microenvironment in chronic lymphocytic leukaemia // Br J Haematol. – 2003. – Vol. 123. – Р. 380-388.
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь – это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона – тимусзависимой областью (Т-зона). В-зависимые зоны – это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны – это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию – фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы – десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов – пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.
Читайте также:
- Патология клапана легочной артерии. Протезы сердечных клапанов
- Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
- Признаки посттравматического остеолиза дистального конца ключицы
- Диагностические операции в легочной хирургии. Торакоскопия
- Внутриутробный токсоплазмоз. Влияние вальпроевой кислоты на плод
