Структура ДНК нуклеосом
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Группа исследователей из ИБХ РАН и МГУ совместно с Университетом Юты (University of Utah) при помощи метода FRET-микроскопии впервые показала способность нуклеосом обратимо раскручиваться под воздействием FAСT без затрат энергии. В дальнейшем полученные данные помогут понять, какую роль этот белковый комплекс играет в активно делящихся клетках в опухолевых тканях. Результаты работы опубликованы в журнале Nature Structural & Molecular Biology.
«Данная работа является примером успешного сотрудничества между двумя научными группами, – рассказывает Ксения Кудряшова, кандидат биологических наук, научный сотрудник Отдела биоинженерии ИБХ РАН. – Первую группу возглавляет исследователь нуклеосом с большим стажем Василий Михайлович Студитский, заведующий лабораторией регуляции транскрипции и репликации Московского государственного университета им. М. В. Ломоносова. Вторая научная группа проводила исследования под руководством специалиста по микроскопических методам в биологии Алексея Валерьевича Феофанова, руководителя лаборатории оптической микроскопии и спектроскопии биомолекул Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН».
Как известно, молекула ДНК компактно свёрнута в ядрах клеток. Правильность укладки генома обеспечивают специальные белки, которые вместе с ДНК формируют структуру под названием хроматин. Единицей компактизации хроматина является нуклеосома. Нуклеосому часто сравнивают с «катушкой ниток», в которой ДНК-«нитка» намотана на бочонок из белков-гистонов – «катушку». Плотная упаковка хроматина в ядре нарушается при транскрипции, когда идёт активное считывание наследственной информации с ДНК. Облегчить транскрипцию хроматина помогает консервативный белок FACT, который стал объектом пристального внимания учёных. Взаимодействие FACT с нуклеосомой было показано ранее, но впервые удалось выяснить важные детали этого процесса.
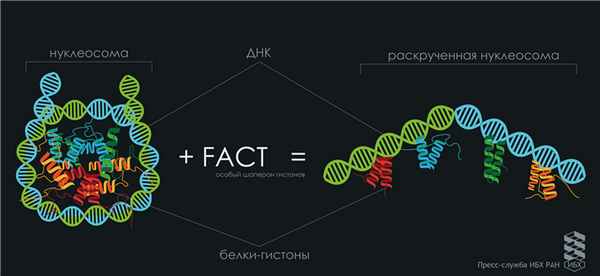
Одна из возможных моделей раскручивания нуклеосом белковым комплексом FACT. Автор: Снежана Мажекенова.
Исследователи изучили взаимодействие белкового фактора FACT с нуклеосомой методом spFRET-микроскопии.
«В результате начатой еще в 2010 году плодотворной работы удалось с нуля разработать метод spFRET и применить его для исследования нуклеосом, – объясняет Ксения Кудряшова. – Его основу составляет микроскопия единичных молекул. В соседние витки нуклеосомной ДНК вводятся флуоресцентные метки, одна из которых служит донором энергии, а другая – акцептором. Донора можно возбудить с помощью лазера определённой длины волны. Если донор находится близко к акцептору, то происходит переброс энергии на акцептор. Чем ближе расположены метки, тем ярче сигнал от акцептора. Таким образом, можно следить за расстоянием между соседними витками ДНК и оценивать, насколько нуклеосома компактно свернута. Это уникальная для России разработка. Она позволяет изучать структурные перестройки в нуклеосомных комплексах с разрешением в несколько нанометров, причём информация собирается от каждой молекулы индивидуально».
С использованием этого метода в работе впервые показали способность нуклеосом обратимо раскручиваться под воздействием FACT in vitro (в пробирке) без затрат энергии, что достаточно необычно. Ведь АТФ-зависимые комплексы ремоделирования для перестройки хроматина тратят много энергии.
При образовании комплекса «нуклеосома-FACT» нити ДНК практически полностью распрямляются, но остаются связанными с белками-гистонами. Если убрать FACT из комплекса, то всё возвращается на круги своя: нуклеосомная ДНК снова наматывается на основание из гистонов. Таким образом, FACT – это редкий пример АТФ-независимого (без естественных источников энергии) комплекса ремоделирования хроматина.
По мнению Марии Валиевой, первого автора статьи из МГУ, в клетке способность FACT обратимо менять структуру хроматина, возможно, помогает активировать определённые гены путём перестройки соответствующих участков ДНК. Однако ничего более конкретного нельзя сказать о подобных процессах, происходящих в клетках, так как вопрос ещё недостаточно изучен. Автор отмечает, что изучение этого белкового комплекса важно не только с научной, но и медицинской точки зрения. Это связано с тем, что FACT в большом количестве содержится в опухолевых тканях. Именно поэтому перед учёными стоит вопрос: «Какую роль этот белковый комплекс играет в активно делящихся клетках?».
(автор: Надежда Куликова)
7 декабря 2016 года
© 2009–2022 Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Нуклеосомная петля ДНК для РНК-полимеразы
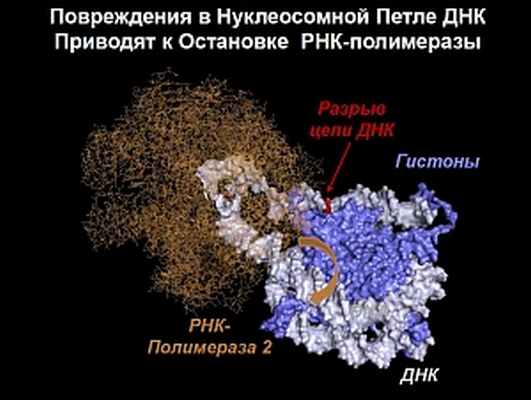
Предполагаемая структура
Молекула ДНК в клетках человека химически нестабильна, что вызывает ее повреждения различной природы. Существует целый ряд механизмов, обеспечивающих ответ на повреждения ДНК, который включает в себя процессы обнаружения повреждения ДНК, генерацию сигнала о повреждении и «починку» молекулы ДНК — так называемую репарацию.
Группа исследователей из МГУ имени М.В.Ломоносова под руководством профессора Василия Студитского вместе со своими зарубежными коллегами открыла новый механизм починки ДНК, который открывает новые перспективы для лечения и предупреждения нейродегенеративных заболеваний. Статья, рассказывающая об открытии, опубликована в научном журнале Science Advances, основанном издателем журнала Science в феврале 2015 года.
К слову, в марте 2015 года в престижном научном журнале PNAS была опубликована статья докторанта химического факультета МГУ Светланы Хороненковой, посвященная иному аспекту репарации ДНК.
«У высших организмов ДНК связана в комплексы с белками — нуклеосомы. На каждые 200 пар нуклеотидов приходится такой ДНК-белковый комплекс — нуклеосома, состоящая из 8 белков-гистонов, на который, как нить на катушку, накручивается двойная спираль ДНК, свернутая в два сверхспиральных витка. Часть поверхности спирали ДНК спрятана, поскольку она взаимодействует с гистонами. Таким способом упакован весь наш геном, за исключением областей, с которых в данный момент считывается информация», — рассказывает ведущий научный сотрудник и руководитель лаборатории регуляции, транскрипции и репликации биологического факультета МГУ, доктор биологических наук Василий Студитский, получивший мегагрант в 2010 году.
Плотная упаковка позволяет нити длиной около двух метров умещаться в микроскопическом клеточном ядре, но делает значительные поверхности ДНК недоступными для ферментов репарации — белков, запускающих механизмы «починки» поврежденных участков. А повреждение ДНК ведет к накоплению мутаций, смерти клетки, а на уровне всего организма — к различным заболеваниям, в том числе, нейродегенеративным, например, болезни Альцгеймера.
Группа, которую возглавляет профессор Василий Студитский, изучала механизм узнавания ферментами одноцепочечных разрывов ДНК, при которых теряется связь между нуклеотидами одной из цепей, в местах, где ДНК связана с гистонами.
О репарации на активных участках ученые знают довольно много. Как известно, для синтеза белка генетический код (инструкция по его сборке, где тройки — триплеты — нуклеотидов соответствуют определенной аминокислоте) должен быть вынесен из ядра в цитоплазму клетки. Тонкая и длинная нить ДНК упакована в ядре и может порваться при выходе наружу, а жертвовать ею нельзя — в клетке ядерная ДНК находится в единственном экземпляре. Поэтому, когда нужно синтезировать определенный белок, ее небольшой участок раскручивается, две цепи размыкаются, и информация о структуре белка с одной из цепей ДНК перезаписывается на РНК, небольшую одноцепочечную молекулу. Молекула матричной (информационной) РНК, которая и становится указанием, как делать белок, синтезируется по принципу комплементарности: каждому нуклеотиду соответствует парный ему.
Во время транскрипции (считывания) информации и переписывания ее на РНК фермент РНК-полимераза «едет» по цепи ДНК, и, обнаружив разрыв, останавливается. Как корректор текста, РНК-полимераза, застопорив переписывание, запускает каскад реакций, в результате которого ферменты репарации исправляют поврежденный участок. В то же время РНК-полимераза не может обнаружить разрывы, присутствующие в другой цепи ДНК.
«Мы доказали (пока еще не в клетке, а в пробирке, in vitro), что репарация разрывов в другой цепи ДНК, «спрятанных» в нуклеосоме, все-таки возможна. По нашему предположению, это происходит благодаря образованию специальных небольших петель ДНК на нуклеосоме, хотя в норме нить намотана на гистонную «катушку» очень плотно», — рассказал Василий Студитский, — «Они возникают, когда ДНК накручивается обратно на нуклеосому вместе с полимеразой. РНК-полимераза может «ползти» по таким петлям ДНК, как и на свободном от гистонов участке, и, останавливаясь рядом с местами разрывов ДНК, «поднимать панику», запуская каскад реакций для начала «ремонтных работ».
В ходе эксперимента в ДНК были введены участки, которые можно легко искусственно разорвать, добавляя в пробирку специальные ферменты. После этого создавалась система с одной нуклеосомой и транскрипцией с одной молекулой РНК. Благодаря разработанной в 2002 году этой же группой ученых модельной системе, гистоны были посажены на молекулу с точностью до одного нуклеотида. Имея специально внесенные разрывы в точно определенных местах на ДНК, ученые исследовали влияние разрывов на скорость движения РНК-полимеразы. Выяснилось, что именно в нуклеосомах, а не на свободной от гистонов ДНК фермент останавливался, когда разрыв присутствует в другой цепи ДНК. Причем останавливался он не перед разрывом, а сразу после него. Достаточно сложно было понять механизм, который позволяет ему замечать повреждение за «спиной», словно он имел «глаза на затылке», хотя, очевидно, он не имеет ни того, ни другого.
Анализ разрывов в различных положениях позволил выдвинуть гипотезу, что остановку движения РНК-полимеразы вызывает формирование петли, которая преграждает ей путь. Полученные данные открывают новое направление для работы по тематике репарации ДНК.
Ранее роль хроматина считалась пассивной: полагали, что только в развернутой нити ДНК могут происходить «ремонтные работы». Но Студитский и его коллеги выяснили, что ремонтировать нить можно и не разматывая «катушку», и высоко консервативные гистоны (изменения в их структуре отбраковываются естественным отбором) играют в этом важную роль. А высокая консервативность белка как раз и предполагает его активное участие во многих процессах.
Кроме того, в предложенных в работе моделях ученые впервые объясняют роль так называемых топологических замков, которые образуются при прохождении любого фермента по ДНК в момент, когда он встречает нуклеосому.
«С точки зрения прикладной науки открытие нового механизма репарации обещает новые перспективные методы предотвращения и лечения заболеваний. Нами было показано, что в формировании петель, останавливающих полимеразу, участвуют ее контакты с гистонами. Если сделать их более прочными, то увеличатся эффективность формирования петель и вероятность репарации, что снизит риск заболеваний. Если же дестабилизировать эти контакты, то с помощью специальных способов доставки лекарства можно запрограммировать смерть пораженных клеток», — заключил Василий Студитский, добавив, что процесс разработки и тестирования таких лекарств, конечно, потребует много времени.
Структура ДНК нуклеосом
Структура ДНК нуклеосом
• Вокруг октамера гистонов обернуто 1,65 витка ДНК
• Структура ДНК изменяется таким образом, что на среднюю ее часть приходится максимальное количество оснований на виток, а на концах это значение оказывается ниже
• При изменении с 10,5 пн/виток в ДНК в растворе до 10,2 на поверхности нуклеосом, теряется около 0,6 отрицательных супервитка, что объясняет парадокс коэффициента зацепления
Расположение ДНК на поверхности нуклеосомы объясняет, почему она подвержена действию некоторых нуклеаз. Особенно информативна обработка нуклеазами, действующую на одну цепь ДНК. Эти нуклеазы (например, ДНКаза I) образуют разрывы в одной из цепей ДНК; при этом вторая цепь остается интактной, и поэтому в двухцепочечной структуре дефекты не проявляются. Однако при денатурации вместо протяженных высвобождаются короткие фрагменты ДНК. Если ДНК на концах была помечена, то концевые фрагменты можно идентифицировать методом радиоавтографии.
Когда ДНК присутствует в растворе в свободном виде, то она атакуется нуклеазами в случайных местах. ДНК, которая находится на нуклеосомах, также подвергается действию ферментов, но разрывы возникают на определенных расстояниях друг от друга. Если ДНК пометить, обработать нуклеазой, а затем денатурировать и подвергнуть электрофорезу, то получается лесенка подобно изображенной на °ис.
Расстояние между ступеньками этой лесенки составляет 10-11 оснований. Лесенка распространяется на все расстояние, которое занимает коровая ДНК. Разрывы нумеруются, начиная с S1 по S13 (где S1 отстоит примерно на 10 оснований от меченного 5'-конца, S2 на 20 оснований, и т. д.).
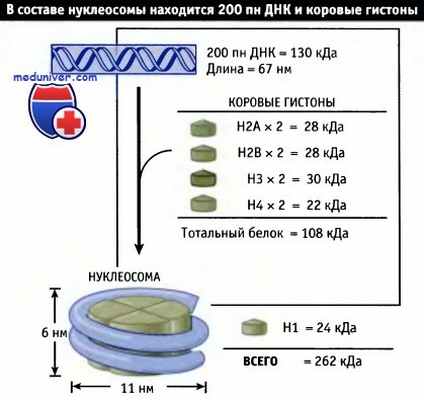
Нуклеосомы состоят из примерно одинаковых количеств ДНК и гистонов (включая гистон Н1).
Рассчетная маса нуклеосомы составляет 262 кДа
Не все сайты с одинаковой эффективностью атакуются ферментом: некоторые расщепляются довольно быстро, а в других разрывы образуются с трудом. ДНКаза I и ДНКаза II дают одинаковую лесенку, хотя интенсивность полос несколько различается. Это свидетельствует о том, что характер деградации ДНК определяется расположением соответствующих сайтов, которое зависит от организации ДНК и лишь в незначительной степени от сродства фермента к сайту. Такой же характер деградации ДНК обнаруживается при атаке гидроксил-радикалом.
Это позволяет предполагать, что он определяется структурой самой ДНК, а не нуклеотидным составом. Отсутствие расщепления по некоторым сайтам является следствием существования определенной структуры нуклеосомы, из-за которой некоторые участки ДНК оказываются недоступными для фермента.
Поскольку в состав коровой частицы входят две цепочки ДНК, метятся оба 5'- (или 3'-) конца, по одному в каждой цепи. Таким образом, при обработке нуклеазами образуются фрагменты обеих цепей. Это иллюстрируется рис. 6.36, где каждый меченный фрагмент происходит из различной цепи. В результате, в таком эксперименте каждая меченная полоса фактически представлена двумя фрагментами, отрезанными на одном и том же расстоянии от любого из меченных концов.
Каким же образом можно тогда объяснить дискретное предпочтение определенных сайтов? Считается, что путь ДНК вдоль частицы симметричен (по отношению к горизонтальной оси, проходящей через нуклеосому). Таким образом, если, например, после обработки ДНКазой I не образуется фрагмент в 80 пн, это должно означать, что положение, соответствующее 80-му основанию с 5'-конца любой из цепей, не чувствительно к ферменту.
Когда ДНК иммобилизована на плоской поверхности, сайты нарезаются в соответствии с определенным расстоянием между точками расщепления. Рисунок ниже позволяет предполагать, что периодичность разрезания соответствует структурной периодичности, присущей В-форме ДНК (классической двуспиральной структуре В-типа, предложенной Уотсоном и Криком). Периодичность разрезания (расстояние между точками расщепления) действительно соответствует структурной периодичности (числу пар на виток двойной спирали).
Таким образом, расстояние между точками расщепления соответствует числу нуклеотидных пар, приходящемуся на виток. Соответствующие измерения показывают, что среднее значение для двухспиральной В-формы ДНК составляет 10,5 пн на виток.
Какова природа участков-мишеней на нуклеосоме? Рисунок ниже иллюстрирует данные, согласно которым в каждом сайте разрезания существуют 3-4 положения, в которых может произойти разрез, т. е. сайт разрезания определяется с точностью ±2 пн. Иными словами, сайт разрезания представляет собой короткий отрезок в обеих цепях, на 3-4 пары оснований открытый для действия нуклеазы. Относительная интенсивность разрезания указывает на то, что некоторые положения оказываются предпочтительнее других.
На основании полученной картины можно рассчитать «среднюю» точку разрезания. Пары сайтов S1-S4 и S10-S13, лежащие на концах ДНК, находятся на расстоянии 10,0 оснований друг от друга. Сайты от S4 до S10, расположенные в ДНК в центре частицы, разделены 10,7 оснований. (Поскольку мы анализируем среднее положение, сайты оказываются разделены не целым числом оснований.)
Вариабельность в периодичности разрезания коровой ДНК (10,0 на концах и 10,7 в середине молекулы) означает, что существует вариабельность в ее структурной периодичности. ДНК, находящаяся в середине частицы содержит больше, а находящаяся на концах меньше пн на виток, чем ДНК в растворе. Средняя периодичность на нуклеосому составляет только 10,17 пн на виток, что существенно меньше, чем 10,5 пн приходящихся на виток ДНК в растворе.
На основании кристаллической структуры коровой частицы можно предполагать, что ДНК организована в плоскую суперспираль, которая образует 1,65 витка вокруг октамера гистонов. Шаг суперспирали варьирует, и в середине имеется перерыв. Области перегибов расположены симметрично и находятся в положениях ±1 и ±4. Это соответствует сайтам S6 и S8 и S3 и S11, которые наименее чувствительны к ДНКазе I.
Структура нуклеосомной коровой частицы показывает, каким образом искажается структура ДНК. Большая часть суперспиральной структуры приходится на центральный район в 129 пн, в котором находится 1,59 левых суперспиральных витка диаметром 80 А (лишь в 4 раза превышающим диаметр самого дуплекса ДНК). Концевые терминальные последовательности вносят лишь небольшой вклад в общую кривизну.
Центральные 129 пн находятся в В-форме, но существенно деформированы, что необходимо для образования суперспирали. Большая канавка согнута плавно, однако маленькая изогнута с резкими изгибами. Эти конформационные изменения объясняют, почему центральная часть нуклеосомной ДНК не связывается с регуляторными белками. Последние обычно связываются с терминальными участками коровой ДНК или с линкер-ной последовательностью.
ДНК располагается на поверхности нуклеосомы таким образом, что при удалении белков, вызывающих конформационные ограничения, образуется 1 отрицательный супервиток. Однако длина ДНК на нуклеосоме соответствует 1,67 супервитку. Это расхождение иногда называют парадоксом коэффициента зацепления.
Расхождение объясняется существованием различия между, в среднем, 10,17 пн на виток в нуклеосомной ДНК и 10,5 пн на виток в свободной ДНК. В нуклеосоме на 200 пн приходится 200/10,17 = 19,67 витков. Когда ДНК высвобождается из нуклеосомы, получается 200/10,5 = 19,0 витков. Менее плотно скрученная ДНК на нуклеосоме занимает -0,67 витка, что объясняет разницу между фактическим (-1,67) и измеренным (-1,0) числом супервитков. Фактически, некоторая часть деформации кручения в нуклеосомной ДНК расходуется на увеличение количества пн/виток; лишь оставшаяся часть воспринимается как суперспираль.
Разрывы в цепях ДНК можно обнаружить по появлению фрагментов после денатурации ДНК, приводящей к образованию одноцепочечных форм.
Если ДНК содержала метку, например, на 5'-конце, то при авторадиографии будут видны только 5'-фрагменты.
Размер фрагмента определяется расстоянием от разрыва до положения метки. Исследование фрагментов переваривания ядер с помощью ДНКазы I показывает,
что разрывы коровой ДНК образуются через регулярные интервалы. Наиболее чувствительные к нуклеазе сайты ДНК располагаются с периодичностью,
отражающей структуру двойной спирали (для ясности показаны сайты только одной цепи). Методом электрофореза с высоким разрешением показано,
что каждый сайт атаки ДНКазы I состоит из нескольких чувствительных фосфодиэфирных связей.
Это следует из рисунка, на котором представлены фрагменты ДНК после ДНКазной обработки коровых частиц с концевым мечением ДНК.
Атака фермента происходила по сайтам S4 и S5. Два витка ДНК на нуклеосоме расположены близко друг к другу. Нуклеосома может представлять собой цилиндр,
снаружи которого располагаются два витка ДНК. Последовательности ДНК, локализованные на разных витках,
на нуклеосоме могут располагаться близко друг к другу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нуклеосома
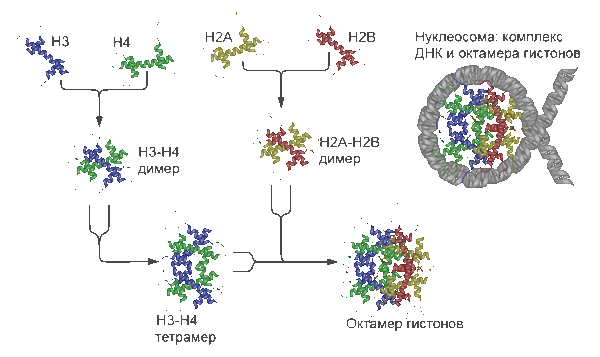
Структура и «сборка» нуклеосомы. Показано образование и строение гистонного октамера и структура комплекса ДНК-гистонный октамер — нуклеосомы.
Нуклеосома — это структурная часть хромосомы, образованная совместной упаковкой нити ДНК с гистоновыми белками H2А, H2B, H3 и H4. Последовательность нуклеосом, соединенная гистоновым белком H1, формирует нуклеофиламент (nucleofilament), или иначе нуклеосомную нить.
Вокруг нуклеосомного ядра, представленного гистонным октамером, ДНК делает 1,67 оборота (147 п.н.). Участок ДНК, между нуклеосомами, называется линкерной ДНК и составляет 10—100 п.н.
Сборка нуклеосомы происходит на ДНК. При репликации ДНК материнские гистоны распределяются случайным образом по дочерним цепям. Гистоновые шапероны временно экранируют заряд гистонов, обеспечивая правильную сборку нуклеосомы. Шаперон CAF1 связан с PCNA, сидит в репликационной вилке, связывая «старые» димеры H3H4, начинает пострепликационную сборку нуклеосом с посадки этого димера.
Последовательности ДНК могут в 1000 раз отличаться по потенциалу связывать нуклеосому. Если подряд следуют последовательности, изгибающие ДНК в одну сторону (например, ТАТА), связывание нуклеосомы будет неустойчиво.
В геноме присутствуют:
- участки, свободные от нуклеосом (сайты связывания транскрипционных акторов, регуляторных белков);
- участки, где положение нуклеосомы строго фиксировано;
- участки, в которых нуклеосомная укладка подвержена регуляции белками АТФ-зависимого ремоделинга хроматина.
Литература
- Хромосомы
- Эпигенетическое наследование
- ДНК
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Нуклеосома" в других словарях:
Нуклеосома — * нуклеасома * nucleosome or nu(v) particle дискообразные структуры эукариотических хромосом диаметром ок. 10 нм, являющиеся элементарной единицей упаковки хромосмной ДНК в хроматине. Состоит из белкового ядра, включающего октомеры из четырех пар … Генетика. Энциклопедический словарь
нуклеосома — nucleosome, nu (ν) particle нуклеосома. Дисковидная структура диаметром около 10 нм, являющаяся элементарной единицей упаковки хромосомной ДНК в хроматине ; состоит из белкового ядра (включает октамер гистонов Н2 … Молекулярная биология и генетика. Толковый словарь.
Нуклеосома — дисковидная структура, являющаяся элементарной единицей упаковки хромосомной ДНК в хроматине. Состоит из белка (гистона) и обернутой вокруг него двойной спирали ДНК … Словарь по психогенетике
минимальная нуклеосома — core particle, minimal nucleosome коровая частица, минимальная нуклеосома. Единица упаковки ДНК, стабильно существующая при формировании нуклеосомной структуры и включающая 146 пар нуклеотидов и октамер коровых гистонов ;… … Молекулярная биология и генетика. Толковый словарь.
Клеточное ядро — Клетки HeLa, ДНК которых окрашена голубым красителем Хёхста 33258. Центральная и правая клетки находятся в интерфазе, по … Википедия
Кариоплазма — Клетки ДНК которых окрашена голубым красителем Хойста. Центральная и правая клетки находятся в интерфазе, поэтому окрашено всё ядро. Клетка слева находится в состоянии митоза (анафаза), поэтому её ядро не видно, а ДНК сконденсирована так, что… … Википедия
Нуклеоплазма — Клетки ДНК которых окрашена голубым красителем Хойста. Центральная и правая клетки находятся в интерфазе, поэтому окрашено всё ядро. Клетка слева находится в состоянии митоза (анафаза), поэтому её ядро не видно, а ДНК сконденсирована так, что… … Википедия
Эукариотическое ядро — Клетки ДНК которых окрашена голубым красителем Хойста. Центральная и правая клетки находятся в интерфазе, поэтому окрашено всё ядро. Клетка слева находится в состоянии митоза (анафаза), поэтому её ядро не видно, а ДНК сконденсирована так, что… … Википедия
Ядерная оболочка — Клетки ДНК которых окрашена голубым красителем Хойста. Центральная и правая клетки находятся в интерфазе, поэтому окрашено всё ядро. Клетка слева находится в состоянии митоза (анафаза), поэтому её ядро не видно, а ДНК сконденсирована так, что… … Википедия
Структура ДНК нуклеосом
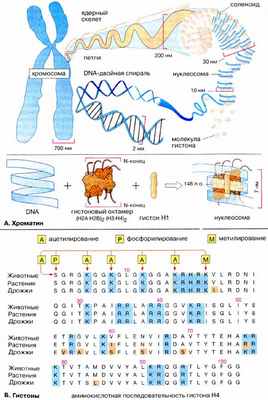
А. Хроматин
В ядре эукариот (схема на с. 98) ДНК (DNA) связана с белками и РНК. Треть нуклеопротеидного комплекса, называемого хроматином , составляет ДНК.
Хроматин можно видеть в оптический микроскоп только во время деления клеток (см. с. 380), когда он находится в конденсированном виде в составе хромосом . Во время интерфазы большая часть хроматина неконденсирована. Морфологически различают эухроматин и гетерохроматин , который более конденсирован, чем эухроматин. Эухроматин соответствует участкам хромосом с активной транскрипцией.
Белки хроматина подразделяются на гистоновые и негистоновые . Гистоны ( Б ) — небольшие, сильно основные белки, ассоциированные непосредственно с ДНК. Они принимают участие в структурной организации хроматина, нейтрализуя за счет положительных зарядов аминокислотных остатков отрицательно заряженные фосфатные группы ДНК, что делает возможной плотную упаковку ДНК в ядре. Благодаря этому 46 молекул ДНК диплоидного генома человека общей длиной около 2 м, содержащих в сумме 6-10 9 пар оснований [п.о. (bp)], могут поместиться в клеточном ядре диаметром всего 10 мкм.
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 п.о., образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой . Участок ДНК (линкерная ДНК), непосредственно не контактирующий с гистоновым октамером , взаимодействует с гистоном Н1 . Этот белок закрывает примерно 20 п.о. и обеспечивает формирование суперспиральной структуры ( соленоида ) диаметром 30 нм. Когда хроматин конденсируется с образованием метафазной хромосомы, соленоидные структуры образуют петли диаметром 200 нм, содержащие ДНК длиной 80000 п.о. Петли связаны с остовом из белков ( ядерный остов ), причем примерно 20 петель образуют минидиски. Большое число минидисков укладывается в стопку, составляя хромосому. Вследствие этого ДНК оказывается свернута настолько плотно, что даже самая маленькая хромосома человека содержит около 50 млн п.о.
Группа негистоновых белков высоко гетерогенна и включает структурные ядерные белки , множество ферментов и факторов транскрипции (см. с. 242), связанных с определенными участками ДНК и осуществляющих регуляцию генной экспрессии и других процессов.
Гистоновые белки интересны со многих точек зрения. Благодаря высокому содержанию лизина и аргинина (на схеме синего цвета) они, как уже упоминалось, проявляют сильно основные свойства. Кроме того, последовательность аминокислот гистонов, т. е. их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей (см. с. 150). Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и ее полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы еще в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точковые мутации, все они, очевидно, приводили к вымиранию мутантных организмов
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосомы ( А ) и важен для поддержания структуры хроматина и контроля за генной экспрессией. Так, например, формирование (конденсация) хромосом связано в фосфорилированием ( Р ) гистонов, а усиление транскрипции — с ацилированием ( А ) в них остатков лизина. Детали механизма регуляции до конца не выяснены.
Читайте также:
