Стволовые клетки при острой лучевой болезни. Лейкопоэз и эритропения при поражении радиацией
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Лейкопения – это снижение уровня лейкоцитов в периферической крови ниже 4000 в 1 мкл. Причиной данного состояния могут быть инфекционные, воспалительные аутоиммунные заболевания, генетические дефекты иммунной системы и пр. Клинически лейкопения проявляется повышенной восприимчивостью организма к различным инфекциям, однако может протекать абсолютно бессимптомно. Уровень лейкоцитов измеряется при заборе венозной либо капиллярной крови утром натощак. Для коррекции данного лабораторного отклонения проводится лечение основного заболевания.
Классификация
Низкий уровень белых кровяных телец может встречаться у абсолютно здоровых лиц – конституциональная безвредная лейкопения отмечается примерно у 2-5% людей. По происхождению патологические лейкопении разделяют на:
- Наследственные (первичные). Низкое содержание лейкоцитов обусловлено генетически детерминированными нарушениями образования и созревания клеток в красном костном мозге. К ним относятся нейтропения Костмана, наследственная нейтропения аутосомно-доминантного типа и т.д.
- Приобретенные (вторичные). Более распространенный вариант. Лейкопения развивается вследствие действия ионизирующего излучения, неблагоприятного эффекта лекарственных препаратов, биологических агентов (бактерий, вирусов) или факторов иммунной аутоагрессии.
По патогенезу (механизму развития) различают лейкопении, возникшие вследствие:
- Нарушения поступления лейкоцитов в кровь из костного мозга. Развитие лейкопении обусловлено повреждением кроветворных клеток либо неэффективным лейкопоэзом из-за дефектов митоза, созревания лейкоцитов. Наблюдается при длительном приеме цитостатических лекарственных препаратов, действии ионизируюшей радиации, генетических заболеваниях, выраженном дефиците витамина В12, фолиевой кислоты.
- Перераспределения лейкоцитов. Происходит изменение соотношения между циркулирующим и пристеночным пулом белых клеток крови в результате их скопления в расширенных капиллярах органов-депо. Встречается при шоковых состояниях.
- Сокращения времени пребывания в крови. Время присутствия в крови лейкоцитов может уменьшаться из-за их деструкции антителами (при аутоиммунных патологиях), токсическими факторами (при тяжелых инфекциях), чрезмерно активированными макрофагами (при гиперспленизме). Усиленное выведение белых клеток крови может наблюдаться при гнойных процессах – холангите, эндометрите.
В зависимости от типа клеток лейкоцитарного ряда выделяют следующие разновидности лейкопении:
- Нейтропении. Снижение содержания нейтрофилов меньше 47% от общего числа лейкоцитов. Наиболее частый вариант лейкопении. Встречается при вирусных, бактериальных инфекциях, токсическом действии медикаментов. Также возможны наследственные формы нейтропении.
- Лимфопении. Уменьшение уровня лимфоцитов ниже 19%. Характерно для вирусных инфекций, коллагенозов, гранулематозных процессов.
- Эозинопении. Содержание эозинофилов меньше 1%. Наблюдается при избыточной продукции гормонов коры надпочечников (болезнь/синдром Иценко-Кушинга). Эозинопения является индикатором неблагоприятного прогноза при септических процессах.
- Моноцитопения. Показатели моноцитов в лейкоцитарной формуле опускаются ниже 2%. Встречается при острых инфекциях, длительном приеме глюкокортикоидов.
- Агранулоцитоз. Редкое тяжелое жизнеугрожающее состояние, характеризующееся полным или почти полным исчезновением нейтрофилов в крови (ниже 0,75х10^9/л). Наблюдается при приеме миелотоксичных лекарств (цитостатиков, тиреостатиков, некоторых НПВС), действии радиации.
Причины лейкопении
Инфекции
Одна из наиболее распространенных причин лейкопении – вирусные и генерализованные бактериальные инфекции. Патогенез снижения уровня лейкоцитов может быть различным – непосредственное повреждение клеток лимфотропными вирусами (ВИЧ, Варицелла-Зостер, корь), подавление образования в костном мозге, усиленная их потеря с экссудацией.
- Вирусные инфекции. Лейкопения развивается преимущественно за счет снижения содержания лимфоцитов (лимфопения). При инфекционном мононуклеозе, гриппе, вирусных гепатитах лейкоциты снижаются незначительно и быстро возвращаются к норме после выздоровления. При ВИЧ-инфекции уровень лимфоцитов нередко достигает нуля на стадии СПИДа. Даже после лечения значения лейкоцитов могут сохраняться низкими, так как препараты для терапии ВИЧ сами по себе способны вызвать лейкопению.
- Бактериальные инфекции. Лейкопения встречается только при тяжелых генерализованных инфекциях (менингококцемия, риккетсиозы, перитонит). Падение числа лейкоцитов является одним из критериев для диагностирования септического состояния и синдрома системного воспалительного ответа. Наблюдается в основном нейтропения, ее степень коррелирует с тяжестью заболевания. Регресс наступает практически сразу после проведения антибактериальной терапии.
Прием лекарственных препаратов
К развитию лейкопении способен привести широкий спектр лекарственных средств. Известно два основных механизма лекарственно-индуцированной лейкопении: токсическое повреждение костного мозга, ведущее за собой нарушение кроветворения, и образование иммунных комплексов, в результате чего вырабатываются антитела, атакующие собственные лейкоциты макроорганизма.
Лейкопения возникает в среднем на 15 сутки от начала приема лекарства. Степень тяжести может быть самой различной – от незначительного снижения количества белых кровяных клеток до агранулоцитоза. В связи с поражением всех 3-х ростков гемопоэза часто встречается сочетание с анемией и тромбоцитопенией (панцитопения). В большинстве случаев достаточно отмены лекарственного препарата. При развитии агранулоцитоза может потребоваться применение колониестимулирующих факторов. Медикаменты, наиболее часто вызывающие лейкопению:
- Цитостатики: циклофосфамид, хлопамбуцил, метотрексат.
- Тиреостатики: пропилтиоурацил, мерказолил.
- Нестероидные противовоспалительные средства: анальгин, амидопирин.
- Антибактериальные средства: левомицетин, сульфаниламиды.
- Противовоспалительные ЛС: D-Пеницилламин, сульфасалазин.
- Антипсихотические ЛС (нейролептики): аминазин, хлорпромазин.
- Противосудорожные ЛС: карбамазепин, диазепам.
Аутоиммунные воспалительные заболевания
Причиной лейкопении могут быть аутоиммунные заболевания. В этих случаях преимущественно снижаются лимфоциты и нейтрофилы. Существует два основных патогенетических механизма аутоиммунной лейкопении – образование антилейкоцитарных антител и снижение экспрессии на мембранах иммунных клеток специальных белков (CD55, CD59), которые защищают клетки от цитолиза. Лейкопения обычно умеренная, регрессирует во время ремиссии или под влиянием патогенетического лечения. Лейкопенический синдром характерен для следующих патологий:
- Заболевания суставов: ревматоидный артрит, синдром Фелти.
- Диффузные болезни соединительной ткани (коллагенозы): системная красная волчанка, синдром Шегрена.
- Демиелинизирующие заболевания: рассеянный склероз.
- Системные васкулиты: гранулематоз с полиангиитом, неспецифический аортоартериит Такаясу.
- Воспалительные заболевания кишечника (ВЗК): неспецифический язвенный колит, болезнь Крона.
Болезни крови
Механизмов лейкопении при гематологических патологиях несколько – замещение кроветворной ткани злокачественными клетками, фиброзной или жировой тканью, синтез антилейкоцитарных антител, дефицит некоторых химических элементов для гранулоцитопоэза (железа, цианкобаламина, фолиевой кислоты):
- Онкогематологические заболевания. Лейкопенией, вплоть до агранулоцитоза, могут дебютировать острые лейкозы (алейкемическая форма) – такое начало заболевания встречается примерно в 20% случаев. Почти всегда в анализе крови дополнительно выявляются тромбоцитопения и анемия. Лейкопения характерна для лимфогранулематоза (лимфомы Ходжкина). Уровень лейкоцитов нередко остается на низком уровне и после лечения.
- Гемолитические анемии. При аутоиммунных гемолитических анемиях, гемоглобинопатиях, наследственном микросфероцитозе возможна умеренная нейтропения. Примечательно, что падение уровня лейкоцитов происходит вне криза. Период гемолитического криза, напротив, сопровождается небольшим лейкоцитозом.
- Дизэритропоэтические анемии. При апластической анемии, а также длительно протекающей недостаточности витамина В12 и фолиевой кислоты из-за угнетения функционирования всех ростков кроветворения наблюдается панцитопения. Лейкопения при железодефицитной анемии развивается только при крайне выраженном дефиците железа и носит умеренный характер.
Лучевая болезнь
Действие ионизирующей радиации неблагоприятно сказывается на всем организме человека. В первую очередь и сильнее всего страдают органы с высокой скоростью клеточного обновления, к которым относится костный мозг. Под влиянием гамма-лучей, имеющих высокую проникающую способность, гемопоэтические стволовые клетки утрачивают митотическую активность.
Наследственные формы лейкопений
К первичным лейкопениям относятся генетические заболевания, обусловленные мутациями генов, регулирующих созревание или дифференцировку лейкоцитов. Некоторые мутации приводят к изменению структуры лейкоцитарных антигенов, из-за чего они подвергаются аутоиммунному разрушению. В подавляющем большинстве случаев встречаются первичные нейтропении.
Дебют наступает с первых лет жизни. Часть из этих болезней имеет доброкачественную природу (циклическая нейтропения, первичная иммунная нейтропения, синдром «ленивых лейкоцитов», синдром Генслена), снижение количества нейтрофилов при них незначительное, присоединяющиеся инфекции протекают в легкой форме, лейкопения регрессирует самостоятельно.
Другие наследственные лейкопении часто сопровождаются инфекционными осложнениями, которые зачастую становятся фатальными уже в детском возрасте: болезнь Костмана (генетически детерминированный агранулоцитоз), первичные иммунодефициты (синдром Ди Джорджи, Вискотта-Олдрича), синдром Чедиака-Хегаси. При этих болезнях для восстановления нормальных значений лейкоцитов требуется специфическое лечение.
Другие причины
- Белковое голодание.
- Переливание крови или лейкоцитарной массы.
- Эндокринные расстройства: гипотиреоз, акромегалия, гиперкортицизм.
- Заболевания, протекающие с гиперспленизмом: цирроз печени, малярия, висцеральный лейшманиоз.
- Болезни накопления: болезнь Гоше, болезнь Ниманна-Пика.
Диагностика
Лейкопения выявляется при клиническом исследовании крови. Ввиду многообразия этиологических факторов данного отклонения при его обнаружении следует обратиться к врачу-терапевту для тщательного сбора анамнеза, физикального осмотра, назначения дополнительного обследования:
- Анализы крови. Выполняется подсчет лейкоцитарной формулы, определяется концентрация маркеров воспаления – СОЭ, СРБ, прокальцитонина. Изучается наличие аутоантител (антител к ДНК, цитоплазме нейтрофилов, аЦЦП).
- Выявление инфекционного возбудителя. Методом иммуноферментного анализа идентифицируются антитела к возбудителям (вирусам, бактериям). Для подтверждения ВИЧ-инфекции назначается иммуноблоттинг. Проводится бактериальный посев крови, мокроты, мочи.
- Биопсия. При подозрении на лейкоз выполняется морфологическое исследование костного мозга, при котором обнаруживается гиперплазия гранулоцитарного ростка, большое количество бластных клеток. Для диагностики лимфом проводится аспирационная биопсия увеличенного лимфатического узла, в биоптате выявляется лимфоцитарная гиперклеточность, разрастание коллагена.
- Генетические исследования. Для подтверждения наследственных форм лейкопений необходимо обнаружение мутаций методом полимеразной цепной реакции и цитогенетическими исследованиями.

Коррекция
Конституциональная лейкопения не требует никакого вмешательства. Если причиной развития данного отклонения стал лекарственный препарат, необходима срочная его отмена. При выраженном снижении лейкоцитов или агранулоцитозе прибегают к введению гранулоцитарного колониестимулирующего фактора (Г-КСФ) или инфузии донорских гранулоцитов. Главное условие успешности терапии – лечение основной патологии:
- Элиминация возбудителя. Для лечения гриппа применяется осельтамивир, для борьбы с ВИЧ-инфекцией – антиретровирусные препараты (зидовудин, саквинавир). При бактериальной инфекции назначаются антибиотики.
- Противовоспалительная терапия. Чтобы достигнуть ремиссии аутоиммунных заболеваний, используются глюкокортикостероиды, иммуносупрессанты, производные 5-аминосалициловой кислоты.
- Химиотерапия. При подтверждении онкогематологической патологии назначаются комбинации химиотерапевтических средств – хлорамбуцил, винкристин, этопозид.
- Пересадка костного мозга. В случае неэффективности химиотерапии гемобластозов, а также при тяжелых первичных нейтропениях выполняется трансплантация гемопоэтических стволовых клеток.
Прогноз
Некоторые формы первичных лейкопений характеризуются высоким уровнем смертности (50-90%) среди детей от инфекционных осложнений. При вторичных лейкопениях прогноз в большей степени зависит от основного заболевания. Поэтому при любом уровне снижения лейкоцитов в крови показано тщательное обследование, направленное на выяснение причины и своевременное начало лечения.
1. Патофизиология системы крови. Часть II. Нарушения в системе лейкоцитов/ Николаева О.В., Кучерявченко М.А., Шутова Н.А. и др. – 2016.
4. Синдромная диагностика и базисная фармакология заболеваний внутренних органов. Том 2/ под ред. Г.Б. Федосеева, Ю.Д. Игнатова. – 2004.
Стволовые клетки при острой лучевой болезни. Лейкопоэз и эритропения при поражении радиацией
В последнее время большое значение в восстановлении кроветворения при лучевых поражениях придается стволовым клеткам, которые могут дифференцироваться в основные типы клеток костного мозга и лимфатических органов [Груздев Г. П., Моничев А. Я., Щербова Е. Н., 1977]. Восстановление происходит за счет выселения стволовых клеток из наиболее сохранившихся участков кроветворной ткани, подвергшихся во время облучения наименьшему воздействию ионизирующего излучения [Стрелин Г. С, 1969]. Особенно большое значение это имеет при неравномерном или парциальном облучении организма [Петров Р. В., Хаитов Р. М., 1972; Невская Г. Ф. и др., 1977; Баранов А. Е., 1978].
У крупных животных я человека кроветворная ткань восстанавливается за счет стволовых клеток в течение нескольких недель после облучения в среднелетальных дозах, у мелких животных — значительно быстрее. Существенно, что в участках кроветворной ткани, подвергшихся массивному воздействию, вызвавшему глубокие изменения стромы и кровеносных сосудов, кроветворная ткань не восстанавливается.
По этой причине, например, у людей, облученных во время несчастных случаев, грудина которых подверглась воздействию ионизирующего излучения в массивной дозе, пунктаты костного мозга даже спустя 3—5 мес после воздействия содержали очень небольшое количество кроветворных клеток, тогда как у больных, передняя поверхность грудной клетки которых не была обращена к источнику излучения, уже на 14-е сутки увеличивалась клеточность костного мозга— до 30000 клеток в 1 мм3 [Куршаков Н. А., Байсоголов Г. Д. и др., 1966].
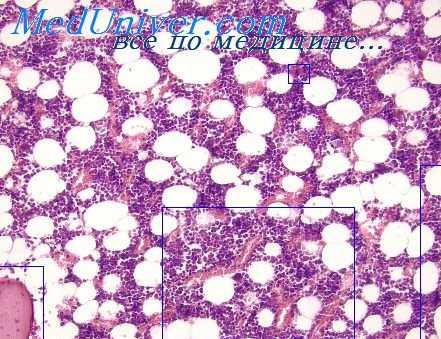
Глубина первоначальных изменений белого ростка крови, наличие абортивного подъема числа лейкоцитов и начало агранулоцитоза зависят только от величины дозы облучения костного мозга, а высота абортивного подъема, начало и темп восстановления кроветворения во многом определяются дополнительными, неспецифическими факторами: инфекционными осложнениями, некрозом мягких тканей в зоне лучевых «ожогов» и т. д. [Воробьев А. И. и др., 1973].
У переживших лучевую болезнь сохраняются неполноценность лейкопоэза и тенденция к эритропении. Проявление последней во многом зависит от вида животных. Анемия бывает отчетливо выражена у крыс и почти не наблюдается у собак и обезьян, хотя при этом и отмечаются признаки гиперпластического состояния кроветворной ткани.
Судя по экспериментальным данным [Шмелев Н. И., 1972], анемия развивается следующим образом: в организме, перенесшем острую лучевую болезнь, повышается митотическая активность, наступает гиперплазия клеток эритроидного ростка костного мозга и уменьшается количество нормобластов. Причиной этого, по-видимому, является усиление эритрофагической функции ретикулоцитов селезенки и ускоренная гибель эритроцитов.
Однако состояние компенсаторного напряжения костного мозга приводит к срыву эритропоэза, особенно при действии дополнительных патогенных факторов, в результате чего наступает анемия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гибель лимфоцитов при острой лучевой болезни. Гистология селезенки при поражении радиацией
Гибель лимфоцитов во всех кроветворных органах происходит однотипно. Одновременно выявляются признаки интенсивного фагоцитоза распавшихся клеток. Однако к концу первых суток большинство макрофагов тоже распадается. Тем не менее очищение селезенки от продуктов клеточного распада происходит быстро. Спустя 7 сут после облучения пульпа селезенки выглядит однородной. Вследствие гибели лимфоцитов фолликулы становятся плохо различимыми.
На месте светлых центров различаются только грубая сеть аргирофильных волокон и единичные ретнкулоциты, а на периферии фолликулов — немногочисленные малые лимфоциты. В красной пульпе находятся макрофаги с признаками кровяного пигмента и эритрофагии.
Гибели лимфоцитов предшествует уменьшение в них нуклеиновых кислот н активности окислительно-восстановительных ферментов, повышение активности щелочной фосфатазы, ультраструктурные изменения клеточных мембран и органоидов клетки. Сроки возникновения и тяжесть указанных изменений находятся в прямой зависимости от дозы облучения [Lucas D. et al., 1969].
Однако количество лимфоцитов снижается пропорционально дозе воздействия только в пределах нарастания дозы облучения до 675Р [Белоусова О. И., Федотова М. П., 19G8], а при воздействии радиации в больших дозах все же сохраняется 13% клеток от исходного содержания их в костном мозге до облучения. После очищения селезенки от продуктов клеточного распада появляются бластные формы ретикулярных клеток с увеличенным количеством эндоплазматического ретикулума и рибосом, набухшими и округленными ядрами и гиперплазированным пластинчатым комплексом (аппарат Гольджи). Властная трансформация ретикулоцитов может быть источником восстановления лимфоцитов и плазматических клеток [Miller J. P. et al., 1971; Токии И. Б„ 1974; Пискарев Е. В. и др., 1977]. Однако этим ни в коей мере не отвергается возможность репарации лнмфоидной ткани за счет заселения в лимфоидные органы клеток из костного мозга [Харлова Г. В., 1975].
На высоте лучевой болезни пульпа селезенки почти не содержит лимфоцитов. Вокруг центральных артерий отмечаются обширные зоны мукоидного пропитывания периваскулярной ткани. Стенки кровеносных сосудов тоже выглядят гомогенизированными за счет накопления в них большого количества кислых мукополисахарядов, стирания межклеточных границ и гибели ядер в гладкомышечных клетках.
В синусах содержится много эритроцитов, немногочисленные клетки с фагоцитированным кровяным пигментом, не дающим положительной реакции образования берлинской лазури. Наблюдается значительное набухание трабекул и расплавление аргирофильного каркаса. Селезенка становится дряблой с морщинистой капсулой, еще больше уменьшается.
В начале 2-й недели после облучения отмечаются признаки восстановления фолликулов в виде пролиферации ретикулярных и эндотелиальных клеток. Эти клетки располагаются группами вокруг артерий и вдоль трабекул. В дальнейшем образуются целые поля регенерирующих клеток, формируются фолликулы, состоящие преимущественно из ретикулярных клеток, больших и средних лимфоцитов, богатых РНК. Среди лимфоцитов встречается много делящихся клеток.
В значительном количестве различаются плазматические клетки, особенно по ходу пульпарных артерий. Появляются атипичные клетки неправильной формы с признаками деления и образованием многополюсных фигур деления. Клеточный состав регенерирующей селезенки облученного организма отличается главным образом большим количеством предшественников лимфоцитов, мигрирующих из костного мозга, а также небольшим количеством Т-лимфоцитов, мигрирующих из тимуса. Поэтому в данный период в селезенке оказывается мало антигенчувствительных клеток для осуществления развития стволовых клеток в сторону предшественников антителообразующих клеток [Петров Р. В., 1971].
В более поздние сроки, соответствующие восстановительному периоду лучевой болезни, признаки регенерации фолликулов становятся отчетливыми. В них различаются большое число делящихся ретикулярных и плазматических клеток, периваскулярные скопления молодых форм лимфоцитов, богатых РНК, но при этом отсутствуют центры размножения [Яковлева Л. А., 1966].
Активация миелопоэза после опустошения костного мозга. Типы регенерации костного мозга после лучевой болезни
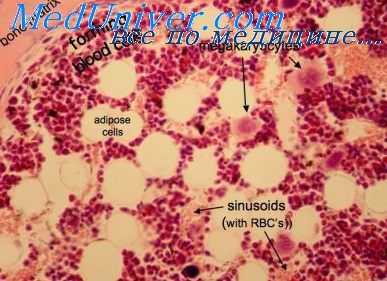
После максимального опустошения костного мозга, когда фактически остаются одни ретикулярные клетки, наступает постепенное заполнение его новообразованными клетками крови. Последние вначале располагаются в виде очагов, степень выраженности которых широко варьирует [Краевский Н. А., 1957; Новикова М. И., 1975]. Чем позже после облучения производится микроскопическое исследование, тем больше бывает выражено заполнение ретикулярной стромы новообразованными клетками и больше среди них выявляются дифференцированные формы белой и красной крови.
Существенно, что активации миелопоэза всегда предшествует увеличение количества лимфоидных клеток [Щербова Е. Н., Груздев Г. П., Белоусова О. И., 1968]. Возможно, что лимфоидные клетки способствуют пролиферации и дифференцировке заселившихся в опустошенный костный мозг стволовых клеток или сами подвергаются трансформации и дифференцировке [Горизонтов П. Д., 1973]. Вместе с тем наблюдения показывают, что у животных, перенесших острую форму лучевой болезни, в течение долгого времени отмечается повышенное разрастание ретикулярных клеток, особенно по ходу костных балок [Шмелева Н. И., 1972]. По мнению авторов более поздних работ, лимфоциты не играют существенной роли в восстановлении грануло- и эритропоэза [Чертков К. С, 1972; Варакина Н. Ф., 1975].
У облученных крыс, например, первым восстанавливается эритроидный росток костного мозга, затем число лимфоцитов и потом уже содержание незрелых форм гранулоцитарного ростка [Гольдберг Е. Д., Карпова Г. В., 1979].
Гистологическая картина костного мозга у людей, перенесших острую лучевую болезнь 6—16 лет назад, свидетельствует о неполной регенерации кроветворной ткани. Она отличается высоким содержанием ретикулярных клеток, плазмоцитов и эозинофилов, меньшим числом мегакариоцитов, признаками прогрессирующего склероза ретикулярной стромы и кровеносных сосудов [Суворова Л. А., 1970; Вялова Н. А. и др., 1970; Грибова И. А., Солдатова В. П„ 1975]. Однако при поражении разными видами излучений наблюдаются некоторые отклонения.
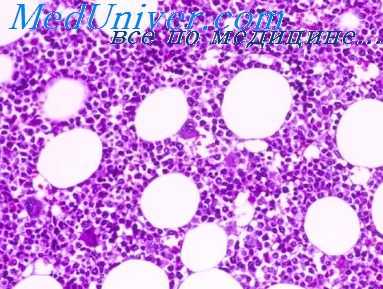
При поражении быстрыми нейтронами, например, больше нарушается регенерация красной крови [Соколов В. В., 1957]. Вместе с тем последние электронно-микроскопические исследования показывают, что у крыс при острой лучевой болезни, вызванной облучением рентгеновскими лучами в дозе 750 Р, максимальные нарушения в клетках красной крови наблюдаются в период наиболее выраженного восстановления миелоидного ростка [Марков В. И., Пискарев Е. В. и др., 1978].
У людей, погибших через 3—6 нед после облучения в результате взрыва атомной бомбы, было выделено несколько типов регенерации костного мозга. В 1-й группе пострадавших костный мозг оставался апластичным. Пролиферация ретикулярных клеток, образование плазматических и так называемых лимфоидных клеток почти не наблюдались. Только в некоторых случаях обнаруживали деление ретикулярных клеток и переход их в плазматические формы. Дифференцировка миелоидных элементов почти отсутствовала. В единичных наблюдениях отмечалось сохранение островков эритропоэза. Во 2-й группе пострадавших очаговая гиперплазия была более выраженной.
В клеточных популяциях, помимо плазматических клеток, можно было видеть лимфоидные и миелоидные клетки. Пролиферация ретикулярных клеток наблюдалась вдоль трабекул кости. В отдельных участках костного мозга встречались лаброциты, островки эритропоэтической ткани, большие и малые клетки, напоминающие мегакарноциты. В 3-й группе пострадавших ииелась очаговая регенерация миелоидной ткани. Кроме того, отмечалась пролиферация ретикулярных клеток и появление большого количества плазматических клеток, лимфоцитов и мегакариоцитов. Наконец, в 4-й группе у всех пострадавших отмечалось разрастание миелоидного костного мозга; среди клеток последнего преобладали миелоциты и в некоторых случаях метамиелоциты.
После 6-й недели указанные изменения в костном мозге были наиболее выраженными. Однако у проживших более 6 нед в периферической крови отмечалась стойкая лейкопения, а в костном мозге дефицит созревания нейтрофилов, хотя он был богат другими клетками [Licbow A. A. et al., 1949]. По литературным данным [Стрельцова В. П., Москалев Ю. И., 1964], после внешнего облучения лейкозы могут развиться у 30—40% облученных особей. Установлена прямая связь между возникновением радиационных лейкозов и изменениями хромосомного аппарата кроветворных клеток облученного организма [Стрельцова В. Н., Страшненко С. И., 1972]. По данным ООН (1978), у лиц, облученных при взрыве атомных бомб в дозах от 10 до 200 рад и более, преобладали гранулоцитарная и лимфобластная формы лейкозов.
Трансплантация костного мозга при острой лучевой болезни. Селезенка при поражении радиацией
Как известно, в мировой практике имелось несколько попыток применить трансплантацию костного мозга для лечения острой лучевой болезни у человека [Куршаков Н. А. и др., 1962; Воробьев А. И. и др., 1973; Mathe G. et al., 1959]. Четырем, больным, подвергшимся действию радиации в больших дозах, пересадка костного мозга принесла значительное улучшение. Через месяц после пересадки была отмечена активная пролиферация кроветворных клеток костного мозга, источником которой, по-видимому, были кроветворные клетки донора.
Еще одни случай пересадки клеток костного мозга при тяжелом лучевом поражении не предотвратил смертельного исхода [Куршаков Н. А. и др., 1962]. При микроскопическом исследовании костного мозга погибшего обнаружено небольшое число клеток крови без наличия зрелых форм, значительное число ретикулярных и плазматических клеток, полнокровие и плазматическое пропитывание стромы [Краевский Н. А., Иванов А. Е., 1962].
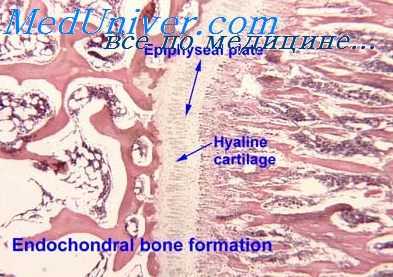
Селезенка при поражении радиацией
Изменения селезенки при острой лучевой болезни изучены так же подробно, как и изменения костного мозга. В наиболее типичной и отчетливой форме они наблюдаются после облучения в минимальной смертельной дозе. В начале заболевания отмечается уменьшение селезенки Она становится бледной и более плотной. Микроскопически к концу 2-х суток после облучения на месте фолликулов обычно бывает видно большое количество распавшихся лимфоцитов и клеточный детрит.
В красной пульпе обнаруживается полнокровие синусоидов, кровоизлияния, кровяной пигмент, не дающий положительной реакции образования берлинской лазури, но содержащий железо и большое количество нейтрофильных лейкоцитов. Распад лимфоцитов начинается с центральных частей лимфатических фолликулов и постепенно распространяется на всю белую пульпу. По мнению большинства исследователей, убыль лимфоцитов происходит главным образом за счет малых лимфоцитов и бластных форм в зародышевых центрах, которые, как известно, содержат В-лимфоциты.
В последних первые признаки дегенерации появляются уже через 30 мин после облучения. Тем: не менее 12% средних лимфоцитов сохраняются даже при облучении в сверхсмертельных дозах, превышающих 600 Р. Существенно, что Т-лимфоциты в селезенке более устойчивы к действию ионизирующего излучения, чем В-лимфоциты, тогда как в лимфатических узлах, тимусе и периферической крови оба вида клеток обладают одинаковой радиочувствительностью. Уже в скрытом периоде острой -лучевой болезни В-лимфоциты селезенки теряют способность к розеткообразованшо, которая сохраняется в это время у Т-лимфоцитов [Durun S. К., Zengozian N., 1978].
Тем не менее Т-лимфоциты облученного организма тоже теряют келерную функцию [Makidono R. et al., 1978]. Облучение уменьшает число иммуноглобулиновых рецепторов на поверхности мембран лимфоцитов [Facchini A. et al., 1977J. По радиочувствительности лимфоциты располагаются в следующем порядке: тимоциты > В-клетки > Т-клеткн, задерживающиеся в селезенке, > Т-клетки лимфатических узлов [Ярилнп А. А., 1978].
Читайте также:
