Синтез глюкокортикоидов и изменения слизистой желудка
Добавил пользователь Владимир З. Обновлено: 28.01.2026
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500–4000 мг внутривенно) или средними/высокими (25–150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80–200 мг) и неделями или месяцами в случае применения средних доз (25–60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Синтез глюкокортикоидов и изменения слизистой желудка
Клиника и симптомы стероидных язв желудка. Синтез глюкокортикоидов при язвенной болезни желудка
Стероидные язвы нередко протекают латентно и в таких случаях являются находкой при рентгенологическом обследовании больных, получающих стероидную терапию. Симптоматология стероидной язвы отличается нестойкостью и нередко исчезает после отмены гормонов и назначения соответствующей диеты.
Иными словами, стероидные язвы, так же как и резерпиновые, бутадионовые, атофановые представляются чисто лекарственными и далеко не равнозначны деструктивным изменениям слизистой оболочки желудка и кишечника при язвенной болезни.
В то же время некоторыми авторами стероидам отводится определенное место в формировании язвенной болезни, с той оговоркой, что эндогенные гормоны по своему действию на структуру и функцию желудочно-кишечного тракта существенно отличаются от экзогенных (С. М. Рысс и Е. С. Рысс). Более того, существует тенденция придать гормонам гипофизарно-надпочечниковой системы если не ведущее, то, по меньшей мере, весьма важное значение в патогенезе язвенной болезни.
В последнее время появился ряд работ (Л. М. Каскевич, О. С. Радбиль и С. Г. Вайнштейн, Grosa и др.), в которых развивается гипотеза Bojanowicz, согласно которой одним из основных механизмов патогенеза язвенной болезни является дискортицизм (повышение глюкокортикоидной и снижение минералокортикоидной функций коры надпочечников).
В этой связи уместно рассмотреть имеющиеся данные относительно характера изменений функции гипофизарно-надпочечниковой системы у больных язвенной болезнью.
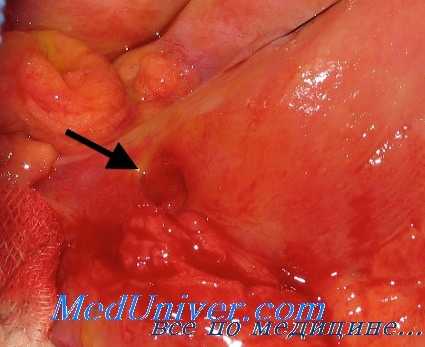
У больных, страдающих язвенной болезнью длительное время, и особенно при локализации язвы в желудке, функция коры надпочечников как по показателям андрогенной, так и глюкокортикоидной ее деятельности снижена (С. М. Рысс, А. А. Фишер, Л. М. Козлов, Biro с соавт., Turner, Sandweiss с соавт., Heteny, Faredin с соавт., Green и др.).
Некоторое расхождение данных встречается лишь у больных язвенной болезнью в начальной фазе заболевания, преимущественно у больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке. В этих случаях (приблизительно у 50% обследованных) одни авторы (Н. А. Дубровина, Н. П. Цизина, Ю. М. Полоус, Л. М. Каскевич) находят функцию надпочечников (андрогенную или глюкокортикоидную) повышенной, другие — нормальной (Г. П. Шульцев, Marinaccio с соавт., Sleisinger с соавт.).
Имеются работы (Sandweiss с соавт. и др.), в которых приводятся данные о снижении глюкокортикоидной и некотором повышении андрогенной функции.
Надо отметить, что большинство авторов, установивших повышенные показатели указанных функций коры надпочечников, связывают это явление с болевым синдромом. М. А. Алекперов специально изучал динамику выделения кортикостероидов с мочой у больных язвенной болезнью (язва 12-перстной кишки) в течение суток и показал определенную связь между болевым синдромом и экскрецией 17-кетостероидов и 17-оксикортикостероидов: при обострении заболевания наблюдалось повышение уровня выделения кортикостероидов.
Как уже указывалось выше, функционально-морфологические изменения слизистой оболочки желудка у больных язвенной болезнью находятся в существенной зависимости от клинических особенностей заболевания. На ранних фазах развития язвенной болезни возникают главным образом функциональные сдвиги, выражающиеся в нарушении цикла и ритма секреторного процесса с явлениями гиперфункции секреторного аппарата.
В более отдаленные сроки болезни появляются признаки секреторной недостаточности, обусловленные морфологическими его изменениями (дистрофия, метаплазия, вплоть до атрофии секреторных элементов желудочных желез). Указанные изменения слизистой желудка и функциональные расстройства гипофизарно-надпочечниковой системы при язвенной болезни имеют одинаковую направленность. Это подтверждает высказанную нами ранее (В. Н. Туголуков) мысль о том, что между этими нарушениями возможна генетическая связь.
При ближайшем рассмотрении полученных данных о морфологических сдвигах в слизистой оболочке желудка у больных язвенной болезнью в свете функционального состояния у них гипофизарно-надпочечниковой системы можно отметить следующее.
У больных язвенной болезнью (независимо от локализации язвы) с явлениями дистрофии слизистой нормальные показатели функции гипофиза и коры надпочечников отмечены только у 2 больных. В подавляющем большинстве случаев отмечались те или иные функциональные нарушения указанной системы. Там, где не было заметных структурных сдвигов (заметим, что эти данные получены при помощи неприцельной аспирационной биопсии), показатели глюкокортикогенеза весьма часто оставались нормальными или были несколько пониженными при сохранении резервных возможностей надпочечников.
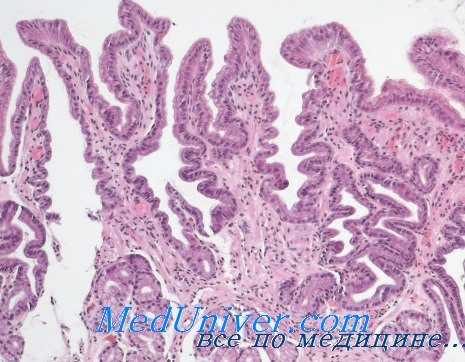
В качестве примера тесной взаимосвязи между функциональными нарушениями гипофизарно-надпочечниковой системы и морфологическими изменениями слизистой оболочки желудка можно привести данные, полученные нами при обследовании больных с локализацией язвы в области тела, субкардиального или кардиального отдела и большой кривизны желудка. Дело в том, что эта разновидность язв желудка, как правило, сопровождается гастритом, вплоть до атрофии желудочных желез с гистаминоустойчивой ахлоргидрией и выраженной недостаточностью пепсиногенообразующей функции (резко сниженное содержание пепсина в желудочном соке и пепсиногена в моче).
У подобного рода больных определяется довольно стойкая недостаточность глюкокортикоидной функции, нередко с отсутствием реакции на АКТГ (надпочечниковая форма).
В проведенных ранее исследованиях (В. Н. Туголуков) подчеркивалось, что гормоны стероидного ряда, в частности глюкокортикоиды, имеют непосредственное отношение к метаболизму и синтезу продуктов секреторного эпителия желудка. Иначе говоря, они оказывают трофическое воздействие на секреторную клетку.
Поскольку между изменениями структуры слизистой оболочки желудка и функциональными расстройствами гипофизарно-надпочечниковой системы наблюдается корреляция, по-видимому, морфологические нарушения, встречающиеся у больных язвенной болезнью, в большей степени связаны с недостаточностью глюкокортикоидной функции коры надпочечников. Эти обстоятельства дают основание считать, что развитие гастритов при язвенной болезни во многом обязано расстройствам гормональной регуляции, в частности гипофизарно-надпочечниковой системы.
При сопоставлении показателей глюкокортикоидной функции с данными секреторной деятельности желудка четкой взаимосвязи установить не удалось. Вместе с тем можно отметить, что у больных язвенной болезнью, у которых наблюдалась секреторная недостаточность, показатели экскреции 17-оксикортикостероидов весьма часто были пониженными. Однако при высокой желудочной секреции, как, например, у больных с язвой в двенадцатиперстной кишке, какой-либо корреляции с уровнем выделения 17-оксикортикостероидов не выявлялось.
Видимо, гиперфункция секреторного аппарата желудка определяется основными патогенетическими механизмами — расстройствами нервной регуляции, нарушающими обмен высокоактивных биологических веществ и, в частности, гистамина (В. Н. Туголуков).
Функция надпочечников, обмен уропепсиногена после операции на язве желудка и ее осложнениях
Анализируя литературные материалы о состоянии ГГНС при язвенной болезни в хирургическом аспекте, можно констатировать следующее: А. Т. Пулатов, В. Е. Волков, В. С. Гафаров склоняются к выводу, что непосредственно после резекции желудка имеет место повышение адренокортикальной функции. По наблюдениям Н. П. Цизиной, у больных после этой операции функциональная активность ГГНС оказалась сниженной.
Gerchards, Cesnik, Memco и Sorge утверждают, что количество выделяемых глюкокортикоидов и уропепсиногена у оперированных больных прямо пропорционально тяжести оперативного вмешательства.
Ю. M. Полоус у большинства обследованных больных наблюдал неадекватную реакцию на стимулирующее действие АКТГ и расценивал этот факт как функциональное истощение коркового вещества надпочечников или парадоксальную реакцию возбужденного органа в ответ на раздражитель. Автор отметил, что у больных, имевших до операции признаки адренокортикальной недостаточности, послеоперационный период протекал с различными осложнениями.
После ушивания прободной язвы желудка и двенадцатиперстной, кишки В. Г. Мыкуляк констатировал снижение адренокортикальной функции, а Ю. Н. Кленус — повышение ее, с удовлетворительной резервной способностью коркового вещества.
По наблюдениям О. Г. Сизова и С. З. Клецкина, при анастомозитах имеет место подъем уровня уропепсиногена; увеличение экскреции этого протеолитического фермента было обнаружено у больных при пенетрации язвы в соседние органы (О. Г. Сизов), в то время как В. Г. Мыкуляк отмечал у такого рода больных понижение показателей экскреции 17-кетостероидов и отрицательную пробу Торна.
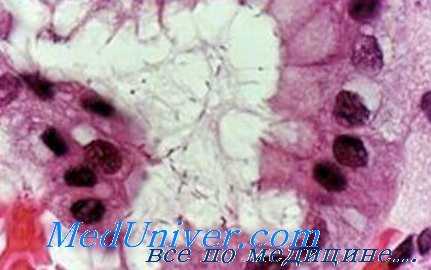
По данным же О. Ф. Гоцуляк, у больных с пенетрирующими и перфоративными язвами показатели уропепсиногена в большинстве случаев оказались повышенными, при перидуодените и перигастрите содержание протеолитического фермента понижалось и наиболее низким оно было при стенозе привратника.
По мнению Ю. М. Полоус, при язвенной болезни, осложненной рубцовой деформацией (особенно при локализации язвы в желудке), функциональная активность коры надпочечников повышалась, в то время как В. Г. Мыкуляк выявил понижение экскреции 17-кетостероидов при данном осложнении.
М. Д. Смехова и А. Ф. Бунатян наблюдали у больных с пептическими язвами анастомоза адренокортикальную недостаточность (даже в период клинического благополучия). Авторы отмечают, что у больных, перенесших реконструктивную резекцию желудка, ранний послеоперационный период, а иногда и сама операция протекали с различными осложнениями и объясняют их возникновение неполноценной функциональной резервной способностью коры надпочечников.
Сравнивая показатели содержания уропепсиногена после резекции желудка по поводу язвенной болезни и рака желудка, Н. П. Смирнов считает, что после резекции желудка по поводу рака угнетение пепсинообразующей функции культи желудка более выражено, чем после операции по поводу осложненной язвенной болезни. Balabnnski и соавт., Vassilev и соавт., Ginev и Zanzov выявили гипокортицизм у длительно болеющих язвенной болезнью, особенно при тяжелых массивных кровопотерях и после резекции желудка.
В то же время Savulescu и др. как при осложненных хронических язвах, так и при гастродуоденальных кровотечениях установили гиперкортицизм, который в 70—80% случаев сопровождался положительной реакцией на стимуляцию АКТГ и в 100% случаев — эозинопенией в ответ на введение инсулина (проба Милку). В течение первых дней кровотечения имела место абсолютная эозинопения, зависящая от гиперсекреции глюкокортикоидов, а в ближайшие дни после геморрагии — эозинофилия, вызванная снижением секреции стероидных гормонов.
Таким образом, по вопросу о состоянии адренокортикальной функции при осложненной язвенной болезни как до, так и после резекции желудка или ушивания прободной язвы имеется еще много разногласий, что указывает на необходимость дальнейшего изучения этой проблемы.
Особенности побочных эффектов глюкокортикоидов в сравнении с проявлениями эндогенного гиперкортицизма
Ключевые слова: глюкокортикоиды, эндогенный гиперкортицизм, матронизм, стрии, прибавка в весе, гипокалиемия, синдром Иценко – Кушинга.
Для цитирования: Древаль А.В., Будул Н.А., Комердус И.В. и др. Особенности побочных эффектов глюкокортикоидов в сравнении с проявлениями эндогенного гиперкортицизма. РМЖ. 2018;1(I):12-16.
Features of the side effects of glucocorticoids in comparison with manifestations of endogenous hypercorticism
A.V. Dreval, N.A. Budul, I.V. Komerdus, T.A. Britvin, A.A. Glazkov
Moscow Regional Research and Clinical Institute named after M.F. Vladimirskiy
Key words: glucocorticoids, endogenous hypercorticism, matronism, striae, weight gain, hypokalemia, Itsenko-Cushing’s syndrome.
For citation: Dreval A.V., Budul N.A., Komerdus I.V. et al. Features of the side effects of glucocorticoids in comparison with manifestations of endogenous hypercorticism // RMJ. 2018. № 1 (I). P. 12–16.
В статье представлены результаты исследования особенностей побочных эффектов глюкокортикоидов в сравнении с проявлениями эндогенного гиперкортицизма. Показано, чтопроявления гиперкортицизма чаще наблюдались при эндогенной форме, чем при терапии различными формами глюкокортикоидов.
Введение
Глюкокортикоид-содержащие препараты (ГК), являясь синтетическими аналогами эндогенных глюкокортикоидов и обладая широким спектром действия (противовоспалительным, иммуносупрессивным, антиаллергическим и рядом других), широко используются в терапевтической практике [1, 2]. Данная группа препаратов довольно эффективно устраняет ряд проявлений неэндокринных болезней, однако у них наблюдается ряд побочных эффектов [3], которые могут отличаться от характерных для синдрома эндогенного гиперкортицизма (ЭГ). По этой причине в ряде случаев этот синдром не может быть достаточно полноценным ориентиром в побочных проявлениях глюкокортикоидной терапии. В связи с этим цель нашего исследования заключалась в анализе побочных эффектов различных ГК и сопоставлении их с проявлениями ЭГ.
Материал и методы
Группу обследования составили больные, которые проходили лечение в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского»: группа 1 – больные с ЭГ (с кортикотропиномой и глюкокортикостеромой); группа 2 – больные, получающие ГК системного действия (с саркоидозом легких, получающие метилпреднизолон (МП), и с вульгарной пузырчаткой, получающие преднизолон); группа 3 – больные, получающие ГК местного действия (с бронхиальной астмой, получающие будесонид, и с псориазом, получающие бетаметазон). Исходная характеристика групп представлена в таблицах 1 и 2.
Сроки осмотра больных: группа больных с ЭГ осмотрена до оперативного лечения; группа больных, получающих МП, осмотрена до и спустя 1 мес. от начала приема МП; группа больных, получающих преднизолон, и больных, получающих терапию местными ГК, – ретроспективная группа (осмотрены через 3 мес. от начала терапии ГК).
Медиана доз принимаемых ГК: МП – 24 мг/сут; преднизолон – 100 мг/сут; топические (мази) ГК – 2 точки нанесения; ингаляционные ГК – 0,64 [0,5; 0,64] мг/сут. Длительность ЭГ: с кортикотропиномой – 35,5 [22; 78] мес.; с глюкокортикостеромой – 54 [33; 72] мес.
Осмотр больных во всех группах проводился согласно разработанному опроснику, который включал в себя сбор жалоб и анамнеза, общий клинический осмотр с измерением артериального давления (АД), окружности талии и бедер (ОТ, ОБ), индекса массы тела (ИМТ).
Больным всех групп выполнялись лабораторные исследования (в лаборатории ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского»): определение уровня гликированного гемоглобина методом капиллярного электрофореза (Capillarys-2 Flex Piercing, Sebia S.A., Франция (2015) (референсные значения – 4,3–5,8%); уровня холестерина (3,3–5,2 ммоль/л), уровня калия (4,0–5,2 ммоль/л), проведение перорального глюкозотолерантного теста (ПГТТ) у лиц, не страдающих диабетом, с 75 г глюкозы (исходно уровень глюкозы в венозной плазме – Больным с ЭГ дополнительно выполнялись лабораторные исследования: определение уровня адренокортикотропного гормона (АКТГ) в плазме крови (референсные значения: утром – 0,8–11 пмоль/л, вечером – 0–5,0 пмоль/л), уровня кортизола в крови (утром – 190,0–650,0 нмоль/л, вечером – 50,0–350,0 нмоль/л) методом иммунорадиометрического исследования (Immulite 2000, США); суточной экскреции свободного кортизола с мочой методом радиоимунного анализа (DSL-2100, США) (80,0–250,0 нмоль/л/сут).
Больным с глюкокортикостеромой и на фоне приема МП выполнялись инструментальные исследования: суточное мониторирование артериального давления (СМАД) («МЭКГ-ДП-НС-01», Россия); определение костной плотности с помощью рентгеновского костного денситометра Discovery A (Hogolic, США).
Жалобы больных разделялись на две группы [4, 5] (табл. 3): специфические проявления (СП) (матронизм, проксимальная миопатия, легкое образование гематом, стрии); менее специфические проявления (МСП) (прибавка в весе, акне, длительное заживление ран, выпадение волос и др.).
Статистический анализ выполнялся с помощью программы IBM SPSS Statistics v23 (IBM corp., USA). Для количественных переменных рассчитывали медианы и квартили (Ме [Q25; Q75]), их сравнение в нескольких группах проводили с использованием критериев Манна – Уитни, Крускала – Уоллиса (с апостериорными попарными сравнениями и поправкой на множественные сравнения), Вилкоксона (для связанных выборок). Сравнение качественных переменных проводили с расчетом критерия χ 2 . Для анализа степени вклада различных симптомов в клиническую картину основного заболевания был проведен дискриминантный анализ, оценивались коэффициенты дискриминантных функций.
Результаты и обсуждение
Клинические проявления гиперкортицизма
Клинические проявления гиперкортицизма (как СП, так и МСП) чаще (р <0,05) наблюдались у пациентов с ЭГ по сравнению с пациентами, получающими различные формы ГК (табл. 3).
Среди СП гиперкортицизма наиболее часто наблюдался матронизм, причем статистически значимо чаще у больных с ЭГ (в 88%), чем на фоне приема ГК системного действия (34,1%), а в группах больных, получающих ГК местного действия, этот симптом вовсе отсутствовал (табл. 3).
Проксимальная миопатия и склонность к легкому образованию гематом чаще наблюдались у пациентов с ЭГ по сравнению с группой пациентов, получающих ГК (в 60% и 50,7% случаев соответственно, р <0,0001). Среди всех жалоб в группе пациентов, получающих ГК местного действия, преобладала жалоба на проксимальную миопатию. Так как в данную группу входили больные с бронхиальной астмой, частыми симптомами которой являются общая слабость и повышенная утомляемость [6], скорее всего, слабость проксимальных мышц нижних конечностей являлась проявлением основного заболевания, а не побочным эффектом ингаляционных ГК. Также процент данных жалоб был значительно выше на фоне приема преднизолона (проксимальная миопатия – 75%; легкое образование гематом – 62,5%) по сравнению с больными, получающими МП (проксимальная миопатия – 15,6%; легкое образование гематом – 6,3%, р<0,05).
Стрии наблюдались у больных с ЭГ, а также на фоне приема больших доз преднизолона. На фоне курса терапии МП, который по длительности был сопоставим с курсом терапии преднизолоном (1 мес.), однако медиана дозы при перерасчете на преднизолон была значительно меньше (30 мг), стрии не развивались. Также стрий не наблюдалось при терапии ГК местного действия. Эти данные указывают на прямую зависимость этого симптома от дозы ГК при сопоставимой длительности лечения.
Среди МСП наиболее часто выявлялась жалоба на прибавку в весе. Преобладала данная жалоба в группе с ЭГ (89,3%). Процент данного проявления в группах пациентов, получающих ГК местного действия, составил менее 25 (табл. 3). Стоит также отметить, что несмотря на то, что спустя 1 мес. приема малых доз ГК прибавки в весе не отмечалось, имелось перераспределение подкожно-жировой клетчатки: избыточное отложение жировой ткани в области живота, лунообразное лицо, дорсоцервикальная жировая подушка.
Другие проявления гиперкортицизма
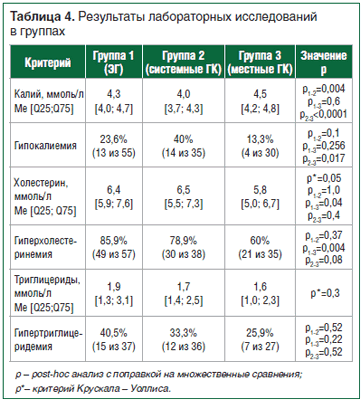
Гипокалиемия, гиперхолестеринемия и гипертриглицеридемия в том или ином проценте случаев наблюдались во всех обследованных группах. Гипокалиемия присутствовала чаще всего в группе больных, получающих ГК системного действия (табл. 4).
Осложнения гиперкортицизма
АГ при ЭГ выявлена более чем у 90% больных (рис. 1), что было чаще, чем на фоне приема таблетированных ГК (р <0,0001). При этом больные с ЭГ были существенно моложе больных, получавших синтетические ГК (табл. 1). Несмотря на то, что в группе больных, получающих ГК местного действия, частота АГ была высокой (80,9%), она не отличалась от среднепопуляционной в данной возрастной группе [7], таким образом, прием местных ГК не повышал частоту АГ.
Уровни систолического и диастолического АД у больных с кортикотропиномой и глюкокортикостеромой значимо не отличались, однако были выше, чем у больных на фоне терапии ГК (табл. 5).
Для коррекции АГ у больных с ЭГ требовалось назначение более 2-х антигипертензивных препаратов, а у больных, получавших терапию ГК местного действия, – 1 препарат (рис. 2).
Нарушения углеводного обмена
Ранние нарушения углеводного обмена (РНУО) и сахарный диабет (СД) чаще наблюдались у пациентов с ЭГ по сравнению с пациентами, получающими системные ГК (табл. 6).
У больных, находящихся на терапии ингаляционными и топическими ГК, ПГГТ не проводился, однако у 12 из 43 на момент исследования уже был установлен диагноз СД.
Уже спустя 1 мес. приема малых доз таблетированных ГК у 9 пациентов из 27 больных без ранее выявленных нарушений углеводного обмена (НУО) отмечались РНУО (рис. 3). Так, у 5 пациентов развилась нарушенная гликемия натощак (НГН), у 1 – нарушенная толерантность к глюкозе (НТГ), у 3 – НГН + НТГ, а у 1 больного с НГН (до приема МП) – НГН + НТГ, т. е. даже короткий курс синтетических ГК приводит к нарушению со стороны углеводного обмена.
Вторичный остеопороз
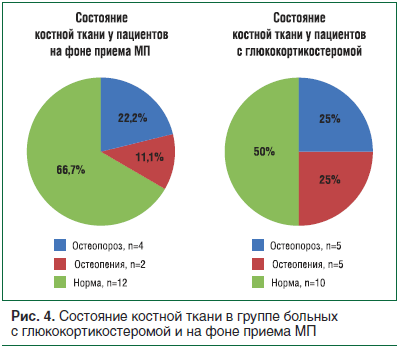
Денситометрия была проведена пациентам с ЭГ (с глюкокортикостеромой) и получающим МП (рис. 4). Согласно полученным данным, частота нарушений плотности костной ткани в данных группах достоверных различий не имела (р>0,05). Остеопороз (ОП) в группе больных, получающих терапию ГК, диагностирован в 22,2% случаев (что соответствует данным о развитии ОП в популяции в этой возрастной группе [8]): у 2 женщин 70,5 и 61 года, а также у 1 мужчины 65 лет. Остеопороз при ЭГ диагностирован в 25% случаев, при этом медиана возраста больных составила 31 [24,5; 40,5] год, они были моложе по сравнению с группой пациентов, получающих малые дозы ГК (р <0,05).
У 3 из 5 пациентов с диагностированным ОП в группе с глюкокортикостеромой возникли малотравматичные переломы ребер и позвоночника. В группе больных, получающих малые дозы ГК, малотравматичные переломы отсутствовали. Это свидетельствует о том, что несмотря на отсутствие отличий в частоте ОП в обеих группах, более тяжелым был ОП при ЭГ.
Выводы
Клинические и лабораторные проявления гиперкортицизма чаще наблюдались у пациентов с ЭГ по сравнению с пациентами, находящимися на терапии глюкокортикоид-содержащими препаратами (р <0,05).
Большинство изменений развивалось спустя 1 мес. приема малых доз системных ГК. Частота гипокалиемии и дислипидемии была выше, чем при ЭГ. Также спустя 1 мес. приема малых доз таблетированных ГК у 33,3% больных без ранее выявленных НУО отмечались РНУО.
Частота АГ и уровень систолического и диастолического АД при ЭГ были выше, чем в других группах. При этом пациенты были моложе по сравнению с другими группами. Также больным с ЭГ требовалось большее количество антигипертензивных препаратов для достижения нормальных значений АД.
Частота нарушений плотности костной ткани в группе с ЭГ (с глюкокортикостеромой) и на фоне короткого курса терапии МП статистически не отличалась (р>0,05). Однако в отличие от группы больных, принимающих синтетические ГК, у больных с ЭГ присутствовали малотравматичные переломы.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Мукоэпидермоидный рак околоушной железы - лучевая диагностика
- КТ при склеродермии пищевода
- Нефротический синдром. Функция нефронов при хронической почечной недостаточности
- Лихорадка Денге . Эпидемиология лихорадки денге. Патогенез лихорадки денге. Диагностика, лечение и профилактика лихорадки денге.
- КТ, МРТ при саркоме жевательного пространства
