Своеобразие вирусного воспаления на клеточном уровне.
Добавил пользователь Дмитрий К. Обновлено: 20.01.2026
Своеобразие вирусного воспаления на клеточном уровне.
Особенности вирусного воспаления на клеточном уровне, также как и на субклеточном, обусловлены морфологическими и функциональными особенностями вирусных частиц. Аналогично воспалению, обусловленному другими инфекционными агентами, возможно развитие двух основных форм воспаления: острого и хронического. Принципиальная схема острого воспаления также сходна: повреждение клеток - выход гидролитических ферментов - нарушение проницаемости сосудистой стенки эндотелия и его базальной мембраны под влиянием продуктов деградации тучных клеток и активированных фагоцитов - диапедез форменных элементов крови и появление экссудата. И все-таки существуют принципиальные различия. Бактерии, за редким исключением (гонококки, менингококки), воздействуют на клетки-мишени извне с помощью различных ферментов и токсинов, которые нередко ведут к полному расплавлению наружнрой мембраны. Вирусы осуществляют процесс воспаления как снаружи, так и изнутри клетки.
Основой защитной воспалительной реакции при бактериальной инфекции служат нейтрофилы, заглатывающие и переваривающие их, а также выделяющие ряд высокоактивных веществ. При этом возникает целый ряд кислородозависимых и кислородонезависимых защитных реакций, продукты которых (супероксид О2, Н202, ОН и др.) обладают мощным бактерицидным действием и в то же время способны повреждать собственные клетки хозяина. Кроме того, полиморфноядерные лейкоциты (ПМЛ) выделяют лизосомальные гидролазы, катепсины и эластазу, которая отслаивает эндотелиоциты от базальной мембраны. Биоокислители (02, Н202) разрушают ингибиторы протеаз и провоцируют образование медиаторов проницаемости, которые, наряду с системой комплемента, способствуют фокусированию нейтрофилов в очаге воспаления. Значительные скопления ПМЛ в сочетании с тромбоцитами способствуют не только повышению проницаемости стенок сосудов, но и их разрушению, что, чаще всего, имеет место при аллергических процессах в легких, бронхиальной астме, острых сливных пневмониях и респираторном дистресс-синдроме.
Сравнительно недавно участие нейтрофилов в развитии воспалительного процесса при респираторных вирусных инфекциях практически отрицалось. Полагали, что это исключительная прерогатива бактерий. Тем не менее, в последние годы представлены убедительные данные о значительном вкладе нейтрофилов в процессы образования активных форм кислорода (АФК) при гриппе. Доказано, что одним из основных механизмов воспалительного процесса при гриппе является образование свободных радикалов кислорода. С генерированием этих форм связаны мутагенез, протеолитическая активация вируса гриппа, цитопатический эффект вирусной инфекции, деструкция капиллярной сети и стенок капилляров, развитие сливных пневмоний с отеком легких. Установлено также, что липидная пероксидация (ЛП), активируемая вирусом гриппа в клетках легкого, является одним из узловых метаболических процессов наряду с генерацией АФК. Именно эти процессы определяют тяжесть и распространенность воспалительной реакции. При резкой активации АФК и ЛП ферментная защита от них в виде супероксиддисмутазы (СОД), каталазы, глютатион-пероксидазы и аскорбиновой кислоты становится недостаточной. Преимущественная генерация при гриппе гипохлорида, который является мощным неспецифическим окислителем, способным окислять не только липиды, но и белки, безусловно, требует переоценки стратегии антиоксидантной терапии при гриппе, с подключением не только токоферола, ионола, но и более эффективной супероксиддисмутазы.
Несмотря на явное участие нейтрофилов в развитии воспаления при вирусных инфекциях, по мнению многочисленных авторов, основой фагоцитарной защитной реакции при вирусной инвазии являются моноциты и их зрелые формы - макрофаги. В чем сходство и отличие фагоцитоза, осуществляемого нейтрофилами и макрофагами? Сходство в наличии ряда аналогичных по функциональной направленности этапов при взаимодействии с чужеродными агентами: хемотаксис, активация, выброс активных веществ, адсорбция, захват, переваривание. Однако много принципиальных отличий. В противоположность нейтрофилам макрофаги - долгоживущие клетки и рассеяны по всему организму, они входят в состав соединительной ткани, содержатся в базальной мембране кровеносных сосудов. Соответствующую фокусировку макрофагов можно обнаружить как в ткани, так и в полостях и экссудатах. При хронической бронхолегочной патологии альвеолярные макрофаги нередко содержат вирусные антигены.
Набор выделяемых активированным макрофагом веществ значительно больше и многообразнее, чем у ПМЛ. Соответственно этому спектр выбрасываемых активных веществ при вирусном воспалении значительно шире. К числу секретируемых им веществ следует отнести гидролазные ферменты (лизоцим, кислые гидролазы, нейтральные протеазы, липазы), ингибиторы протеолитических ферментов, факторы, меняющие клеточную пролиферацию и функцию (интерлейкин 1, фактор созревания тимоцитов, ангиогенный фактор, интерферон и фибронектин), производные липидов (простагландины, лейкотриены, фактор активации тромбоцитов), факторы, меняющие процесс свертывания крови (тромбопластин, активатор плазминогена), вирусоцидные агенты (супероксид - радикал О2, Н202, интерфероны), компоненты комплемента и их ингибиторы.
Обилие секретируемых макрофагами веществ определяет и большую сложность и многообразие их функций. Активные МФ из очага воспаления участвуют во всех процессах по обеспечению гомеостаза, являясь главными его эффекторами. В отличие от нейтрофилов макрофаги способны фагоцитировать крупные, более 1 мкм объекты, именно они поглощают фрагменты клеток с содержащимися в них вирусами. В силу многообразия секретируемых веществ и выполняемых функций макрофаг активно вступает в контакт с другими клетками, осуществляющими более высокий уровень клеточной защиты организма. Именно макрофаг представляет Т-хелперам вирусный антиген, который находится на поверхности МФ в комплексе с клеточными маркерами главного комплекса гистосовместимости. Макрофаги запускают и регулируют деятельность всех видов лимфоцитов (В, Т с хелперной и супрессорной активностью). Под влиянием активированных МФ Т-лимфоциты продуцируют разнообразные растворимые факторы - лимфокины, которые, в свою очередь, оказывают активирующее воздействие на макрофаги.
Макрофаги в значительно большей степени участвуют в развитии наиболее сложных и актуальных в настоящее время хронических форм воспаления. Причин для возникновения хронического воспаления при активации макрофагов значительно больше в силу их более длительного жизненного цикла, полифункциональности и значительной связи с элементами, контролирующими клеточный иммунитет, который при вирусных инфекциях, в отличие от бактериальных, имеет доминирующее значение. Функциональная недостаточность МФ, в том числе альвеолярных, нередко возникает именно под влиянием респираторных вирусов, встраивающихся в мембрану макрофага, повреждающих их рецепторный аппарат и внутренние структуры. Известно также, что для вирусов характерен незавершенный механизм фагоцитоза, при котором сами фагоциты способствуют диссеминации вирусного агента на значительные расстояния от первичного очага воспаления.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусные инфекции на клеточном уровне
Комплексная цель модуля состоит в необходимости объединить лекционный материал, касающийся всех возможных проявлений вируса на клеточном и организменном уровне, продемонстрировать единую систему протекания вирусной инфекции при заражении организма-хозяина. В задачу лекционного материала, объединенного в данный модуль входит необходимость обобщить информацию о классификации вирусных инфекций, о вирусном патогенезе на клеточном и организменном уровне, о цитопатическом эффекте вирусного поражения, а также путях проникновения и распространения вирусов в организме хозяина.
Модуль состоит из двух лекций, материал которых позволяет решить поставленную цель.
Под инфекцией понимают комплекс процессов, происходящих при взаимодействии инфекционного агента с организмом хозяина. Однако в связи с тем, что вирусы являются внутриклеточными паразитами, а точнее, генетическими паразитами, в основе их взаимодействия с организмом всегда лежит инфекционный процесс на уровне клетки, который реализуется путем взаимодействия вирусного и клеточного геномов. Поэтому возможно классифицировать инфекции как на клеточном уровне, так и на уровне организма
КЛАССИФИКАЦИЯ ВИРУСНЫХ ИНФЕКЦИЙ НА КЛЕТОЧНОМ УРОВНЕ
Автономные и интеграционные инфекции. Если вирусный геном реплицируется независимо от клеточного генома, такая инфекция называется автономной. Понятие автономии относительно, оно ограничивается лишь отсутствием физической связи между вирусным и клеточным геномами, хотя взаимодействие их постоянно происходит в течение инфекции. Автономная форма вирусной инфекции характерна для большинства вирусов животных.
Если вирусный геном включается в состав клеточного генома, или, как принято называть этот процесс, интегрирует с клеточным геномом и реплицируется вместе с ним, такая инфекция называется интеграционной. Интеграционная инфекция возникает в результате физического объединения генома вируса и клетки. При этой форме инфекции вирусный геном реплицируется и функционирует как составная часть клеточного генома. Интегрировать могут как полный геном, так и часть генома. При гепатите В
возможна интеграция полного генома, при аденовирусных и герпесвирусных инфекциях обычно интегрирует часть генома, при инфекции онковирусами может интегрировать как полный геном, так и часть его. Вирусные последовательности в составе клеточного генома называются провирусом, или провирусной ДНК.
При интеграционных инфекциях нет ни сборки вирусной частицы, ни выхода вируса из клетки. Клетка может сохранить нормальные функции и при ее делении вирусные последовательности могут переходить в геном дочерних клеток. Такая ситуация наблюдается в случае инфекции, вызванной онкогенными вирусами. Интеграция может привести к неопластической трансформации клетки. Трансформированная клетка приобретает способность к неограниченному делению в результате нарушения регуляторных механизмов, контролирующих деление. Интеграционный тип инфекции возможен для нескольких семейств ДНК-содержащих вирусов: аденовирусов, паповавирусов, вирусов герпеса, а также для вируса гепатита В и обязателен для одного семейства РНК-содержащих вирусов — ретровирусов. В соответствии с данными В. М. Жданова, интеграционная форма инфекции может возникнуть при заражении и другими РНК-содержащими вирусами, такими, как вирус клещевого энцефалита (семейство тогавирусов), вирусы кори и SV5 (семейство парамиксовирусов) и др. Обязательным условием в этом случае является присутствие в клетках фермента — обратной транскриптазы, необходимого для процесса интеграции. Возникающая интеграционная инфекция может явиться причиной ряда хронических и аутоиммунных заболеваний.
Механизм интеграции вирусного генома с клеточным геномом. Из многих моделей, объясняющих процесс интеграции, наиболее признанной является модель Кемпбелла. В соответствии с этой моделью для интеграции с клеточным геномом необходима кольцевая форма двунитчатой вирусной ДНК. Эта молекула ДНК прикрепляется к клеточной ДНК, в месте прикрепления обе молекулы разрезаются и образовавшиеся концы сшиваются таким образом, что вирусная ДНК становится частью клеточного генома. Существенную роль в интеграции играют длинные концевые повторы двунитчатой ДНК, которые определяют специфичность интеграции в результате узнавания ими определенных участков клеточного генома. ДНК паповавирусов является циркулярной и двунитчатой и полностью отвечает требованиям модели Кемпбелла.
Продуктивная и абортивная инфекции. Инфекция может быть продуктивной и абортивной. Продуктивная инфекция завершается образованием инфекционного потомства. Абортивной называется инфекция, которая не завершается образованием инфекционных вирусных частиц, или они образуются в гораздо меньшем количестве, чем при продуктивной инфекции. Абортивная инфекция может возникнуть при следующих трех обстоятельствах: 1) заражение чувствительных клеток дефектным вирусом; 2) заражение чувствительных клеток в неразрешающих условиях; 3) заражение нечувствительных клеток стандартным вирусом.
Заражение чувствительных клеток дефектным вирусом. Дефектным называется такой вирус, который не способен проявить все генетические функции, необходимые для образования инфекционного потомства.
Существуют дефектные вирусы и дефектные вирусные частицы. Дефектными называются такие вирусы, которые репродуцируются лишь в присутствии вируса-помощника, например аденоассоциированный вирус (семейство парвовирусов), дающий потомство только в присутствии аденовируса-помощника. Дефектные вирусные частицы накапливаются в популяции многих вирусов, особенно при пассировании их с высокой множественностью инфекции. Дефектные частицы интерферируют при репродукции вируса с инфекционными вирусными частицами и потому называются дефектными интерферирующими частицами (ДИ-частицами). Этот тип вирусных частиц наиболее хорошо изучен на модели вирусов везикулярного стоматита и гриппа. Получение дефектных частиц вируса гриппа при заражении куриных эмбрионов с высокой множественностью инфекции получило название феномена фон Магнуса по имени исследователя, впервые его описавшего. Дефектные вирусные частицы вызывают абортивную инфекцию в связи с тем, что они лишены части генетического материала. Например, дефектные частицы вируса гриппа содержат неполные последовательности Р-генов, кодирующих три высокомолекулярных вирусных белка.
Заражение чувствительных клеток в неразрешающих условиях. Абортивная Инфекция может возникать при изменении условий, в которых происходит инфекционный процесс. Эти условия возникают в организме и могут моделироваться в эксперименте; в организме — повышение температуры, изменение рН в очаге воспаления и концентрации ионов, наличие антиметаболитов, ингибиторов и т. д.; в эксперименте — изменение температуры инкубации, состава питательной среды, внесение антиметаболитов и ингибиторов и т. д. В результате клетка либо погибнет без продукции инфекционного вируса, либо инфекция прерывается на определенном этапе. При устранении неразрешающих условий абортивная инфекция превращается в продуктивную. Смена абортивной инфекции на продуктивную может осуществиться и с помощью вируса-помощника.
Заражение нечувствительных клеток стандартным вирусом приводит к наиболее распространенной форме абортивной инфекции.
Непермиссивность клетки к определенному вирусному агенту может проявиться на любом этапе инфекции. Чувствительность клетки к ряду вирусов определяется наличием на клеточной поверхности специфических рецепторов, обусловливающих адсорбцию и проникновение вируса в клетку. Такой генетически обусловленный механизм клеточной резистентности наиболее четко установлен для пикорнавирусов, а также онковирусов птиц. Для большинства вирусов можно подобрать две клеточные системы, в одной из которых будет развиваться продуктивная, а в другой — абортивная инфекция. Механизм генетически обусловленной резистентности клеток к вирусам широко варьирует, но в основе его лежит либо отсутствие клеточных факторов, необходимых для репродукции вируса, либо наличие факторов, нарушающих процесс репродукции.
У сложно устроенных вирусов клеточная непермиссивность часто проявляется на стадии сборки вирусных частиц; нарушение сборки в некоторых непермиссивных системах для вирусов гриппа и парамиксовирусов обусловлено уменьшением количества молекул матриксного белка вируса.
Острая и хроническая инфекция.Как продуктивная, так и абортивная инфекция может протекать в виде острой или хронической инфекции.
Острой называется такая форма инфекции, при которой после образования вирусного потомства клетка либо погибает, либо выздоравливает и не содержит вирусных компонентов. Хроническая инфекция — это такая форма инфекции, при которой клетка продолжает продуцировать вирусные частицы или вирусные компоненты в течение длительного времени и передает эту способность дочерним клеткам.
Чаще хроническую форму приобретает абортивная инфекция, так как вирусный генетический материал обычно не входит в состав вирусного потомства, а накапливается в клетках и передается в дочерние клетки. Одним из факторов, вызывающих хроническую инфекцию, являются ДИ-частицы. Такие частицы, попадая в клетки вместе с инфекционными вирусными частицами, конкурируют с ними за факторы репродукции и препятствуют образованию инфекционного потомства. В результате гибель клеток предотвращается. При появлении в системе новых чувствительных клеток в них вновь возникает продуктивная инфекция с образованием ДИ-частиц, и такой цикл инфекции возобновляется снова и снова.
Цитолитическая и нецитолитическая инфекции. Острая инфекция на клеточном уровне может быть цитолитической и нецитолитической в зависимости от судьбы зараженной клетки. Инфекция, завершающаяся гибелью (лизисом) клетки называется цитолитической. Инфекция, которая непосредственно не приводит к лизису клетки, и клетка еще может функционировать в течение некоторого периода времени, продуцируя вирусные частицы, называется нецитолитической.
Смешанная инфекция. Вестественных условиях распространен феномен смешанной инфекции, при котором клетка заражается двумя или несколькими разными вирусами. Два и больше инфекционных процесса, происходящих одновременно в одной клетке, могут оказывать различное влияние друг на друга. Возможны несколько вариантов взаимодействия вирусов в процессе смешанной инфекции.
1. Один из вирусов подавляет репродукцию второго вируса, или подавляется репродукция обоих вирусов. Этот феномен называется интерференцией вирусов.
2. Вирус усиливает репродукцию второго вируса в результате комплементации или экзальтации. Комплементация может происходить между двумя родственными или неродственными вирусами, например между аденовирусом и аденоассоциированным вирусом человека или SV40, при этом вирус-помощник предоставляет другому вирусу неструктурный белок. Экзальтация может быть связана с подавлением процесса образования интерферона первым вирусом.
3. Оба вируса не оказывают существенного влияния на процесс репродукции каждого из них, однако может происходить нарушение морфогенеза обоих вирусов.
Смешанная инфекция широко используется вирусологами для изучения генетических функций вирусов и дефектности геномов.
ЦИТОПАТОЛОГИЯ ЗАРАЖЕННОЙ ВИРУСОМ КЛЕТКИ
Патологические изменения зараженных вирусами клеток обусловлены специфическими и неспецифическими процессами. К неспецифическим процессам относятся процессы, обусловленные изменением проницаемости плазматической мембраны, маргинация хроматина, хромосомные аберрации, пикноз ядер, вакуолизация цитоплазмы. Последнее свойство может приобретать настолько своеобразный и выраженный характер, что превращается в специфический признак некоторых вирусных инфекций. Так, один из вирусов, вызывающий такой процесс,— SV40 — получил название «вакуолизирующий вирус». Специфическими изменениями являются, например, вирусные включения, образование симпластов. Специфические и неспецифические процессы могут привести к деструкции клетки. Цитопатический эффект и его причины.Деструкцию клетки, возникающую при цитолитической инфекции, называют цитопатическим эффектом, а вирус, вызывающий этот эффект, называют цитопатогенным. Большинство вирусов животных являются цитопатогенными, и это свойство лежит в основе патогенеза ряда вирусных инфекций. Цитопатический эффект широко используется в лабораторной диагностике вирусных инфекций для индикации вируса в культуре клеток и выявления антител в сыворотках переболевших.
Цитопатический эффект является следствием нескольких причин: 1) нарушение нормальной жизнедеятельности клетки в результате механического повреждающего действия вирусных компонентов на клеточные структуры; 2) повреждение лизосом, в результате чего освобождаются высокоактивные лизосомальные ферменты, вызывающие аутолиз клетки; 3) интенсивное истощение белковых и энергетических ресурсов клетки за счет переключения клеточных ферментов и белок-синтезирующего аппарата на синтез вирусспецифических макромолекул; 4) специфическое повреждающее действие вирусов на клеточные молекулы. Эти причины повреждения клетки различным образом проявляются и сочетаются при разных вирусных инфекциях.
Среди РНК-содержащих цитопатогенных вирусов пикорнавирусы оказывают наиболее быстрое и глубокое действие на синтез клеточных белков. Причиной выключения белкового синтеза является блокирование узнавания рибосомой «шапочки» клеточных иРНК. Поскольку РНК вируса полиомиелита транслируется по механизму, независимому от «шапочки», происходит селективное подавление трансляции клеточных иРНК.
Вирусные включения.Вирусные включения, выявляющиеся при окрашивании зараженных клеток, являются специфическими морфологическими признаками вирусной инфекции, часто имеющими диагностическое значение. Внутриклеточные вирусные включения были обнаружены гистологами еще в прошлом столетии. Д. И. Ивановский обнаружил в клетках растения, зараженного вирусом табачной мозаики, кристаллоподобное включение, которое впоследствии получило название «кристаллы Ивановского». Позже было доказано, что «кристаллы Ивановского» представляют собой скопление вирусов табачной мозаики. Вирусные включения выявляются в ядре или цитоплазме зараженной клетки. В зависимости от прокрашивания разными красителями включения бывают базофильными и ацидофильными (эозинофильными). Включения при разных вирусных инфекциях различаются по величине, форме, численности. Они могут быть одиночными и множественными, крупными и мелкими, округлыми или неправильной формы. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса, полиомы, аденовирусами, флавивирусами, вирусом ящура. Характерные цитоплазматические включения формируются в клетках, зараженных вирусами оспы, гриппа, бешенства.
Природа включений разнообразна. Большей частью включения представляют собой «вирусные фабрики», т. е. очаги, в которых идет транкрипция и репликация вирусных геномов и сборка вирусных частиц. В клетках, зараженных реовирусом, образуются причудливые серповидные околоядерные включения; при электронно-микроскопическом исследовании они оказались связанными с нитями митотического веретена, в ассоциации с которыми идет репродукция этого вируса. Включения могут представлять собой скопление вирусных частиц, как, например, внутриядерные включения в клетках, зараженных аденовирусами и вирусом полиомы, либо скопление молекул вирусных белков, например ядерные и цитоплазматические включения в клетках, зараженных вируеом гриппа, представляющие собой скопление молекул неструктурного вирусного белка. Некоторые включения содержат только клеточный материал, например ядерные ацидофильные включения в клетках, зараженных вирусами герпеса на поздней стадии инфекции.
Симпласты. Некоторые вирусы вызывают характерный цитопатический эффект, проявляющийся в слиянии клеток и образовании многоядерных клеток, называемых симпластами или синтицием. Образование симпластов обусловлено действием на клеточные мембраны прилежащих друг к другу клеток вирусных белков слияния и определяется тем же механизмом, который обеспечивает слияние вирусной и клеточной мембраны и проникновение вирусов в клетку. Слияние может происходить как за счет белков родительского вируса при заражении клеток большими концентрациями вируса (слияние снаружи), так и за счет внутриклеточного накопления вновь синтезированных вирусных белков слияния (слияние изнутри). Образование симпластов вызывают многие вирусы: парамиксовирусы, некоторые ретровирусы, вирусы герпеса. В определенных условиях (при низких значениях рН) слияние вызывают вирусы гриппа, буньявирусы и др.
Особенности вирусной инфекции в клеточной популяции. Основной особенностью вирусной инфекции в клеточной популяции является гетерогенность системы в связи с гетерогенностью вирусных частиц и клеток, входящих в состав популяции. В любом вирусном препарате наряду с инфекционными вирионами находятся ДИ-частицы. Клетки в каждой клеточной популяции широко варьируют по чувствительности к вирусу, и инфекция может протекать не так, как на клеточном уровне. Например, при заражении вирусом, вызывающим в клетках продуктивную инфекцию, чувствительные клетки популяции могут погибнуть, и в популяции за счет некоторого количества нечувствительных клеток может установиться хроническая инфекция.
Воспалительные изменения на уровне субклеточных структур при вирусной инфекции.
Вызываемое вирусами развитие клинических проявлений болезни и видимые признаки воспаления есть конечный результат множества событий. Большая часть процессов, связанных с репликацией вируса, а следовательно, с начальными воспалительными реакциями на микроструктурном уровне, недоступна для распознавания на клиническом уровне. Эта особенность, характерная для многих вирусных инфекций и впервые описанная С.А. Mims и А.Н. Sharpe], представляет собой важную концепцию для понимания вирусного воспаления. Зачастую привычные признаки: краснота, припухлость, инфильтрация составляют лишь видимую с большим опозданием и весьма незначительную часть того воспаления, которое захватывает многочисленные структуры пораженного организма.
Основные этапы взаимодействия вирусов и клеток чрезвычайно кратко представлены в модифицированной таблице.
В правом столбце таблицы перечислены события, происходящие внутри клетки, именно они определяют ее конечную судьбу: гибель, трансформацию, резервирование персистентного вируса и т.д. В левом столбце приведены события на уровне организма или ткани, ведущие к заражению клеток и развитию защитных иммунных реакций. Эта схема значительно упрощена, многое зависит от специфики вируса и хозяина.
Респираторные вирусы чаще проникают в организм через верхние дыхательные пути. Первичное прикрепление вируса к эпителиальным клеткам зависит от множества факторов: его устойчивости к неспецифическим защитным факторам (протеолитические ферменты, слизь, движение ресничек, соли желчных кислот), к секреторным антителам, а также от наличия специфических комплементарных рецепторов на поверхности клетки, способных к воссоединению с рецепторами вируса.
Как показали исследования последних лет, комплементарность вирусных и клеточных рецепторов зачастую обусловлена генетическими маркерами организма: группой крови и HLA-принадлежностью. Так, самые тяжелые осложненные формы гриппа чаще возникают у носителей антигенов А-Н и HLA-8, склонность к персистированию превалирует у лиц с группой крови ВШ и HLA-A9. Таким образом, развитие тех или иных форм воспаления отчасти предопределено генетически. Не исключено, что каждому из респираторных вирусов соответствует свой излюбленный генотип.
Вторым, не зависящим от специфических рецепторов, механизмом органотропности является протеолитическое расщепление гликопротеиновых оболочек парамиксовирусов (парагрипп, PC-вирус) в присутствии трипсиноподобных ферментов, содержащихся в инфицируемых клетках. Аналогичное свойство присуще вирусу гриппа, у которого ферментативному расщеплению подвергается гемагглютинин. При отсутствии в ткани необходимых ферментов многоцикловая инфекция не воспроизводится.
Прикрепление вируса к клетке является пусковым моментом для развития симптомокомплекса воспаления, который включает в себя альтерацию, экссудацию, трансформацию и пролиферацию в сочетании с нарушениями микроциркуляции и повреждениями функциональной активности. Краткая схема этого сложного и многообразного процесса не может отразить всех возможных вариантов и особенностей, но может облегчить восприятие основных моментов. Большая часть перечисленных в таблице 2 признаков воспаления, прежде всего деструкция и дистрофия, являются общими для всех респираторных вирусов и не могут служить надежными признаками дифференциации. Однако характер вирусных включений: их размеры, локализация, структура в сочетании с определенным типом поражения клеток (образование гигантских структур, пластов, скопления гроздевидных округлых клеток и т.д.) имеют определенное диагностическое значение при рассмотрении воспаления на субклеточном и клеточном уровне. Так, уже в начальной стадии воспаления, через 6-8 часов от момента заражения, при гриппе определяются базофильные включения, содержащие вирусные частицы. Чаще всего они локализуются в апикальной части эпителия; эозинофильные включения реже содержат вирус и чаще рассматриваются в качестве реактивных образований. При парагриппе и PC-инфекции выявляются цитоплазматические фуксинофильные включения, нередко группирующиеся вокруг ядра. При герпетической и цитомегаловирусной инфекции чаще регистрируются четко контурируемые внутриядерные включения, округлые, крупные, эозинофильные и оксифильные, нередко отгороженные от остальной цуклеплазмы светлой зоной. При аденовирусной инфекции также преобладают внутриядерные включения, на ранних стадиях инфекции (через 16 часов) - мелкие, округлые, базофильные или оксифильные; одни из них однородны, другие имеют форму колец с прозрачным центром. В дальнейшем число внутриядерных включений увеличивается, встречаются слоистые и ячеистые формы. На поздних этапах инфекции включения обнаруживаются и в цитоплазме клеток. Наиболее точная дифференцировка специфичности включений осуществляется с помощью прямого и непрямого иммунофлуоресцентного метода с использованием меченых антител.
Формирование вирусных включений интересно не только с точки зрения патогенных возможностей респираторных вирусов, но и с точки зрения анализа самого понятия воспаления. С одной стороны, это несомненный результат непосредственного воздействия вируса на клетку, вероятно это защитная реакция клетки, стремящейся локализовать патогенные частицы, а с другой стороны - это и возможность длительной резервации вируса. Таких двояких по целесообразности моментов в процессе вирусного воспаления достаточно. Так, под действием вирусов может происходить своеобразная активация фагоцитарной способности клеток, что проявляется в усилении цитофагоцитоза, когда инфицированные клетки активно фагоцитируют другие клетки, а также ферменты распавшихся структур. С одной стороны, это полезно с точки зрения утилизации и удаления дегенерировавших элементов, с другой стороны - нередко способствует большему распространению вирусной инфекции по клеточному пласту.
Большинство респираторных вирусов на ранних стадиях инфицирования вызывает ряд изменений клеточных структур, которые можно рассматривать как защитно-компенсаторные: набухание, гиперплазия ряда клеточных элементов, увеличение функционирующих локусов митохондрий, и лишь на более поздних стадиях возникают явления дистрофии, деструкции, либо необратимого перерождения.
Перечисляя изменения клеточных элементов, обусловленных вирусной репродукцией, было бы несправедливым забыть о главной их способности - нарушать синтез клеточных макромолекул. В случае развития вирусного инфицирования в клетке появляется два источника информации: клеточный и вирусный геномы. В подавляющем большинстве случаев ведущим оказывается вирусный геном, под руководством которого осуществляются процессы, направленные на воспроизводство вирусного потомства, в то время как синтез клеточных макромолекул (РНК, ДНК, белка) претерпевает значительное подавление. После длительных экспериментальных поисков было доказано, что в основе ингибирования синтеза клеточных РНК и ДНК в инфицированных клетках лежит феномен блокирования процесса транскрипции, т.е. "считывания" информации, закодированной в клеточном геноме, без нарушения целостности структур ДНК и РНК, а также РНК-полимераз. Ингибитором, ответственным за этот процесс, оказался аргининсодержащий белок - гистон. Большая часть исследователей полагает, что синтез белков-ингибиторов осуществляется самой клеткой в результате реализации информации, закодированной в ее геноме. Вирус лишь стимулирует синтез этих ингибиторов. Помимо подавления синтеза клеточных РНК, гистоны подавляют функцию и синтез ДНК, а также синтез АТФ и перенос аминокислот. Таким образом, появление индуцированных вирусом и воспроизведенных клеткой гистонов является одной из основных причин нарушения синтеза клеточных структур, а, следовательно, и дистрофии, являющейся одним из признаков воспаления.
Вирусы являются внутриклеточными инфекционными агентами. Весь репликативный цикл вируса осуществляется с исполь зованием метаболических и генетических ресурсов клеток. Поэтому патогенез вирусных инфекций, в первую очередь, следует рассматривать на молекулярном и клеточном уровнях (В.И. Покровский, О.И. Киселев, 2002). Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Поэтому характер развития внутритканевых процес сов при вирусных инфекциях, с одной стороны, определяется, как правило, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты от вирусной инфекции. Последние не редко носят деструктивный характер и усугубляют течение забо левания и его последствия. Поэтому понимание патогенеза вирусных инфекций представляется исключительно важным для создания рациональных схем лечения, основанных на гармоничном сочетании симптоматического лечения и противовирусной химиотерапии.
В клинической практике важное значение имеют процессы, вызванные вирусной инфекцией, виремией – (степень «вирусной нагрузки» прямо коррелирует с явлениями общего токсикоза, тяжестью состояния пациента, лихорадкой; тесным взаимодействием с иммунной системой), реакция которой в значительной степени определяет характер течения инфекционного процесса и его исход; присоединением бактериальной инфекции и развитием осложнений. Смешанные инфекции представляют собой опасный путь развития процесса.
Стадии репликативного цикла вируса гриппа представлены на рис. 1. Такой же репликативный цикл свойствен большинству РНК- и ДНК-содержащих вирусов, кроме тех, кото рые обладают особыми механизмами хронизации процесса, латенции и способностью к интеграции в клеточный геном (например, ВИЧ, гепатит С, вирус папилломы и.т.). Ключевыми стадиями репликативного цикла вируса являются проникновение в клетки, декапсидация, активация процессов транскрипции и трансляции, собственно репликация вирусного генома и созревание зрелых вирусных частиц с выходом нового потомства инфекционного вируса.
Проникновение вируса в клетки - одна из ключевых стадий патогенеза инфекционного процесса. Для большинства вирусов степень цитопатического действия вируса прямо зависит от множественности заражения. В естественных условиях инфицирова ние клеток вирусами не происходит обычно с высокой множе ственностью. Исключение составляют респираторные вирусы, которые передаются воздушно-капельным путем с высокой инфицирующей дозой. ВИЧ и гепатиты, наоборот, эффективно передаются с кровью в самых незначительных трудно определяе мых титрах. Такие вирусы имеют особые свойства, определяющие их контагиозность.
Для проникновения вируса в клетку, необходимо: высокое сродство к вирусоспецифическому рецептору; множественность рецепторов; эффективность слияния вируса с клетками при инфицировании; способность к образованию синцития, к образованию гигантских синпластов, состоящих из множества слившихся клеток, в которых вирусный нуклеопротеид без эндоцитоза беспрепятственно переходит от одной зараженной клетки к множеству других через цитоплазму.
Такими свойствами из респираторных вирусов обладает респираторно-синцитиальный вирус, а среди ретровирусов – вирус иммунодефицита человека.
Стадии жизненного цикла вируса гриппа и соответствующие ингибиторы репродукции в известной степени могут быть экстраполированы на многие другие вирусы, за исключением тех, жизненный цикл которых включает интеграцию в клеточный геном. В процессе репликации вирусов обычно происходит селективная блокада трансляции клеточных мРНК и активация экспресси клеточных генов, кодирующих провоспапительные лимфокины. Многократные раунды репликации вирусного генома приводят к истощению энер гетических ресурсов клеток и пула предшественников азотистых оснований. Повышенное содержание провоспалительных лимфокинов приводит к развитию воспалительной реакции и локально му генерированию свободных радикалов, оказывающих, в свою очередь, повреждающее действие на клетки и ткани через перекисное окисление липидов клеточных мембран, инактивацию жизненно важных ферментов. Поэтому одним из важнейших факторов патогенности вирусов является их репликативный потенциал: чем активнее происходит репликация, тем сильнее цитопатическое действие вирусов на клетки и пораженную ткань (орган).
Значительный вклад в цитопатическое действие вирусов вносит репродукция вирусов в митохондриях, что сопровождается нарушением функций этих органоидов, падением продукции АТФ и индукцией опосредованного митохондриями пути апоптоза.
Впервые возможность репродукции вирусов в митохондриях была доказана выдающимся отечественным вирусологом В.М. Ждановым. Узкий тропизм вирусов, в известной степени, спасителен для организма, так как инфекционный процесс ограничен одним органом.
Это обстоятельство позволяет, проводит рациональную симптоматическую терапию, направленную на защиту данной ткани или органа и ориентировать противовирусные средства в данный орган, например, легкие.
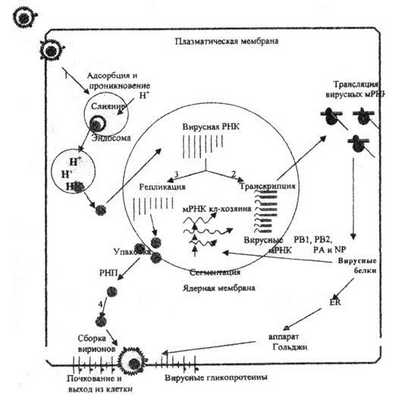
Рис. 1. Репликативный цикл вируса гриппа (В.И.Покровский, О.И.Киселев, 2002)
Представлены 4 основные фазы репликативного цикла вируса гриппа: 1 – адсорбция и проникновение вируса в клетку хозяина; 2 – транскрипция вирусной РНК и трансляция вирусных белков; 3 – репликация вирусной РНК и 4 – самосборка вирионов и последующий выход их из клетки.
Над оболочкой вируса поднимаются два типа «шипов» (гликопротеины) – гемаглютинин (Н) и нейраминидаза (N) – поверхностные антигены вируса гриппа. Гемаглютинин – полипептид, назван так благодаря способности гемолизировать эритроциты. Он имеет высокую изменчивость и иммуногенность, обеспечивая прикрепление вируса к клетке. Нейраминидаза – этогликопротеидный комплекс, который определяет ферментативную активность, отвечает за способность вирусной частицы проникать в клетку хозяина и выходить из нее после размножения.
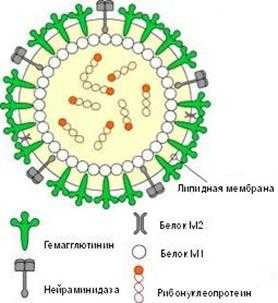
Рис. 2. Схематическое строение вируса гриппа
Гемаглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемаглютинина, а нейраминидаза обладает выраженным иммунодепресивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемаглютинины 1, 2, 3 типов и нейраминидазы 1, 2 типов содержат вирусы, которые поражают человека. Другие антигены характерные для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.).
Вирусы гриппа А. Эти возбудители более вирулентны и контагиозны, чем вирусы гриппа В и С. Это обусловлено тем, что вирус А содержит 2 типа нейраминидазы (N1, N2) и 4 –гемаглютинина (H0, H1, H2, H3); вирус В – 1 и 1 соответственно, поэтому он имеет лишь антигенные варианты внутри одного серотипа; вирус С содержит только гемаглютинин и не содержитнейраминидазу, но он имеет рецептор, который разрушает энзим. Вирусу С не свойственная изменчивость.
Одновременно циркулируют и имеют эпидемическое распространение 2 подтипа вируса гриппа А H3N2 и H1N1. На сегодняшний день во всем мире доминирует вариант А/Сидней/05/97, А/Берн/07/95 и А/Пекин/262/95. Характерной чертой современных вирусов гриппа А (H3N2) является изменение ряда их биологических свойств: тяжело размножаются в куриных эмбрионах, не агглютинируют эритроциты кур, взаимодействуют только с эритроцитами человека или морской свинки, имеют низкую иммуногенную активность.
Вирусы гриппа В выделяются только от людей. По вирулентности и эпидемиологической значимости они уступают вирусам гриппа А. По антигенным свойствам гемаглютинин инейраминидазу вируса В можно разделить на 5 подтипов. Их изменчивость носит более постепенный и медленный характер, что объясняет эпидемиологические особенности вируса гриппа В (эпидемии возникали 1 раз в 3-4 года до 1988 г.). В мире сейчас циркулируют 2 варианта вируса гриппа В: В/Пекин/184/93 (Европа, Америка, Африка, Австралия) и В/Виктория/2/87 (Юго-Восточная Азия). Характерной чертой современных вирусов гриппа А и В является их высокая чувствительность к ингибиторам гемаглютинирующей и инфекционной активности, которые содержатся в сыворотке крови нормальных животных.
Вирусы гриппа С . Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, но они могут быть причиной вспышек в организованных детских коллективах. Подъемы заболеваемости гриппом С нередко предшествуют или сопровождают эпидемии гриппа А и В. У детей раннего возраста и более старших возрастных группах он приводит к заболеваниям в легкой ибессимптомной форме.
Для вирусов гриппа С характерна значительно большая стабильность антигенных и биологических свойств. По ряду биологических характеристик эти возбудители отличаются от других представителей семейства ортомиксовирусов. Им присуща низкая репродуктивная активность в разных клеточных системах и наличие других, чем у вирусов гриппа А и В, рецепторов на поверхности эритроцитов. Рецептор-деструктирующая активность связана не с нейраминидазой, как у вирусов гриппа А и В, а с ферментом нейраминат-0-ацетилестеразою.
Сложность этиологии усиливают факты выделения от людей вирусов, которые не свойственные человеку. Гены вируса гриппа (H5N1), выделенные в 1997 году от человека в Гонконге, оказались подобными генам птичьего вируса, который преодолел межвидовой барьер. Оказалось, что человеческие и птичьи вирусы гриппа были реасортантами (рекомбинантные штаммы), которые получили внутренние гены РВ1 и РВ2 от перепелиного вируса гриппа А (H9N2) – штаммы А/перепел/Гонконг/61/97.
Вирусы гриппа малоустойчивы во внешней среде, в течение нескольких часов при комнатной температуре разрушаются. Под действием дезинфицирующих растворов (спирта, формалина, сулемы, кислот, щелочей) они быстро погибают. Нагревание до 50-60°С инактивирует вирусы в течение нескольких минут, в замороженном состоянии при температуре -70° С они сохраняются годами, не теряя инфекционных свойств, быстро погибают под воздействием ультрафиолетового излучения. Оптимум размножения вируса происходит при +37°С в слабощелочной среде. Как и другие вирусы, возбудитель гриппа отнюдь не чувствительный к антибиотикам и сульфаниламидам.
Вирус гриппа не растет на обычных питательных средах. Его можно выделить из материала, который получен от больного в первые дни болезни (смывы из носоглотки, мокроты), путем заражения культур или клеток куриных эмбрионов.
Традиционно считалось, что человеческий организм освобождается от возбудителя в ближайшие дни после выздоровления. Однако постепенно накапливались косвенные свидетельства, которые опровергают эту точку зрения. И в 1985 г. были получены прямые доказательства формирования длительной персистенции вируса гриппа. У одного человека удалось многократно выделять вирус гриппа в течение 9-ти месяцев и дольше. Возможность пожизненной персистенции вируса в организме человека продолжает изучаться.
1. Грипп и другие респираторные вирусные инфекции / под ред. О.И. Киселева, И.Г. Мариничева, А.А. Сомининой. – СПб. – 2003.
2. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков // Практическое руководство под редакцией О.И. Киселева. – Санкт-Петербург. – 2003.
3. Железникова Г.Ф., Иванова В.В., Монахова Н.Е. Варианты иммунопатогенеза острых инфекций у детей. – Санкт-Петербург. – 2007. – 254 с.
4. Ершов Ф.И. Грипп и другие ОРВИ // Антивирусные препараты. Справочник. – М., 2006. –С. 226-247.
5. Ершов Ф.И., Романцов М.Г. Антивирусные средства в педиатрии. – М., 2005. – С.159-175.
6. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). – М., 2005. – С. 287-292.
7. Иванова В.В. Острые респираторно-вирусные заболевания // Инфекционные болезни у детей. – М., 2002.
8. Онищенко Г.Г., Киселев О.И., Соминина А.А. Усиление надзора и контроля за гриппом как важнейший элемент подготовки к сезонным эпидемиям и очередной пандемии. – М., – 2004. – С.5-9.
9. Об утверждении стандарта медицинской помощи больным гриппом, вызванным идентифицированным вирусом гриппа (грипп птиц) // Приказ Минздравсоцразвития №460 от 07.06.2006 г.
10. Романцов М.Г., Ершов Ф.И. Часто болеющие дети: Современная фармакотерапия. – М., 2006. – 192 с.
11. Стандартизированные принципы диагностики, лечения и экстренной профилактики гриппа и других острых респираторных инфекций у детей / под ред. О.И. Киселева. – СПб. – 2004. – С. 82-95.
12. Лекарственные средства в фармакотерапии патологии клетки / под редакцией Т.Г. Кожока.-М., 2007.
Фагоцитоз при вирусной инфекции. Хроническое вирусное воспаление.
Существует множество других опосредованных воздействий, ведущих к несовершенству фагоцитоза при вирусных инфекциях: дефицит Т-лимфоцитов и/или продуцируемых ими лимфокинов, активирующих МФ, нарушения в системе аутостимуляции и аутоингибиции макрофага, выражающиеся в диспропорции биологически активных веществ (компоненты комплемента, интерферон, ферменты и т.д.)
Наиболее тесная связь вирусов в процессе воспаления с макрофагами находит свое отражение в особенностях ферментативно-альтерирующих процессов в бронхолегочной системе. При этом секретируются не сериновые, а металлопротеиназы (коллагеназа, эластаза), ответственные за разрастание соединительной ткани и развитие эмфиземы. В отличие от коллагеназы нейтрофилов коллагеназа, продуцируемая активированными макрофагами, менее активна в отношении коллагена I типа, однако обеспечивает более пролонгированный, менее острый характер деструкции, в основе которой лежит циклическая закономерность: лишенные гликозамино-гликанового окружения и расщепленные коллагеназами пучки коллагена лучше связывают фибронектин и хемотаксические факторы, что способствует притоку их новых порций. Круг замыкается и начинается вновь. Вслед за альтерацией наступает период пролиферации соединительной ткани. Усилению фиброзирующих процессов способствуют и клетки поврежденной легочной паренхимы, которые активируют цепочку Т-лимфоциты - лимфокины - макрофаги.
Особенностью хронического вирусного воспаления, наряду с длительной продукцией металлопротеиназ, является нередкое размножение вирусных агентов внутри макрофага, процесс проникновения через Fc рецепторы значительно облегчается в условиях большого количества противовирусных антител и иммунных комплексов, что нередко отмечается при таких хронических формах бронхолегочной патологии, как хроническая обструктивная болезнь легких и бронхиальная астма. Избыток антител, как показали исследователи США, к сожалению, обладает не только противовирусным, но и выраженным повреждающим воздействием на клетки, в основе которого лежит активный протеолиз.
Несмотря на колоссальную роль макрофагов в развитии воспалительных реакций при вирусных инфекциях, они представляют лишь часть поступенчатой защиты организма. Основные реакции могут быть условно подразделены на два этапа: неспецифический и специфический.

В неспецифический этап воспаления включается следующее:
- презентация антигена Т-хелперам с помощью антиген-презентующих клеток (АПК): макрофагов, клеток Лангерганса в коже, вуалевых клеток лимфатических сосудов и дендритных клеток селезенки;
- секреция активированными АПК растворимых медиаторов воспаления, прежде всего интерлейкина-1 (а и (3 ), который через многообразные клетки-мишени (нейтрофилы, макрофаги, Т- и В-лимфоциты, фибробласты, гепатоциты и т.д.) стимулирует продукцию ряда других биологических веществ - цитокинов. Последние подразделяют на монокины - продукты моноцитов и макрофагов, а также лимфокины - продукты лимфоцитов.
Монокины (ИЛ-1, фактор некроза опухоли, интерфероны а и (3, a также натуральные киллерныс клетки (НК), появляются в первую очередь (через 1-2 часа от начала вирусной стимуляции) и осуществляют первую линию противоинфекционной защиты.
Лимфокины (большая часть остальных интерлейкинов) регистрируются позднее: так, ИЛ-2 через 2 часа, ИЛ-4 через 4 часа, ИЛ-10 через 6 часов, и, наконец, ИЛ-9 через 24 часа от начала антигенной стимуляции. Пики выработки лимфокинов определяются в пределах от 24 до 72 часов. Более поздние сроки формирования лимфокинов связаны с необходимостью предварительной дифференцировки СД4+ - Т-клеток в хелперы двух основных классов (1 и 2), требующей синтеза ряда новых белков. Лимфокины, как правило, ответственны за вторую специфическую линию защиты.
Несмотря на различное происхождение, принципы действия обеих разновидностей цитокинов одинаковы: выраженная локальность воздействия, преимущественно в очаге поражения органа; при первичной встрече с вирусом цитокины практически не поступают в кровоток и лишь при интенсивном и длительном воспалении, чаще при хронических бронхолегочных процессах и хронических вирусных инфекциях, удается обнаружить значительные уровни монокинов и лимфокинов как в очаге воспаления, так и в крови.
Большое разнообразие цитокинов и нередкая стандартность клеточного ответа на различные стимулы приводит к значительному перекрыванию одних и тех же иммунных защитных реакций. Подобный дубляж обеспечивает большую надежность защиты от чужеродного агента.
Варианты взаимодействия цитокинов чрезвычайно сложны, многообразны и до конца не изучены. Не уточнен характер отношений между макрофагами и Т-хелперами 2 типа. Полагают, что источником иммунного гамма-интерферона (лимфокина) и ИЛ-4, которые соответственно стимулируют продукцию Т-хелперов 1 и 2 типов, могут служить активированные натуральные киллеры и тучные клетки, осуществляющие антигеннеспецифический контроль. Между Т-хелперами 1 и 2 типа на уровне цитокинов отношения взаимоингибирующие, опосредованные через гамма-интерферон и ИЛ-10.
Помимо противовоспалительного воздействия цитокинов, к числу важнейших факторов противовирусной защиты следует отнести антигенспецифическое цитолитическое (ЦТЛ) воздействие Т-лимфоцитов (СД8+). Они представляют собой чрезвычайно важные эффекторы, препятствующие развитию вирусных инфекций, однако при определенных условиях способны повреждать и обширные участки ткани больного. Наиболее существенно, что индукция и экспрессия цитотоксичности лимфоцитов осуществляется в соответствии с основными классами гистосовместимости (HLA -А, -В и -С антигенам у человека). Для индукции Т-цитотоксического ответа вирус обязательно должен быть презентован и распознан в комплексе с клеточными антигенами хозяина, возможно, что при этом вирусный антиген включается в плазматическую мембрану презентующих клеток. Максимум Т-цитотоксической активности наблюдается примерно через 5-9 часов дней от начала ее регистрации, затем образуются клетки памяти; после вторичного контакта с вирусом определенной разновидности цитолитическое и одновременно иммуносупрессорное воздействие Т-лимфоцитов СД8+ выявляется в более ранние сроки. Учитывая эти факты, не удивительно, что более неблагоприятно протекают повторные ОРЗ, обусловленные одной и той же разновидностью вируса, а не частые ОРЗ, вызванные различными вирусными агентами.
Читайте также:
