Свойства мРНК антител. Структура мРНК иммуноглобулинов
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Классы иммуноглобулинов. Структура цепей иммуноглобулинов
В настоящее время антитела и некоторые близкие к ним белки относят к особой группе гликопротеидов, называемых иммуноглобулинами. Всем им присущ ряд общих черт: близкие антигенные и химические свойства, одинаковые принципы построения молекул и общее филогенетическое происхождение. По-видимому, все иммуноглобулины — как «нормальные», так и «патологические», встречающиеся в повышенном количестве при некоторых пролиферативных заболеваниях лимфатической системы,— являются антителами к каким-либо антигенам.
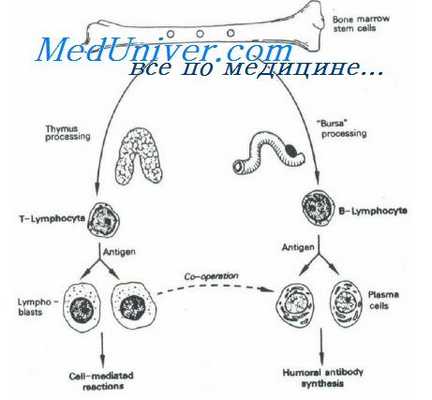
Молекулы иммуноглобулинов, как уже отмечалось во Введении, строятся из «тяжелых» и «легких» полипептидных цепей. Классы иммуноглобулинов отличаются друг от друга своими тяжелыми цепями. У человека насчитывается пять классов этих белков (IgG, IgM, IgA, IgD и IgE), тяжелые цепи которых обозначают соответственно греческими буквами у, а и е.
Легкие цепи молекулы иммуноглобулинов человека и большинства животных бывают двух типов: каппа и ламбда. Оба типа легких цепей могут входить в состав молекул всех классов иммуноглобулинов. Молекулы IgM и полимерные молекулы IgA содержат, кроме того, по одной J-цепи, а полимерные IgA — еще и так называемый секреторный компонент.
Обычно большая часть антител относится к классу IgG. В первый период иммунного ответа, однако, значительная часть антител принадлежит к IgM, которые являются, по-видимому, филогенетически наиболее древними. IgA обладают свойством проникать в секреты — слюну, молозиво, кишечный сок и др. Антитела типа реагинов относятся к IgE.
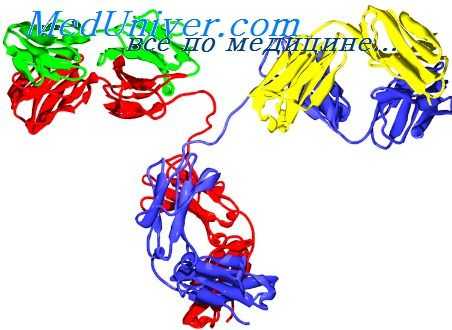
Структура цепей иммуноглобулинов
Выяснение последовательности аминокислот в пептидных цепях иммуноглобулинов затруднено гетерогенностью этих белков. Антитела к данному антигену, выделенные даже в чистом виде, почти всегда неоднородны. Одной из причин этой неоднородности следует прежде всего назвать наличие у большинства антигенов нескольких антигенных детерминант, к которым образуются различные по специфичности антитела.
Кроме того, антитела даже к одной детерминанте могут принадлежать к разным классам и подклассам иммуноглобулинов. Далее следует упомянуть и о том, что в ходе иммунного ответа могут меняться свойства самих антител.
Возможность изучения химической структуры иммуноглобулинов появилась после обнаружения так называемых патологических иммуноглобулинов, встречающихся при некоторых лимфопролиферативных заболеваниях у человека и животных. Эти иммуноглобулины очень сходны с нормальными, но отличаются от них гомогенностью. В последнее время проводятся исследования по получению однородных антител путем иммунизации гомогенными антигенами.
В ряде случаев удалось выработать достаточно большие количества гомогенных препаратов, пригодных для определения последовательности аминокислотных остатков в их полипептидных цепях.
Начиная с 1965 г. была проделана большая работа по расшифровке первичной структуры пептидных цепей иммуноглобулинов, которая в 1969 г. ознаменовалась крупным успехом: группой Эдельмана была установлена полная последовательность аминокислот в обеих цепях одного иммуноглобулина (IgG l Eu) (Edelman, 1973).
Наиболее важным результатом этих исследований явилось обнаружение у тяжелых и легких цепей двух резко различных областей — вариабельной (V) и постоянной (С). Цепи данного класса (подкласса) и типа различаются только по последовательности V-областей (идиотипические вариации), тогда как С-области у них идентичны, за исключением небольших отличий, обусловливающих аллельные (аллотипические) вариации. В то же время различия между классами (подклассами) и типами цепей определяются неодинаковым строением С-областей (изотопические вариации).
Столь необычное строение цепей станет понятным, если вспомнить, каковы их биологические функции. Основным назначением иммуноглобулинов как антител является образование комплексов с антигенами, и в этом отношении они высокоспецифичны и резко отличаются друг от друга. В то же время разные по специфичности антитела обладают рядом общих биологических функций: связывание комплемента, фиксация на мембранах и прохождение через них. Такая двойственность свойств отражается в соответствующей двойственности структуры.
По всей видимости, строение V-областей обусловливает специфические свойства антител, поскольку они строят активный центр, тогда как С-области обеспечивают свойства, общие для всех антител данного класса и типа.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Свойства мРНК антител. Структура мРНК иммуноглобулинов
Выделение относительно чистых препаратов мРНК позволило перейти к прямому изучению их физико-химических свойств и структуры. Сразу же обнаружилось, что константы седиментации, а следовательно, и молекулярные веса и размеры мРНК, кодирующих Н- и L-цени, значительно выше ранее предполагавшихся. Константы седиментации мРНК для Н-цепей определены ровными 12—17S (Namba, Hanaoka, 1969; Bernardini, Tonegawa, 1973; Cowan e. a., 1976), а для L-мРНК —12— 15S (Tonegawa, Baldi, 1973; Mach e. a., 1973; Schechter e. a., 1976).
Соответственно молекулярные веса этих мРНК составляют 440 000 в случае L-мРНК, а не 220 000, как считалось ранее, и 650 000, а не 400000 для Н-мРНК. Число нуклеотидов в L-мРНК составляет 1100—1250, а в Н-мРНК —1900.
Легко подсчитать, что для синтеза L-цепи, состоящей из 214 аминокислотных остатков, требуется всего ~650 нуклеотидов (м. в. 220 000). Для синтеза предшественника, содержащего дополнительно 20 NH2-концевых и 25 СООН-концевых аминокислотных остатков, требуется еще 60 и 75 нуклеотидов (м. в. 45 000). Итого для синтеза предшественника L-цепи достаточно 785 нуклеотидов, т. е. ~65% всех имеющихся в мРНК.
Аналогично для синтеза Н-цепей, состоящих из 450 аминокислот, требуется 1350 нуклеотидов, а в Н-мРНК, как мы видели, входит 1900. Таким образом, число экстр а нуклеотидов в этом случае составляет 650. Что же представляют собой «неиспользуемые» 30% нуклеотидов, где они расположены и какова их функция?
Изучение строения двух мРНК, кодирующих L-цепи (Brownlee е. а., 1973; Faust е. а., 1974), и одной мРНК, кодирующей Н-цепь (Вегпаг-dini, Tonegawa, 1973, 1974) показало, что 200 нуклеотидов (м. в. 65000) в этих мРНК приходится на долю полиА-последовательности, располагающейся на 3'-конце молекул. Функция их пока неясна. Очевидно лишь, что поскольку полиА-нуклеотиды обнаружены у всех исследованных до сих пор мРНК, кодирующих синтез белков как связанными, так и свободными полирибосомами (Rosenfeld е. а., 1972), то специального отношения к синтезу секретируемых белков вообще и иммуноглобулинов в частности они не имеют.
Известно, что полиА-конец присоединяется к молекуле мРНК уже после завершения ее синтеза. Предполагается, что полиА-участок играет роль при транспорте мРНК из ядра в цитоплазму, однако наличие полиА-участка в вирусном геноме, реплицирующемся в цитоплазме, свидетельствует о том, что у полиА-нуклеотидов должны быть и другие функции. Не исключено, что участок полиА нужен для изменения вторичной и третичной структуры мРНК и повышения ее стабильности или для связывания мРНК с полирибосомами; может быть, он играет роль в трансляции мРНК, хотя однозначно это не доказано (Rosenfeld е. а., 1972).
Кроме 200 нуклеотидов, приходящихся на долю участка полиА, в L-мРНК остается еще 200 нуклеотидов, не транслируемых и неизвестно где расположенных.
В L-цепьевой мРНК из клеток МОРС 41 недавно были найдены незначительные количества N6-метилгуанозина и N7-метилгуанозина, расположенного на 5'-конце и связанного с соседними нуклеотидами 5',5'-пирофосфатной связью. Сейчас известно, что наличие метилгуанидилового остатка на 5'-конце необходимо для стабилизации и трансляции мРНК у эукариотов.
Данные по расшифровке строения мРНК носят предварительный характер. По свидетельству самих авторов, неточно определены размеры нетранслируемого участка на 5'-конце мРНК; пока только 194 нуклеотида удалось «приписать» кодируемой области белковой цепи, состоящей из 75 аминокислот (из 214 во всей L-цепи).
Сходная работа была проведена и с мРНК, кодирующей Н-цепи МОРС 21 (Cowan е. а., 1976). Использование одного из мутантов МОРС 21, синтезирующего Н-цепи с делецией Сн1 -домена, позволило расшифровать 18 олигонуклеотидов, содержащих 202 основания и принадлежащих как V-, так и С-областям. В Н-мРНК также были обнаружены полиА- и нетранслируемые нуклеотиды.
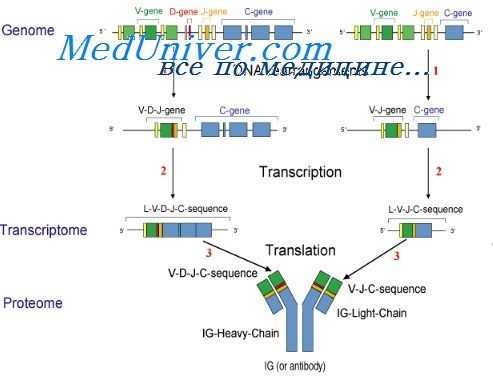
Необходимо отметить, что принципиальное значение результатов, полученных в этих опытах, заключается еще и в том, что они окончательно решили вопрос о синтезе Н- и L-цепсй как единого целого и о слиянии информации о структуре V- и С-областей на уровне ДНК-Действительно, в L-мРНК удалось не только выявить последовательности нуклеотидов, кодирующие V- и С-области, и показать, что они расположены на одной молекуле, но даже выделить олигонуклеотид, кодирующий остатки 105—108, т. е. место сочленения V- и С-областей.
Как мы видели ранее, аналогичные данные были получены и с помощью другого подхода также на молекулярном уровне.
Кроме того, в пользу слияния V- и С-генов на уровне ДНК и считывания информации уже с таких объединенных генов, как с одного гена, свидетельствуют опыты с соматическими гибридами клеток, продуцирующих иммуноглобулины, различающиеся по своим V- и С-областям (Margulies е. а., 1977; Milstein е. а., 1977). Ни в одном из таких опытов не наблюдалось образования рекомбинаптных молекул, содержащих V-область, кодируемую одним партнером, а С-область, кодируемую другим.
мРНК участвующие в синтезе антител. Методы изучения мРНК
В настоящее время наметилось два подхода — химический и иммунохимический. В основе первого лежит химическое фракционирование мРНК, выделенных из клеток, продуцирующих иммуноглобулины. Основными этапами являются: выделение из мисломных клеток микросом или связанных с мембранами полирибосом (Stavnezer е. а., 1971; Milstein е. а., 1972); экстракция из них РНК в условиях, предупреждающих их деградацию; фракционирование РНК в градиенте плотности сахарозы; выделение фракций, соответствующих по размерам предполагаемой мРНК; очистка их от рибосомальных РНК на колонках с олиго((1Т)- или поли (У)-целлюлозой (или сефарозой), задерживающих только богатые аденнловыми основаниями мРНК (полиА-мРПК), и исследование биологической активности выделенных фракций.
В ряде случаев для дополнительной очистки препаратов мРНК используется электрофорез в полнакрпламидном геле в присутствии 99%-ного формамида (Farace е. а., 1976; Matthyssens с. а., 1976). С теми или иными вариациями приведенная выше схема используется в настоящее время подавляющим большинством исследователей. Выход индивидуальной полиА-мРНК обычно составляет 0,01% от внесенного количества РНК (Brownlee е. а., 1973). В результате в настоящее время выделено нз плазмоцитом МОРС 70Е, МОРС 21, МОРС 41 несколько мРНК, кодирующих как Н-, так и L-цепи. Чистота большинства этих препаратов не превышает 40—60%.
Лишь одной группе авторов удалось недавно таким способом получить мРНК более чем 90%-ной чистоты (Matthyssens е. а., 1976). Это не удивительно. Использованный метод основан, во-первых, на разделении молекул РНК по их молекулярному весу и, во-вторых, на отделении популяции полиЛ-содержащих РНК от лишенных ее.
Естественно, что в клетках может присутствовать ряд мРНК с аналогичными свойствами, не имеющих отношения к иммуноглобулинам. Все эти РНК неизбежно будут загрязнять препараты индивидуальной иммуноглобулиновой РНК. Очевидно, что в зависимости от относительной доли синтезируемого клетками иммуноглобулина этих примесей будет либо больше, либо меньше.
Поэтому для выделения мРНК из миелом, синтез иммуноглобулинов в которых достигает 30—40% от синтеза всех белков вообще, этот метод может быть использован; в то же время для выделения мРНК, кодирующих синтез иммуноглобулинов, из нормальных лимфоидных тканей, особенно из чрезвычайно гетерогенной по клеточному составу селезенки, он явно непригоден.
Значительно более перспективным, с нашей точки зрения, является иммунохимический подход к решению этой проблемы. Преимущество его заключается в том, что уже первый этап фракционирования предполагает строго специфическое выделение индивидуальных полирибосом с помощью антител к синтезируемому этими полирибосомами белку. Существует три варианта этого метода. Первый — осаждение полирибосом антителами к синтезируемому ими белку в присутствии носителя, т. е. того же самого белка (копреципитация) (Delovitch е. а., 1972; Laskov, Mitelman, 1975).
Второй — обработка полирибосом антителами к синтезируемому ими белку и осаждение полученного комплекса антисывороткой к антителам (непрямая преципитация) (Schechtcr, 1973, 1974а). И третий — извлечение индивидуальных полирибосом с помощью иммуносорбентов, содержащих ковалентно или нековалентно связанные антитела к синтезируемому на полирибосомах белку (Сидорова и др., 1973; Sidorova с. а., 1974; Любимова и др., 1975). Из полученных таким образом индивидуальных полирибосом тем или иным способом экстрагируют полисомные РНК и извлекают мРНК, пропуская эту смесь через колонки с олиго- или поли (У)-целлюлозой. С помощью иммунохимического подхода удалось получить препараты мРНК примерно 95%-ной чистоты.
Что такое иммуноглобулины и зачем они нужны
зложена на разныеЧеловеческий иммунитет – это сложная многоступенчатая система защиты организма от вредоносного воздействия извне (вирусов, бактерий, аллергенов, грибков). Не существует одного органа, который бы отвечал за иммунную защиту. Эта функция возложена на разные органы иммунной системы: начиная с лимфатических узлов до кишечника и заканчивая белковыми веществами – иммуноглобулинами.
Общая характеристика иммуноглобулинов
Иммуноглобулины (Ig), или антитела, представляют собой гликопротеины, имеющие в своем составе центры специфического нековалентного связывания антигена, основанного на принципе комплементарности. Существуют растворимые формы иммуноглобулинов, которые и называют антителами, и мембранные формы иммуноглобулинов, составляющие основу В-клеточных рецепторов на поверхности В-лимфоцитов. Иммуноглобулины содержатся в крови и в некоторых секреторных жидкостях и вырабатываются как ответ на контакт с антигенами, например, бактериями или вирусами. Иногда иммуноглобулины продуцируются после контакта с собственными тканями организма, называемыми аутоантигенами.
Дефицит или избыток антител может быть признаком различных патологий, поэтому определение их количества в крови является важной частью при диагностике многих заболеваний. Кроме того, современные достижения в биомедицине позволяют использовать синтетические антитела в лечении некоторых заболеваний.
Структура антител
Иммуноглобулины – это симметричные Y-образные молекулы, состоящие из двух тяжелых длинных (Н) и двух коротких легких (L). цепей, которые соединены друг с другом либо дисульфидными (SS), либо водородными связями. Каждая молекула иммуноглобулина содержит не менее двух идентичных Н-цепей. Тяжелые цепи иммуноглобулинов разных классов состоят из четырех или пяти доменов и обозначаются буквами греческого алфавита соответственно латинской аббревиатуре класса. Принадлежность антитела к конкретному классу и подклассу называют изотипом, который обозначается по типу тяжелой цепи.
Легкие цепи построены из двух доменов. В их составе обязательно находится два вида доменов – вариабельный (V – variable) и константный (С-coпstaпt). Иммуноглобулины, продуцируемые разными клонами плазматических клеток, имеют разные по аминокислотной последовательности вариабельные домены. Константные домены сходны или очень близки для каждого изотипа иммуноглобулина. Вариабельные домены являются N-концевыми. В составе легкой цепи N-концевой домен является вариабельным (VL), С-концевой домен – константным (CL). Тяжелые цепи имеют один вариабельный (N-концевой) домен (Vн) и несколько константных доменов. Легкие и тяжелые цепи иммуноглобулинов гликозилированы.
Иными словами, каждое антитело подходит к антигену по принципу ключа и замка, а при соединении образуют иммунные комплексы. Но также антитела способны проявлять гибкость чужеродных агентов, благодаря чему с легкостью адаптироваться к различным антигенам. Однако эта способность иммуноглобулинов иногда провоцирует у человека перекрестные аллергические реакции – когда иммунитет человека с аллергией не может различать аллергены. Например, человек с аллергией на цветочную пыльцу вследствие “ошибки” иммуноглобулинов может также реагировать на сырые фрукты и овощи.
Разновидности иммуноглобулинов
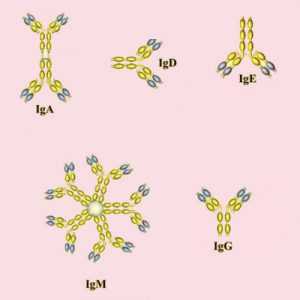
В человеческом организме иммуноглобулины представлены в двух формах:
- растворимые (продуцируются плазматическими клетками);
- связанные с наружной мембраной B-лимфоцитов, они же – рецепторные антитела.
Кроме того, существуют разные классы и подклассы (изотопы) иммуноглобулинов. Они различаются по своим биологическим особенностям, структуре и нацеленности на «мишени». На основе различий в структуре тяжелых цепей было выделено несколько классов антител. Каждый из них отличается функциями и ответными реакциями.
Кроме основных классов иммуноглобулинов существует несколько подклассов. Разница между ними основана на незначительных отличиях в типе тяжелых цепей каждого класса. В человеческом организме встречаются 4 подкласса антител. Нумерация соответствует порядку уменьшения их концентрации в сыворотке. Так, антитела IgG и IgA дополнительно группируют на подклассы IgG1, IgG2, IgG3, IgG4, а также IgA1 и IgA2.
Большинство антител (IgG, IgD, IgE) в организме представлены в форме мономера (одной молекулы). Исключение составляет антитела класса А, которые также встречается в форме димера, и IgМ, образующий форму снежинки (пентамер).
Характеристика разных классов иммуноглобулинов
Класс IgA
Около 15% антител, содержащихся в организме здорового человека, это иммуноглобулины класса IgA, которые разделяются на два подкласса IgA – IgA1 и IgA2. Они различаются молекулярной массой тяжелых цепей и концентрацией в сыворотке, где IgA представлен в основном как мономер, с молекулярной массой 160 кДа. В секреторных жидкостях иммуноглобулины присутствуют в виде димера, образованных двумя мономерами, их содержание составляет 10-15% от общего количества сывороточных иммуноглобулинов. Димерные иммуноглобулины присутствуют в большинстве секреторных жидкостей, включая слизистые оболочки дыхательных и мочеполовых путей, ЖКТ, а также слюну, слезы, молозиво и молоко у женщин. Поскольку IgA присутствует на слизистых оболочках пищеварительной системы, где он может подвергаться воздействию ферментов, в его составе есть специальный компонент, который защищает молекулу от преждевременного разрушения.
Иммуноглобулины класса A, как правило, не являются специфическими с точки зрения «подстраивания» под специфический антиген. Обычно антитела из этой группы присутствуют в уязвимых местах организма или на участках, где микробы могут легко проникнуть внутрь. Иммуноглобулины класса A обеспечивают местный гуморальный иммунитет. Это связано с их свойствами предотвращать проникновение патогенов через эпителиальные поверхности, благодаря присутствию IgA в секрете слизистых оболочек (слюна, слезы) он защищает организм от некоторых локальных инфекций.
Основная функция иммуноглобулинов этого класса состоит не в разрушении антигенов, а в предотвращении проникновения инфекционных агентов в систему кровообращения. Сами по себе IgA не способны самостоятельно разрушать бактерии, поэтому они всегда работают вместе с лизоцимами – ферментами, которые также присутствуют в секреторных жидкостях и могут разрушать бактерии.
Нарушения концентрации иммуноглобулинов класса IgA в организме способствуют его восприимчивости к инфекционным заболеваниям дыхательных путей и мочеполовой системы, в том числе нефропатии. Лица, с недостаточностью IgA, более склонны к аутоиммунным расстройствам, таким как ревматоидный артрит, волчанка, аллергия и астма.
К снижению содержания IgA могут привести разные заболевания, среди которых – гонорея. Бактерии, вызывающие гонорею, продуцируют фермент, который расщепляет IgA на две части: Fc и Fab фрагменты. Что интересно, Fab все еще может находить опасные для организма бактерии, но без взаимодействия с Fc он не способен противостоять им.
Класс IgD
Иммуноглобулины класса D в организме человека представлены в очень маленьком количестве и составляют примерно 0,2% от всех антител. Известно, что IgD прикрепляется к поверхности некоторых В-лимфоцитов как рецептор В-клеток. Тем не менее его функции в человеческом организме на сегодня до конца еще не изучены. Предполагается, что именно IgD является причиной аллергии на пенициллин, а также он может участвовать в запуске аутоиммунных реакций.
Класс IgE
Иммуноглобулин IgE в норме составляет не более 0.1% от общего количества сывороточных иммуноглобулинов. Более 90% синтезируемого плазматическими клетками IgE секретируется в слизистых экзосекретах желудочно-кишечного тракта. Биологическая функция заключается в защите от внеклеточных паразитов, хотя она полностью не выяснена, и резкое увеличение количества IgE является патогенетическим признаком при аллергических реакциях.
Иммуноглобулины этой группы связываются с поверхностью базофилов и тучных клеток. Дальше к ним присоединяется антиген, что в свою очередь ведет к выбросу в кровоток вазоактивных аминов и развитию IgE-зависимой аллергической реакции по следующему механизму.
Различные антигены, такие как пыльца, ядовитые вещества, споры грибов, пылевые клещи или перхоть домашних животных связываются с IgE и запускают высвобождение гепарина, гистамина, протеолитических ферментов, лейкотриенов и цитокинов. Это ведет к расширению сосудов и повышению их проницаемости, что способствует проникновению чужеродных агентов в капилляры, а затем и в ближайшие ткани, вследствие чего развиваются характерные для аллергической реакции симптомы. Однако, большинство типичных аллергических реакций в виде чихания, кашля, слезотечения и повышенного выделения слизи способствует выведению из организма оставшихся аллергенов.
Исследования показали, что такие расстройства, как астма, ринит, экзема, крапивница и дерматит вызывают повышение уровня IgE. Антитела Е-типа также активно продуцируются в ответ на присутствие в организме гельминтов, персистирующих инфекций (герпесвирусы, атипичные микроорганизмы) и некоторых членистоногих (например, вшей). Кроме того, IgE играет косвенную роль в иммунном ответе, стимулируя другие иммунные компоненты. Также он может защищать поверхности слизистых оболочек, вызывая, в случае опасности, воспалительные реакции.
Патологически низкий уровень антител класса IgE может возникать на фоне редкого генетического заболевания, сопровождающегося нарушением координации мышц (атаксия телеангиэктазия).
Класс IgG
Иммуноглобулины класса G являются доминирующими в человеческом организме. На их долю приходится 75% всех антител. Частично это связано с длительным периодом полураспада: от 7 до 23 дней (зависимо от подкласса). Кроме того, они могут сохраняться в крови в течение нескольких десятков лет после контакта с антигеном.
Существуют 4 подкласса IgG:
- IgG1 составляет от 60 до 65% от общего количества иммуноглобулина этого класса. Его дефицит обычно является признаком гипогаммаглобулинемии (дефицит плазматических клеток).
- IgG2 – второй по распространенности изотоп, составляет 20-25% от общего количества IgG. «Взрослые» концентрации антитела обычно появляются к 6-7-летнему возрасту. Дефицит IgG2 связывают с рецидивирующими инфекциями дыхательных путей.
- IgG3 занимает от 5 до 10% от общего IgG. Играет основную роль в иммунных реакциях против белковых или полипептидных антигенов.
- IgG4 составляет до 4% в общей доле IgG. Раньше IgG4 связывали только с пищевой аллергией, но недавние исследования показали, что повышение IgG4 в сыворотке отмечается у пациентов, страдающих склерозирующим панкреатитом, холангитом и интерстициальной пневмонией. Тем не менее точная роль IgG4 до сих пор неизвестна.
IgG играет ключевую роль в гуморальном иммунном ответе. Это основной иммуноглобулин, содержащийся в крови, а также в лимфатической, спинномозговой и брюшной жидкостях. Способность оставаться в организме в течение длительного времени делает его наиболее полезным антителом для пассивной иммунизации. Это единственное антитело, способное проникать через плаценту матери и попадать в кровообращение плода, обеспечивая послеродовую защиту новорожденного в течение первых месяцев его жизни.
Главные функции IgG:
- усиление фагоцитоза в макрофагах и нейтрофилах;
- нейтрализация токсинов;
- инактивация вирусов;
- уничтожение бактерий.
Класс IgM
IgM – это самый важный представитель семейства человеческих иммуноглобулинов, хотя он и отличается весьма коротким периодом полураспада – около 5 дней.
Иммуноглобулины класса IgM в общей доле сывороточных антител в человеческом организме составляют примерно 10-13%. Они участвуют в первичных иммунных реакциях и обладает выраженной антибактериальной активностью, способностью связывать комплемент, не проникают через плацентарный барьер. Первыми синтезируются в ответ на антигенную стимуляцию организма. Наиболее ранние антитела относятся к иммуноглобулинам класса М, что нередко используется в диагностике инфекционных заболеваний. Они же первыми появляются в процессе онтогенеза и филогенеза.
Повышение уровня IgM можно расценивать как признак недавно перенесенной инфекции или присутствия в организме антигена. На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора.
Роль иммуноглобулинов в организме
Антитела являются частью гуморального иммунного ответа и действуют очень специфично, так как всегда направлены против определенного антигена.
Задача любого антитела в организме человека – участвовать в иммунных реакциях. Иммуноглобулины обладают способностью образовывать иммунные комплексы с молекулами антигена, активировать систему комплемента (комплекс белков, содержащихся в крови, необходимых для защиты организма от чужеродных агентов) и вызывать воспаления. Все эти действия направлены на нейтрализацию антигена и безопасное удаление его из организма.
Вследствие различных структурных свойств разные классы антител могут выполнять специализированные функции:
- нейтрализовать паразитов (IgE);
- нейтрализовать микроорганизмы (IgM, IgG);
- защищать от повторных заболеваний, таких как эпидемический паротит (IgG);
- защищать слизистые оболочки (IgA);
- участвовать в синтезе лимфоцитов (IgD);
- защищать плод (IgG) и новорожденного малыша (IgA).
Антитела и иммунологическая память
Иммунный ответ делится на первичный и вторичный. Первичный ответ проявляется во время первого контакта с антигеном, после чего организм сначала вырабатывает иммуноглобулины класса IgM, которые затем замещаются более специфическими и стабильными антителами IgG.
Вторичный иммунный ответ возникает при повторном контакте с тем же антигеном. Он интенсивнее первичного, концентрация антител достигает более высоких уровней, чем в первый раз.
Такой эффект обусловлен иммунологической памятью, которая опосредована В-имфоцитами. Это долгоживущие клетки которые вступают в контакт с антигеном, начинают очень интенсивно делиться и продуцировать специфические антитела.
Как определяется количество антител
Антитела составляют от 12% до 18% сывороточных белков. Количества отдельных белковых фракций, в лабораторных условиях определяется на основании протеинограмм.
Тест на антитела методом иммуноферментного анализа (ИФА), как правило, проводится с венозной кровью (позволяет определить количество иммуноглобулинов класса IgM, IgG, IgE, IgA). Кроме того, определить количество антитела класса IgA можно путем биохимического исследования слюны или кала человека – методом полимеразной цепной реакции (ПЦР). В отдельных ситуациях тест может быть проведен с использованием другого материала, например спинномозговой жидкости.
Если в крови пациента диагностировано критическое повышение некоторых иммуноглобулинов, говорят о гипергаммаглобулинемии. Как правило, у таких пациентов чрезмерно повышаются антитела класса IgM, при этом остальные остаются в дефиците.
На фоне патологического повышения некоторых антител могут развиваться разные заболевания, в том числе:
- острые и хронические воспаления;
- паразитарные, бактериальные, вирусные или грибковые заболевания;
- аутоиммунные болезни;
- цирроз печени;
- саркоидоз; .
Патологически низкое количество антител в сыворотке может возникать на фоне:
- врожденных генетически расстройств;
- приема некоторых противомалярийных, цитостатических, глюкокортикоидных препаратов;
- недоедания;
- инфекции, в том числе ВИЧ;
- онкологических заболеваний;
- нефротического синдрома;
- обширных ожогов;
- тяжелой диареи.
Иммуноглобулины и вакцинация
Антитела играют ключевую роль в развитии иммунитета после вакцинации. В результате контакта с антигеном, содержащимся в вакцине, иммунная система вырабатывает антитела. Сначала менее стойкий и специфический IgM, а затем более стойкий IgG. Например, во время вакцинации против вируса гепатита В, вакцину вводят трижды с определенным интервалом между прививками. Это позволяет создать стойкий иммунитет к болезни. Эффективность такой вакцинации определяется изменением в организме количества антител IgG.
Антитела в медицине
Благодаря развитию биохимии, молекулярной биологии и медицины, в наше время стало возможным синтезировать иммуноглобулины в лабораторных условиях (как правило, антитела класса IgG). Такие антитела называются моноклональными, так как они происходят из клона одной клетки и работают против определенного антигена.
Сегодня моноклональные иммуноглобулины используют для лечения разных заболеваний. Впервые эта методика была применена в 1981 году для лечения лимфомы. А уже в 1984 году изобретатели моноклональных антигенов – немецкий биолог Георг Келер и британский иммунолог Сезар Мильштейн – получили Нобелевскую премию.
В современной медицине моноклональные антитела применяют для:
- уничтожения раковых клеток;
- ингибирования отдельных клеток иммунной системы после трансплантации органов (позволяет предотвратить отторжение пересаженного органа);
- подавления иммунных реакций при аутоиммунных заболеваниях.
Иммунный ответ на каждый отдельный антиген включает продукцию множества молекул антител, синтезируемых разными плазматическими клетками, и имеющих разное строение активного центра и изотип. Вследствие различий в строении активных центров образующиеся антитела имеют различную специфичность и аффинность.
Специальность: врач педиатр, инфекционист, аллерголог-иммунолог .
Научная электронная библиотека

Антитела (иммуноглобулины, ИГ, Ig) – это особый класс гликопротеинов (т.е. белков с присоединенных к ним углеводными остатками), присутствующих в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на вещества определенной структуры – антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных и нежелательных эндогенных объектов – например, бактерий и вирусов, опухолевых клеток и др. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом – характерным фрагментом антигена.
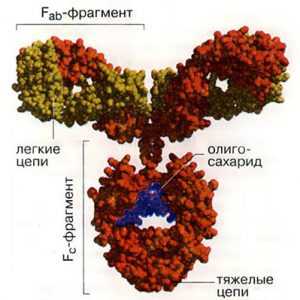
Антитела являются относительно крупными (~150 кДа для IgG) гликопротеинами, имеющими сложное строение. Антитела состоят из двух идентичных тяжелых цепей и из двух идентичных лёгких цепей, т.е.
фрагментов с меньшим и большим молекулярным весом (рис. 3). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding – антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable – фрагмент, способный к кристаллизации). Fab фрагменты называются также вариабельной областью антител, т.к. именно их строение определяет связывающую функцию Ат и варьируется в зависимости от структуры антигена. Fc фрагмент называется константной областью Ат, т.к. у особей данного вида для всех молекул Ат этот фрагмент является идентичным.
Рис. 5. Структура антител
В зависимости от выполняемых функций антитела могут существовать как в различных формах (классы иммуноглобулинов): мономерной (IgG, IgD, IgE, сывороточный IgA) или в олигомерной форме (димер-секреторный IgA, пентамер – IgM). Схематичное строение
Иммуноглобулины класса G (IgG) – основной иммуноглобулин сыворотки здорового человека, составляет 70–75 % всей фракции иммуноглобулинов. IgG наиболее активны во вторичном иммунном ответе и антитоксическом иммунитете. Являются единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивают иммунитет плода и новорожденного. IgG являются самыми небольшими молекулами по сравнению с другими классами Ig (молекулярная масса М = 146 кДа).
Иммуноглобулины класса А (IgA) содержатся в сыворотке (15–20 %
всей фракции Ig), в секреторном компоненте: слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой
и респираторной системы. IgA представлены в виде мономеров (80 % в сыворотке), димеров (в секрете), и тримеров. Средняя молекулярная масса IgA М = 500 кДа.
Иммуноглобулины класса М (IgM) являются пентамерами IgG и составляют до 10 % фракции иммуноглобулинов. Появляются IgM при первичном иммунном ответе B-лимфоцитами на неизвестный антиген. IgM встроены в плазматическую мембрану B-лимфоцитов и выполняют роль антиген распознающего рецептора. Средняя молекулярная масса IgМ М = 970 кДа.
Иммуноглобулины класса Е (IgE) – мономеры. Их функция заключается в связывании с поверхностью базофилов и тучных клеток, с последующим присоединением к ним антигена, при этом происходит дегрануляцию и выброс в кровь гистамина и серотонина – медиаторов воспаления. IgE участвуют в защите от паразитарных инфекций, обуславливают многие аллергические реакции. М = 200 кДа.
Рис. 6. Классы иммуноглобулинов
Антитела также классифицируют по типу антигена и, соответственно, по выполняемым Ат функциям. По этому принципу можно выжделить несколько основных классов антител:
● Антиинфекционные или антипаразитарные антитела, вызывающие гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита.
● Антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины, либо другие экзогенные токсические вещества.
● «Антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным антигеном (возбудителем) в прошлом или о текущем присутствии этого антигена (возбудителя), но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
● Естественные антитела – антитела к эндогенным соединениям, присутствующие в здоровом организме и выполняющие регулятор-
ные функции;
● Аутоагрессивные антитела, или аутологичные антитела, аутоантитела – антитела, способные образовываться из естественных антител и вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
● Аллореактивные антитела, или гомологичные антитела, аллоантитела – антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
● Гетерологичные антитела, или изоантитела – антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку). К изоантителам относятся также вторичные (антивидовые) антитела, используемые в различных видах ИХМ.
● Антиидиотипические антитела – антитела против антител, вырабатываемых самим же организмом. Этот вид антител специфичен
к вариабельному участку антител, так называемому идиотипу. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело (рис. 5). И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т.д.
Читайте также:
- Комбинированная анестезия в легочной хирургии. Недостатки эфирно-кислородного наркоза
- Мышечная ткань. Нервная ткань. Нейроны.
- КТ, МРТ при гломусной тимпанической параганглиоме
- Костный мозг при острой лучевой болезни. Морфология лучевого поражения костного мозга
- Лучевая диагностика септического артрита дугоотростчатого сустава позвоночника
