Тахикардия при приеме антиаритмиков. Тромбоэмболии при приеме антиаритмиков
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Фибрилляция предсердий – это быстрый нерегулярный предсердный ритм. Симптомы включают: перебои в работе сердца и иногда – слабость, снижение толерантности к физической нагрузке, одышку, пресинкопальные состояния. Часто имеет место образование тромбов в полости предсердий, которые являются достоверным риском эмболического инсульта. Диагностируется по электрокардиографии. Лечение включает медикаментозный контроль частоты ритма, профилактику тромбоэмболий при помощи антикоагулянтов и иногда – восстановление синусового ритма при помощи препаратов или кардиоверсии.
Фибрилляция предсердий обусловлена множественными волнами хаотического повторного возбуждения в предсердиях. Тем не менее во многих случаях играет роль запускающий эктопический фокусный очаг в венозных структурах, смежных с предсердиями (обычно легочные вены), которые ответственны за возникновение и, возможно, поддержание фибрилляции предсердий. При фибрилляции предсердий предсердия не сокращаются, АВ-соединение бомбардируется множеством электрических импульсов, проведение которых обусловливает нерегулярный желудочковый ритм, который, как правило, находится в диапазоне тахикардии.
Фибрилляция предсердий – одна из наиболее распространенных аритмий, затрагивающая около 2,3 млн взрослого населения США. Лица мужского пола и лица белой расы чаще страдают ФП по сравнению с женщинами и лицами черной расы. фибрилляцией предсердий. Распространенность увеличивается с возрастом; почти 10% людей > 80 лет страдают ФП. Мерцательная аритмия обычно возникает у пациентов на фоне уже имеющихся заболеваний сердца.
Осложнения фибрилляции предсердий
Отсутствие сокращений предсердий предрасполагает к образованию тромбов; годовой риск цереброваскулярных эмболических событий около 7%. Риск инсульта Обзор инсульта (Overview of Stroke) Инсульт – это гетерогенная группа заболеваний, обусловленная внезапным очаговым прекращением мозгового кровотока, которое вызывает развитие неврологических нарушений. Инсульты могут быть ишемическими. Прочитайте дополнительные сведения Фибрилляция предсердий также может снижать сердечный выброс; отсутствие сокращения предсердий может снижать сердечный выброс при нормосистолии примерно на 10%. Такое снижение обычно хорошо переносится, кроме случаев с повышением частоты сокращений желудочков, когда ритм становится слишком частым (например, > 140 ударов/минуту) или когда у пациентов исходно имеется пограничный или сниженный сердечный выброс. В таких случаях может развиться сердечная недостаточность Сердечная недостаточность (СН) Сердечная недостаточность (СН) – синдром дисфункции желудочков сердца. Левожелудочковая недостаточность приводит к развитию одышки и быстрой утомляемости, правожелудочковая недостаточность –. Прочитайте дополнительные сведенияЭтиология фибрилляции предсердий
Наиболее частыми причинами фибриляции предсердий явялются:
Неумеренное потребление алкоголя (синдром "праздника сердца")
Менее распространенные причины мерцательной аритмии включают:
Идиопатическая первичная фибрилляция предсердий─ это предсердная фибрилляция без установленной причины у пациентов < 60 лет.
Классификация мерцательной аритмии
Пароксизмальная фибрилляция предсердий представляет собой фибрилляцию предсердий, которая обычно длится < 1 недели и проходит самостоятельно или в результате вмешательства до восстановления нормального синусового ритма. Случаи могут повторяться.
Персистирующая форма фибрилляции предсердий – это постоянная фибрилляция предсердий, длящаяся > 1 недели.
Продолжительная персистирующая форма фибрилляции предсердий длится > 1 года, однако возможность восстановления синусового ритма все-таки существует.
Постоянная фибрилляция предсердий не может быть преобразована в синусовый ритм (под определение попадают также пациенты, для которых было принято решение не пытаться преобразовать ритм в синусовый). Чем дольше существует фибрилляция предсердий, тем меньше вероятность спонтанного восстановления синусового ритма, а кардиоверсия менее эффективна вследствие ремоделирования предсердий (изменения элекрофизиологии предсердий, вызванные быстрым предсердным ритмом, которые в основном связаны с укорочением рефрактерности предсердий и могут также включать увеличение пространственной дисперсии предсердной рефрактерности, замедленную скорость проведения в предсердии или все изменения вместе).
Симптомы и признаки фибрилляции предсердий
Фибрилляция предсердий нередко бессимптомна, но у многих пациентов возникают учащённое сердцебиение, дискомфорт в грудной клетке или симптомы сердечной недостаточности (слабость, головокружение, одышка), особенно, когда частота сокращений желудочков очень высока (140–160 уд/минуту). Также симптомы могут быть по типу острого инсульта или повреждения других органов вследствие системных эмболий.
Пульс нерегулярный с потерей a волн югулярного венозного пульса. Дефицит пульса (частота верхушечных толчков быстрее, чем частота пульса, пальпируемого на запястье) может появиться из-за того, что ударного объёма левого желудочка бывает недостаточно для образования волны периферического давления для удара, идущего сразу же за предыдущим ударом.
Диагностика фибрилляции предсердий
Функциональные тесты щитовидной железы
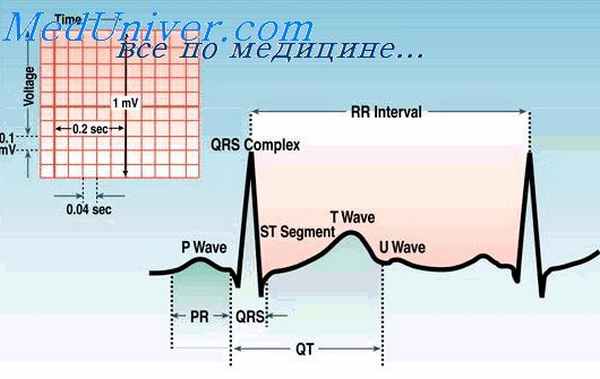
Диагноз фибрилляции предсердий устанавливается с помощью ЭКГ (см. рисунок Фибрилляция предсердий Фибрилляция предсердий ). Признаки включают:
Отсутствие зубцов P
Наличие волн f (волн фибрилляции) между комплексами QRS; волны f нерегулярны по времени, имеют неправильную морфологию; ритм предсердий составляет > 300 ударов/минуту; электрическая активность предсердий обычно лучше всего определяется в отведении V1, при этом не всегда явно выражена во всех отведениях.
Нерегулярные неправильные интервалы R-R
Фибрилляция предсердий
Другие нерегулярные ритмы могут напоминать фибрилляцию предсердий на ЭКГ, но могут быть распознаны наличием дискретных P-зубцов или волн трепетания, которые иногда могут быть более заметны при помощи вагусных проб. Тремор мышц или электрические помехи могут выглядеть как f волны, но основной ритм остается регулярным. Фибрилляция предсердий также обусловливает феномен, который имитирует желудочковые экстрасистолы или желудочковую тахикардию (феномен Ашмана). Данный феномен обычно возникает, когда короткий RR-интервал следует за длинным RR-интервалом; более длинный интервал удлиняет рефрактерный период инфрагисиальной системы проведения и последующие комплекс(ы) QRS проводятся аберрантно, обычно с морфологией блокады правой ножки пучка Гиса.
Эхокардиография Эхокардиография На данном фото изображен пациент, которому выполняется эхокардиография. На этом изображении показаны все 4 камеры сердца, а также трикупсидальный и митральный клапаны. Эхокардиография использует. Прочитайте дополнительные сведенияЗдравый смысл и предостережения
Лечение фибрилляции предсердий
В некоторых случаях: контроль ритма при помощи синхронизированной кардиоверсии Контроль ритма , лекарственных препаратов либо абляции субстрата фибрилляции предсердий
Если подозревается серьезное основное заболевание, пациентам с впервые возникшей фибрилляцией предсердий может понадобиться госпитализация; однако пациенты с повторяющимися эпизодами аритмии не требуют госпитализации до тех пор, пока не возникнут другие симптомы, требующие ее проведения. Как только причины фибрилляции предсердий установлены, лечение фокусируется на контроле желудочковых сокращений, контроле ритма и профилактике тромбоэмболий.
Контроль частоты желудочковых сокращений
У пациентов с фибрилляцией предсердий любой длительности для контроля симптомов и предотвращения тахикардия-индуцируемой кардиомиопатии требуется контроль частоты сердечных сокращений (обычно < 100 уд/минуту в покое).
Для острых пароксизмов с быстрым ритмом (140–160 ударов в минуту) применяют внутривенно препараты, блокирующие АВ-узел (информацию о дозах см. в таблице Антиаритмические препараты Антиаритмические препараты (классификация Vaughan Williams) ). ВНИМАНИЕ: Препараты, замедляющие АВ-проведение, не следует применять у пациентов с WPW-синдромом, когда проведение идет по дополнительному пути (отражается в наличии широких комплексов QRS); данные препараты повышают частоту проведения через дополнительный путь, предрасполагая к возможной фибрилляции желудочков. Бета-блокаторы (например, метопролол, эсмолол) предпочтительны, если предполагается избыток катехоламинов (например, при заболеваниях щитовидной железы, в случаях провокации физической нагрузкой). Недигидропиридиновые блокаторы кальциевых каналов (например, верапамил, дилтиазем) также эффективны. Дигоксин наименее эффективен, но может применяться при наличии сердечной недостаточности Сердечная недостаточность (СН) Сердечная недостаточность (СН) – синдром дисфункции желудочков сердца. Левожелудочковая недостаточность приводит к развитию одышки и быстрой утомляемости, правожелудочковая недостаточность –. Прочитайте дополнительные сведенияЗдравый смысл и предостережения
Препараты, замедляющие АВ-проведение, не следует применять у пациентов с Wolff-Parkinson-White синдромом Синдром Вольфа – Паркинсона – Уайта (WPW) В возникновении наджелудочковых тахикардий по механизму риентри (НЖТ) участвуют электрические проводящие пути, расположенные выше бифуркации пучка Гиса. У пациентов возникают эпизоды внезапного. Прочитайте дополнительные сведения , когда проведение идет по дополнительному пути (отражается в наличии широких комплексов QRS); данные препараты повышают частоту проведения через дополнительный путь, предрасполагая к возможной фибрилляции желудочков.
Контроль ритма
Пациентам с сердечной недостаточностью или другими нарушениями гемодинамики, непосредственно связанными со впервые возникшим эпизодом фибрилляции предсердий, показано восстановление синусового ритма с целью улучшения сердечного выброса. В других случаях восстановление фибрилляции предсердий до нормального синусового ритма оптимально, но антиаритмические препараты Антиаритмические средства Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения , используемые для купирования (классов Ia, Ic и III), имеют риск побочных эффектов и могут повышать смертность. Восстановление синусового ритма не означает прекращения приема антикоагулянтной терапии.
Для острой конверсии ритма могут быть использованы синхронизированная кардиоверсия Сердечная ресинхронизирующая терапия (СРТ) Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения или медикаментозные препараты. Перед попыткой конверсии желудочковый ритм следует удерживать на уровне < 120 уд/минуту, большинству больных должны быть назначены антикоагулянты (для критериев и методов, см. Профилактика тромбоэмболии во время контроля ритма Профилактика тромбоэмболии во время восстановления ритма Фибрилляция предсердий – это быстрый нерегулярный предсердный ритм. Симптомы включают: перебои в работе сердца и иногда – слабость, снижение толерантности к физической нагрузке, одышку, пресинкопальные. Прочитайте дополнительные сведения ). Если фибрилляция предсердий длится > 48 часов, больному, как правило, должны быть назначены пероральные антикоагулянты (восстановление ритма, независимо от используемого метода, увеличивает риск тромбоэмболии). Антикоагулянтная терапия рекомендуется на протяжении > 3 недель до кардиоверсии либо на протяжении более короткого периода, если при чреспищеводной эхокардиографии (ЧПЭ) тромбы в левом предсердии не определяются. Антикоагулянтная терапию необходимо продолжать в течение не менее 4 недель после кардиоверсии. Многие пациенты нуждаются в постоянном приеме антикоагулянтов (см. Долгосрочные меры по предотвращению тромбоэмболии Длительная профилактика тромбоэмболий Фибрилляция предсердий – это быстрый нерегулярный предсердный ритм. Симптомы включают: перебои в работе сердца и иногда – слабость, снижение толерантности к физической нагрузке, одышку, пресинкопальные. Прочитайте дополнительные сведения ).
Здравый смысл и предостережения
При фибрилляции предсердий следует назначать антикоагулянты, когда это возможно, до восстановления синусового ритма.
После восстановление синусового ритма не рекомендуется прекращать антикоагулянтную терапию у больных с показаниями к ее назначению.
Синхронизированная кардиоверсия (100 Дж, затем 200 и 360 Дж при необходимости) преобразует фибрилляцию предсердий в нормальный синусовый ритм у 75 – 90% пациентов, хотя частота рецидивов высока. Эффективность и поддержание синусового ритма после процедуры улучшается с использованием за 24–48 часов до процедуры антиаритмических препаратов Антиаритмические средства Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения классов Ia, Ic или III. Кардиоверсия более эффективна у пациентов с непродолжительной фибрилляцией предсердий, идиопатической формой фибрилляции предсердий, или фибрилляцией предсердий с обратимой причиной; она менее эффективна, когда левое предсердие увеличено ( > 5 см), имеет место низкая скорость кровотока в ушке предсердия или при известной структурной патологии сердца.
Препараты для восстановления синусового ритма во время фибрилляции предсердий включают Ia-класс (прокаинамид, хинидин, дизопирамид), Ic (флекаинид, пропафенон) и III класс (амиодарон, дофетилид, дронедарон, ибутилид, соталол, вернакалант) антиаритмиков (см. таблицу Антиаритмические препараты Антиаритмические препараты (классификация Vaughan Williams) ). Эффективность данных препаратов около 50–60%, но побочные эффекты различны. Вышеуказанные препараты не следует использовать, пока скорость ЧСС контролируется с помощью бета-блокаторов или недигидропиридиновых блокаторов кальциевых каналов. Эти купирующие препараты, предназначенные для приема перорально, также могут применяться для длительного поддержания синусового ритма (с или без предшествующей кардиоверсии). Выбор зависит от переносимости пациентом. Кроме того, при пароксизмальной ФП, которая возникает практически только в покое в течение сна, когда повышен вагусный тонус, препараты с ваголитическим эффектом (например, дизопирамид) могут быть особенно эффективными. ФП, индуцируемую физической нагрузкой, лучше предотвращать с помощью бета-блокаторов.
Для некоторых пациентов с пароксизмальной фибрилляцией предсердий, которые могут определять начало пароксизма по симптомам, некоторые врачи рекомендуют однократный прием нагрузочной дозы флекаинида (300 мг для пациентов ≥ 70 кг, в остальных случаях – 200 мг) или пропафенона (600 мг для пациентов ≥ 70 кг, в остальных случаях - 450 мг), что позволяет пациенту самостоятельно реагировать на проявления болезни (подход "таблетка в кармане"). Этот подход может применяться у пациентов без дисфункции синусового и AВ узлов, блокады ножек пучка Гиса, удлинения интервала QT, синдрома Бругада или структурных заболеваний сердца. Опасностью такого подхода (оценивается в 1%) является возможность преобразования фибрилляции предсердий в трепетание предсердий с проведением 1:1 с частотой 200–240 ударов в минуту. При этом потенциальном осложнении частота может быть уменьшена при совместном применении препаратов, подавляющих АВ-проведение (бета-блокаторы или недигидропиридиновые антагонисты кальциевых каналов).
Ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы рецепторов к ангиотензину II (БРА) и блокаторы альдостерона могут замедлять фиброз миокарда, который является субстратом фибрилляции предсердий у пациентов с сердечной недостаточностью, но роль этих препаратов в рутинном лечении фибрилляции предсердий до сих пор не определена.
Профилактика тромбоэмболии во время восстановления ритма
Больные, особенно с текущим эпизодом фибрилляции предсердий > 48 часов, в течение нескольких недель после лекарственной терапии или кардиоверсии постоянного тока имеют высокий риск тромбоэмболии. Если начало текущей фибрилляции предсердий не удается распознать в течение 48 часов, больной должен принимать антикоагулянты в течение 3 недель до и по меньшей мере 4 недели после кардиоверсии, независимо от предполагаемого риска тромбоэмболии для пациента.
Кроме того, когда начинается терапия антикоагулянтами, выполняется транспищеводная эхокардиографии (ТПЭ), и, если в левом предсердии или ушке левого предсердия нет тромба, может быть выполнена кардиоверсия c последующей терапией антикоагулянтами в течение не менее 4 недель.
Если кардиоверсия необходима для нормализации гемодинамики, она выполняется, и прием антикоагулянтов начинается (как только возможно) и продолжается в течение по крайней мере 4 недель.
Если начало текущей фибрилляции предсердий не удается распознать в течение 48 часов, кардиоверсия может быть выполнена без предварительного введения антикоагулянтов в случае, если больной имеет неклапанную фибрилляцию предсердий риск тромбоэмболии не высок. После кардиоверсии лечение антикоагулянтами продолжается в течение 4 недель; однако антикоагуляция может и не понадобиться у пациентов с низким риском тромбоэмболии.
Процедура абляции при фибрилляции предсердий
Пациентам с неэффективной или невозможной терапией для контроля ЧСС может быть проведена абляция Абляция при сердечной аритмии Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения АВ-узла с целью достижения полной АВ-блокады; в таком случае необходима имплантация постоянного кардиостимулятора Электрокардиостимуляторы Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведенияПроцедура абляции, при которых осуществляется изоляция легочных вен от левого предсердия, может предотвращать фибрилляцию предсердий, не вызывая АВ-блокады. В сравнении с другими процедурами абляции, изоляция ЛВ имеет более низкую эффективность (60–80%) и более высокую частоту осложнений (1–5%). Соответственно, эта процедура часто предназначена для более подходящих для нее кандидатов (например, молодых пациентов, у которых нет значительных структурных заболеваний сердца, пациентов без других сопутствующих заболеваний, таких как лекарственно-устойчивая ФП, или пациентов с систолической дисфункцией левого желудочка и сердечной недостаточностью).
Длительная профилактика тромбоэмболий
При длительном лечении у некоторых пациентов с фибрилляцией предсердий применяются долгосрочные меры по предотвращению тромбоэмболии, в зависимости от оценки риска инсульта по сравнению с риском кровотечения.
Больные с ревматическим митральным стенозом и искусственными клапанами сердца относятся к высокому риску тромбоэмболии в качестве пациентов с неклапанной фибрилляцией предсердий, которые имеют дополнительные факторы риска. Дополнительные факторы риска выявляются с помощью шкалы CHA2DS2 Vasc (см. таблицу Cтепень CHA2DS2-Vasc Cтепень CHA2DS2-Vasc ).
Тахикардия при приеме антиаритмиков. Тромбоэмболии при приеме антиаритмиков
Тахикардия при приеме антиаритмиков. Тромбоэмболии при приеме антиаритмиков
Если у пациента нет патологии АВ-проведения, тахикардия возникает сразу же после развития фибрилляции или трепетания предсердий. Транзиторное снижение ударного объема вследствие потери предсердного вклада частично компенсируется увеличением симпатического тонуса и, как следствие, учащением сердечного ритма, что нередко вызывает ощущение беспокойства.
Беспокойство, в свою очередь, еще больше повышает симпатический тонус. Поэтому при остром развитии фибрилляции или трепетания предсердий обычно наблюдаются очень большая частота сердечного ритма и сильное сердцебиение. Однако симпатический тонус, как правило, снижается в течение нескольких часов, и сердечный ритм замедляется до более приемлемого (неопасного) уровня.
При хроническом учащении сердечного ритма — в течение недель или месяцев, — у пациента может развиться тахикардитическая или аритмогенная кардиомиопатия. Термином тахикардитическая кардиомиопатия характеризуется желудочковая дисфункция, развивающаяся вследствие длительно не прекращающейся тахикардии. Хотя это состояние наблюдается относительно редко, оно не отличимо от других форм дилатационной кардиомиопатии, однако тахикардитическая кардиомиопатия в значительной мере обратима при нормализации частоты сердечного ритма.
В любом случае, существованием феномена тахикардитической кардиомиопатии подчеркивается тот факт, что частый сердечный ритм, сопровождающий фибрилляцию и трепетание предсердий, гораздо более значим, чем «простое» учащенное сердцебиение.
Тромбоэмболии при приеме антиаритмиков
Возможно, самое серьезное гемодинамическое последствие предсердной фибрилляции (и в значительно меньшей степени — трепетания предсердий) — риск тромбоэмболии. У 1/3 пациентов с хронической фибрилляцией предсердий периодически развивается инсульт, и приблизительно в 75 % случаев инсульта причиной его становятся эмболы.
Как частота развития фибрилляции предсердий самой по себе, так и ежегодный риск развития инсульта у больных с предсердной фибрилляцией увеличиваются с возрастом. Фибрилляция предсердий развивается примерно у 3 % пациентов в возрасте 60 лет и у более 10 % пациентов в возрасте 80 лет и старше. Ежегодный риск развития инсульта у 60-летнего пациента составляет примерно 2 %, а у пациента 80 лет и старше этот риск возрастет до 5 % и более.
Более того, по непонятным причинам, инсульты у больных с фибрилляцией предсердий, чаще сопровождаются инвалидностью и смертью, чем у остальных пациентов. Антиэмболическая терапия варфарином или, в меньшей степени, аспирином достоверно снижает риск инсульта у больных с хронической фибрилляцией предсердий. Мы обсудим показания к терапии антикоагулянтами ниже.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
мерцательная аритмия
У большинства больных с ФП (за исключением пациентов с послеоперационной ФП) рано или поздно происходит рецидив. Среди факторов риска частого рецидивирования пароксизмов ФП – женский пол и органическое заболевание сердца.
Другие факторы риска рецидивирования ФП: увеличение предсердий и ревматизм, причем некоторые из вышеуказанных факторов взаимосвязаны (например, длительность ФП и размер предсердий).
Поддержание синусового ритма. Фармакотерапия для профилактики рецидива мерцательной аритмиия
Поддержание синусового ритма необходимо у пациентов с пароксизмальной формой ФП (у которых приступы купируются самостоятельно) и постоянной формой ФП (у которых электрическая или фармакологическая кардиоверсия необходима для поддержания синусового ритма).
Цель поддерживающей терапии – подавление симптоматики и иногда профилактика кардиомиопатии, вызванной тахикардией. Неизвестно, способствует ли поддержание синусового ритма профилактике тромбоэмболии, сердечной недостаточности или смерти.
Общий подход к антиаритмической терапии
До начала приема любого антиаритмического препарата следует заняться обратимыми сердечно- сосудистыми и другими заболеваниями, способствующими развитию ФП. Большинство из них связано с ИБС, заболеваниями клапанов сердца, гипертензией и СН.
Те, у кого ФП развивается после приема алкоголя, должны воздерживаться от алкоголя.
Профилактический прием препаратов обычно не показан после первого приступа ФП. Следует также избегать применения антиаритмических препаратов у больных с редкими и хорошо переносимыми пароксизмами ФП.
У больных с развитием приступа ФП только после физических усилий может быть эффективным прием бета-блокаторов, однако один конкретный фактор редко является единственным пусковым фактором всех приступов аритмии, и у большинства пациентов синусовый ритм не будет сохраняться без антиаритмической терапии.
Выбор подходящего препарата основывается прежде всего на безопасности и зависит от наличия органического заболевания сердца, а также количества и характера предыдущих приступов ФП. У больных с изолированной ФП вначале можно попытаться начать прием бета-блокатора, однако особенно эффективны флекаинид, пропафенон и соталол. Амиодарон и дофетилид рекомендованы в качестве альтернативной терапии.
Не рекомендуется применение хинидина, прокаинамида и дизопирамида (кроме случаев неэффективности амиодарона или противопоказаний к нему).
У больных с вагусной формой ФП хорошим выбором может быть длительно действующий дизопирамид (с учетом его антихолинергической активности). В этой ситуации флекаинид и амиодарон являются препаратами второй и третьей линии соответственно, а пропафенон не рекомендован к применению в связи с тем, что его слабая внутренняя бета-блокирующая активность может ухудшать течение вагусной пароксизмальной ФП.
У больных с катехоламинчувствительной формой ФП бета-блокаторы – препараты первой линии, затем следуют соталол и амиодарон. У больных с катехоламинчувствительной изолированной ФП амиодарон не является препаратом первой линии.
При неудаче монотерапии может попробовать применить комбинированную терапию. Полезные комбинации: бета-блокатор, соталол или амиодарон + препарат группы IC. Вначале безопасный препарат может приобрести проаритмогенные свойства при развитии у пациента ИБС или СН или начале приема другого препарата, который в сочетании может стать проаритмогенным. Поэтому пациента следует предупредить о важности таких симптомов, как обморок, стенокардия или одышка, а также о нежелательности приема препаратов, удлиняющих интервал QT.
При наблюдении за пациентами следует периодически проверять уровень калия, магния в плазме и показатели функции почек, потому что почечная недостаточность приводит к накоплению препарата и возможного его проаритмогенного действия. У некоторых пациентов может появиться необходимость в проведении серии неинвазивных исследований для повторной оценки функции ЛЖ, особенно при развитии клиники СН во время лечения ФП.
Антиаритмической терапии в амбулаторных условиях
Наиболее серьезной проблемой безопасности амбулаторной антиаритмической терапии являются проаритмии, которые редко встречаются у пациентов без СН с нормальными функцией желудочков и исходным интервалом QT, без выраженной брадикардии.
У таких пациентов в связи с малой вероятностью наличия дисфункции СПУ или ПЖУ, препаратами первой линии в амбулаторных условиях могут быть пропафенон или флекаинид.
До начала терапии этими препаратами следует назначить бета-блокаторы или антагонисты кальция для профилактики быстрого АВ проведения или АВ проведения 1:1 при развитии трепетания предсердий.
В связи с тем, что купирование пароксизма ФП флекаинидом или пропафеноном может быть связано с брадикардией, развивающейся за счет дисфункции СПУ или ПЖУ, первую попытку восстановления синусового ритма следует предпринимать в условиях стационара до того, как разрешить пациенту применять эти препараты в амбулаторных условиях по принципу «таблетка в кармане» для быстрого купирования последующих рецидивов.
У больных с синдромом слабости СПУ, нарушениями АВ проведения или блокадой ножек пучка Гиса следует избегать амбулаторного приема препаратов.
Выбор антиаритмических препаратов у больных с отдельными сердечными заболеваниями
Сердечная недостаточность
Пациенты с застойной СН особенно склонны к развитию желудочковых аритмий на фоне приема антиаритмических препаратов, что связано с дисфункцией миокарда и электролитными нарушениями.
В рандомизированных исследованиях была показана безопасность амиодарона и дофетилида (по отдельности) у больных с СН, и эти препараты рекомендованы для поддержания синусового ритма.
Ишемическая болезнь сердца
У больных с ИБС в стабильном состоянии препаратами первой линии могут быть бета-блокаторы, но польза от их применения подтверждается лишь в 2 исследованиях, а данные об их эффективности для поддержания синусового ритма у пациентов с хронической ФП после кардиоверсии неубедительны.
Соталол обладает выраженными бета-блокирующими свойствами и поэтому может быть препаратом выбора у больных с сочетанием ФП и ИБС, потому что его прием связан с меньшим количеством долговременных побочных эффектов, чем прием амиодарона. И соталол, и амиодарон достаточно безопасны при приеме в течение короткого периода времени, и амиодарон может быть предпочтительным у больных с СН.
Флекаинид и пропафенон в этих ситуациях не рекомендованы. Хинидин, прокаинамид и дизопирамид являются препаратами третьей линии у больных с ИБС.
Гипертоническое сердце
У пациентов с гипертрофией ЛЖ может наблюдаться повышенный риск развития тахикардии типа пируэт, связанной с ранней желудочковой постдеполяризацией. Поэтому в качестве терапии первой линии следует использовать препарат, который не удлиняет интервал QT, и в отсутствие ИБС или выраженной гипертрофии ЛЖ, можно применять пропафенон и флекаинид.
Развитие лекарственной аритмии при приеме одного препарата вовсе не означает обязательного ее развития при приеме другого. Например, больные с гипертрофией ЛЖ, у которых развивается тахикардия типа пируэт на фоне лечения препаратом III класса, могут хорошо переносить лечение препаратом IC класса.
Амиодарон способствует удлинению интервала QT, но при его приеме риск развития желудочковых аритмий очень низок. Внесердечные токсические эффекты амиодарона переводят его в группу препаратов второй линии у больных с гипертоническим сердцем, однако амиодарон становится препаратом первой линии при наличии выраженной гипертрофии ЛЖ. При неэффективности или противопоказаниях к приему амиодарона или соталола в качестве альтернативных препаратов можно использовать дизопирамид, хинидин или прокаинамид.
Синдром WPW
У пациентов с синдромом предвозбуждения желудочков и ФП предпочтительной является радиочастотная абляция дополнительных проводящих путей.
В некоторых случаях могут быть эффективные антиаритмические препараты. Следует избегать приема дигоксина в связи с риском парадоксального ускорения желудочкового ритма во время ФП у некоторых пациентов с дополнительными проводящими путями.
Бета-блокаторы не уменьшают проведение по дополнительным проводящим путям во время приступов ФП с предвозбуждением и могут вызывать гипотензию или другие осложнения у больных с нестабильной гемодинамикой.
Нефармакологические методы лечения ФП
Хирургическая абляция
На основании исследований по картированию на животных и человеческих моделях ФП J.Cox разработал хирургическую методику под названием «операция лабиринт», которая приводит к излечению от ФП у более чем 90% выбранных пациентов.
Частота смертности при изолированной операции «лабиринт» составляет менее 1%. Осложнения операции «лабиринт» включают осложнения, общие для срединной стернотомии и применения аппарата искусственного кровообращения, а также кратковременную задержку жидкости, временное уменьшение транспортной функции ЛП и ПП и ранние послеоперационные предсердные тахиаритмии.
Помимо этого, при прекращении кровоснабжения СПУ может развиться его дисфункция, требующая имплантации постоянного искусственного водителя ритма.
Катетерная абляция
Риск рецидива ФП после абляции все еще высок – от 20 до 50% в течение 1 года. Процедура «холодовой» РЧА с изоляцией устьев легочных всех вен позволяет добиться положительных результатов у 75-80% пациентов с пароксизмальной или персистентной формой ФП. 10-25% пациентам требуется продолжение антиаритмической терапии после абляции..
Возможные осложнения:
тромбоэмболии,
стеноз легочных вен,
выпот в полость перикарда,
тампонада сердца и паралич диафрагмального нерва,
хотя в последние годы с накоплением опыта их число не превышает 0,5-1% случаев.
Имплантация искусственного водителя ритма
В нескольких исследованиях изучалась роль имплантации предсердного искусственного водителя ритма со стимуляцией правого предсердия, так и из более одного участка предсердий для профилактики рецидива пароксизмальной ФП.
У больных со стандартными показаниями к имплантации искусственного водителя ритма риск развития ФП ниже при использовании предсердного водителя ритма по сравнению с желудочковым.
Несмотря на этот факт, в крупных контролируемых исследованиях польза предсердного водителя ритма при лечении пароксизмальной ФП у больных без обычных показаний к имплантации искусственного водителя ритма (ИВР) доказана не была.
Имплантируемые предсердные дефибрилляторы
В течение последних 10 лет растет интерес к внутренней кардиоверсии при ФП. Важным ограничением этой процедуры, не связанным с безопасностью или эффективностью, является тот факт, что энергия разряда выше 1 Дж вызывает неприятные ощущения у большинства пациентов, а средний порог кардиоверсии в ранних исследованиях составлял приблизительно 3 Дж.
Электрический разряд такой амплитуды без анестезии в необходимых условиях перенести нельзя, что делает широкое использование этого устройства в его нынешней форме неприемлемым. Другим уязвимым местом является то, что некоторые системы не используют стимуляцию предсердий для поддержания синусового ритма после кардиоверсии.
Абляция предсердно-желудочкового узла
Абляция ПЖУ и имплантация постоянного искусственного водителя ритма является высокоэффективным способом лечения у некоторых пациентов с ФП.
В общем случае наибольшую пользу от такого лечения получают те пациенты, у которых выраженной симптоматикой сопровождается ускоренная ЧЖС, которая не подвергается адекватному контролю с помощью антиаритмических или отрицательных хронотропных препаратов и имеющие дисфункцию ЛЖ.
Это небольшая группа больных, которым РЧА ПЖУ и п. Гиса должна проводиться по жизненным показаниям. Осложнения абляции ПЖУ сходны с таковыми при имплантации ИВР, необходимо также отметить возможность возникновения желудочковых аритмий, относительно редкие случаи ухудшения функции ЛЖ, тромбоэмболии, связанные с прерыванием лечения антикоагулянтами и увеличение частоты трансформации пароксизмальной формы ФП в постоянную.
Несмотря на то, что преимущества абляции ПЖУ несомненны, среди ограничений этой методики можно указать постоянную необходимость антикоагуляционной терапии, потерю АВ синхронности и пожизненную зависимость от имплантированного ЭКС.
Тахикардия при приеме антиаритмиков. Тромбоэмболии при приеме антиаритмиков
Отдел новых методов диагностики
Отдел клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца
Врач ФД Балацина Анастасия Геннадьевна
И.О. заведующей ОФД, врач ФД Павлова Татьяна Сергеевна
Врач ФД, к.м.н. Плинер Татьяна Павловна
Руководитель отдела новых методов диагностики, д.б.н., профессор Рогоза Анатолий Николаевич
Руководитель лаборатории интервенционных методов диагностики и лечения нарушений ритма, проводимости сердца и синкопальных состояний, д.м.н. Певзнер Александр Викторович
Синдром Бругада – "аритмический синдром", характеризующийся синкопальными состояниями в связи с развитием пароксизмов желудочковой тахикардии и повышенным риском внезапной сердечной смерти у пациентов без признаков органических изменений в сердце. Заболевание является врожденной ионной каналопатией с аутосомно-доминантным типом наследования и развивается в результате мутации генов, кодирующих натриевые, калиевые и кальциевые ионные каналы сердца. Впервые изменения были выявлены в гене SCN5A, кодирующем синтез α-субъединицы потенциал-зависимого натриевого канала, осуществляющего быстрый деполяризующий натриевый ток. Изменения в структуре натриевого канала приводят к его преждевременной инактивации в эпикарде, в то время как в эндокарде процессы деполяризации протекают нормально. Таким образом, эндокард, еще находящийся в стадии деполяризации, может становиться источником повторного возбуждения эпикарда, находящегося в стадии реполяризации, что обуславливает электрическую гетерогенность миокарда желудочков и предрасполагает к развитию жизнеугрожающих аритмий .
Заподозрить патологию можно при регистрации стандартной ЭКГ, которая выявляет подъем сегмента ST-T в одном или нескольких правых прекордиальных отведениях (V1-V3) по типу "свода" (I тип) или "спинки седла" (II тип). Изменения на ЭКГ чаще всего носят транзиторный характер, проявляясь при усилении тонуса блуждающего нерва (во время сна и в покое во время бодрствования), вследствие чего для уточнения диагноза нередко требуется проведение 12-канального холтеровского мониторирования ЭКГ. Провоцировать их могут лихорадка, прием алкоголя и переедание. Диагностически значимым является I тип изменений на ЭКГ. При выявлении II типа используются фармакологические пробы с препаратами, блокирующими натриевые каналы (аймалин, прокаинамид), которые позволяют трансформировать второй тип электрокардиографических изменений в первый. Однако чувствительность таких проб составляет 50-75%. Кроме того, лекарственные препараты могут быть недоступны или противопоказаны. Разумной альтернативой фармакологическому тесту является проба с обильным приемом пищи, в особенности углеводной.
На рис. 2 отражена динамика ЭКГ в правых грудных отведениях до и после приема пищи.
Рис. 1 ЭКГ в 12 отведениях, элевация сегмента ST-T в отведениях V1-V2 по типу "спинки седла".
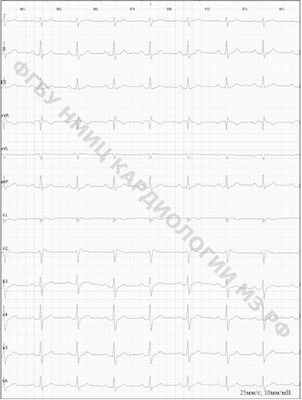
Рис.2. Динамика ЭКГ в отведениях V1-V2 до и после приема пищи.
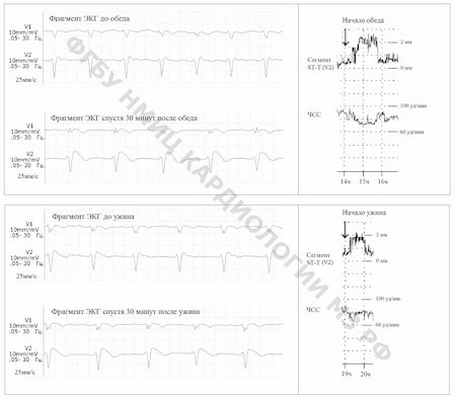
До обильного приема пищи отмечаются изменения на ЭКГ в виде небольшой элевации сегмента ST-T по типу «спинки седла», спустя 30 минут после обеда и ужина наблюдается трансформация сегмента ST-T в диагностически значимый I тип изменений по типу «свода». Указанная электрокардиографическая картина сохранялась в течение часа (cм. "тренды"). Отмечается снижение частоты сердечных сокращений, что также сопряжено с приемом пищи. Предположительным механизмом изменений на ЭКГ у больных с синдромом Бругада, который ассоциируется с обильным приемом пищи, является ваготония.
Больной проведено обследование (тилт-тест, велоэргометрическая проба по специальному протоколу, ЭЭГ, МРТ головного мозга, консультация невролога) для поиска причины синкопального состояния, по результатам которого данных за неврологической и вазовагальный генез приступа потери сознания не получено. От внутрисердечного электрофизиологического исследования пациентка отказалась. На основании клинических и электрокардиографических данных поставлен диагноз "синдром Бругада", который в дальнейшем подтвержден результатами генетического исследования. С учетом факторов повышенного риска жизнеугрожающих аритмий больной был имплантирован двухкамерный кардиовертер-дефибриллятор.
1 P. Brugada, R. Brugada, Ch. Antzelevitch, K. Nademanee, J. Towbin, J. Brugada “The Brugada Syndrome” in Cardiac Repolarization edited by I. Gussak, Ch. Antzelevitch, 2003, p. 427-447;
2 Ch. Antzelevitch et al. “J-wave syndromes experts consensus conference report: Emerging concepts and gaps in knowledge” Europace 2017, 19, 665-694
3 Ikeda T., Abe A., Yusa S. et al. The full stomach test as a novel diagnostic technique for identifying patients at risk for Brugada Syndrome. J Cardiovasc Electrophysiol 2006; 17:602–607.
Купирование аритмии без электрического разряда
В ФГБУ «НМИЦ кардиологии» Минздрава России активно используется новый отечественный антиаритмический препарат III класса Рефралон.
Этот препарат применяется для восстановления синусового ритма у больных с мерцательной аритмией (фибрилляцией и трепетанием предсердий). Фибрилляция предсердий является наиболее часто встречающейся устойчивой формой нарушений ритма сердца, которой в нашей стране страдает около 2,5 млн человек, и это количество продолжает увеличиваться. Мерцательная аритмия оказывает неблагоприятное влияние на прогноз здоровья и жизни больных с различными сердечно-сосудистыми заболеваниями и, при этом, в подавляющем большинстве случаев сопровождается выраженными клиническими проявлениями, существенно снижающими качество жизни пациентов, что требует купирования аритмии.
Доступные в настоящее время антиаритмические препараты позволяют восстановить синусовый ритм лишь у больных с недавно возникшей аритмией. При сохранении приступа более 2-х суток эффективность их существенно снижается, а при персистирующей (т.е., длящейся более недели) форме фибрилляции предсердий практически равна нулю. Вот почему только электрическая кардиоверсия до недавнего времени была единственным способом восстановления синусового ритма у больных затяжной аритмией.
По результатам исследования, проведённого в отделе Клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца ФГБУ "НМИЦ кардиологии" Минздрава России, эффективность препарата в восстановлении синусового ритма при персистирующей фибрилляции предсердий достигает 90% и не уступает электрической кардиоверсии. Преимущества Рефралона заключаются в том, что, в отличие от электрической кардиоверсии восстановление нормального ритма сердца с использованием этого препарата не требует наркоза и отсутствует риск электрической травмы сердца (при проведении электроимпульсной терапии распространённость осложнений, обусловленных анестезиологическим пособием и электрической травмой сердца, может достигать 10%).
Новый антиаритмический препарат выпускает Экспериментальное производство медико-биологических препаратов ФГБУ «НМИЦ кардиологии» Минздрава России. Рефралон включен в Государственный реестр лекарственных средств, в Национальные рекомендации по диагностике и лечению фибрилляции предсердий и может быть использован для восстановления синусового ритма у госпитализированных в стационар пациентов.
Сердечно-сосудистая хирургия
Отдел сердечно-сосудистой хирургии создан при кардиогическом научном центре более 30 лет назад. В течение всего периода времени бессменным руководителем его является доктор медицинских наук академик РАН Акчурин Ренат Сулейманович. В отделе проводятся кардиохирургические операции различных направлений. Коечный фонд – 55 палат (одно- и двухместные), оснащенные всем необходимым для ведения пациентов после кардиохирургических операций. В отделе сложился высокопрофессиональный коллектив врачей и среднего медицинского персонала, отзывчивый, готовый в любой момент придти на помощь. Одно из основных направлений хирургической помощи, доступных в ОССХ, лечение ишемической болезни сердца.
Операции коронарного шунтирования (КШ) проводятся как на остановленном (с помощью аппарата искусственного кровообращения), так и на работающем сердце. Всего за прошедший год выполнено более 400 операций КШ. Наша клиника обладает многотысячным опытом (более 30 лет) проведения операций коронарного шунтирования с микрохирургической техникой (микроскоп, лупы), что позволяет оперировать пациентов с диффузным поражением, кальцинозом и малым диаметром сосудов коронарного русла и ,при этом, достичь наилучших отдаленных результатов. Вместе с широким внедрением в практику лечения ИБС повторного стентирования появилась проблема проведения операции коронарного шунтирования у пациентов с рестенозами стентов, установленных в средние и дистальные отделы артерий сердца. Около четверти всех пациентов, приходящих к нам для проведения операции коронарного шунтирования – это больные, которым было отказано в операции другими лечебными учереждениями.
Большинству пациентов проводятся операции коронарного шунтирования с использованием аутоартериальных трансплантатов (не только левой, но и правой внутригрудной артерии, а также лучевых артерий).
При наличии у пациентов постинфарктной аневризмы левого желудочка сердца одномоментно может быть проведена операция аневризмэктомии и эндовентрикулопластики левого желудочка.
При симптомных нарушениях ритма сердца, устойчивых к антиаритмической терапии или при плохой переносимости антиаритмических препаратов пациентам может быть рекомендовано проведение операции катетерной радиочастотной аблации (РЧА) устьев легочных вен (фибрилляция предсердий), кава-трикуспидального перешейка (трепетание предсердий), выходного тракта правого желудочка сердца (частая желудочковая экстрасистолия из этого отдела сердца). Хирурги-аритмологи выполняют операции (РЧА) по лечению жизнеугрожающих нарушений ритма сердца (желудочковая тахикардия). В отделе накоплен опыт лечения персистирующей (длительно существующей) фибрилляции предсердий. Ежегодно выполняется около 180 катетерных РЧА и более 100 катетерных операций криоаблации аритмогенных зон сердца. При наличии мерцательной аритмии у пациентов с показаниями к открытой операции на сердце (коронарное шунтирование, операции протезирования или пластики клапанов) ,как правило, проводится одномоментная криоаблация аритмогенных зон сердца, что позволяет добиться устойчивого синусового ритма в послеоперационном периоде. При необходимости проведения второго этапа РЧА (у 40-50% пациентов с фибрилляцией предсердий) пациенты повторно консультируются врачами отделения и госпитализируются вне общей очереди.
При поражении клапанного аппарата сердца используются клапансохраняющие методики, а также протезирование механическими и биологическими протезами. В каждом конкретном случае принимается взвешенное решение, которое согласуется с пациентом и родственниками. Врачи подробно объясняют преимущества того или иного вида протеза клапана и вида хирургической методики. В отделе накоплен уникальный опыт (с 2010г.) проведения операции транскатетерного протезирования аортального клапана биологическими протезами (TAVI) без вскрытия грудной клетки. Этот вид операций проводится наиболее тяжелым пациентам, имеющим сложную сопутствующую патологию и, как правило, преклонный возраст. За 2017-2018 годы в отделе выполнено около 400 операций TAVI.
В отделе накоплен многолетний опыт лечения пациентов с сочетанным атеросклеротическим поражением коронарных и сонных артерий. При наличии показаний проводятся одномоментные операции – каротидной эндартерэктомии и коронарного шунтирования.
Профессиональный и технический уровень отдела позволяет оказывать помощь пациентам с наиболее тяжелыми видами сердечной и сосудистой патологии, а также с тяжелой сопутствующей патологией (почечной недостаточностью, бронхо-легочными заболеваниями, последствиями нарушений мозгового кровообращения, онкозаболеваниями). В отделе проводилась совместная научно- практическая программа с Онкологическим Научным Центром им. Н.Н.Блохина. Разработан алгоритм выполнения последовательных операций при наличии ИБС и онкозаболевания.
У пациентов с ИБС проводятся операции катетерного протезирования аневризм аорты (брюшного и грудного отделов) стентграфтами , а также балонирования и стентирования артерий нижних конечностей при наличии облитерирующего атеросклероза и перемежающейся хромотой. В отделе внедрены наиболее современные устройства для малоинвазивных операций такого типа. За год имплантируется около 80 стентграфтов пациентам с аневризмами аорты.
Кардиологами отдела сердечно-сосудистой хирургии разработана программа ранней реабилитации пациентов после операции коронарного шунтирования и сочетанных операций.
Электрокардиостимуляция
Нарушения сердечного ритма широко распространены в структуре заболеваний сердечно-сосудистой системы. По предварительным данным более 16 млн. человек страдает нарушениями сердечного ритма. Зачастую они могут протекать как бессимптомно, так и иметь яркую клиническую картину, начиная от ощущений учащенного сердцебиения, перебоев в работе сердца, предобморочных, обморочных состояний и заканчивая развитием тяжелой сердечной недостаточности. При отсутствии своевременного лечения аритмия может носить для пациента весьма неблагоприятные последствия.
Нарушения ритма связанные с редким пульсом у пациента называются брадиаритмиями. Основными симптомами редкого пульса являются: слабость, головокружение, потеря сознания. При снижении пульса сердце прокачивает недостаточное количество крови, в следствии чего снижается кровоток к органам организма, в том числе наиболее остро воспринимается дефицит кровоснабжения головного мозга, что и приводит к появлению ранее описанных симптомов. Данные жалобы являются характерными, но неспецифическими для нарушений ритма сердца и могут быть проявлением иных заболеваний, по этому при их появлении следует незамедлительно обратиться к врачу. Известно, что редкий пульс может стать причиной ишемического инсульта и, следовательно, брадикардия является фактором риска развития инсульта, а асистолия по данным литературы является причиной внезапной смерти в 17% случаев.
Единственным способом лечения брадиаритмии является операция имплантация электрокардиостимулятора. На сегодняшний день не существует лекарственных препаратов, применяющихся для постоянного лечения редкого пульса.
Лечение симптомных брадиаритмий возможно при помощи имплантации электрокардиостимулятора, который выполняет роль искусственного водителя ритма. Современные кардиостимуляторы представляют собой устройство небольшого размера в металлическом корпусе, в котором располагается батарея и микропроцессор. От корпуса стимулятора через вену в полость сердца идут электроды. Все современные кардиостимуляторы могут воспринимать собственную электрическую активность сердца, и, при возникновении паузы, генерировать и наносить электрические импульсы.
Различают однокамерные и двухкамерные ЭКС. При двухкамерной стимуляции один электрод располагается в правом предсердии, а второй в правом желудочке. Двухкамерная стимуляция является наиболее физиологической, так как обеспечивает синхронность сокращения камер сердца и минимизирует необоснованную стимуляцию сердечной мышцы (миокарда). Режимы стимуляции и выбор типа аппарата при разных формах брадиаритмий определяется лечащим врачом согласно действующим рекомендациям по лечению нарушений ритма сердца. Клинико-инструментальная диагностика брадиаритмий включает проведение электрокардиографии, суточного мониторирования ЭКГ, эхокардиографии с целью исключения структурной патологии сердца. Однако даже в этом случае не всегда удается выявить аритмию. С этом случае возможно проведение длительного мониторирования ЭКГ с применением имплантируемых петлевых кардиомониторов, возможности которых позволяют непрерывно регистрировать у пациентов ЭКГ.
В ФГБУ НМИЦ кардиологии возможно проведение комплексного обследования для выявления и определения показаний к имплантации ЭКС. А на базе отдела сердечно сосудистой хирургии Национального медицинского исследовательского центра кардиологии Министерства Здравоохранения
Российской федерации проводятся операции по имплантации всех видов кардиостимуляторов. Кроме того, на базе отделения возможно оказание помощи, так называемым «технически сложным» пациентам, которым требуются особые условия для проведения оперативного лечения. В том числе возможна имплантация эпикардиальной системы электродов при невозможности выполнения стандартного доступа для имплантации кардиостимулятора.
Учитывая распространенность уже имплантированных электрокардиостимуляторов очевиден и рост ежегодно имплантируемых эндокардиальных электродов. В России ежегодно выполняется более 40 тысяч имплантаций ЭКС, причем около половины этих операций приходится на центральный и северо-западный административный округ РФ. В связи с увеличением антиаритмических устройств в некоторых случаях возникает необходимость лечения осложнений, связанных с их имплантацией. Инфицирование и сепсис могут потребовать частичного или полного удаления кардиостимулятора, включая и устройство и электроды. Это может быть сопряжено с потенциальным риском значимых осложнений и даже смертью больного. Лечение подобных осложнений имплантации ЭКС является отдельным направлением в сердечно-сосудистой хирургии, и требует специальной подготовки и оснащения отделения и операционной. Для проведения подобных вмешательств необходимо:
- наличие кардиохирургической службы и возможность немедленно развернуть кардиохирургическую операционную;
- наличие анестезиологического оборудования и обеспечение анестезиологического пособия ;
- возможность немедленного выполнения открытой операции на сердце;
- возможность использования аппарата искусственного кровообращения, присутствие перфузиологов;
- возможность немедленного проведения ультразвуковых методов визуализации;
Отдел сердечно-сосудистой хирургии отвечает всем требованиям, необходимым для экстракции электродов ЭКС: наличие кардиохирургической операционной и хороший опыт выполнения подобных процедур (более 50 экстракций, в том числе открытым способом.
Эндоваскулярное удаление электродов кардиостимулятора – является относительно новым методом в практике электрокардиостимуляции. Постоянный рост количества первично имплантируемых электродов ЭКС и увеличение потребности в новых, приводит также к тому, что в полостях сердца может одномоментно находиться более двух электродов. Наличие в просвете сосудов и полостях сердца большого количества электродов – уже само по себе является фактором риска и может служить причиной развития различных нежелательных явлений. Наиболее распространенные из них – инфекция, тромбоэмболии, нарушения функции трехстворчатого клапана.
Сотрудниками отдела сердечно-сосудистой хирургии проводятся операции коррекции ранее установленных электрокардиостимуляторов, включая возможность удаления всей системы с электродами и последующей имплантацией нового электрокардиостимулятора. Выполнение таких операций проводится строго по показаниям. На сегодняшний день в отделе сердечно-сосудистой хирургии ФГУБ НМИЦ кардиологии уже выполнено более 1500 операций по имплантации устройств предназначенных для лечения нарушений сердечного ритма.
Читайте также:
