Тамоксифен в лечении рецидива рака эндометрия и его эффективность
Добавил пользователь Владимир З. Обновлено: 19.01.2026
Рак молочной железы (РМЖ) — наиболее частая опухоль у женщин, ежегодно в мире регистрируется 1 млн 150 тыс. новых случаев инвазивного РМЖ, а 450 тыс. женщин погибают от этого заболевания (В.В. Семиглазов, 2009; Parkin DM, 2005). Лечение больных гормоночувствительным операбельным РМЖ обычно начинается с хирургического вмешательства, дополняемого при необходимости лучевой терапией с последующей многолетней эндокринотерапией. Уже доказано, что применение послеоперационной (адъювантной) эндокринотерапии препаратом тамоксифен снижает риск рецидива заболевания, увеличивая показатели общей выживаемости. Дополнительно к эндокринотерапии адъювантное лечение может включать первичную химиотерапию, которая также может улучшить отдаленные результаты.
Среди многообразия факторов, вовлеченных в канцерогенез и определяющих терапевтические мишени при этих опухолях, эстрогены и рецепторы к ним (ЭР) можно отнести к наиболее подходящим признакам, имеющим прогностическое и предсказывающее значение. Доказано, что длительная экспозиция к эстрогенам и высокие уровни плазменных эстрогенов коррелируют с нарастающим риском возникновения РМЖ. Точно так же выявлено увеличение экспрессии ЭР при сравнении нормального эпителия протоков молочной железы, гиперплазии эпителия и протоковой карциномы in situ.
Наличие рецепторов эстрогенов является предсказывающим признаком благоприятного эффекта от планируемой эндокринной терапии. Значение информации о рецепторах прогестерона менее очевидно, но все же и она может быть использована для определения степени эндокринной чувствительности при низких уровнях ЭР.
Поэтому традиционно стратегия эндокринотерапии РМЖ строится на попытках лишить опухолевые клетки стимулирующего влияния эстрогенов. Это может быть достигнуто несколькими путями: 1) конкурирующим захватом рецепторов эстрогенов антиэстрогенами, например тамоксифеном; 2) снижением уровня эстрогенов в крови и в самой опухоли с помощью ингибиторов ароматазы в постменопаузе и овариэктомии или супрессии яичников агонистами ЛГРГ в пременопаузе; 3) разрушением рецепторов эстрогенов с помощью «чистых» антиэстрогенов, например, с помощью фулвестранта.
Задолго до открытия гормонов и рецепторов к ним, 110 лет назад шотландский хирург Beatson обнаружил, что овариэктомия вызывает иногда регрессию распространенного РМЖ. С этого времени основные терапевтические исследования стали фокусироваться на попытках устранения или максимального подавления периферических эстрогенов или на целенаправленном воздействии на рецепторы эстрогенов и прогестерона (ER/PR) как основную мишень гормонозависимого РМЖ.
В течение почти четырех десятилетий селективный модулятор рецепторов эстрогенов тамоксифен являлся основным препаратом эндокринотерапии ЭР-положительного РМЖ. Оксфордский обзор группы по изучению ранних стадий РМЖ (Early Breast Cancer Trialists’ Collaborative Group — EBCTCG), в состав которой входит и НИИ онкологии им. Н.Н.Петрова, продемонстрировал, что тамоксифен улучшает показатели безрецидивной и общей выживаемости у больных с потенциально гормональночувствительными (т.е. ER+ и/или PR+) опухолями. В противоположность этому больные с ЭР-отрицательными опухолями или низким уровнем экспрессии рецепторов стероидных гормонов не имели пользы от гормональных воздействий.
Тамоксифен в целом хорошо переносится больными, но иногда способен вызывать опасные, угрожающие жизни побочные эффекты из-за его частичной активности в качестве агониста эстрогенов. С этим связано развитие рака эндометрия, тромбоэмболических осложнений, частота которых увеличивается при многолетнем применении препарата.
Это привело к поиску новых гормональных препаратов с более безопасными терапевтическими параметрами. Среди них оказались ингибиторы ароматазы. Первое поколение ингибиторов ароматазы, использовавшееся для лечения метастатических форм РМЖ, не достигло адъювантного применения из-за неблагоприятного «терапевтического индекса» («польза—вред») по сравнению с тамоксифеном.
Ингибиторы ароматазы блокируют цитохром Р450 — фермент ароматазы, отвечающий за превращение андрогенов в эстрогены, тем самым снижая уровень эстрогенов. В постменопаузе эстрогены синтезируются в надпочечниках, коже, мышцах и в жировой ткани (Miller WR, 2002). Кроме того, большинство опухолей молочной железы обладает ароматазной активностью, являясь источником локальных эстрогенов для опухолевых клеток (Bolufer P., 1992).
В противоположность этому у пременопаузальных женщин ингибиторы ароматазы индуцируют секрецию гонадотропных гормонов гипофиза через механизм обратной связи, приводя к овариальной стимуляции и развитию овариальных кист. Поэтому применение ингибиторов ароматазы у женщин с сохраненной менструальной функцией противопоказано.
Существуют два типа ингибиторов ароматазы. Ингибиторы I типа являются аналогами андрогенов, необратимо инактивируют ароматазу, вступая в ковалентную связь с энзимным протеином. По этой причине их называют инактиваторами ароматазы, или стероидными ингибиторами ароматазы. Среди них препарат эксеместан (Аромазин®) является наиболее изученным в клинической практике средством.
Ингибиторы II типа — это нестероидные агенты с обратимой связью с активным сайтом ароматазы. Среди них в клинической практике применяются анастрозол (Аримидекс®) и летрозол (Фемара®).
Все используемые ингибиторы ароматазы назначаются перорально и ежедневно. Время, необходимое для достижения максимального подавления эстрадиола (Е2), варьируют от 2 до 7 дней. Период полувыведения колеблется от 27 до 41 час для анастрозола и эксеместана и намного продолжительнее для летрозола (96 час). Необходимо не менее 7 дней для достижения устойчивого уровня препарата в плазме для анастрозола и эксеместана и 69 дней — для летрозола (Buzdar AU, 2002).
Установлено, что риск рецидива заболевания при ЭР+ опухолях является высоким на протяжении первых 5 лет после установления диагноза РМЖ, и особенно высокий риск падает на 2—3-й годы независимо от статуса лимфатических узлов. Именно риск ранних рецидивов, по мнению ряда авторов, оправдывает раннее (up-front) назначение ингибиторов ароматазы.
В то же время при ЭР+ опухолях показатели смертности от РМЖ схожи во временных отрезках «0—4 года» и «5—14 лет» с кумуляцией 2/3 смертельных исходов между 5-м и 15-м годами. Это наблюдение свидетельствует о потенциальной пользе «продолженной» адъювантной эндокринотерапии свыше 5 лет.
Кроме того, для более полной оценки реального вклада адъювантного эндокринного лечения необходимо изучение и показателей общей выживаемости после длительного периода наблюдения, порядка от 8 до 15 лет.
Предложены четыре стратегии изучения ингибиторов ароматазы III поколения в адъювантном лечении РМЖ (табл. 1).
Первичная (up-front) стратегия
Представляется чрезвычайно важным, чтобы женщины получили наиболее эффективную адъювантную терапию с целью минимизировать ранний риск рецидива РМЖ. Несколько клинических испытаний сравнили ингибиторы ароматазы с тамоксифеном, назначаемые на 5 лет (анастрозол в испытание АТАС, летрозол — в BIG 1-98). Эксеместан исследовался в испытании TEAM (результаты еще не представлены).
Данные испытания показали преимущество адьювантной терапии РМЖ с использованием ингибиторов ароматазы в сравнении с терапией тамоксифеном: было продемонстрировано увеличение безрецидивной выживаемости, увеличение времени до прогрессирования, снижение риска развития контралатерального РМЖ (Trialists Group, 2002, 2003, 2005; Coates A., 2007).
«Переключающая» (switch) стратегия
Переключение на ингибиторы ароматазы после 2—3-х лет лечения тамоксифеном у больных, которым был запланирован 5-летний прием тамоксифена, оценено для эксеместана (Intergroup Exemestane Study — IES), для анастрозола (Итальянское испытание — ITA), а также в Австрийском испытании (Аримидекс/Нольвадекс — ABCSG8/ARNO-95).
«Переключающую» стратегию нередко путают с «последовательной» стратегией. Отличие между двумя подходами заключается в том, что «переключающие» испытания цензурируют (исключают) пациентов с рецидивом опухоли в первые 2—3 года терапии тамоксифеном, отбирая субпопуляцию пациентов с более высокой эндокринной чувствительностью (пациенты с ранним рецидивом должны быть менее чувствительны к гормонотерапии). «Последовательные» испытания включают всех пациентов от начала адъювантной терапии, включая больных с рецидивом на тамоксифене в первые 2—3 года лечения. Поэтому представляется обманчивым использовать данные и результаты «переключающих» (switch) испытаний с целью достичь определенного заключения о последовательной стратегии адъювантной эндокринотерапии.
В рандомизированном двойном слепом многоцентровом исследовании IES (Intergroup Exemestane Study) действие эксеместана исследовали после 2—3-х лет проведения терапии тамоксифеном по сравнению с группой пациенток, продолжающих лечение тамоксифеном (до 5 лет) у женщин в постменопаузе, страдающих гормоночувствительным РМЖ ранних стадий (n=4742).
Общая продолжительность гормонотерапии была одинаковой в обеих группах (5 лет), а среднее время лечения тамоксифеном до рандомизации равнялось 2,4 года. После среднего периода наблюдения за 4724 больными опубликован анализ этого испытания. Полученные результаты свидетельствуют о преимуществе режима переключения на эк семестан в сравнении с режимом 5-летней терапии тамоксифеном по всем основным показателям. В группе эксеместана было продемонстрировано увеличение общей выживаемости (НR=0,83; р=0,05), безрецидивной выживаемости на 24% (р=0,00015), снижение риска развития рецидива заболевания на 26% (р=0,0001, HR 0,74), снижение риска развития отдаленных метастазов на 17% (Сoombs RC, 2007). Кроме того, на 44% снижалась частота контралатерального РМЖ в группе эксеместана по сравнению с терапией тамоксифеном (НR=0,56; p=0,04).
Испытание ITA — открытое исследование III фазы, сравнивающее 5-летнее лечение тамоксифеном с 2—3-летним лечением также тамоксифеном с переключением на анастрозол на 2—3 года (общая продолжительность лечения в обеих группах 5 лет). После включения в исследование 448 больных выявлено значительное преимущество анастрозола над тамоксифеном в показателях выживаемости без «событий» (event-free) (НR=0,42; p=0,0001). Однако многообещающие результаты этого испытания нуждаются в подтверждении в более крупных испытаниях, таких как Австрийское исследование ABCSG8/ARNO 95.
Результаты комбинированного Австрийского исследования АBCSG8/ARNO 95 были представлены после включения 3224 больных при среднем периоде наблюдения 28 месяцев. Оказалось, что переключение на анастрозол пролонгирует и увеличивает «бессобытийную» выживаемость по сравнению с продолжающимся до 5 лет лечением тамоксифеном (НR=0,60; р=0,0009); безметастатическая выживаемость также улучшалась с переключением на анастрозол (НR=0,60; р=0,0067); улучшалась и общая выживаемость (HR=0,71; p=0,038).
Побочные эффекты эндокринотерапии
Известно, что тамоксифен обладает эстрогенным воздействием на здоровый эндометрий, что приводит к его пролиферации и гиперплазии. Длительное применение тамоксифена ассоциируется с нарастанием риска развития полипов, вагинальными кровотечениями, увеличением частоты развития рака эндометрия. В отличие от этого ингибиторы ароматазы индуцируют маточную атрофию и могут уменьшить патологические изменения, вызванные приемом тамоксифена. По данным исследования IES, при использовании эксеместана в адъювантной терапии (switch-off) риск развития гиперплазии эндометрия уменьшается в 6 раз в сравнении с терапией тамоксифеном. Также было показано, что при терапии Аромазином® в сравнении с терапией тамоксифеном почти на 50% уменьшается риск возникновения вагинальных кровотечений и существенно, почти в 3 раза, снижается частота образований полипов матки.
Хорошо известен тот факт, что у больных РМЖ могут развиваться тромбоэмболические осложнения. При этом тамоксифен ассоциируется с умеренным, но достоверным увеличением риска развития венозных тромбоэмболий, особенно при комбинации его с предшествующей химиотерапией. В то же время в исследованиях с применением ИА сообщается о достоверном снижении риска развития тромбоэмболий при сравнении с тамоксифеном (IES: 1,9% vs. 3,1%). У женщин в постменопаузе наблюдается снижение минеральной плотности костной ткани, нередко приводящее к развитию остеопороза и возникновению переломов. Длительное снижение уровня эстрогенов, возникающее при лечении ингибиторами ароматазы, может спровоцировать уменьшение плотности костной ткани. Тамоксифен оказывает положительный эффект на костную минеральную плотность (BMD) у постменопаузальных больных РМЖ (Powles TJ, 2006). У больных, получавших лечение ингибиторами ароматазы, увеличивается частота мышечно-скелетных нарушений в испытаниях, сравнивающих ингибиторы ароматазы с тамоксифеном.
В испытании ATAC анастрозол индуцировал достоверно больше переломов в сравнении с тамоксифеном (11,0% против 7,7%; р=0,0001). Следует отметить, что частота переломов резко нарастала на фоне применения анастрозола в первые 2 года терапии, а затем относительный риск переломов оставался постоянным на протяжении всего периода лечения (ATAC Trialists Group, 2006). И при завершении терапии частота переломов резко снижалась до низких показателей, наблюдаемых при лечении тамоксифеном.
Летрозол также увеличивает риск возникновения переломов при прямом сравнении с тамоксифеном (8,6% против 5,8%; р=0,001) (Coates A,, 2007).
Не существует «скелетных» противопоказаний к использованию ингибиторов ароматазы в адъювантном лечении. Однако строго рекомендуется, особенно у больных с наличием факторов риска остеопороза, определять костно-минеральную плотность (BMD) и фосфор-кальциевый метаболизм до начала терапии ингибиторами ароматазы (Winer EP, 2005). В случаях изначально нормального BMD-статуса рекомендуется выполнить повторный тест при завершении терапии ингибиторами ароматазы. Если с самого начала терапии имеется остеопения, повторное определение BMD рекомендуется через 1—2 года терапии ингибиторами ароматазы. При выявлении исходного остеопороза рекомендуется применение бисфосфонатов одновременно с ингибиторами ароматазы (табл. 2)( Gnant M., 2004).
В клинической практике главными симптоматическими признаками, связанными с лечением ингибиторами ароматазы, остаются артралгии и фибромиалгии, для которых нет ясных физиопатологических объяснений.
Реже всего развитие данных побочных эффектов наблюдалось при назначении Аромазина® (эксеместана): 18,6% vs. 11,8% в группе тамоксифена (р=0,0001). В испытании АТАС достоверно больше пациенток, получающих анастрозол, жаловались на артралгии в сравнении с тамоксифеном (35,6% против 29,4%; р=0,0001). Более 90% больных с описанными жалобами принимали нестероидные противовоспалительные препараты в комбинации с более мягкими анальгетиками. В испытании BIG 1-98 летрозол индуцировал больше артралгий, чем тамоксифен (22,0% против 13,5%; р=0,001).
При изучении ингибиторов ароматазы при распространенных формах РМЖ не было идентифицировано серьезных осложнений сердечной деятельности. Однако продолжительность лечения была относительно короткой (Nabholtz JM, 2006).
В исследовании IES частота ишемического сердечно-сосудистого заболевания несколько снижалась (эксеместан: 3,0% против тамоксифена: 6,9%; р=0,17). По данным исследования BIG 1-98, частота кардиальных «событий» 3—5-й степеней была почти в 2 раза выше при назначении летрозола в сравнении с тамоксифеном (74 случая против 35; р=0,05). Эти «события» были представлены ишемией миокарда (42 случая против 21, соответственно; р
Тамоксифен в лечении рецидива рака эндометрия и его эффективность
Тамоксифен как причина рака эндометрия
Тамоксифен широко применяется для лечения рака молочной железы (РМЖ). Кроме того, Fisher, Powels и Veronesi и соавт. выполнили 3 исследования профилактического применения тамоксифена у женщин без рака молочной железы (РМЖ). В публикациях приводится несколько случаев возникновения рака эндометрия (РЭ) у женщин, получавших тамоксифен. К настоящему моменту не выяснено, повышен ли риск аденокарциномы эндометрия у женщин, получающих тамоксифен.
Можно надеяться, что несколько продолжающихся в настоящее время исследований дадут ответ на этот вопрос. Тамоксифен, хоть и заявлен как антиэстрогенный препарат, обладает свойствами эстрогенов и по сути представляет собой слабый эстроген. Кроме того, женщины, получающие тамоксифен, в некоторой степени защищены от остеопороза и ИБС (за счет снижения лактатдегидрогеназы и холестерина) подобно тем, кто получает ЗГТ эстрогенами.
В недавнем прошлом насчитывалось значительное количество как дилетантских, так и профессиональных публикаций, посвященных возможной связи между приемом тамоксифена и возникновением рака эндометрия (РЭ). Тамоксифен впервые испытывали в клинических исследованиях в начале 1970-х годов, а в 1978 г. препарат был одобрен FDA для лечения выраженных стадий РМЖ у женщин в постменопаузе. С тех пор накоплен большой опыт применения данного препарата.
Установлено, что более 4 млн женщин в США применяли тамоксифен в течение почти 8 млн человеко-лет. Подсчитано, что каждый год в США около 80 000 женщин начинают прием тамоксифена по поводу РМЖ и, вероятно, лечение этим препаратом будет продолжаться не менее 5 лет. Не исключено, что результаты профилактических исследований будут способствовать повышению этого числа больных.
Эффективность тамоксифена успешно доказана, особенно у пациенток в постменопаузе, поэтому он обычно рассматривается в качестве препарата выбора для этой группы женщин. Кроме того, доказана активность препарата у больных с метастатическим РМЖ. Один из главных положительных эффектов тамоксифена заключается в существенном снижении частоты возникновения второй злокачественной опухоли в контралатеральной молочной железе. Среди больных, получавших препарат преимущественно с профилактической целью, частота рецидивов была заметно ниже, чем у женщин в контрольной группе.
Согласно результатам первых исследований, тамоксифен следует применять в течение 2 лет, позднее этот срок был продлен до 5 лет, а в настоящее время изучают возможность его применения на протяжении 10 лет. Таким образом, пет оснований сомневаться в том, что тамоксифен, обладающий сравнительно низкой токсичностью, оказался высокоэффективным препаратом для лечения больных РМЖ.
В 1985 г. Killackey и соавт. сообщили о 3 больных РМЖ, получавших тамоксифен, у которых впоследствии развился рак эндометрия (РЭ). За последние 10 лет во всем мире было описано приблизительно 400 пациенток, у которых после приема тамоксифена диагностирован РЭ. Как правило, публикации, посвященные этой проблеме, представлены в виде описаний отдельных случаев, но есть и данные, полученные из нескольких групповых исследований.
Одно из них, получившее наибольшую общественную известность, — это проспективное рандомизированное исследование NSABP (National Surgical Adjuvant Breast and Bowel Project). В нем проанализированы результаты лечения 2843 больных инвазивным РМЖ с положительными рецепторами эстрогенов, без метастазов в лимфоузлах. Пациенток случайным отбором распределили на две группы: получавших плацебо (1-я группа) или 20 мг/сут тамоксифена (2-я группа).
Эти 2 пациентки 1-й группы принимали тамоксифен всего в течение 5 и 8 мес. до того, как у них был выявлен рак эндометрия (РЭ). Во 2-й группе было 5 больных, у которых РЭ развился спустя 7—73 мес. после прекращения приема тамоксифена. В 3-й группе дополнительно включенных пациенток, получавших тамоксифен, впоследствии было диагностировано 8 случаев возникновения опухоли матки (из них 7 РЭ). Из этих больных 3 получали тамоксифен менее года (2, 2 и 9 мес). Для всех пациенток авторы определили среднегодовой относительный риск РЭ на 1000 женщин.
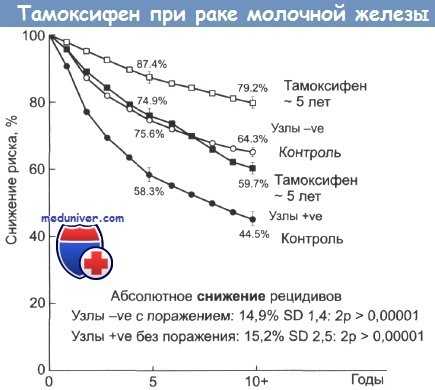
Абсолютное снижение риска возникновения рецидивов рака молочной железы при приеме тамоксифена.
Светлые значки — пациентки без признаков поражения лимфатических узлов; затемненные значки — пациентки с признаками поражения лимфоузлов.
Он составил 0,2 в 1-й группе плацебо, 1,6 во 2-й группе пациенток, начавших получать тамоксифен, и 1,4 в 3-й группе продолживших прием препарата. В этом исследовании NSABP низким оказался относительный риск РЭ в группе плацебо, что противоречит данным SEER (Surveillance, Epidemiology, and End Results), а также предшествующим результатам рандомизированных испытаний NSABP. Согласно этим исследованиям, среднегодовой относительный риск РЭ в группе плацебо равняется 0,7 па 1000 женщин.
Относительный риск рака эндометрия (РЭ) во время приема тамоксифена определен на уровне 2,3 на основании наблюдения за ограниченным числом больных. Однако здесь не был учтен хорошо известный факт, что у женщин, у которых развился РМЖ, высок риск РЭ вне зависимости от последующего лечения. Сообщалось об относительном риске от 1,72 до 3 и более. В исследовании NSABP изучены риски и положительные эффекты, связанные с профилактикой рецидивов и новых случаев РМЖ, в сравнении с новыми случаями РЭ. Положительный эффект тамоксифена заключается в снижении числа случаев РМЖ на 121,3 на 1000 женщин в сравнении с новыми случаями РЭ — 6,3 на 1000 женщин.
Сравнение этих цифр позволяет сделать вывод в пользу явной эффективности тамоксифена.
Изначально предполагалось, что частота рака эндометрия (РЭ), обусловленного приемом тамоксифена, могла быть равна проценту случаев этого заболевания, возникшего в результате заместительной терапии эстрогенами без прикрытия прогестинами. Поскольку тамоксифен представляет собой слабый эстроген, то теоретически предполагалось наличие общих характеристик опухолей эндометрия, индуцированных этим препаратом и чистыми эстрогенами: это должен быть высокодифференцированный рак с поверхностной инвазией в миометрий.
Magriples и соавт. представили результаты ретроспективного анализа 15 больных раком молочной железы (РМЖ), которые получали тамоксифен и у которых на фоне его приема развился РЭ; в группу контроля вошло 38 пациенток с РМЖ, у которых также развился РЭ, хотя они не принимали этот препарат. Больные основной группы получали тамоксифен 40 мг/сут в течение 3—10 лет (в среднем 4,2 года). Опухоли высокой степени злокачественности выявлены у 67% женщин основной группы и у 24 % — контрольной.
Из 15 больных основной группы 5 умерли от рака эндометрия (РЭ), а в группе сравнения — 1 пациентка. Авторы пришли к выводу, что РЭ, связанный с приемом тамоксифена, характеризуется неблагоприятным прогнозом. Barakat и соавт. провели обзор 5 исследований, включавший работы Magriples, NSABP, их собственные данные, полученные в Memorial Sloan-Kettering Hospital, а также 2 иностранные статьи. В общей сложности проанализированы истории болезней 103 пациенток с учетом гистологических характеристик, степени дифференцировки опухоли, стадии РЭ в соответствии с классификацией FIGO, случаи летальных исходов. В итоге не было выявлено увеличения прогностически неблагоприятных факторов в плане гистологического типа, степени дифференцировки опухоли и стадии РЭ по сравнению с группой больных, не получавших тамоксифеи.
Jordan при оценке данных SEER, а также публикаций о связанном с приемом тамоксифена РЭ получил аналогичные результаты.
Некоторые авторы, опираясь на данные, полученные при наблюдении крайне ограниченного числа пациенток, полагают, что у всех женщин, получающих тамоксифеи, необходимо не реже 1 раза в год исследовать состояние эндометрия. Основанием для этой рекомендации служит мнение о том, что тамоксифеи индуцирует развитие РЭ. За последние 10 лет в мировой литературе описано всего 400 таких случаев. Подсчитано, что за этот же период времени только в США число случаев РЭ составило примерно 350 000.
Учитывая, что 3 млн женщин в США принимают тамоксифеи, а в мире описано всего 400 случаев РЭ, связанного с применением этого препарата, затраты на ежегодное исследование эндометрия у этого контингента больных необоснованны. Безусловно, все женщины, вне зависимости от того, применяют они тамоксифеи или нет, должны ежегодно проходить гинекологическое обследование. Оценку состояния эндометрия следует проводить при наличии соответствующих показаний. В настоящее время мы не рекомендуем выполнять биопсию эндометрия или УЗИ только на основании того, что женщина принимает тамоксифеи. Изучение последствий приема этого препарата с профилактической целью осуществляется во время ежегодного скрининга. Полученные данные позволят определит!) оптимальный вариант наблюдения и обследования этих больных.
Вопрос о возможной взаимосвязи тамоксифена и рака эндометрия (РЭ) в ближайшем будущем может стать чисто теоретическим, т. к. ингибиторы ароматазы, возможно, окажутся более эффективными для профилактики рецидивов или возникновения контралатерального РМЖ. В настоящее время эта проблема находится в стадии изучения, а результаты предварительных исследований еще не опубликованы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель Российского общества клинической онкологии (RUSSCO), профессор, доктор медицинских наук, Москва
Адъювантная гормональная терапия существенно изменила прогноз больных раком молочной железы с наличием рецепторов эстрогенов и прогестерона в опухоли. При назначении тамоксифена отмечается снижение на 50% частоты рецидива на фоне приема препарата и на 30% в следующие 5 лет после прекращения его приема. Это сопровождается снижением смертности на 30% в течение 15 лет с начала приема тамоксифена. Ингибиторы ароматазы в течение 5 лет обладают еще большим эффектом в сравнении с тамоксифеном, уменьшая риск прогрессирования на 30% за период приема и на 15% риск смерти в первые 10 лет. Однако накопленный опыт показывает, что после прекращения 5-летнего приема тамоксифена или ингибиторов ароматазы у больных сохраняется риск отсроченного прогрессирования. Это послужило основанием для проведения исследований по увеличению сроков адъювантной гормонотерапии.
Увеличение продолжительности приема тамоксифена было изучено в двух опубликованных на сегодняшний день исследованиях (таблица 1). В исследовании NSABP-14 увеличение продолжительности приема до 10 лет не привело к улучшению отдаленных результатов. В это исследование включались больные с N0, а значит с низким риском прогрессирования, что не позволило выявить потенциально возможную пользу длительного приема тамоксифена. В исследовании ATLAS увеличение продолжительности приема тамоксифена с 5 до 10 лет привело к достоверному снижению риска прогрессирования и смерти. При этом польза от длительного приема тамоксифена становится достоверной отсроченно, только после прекращения 10-летнего приема препарата. Причиной улучшения результатов лечения является уменьшение частоты локальных рецидивов заболевания, возникновения контрлатерального рака молочной железы (профилактический эффект) и незначительное снижение частоты отдаленных метастазов. В обоих исследованиях отмечено снижение частоты и выраженности ишемической болезни сердца, отсутствие увеличения частоты инсультов и тромбоэмболий и увеличение в 2 раза (с 2-3% до 4-5%) частоты возникновения рака эндометрия.
Таблица 1. Результаты рандомизированных исследований
по сравнению продленной и стандартной адъювантной гормонотерапии.
| Исследование | Число больных | Лечение | Срок наблюдения после рандомизации | БРВ | OВ |
|---|---|---|---|---|---|
| NSABP B-14 [1] | 1172 | Тамоксифен 5 лет Плацебо 5 лет | 7 лет | 78% 82% | 91% 94% |
| ATLAS [2] | 6846 | Тамоксифен 5 лет Плацебо 5 лет | 10 лет | 78,6%* 74,9% | 87,8%* 85% |
| MA.17 [3] | 1918 | Летрозол 5 лет Плацебо 5 лет | 5 лет | 95%* 91% | 93% 94% |
| NSABP B-42 [4] | 3966 | Летрозол 5 лет Плацебо 5 лет | 7 лет | 84,7% 81,3% | Н.Д. |
| IDEAL [5] | 1824 | Летрозол 5 лет Летрозол 2,5 года | 6,6 года | 82% 85,4% | Н.Д. |
| ABCSG-16 [6] | 3482 | Анастрозол 5 лет Анастрозол 2 года | 5 лет | 78% 78% | Н.Д. |
* – статистически достоверная разница; Н.Д. – нет данных.
Ингибиторы ароматазы продемонстрировали большую эффективность в сравнении с тамоксифеном при проведении адъювантной гормонотерапии больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли. В связи с этим стало актуальным изучить клиническую эффективность увеличения продолжительности приема ингибиторов ароматазы по сравнению со стандартным 5-летним приемом. В таблице 1 приведены результаты исследования по изучению продленной терапии ингибиторами ароматазы. Следует отметить, что только одно исследование MA.17 опубликовано в полном виде, для всех остальных исследований известна только безрецидивная выживаемость и токсичность терапии. В исследовании MA.17 прием летрозола в течение 5 лет после окончания 5-летней терапии тамоксифеном (79% больных) или ингибиторами ароматазы (21%) привел к достоверному снижению безрецидивной выживаемости, не оказав влияния на общую. Отмечено, что основной причиной снижения безрецидивной выживаемости стало уменьшение частоты контрлатерального рака. В исследования NSABP B-42 10-летний прием летрозола не повлиял на частоту прогрессирования заболевания по сравнению с 5-летним приемом тамоксифена или ингибиторов ароматазы. Анализ токсичности демонстрирует увеличение риска развития сердечно-сосудистых заболеваний и костных переломов на фоне длительного приема препаратов. Риск развития переломов повышается после 7 лет приема ингибиторов ароматазы.
Два исследования посвящены определению оптимальной продолжительности проведения адъювантной гормонотерапии. Дополнительные 5 лет приема были выбраны эмпирически, и остается актуальным сокращение сроков проведения адъювантной терапии для удобства пациентов и уменьшения риска развития побочных эффектов. В исследовании IDEAL сравнивается дополнительное назначение летрозола в течение 2,5 и 5 лет после ранее проведенной стандартной 5-летней адъювантной терапии. При медиане наблюдения 6,6 года после рандомизации не отмечено разницы в показателях безрецидивной и общей выживаемости. Длительный прием летрозола сочетался со снижением частоты контрлатерального рака.
В исследовании ABCSG-16 больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли и отсутствием амплификации HER2, получавшим адъювантную терапию тамоксифеном или ингибиторами ароматазы в течение 5 лет, назначали дополнительный прием анастрозола в течение 2 или 5 лет. В исследование были включены 3484 больные без признаков болезни на момент рандомизации после 5 лет адъювантной терапии. Стратификация проводилась в зависимости от проводимой гормонотерапии в первые 5 лет (тамоксифен или ингибиторы ароматазы). Предварительные результаты, доложенные на прошедшем симпозиуме по раку молочной железы в Сан-Антонио (США) в декабре 2017 года, свидетельствуют, что частота развития прогрессирования заболевания была одинаковой в обеих группах, безрецидивная выживаемость составила 78% и не зависела от вида гормонотерапии в первые 5 лет. Не отмечено разницы в развитии контрлатерального рака молочной железы. В группе длительного приема анастрозола отмечается повышение частоты костных переломов после 3-го года приема. Авторы делают вывод, что увеличение продолжительности адъювантной терапии на 2 года (всего 7 лет) эффективно предотвращает прогрессирование рака молочной железы и предохраняет от развития побочных эффектов, обусловленных длительным приемом ингибиторов ароматазы. Добавление ингибиторов ароматазы в течение 5 лет не дает выигрыша в улучшении отдаленных результатов и сопровождается увеличением побочных эффектов.
Приведенные исследования показывают, что назначение тамоксифена или ингибиторов ароматазы в течение 7-10 лет может приводить к выигрышу в безрецидивной и общей выживаемости по сравнению с 5-летним их назначением. Очевидно, что выигрыш этот отмечается лишь у меньшинства пациенток, в то время как большинство напрасно получают потенциально токсичную терапию со снижением качества жизни. Поэтому важно при обсуждении увеличения продолжительности гормонотерапии оценивать риск дальнейшего прогрессирования после 5 лет адъювантной гормонотерапии у каждой конкретной больной. Этому было посвящено исследование Оксфордской группы EBCTCG (Early Breast Cancer Trialists Collaborative Group) [7].
Были обобщены 88 исследований по 5-летнему назначению адъювантной гормонотерапии и оценен риск прогрессирования и смерти в течение 15 (5-20) лет после прекращения приема в зависимости от различных прогностических факторов.
Результаты наблюдения за больными в последующие 15 лет после 5-летнего прекращения гормонотерапии демонстрируют увеличение кумулятивного риска прогрессирования и смерти от рака молочной железы. Риск прогрессирования и последующей смерти от рака молочной железы напрямую связан с наличием метастазов и их числом в подмышечных лимфоузлах (см. таблицу 2). В первые 5 лет приема гормональных препаратов наблюдается существенное отставание риска смерти от частоты развития прогрессирования заболевания. Однако при наблюдении в течение 20 лет частота смерти от рака молочной железы догоняет частоту рецидивирования и составляет в зависимости от метастатического поражения подмышечных лимфоузлов 15%, 28% и 49%.
Таблица 2. Риск прогрессирования и смерти при проведении гормонотерапии в течение 5 лет.
| Частота рецидивов | Частота смерти | |||
|---|---|---|---|---|
| 5-летняя | 20-летняя | 5-летняя | 20-летняя | |
| N0 | 6% | 22% | 3% | 15% |
| N1-3 | 10% | 31% | 5% | 28% |
| N4-9 | 22% | 52% | 12% | 49% |
Авторы изучили, какие клинические факторы в наибольшей степени определяют риск прогрессирования после прекращения приема гормонов за период 5-20 лет. Оказалось, что, несмотря на то, что на период 5 лет все больные не имели признаков прогрессирования заболевания, размер первичной опухоли и состояние подмышечных лимфоузлов в момент постановки диагноза в наибольшей степени предсказывали риск прогрессирования в последующие после прекращения приема гормональных препаратов годы. Минимальный ежегодный риск прогрессирования менее 1% и кумулятивный в 13% на период 20 лет отмечается у больных с T1N0. С увеличением размера первичной опухоли и числа метастазов в подмышечные лимфоузлы растет как ежегодный, так и кумулятивный риск прогрессирования, достигая максимальных значений 2,8% и 41% при T2N4-9. У больных с T1N0 на частоту прогрессирования оказывала влияние степень дифференцировки, увеличивая его с 10% при высокой степени до 17% при низкой.
Таким образом, проведенное исследование подтвердило, что после прекращения приема гормональных препаратов в течение 5 лет в последующие годы происходит увеличение риска прогрессирования, степень которого зависит от размера первичной опухоли, наличия и числа метастазов в подмышечных лимфоузлах. Все это оправдывает и объясняет целесообразность увеличения продолжительности приема тамоксифена или ингибиторов ароматазы у больных с высоким риском прогрессирования. При обсуждении необходимости продолжения гормонотерапии после 5 лет приема исследование EBCTCG помогает оценить риск прогрессирования и принять правильное решение.
Можно ли с большей точностью определить популяцию больных, которым показано проведение продленной адъювантной гормонотерапии? Возможно, использование генетических тестов (например, Oncotype DX или MammaPrint) с лучшей точностью в сравнении со стадией болезни позволит выявить пациентов с высоким риском прогрессирования после 5 лет адъювантной терапии. Но пока отсутствуют результаты таких исследований, практический интерес представляет исследование по изучению циркулирующих опухолевых клеток у больных после 5 лет адъювантной гормонотерапии [8]. В исследование, которое было представлено на конференции по раку молочной железы в Сан-Антонио в 2017 году, включались больные раком молочной железы II-III стадий с отсутствием экспрессии HER2, которым проводилась адъювантная химиотерапия с добавлением и без бевацизумаба (исследование E5103). Затем больным с наличием рецепторов стероидных гормонов назначали адъювантную гормонотерапию. У 546 больных без признаков прогрессирования выполняли определение наличия циркулирующих опухолевых клеток в крови методом CELLSEARCH CTC assay в период 4,5-7 лет с момента постановки диагноза.
Оказалось, что циркулирующие опухолевые клетки определяются у 4,8% больных: у больных с наличием рецепторов стероидных гормонов – 5,1%, при отрицательных рецепторах – 4,3%. При медиане наблюдения 1,6 года после выполнения теста наличие циркулирующих опухолевых клеток увеличивает риск прогрессирования в 20 раз у больных с положительными рецепторами и не влияет на частоту прогрессирования при отрицательных рецепторах. Было показано, что риск прогрессирования в ближайшие 2 года у больных с положительными рецепторами и наличием циркулирующих опухолевых клеток и без них составляет 35% и 2% соответственно. Авторы посчитали полученные результаты неожиданными. Первой неожиданностью было обнаружение циркулирующих опухолевых клеток у больных без признаков болезни после 5 лет интенсивной адъювантной химиогормонотерапии. Второй неожиданностью была высокая предсказывающая способность прогрессирования заболевания в случае обнаружения циркулирующих опухолевых клеток только у больных с наличием рецепторов стероидных гормонов в опухоли. И третья неожиданность – это быстрое прогрессирование болезни в этой группе больных после окончания адъювантной гормонотерапии.
Авторы делают вывод, что обнаружение циркулирующих опухолевых клеток у больных с наличием рецепторов стероидных гормонов в момент окончания 5-летнего приема адъювантной гормонотерапии является четким биомаркером быстрого прогрессирования заболевания в ближайшие годы после ее окончания. Можно предположить, что определение опухолевой ДНК в плазме крови больных после 5-летнего приема гормональной адъювантной терапии также может служить индикатором присутствия микрометастазов и высокого риска прогрессирования. Возможно, именно эти больные выигрывают от увеличения продолжительности адъювантной гормонотерапии, а тест на определение циркулирующих опухолевых клеток или опухолевой ДНК будет обязательным для определения оптимальной продолжительности гормонотерапии. Можно думать, что в группе больных с высоким риском прогрессирования будут найдены более эффективные методы лечения в сравнении с увеличением только продолжительности приема гормональных препаратов. Добавление ингибиторов циклинзависимых киназ приведет не только к повышению эффективности адъювантной гормонотерапии, но и к возможному сокращению сроков ее проведения. Интересным представляется назначение ингибиторов контрольных точек иммунного ответа у больных с микрометастазами рака молочной железы после проведения начального этапа гормонотерапии.
Исходя из полученных данных, можно сделать следующие выводы:
- Увеличение продолжительности адъювантной гормонотерапии обладает недостаточной эффективностью, улучшая показатели 10-летней безрецидивной выживаемости на 3-4%. Это обусловлено как резистентностью опухолевых клеток к проводимой более 5 лет гормонотерапии, так и отсутствием селекции больных, которые выигрывают в наибольшей степени от увеличения ее продолжительности.
- У больных с негативными факторами риска (в первую очередь по распространенности опухолевого процесса) можно рекомендовать следующие варианты продленной гормонотерапии:
- при первоначальном приеме тамоксифена 5 лет продление можно осуществить за счет дополнительного назначения тамоксифена еще на 5 лет или ингибиторов ароматазы на 2 года;
- при назначении ингибиторов ароматазы в качестве адъювантной гормонотерапии ее продолжительность должна составлять 5 лет. Проведенные исследования свидетельствуют о возможной пользе увеличения этого срока до 7 лет, что требует подтверждения в дополнительных исследованиях;
- при первоначальном приеме тамоксифена в течение 2-3 лет с последующим переходом на ингибиторы ароматазы в течение еще 2-3-лет можно рекомендовать продление приема ингибиторов до суммарной продолжительности их приема в течение 5 лет.
Ключевые слова: рак молочной железы, адъювантная гормонотерапия.
- Fisher B, Dignam J, Bryant J, et al. Five versus more than 5 years of tamoxifen for lymph node negative breast cancer: Updated findings from the National Surgical Adjuvant Breast and Bowel Project B-14 randomized trial. J. Natl. Cancer Inst. 2001; 93: 684-690.
- Davies C, Pan H, Godwin J, et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen.receptor-positive breast cancer: ATLAS, a randomised trial. Lancet. 2013; 381: 805-816.
- Goss P, Ingle J, Pritchard K, et al. Extending aromatase-inhibitor adjuvant therapy to 10 years. N. Engl. J. Med. 2016; 375: 209-219.
- Mamounas P, Bandos H, Lembersky C, et al. A randomized, double blinded, placebo-controlled clinical trial of extended adjuvant endocrine therapy with letrozole in postmenopausal women with hormone-receptor breast cancer who have completed previous adjuvant therapy with an aromatase inhibitor: results from NRG Oncology/NSABP B-42. 2016 San Antonio Breast Cancer Symposium. Abstract S1-05.
- Blok E, Kroep J, Meershoek-Klein E, et al. Optimal duration of extended adjuvant endocrine therapy for early breast cancer; results of the IDEAL-trial (BOOG 2006-05). J. Natl. Cancer Inst. 2018; 110: djx134.
- Gnant M, Steger G, Greil R, et al. A prospective, randomized, multi-center, phase-III trial of additional 2 years of anastrozole versus additional 5 years of anastrozole after initial 5 years of adjuvant endocrine therapy. Results from 3,484 postmenopausal women in the ABCSG-16 trial. 2017 San Antonio Breast Cancer Symposium. Abstract GS3-01.
- Pan H, Gray R, Braybrooke J, et al. 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N. Engl. J. Med. 2017; 377: 1836-1846.
- Sparano J, O'Neill A, Alpaugh K, et al. Circulating tumor cells five years after diagnosis are prognostic for late recurrence in operable stage II-III breast cancer. 2018 San Antonio Breast Cancer Symposium. Abstract GS6-03.
Узнать больше о лечении рака молочной железы можно на
Большой конференции RUSSCO «Рак молочной железы»
(25-26 января 2018, Лотте Отель Москва)Прогестины в лечении рецидива рака эндометрия и их эффективность
Несмотря на то что смертность от рака эндометрия (РЭ) ниже, чем при злокачественных опухолях шейки матки и яичников, она все же остается высокой, особенно если принять во внимание подавляющее число больных с первично диагностированной I стадией. Некоторые рецидивы, например, в культе влагалища можно успешно лечить с помощью хирургического вмешательства, ЛТ или комбинированным методом.
Прогноз для многих больных благоприятный, и они живут достаточно долго. К сожалению, во многих случаях рецидивы возникают за пределами верхней части влагалища и поэтому не подлежат ни хирургическому лечению, ни ЛТ. У некоторых пациенток ЛТ имеет ограниченное значение, особенно если ее применяли как этап первичного лечения. Следовательно, для многих пациенток с рецидивом рака эндометрия (РЭ) терапией выбора остается гормональная или химиотерапия.
Прогестины назначают в качестве адъювантной терапии, направленной на профилактику рецидива заболевания. В рамках рандомизированного исследования Lewis и соавт. при раке эндометрия (РЭ) применяли медроксипрогестерона ацетат (МПА) или плацебо в послеоперационный период. В обеих группах 4-летняя выживаемость была одинаковой.
Kauppila и соавт., описав более 1100 больных раком эндометрия (РЭ), получавших адъювантную терапию прогестинами в течение 2 лет после операции и ЛТ, обнаружили, что рецидивы возникали даже при высокодифференцированных аденокарциномах I стадии; по их мнению, профилактическое применение прогестинов у этих пациенток было неэффективным.
В проспективном исследовании DePalo и соавт. не обнаружили разницы в выживаемости 363 больных раком эндометрия (РЭ) I стадии, получавших МПА в течение 12 мес, и 383 пациенток с той же стадией, которые не получали этот препарат. По данным британского исследования, в котором 429 пациенток с I и II стадиями рака эндометрия (РЭ) были рандомизированы для послеоперационной терапии МПА или наблюдения, разницы в показателях выживаемости через 5 лет выявлено не было.
Эксперты GOG назначали МПА по 50 мг 3 раза в сутки 420 больным с выраженными стадиями или рецидивами рака эндометрия (РЭ). Из 219 пациенток с объективно измеряемыми опухолями было всего 17 (8%) с полным ответом на терапию и 13 (6 %) — с частичным. Более чем у 1/2 пациенток заболевание оставалось стабильным, а у 1/3 — прогрессировало. Медиана выживаемости составила 10,5 мес.
Из 58 пациенток прореагировали на лечение 13 (24%); у 6 (11 %) пациенток ответ был частичным, причем в 4 случаях он длился более 18 мес. и наблюдался при умеренно и высокодифференцированных аденокарциномах.
Позднее стали определять специфические ЭР и ПР в клетках злокачественных опухолей матки. Нет сомнений в наличии этих рецепторов, но их концентрация варьирует в различных опухолях. В высокодифференцированных опухолях по сравнению с низкодифференцированными содержится больше как ЭР, так и ПР.
В небольшой группе пациенток было установлено, что примерно в 1/3 рецидивных опухолей содержались ЭР и ПР. Следовательно, рецепторный статус опухоли может коррелировать с клиническими данными чувствительности к прогестерону у больных с рецидивным раком эндометрия (РЭ). Предварительные результаты весьма убедительно свидетельствуют об этом.
Очевидно, что для подтверждения этих данных необходимо получить дополнительную информацию; во всяком случае, перспективы в этом направлении весьма обнадеживающие. Если подтвердится прямая корреляция, то анализ рецепторного статуса опухоли позволит подбирать ту или иную схему гормональной или химиотерапии при рецидивах рака эндометрия (РЭ). Если результат анализа на наличие ЭР и ПР положительный, то у пациентки хорошие шансы на достижение ремиссии при лечении прогестинами, даже если у нее низкодифференцированная опухоль.
С другой стороны, при отрицательных результатах ответ на терапию прогестинами может оказаться настолько низким, что проведение XT сэкономит время и будет более эффективным. Kauppila, анализируя данные 5 исследований, описанных в литературе, подсчитал, что 89% опухолей с ПР проявили чувствительность к гормональной терапии по сравнению с чувствительностью всего лишь 17 % у опухолей, не содержащих эти рецепторы. По данным GOG, 4 (40%) из 10 опухолей, имеющих ЭР и ПР, реагировали на проводившуюся терапию прогестинами по сравнению с 5 (12%) из 41 опухоли без ПР.
Терапию прогестинами можно проводить несколькими способами. Мы предпочитаем использовать МПА (Депо-Провера) по 400 мг в/м с недельным интервалом. Другие рекомендуемые прогестины: пероральный МПА (Провера) 150 мг/сут и мегестрола ацетат (Мегейс) 160 мг/сут. Если достигнут объективный ответ, терапию прогестинами продолжают неопределенно долго. При прогрессировании заболевания прогестины отменяют и назначают XT.
Тамоксифен-ассоцированная патология эндометрия и возможности ее коррекции
Тамоксифен является наиболее часто используемым препаратом для лечения рака молочной железы. Известно также влияние данного препарата на гормон-чувствительные ткани. Ретроспективные и наблюдательные исследования показали, что у женщин в постменопаузе с раком молочной железы, принимающих тамоксифен, риск развития доброкачественной патологии матки возрастает. Тамоксифен может быть причиной развития полипов цервикального канала и эндометрия, пролиферативных изменения эндометрия, гиперплазии и рака эндометрия и др. Все вышеперечисленное диктует необходимость поиска возможных путей профилактики и лечения данной патологии.
Заболеваемость и смертность женщин, страдающих гормонально-зависимыми опухолями,
ежегодно растет. Наибольший удельный вес в структуре онкологической заболеваемости женщин имеют злокачественные новообразования органов репродуктивной системы (37,6%), при этом опухоли половых органов составляют 17,1% всех злокачественных новообразований у женщин. Злокачественные опухоли молочной железы (20,5%) являются ведущей онкологической патологией у женского населения [1].В последующем (5–9 лет после начала терапии) риск оставался сниженным примерно на треть
(RR 0,68), а через 10–14 лет достиг плато (RR 0,97). Достижение плато к 10 годам наблюдения, по мнению экспертов, свидетельствует о том, что к этому сроку эффект адъювантной терапии перестал
нарастать или снижаться, оставаясь стабильным.Однако более важно то, что на протяжении всех 15 лет наблюдения сохранялось статистически значимое снижение риска смерти от рака молочной железы (в среднем на треть). Относительный риск
смерти в течение 4 лет после выявления составил 0,71, последующие 5–9 лет – 0,66, и в 10–14 – 0,68.
Статистически значимо сократился и риск смерти от других причин. Общая смертность, не связанная
с раком молочной железы, была почти одинакова в группах, получавших и не получавших адъювантную терапию тамоксифеном, что свидетельствует о малой токсичности подобной терапии. В группе, получавшей тамоксифен, было отмечено лишь незначительное увеличение абсолютного числа
смертей от рака эндометрия и тромбоэмболических осложнений. При подробном анализе было
показано, что риск этих осложнений был крайне мал в возрастных когортах младше 45 лет и от
45 до 54 лет. У женщин старшего возраста (55 лет и старше) с интактной маткой риск развития рака
эндометрия или тромбоэмболии легочной артерии на фоне приема тамоксифена увеличивался приблизительно на 1% [4].Исследование 37 тыс. больных, получающих адъювантную терапию тамоксифеном, показало,
что у 16% предотвращается прогрессирование заболевания в течение 10 лет и на 8% повышается
выживаемость больных с наличием эстрогеновых рецепторов в опухоли. Вместе с тем тамоксифен, являясь антиэстрогеном, выступает частичным агонистом эстрадиола. Поэтому в некоторых случаях тамоксифен вызывает следующие изменения:
1) возрастает частота гиперпластических процессов в эндометрии;
2) увеличиваются размеры матки за счет миоматозных узлов;
3) формируются очаги аденомиоза;
4) возрастает вероятность развития рака эндометрия [3–8].В настоящее время особенно актуальна проблема гиперпластических процессов и рака эндометрия на фоне длительного приема тамоксифена. Впервые связь между приемом тамоксифена и раком эндометрия показал Жакет с соавт. в 1985 г., когда у 3 пациенток, страдающих раком молочной железы, принимающих антиэстроген, развился рак эндометрия. Позднее сообщалось приблизительно о 250 случаях тамоксифен-индуцированного рака эндометрия. Из этого следует, что тамоксифен является независимым фактором риска развития рака эндометрия наряду с диабетом, артериальной гипертензией, возрастом, избыточным весом, курением, наследственной предрасположенностью к раку молочной железы или гениталий [9, 10].
Поскольку отсутствуют точные данные о морфодинамике развития рака эндометрия, изменения, которые предшествуют е.
Читайте также:
- КТ, МРТ при кровоизлиянии в надпочечники
- Опухоли мочеиспускательного канала. Папиллома вульвы.
- Вентрометрия. Исследование живота в стоячем положении
- КТ, МРТ при перфорации носовой перегородки
- Желудочковые устройства вспомогательного кровообращения. Показания к имплантации устройств вспомогательного кровообращения
