Теория слуха. Кохлеарный нерв
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Диагностика и лечение слуха у детей и взрослых
Слуховые аппараты в Краснодаре, Новороссийске, Армавире
Исследование нарушений слуха на современном оборудовании
Отосклероз - специфическое заболевание, представляющее собой первичное метаболическое поражение костной капсулы ушного лабиринта, выражающееся особой формой остеодистрофии с преимущественно двусторонним очаговым поражением энхондрального (среднего) слоя капсулы.
При отосклерозе в костном лабиринте активизируется процесс остеогенеза и в разных его участках образуются зоны спонгизации (формирования незрелой обильно кровоснабжающейся костной ткани), которые впоследствии склерозируются и трансформируются в зрелую кость. В результате подвижность стремечка постепенно снижается и при отсутствии лечения оно рано или поздно полностью обездвиживается – формируется анкилоз. В патологический процесс также могут вовлекаться улитка и другие отделы лабиринта. Передача колебаний по структурам среднего и внутреннего уха нарушается, импульс до мозговых центров не доходит – больной отмечает снижение слуха.
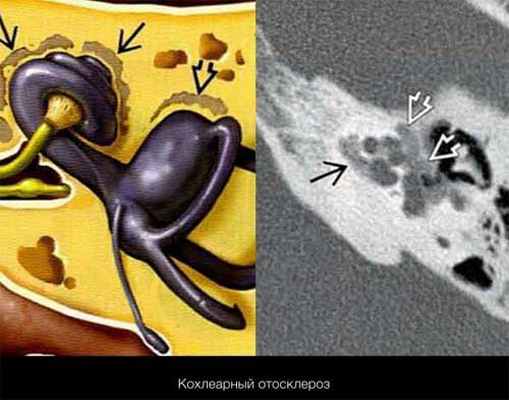
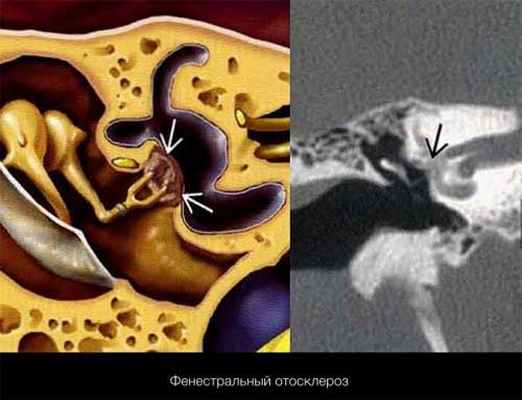
Эпидемиология, патогенез
- Аутосомно-доминантная наследственная теория.
Современные генетические исследования позволили определить гены, ответственные за развитие наследственного отосклероза и их локализацию – хромосомы 15q25-26 (ген OTSC1), 7q34-36 (OTSC2), 6р21-22 (OTSC3), 16q22-23 (OTSC4), 3q22–24 (OTSC5). Обнаружено участие костных морфогенетических белков BMP2, 4 и 7, которые влияют на хондрогенез, а их мутации вызывают нарушения остеогенеза. - Вирусная теория.
Морфологические и биохимические исследования доказали ассоциации между вирусом кори и развитием отосклероза. - Аутоиммунная теория.
Присутствие антител в сыворотке крови к коллагену типа II и к коллагену IX у больных отосклерозом может свидетельствовать об аутоиммунной гипотезе развития отосклероза. Также это подтверждается исследованиями, которые выявили в сыворотке крови больных отосклерозом более высокий титр антител к коллагену типа II в сравнении со здоровыми. Выявлено участие трансформирующего фактора роста b1 (TGFB 1 – transforminggrowth factor) в патогенезе отосклероза. Его активность угнетает дифференцирование остеокластов и ингибирует нормальное ремоделирование капсулы лабиринта. - Эндокринно-метаболическая теория.
Роль эндокринно-метаболических нарушений в манифестации отосклероза являются сложными и недостаточно изученными. Наиболее вероятно, что проявлению отосклероза предшествует нарушение функций нескольких эндокринных желѐз, в первую очередь тех, которые регулируют минеральный обмен (надпочечники, гипофиз, паращитовидные, половые железы)
Формы:
1) Фенестральная (стапедиальная) форма, характеризуется поражением лабиринтной стенки: овального окна, круглого окна, промонториума. Нарушается только звукопроводящая функция уха; это наиболее благоприятная форма отосклероза, поскольку подлежит хирургической коррекции с вероятностью полного восстановления слуха.
2) Кохлеарная форма, характеризуется поражением костной капсулы улитки, при этом нарушается звукопроводящая функция внутреннего уха; хирургическое лечение не приводит к полному восстановлению слуха.
3) Смешанная форма, снижаются функции и восприятия, и проведения звука по внутреннему уху; результатом лечения становится восстановление слуха до костного проведения.
Стадии: активная (незрелая) и неактивная (зрелая).
- Прогрессирующее, постепенное, «беспричинное» снижение слуха, как правило, двухстороннее;
- Субъективное ощущение шума в одном или обоих ушах;
- Некоторые пациенты при тимпанальной или смешанной формах отосклероза с относительно хорошим уровнем слуха по КП, отмечают улучшение слуха в шумной обстановке («paracusis Wilisii»);
- Наличие головокружений или нарушения равновесия.
Лечение
Консервативное лечение:
Инактивирующая терапия - бифосфонаты, которые ингибируют костную резорбцию, в сочетании с фтористым натрием, кальция глюконатом и витамином D. Наиболее эффективными являются азотосодержащие бифосфонаты 3 поколения.
Проводится не менее двух курсов медикаментозной терапии в течение трѐх месяцев, с перерывом в три месяца. При недостаточной эффективности проводится ещѐ 1-2 курса с перерывом в 3 месяца. Контролем эффективности проведенного инактивирующего лечения являются показатели ТПА и КТ височных костей.
Хирургическое лечение:
Показаниями к хирургическому лечению являются:
1. жалобы пациента на снижение слуха и наличие субъективного ушного шума;
2. кондуктивный или смешанный характер тугоухости с костно-воздушным интервалом не менее 30 дБ;
3. отсутствие признаков активного отосклероза (по данным отомикроскопии и КТ височных костей);
4. отсутствие перфорации барабанной перепонки и инфекции в наружном слуховом проходе;
5. отсутствие общих противопоказаний для проведения планового хирургического вмешательства.
- Стапедопластика. Суть ее заключается в замене части стремени протезом. В отдельных случаях стремечко полностью удаляется и заменяется протезом. Одномоментно проводится операция только на одном ухе, операция на втором возможна только через полгода.После операции больной двое суток должен лежать только на неоперированном ухе или на спине. В течение месяца также противопоказаны физические нагрузки и полеты на самолете. Улучшение слуха больной отмечает через 7–10 дней после операции.
Иногда проводится операция, называемая «мобилизация стремени». Суть ее заключается в восстановлении подвижности стремени путем отсоединения его от костных сращений, обездвиживающих его.
Кроме того, может быть проведена операция фенестрация лабиринта, во время которой в стенке преддверия лабиринта создается новое окно. Последние 2 операции характеризуются нестойким эффектом: в течение нескольких лет слух больного сохраняется, однако потом тугоухость стремительно прогрессирует. - Кохлеарная имплантация
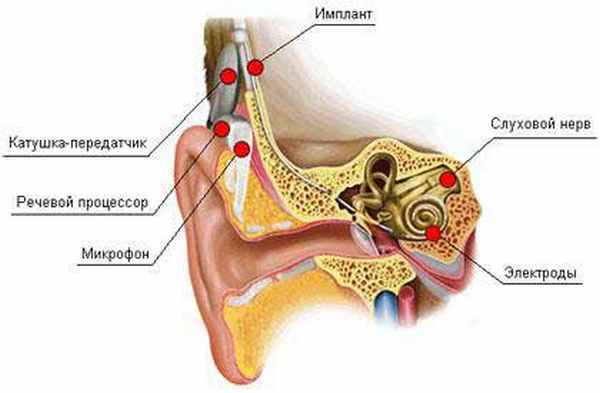
Иное лечение: Слухопротезирование
Прогноз, генетика заболевания
В патогенезе отосклероза рассматривают аутосомно-доминантный тип наследования. Аутосомными называют гены, входящие в состав 22 пар неполовых хромосом. Аутосомно-доминантные заболевания - это заболевания, при которых для появления фенотипических проявлений достаточно одного мутантного гена (аллеля) в гетерозиготном состоянии. Для аутосомно-доминантных заболеваний характерен ряд следующих признаков, которые выявляются в большинстве случаев:
1) заболевание передается вертикально по родословной, и случаи заболевания диагностируются в каждом поколении;
2) риск наследования заболевания для любого из детей пациента составляет 50%;
3) фенотипически нормальные члены семьи не передают заболевания по наследству своему потомству;
4) лица мужского и женского пола поражаются с равной частотой:
5) значительная часть случаев заболевания обусловлена новой мутацией.

Используемая литература:
1) Клинические рекомендации «Отосклероз». 2016 год
2) Лучевая диагностика заболеваний и повреждений височной кости» Г.Е. Труфанов, Н.И. Дергунова, А.Е. Михеев
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

К вопросу об электротестировании кандидатов на кохлеарную имплантацию
Петров Сергей Михайлович
На настоящий момент имеется большое количество работ, в которых приводятся результаты электротестирования (ЭТ), т.е. результаты исследования слуховой функции с помощью электрических стимулов разной частоты [1,2,3,4,]. Под термином ЭТ, в основном, подразумевается либо электроаудиометрия, при которой активный электрод располагается в наружном слуховом проходе, либо промонториальный тест, при котором активный электрод вводится через барабанную перепонку и устанавливается на промонториуме. Такие измерения в большинстве своем проводятся при отборе кандидатов на кохлеарную имплантацию (КИ), т.е. с помощью этой методики обследуются пациенты со значительными периферическими потерями слуха или глухотой. Цель ЭТ - оценка состояния слухового нерва.
Однако отношение к такому обследованию неоднозначно у различных исследователей. По мнению одних - ЭТ обязательно и по его результатам можно судить о сохранности слухового нерва, определять показания к КИ и прогнозировать результаты слуховой реабилитации после операции кохлеарной имплантации [1, 2], по мнению других - положительные результаты при ЭТ не абсолютно необходимы и операция проводится даже при отсутствии слуховых ощущений в ответ на электрические стимулы [5, 6]. Причем и в том и в другом случае отмечаются вполне удовлетворительные отдаленные результаты слуховой реабилитации имплантированных пациентов.
В последнее десятилетие в России внедряется в практику кохлеарная имплантация (КИ), т.е. способ реабилитации глухих пациентов посредством имплантации электродов в улитку -в нескольких клиниках страны прооперировано менее 100 человек (во всем мире - десятки тысяч). В частности, в С.-Пб НИИ ЛОР в течение последних 5 лет реализуется программа КИ, и, естественно, что в процессе работы по этой проблеме возникают некоторые вопросы, связанные, в частности, с отбором пациентов на такую операцию. Одним из таких практических вопросов и является электротестирование.
В данной работе предпринимается попытка рассмотреть метод ЭТ с точки зрения значимости его результатов, обсудить проблемы, возникающие при проведении ЭТ и оценить возможности трактовки результатов «электроаудиометрического» обследования.
Кратко рассмотрим методику проведения ЭТ
Стимулами при данном обследовании являются электрические сигналы синусоидальной или бифазные прямоугольной формы, которые подаются на два электрода. Один из них - индифферентный электрод - располагается, как правило, на лбу или сосцевидном отростке и второй - активный - имеет различные точки приложения.
При данном обследовании наиболее часто применимы три точки расположения активного электрода: около барабанной перепонки в наружном слуховом проходе, на промонториуме и в нише круглого окна. Различными фирмами, например, «Nucleus» и «Med El», разработаны и поставляются приборы для такого тестирования. В первом случае проводится промонториальный тест на октавных частотах 50-800 Гц, во втором - электроаудиометрия, при которой активный электрод располагается в наружном слуховом проходе и стимулы имеют октавные частоты в диапазоне 63-2000 Гц.
Основные результаты, которые регистрируются при электроаудиометрии это: порог слышимости при электрическом раздражении стимулами разных частот (частотно-пороговая кривая) и динамический диапазон слухового восприятия, т.е. разность значений уровней дискомфорта и порога слышимости. Регистрируемый параметр стимуляции - величина электрического тока.
Рассмотрим эти результаты
Пороги слышимости при электрическом раздражении зависят от местоположения активного электрода и повышаются при удалении его от ниши круглого окна к наружному слуховому проходу. Что касается собственно значений порогов то, например, при частоте 62 Гц пороги соответственно равны: электрод в нише круглого окна -0 дБ, на промонториуме - 7,7 дБ и в наружном слуховом проходе (НСП)- 35.8 дБ [3]. Близкие соотношения значений порогов восприятия при разных точках расположения активного электрода отмечаются и на других частотах [1].
Такое распределение пороговых значений тока в зависимости от положения электрода вполне понятно.
Рассмотрим следующий экспериментальный факт, который требует своего объяснения.
ЭТ проводится на разных частотах и непременным указанием на то, что оно выполняется правильно, является отсутствие ям или горбов в кривой, отражающей зависимость порогов слухового восприятия от частоты, а также плавное повышение порогов слышимости при увеличении частоты электрических стимулов [2, 11]. Иначе говоря, частотно-пороговая кривая (ЧПК) плавно поднимается от низких частот к высоким.
Существует точка зрения, что пороговая кривая свидетельствует о состоянии волокон слухового нерва, расположенных в разных частях улитки, и по результатам измерений пороговой чувствительности можно судить о состоянии волокон слухового нерва в соответствии с нормальной тонотопикой улитки.
Рассмотрим, так ли это?
Вернемся к результатам ЭТ кандидатов на КИ. Как отмечают иследователи абсолютно у всех пациентов отмечается совершенно аналогичный ход ЧПК.
Теория слуха. Кохлеарный нерв
Теория слуха. Кохлеарный нерв
Восприятие звуков по общепринятой резонаторной теории происходит в кортиевом органе. Звуковые колебания через звукопроводящий аппарат передаются на перилимфу преддверия и лестницы улитки и приводят в колебательные движения основную мембрану, на которой расположен кортиев орган. Отдельные участки поперечных волокон последней, имея различную длину, действуют как резонаторы и приходят в колебательные движения в зависимости от частоты звукового раздражителя. Следовательно, высокие звуки вызывают соответствующие колебания мембраны основного завитка, низкие звуки соответственно действуют на верхушку улитки, средние же звуки— на средний завиток улитки.
Сложный звук вызывает колебание многих участков основной мембраны. Расположенные на колеблющихся участках основной мембраны волосковые слуховые клетки кортиевого органа будут, таким образом, или прижаты или оттянуты от кортиевой мембраны. Таким образом, колебательное звуковое раздражение превращается в раздражение слуховой нервной клетки, которое через нервные волокна проводится в центральную нервную систему.
Учение об условных рефлексах И. П. Павлова подтвердило резонаторную теорию слуха. Ученик И. П. Павлова Л. А. Андреев дал в своей работе убедительное доказательство правильности этой теории механизма анализатора частот.
Л. А. Андреев вырабатывал у животных условные рефлексы на звуки различной высоты и затем разрушал у них основную мембрану в различных местах. На основании этих опытов Андреев доказал, что повреждение коротких волокон основной мембраны сопровождается выпадением условных рефлексов на высокие тона. При нарушении же целости основной мембраны в области верхушки улитки животное теряло условные рефлексы на низкие тона.

Схема кортиева органа: 1—внутренняя слуховая клетка, 2— внутренний кортиев столбик, 3 — кортиева, мембрана, 4 — наружный кортиев столбик, 5 — наружная слуховая клетка, 6 и 7 — наружные опорные клетки (Гензена), 8 — опорныо клетки (Клаудиуса), 9 — основная мембрана, 10 — опорная клетка Дейтерса, 11 — тоннель, 12 —каналец в спиральной костной пластинке, 13 — волокно слухового нерва
Кохлеарный нерв
Кохлеарный нерв, как уже было сказано, представляет собою центральные отростки биполярных нервных клеток спирального узла. Он идет совместно с вестибулярным нервом в составе VIII пары черспномозговых нервов через внутренний слуховой проход и мостомозжечковое пространство вплоть до вхождения в ствол мозга. В продолговатом мозгу волокна кохлеарного нерва направляются к своим кохлеарным ядрам вентральному и дорсальному. Последнее носит название слухового бугорка.
Большой интерес представляет изменение строения VIII нерва на уровне отверстия внутреннего слухового прохода.
В этом месте швановские клетки, сопровождающие волокна кохлеарного нерва, заменяются глиозными элементами. Это место стыка между швановокими и глиозными элементами нерва является наиболее чувствительным к воспалительным и токсическим процессам на всем протяжении VIII нерва.
Окончание первого кохлеарного нсврона и начало второго происходит в кохлеарных ядрах. Существует обоснованное мнение, что волокна, идущие от основного завитка улитки, проецируются в дорсальную часть слухового бугорка. Верхушечная часть улитки представлена в базальной части указанного ядра и также в вентральном ядре. От последнего в центральном направлении возникает слуховой путь, носящий название трапецевидного тела. Волокна трапецевидного тела совершают частичный перекрест и заканчиваются в верхней оливе варолиевого моста. К этой же верхней оливе тянутся слуховые волокна от слухового бугорка своей и противоположной стороны.
Из верхней оливы возникает восходящий слуховой путь, идущий в боковой петле (lemniscus lateralis) до внутреннего коленчатого тела. Часть же волокон, проходя мимо заднего двухолмия через нижнюю ручку, заканчиваются в последнем.
Согласно работам Клосовекого, от заднего двухолмия начинается короткий рефлекторный путь через описанный им пучок (fasciculus collico-rubralis) в красное ядро. Из красного ядра импульсы через экстрапирамидный монаковский путь доходят до передних рогов спинного мозга.
По этой рефлекторной дуге слуховые раздражения могут дать двигательные рефлексы.
Последний неврон слухового пути возникает во внутреннем коленчатом теле и оканчивается в поперечных извилинах Гешля височной доли мозга, располагающихся в глубине еильвиевой борозды. Здесь находится корковый центр слуха.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Теория слуха. Кохлеарный нерв
Российский научно-практический центр аудиологии и слухопротезирования ФМБА России, Москва, Россия, 117513, кафедра сурдологии Российской медицинской академии последипломного образования Минздрава России, Москва, Россия, 125993
История кохлеарной имплантации
Журнал: Вестник оториноларингологии. 2016;81(6): 4‑8
Российский научно-практический центр аудиологии и слухопротезирования ФМБА России, Москва, Россия, 117513, кафедра сурдологии Российской медицинской академии последипломного образования Минздрава России, Москва, Россия, 125993
Создание кохлеарных имплантов стало возможным благодаря сотрудничеству специалистов в области нейрофизиологии, оториноларингологии, аудиологии с привлечением инженеров и психоакустиков. Экспериментальные работы 30-х годов, не связанные напрямую с электрической стимуляцией слухового нерва, оказали существенное влияние на развитие кохлеарной имплантации. Первые попытки в 1957 г. прямой электрической стимуляции слухового нерва устройством, состоящим из активного электрода и имплантируемой индукционной катушки, показали хорошее различение интенсивности, но неудовлетворительное частотное различение акустических стимулов глухим пациентом. Дальнейшие исследования были направлены на оптимизацию хирургического этапа кохлеарной имплантации, разработку многоканальных электродов и стратегий кодирования, повышающих разборчивость речи. В 1985 г. кохлеарная имплантация официально разрешена для проведения взрослым, в 1990 г. — детям старше 2 лет. Многоканальная кохлеарная имплантация проводится в России с 1991 г. В настоящее время программа кохлеарной имплантации реализуется в нескольких клинических центрах в разных регионах России и финансируется из средств федерального бюджета, кохлеарные импланты используют более 8000 пациентов.
Российский научно-практический центр аудиологии и слухопротезирования ФМБА России, Москва, Россия, 117513, кафедра сурдологии Российской медицинской академии последипломного образования Минздрава России, Москва, Россия, 125993
С внедрением метода кохлеарной имплантации в корне изменились подходы к лечению сенсоневральной глухоты. Менее чем за четыре десятилетия кохлеарные импланты прошли путь от первых попыток прямой электрической стимуляции слухового нерва до коммерческих устройств, обеспечивающих восстановление слуха сотням тысяч пациентов. Некоторые аспекты в истории кохлеарной имплантации могут быть отнесены и к развитию других нейропротезов. Прежде всего это относится к междисциплинарному подходу в кохлеарной имплантации. Значительный вклад в решение проблемы был внесен инженерами, отологами, аудиологами, нейрофизиологами, психоакустиками и представителями индустрии. Не всегда взаимодействие между этими специалистами было гармоничным, однако в спорах и соперничестве рождалась истина. Безусловное значение для прогресса в кохлеарной имплантации имела готовность нескольких клиницистов с риском для своей репутации выступить против существующих в то время научных догм в области лечения больных с тугоухостью и глухотой. И, наконец, успеху способствовали и сами пациенты, которые были готовы принять участие в экспериментальных операциях.
История кохлеарной имплантации состоит из нескольких периодов. Первый этап начался в 1957 г. и продолжался до 60-х годов. Это был период открытий и экспериментов. Второй — 70-е годы — был посвящен определению безопасности стимуляции слухового проводящего пути и обеспечению имплантом достаточного слуха. Третий период завершился созданием коммерческих многоканальных имплантов.
В 1800 г. A. Volta [1] первым описал возможность вызывать электрическим током слуховые ощущения. Аналогичные попытки проводились в течение последующих 150 лет, однако ни в одной из них не было дано объяснения механизмам действия электрического тока.
В 30-х годах прошлого века Г.В. Гершуни и А.А. Волоховым [2—4] в Ленинградской военно-медицинской академии были проведены эксперименты, позволившие уточнить механизмы «электрического» слуха. Было показано, что возникавшие слуховые ощущения при электрической стимуляции через электроды, расположенные в среднем ухе, не отличались у пациентов с интактным средним ухом и отсутствием структур среднего уха. Таким образом, ими была исключена возможность участия среднего уха в электрической стимуляции. Более сложной задачей было определить, является ли слуховое ощущение результатом механического ответа органа Корти или результатом непосредственной стимуляции волокон слухового нерва.
Ряд открытий, сделанных в первой половине XX века, не были напрямую связаны с электрической стимуляцией слухового нерва, но оказали существенное влияние на разработку кохлеарных имплантов (КИ). Прежде всего это относится к открытиям E. Wever и C. Bray [5] микрофонного потенциала, S. Stevens [6] «электрофонического» слуха, а также к работе H. Dudley [8], посвященной синтезу речи и «вокодерам».
В 1930 г. S. Stevens [6] описал механизм возникновения слухового ощущения при электрической стимуляции структур улитки, который был назван им «электрофоническим слухом». Сегодня мы знаем, что «электрофонический» слух является результатом механических осцилляций основной мембраны в ответ на изменение напряжения. Основным условием для реализации данной концепции была интактность улитки.
В 1935 г. А.М. Андреев, Г.В. Гершуни и А.А. Волохов [7] продемонстрировали, что частота стимуляции от сотен герц до 6000 Гц вызывает одни и те же слуховые ощущения, что свидетельствовало о непосредственной стимуляции волокон слухового нерва. Иными словами, слуховые ощущения были результатом не «электрофонического» слуха, а стимуляции волокон слухового нерва. Однако должные выводы авторами сделаны не были.
В 1939 г. H. Dudley [8] описал и продемонстрировал синтезатор голоса, функционирующий в реальном времени и продуцирующий понятную речь. В основу действия устройства, получившего название вокодер, была положена схема, обеспечивающая выделение основной частоты речи и интенсивности ее спектральных компонентов. Спектральные компоненты выделялись при помощи набора 10-полосных фильтров, покрывающих частотный диапазон речи. Принцип действия вокодера, заключающийся в разделении речи на ее основные компоненты, явился основой для первых схем обработки речи в многоканальных КИ.
До 1957 г. все попытки электрической стимуляции проводились на лицах с частично функционирующей улиткой. Поэтому у этих субъектов ответ мог являться результатом «электрофонического» слуха, а не результатом непосредственной стимуляции волокон слухового нерва.
Несмотря на то что в течение последних столетий предпринимались многочисленные попытки лечения глухоты электрическим током, первой публикацией о непосредственной стимуляции слухового нерва с целью генерирования слуховых ощущений являются работы A. Djourno и Ch. Eyriès [9—11]. И хотя КИ имел революционное значение для развития науки о слухе, исследование французских ученых не получило должной оценки.
Одним из направлений работы A. Djourno [9] явилась разработка имплантируемой индукционной катушки, предназначенной для телестимуляции или стимуляции через индуктивную связь. Вначале имплантируемая катушка использовалась для стимуляции седалищного нерва, и стимуляция была чрескожной, а не подкожной. Параллельно изучалась биосовместимость устройства. Проводя эксперименты по изучению влияния частоты стимуляции, A. Djourno [10] определил, что оптимальной частотой для сокращения мышц является частота 400—500 Гц, после чего для стимуляции он стал использовать собственный голос в качестве аналогового стимулирующего сигнала. Это явилось основанием для возникновения идеи о стимулировании слухового нерва с целью восстановления слуха.
В феврале 1957 г. во время операции по восстановлению лицевого нерва у больного после правосторонней резекции височной кости по поводу двусторонней гигантской холестеатомы с двусторонней глухотой (левосторонняя резекция была выполнена несколькими годами ранее) C. Eyriès использовал устройство A. Djourno [11], расположив активный электрод в культе слухового нерва, а индукционную катушку — в височной мышце. При внутриоперационном тестировании использовались посылки импульсов частотой 100 Гц, предъявляемые 15—20 раз в минуту, низкочастотный переменный ток, а также слова, преобразованные в аналоговые сигналы на выходе микрофона. Пациентом было отмечено возникновение слухового ощущения. При количественной оценке было выявлено хорошее различение интенсивности, плохое частотное различение и отсутствие разборчивости речи. Результатом интенсивной послеоперационной реабилитации явилось улучшение частотного различения (высоких и низких частот), различение окружающего шума и некоторых слов, однако разборчивость и понимание речи отсутствовали. Несколькими месяцами позже имплант повредился, а повторная операция не дала результатов. Операция у второй больной также была безуспешной.
Следующий этап начинается с работ C.-H. Chouard [12], который, будучи студентом в лаборатории C. Eyriès, занимался лицевым нервом. Ему принадлежит приоритет в разработке одного из первых функциональных многоканальных КИ.
Хотя имплантация, произведенная A. Djourno и C. Eyriès, считается первой кохлеарной имплантацией, более тщательное изучение анатомии улитки поставило под сомнение факт стимуляции непосредственно слухового нерва (а не стволомозговых структур), так как процесс вторичной дегенерации мог привести к дегенерации улитковых ядер. Тем не менее ни в коей мере нельзя умалять значения данной пионерской работы [13]. На самом деле первые попытки использовать электрический ток для компенсации слуха отмечались 200 лет назад (классическая работа Alessandro Volta конца XVIII столетия), хотя электрическая стимуляция в них использовалась в качестве терапевтического метода или как пример реализации «электрофонического» слуха.
В США приоритет в разработке КИ принадлежит W. House [14]. В 1959 г. он впервые ознакомился с работой A. Djourno и C. Eyriès. В это время W. House [15] активно занимался разработкой подхода к внутреннему слуховому проходу через среднюю черепную ямку. Совместно с нейрохирургом J. Doyle [16] им была произведена попытка зарегистрировать ответы от слухового нерва, выделенного через среднюю черепную ямку для вестибулярной нейроэктомии с целью лечения болезни Меньера. И хотя они преследовали цель зарегистрировать потенциалы, связанные с ушным шумом, которая оказалась несостоятельной, сама возможность регистрации слуховых вызванных потенциалов привела их к мысли о возможности стимуляции аналогичными по форме сигналами с целью восстановления слуха. Первые попытки электрической стимуляции с целью вызывать слуховые ощущения осуществлялись ими при хирургическом вмешательстве на стремени при установке игольчатого электрода на промонториальной стенке или в открытом окне преддверия. При стимуляции прямоугольными импульсами у пациента вызывались слуховые ощущения, не сопровождающиеся дискомфортом, головокружением или стимуляцией лицевого нерва. Это послужило основанием для проведения в 1961 г. имплантации пациенту (добровольцу) с выраженным отосклеротическим поражением и глухотой. Постаурикулярным подходом ему был введен электрод в окно улитки. Пациент отмечал слуховые ощущения, однако из-за непереносимости громких звуков имплант был вскоре удален. В 1961 г. была проведена кохлеарная имплантация второй пациентке. При вестибулярной нейроэктомии подходом через среднюю черепную ямку электрод был введен в барабанную лестницу базальной части улитки. Пациентка отмечала слуховые ощущения, однако через несколько дней интенсивность тока, необходимая для вызывания ответа, возросла, и имплант был удален [17].
Учитывая обнадеживающие результаты, полученные у первого пациента, и рассчитывая на дискриминацию высоких частот, W. House и J. Doyle решили провести реимплантацию пятиэлектродной решеткой, которая была установлена через промонторий и круглое окно. Однако через несколько недель в связи с необходимостью в увеличении интенсивности и с воспалением кожи в заушной области имплант был удален.
Результаты этих операций попали в прессу, что явилось важным стимулом в развитии метода кохлеарной имплантации [19, 20].
В 1964 г. F. Simmons [21, 22] имплантировал электрод в модиолюс глухого пациента, однако результаты также не были обнадеживающими. В 1971 г. R. Michelson [23] применил у нескольких пациентов одноканальные полностью имплантируемые устройства. Результаты операций получили освещение в печати на национальном уровне.
Начало 70-х годов принесло больше разочарований, чем положительных результатов. Большинство ученых, занимающихся фундаментальной наукой, выступали против кохлеарной имплантации, основываясь на имевшихся на тот момент знаниях о физиологии слуха [24—27].
Переломным моментом в развитии кохлеарной имплантации явился 1975 г., когда Национальные институты здоровья США (NIH) спонсировали обследование пациентов, ранее оперированных R. Michelson и W. House с использованием одноканальных К.И. Расширенные психоакустическое, аудиологическое и вестибулологическое исследования были проведены в Питсбурге R. Bilger [28]. Было сделано заключение о том, что одноканальные КИ не обеспечивают разборчивого восприятия речи, однако продукция речи, считывание с губ, равно как и качество жизни оперированных пациентов существенно улучшились.
В конце 70-х годов исследования в области кохлеарной имплантации стали легитимными, что сопровождалось финансированием новых экспериментов. M. Merzenich и соавт. [29] провели исследования по изучению возможности и безопасности длительной электрической стимуляции слухового нерва у кошек и подтвердили, что при атравматичном введении электрода в барабанную лестницу возможно проведение хронической электрической стимуляции волокон слухового нерва, не сопровождающейся выраженными дегенеративными изменениями нервных волокон.
Параллельно с фундаментальными исследованиями две группы ученых (R. Schindler и соавт. [30] — в Калифорнийском университете и G. Clark [31] — в Мельбурнском университете) проводили работы по разработке многоканальных систем кохлеарной имплантации. РезультатомэтихработявилисьКИ Nucleus Cochlear Corporation и Clarion Advanced Bionics.
В 1969 г. G. Clark [32] продемонстрировал ограниченные возможности одноканального КИ и приступил к разработке многоканальных систем. Его исследования включали разработку стратегий кодирования речи, надежного имплантируемого приемника-стимулятора, оптимизацию электродной решетки. G. Clark и соавт. [33, 34] продемонстрировали, что антероградное введение электродной решетки через одну кохлеостому в барабанную лестницу является менее травматичным по сравнению с введением через множество кохлеостом. Использование же платиновых электродов исключало возможность их повреждения и обеспечивало безопасную длительную электрическую стимуляцию [35]. Первый пациент был прооперирован ими в 1978 г., а уже в 1981 г. было отмечено, что пациенты понимают речь без считывания с губ [36]. Для того чтобы отдельные электроды могли бы эффективно вызывать различные частотные ответы, пространственное распределение стимулов также должно было быть различным. Было показано, что выраженное взаимодействие между электродами являлось результатом одновременной стимуляции множества электродов. Для минимизации отмеченного взаимодействия между электродами было предложено использование смещенного неодновременного паттерна стимуляции. Также было показано, что использование скоростей стимуляции выше 1 кГц обеспечивало улучшение разборчивости речи. Данная концепция была запатентована как стратегия CIS [37]. В течение последующих лет продолжались разработки в области совершенствования самого импланта, а также стратегий кодирования речи.
Многоканальные КИ были внедрены в 1984 г., что сопровождалось вытеснением одноканальных систем. В 1985 г. имплантация была разрешена FDA взрослым, а в 1990 г. — детям старше 2 лет [38].
Следующим аспектом, требующим решения, было обеспечение улучшенной разборчивости речи, что нашло реализацию в высокоскоростной перемежающейся стимуляции. Многоканальная стимуляция основывалась на принципах кодирования по месту вдоль улитки.
В СССР в 80-х годах под руководством проф. М.Р. Богомильского [39—41] были начаты работы по созданию отечественного КИ. И хотя был изготовлен опытный образец одноканального КИ и проведены операции двум пациентам, промышленного производства налажено не было.
Начало многоканальной кохлеарной имплантации в СССР было положено в 1991 г., когда после регистрации КИ Nucleus CI22 австралийской фирмы «Cochlear» сотрудниками Всесоюзного научного центра аудиологии и слухопротезирования при активном содействии и непосредственном участии проф. Э. Ленхардта и д-ра Моники Ленхардт были произведены две первые кохлеарные имплантации. В 1997 г. к программе кохлеарной имплантации подключился Санкт-Петербургский НИИ уха, горла, носа и речи, в 2005 г. — Научно-клинический центр оториноларингологии (Москва), а в 2009 г. — Клиническая больница № 122 им. Л.Г. Соколова ФМБА России (С.-Петербург). На сегодняшний день в стране КИ используют более 8000 пациентов.
В этом году исполняется 25 лет программе кохлеарной имплантации в Российской Федерации, и за это время кардинально изменились и показания к имплантации, и возраст кандидатов на операцию, и сами К.И. Прежде всего следует отметить внедрение программ универсального аудиологического скрининга, способствующих значительному снижению возраста кандидатов на имплантацию, разработку принципиально новых электродных систем и новых стратегий кодирования речевой информации, использование беспроводных технологий как для интраоперационных регистраций, так и для послеоперационного ведения пациентов. Пожалуй, к самым существенным достижениям в реабилитации больных с выраженной степенью тугоухости и глухотой следует отнести электроакустическую стимуляцию, используемую в «гибридных» системах кохлеарной имплантации, и бинауральную имплантацию. Новые технологии реабилитации развивались параллельно с научными исследованиями, направленными на изучение пластичности центральной слуховой системы, кроссмодальной пластичности, разработку методов регистрации вызванных потенциалов слуховой коры у пациентов с КИ на речевые стимулы. Все это направлено на достижение главной цели — повышение эффективности реабилитации больных с тугоухостью и глухотой.
Теория слуха. Кохлеарный нерв
Профессиональная нейросенсорная тугоухость
Рассмотрим патогенез нейросенсорной тугоухости, клинические формы, а также критерии диагностики профессиональной нейросенсорной тугоухости
Ухо – орган для восприятия звуков. Жидкость во внутреннем ухе стимулирует специальные нервные окончания (волосковые клетки), которые индуцируют нервный импульс и передают его по нервным путям в специальные отделы коры головного мозга.
Шум – это сочетание звуков различной частоты и интенсивности, оказывающих вредное воздействие на организм человека.
Источники шума:
- Движущиеся детали производственных машин: двигатели, насосы, компрессоры, турбины, центрифуги
- Пневматические и электрические инструменты: молоты, дробилки
- Станки
Источники бытового шума:
- Городской транспорт
- Бытовая техника
Звуковые колебания, воспринимаемые органами слуха человека являются механическими колебаниями, распространяющимися в упругой среде, и характеризуются:
- Частотой колебаний, выражаемую в Гц (число колебаний, произошедших за 1 секунду)
- Интенсивностью – уровень звукового давления, измеряемый в децибелах (дБ)
Акустические колебания воспринимаемые ухом человека, находятся в довольно широком диапазоне частот – от 16 до 20 000 Гц.
Звуковой диапазон делят на 3 класса:
- Низкочастотный – от 20 до 400 Гц
- Среднечастотный – от 400 до 1000 Гц
- Высокочастотный – более 1000 Гц
Звуковые волны с частотой:
Менее 20 Гц называются инфразвуковыми
Более 20 000 Гц - ультразвуковыми
- Наиболее чувствителен слуховой аппарат к восприятию звуков частотой 1000-3000 Гц (речевая зона)
- Если сравнивать шумы с одинаковым уровнем звукового давления, то высокочастотные шумы более неприятны для человека, чем низкочастотные
- Звуки очень большой силы, уровень которых превышает:
- 120-130 дБ, вызывают резкие болевые ощущения и повреждения в слуховом аппарате – «акустическая травма»
- 180-185 дБ - происходит разрыв барабанных перепонок
- 195 – 196 дБ – порог повреждения легочной ткани
- В ночное время шум 30-40 дБ вызывает нарушения сна
- острого и хронического среднего отита (перфорация барабанной перепонки, рубцы в барабанной полости),
- отосклероза,
- нарушения функции слуховой (евстахиевой) трубы,
- аденоидов и др.
Профессиональная нейросенсорная тугоухость - постепенное снижение остроты слуха, обусловленное длительным (многолетним) воздействием производственного шума (преимущественно высокочастотного).
В России профессиональная тугоухость в структуре профессиональной патологии составляет 9-12% и занимает 4-е место (после поражений нервной системы, опорно-двигательного аппарата и профессиональной пылевой патологии).
Интенсивность шума:
На рабочем месте шум допустим с интенсивностью в 70-95 дБ (в зависимости от частоты)
При работе мощных двигателей интенсивность шума может достигать 120-150 дБ
Бытовой шум, связанный с жизнедеятельностью людей, составляет до 45-60 дБ
На магистральных улицах городов до 85 дБ
В России предельно допустимый средний уровень промышленного шума – 85 дБ.
Шум нормируется на рабочих местах согласно ГОС 12. 1. 003-83 и СН №3223-85 «Санитарные норма допустимых уровней шума на рабочих местах».
В указанных нормативных документах предусмотрены два метода нормирования шума:
- По предельному спектру шума (для постоянных шумов) – совокупность нормативных значений звукового давления на стандартных частотах (например на частоте 1000 Гц – ПС-45 или ПС-75)
- По интегральному показателю (предпочтительнее для непостоянных шумов) = эквивалентному уровню шума в дБА (измерение шума по стандартной шкале А шумомера, которая имитирует частотную чувствительность человеческого уха)
- Резонансная теория Гельмгольца,
- Механическая теория «бегущей волны» Бекеши,
- Сосудистая теория: нарушение в системе кровоснабжения и питания
- Теория нарушений взаимодействия коры и подкорки
Клинические формы нейросенсорной тугоухости:
до 4 недель – острая нейросенсорная тугоухость - эффективность лечения составляет 70-90%,
от 1 месяца до 3 месяцев – подострая нейросенсорная тугоухость – эффективность лечения 30-70%,
от 3 месяцев - хроническая нейросенсорная тугоухость – эффективность лечения сомнительна
- Реологические нарушения и расстройство кровообращения в сосудах, питающих внутреннее ухо и головной мозг, особенно его стволовой отдел — главным образом в сосудах вертебро-базилярной системы.
- В результате сердечно-сосудистой патологии,
- При некоторых нарушениях обмена и общих заболеваниях
- Наследственность (передается по аутосомно-рецессивному или Аутосомно-доминантному типам).
- Проявление возрастной патологии (пресбиакузис),
- Невриномы VIII нерва,
- Гипопаратиреоз,
- Аллергии, метеозависимость и т.д.
- Кохлео-вестибулярные нарушения могут наступить в различные сроки после приема препаратов - от 3-4-х суток до нескольких месяцев,
- Снижение слуха после приема ототоксических антибиотиков бывает двусторонним и равномерным на оба уха
При лекарственном и интоксикационном поражении (воздействие стрептомицина, мономицина, канамицина, гентамицина, тобрамицина и ряда других ототоксических препаратов) на первый план выступают дегенеративные изменения клеток спирального органа.
Диуретики петлевые (этакриновая кислота, фуросемид), хинидин, ртуть, мышьяк, нарушают проницаемость клеточных мембран, и потому их применение и сочетание в лечебной практике с ототоксическими антибиотиками вызывает выраженные и, как правило, необратимые поражения нейросенсорных структур внутреннего уха.
- Профессиональное воздействие шума
- Производственные травмы (механическая, баротравма, акустическая, вибрационная). Одновременная акустическая и вибрационная травмы даже на уровне допустимых параметров в 2,5 раза чаще приводят к поражению рецепторов в улитке.
- Вследствие интоксикации организма окисью углерода, ртутью, свинцом и др.
Неспецифическое действие шума сказывается на функциях центральной нервной системы (по типу астенических реакций и астеновегетативного синдрома), сердечно-сосудистой системы, пищеварительной системы.
Больные в первую очередь предъявляют жалобы со стороны нервной системы:
- Головная боль тупого характера
- Чувство тяжести и шума в голове, возникающие к концу смены или после работы
- Головокружение при смене положения тела
- Раздражительность, утомляемость, снижение внимания
- Повышенная потливость
- Нарушение сна (сонливость днем, тревожный сон ночью)
При обследовании:
- мышечная слабость, тремор век и вытянутых пальцев рук
- гипергидроз, похолодание кистей и стоп
- При эмоциональных нагрузках возникают колющие боли в области сердца, сердцебиения
- Отмечается неустойчивость АД и пульса в период пребывания в условиях шума: к концу смены пульс замедляется, АД повышается, появляются функциональные шума в сердце
- ЭКГ: брадикардия, брадиаритмия, тенденция к замедлению внутрижелудочковой или предсердно-желудочковой проводимости
- чаще лабиринтный - обусловлено нарушением кровообращения на уровне артерии лабиринта (системное, с перемещением или вращением предметов),
- значительно реже — центральный - нарушения кровообращения в вертебрально-базилярной системе (чувство неуверенности при ходьбе, покачивание в обе стороны).
Жалобы больных профессиональной нейросенсорной тугоухостью немногочисленны и однообразны:
- понижение слуха,
- реже шум в ушах иногда с рабочей стороны источника шума
- и лишь иногда больные жалуются на головокружение, покачивание при ходьбе.
Следует отметить, что снижение слуха может наступить вследствие воздействия на организм неблагоприятных факторов (при вирусном заболевании, гипертоническом кризе, прогрессирующем остеохондрозе, травме), при этом начинает прогрессировать ушной шум, который становится основной жалобой больного.
Особенности клиники при профессиональном снижении слуха – профессиональная тугоухость:
Снижение слуха идет по типу кохлеарного неврита. Процесс двусторонний. Развитие нарушений медленное.
Наблюдается предшествующая реакция адаптации к шуму:
- ощущение звона или шума в ушах,
- головокружение или головная боль
- восприятие разговорной и шепотной речи в этот период не нарушается
При осмотре отоскопическая картина не изменена.
- шепотная речь воспринимается больным с расстояния 1—3 м,
- разговорная — с расстояния 4 м и более.
- шепотная речь воспринимается с расстояния менее 1 м,
- разговорная речь — с расстояния 2—4 м.
- шепотная речь, как правило, вовсе не воспринимается,
- разговорная - с расстояния менее 1 м.
- Длительный стаж работы в условиях воздействия превышающего ПДУ шума
- Постепенное снижение слуха по типу кохлеарного неврита, как правило, двухстороннее, с одинаковой степенью снижения на оба уха
- Отсутствие каких-либо особенностей в отоскопической картине
- Нисходящий характер костно-воздушной проводимости на аудиограмме
- Нарушение восприятия на высоких частотах (4000 Гц)
- Отсутствие в анамнезе заболеваний или других причин, приводящих к изменению слуха
- Улучшение мозговой динамики: стугерон, кавинтон, пентоксифиллин, препараты никотиновой кислоты и Гинкго Билоба .
- Улучшение клеточного и тканевого метаболизма: витамины В1, В6, В12, витамины А и Е, биостимуляторы (алоэ)
- Для уменьшения шума в ушах: препараты брома, группы атропина, бетасерк
- Физиотерапия и ИРТ.
- с донозологической формой шумовой патологии (признаки действия шума на орган слуха)
- с сформировавшимся невритом слуховых нервов различной степени тяжести с целью своевременной профилактики профессионального снижения слуха и решения вопросов экспертизы трудоспособности.
Вторая группа объединяет больных с установленными невритами слуховых нервов различной степени выраженности (легкой, умеренной, значительной).
Эта группа больных должна быть обследована в специальном отделении профзаболеваний областной клинической больницы для установления характера заболевания и определения трудоспособности больного в своей профессии.
Во время направления больного необходимо указать:
- состояние слуха при поступлении на работу,
- динамику слуха по данным периодических медицинских осмотров,
- сведения обо всех перенесенных заболеваниях, в том числе о лечении антибиотиками ототоксического характера и о черепно-мозговых травмах.
- категорию заболевания определяют и проводят освидетельствование больного с установлением только соответствующего -процента утраты трудоспособности (5-15%).
- группа инвалидности не устанавливается
- группа может устанавливаться при наличии сопутствующих заболеваний, значительно ограничивающих профессиональную трудоспособность: например, вибрационная болезнь 2 степени в сочетании с хронической двусторонней нейросенсорной тугоухостью с легкой степенью снижения слуха (1 ст.), заболевания профессиональные. В этом случае может быть установлена третья группа инвалидности с учетом наличия второго профессионального заболевания.
- только в случае утраты профессиональной трудоспособности может устанавливаться третья группа инвалидности с определением процента утраты профессиональной трудоспособности (до 30%).
- через год после переквалификации группа инвалидности может сниматься с определением только процента утраты трудоспособности.
- При нейросенсорной тугоухости со значительной степенью снижения слуха (III степень):
- противопоказана работа в условиях шума, что приводит к утрате профессиональной трудоспособности и, как правило, устанавливается третья группа инвалидности (30-40%),
- а если по состоянию здоровья и социальным факторам нет показаний для установления группы, то определяется только процент утраты трудоспособности (20-25%).
- Технологические мероприятия - улучшение конструкции приборов для снижения уровня шума (например, замена клепки на сварку), использование различных материалов, поглощающих шум.
- Санитарно-технические мероприятия - использование поглощающих панелей, специальных кожухов.
- Индивидуальные средства защиты (беруши уменьшают шум на 15 дБ, наушники - на 30 дБ).
- Организационные мероприятия - рациональный режим труда и отдыха.
- Медицинские профилактические осмотры.
- Законодательные мероприятия - нормирование шума в производственных помещениях. Для цехов норма шума составляет 80 дБ. Если человек находится в диспетчерской, то есть защищен от общего цехового шума, то уровень шума не должен превышать 60 дБ.
- Механического (вибрционного) происхождения – это механические колебания, генерируемые машинами, частотой менее 20 Гц
- Аэродинамического происхождения, возникающий в результате больших турбулентных потоков газов или жидкостей. Он способен распространяться на большие расстояния по воздуху, воде, земной поверхности
- Вместе с ветром
- Грозовыми разрядами
- Обвалами, взрывами
- Землетрясениями
При более интенсивном воздействии ИФЗ добавляются:
- Ощущение беспокойства, раздражительность, нарастание панического страха
- Сухость во рту, царапанье в глотке, кашель, удушье
Длительное воздействие ИФЗ интенсивностью более 150 дБ ведет к развитию миокардиодистрофии (снижение ЧСС и силы, глухость тонов). Упругий мощный ИФЗ способен повредить миокард и даже вызвать остановку сердца.
Со стороны органов слуха: чувство давления в ушах, повышение порога слышимости, гиперемия барабанной перепонки.
При объективном осмотре:
- Заторможенность
- Вялость
- Глухость тонов сердца
- Стойкое снижение слуха любой этиологии
- Отосклероз и другие хронические заболевания уха
- Нарушение вестибулярного аппарата любой этиологии, в том числе болезнь Меньера.
- Механический: сжатие – растяжение
- Термический при переходе механической энергии в тепловую на границе раздела (например, твердого и жидкости)
- Физико-химический эффект: образование кавитации (микропузырьков), которая возникает при распространении УЗ интенсивностью свыше 0,3 Вт/см2 в жидкостях и в биологических тканях. В тканях кавитация сопровождается:
- повышением температуры и давления,
- возникновением электрических зарядов,
- ионизацией молекул воды, распадающиеся на свободные гидроксильные радикалы и атомарный водород) продукты распада ионизированных молекул воды крайне активны).
Низкочастотные звуковые колебания с их преимущественно механическим эффектом широко используются для промывки и обезжиривания металлических деталей, оптических стекол, керамики. Ультразвук оказался эффективным для изготовления эмульсий из несмешивающихся жидкостей, для ускорения электролитических процессов в гальванотехнике, при расщеплении целлюлозы в бумажной промышленности и.д.
Он нашел также широкое применение в медицине, используется при диагностике многих заболеваний.
- ЦНС и периферической,
- эндокринной
- сердечно-сосудистой
При воздействии ультразвука развивается клиника ангиотрофоневроза в компенсированной форме.
Основные жалобы:
- Головная боль, плохой сон,
- Неприятные ощущения в руках
При осмотре:
- Явные вегетативные нарушения (тремор пальцев рук, неустойчивость в позе Ромберга и др.), нарушение чувствительности: температурной, тактильной, вибрационной
- Кисти рук холодные, цианотичные, мраморность кожных покровов.
- Нарушение ритма сердца: чаще бради-, реже тахикардия; гипотония
- В выраженных случаях может развиться гипоталамическая недостаточность:
- Приступы упорных головных болей, головокружений
- Анорексия с потерей массы тела
- Субфебрилитет
В начальной стадии ангиотрофоневроза преобладает синдром вегетативной невралгии конечностей на фоне вегетососудистой дистонии.
На второй стадии:
Клиника полинейропатии верхних конечностей
Астеновегетативный синдром
- Диэнцефальная патология с явлениями гипоталамической недостаточности:
- Нарушения чувствительности
- Сосудистые и трофические изменения на верхних и на нижних конечностях
- Возможны эндокринные нарушения (гипогликемия)
- Гальванизация по методу Щербака
- Родоновые, соляно-хвойные, сероводородные ванны
- Массаж, ИРТ
- Санаторно-курортное лечение
Показаны оздоровление в санатории- профилактории, диспансерное наблюдение.
При более выраженных симптомах заболевания и отсутствии терапевтического эффекта больного необходимо перевести на работу, не связанную с воздействием физического фактора.
Профилактика
Необходимо усовершенствование ультразвуковых установок.
В настоящее время широко внедряется дистанционное управление оборудованием.
Используются средства индивидуальной защиты (перчатки, противошумы и др.)
Периодические медицинские осмотры проводятся 1 раз в 2 года с участием невропатолога и терапевта.
- Хронические заболевания периферической нервной системы
- Облитерирующий эндартериит, болезнь Рейно, ангиоспазмы периферических сосудов.
Организатор:
- «Академия непрерывного медицинского образования», учебный центр дополнительного последипломного образования врачей и среднего медицинского персонала.
Читайте также:
