Трансплантация стволовых клеток при нейробластоме и опухолях мозга
Добавил пользователь Morpheus Обновлено: 29.01.2026
Актуальность. Нейробластома (НБ) – первая по частоте экстракраниальная детская солидная опухоль. Прогноз пациентов группы высокого риска остается неблагоприятным, что требует интенсивной комплексной терапии, включающей в себя высокодозную полихимиотерапию (ВДПХТ) с аутологичной трансплантацией гемопоэтических стволовых клеток (ауто-ТГСК). Авторами представлен опыт применения ВДПХТ с ауто-ТГСК у пациентов с НБ в отделении трансплантации костного мозга для детей № 2 НИИ ДОГиТ им. Р.М. Горбачевой ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России.
Материалы и методы. Проанализированы результаты лечения в когорте из 72 пациентов c НБ группы высокого риска. В 69 случаях применялся режим кондиционирования Bu-Mel (бусульфан 16 мг/кг, мелфалан 140 мг/м2 ), у 3 больных – режим 5D/5D (карбоплатин 1000 мг/м2 , иринотекан 150 мг/м2 , темозоломид 750 мг/м2 , этопозид 400 мг/м2 , циклофосфамид 140 мг/кг). В качестве источника трансплантата использовался аутологичный костный мозг (КМ) (n = 59; 82 %), стволовые клетки периферической крови (СКПК) (n = 11; 15 %), либо КМ и СКПК (n = 2; 3 %). У 52 (79 %) из 66 пациентов с исходным поражением КМ выполнена оценка потенциальной контаминации трансплантата методом проточной цитофлуориметрии.
Результаты. Двухлетняя и 5-летняя общая (ОВ) и бессобытийная (БСВ) выживаемость составили 61 % и 48 %, 41 % и 35 % соответственно. Основными факторами, негативно влияющими на ОВ и БСВ, были возраст на момент заболевания более 18 месяцев, сочетанное поражение костей и КМ, выявление амплификации MYCN, уровень нейронспецифической енолазы в дебюте заболевания более 100 нг/мл, резистентность к индукционной терапии, рецидив заболевания и сохранение метайодбензилгуанидин-позитивных очагов поражения до и после ВДПХТ с ауто-ТГСК.
Заключение. Достигнутые результаты сопоставимы с литературными данными. В отдельных группах пациентов с НБ высокого риска ВДПХТ с ауто-ТГСК недостаточно эффективна. Необходимо совершенствование стратификации и использование дополнительных терапевтических методов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проведено без спонсорской поддержки.
Ключевые слова
Об авторах
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
Илья Викторович Казанцев
врач-детский онколог отделения трансплантации костного мозга для детей № 2
ассистент кафедры гематологии, трансфузиологии и трансплантологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
к.м.н., заведующая отделением трансплантации костного мозга для детей № 2
ассистент кафедры гематологии, трансфузиологии и трансплантологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой
Россия
врач-детский онколог отделения трансплантации костного мозга для детей № 2
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой
Россия
врач-детский онколог отделения трансплантации костного мозга для детей № 2
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
к.м.н., старший научный сотрудник
доцент кафедры гематологии, трансфузиологии и трансплантологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
к.м.н., врач-детский онколог отделения трансплантации костного мозга для детей № 2
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой
Россия
заведующая отделением криоконсервации с лабораторией контроля качества гемопоэтических клеток
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой
Россия
М.А. Эстрина: заведующая отделением клинической трансфузиологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
врач-трансфузиолог отделения клинической трансфузиологии
заведующий радиологическим отделением
ассистент кафедры рентгенологии и радиационной медицины
врач радиологического отделения
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
к.м.н., врач-детский онколог отделения трансплантации костного мозга для детей № 2
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
д.м.н., профессор кафедры гематологии, трансфузиологии и трансплантологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
д.м.н., профессор кафедры гематологии, трансфузиологии и трансплантологии
Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Россия
д.м.н., профессор, директор
заведующий кафедрой гематологии, трансфузиологии и трансплантологии
Список литературы
1. Мень Т.Х., Поляков В.Г., Алиев М.Д. Эпидемиология злокачественных новообразований у детей в России. Онкопедиатрия 2014;1:7–13. [Men T.Kh., Polyakov V.G., Aliyev M.D. Epidemiology of malignant neoplasms in children in Russia. Onkopediatriya = Oncopediatrics 2014;1:7–13. (In Russ.)].
2. Maris J., Hogarty M., Bagatell R., Cohn S.L. Neuroblastoma. Lancet 2007;369(9579):2106–20. doi: 10.1016/S0140-6736(07)60983-0.
3. Smith M.A., Alterkruse S.F., Adamson P.C., Reaman G.H., Seibel N.L. Declining childhood and adolescent cancer mortality. Cancer 2014;120(16):2497–506. doi: 10.1002/cncr.28748.
4. Pinto N.R., Applebaum M.A., Volchenboum S.L., Matthay K.K., London W.B., Ambros P.F., Nakagawara A., Berthold F., Schleiermacher G., Park J.R., Valteau-Couaned D., Pearson A.D., Cohn S.L. Advances in Risk Classifi cation and Treatment Strategies for Neuroblastoma. J Clin Oncol 2015;33(27):3008–17. doi: 10.1200/JCO.2014.59.4648.
5. Maris J. Recent Advances in Neuroblastoma. N Engl J Med 2010;362(23):2202–11. doi: 10.1056/NEJMra0804577.
6. Matthay K.K., Shulkin B., Ladenstein R., Michon J., Giammarile F., Lewington V., Pearson A.D., Cohn S.L. Criteria for evaluation of disease extent by (123)I-metaiodobenzylguanidine scans in neuroblastoma: a report for the International Neuroblastoma Risk Group (INRG) Task Force. Br J Cancer 2010;102(9):1319–26. doi: 10.1038/sj.bjc.6605621.
7. Cohn S.L., Pearson A.D., London W.B., Monclair T., Ambros P.F., Brodeur G.M., Faldum A., Hero B., Iehara T., Machin D., Mosseri V., Simon T., Garaventa A., Castel V., Matthay K.K.; INRG Task Force. The International Neuroblastoma Risk Group (INRG) classifi cation system: an INRG Task Force report. J Clin Oncol 2009;27(2):289–97. doi: 10.1200/JCO.2008.16.6785.
8. Ward E., DeSantis C., Robbins A., Kohler B., Jemal A. Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 2014;64(2):83–103. doi: 10.3322/caac.21219.
9. Matthay K.K., Reynolds C.P., Seeger R.C., Shimada H., Adkins E.S., Haas-Kogan D., Gerbing R.B., London W.B., Villablanca J.G. Longterm results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cisretinoic acid: a children’s oncology group study. J Clin Oncol 2009;27(7):1007–13. doi: 10.1200/JCO.2007.13.8925.
11. Шаманская Т.В., Качанов Д.Ю., Андреев Е.С., Талыпов С.Р., Хисматуллина Р.Д., Шевцов Д.В., Скоробогатова Е.В., Киргизов К.И., Хачатрян Л.А., Рощин В.Ю., Ольшанская Ю.В., Осипова Е.Ю., Казакова А.Н., Терещенко Г.В., Щербаков А.П., Ликарь Ю.Н., Райкина Е.В., Феоктистова Е.В., Нечеснюк А.В., Грачёв Н.С., Фомин Д.К., Масчан М.А., Варфоломеева С.Р. Результаты терапии пациентов с нейробластомой группы высокого риска. Российский журнал детской гематологии и онкологии (специальный номер) 2018:88;тезис № 533. [Shamanskaya T.V., Kachanov D.Yu., Andreev E.S., Talypov S.R., Khismatullina R.D., Shevtsov D.V., Skorobogatova E.V., Kirgizov K.I., Khachatryan L.A., Roshchin V.Yu., Olshanskaya Yu.V., Osipova E.Yu., Kazakova A.N., Tereshchenko G.V., Shcherbakov A.P., Likar Yu.N., Raikina E.V. , Feoktistova E.V., Nechesnyuk A.V., Grachev N.S., Fomin D.K., Maschan M.A., Varfolomeeva S.R. Results of treatment of patients with high-risk neuroblastoma. Rossiyskiy zhurnal detskoy gematologii i onkologii = Russian Journal of Pediatric Hematology and Oncology (special number) 2018:88;abstr. 533. (In Russ.)].
12. Хижников А.В., Казанцев А.П. Лечение пациентов с нейробластомой группы высокого риска. Онкопедиатрия 2017;4(2):131–40. doi: 10.15690/onco.v4i2.1707. [Khizhnikov A.V., Kazantsev A.P. Treatment of patients with high-risk neuroblastoma. Onkopediatriya = Oncopediatrics 2017;4(2):131–40. (In Russ.)].
13. Скоробогатова Е.В., Балашов Д.Н., Трахтман П.Е., Масчан А.А., Румянцев А.Г., Киргизов К.И. Итоги двадцатилетнего опыта трансплантации гемопоэтических стволовых клеток у детей. Педиатрия 2011;90(4):12–6. [Skorobogatova E.V., Balashov D.N., Trakhtman P.E., Maschan A.A., Rumyantsev A.G., Kirgizov K.I. The results of twenty years of experience in hematopoietic stem cell transplantation in children. Pediatriya = Pediatrics 2011;90(4):12–6. (In Russ.)].
14. Corbacioglu S., Carreras E., Ansari M., Balduzzi A., Cesaro S., Dalle J.H., Dignan F., Gibson B., Guengoer T., Gruhn B., Lankester A., Locatelli F., Pagliuca A., Peters C., Richardson P.G., Schulz A.S., Sedlacek P., Stein J., Sykora K.W., Toporski J., Trigoso E., Vetteranta K., Wachowiak J., Wallhult E., Wynn R., Yaniv I., Yesilepek A., Mohty M., Bader P. Diagnosis and severity criteria for sinusoidal obstruction syndrome/veno-occlusive disease in pediatric patients: a new classifi cation from the European society for blood and marrow transplantation. Bone Marrow Transplant 2018;53(2):138–45. doi: 10.1038/bmt.2017.161.
15. Morgenstern D.A., Pötschger U., Moreno L., Papadakis V., Owens C., Ash S., Pasqualini C., Luksch R., Garaventa A., Canete A., Elliot M., Wieczorek A., Laureys G., Kogner P., Malis J., Ruud E., Beck-Popovic M., Schleiermacher G., Valteau-Couanet D., Ladenstein R. Risk stratifi cation of high-risk metastatic neuroblastoma: A report from the HR-NBL-1/SIOPEN study. Pediatr Blood Cancer 2018;65(11):e27363. doi: 10.1002/pbc.27363.
16. Georantzi K., Sköldenberg E.G., Stridsberg M., Kogner P., Jakobson Å., Janson E.T., Christoff erson R.H.B. Chromogranin A and neuronspecifi c enolase in neuroblastoma: Correlation to stage and prognostic factors. Pediatr Hematol Oncol 2018;35(2):156–65. doi: 10.1080/08880018.2018.1464087.
17. Cheung N.K., Zhang J., Parker M., Bahrami A., Tickoo S.K., Heguy A., Pappo A.S., Federico S., Dalton J., Cheung I.Y., Ding L., Fulton R., Wang J., Chen X., Becksfort J., Wu J., Billups C.A., Ellison D., Mardis E.R., Wilson R.K., Downing J.R., Dyer M.A.; St Jude Children’s Research Hospital – Washington University Pediatric Cancer Genome Project. Association of age at diagnosis and genetic mutations in patients with neuroblastoma. JAMA 2012;307(10):1062–71. doi: 10.1001/jama.2012.228.
18. Suzuki M., Kushner B.H., Kramer K., Basu E.M., Roberts S.S., Hammond W.J., LaQuaglia M.P., Wolden S.L., Cheung N.V., Modak S. Treatment and outcome of adult-onset neuroblastoma. Int J Cancer 2018;143(5):1249–58. doi: 10.1002/ijc.31399.
19. Berthold F., Hömberg M., Proleskovskaya I., Mazanek P., Belogurova M., Ernst A., Sterba J. Metronomic therapy has low toxicity and is as eff ective as current standard treatment for recurrent high-risk neuroblastoma. Pediatr Hematol Oncol 2017;37(5):308–19. doi: 10.1080/08880018.2017.1373314.
20. Kalra R., Zoger S., Kosovich M.S., Matthay K.K. Radiological case of the month. Miliary pulmonary neuroblastoma. Arch Pediatr Adolesc Med 1995;149(2):195–6.
21. Попов А.М., Шориков Е.В., Вержбицкая Т.Ю., Цаур Г.А., Друй А.Е., Солодовников А.Г., Савельев Л.И., Фечина Л.Г. Прогностическое значение определения поражения костного мозга у детей с нейробластомой методом проточной цитометрии. Вопросы онкологии 2014;60(4):470–6. [Popov A.M., Shorikov E.V., Verzhbitskaya T.Yu., Tsaur G.A., Druy A.E., Solodovnikov A.G., Saveliev L.I., Fechina L.G. The prognostic value of determining bone marrow damage in children with neuroblastoma by fl ow cytometry. Voprosy onkologii = Problems in Oncology 2014;60(4):470–6. (In Russ.)].
22. Попов А.М., Друй А.Е., Шориков Е.В., Цаур Г.А., Вержбицкая Т.Ю., Савельев Л.И., Фечина Л.Г. Сравнение результатов определения поражения костного мозга у детей с нейробластомой методами проточной цитометрии и полимеразной цепной реакции. Вопросы онкологии 2015;61(5):767–73. [Popov A.M., Druy A.E., Shorikov E.V., Tsaur G.A., Verzhbitskaya T.Yu., Saveliev L.I., Fechina L.G. Comparison of bone marrow lesion in children with neuroblastoma using fl ow cytometry and polymerase chain reaction. Voprosy onkologii = Problems in Oncology 2015;61(5):767–73. (In Russ.)].
23. Druy A.E., Shorikov E.V., Tsaur G.A., Popov A.M., Zaychikov A.N., Tuponogov S.N., Saveliev L.I., Tytgat G.A.M., Fechina L.G. Prospective investigation of applicability and the prognostic signifi cance of bone marrow involvement in patients with neuroblastoma detected by quantitative reverse transcription PCR. Pediatr Blood Cancer 2018;65(11):e27354. doi: 10.1002/pbc.27354.
25. Abate M.E., Paoili A., Cammeli S., Cesari M., Longhi A., Palmerini E., Ferrari S., Carreta E., Picci P., Piscaglia F. Sinusoidal obstruction syndrome/venoocclusive disease after high-dose intravenous busulfan/melphalan conditioning therapy in high-risk Ewing sarcoma. Bone Marrow Transplant 2018;53(5):591–9. doi: 10.1038/s41409-017-0066-4.
26. Applebaum M.A., Vaksman Z., Lee S.M., Hungate E.A., Henderson T.O., London W.B., Pinto N., Volchenboum S.L., Park J.R., Naranjo A., Hero B., Pearson A.D., Stranger B.E., Cohn S.L., Diskin S.J. Neuroblastoma survivors are at increased risk for second malignancies: A report from the International Neuroblastoma Risk Group Project. Eur J Cancer 2017;72:177–85. doi: 10.1016/j.ejca.2016.11.022.
29. Yanik G.A., Villablanca J.G., Maris J.M., Weiss B., Groshen S., Marachelian A., Park J.R., Tsao-Wei D., Hawkins R., Shulkin B.L., Jackson H., Goodarzian F., Shimada H., Courtier J., Hutchinson R., Haas-Koga D., Hasenauer C.B., Czarnecki S., Katzenstein H.M., Matthay K.K. 131I-Metaiodobenzylguanidine with Intensive Chemotherapy and Autologous Stem Cell Transplantation for HighRisk Neuroblastoma. A New Approaches to Neuroblastoma Therapy (NANT) Phase II Study. Biol Blood Marrow Transplant 2015;21(4):673-81. doi: 10.1016/j.bbmt.2014.12.008.
30. Ladenstein R., Pötschger U., Valteau-Couanet D., Gray J., Luksch R., Castel V., Shifra A., Laureys G., Owens C., Trahair T., Chi Fung Chan G., Ruud E., Schroeder H., Popovic M.B., Loibner H., Schreier G., Ambros P.F., Sarnacki S., Boterberg T., Lode H.N. Immunotherapy with anti-GD2 antibody ch4.18/CHO ± IL2 within the HR-NBL1/ SIOPEN trial to improve outcome of high-risk neuroblastoma patients compared to historical controls. J Clin Oncol 2018;36(15s):1059. doi: 10.1200/JCO.2018.36.15_suppl.10539.
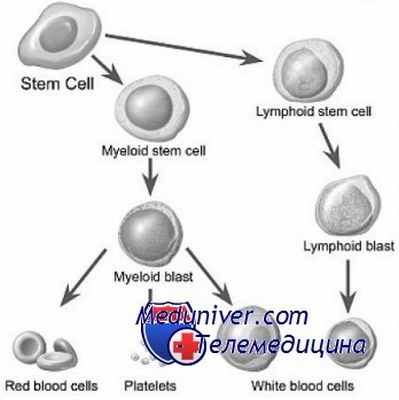
Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических стволовых клеток (ТГСК) – метод лечения, широко применяющийся при многих гематологических, онкологических и генетических заболеваниях. В обиходе для этого метода часто используется термин «трансплантация костного мозга», хотя в действительности сейчас далеко не всегда для ТГСК используется именно донорский костный мозг. Гемопоэтические стволовые клетки для трансплантации могут быть взяты из разных источников: как действительно из костного мозга (ТКМ), так и из периферической крови (ТПСК) или пуповинной крови.
Суть ТГСК заключается в следующем. Сначала больной получает терапию кондиционирования (как правило, это химиотерапия высокими дозами препаратов, иногда в сочетании с облучением всего тела), которая полностью подавляет его собственный костный мозг. Затем больному внутривенно вводятся суспензия гемопоэтических стволовых клеток (ГСК), которые постепенно заселяют его костный мозг и восстанавливают кроветворение.
Существуют два основных типа ТГСК.
I. При аутологичной трансплантации (аутотрансплантация, ауто-ТГСК) больному вводят его собственные ГСК, взятые у него заранее в ходе лечения (например, после нескольких блоков химиотерапии) и хранившиеся в замороженном виде до момента трансплантации. Ауто-ТГСК чаще всего применяется при лечении злокачественных солидных опухолей: различных лимфом, нейробластомы, опухолей головного мозга и др. Смысл этой процедуры заключается в том, что она позволяет проводить лечение очень высокими дозами химиопрепаратов. Такие дозы нельзя использовать при обычной химиотерапии, так как они приводят к необратимому повреждению костного мозга. Но если у больного было заранее взято достаточное количество ГСК, то можно провести высокодозную химиотерапию (ВДХТ), после чего ввести больному его собственные сохраненные клетки. Эти клетки приживаются в костном мозге и восстанавливают кроветворение. Так как используются собственные клетки, при ауто-ТГСК отсутствуют иммунные осложнения. К сожалению, ауто-ТГСК эффективна далеко не при всех болезнях.
II. При аллогенной трансплантации (аллотрансплантация, алло-ТГСК) больному вводят гемопоэтические стволовые клетки донора. Этот донор может быть совместимым родственным (например, брат или сестра больного), частично совместимым родственным (обычно кто-то из родителей) либо неродственным; в последнем случае необходима сложная процедура его подбора через регистры доноров гемопоэтических стволовых клеток.
Смысл проведения алло-ТГСК заключается в том, чтобы собственное кроветворение больного было полностью заменено донорским. В случае успеха алло-ТГСК приводит к излечению целого ряда заболеваний кроветворной системы – как врожденных, так и приобретенных. Аллогенные трансплантации широко применяются для лечения лейкозов, апластической анемии, миелодиспластических синдромов и многих наследственных заболеваний (таких как анемия Фанкони, анемия Блэкфана-Даймонда, синдром Вискотта-Олдрича, тяжелая комбинированная иммунная недостаточность и т.п.).
Трансплантации ГСК уже позволили спасти многие десятки тысяч жизней по всему миру. Однако сама процедура ТГСК связана со значительными рисками. Состояние панцитопении и низкого иммунитета в ранний период после трансплантации влечет за собой угрозу инфекций. В результате химиотерапии могут повреждаться различные органы – в частности, печень, легкие, сердце, кровеносные сосуды. Очень серьезным осложнением аллогенной трансплантации может стать острая или хроническая реакция «трансплантат против хозяина». Поэтому ТГСК проводится только в случаях жизненной необходимости, и врачи каждый раз взвешивают соотношение всех рисков и возможного положительного эффекта.
Проведение ауто-ТГСК: 1) подготовительная терапия, приводящая к снижению числа опухолевых клеток, 2) взятие ГСК из костного мозга или крови, 3) замораживание их суспензии для последующего использования, 4) ввод размороженной суспензии после кондиционирования пациента.
Проведение алло-ТГСК: 1) взятие донорских клеток, 2) при необходимости – дополнительная обработка трансплантата, 3) ввод клеток реципиенту, получившему кондиционирование.
Трансплантация стволовых клеток при нейробластоме и опухолях мозга
Трансплантация стволовых клеток при нейробластоме и опухолях мозга
Нейробластома самая частая внечерепная солидная опухоль у детей. Имеются данные о несколько лучших результатах трансплантации кроветворных стволовых клеток (ТКСК) при этой опухоли по сравнению с химиотерапией (рандомизированные сравнительные испытания проводятся в настоящее время). 3-летняя БРВ после ТКСК на поздних стадиях развития опухоли колебалась в пределах 7-25%, но при трансплантации на ранних стадиях достигала 25-55 %.
Трансплантация стволовых клеток (ТКСК) особенно эффективна при высоком риске распространения и рецидива опухоли, включая больных с амплификацией гена NMYC, детей старше 2 лет, случаи неполной ремиссии после химиотерапии и наличие метастазов в костный мозг. В рандомизированном исследовании Группы детского рака (Children's Cancer Group) больным с плохим прогнозом после химиотерапии, облучения или операции проводили аутотрансплантацию кроветворных стволовых клеток и лечение 13-цис-ретиноевой кислотой (13-РК).
3-летняя безрецидивная выживаемость (БРВ) после одной только химиотерапии составила 18%, после химиотерапии + 13-РК - 32%, после трансплантации кроветворных стволовых клеток (ТКСК) - 40%, а после трансплантации кроветворных стволовых клеток (ТКСК) + 13-РК — 55 %. Эти данные отражают способность 13-РК индуцировать дифференцировку ганглионейронов при нейробластоме.
На долю опухолей ЦНС приходится 20% всех злокачественных новообразований в детском возрасте. Высокодозная химиотерапия сопряжена с угнетением миелопоэза, и ТКСК в таких случаях играет спасительную роль. Проводилось объединенное исследование с участием 53 больных с медуллобластомой или супратенториальными примитивными опухолями нейроэктодермального происхождения.
После операции, курса топотекана и облучения назначали четыре цикла терапии циклофосфамидом, цисплатином и винкристином, а также аутотрансплантацию стволовых клеток периферической крови. У больных с плохим прогнозом (19 человек) 2-летняя БРВ составила 73 %, а в группе среднего риска (34 человека) — 93%. Итальянские врачи наблюдали 11 детей с рецидивом медуллобластомы (3), полиморфной глиобластомой (2), нейроэктодермальной опухолью (2), эпендимомой (2), анапластической астроцитомой (1) и анапластической олдигодендроглиомой (1).
Перед аутотрансплантацией костного мозга больные получали этопозид и бис-хлорэтилнитрозомочевину или тиоТЭФ по обычной схеме. 5 детей, у которых к моменту трансплантации опухоль не выявлялась, жили без рецидива в течение в среднем 20 мес. В исследовании Группы детского рака 23 больным с рецидивом медуллобластомы перед ТКСК вводили карбоплатин, тиоТЭФ и этопозид. Трехлетняя БРВ составила 34 %.
В другом исследовании у детей с недавно выявленными опухолями головного мозга (злокачественная глиома — 9, эпендимома — 10, глиома ствола мозга — 6, медуллобластома — 13, нейроэктодермальная опухоль — 14, прочие — 10) перед ТКСК использовали только химиотерапию (винкристин, цисплатин, циклофосфамид и этопозид). Из 62 больных у 37 к моменту аутотрансплантации костного мозга опухоль не прогрессировала, 2-летняя БРВ после трансплантации составила 41 % (27% с учетом всех 62 случаев).
Пересадка (трансплантация) костного мозга в Беларуси: Цены
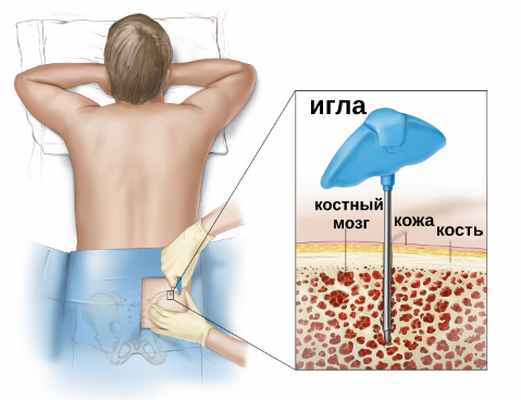
Костный мозг – это губчатая мягкая ткань внутри кости. Все типы клеток крови, включая молодые клетки крови, производимые костным мозгом, называют стволовыми.
Пересадка костного мозга предусматривает введение в человеческий организм здоровых кроветворных клеток, чтобы заменить поврежденные или больные. Чаще стволовые клетки берут не из костного мозга, а из крови. Поэтому процедуру часто называют трансплантацией стволовых клеток крови.
Операцию используют в качестве потенциально излечивающей терапии для некоторых опасных онкогематологических заболеваний и незлокачественных болезней крови. Трансплантация костного мозга необходима в случаях, когда кровь не справляется со своими функциями. Эта процедура эффективна при различных заболеваниях в том числе:
- тяжелых формах апластической анемии,
- опухолевых заболеваниях крови (множественной миеломе, лимфоме, лейкозе, лимфогранулематозе, нейробластоме и пр.),
- неопухолевых болезнях с поражением тромбоцитарного и эритроцитарного ростков кроветворения,
- серьезных поражениях иммунной системы,
- генетических и аутоиммунных заболеваниях.
Показания к аллогенной ТГСК у взрослых.
- острый миелоидный лейкоз;
- острый лимфобластный лейкоз);
- миелодиспластический синдром;
- хронический миелолейкоз;
- злокачественная лимфома;
- первичный миелофиброз ;
- апластическая анемия);
- лимфома Ходжкина;
- хронический лимфолейкоз;
- Первичный миелофиброз
- талассемия;
Показания к аутологичной ТГСК у взрослых:
- Злокачественная неходжкинская лимфома;
- Лимфома Ходжкина;
- Множественная миелома;
- Аутоиммунные заболевания (рассеянный склероз и другие).
- Острый миелоидный лейкоз;
- Острый лимфобластный лейкоз;
- Нейробластома
- Солидные опухоли
Здоровый костный мозг пересаживают с целью замены им больного костного мозга, дефектного или поврежденного.
Противопоказания
Среди противопоказаний к пересадке костного мозга пациенту такие состояния, как:
- неконтролируемая инфекция,
- декомпенсированные заболевания (почек, сердца, органов дыхания, печени, сосудов),
- неэффективность высокодозной;химиотерапии,
- серьезные психические расстройства,
- положительный тест на беременность,
Виды трансплантации костного мозга
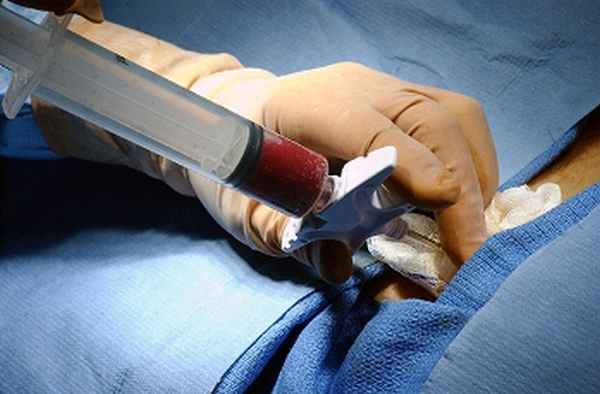
Аутологичная трансплантация– в данном случае для пересадки используют собственный костный мозг или стволовые клетки пациента.
Аллогенная трансплантация– пересадка костного мозга от донора. Обычно, вследствие необходимости проведения дополнительных анализов для подбора генетически совместимого донора, этот тип пересадки занимает более длительное время.
Различие между ними одно: кроветворные клетки крови принадлежат либо вам, либо донору.
У пациента при аутологичном типе процедуры на сепараторе клеток собирают стволовые клетки для замораживания. Перед трансплантацией проводится режим подготовки - кондиционирование. Затем пациенту вводят его же собственные клетки, размороженные после хранения в жидком азоте при температуре минус 197 градусов Цельсия. Благодаря этой пересадке идет восстановление кроветворной и иммунной систем пациента и замена поврежденного болезнью и химиотерапией костного мозга. Аутотрансплантацию проводят в стадии ремиссии заболевания.
При аллопересадке костный мозг берут у донора с совместимым генотипом. Аллогенная трансплантация имеет несколько подвидов:
- от близкородственного совместимого донора,
- от неродственного донора совместимого по HLA системе,
- из пуповинной крови, совместимой по HLA системе,
- от частично совместимого донора (гаплоиндентичная пересадка от одного из родителей либо детей).
Подобрать неродственного донора довольно сложно. При отсутствии родственного донора проводится поиск в национальных и международных регистрах.
План лечения

После принятия решения о целесообразности пересадки костного мозга алгоритм действий состоит из нескольких этапов:
- Тщательная диагностика для исключения наличия в организме инфекций;
- Забор и подготовка трансплантата (донорского или аутологичного); метод обработки биоматериала зависит от диагноза и ряда других факторов;
- Высокодозная химиотерапия для уничтожения патологических клеток костного мозга (обычно занимает 5-6 дней) – режим кондиционирования;
- Пересадка костного мозга;
- Изоляция и послеоперационное наблюдение – во избежание развития инфекций и других послеоперационных осложнений, по окончании процедуры пациент переводится в специальную палату с ламинарным потоком воздуха, где он остается до приживления костного мозга;
- Амбулаторное наблюдение, в ходе которого регулярно выполняются анализы крови и другие необходимые исследования по оценки приживления трансплантата, мониторингу основного заболевания
Стоимость пересадки костного мозга
Стоимость пересадки костного мозга индивидуальна для каждого пациента и рассчитывается в соответствии с диагнозом, типом трансплантации (аутологичная или аллогенная) и типом вводимого биоматериала (костный мозг, гемопоэтические клетки, и т.д.). При этом цена процедуры в Республике Беларусь будет существенно ниже, чем в странах западной Европы, США и других странах.
В стоимость трансплантации костного мозга в центре включаются:
- Диагностика заболевания и его стадирование по международным критериям;
- Химиотерапия перед трансплантацией;
- Дополнительные медикаментозные препараты;
- Забор и хранение биоматериала;
- Процедура трансплантации;
- Госпитализация в специализированной одноместной палате;
- Препараты крови;
- Если проводится аллогенная трансплантация, стоимость лечения также будет включать поиск донора (если нет родственного донора) и его подбор по системе HLA в соответствии с критериями Международной федерации иммуногенетики.
Преимущества пересадки костного мозга в Беларуси
Пациенты выбирают наш центр, потому что:
- Белорусский центр трансплантации костного мозга был открыт более 25 лет назад и имеет опыт выполнения более 2 тысяч трансплантаций. Врачи центра прошли обучение в клиниках Германии, Великобритании и Италии.
- Благодаря использованию в лечении передовых технологий специалистам удалось достичь значительных ремиссий у пациентов, которым была проведена пересадка костного мозга. Беларусь – страна, куда едут искать спасения больные из многих стран.
- По желанию пациента мы оказываем весь комплекс сервис-услуг, встречу в аэропорту
Мы осуществляем динамическое наблюдение гематолога и уход в послеоперационным периоде. Уход за пациентами осуществляется специально обученным персоналом.
Редкие заболевания при которых требуется пересадка костного мозга и сколько это стоит?
Трансплантация костного мозга является единственным способом лечения тяжелых заболеваний крови. Согласно статистике Всемирной организации здравоохранения, ежегодно в мире проводится более 50,000 подобных операций. После пересадки стволовых кроветворных клеток пациент получает второй шанс на жизнь.
Какие редкие болезни можно вылечить с помощью ТКМ, где проводят данную процедуру за границей и сколько за это нужно заплатить – читайте в нашей статье.
Слушать статью:
Нейробластома
Ежегодно регистрируется почти 500 новых случаев болезни. Более 90% нейробластом обнаруживают у детей в возрасте до 5 лет. Около 30% случаев диагностируют до 1 года. Недуг редко проявляется у подростков и взрослых, но результаты лечения этой возрастной группы менее оптимистичные.
Основа лечения нейробластомы состоит из химиотерапии, хирургической резекции, лучевой терапии и трансплантации костного мозга. Тем не менее, многие агрессивные опухоли развивают устойчивость к химическим препаратам, что значительно увеличивает вероятность рецидива.
Выбор методов для борьбы с этим заболеванием зависит от стадии опухоли и степени риска повторного появления раковых клеток. При своевременном и правильном лечении пациенты с нейробластомой 1-2 стадии имеют высокие шансы на полное излечение. Шанс на выживание для опухолей низкого риска рецидива – 90% и более 70% – для среднего. Лечение нейробластомы с высокой вероятностью рецидива эффективно у менее 30% случаев.
В марте 2009 года Детская онкологическая группа (COG) провела исследование. В нем приняли участие 226 человек с высоким риском рецидива нейробластомы. Результат показал, что через два года после трансплантации стволовых клеток у 66% больных рак отступил. Пациенты получили терапию моноклональными антителами, которые повысили шансы на благоприятный исход.
Когда нейробластома диагностируется на последней стадии, 5-летняя выживаемость онкобольных не превышает 20%. Высокодозная химиотерапия вместе с хирургией и пересадкой гемопоэтических стволовых клеток снижает смертность у пациентов с нейробластомой последней стадии. Новые подходы в ТКМ и поддерживающем уходе позволяют пациентам успешно противостоять раку и жить полноценно.
ЗАПИСЬ НА ПЕРЕСАДКУ КОСТНОГО МОЗГА
Чтобы записаться на данную процедуру за границу, нажмите на кнопку ниже и заполните форму. Наши координаторы перезвонят Вам в течение 30 минут. Они предоставят всю необходимую информацию и помогут с организацией поездки.
Миеломная болезнь
Множественная миелома – это вид онкологии костного мозга, который развивается с плазменных клеток крови. Она имеет несколько очагов поражения. Чаще всего встречается у мужчин старше 60 лет. Заболевание является неизлечимым, но хорошо поддается терапии, что значительно продлевает жизнь пациента и повышает ее качество.
5-летняя выживаемость больных, которые прошли комплексное лечение миеломы, составляет более 50%. Если болезнь не лечить, продолжительность жизни не превышает 7 месяцев.
Лечение множественной миеломы зависит от того, есть ли у пациента симптомы и какое у него общее состояние здоровья. Болезнь с бессимптомным течением не нуждается в терапии. В этом случае показано наблюдение. Хотя не существует лекарства от множественной миеломы, у многих пациентов рак можно успешно лечить годами. Основной целью такой терапии считается:
максимально возможное уничтожение миеломных клеток;
контроль роста опухоли;
устранение боли;
предоставление пациенту возможности вести активный образ жизни.
Для больных в возрасте до 65 лет предпочтительным методом борьбы с заболеванием является химиотерапия в высоких дозах и трансплантация стволовых клеток. Существует два типа ТКМ для лечения множественной миеломы. При аутологичной трансплантации гемопоэтических стволовых клеток (ASCT):
собственные стволовые клетки человека собираются из крови пациента;
проводится высокодозная химиотерапия;
сохраненные стволовые клетки пересаживают обратно человеку.
Подобная тактика борьбы с заболеванием не излечивает его, однако позволяет пациенту добиться стойкой и длительной ремиссии. При аллогенной ТКМ стволовые клетки здорового донора пересаживают больному. Аллогенная трансплантация стволовых клеток имеет потенциал для излечения, но используется очень редко. Кроме того, 5–10% смертности пациентов с множественной миеломой, связаны именно с отторжением аллогенных стволовых клеток.
Люди старше 65 лет с другими заболеваниями часто не переносят трансплантацию стволовых клеток. Им показано лечение с использованием химиотерапии.
Лейкоз
Лейкоз – рак кроветворных тканей организма, в том числе костного мозга и лимфатической системы. Заболевание вызвано повышением уровня лейкоцитов. Его лечение комплексное.
Терапия лейкоза зависит от типа онкоклеток, стадии патологии, возраста пациента и других факторов. Своевременная диагностика и правильная программа лечения позволяет 80% пациентов успешно преодолевать 5-летний рубеж выживания.
Аллогенная трансплантация стволовых клеток эффективна при лейкозе. В аллогенной ТКМ материал забирают от родственного или неродственного донора. Лучшими донорами считаются близкие родственники (например, родные брат или сестра).
Если близкие родственники не подходят, стволовые клетки получают от неродственного донора, ткани которого подходит пациенту. Когда донорские иммунные клетки вводят в организм, они распознают любые оставшиеся лейкозные клетки как чужеродные и атакуют их. Такого эффекта при аутологичной трансплантации нет.
Для большинства пациентов с лейкозом, особенно с повышенным риском рецидива, использование аллогенной ТКМ предпочтительнее, чем аутологичной. Лейкемия – заболевание крови и костного мозга. Возвращение пациенту его собственных клеток после лечения означает возвращение некоторых раковых клеток.
ЗАПИСЬ НА ЛЕЧЕНИЕ ЛЕЙКОЗА
Оставьте заявку на нашем сайте, и врачи-координаторы MediGlobus помогут с подбором клиники и организацией лечения за рубежом.
Нефробластома (опухоль Вильмса)
Нефробластома – это редкое злокачественное новообразование почек, которое обычно поражает детей в возрасте до 5 лет. Болезнь характеризуется высокой степенью злокачественности. Лечение нефробластомы комплексное: применяется химиотерапия, радиотерапия, хирургия и пересадка костного мозга. В большинстве случаев прогноз благоприятный. 5-летняя выживаемость составляет от 70 до 90%. Однако для пациентов с рецидивом этот показатель снижен.
Для лечения рецидивирующей опухоли Вильмса используется высокодозная химиотерапия с сохранением собственных стволовых клеток. Такая процедура восстанавливает показатели крови и увеличивает продолжительность жизни больных с нефробластомой.
Саркома Юинга
Саркома Юинга – вид рака, который образуется в кости или мягких тканях. Онкоклетоки развиваются в ногах, тазе и грудной стенке. Болезнь чаще всего встречается у подростков и молодых людей. Поражает преимущественно представителей сильного пола. Программа лечения саркомы Юинга подразумевает использованием нескольких методов, к числу которых относятся:
химиотерапия;
лучевая терапия;
хирургическое вмешательство;
пересадка стволовых клеток.
При саркоме Юинга пациент сначала получает стандартные дозы химиотерапии, а затем хирургическое вмешательство и/или лучевую терапию. Высокодозная химиотерапия с пересадкой стволовых клеток применяется только после основного лечения.
Для ТКМ используются собственные стволовые клетки пациента, которые после забора замораживаются и хранятся до конца курса химиотерапии. Когда лечение заканчивается, стволовые клетки возвращают в организм пациента при переливании крови. Они проходят через кровоток, оседают в костном мозге и в течение нескольких недель начинают производить новые, здоровые клетки крови.
Аллогенная пересадка костного мозга редко применяется для лечения опухолей Юинга.
Где можно сделать ТКМ за рубежом и сколько это стоит?
Пересадку костного мозга можно провести в ведущих клиниках развитых стран мира. Цена этой процедуры зависит от заболевания, вида пересадки (донорский или собственный материал) и наличия у пациента сопутствующих патологий. На стоимость влияет ценовая политика страны и уровень клиники.
Детям и взрослым пациентам ТКМ проводят в:
Турции (Мемориал, Лив, Медикал Парк);
Испании (Униклиника Кирон Мадрид, Униклиника Наварры);
Израиле (Ихилов, Шиба, Хадасса);
Южной Корее (СунЧонХян, Асан, Самсунг);
Германии (Униклиника Фрайбурга, университетская клиника Кельна).
Без доступа к международному банку доноров можно провести пересадку костного мозга в Индии (больница БЛК, сеть клиник Аполло, сеть клиник Фортис). В Турции клиники Коч и Хисар проводят ТКМ взрослым пациентам, а больница Медистейт – детям.
Испания
Турция
Израиль
Германия
Южная Корея
Индия
Резюме
При лечении нейробластомы может применяться пересадка костного мозга, особенно на поздних стадиях заболевания. Лечение помогает одолеть болезнь у 66% больных раком. Высокодозная химиотерапия вместе с хирургией и пересадкой гемопоэтических стволовых клеток снижает смертность у пациентов с нейробластомой даже последней стадии.
5-летняя выживаемость больных с миеломной болезнью составляет более 50%. Для больных в возрасте до 65 лет предпочтительным методом борьбы с заболеванием является химиотерапия в высоких дозах и трансплантация стволовых клеток.
Своевременная диагностика и правильная программа лечения лейкоза позволяет 80% пациентов успешно преодолевать 5-летний рубеж выживания. Предпочтительным методом лечения является аллогенная ТКМ.
Для лечения рецидивирующей опухоли Вильмса используется высокодозная химиотерапия с сохранением собственных стволовых клеток. Пятилетняя выживаемость составляет 70-90%.
При лечении саркомы Юинга применяются химиотерапия с лучевой терапией или операцией, за которой может последовать трансплантация костного мозга. При этой болезни чаще всего применяется аутологичная ТКМ.
Стоимость пересадки костного мозга за рубежом начинается от $25,000. Среди ведущих направлений для этой процедуры – Турция, Германия, Испания, Израиль, Южная Корея и Индия.
Для организации поездки на лечение за границу обращайтесь к врачам-координаторам международной медицинской платформы MediGlobus. Оставляйте свою заявку – мы подберем для Вас наилучший вариант!
Читайте также:
