Трехмерная эхокардиография при недостаточности митрального клапана
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Главный редактор
Лео Антонович Бокерия, доктор медицинских наук, профессор, академик РАН и РАМН, президент
Академик РАН и РАМН Лео Антонович БОКЕРИЯ,
президент им. А.Н. Бакулева,
главный редактор издательства Центра
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
По инициативе Л.А. Бокерия в успешно функционирует учебно-исследовательский центр «Современные медицинские технологии», который ежегодно проводит 4–6 курсов последипломного повышения квалификации специалистов высшего звена.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Академик Л.А. Бокерия проводит приоритетные исследования по созданию биопротезов клапанов сердца для коррекции клапанных пороков – низкопрофильного, изогнутого по плоскости биопротеза митрального и трикуспидального клапанов, воспроизводящего естественную форму фиброзного кольца, на упругоподатливом каркасе. Продолжено изучение эффективности защиты миокарда у детей первого года жизни при применении нового внутриклеточного кардиоплегического раствора «Бокерия – Болдырева», созданного в под руководством Л.А. Бокерия.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – научный руководитель 350 кандидатских и консультант более 100 докторских диссертаций. Он создатель издательства им. А.Н. Бакулева с типографией, основатель и главный редактор журналов «Анналы хирургии», «Бюллетень им. А.Н. Бакулева «Сердечно-сосудистые заболевания», «Детские болезни сердца и сосудов», «Клиническая физиология кровообращения», «Анналы аритмологии», «Креативная кардиология», информационного сборника «Сердечно-сосудистая хирургия»; главный редактор журнала «Грудная и сердечно-сосудистая хирургия».
Активная деятельность Л.А. Бокерия и его вклад в отечественное здравоохранение отмечены званиями и премиями самого высокого достоинства. Он лауреат Ленинской премии (1976 г.), двух Государственных премий (1986 г. – СССР, 2002 г. – РФ), Премии Правительства Российской Федерации (2003 г.). За выдающиеся достижения Л.А. Бокерия награжден орденом «За заслуги перед Отечеством» III (1999 г.), II (2004 г.) и IV (2010 г.) степени, орденом Достоинства и Чести (Республика Грузия, 1999 г.), орденом Преподобного Сергия Радонежского II степени (2001 г.). Русский биографический институт неоднократно признавал Л.А. Бокерия «Человеком года», а в 2000 г. – «Человеком десятилетия» в номинации «Медицина». В 2002 г. он удостоен титула «Человек-легенда», общероссийской премии «Русский национальный Олимп», учрежденной Правительством, Союзом промышленников и фондом «Третье тысячелетие». Как одному из ведущих кардиохирургов мира в 2003 г. Л.А. Бокерия вручена международная премия «Золотой Гиппократ». В 2004 г. он удостоен премии РАН «Триумф» в номинации «Наука о жизни – медицина». В 2004 г. он отмечен наградным знаком – орденом «Меценат», который присуждается Благотворительным фондом «Меценаты столетия» за выдающийся вклад в дело возрождения и процветания мира, за величие души, за бескорыстную щедрость; в 2004 и 2005 г. – Золотым почетным знаком «Общественное признание», который присуждается Национальным фондом «Общественное признание», Национальным гражданским комитетом по взаимодействию с правоохранительными, законодательными и судебными органами и независимой организацией «Гражданское общество» за большой личный вклад в развитие отечественной медицины, проведение уникальных кардиохирургических операций с применением новейших медицинских технологий, спасших жизни сотен детей и новорожденных, многолетнюю и плодотворную научно-практическую, педагогическую и просветительскую деятельность, активную гражданскую позицию.
В 2006 г. Л.А. Бокерия награжден Почетным алмазным орденом «Общественное признание», удостоен диплома Президиума Парламента народов России «за спасение многочисленных жизней, выдающиеся знания, умение руководить, за уникальные личные качества – благородство, мужество, чувство долга, умение беречь честь и достоинство, держать слово и делать дело, в также за веру в великое будущее Отечества», Золотой медали – за выдающийся вклад в образование России и Золотой звезды «Честь, гордость и слава России».
В 2008 г. Л.А. Бокерия награжден медалью «За практический вклад в укрепление здоровья нации», Орденом Чести с присуждением звания «Опора честного бизнеса» и почетного титула «Выдающийся кардиохирург современности». В 2009 г. огромный вклад Л.А. Бокерия в науку и отечественное здравоохранение отмечен присуждением ему Премии имени А.Н. Косыгина «За большие достижения в решении проблем развития экономики России» и премии города Москвы в области медицины «за разработку и внедрение в клиническую практику нового биологического клапана «Биоглис».
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Он президент Ассоциации сердечно-сосудистых хирургов России (1995 г.), президент Общероссийской общественной организации «Лига здоровья нации» (2003 г.), член Общественной палаты РФ всех созывов.
Ишемическая митральная недостаточность: алгоритм эхокардиографического обследования, место трехмерной чреспищеводной эхокардиографии
Цель исследования. Определение диагностических маркеров тяжелых изменений митрального клапана (МК) у пациентов с ишемической митральной регургитацией (ИМР) и предложение модификации алгоритма эхокардиографического обследования.
Материал и методы. Обследованы 65 пациентов с легкой (n=22), умеренной (n=22) и тяжелой (n=21) ИМР методами двумерной (2D) трансторакальной эхокардиографии (ЭхоКГ) c допплерографией, чреспищеводной 2Dи 3D-ЭхоКГ (ЧП-ЭхоКГ).
Результаты. Параметры 3D-геометрии МК взаимосвязаны с показателями степени тяжести ИМР, глобального и регионарного ремоделирования левого желудочка (ЛЖ) и имеют различия при симметричном и асимметричном вариантах ИМР. При симметричном варианте перестройка МК коррелирует со степенью дилатации и снижения сократительной способности ЛЖ, при асимметричном варианте – с показателями регионарного ремоделирования. Тяжелая ИМР характеризуется снижением скорости смещения кольца (27,0±6,6 мм/с против 32,4±10,8 мм/с при легкой ИМР; р<0,05), уменьшением фракции объема тентинга (32,5±14,8% против 56,2±16,8% при легкой ИМР; p<0,05) и фракции площади кольца (4,7±2,7% против 6,6±4,5% при легкой ИМР; р<0,05) МК. Ширина струи регургитации (Vena contracta), радиус площади проксимальной изоскоростной поверхности (PISA), площадь эффективного регургитирующего отверстия (EROA), регургитирующий объем (Rvol), конечный систолический размер (КСР) ЛЖ, центральная струя регургитации >50% площади левого предсердия (ЛП) имеют прогностическую значимость в диагностике тяжелых изменений МК, при достижении пороговых значений могут служить показаниями к 3D-ЧП-ЭхоКГ.
Выводы. Трехмерная чреспищеводная эхокардиография позволяет детально оценить геометрические и функциональные показатели МК, которые имеют различия в зависимости от тяжести и варианта ИМР. Для решения вопроса о хирургической коррекции МК выполнение 3D-ЧП-ЭхоКГ рекомендуется при наличии следующих комбинаций показателей: 1) Vena contracta ≥0,7 см; PISA ≥1,0 см; центральная струя МР ≥50% площади ЛП; КСР ЛЖ ≥4,0 см; 2) Vena contracta ≥0,6 см; PISA 0,6–0,99 см; EROA ≥0,3 см 2 ; RVol ≥45 мл; эксцентричная струя ИМР + эллиптическое отверстие ИМР.
Ключевые слова
Об авторах
Андрианова Анна Михайловна
Список литературы
1. Agricola E, Oppizzi M, Pisani M, Meris A, Maisano F, Margonato A. Ischemic mitral regurgitation: Mechanisms and echocardiographic classification. European Journal of Echocardiography. 2007;9(2):207– 21. DOI: 10.1016/j.euje.2007.03.034
2. Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Fleisher LA et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135(25):e1159–95. DOI: 10.1161/CIR.0000000000000503
4. Кузнецов В.А., Ярославская Е.И., Криночкин Д.В., Пушкарев Г.С., Марьинских Л.В. Факторы, ассоциированные с митральной регургитацией, у мужчин с ишемической болезнью сердца без инфаркта миокарда. Кардиология. 2013;53(11):4-8
5. Goliasch G, Bartko PE, Pavo N, Neuhold S, Wurm R, Mascherbauer J et al. Refining the prognostic impact of functional mitral regurgitation in chronic heart failure. European Heart Journal. 2018;39(1):39–46. DOI: 10.1093/eurheartj/ehx402
6. Бокерия Л.А., Бокерия О.Л., Фатулаев З.Ф., Шенгелия Л.Д. Митральная регургитация: этиопатогенетические механизмы и обзор диагностических методов. Кардиология. 2017;57(3):75-80
7. Borger MA, Alam A, Murphy PM, Doenst T, David TE. Chronic Ischemic Mitral Regurgitation: Repair, Replace or Rethink? The Annals of Thoracic Surgery. 2006;81(3):1153–61. DOI: 10.1016/j.athoracsur.2005.08.080
8. Dudzinski DM, Hung J. Echocardiographic assessment of ischemic mitral regurgitation. Cardiovascular Ultrasound. 2014;12(1):46. DOI: 10.1186/1476-7120-12-46
9. Acker MA, Parides MK, Perrault LP, Moskowitz AJ, Gelijns AC, Voisine P et al. Mitral-Valve Repair versus Replacement for Severe Ischemic Mitral Regurgitation. New England Journal of Medicine. 2014;370(1):23–32. DOI: 10.1056/NEJMoa1312808
10. Zeng X, Tan TC, Dudzinski DM, Hung J. Echocardiography of the Mitral Valve. Progress in Cardiovascular Diseases. 2014;57(1):55–73. DOI: 10.1016/j.pcad.2014.05.010
11. Zoghbi WA, Adams D, Bonow RO, Enriquez-Sarano M, Foster E, Grayburn PA et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation. Journal of the American Society of Echocardiography. 2017;30(4):303–71. DOI: 10.1016/j.echo.2017.01.007
12. Hahn RT, Abraham T, Adams MS, Bruce CJ, Glas KE, Lang RM et al. Guidelines for Performing a Comprehensive Transesophageal Echocardiographic Examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. Journal of the American Society of Echocardiography. 2013;26(9):921–64. DOI: 10.1016/j.echo.2013.07.009
14. Noack T, Kiefer P, Ionasec R, Voigt I, Mansi T, Vollroth M et al. New concepts for mitral valve imaging. Annals of Cardiothoracic Surgery. 2013;2(6):787–95. DOI: 10.3978/j.issn.2225-319X.2013.11.01
15. Lancellotti P, Tribouilloy C, Hagendorff A, Popescu BA, Edvardsen T, Pierard LA et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 2013;14(7):611–44. DOI: 10.1093/ehjci/jet105
16. Андрианова А.М., Саидова М.А. Трехмерная чреспищеводная эхокардиография в оценке параметров геометрии и функции митрального клапана у пациентов с хронической ишемической митральной недостаточностью. Неотложная кардиология. 2017;1:14-24
17. Zeng X, Nunes MCP, Dent J, Gillam L, Mathew JP, Gammie JS et al. Asymmetric versus Symmetric Tethering Patterns in Ischemic Mitral Regurgitation: Geometric Differences from Three-Dimensional Transesophageal Echocardiography. Journal of the American Society of Echocardiography. 2014;27(4):367–75. DOI: 10.1016/j.echo.2014.01.006
18. Agricola E. Echocardiographic classification of chronic ischemic mitral regurgitation caused by restricted motion according to tethering pattern. European Journal of Echocardiography. 2004;5(5):326–34. DOI: 10.1016/j.euje.2004.03.001
19. Andrianova A.M., Saidova M.A., Bolotova M.N., Dobrovolskaya S.V., Makeev M.I. P1134. Correlations of three-dimensional mitral valve geometry with chronic ischemic mitral regurgitation severity in compliance with tethering phenotypes. European Heart Journal Cardiovascular Imaging. 2016;17(suppl_2):ii240. DOI: 10.1093/ehjci/jew262.002
20. Андрианова А.М., Саидова М.А., Болотова М.Н., Добровольская С.В. Сравнительная оценка симметричного и асимметричного вариантов ишемической митральной регургитации по данным трехмерной чреспищеводной и двумерной трансторакальной эхокардиографии. Атеросклероз и дислипидемии. 2017;2(27):74–83
Метод интраоперационной трёхмерной чреспищеводной эхокардиографии у пациентов с выраженной недостаточности митрального клапана
Трёхмерная чреспищеводная эхокардиография (3D-ЧП ЭхоКГ) по сравнению с двухмерной позволяет получить наиболее полное представление о морфометрии отдельных структур и сердца в целом. Методика интраоперационной 3D ЧП ЭхоКГ незаменима при выполнении реконструктивных вмешательств у пациентов с митральной недостаточностью (МН), которая занимает второе место в структуре пороков сердца. Согласно рекомендациям Европейского общества кардиологов (ESC) и Европейской ассоциации кардиоторакальных хирургов (EACTS) 2017 года, именно реконструктивные операции на митральном клапане у пациентов с недостаточностью приобретают приоритетное значение. Безусловными преимуществами пластических операций являются низкий риск развития тромбоэмболий и эндокардита, лучшая отдалённая выживаемость и свобода от приёма антикоагулянтов. Успех хирургического лечения с использованием реконструктивного подхода во многом зависит от уровня и качества выполненных диагностических исследований.
Трёхмерная интраоперационная чреспищеводная эхокардиография позволяет в режиме реального времени проводить построение модели клапана, которая максимально сопоставима с видом клапана, каким его видит хирург в операционном поле («surgical view»), и детально оценить его анатомию, геометрию и функцию. На основании полученных данных хирург имеет объективную возможность определить тактику операции, объём и вид реконструкции клапана. После выполненной реконструкции незамедлительно оценить результат операции.
Представляем клинический случай использования интраоперационной чреспищеводной эхокардиографии с 3D режимом для определения тактики и оценки результатов операции у пациентки с выраженной недостаточностью митрального клапана.
Пациентка, 56 лет, поступила в отделение реконструктивной хирургии клапанов сердца и коронарных артерий ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России с жалобами на одышку при умеренной физической нагрузке, сердцебиение. Из анамнеза: страдает ревматизмом с 15 лет. По данным трансторакальной эхокардиографии (ЭхоКГ) выявлена выраженная митральная недостаточность, дилатация левых отделов сердца.
На основании проведённого обследования поставлен диагноз: Ревматизм, неактивная фаза. Митральный порок сердца: выраженная недостаточность. Относительная умеренная недостаточность трикуспидального клапана. Дилатация левых камер сердца. Умеренная лёгочная гипертензия. ХСН 2А. ФК 3 по NYHA.
Была выполнена операция: Многокомпонентная реконструкция митрального клапана с ушиванием расщепления передней митральной створки, с аннулопластикой на опорном кольце; пластика трикуспидального клапана по de Vega, в условиях ИК, гипотермии и ФХКП. (хирург — директор Института коронарной и сосудистой хирургии ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ, профессор И.И. Скопин).
Данные интаоперационной 3D ЧП ЭхоКГ: Митральный клапан: ФК 44 мм, створки уплотнены, расщепление передней створки от свободного края до фиброзного кольца в сегменте А 2, движение створок разнонаправленное. Градиент давления максимальный — 6,2 мм рт.ст., средний 2,1 мм рт.ст. Регургитация выраженная: vena contracta - 0,9 см, площадь потока регургитации — 11,4 см², в непрерывноволновом допплеровском режиме плотный поток регургитации, радиус PISA — 1,0 см. Регургитация — эксцентричная, по боковой стенке ЛП.
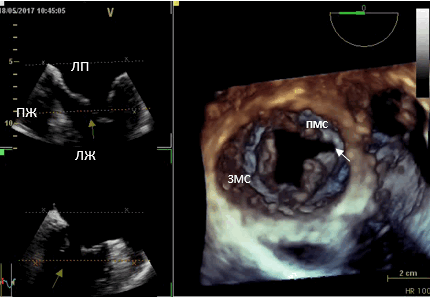
Рис. 1. Трёхмерная чреспищеводная эхокардиография. Среднепищеводный доступ. Трёхмерная реконструкция митрального клапана. (ЛП — левое предсердие, ЛЖ — левый желудочек, ПЖ— правый желудочек, ПМС — передняя митральная створка, ЗМС — задняя митральная створка). Расщепление передней митральной створки (белая стрелка).
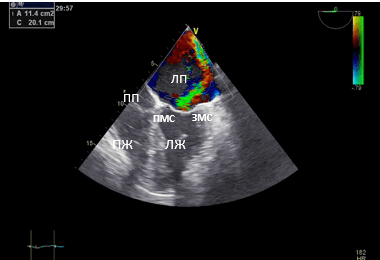
Рис. 2. Чреспищеводная эхокардиография. Среднепищеводный доступ. Четырёхкамерная позиция. (ПП — правое предсердие). Площадь потока регургитации — 11,4 см².
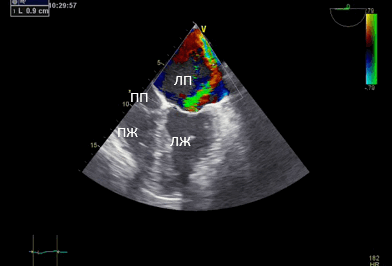
Рис. 3. Чреспищеводная эхокардиография. Среднепищеводный доступ. Четырёхкамерная позиция. Vena contracta 0,9 см.
На основании дооперационной трансторакальной эхокардиографии планировалась имплантация опорного кольца и коррекция пролапса ПМС за счёт имплантации неохорд или транслокации хорд от задней митральной створки к передней. Данные интраоперационной трёхмерной ЧП ЭхоКГ позволили визуализировать расщепление передней створки митрального клапана и подтвердить дилатацию фиброзного кольца. Таким образом, тактика операции была изменена и выполнена пластика расщеплённой передней створки МК, имплантация опорного кольца Carpantier-Edwards №32, пластика трикуспидального клапана по de Vega.
После отключения искусственного кровообращения и стабилизации гемодинамики выполнено контрольное ЧП ЭхоКГ исследование. Показатели функционального состояния миокарда, клапанного аппарата были в норме.
В представленном клиническом случае больной с патологией митрального клапана – выраженной недостаточностью, в плановом порядке интраоперационно до основного этапа операции проведена чреспищеводная эхокардиография с построением в режиме реального времени трёхмерной модели клапана, позволившая детально оценить патологию и определить механизм формирования митральной недостаточности. С помощью трёхмерной реконструкции удалось диагностировать расщепление передней створки митрального клапана, определить точную локализацию патологии.
Полученные данные были подтверждены непосредственно в ходе операции при ревизии клапана и явились основанием выбора тактики хирургического вмешательства.
Трехмерная эхокардиография при недостаточности митрального клапана
Трехмерная эхокардиография при недостаточности митрального клапана
В следующих статьях приведен ряд клинических показаний и областей применения для трехмерной ЭхоКГ, в которых эта новая методика обладает существенными преимуществами перед традиционной и потому может использоваться в рутинном обследовании.
В некоторых медицинских центрах одной из клинических областей применения трехмерной ЭхоКГ стала визуализация патоморфологии митрального клапана, в том числе и при планировании хирургического реконструктивного вмешательства. Здесь особенно важно то преимущество трехмерной ЭхоКГ, что она способна создавать недостижимое при помощи традиционной методики объемное изображение, так что одним взглядом можно охватить взаимное пространственное расположение патологических изменений.
Так, например, локализация пролабирующих частей створки в комиссуральных областях клапана и в передней створке определяется существенно проще и надежнее при помощи трехмерных методик, чем при общепринятых двумерных исследованиях, что может облегчить предоперационное планирование хирургического вмешательства.
Кроме того, при помощи трехмерных методик удается провести очень точные измерения аппарата митрального клапана при различных патологических изменениях (например, ишемическая митральная недостаточность), что было невозможно на уровне двумерной ЭхоКГ и позволило получить новые представления в области патофизиологии.
Видео. Пролапс задней створки митрального клапана (тот же больной, что и на рисунке выше). Пластическая поверхностная реконструкция трехмерной чреспищеводной ЭхоКГ на примере выраженного пролапса митрального клапана. Сканирование выполнено в направлении митрального клапана из левого предсердия в так называемой хирургической перспективе. Отчетливо видно раскрытие воронки митрального клапана. Справа на митральном кольце видна передняя створка митрального клапана. Средний сегмент задней створки (слева внизу) выдается в левое предсердие («молотящая» створка).
Видео. Пролапс задней створки митрального клапана (тот же больной, что и на рисунке выше). Пластическая поверхностная реконструкция трехмерной чреспищеводной ЭхоКГ на примере выраженного пролапса митрального клапана. При повороте плоскости сканирования вдоль длинной оси удается лучше разглядеть пролабирование створки и оценить его степень, при этом куполообразно пролабирующая часть лучше видна. Вверху – левое предсердие, внизу – левый желудочек.
Видео. Пролапс задней створки митрального клапана. Трансторакальная трехмерная ЭхоКГ в реальном времени. Сканирование выполнено в направлении митрального клапана из левого предсердия в так называемой хирургической перспективе. Также отчетливо видно раскрытие воронки митрального клапана. Слева на сонограмме – передняя митральная створка. Средний сегмент задней створки пролабирует в левое предсердие («молотящая» створка).
а) Цветовая трехмерная эхокардиография при недостаточности клапана. Дополнительно к серошкальным двумерным изображениям можно зарегистрировать цветокодированный допплеровский сигнал и полученные цветовые данные вместе с двумерными ультразвуковыми данными превратить в трехмерную реконструкцию цветовой допплер-ЭхоКГ. Наряду с визуализацией и анализом цветных допплеровских потоков возможно также одновременное отображение лежащей в основе этого патоморфологии. Это особенно важно в тех случаях, когда это позволяет продемонстрировать механизм клапанной недостаточности.
б) Оценка степени тяжести. Трехмерная визуализация внутриполостных потоков при помощи цветового допплера, возможно, способна улучшить решение клинически важной и до сих пор сложной проблемы оценки степени тяжести клапанной недостаточности. Первые исследования in vitro и некоторые современные исследования in vivo продемонстрировали преимущества, например, измерения площади сечения vena contracta по сравнению с общепринятыми двумерными методиками.
Для интерпретации трехмерной цветовой допплер-ЭхоКГ сохраняются, конечно, те же ограничения, что и для традиционного двумерного допплеровского анализа, т.е. зависимость от усиления, качества изображения и угла сканирования.
Цветовая трехмерная реконструкция тяжелой эксцентрической митральной недостаточности у пациента с пролапсом митрального клапана. Оба стоп-кадра в середине систолы демонстрируют струю регургитации и морфологию митрального клапана (в виде объемной серой структуры) в двух различных перспективах. Кадр слева: вид со стороны, сверху левое предсердие (LA), снизу левый желудочек (LV). Пролабирующая задняя створка митрального клапана отмечена пунктирной стрелкой. Хорошо видна эксцентрично справа налево проходящая струя митральной регургитации (Mi-Jet). Кадр справа: взгляд на поверхность митрального клапана со стороны левого желудочка. Голубая пунктирная линия на кадре слева демонстрирует направление взгляда на кадре справа. На желудочковой стороне клапана видна оранжево-бирюзовая проксимальная зона конвергенции (PISA), имеющая форму, отличную от полусферической, и являющаяся выражением соответствующей митральной недостаточности. Стоп-кадр (середина систолы) из трехмерной реконструкции чреспищеводной цветовой эхокардиограммы. Взгляд со стороны верхушки левого желудочка на закрытый митральный клапан. Поперечное сечение vena contracta видно как область распространения турбулентных потоков. Обрисовка контура vena contracta на трехмерном изображении дает в данном случае площадь 0,4 см 2 , как при тяжелой недостаточности митрального клапана.
Видео. Трехмерная реконструкция при чреспищеводном цветовом допплеровском картировании: относительная митральная недостаточность вследствие расширения митрального кольца (ср. также с рисунком выше). Сканирование начинают вдоль длинной оси сердца (вверху – левое предсердие, внизу – левый желудочек). Отчетливо видно центральное расположение струи митральной регургитации. В заключение ультразвуковой пучок направляют со стороны левого желудочка, сканируя обратную сторону воронки митрального клапана. В результате получают изображение в поперечной плоскости, в которой могут быть видны контуры стенозированной вены (vena contracta), имеющей вид плоского турбулентного потока.
Видео. Трехмерное цветовое допплеровское картирование при митральной и аортальной недостаточности, выполненное с помощью трансторакального матричного датчика. Вверху (вблизи сканирующей головки датчика) – левый желудочек, внизу – левое предсердие. Систолическая цветная струя выраженной митральной недостаточности видна так же хорошо, как и струя аортальной недостаточности. Одновременно видны митральный клапан и границы выносящего тракта левого желудочка. Обратите внимание на узкий окрашенный сектор и ЭКГ, которая позволяет точно привязывать каждый кадр к определенной фазе сердечного цикла.
Трехмерная эхокардиография при недостаточности митрального клапана
ВСЕВОЛОД СЕДОВ: «ЭХОКГ ДОЛЖЕН ДЕЛАТЬ КАРДИОЛОГ»
Возможности современной ультразвуковой диагностики сердца уникальны. Однако правильный результат может быть получен только при сочетании опыта оператора, его клинических знаний и умения оценивать ультразвуковое изображение. О том, что должен учитывать врач, направляя пациентов на ЭхоКГ, рассказывает профессор кафедры лучевой диагностики и лучевой терапии Первого МГМУ имени И.М. Сеченова, д.м.н. Всеволод Парисович СЕДОВ.

– Всеволод Парисович, расскажите о показаниях к ЭхоКГ. В каких случаях врач общей практики или кардиолог должен направлять на ультразвуковое исследование сердца?
– Врач, использующий аускультацию в своей клинической практике, безусловно, может услышать грубые шумы в сердце, однако, как правило, он не в состоянии их правильно интерпретировать. Их причиной могут быть клапанные заболевания или пороки сердца (врожденные или приобретенные), диагностировать которые можно только инструментальными методами. Эхокардиография может предоставить врачу массу полезной информации, не требуя в отличие от лучевых методов значительных расходов и специального помещения.
Сегодня эхокардиография входит в обязательные стандарты при обследовании пациентов с гипертонической болезнью, с ИБС, клинически выраженной или предполагаемой на основе факторов риска. Однако таких больных необходимо направлять на исследование ЭКГ и ЭхоКГ, которые проводятся синхронно. Врач видит на дисплее и ультразвуковое изображение, и электрокардиографическую картину, что позволяет ему оценивать фазы сердечного цикла. Золотым стандартом для назначения ЭхоКГ служат пороки сердца – врожденные и приобретенные, а также варианты дилатационной, гипертрофической и рестриктивной кардиомиопатии. Эти виды патологий, к сожалению, часто пропускаются не только терапевтами, но и кардиологами. А ведь правильная интерпретация эхографических изображений и адекватная клиническая оценка играют существенную роль в планировании лечения – консервативного или оперативного.
Поражения сердечной мышцы при таких состояниях, как миокардит, различные формы кардиопатии (дилатационная, гипертрофическая кардиомиопатия, некомпактный миокард), также очень хорошо диагностируются при ЭхоКГ. Тем не менее стоит помнить о том, что наиболее точный метод для оценки морфологии миокарда и его структурных характеристик – это МРТ. Сочетание ЭхоКГ с МРТ позволяет получить больше информации об этих заболеваниях.
– Какие клинические симптомы должны служить поводом для направления на ЭхоКГ?
– Это прежде всего сердечный шум, острая боль в груди, одышка, нестабильность гемодинамики. Причем в последнем случае речь идет не об артериальной гипертензии, а о резких колебаниях АД – сегодня это 120/80 мм рт.ст., завтра 180/100, а через день 110/60 мм рт.ст. Эти случаи в обязательном порядке требуют уточнения морфологии и функции сердца с помощью ЭхоКГ.
– Насколько часто в вашей практике встречаются пациенты, которым ЭхоКГ следовало бы назначить намного раньше?
– Сейчас в основном все врачи знают возможности ЭхоКГ и, как правило, вовремя назначают пациентам с подозрением на сердечные заболевания это исследование, однако далеко не всегда оно выполняется квалифицированно. Нам очень часто приходится либо интерпретировать результаты по‑другому, либо заново обследовать пациента. Так что в основном проблема в кадрах, т. е. тех врачах, которые проводят ЭхоКГ.
В Европе и особенно в США этот метод отдан в руки специалистов со средним образованием, но очень квалифицированных. В России ЭхоКГ делают либо врачи функциональной диагностики, либо врачи ультразвуковой диагностики, и, конечно, они часто интерпретируют результаты не так, как кардиолог. Многое зависит и от клинического опыта оператора, его умения выделить сердце, найти правильную позицию, сечение и на основе полученных данных оценить наблюдаемые изменения сердца. Поэтому, с моей точки зрения, такой врач должен быть клиницистом, хорошо знать кардиологию.
Золотым стандартом для назначения ЭхоКГ служат пороки сердца – врожденные и приобретенные, а также варианты дилатационной, гипертрофической и рестриктивной кардиомиопатии
– В последние годы в профильных учреждениях можно сделать и трехмерную эхокардиографию, а также ЭхоКГ с контрастированием. В каких случаях предпочтительнее прибегать к этим методам?
– Действительно, это очень модные на сегодня модальности, которые могут дать в некоторых случаях более точную информацию. Однако в рутинной практике их не используют по нескольким причинам. Трехмерная кардиография, безусловно, позволяет лучше оценить морфометрические взаимоотношения различных областей сердца, камер и клапанов. Этот метод используется при планировании кардиохирургической операции, поскольку позволяет рассмотреть сердце со всех сторон, понять, как сформирован порок, получить количественные параметры, например длину створок и степень прогиба. Его используют и в послеоперационном обследовании, чтобы оценить достигнутый эффект. Однако в рутинной практике применять трехмерную ЭхоКГ достаточно сложно, потому что, во‑первых, она требует достаточно много времени, а, во‑вторых, пространственное и временное разрешение 3D‑датчиков значительно ниже, чем 2D.
Исследования с контрастированием в основном применяют при диагностике ИБС во время проведения стресс‑кардиографии. Кроме того, контрастная ЭхоКГ хорошо выявляет дефекты межпредсердной или межжелудочной перегородки. Она используется также для верификации гемодинамических нарушений, например при аортальных стенозах. В этих случаях контрастная ЭхоКГ служит хорошим подспорьем.
Нам очень часто приходится либо интерпретировать результаты ЭхоКГ по‑другому, либо заново обследовать пациента. Так что в основном проблема в квалификации тех врачей, которые проводят ЭхоКГ
– Эхокардиография – очень чувствительный метод, но все же, наверное, не универсальный. В каких случаях назначение ЭхоКГ не оправдано?
– Действительно, врачи очень любят направлять пациентов на ЭхоКГ для диагностики ИБС без инфарктов в анамнезе. Однако в этих случаях, когда налицо стенокардия, но нет признаков рубцовых изменений миокарда, возможности ЭхоКГ ограничены. Диагноз ИБС должен быть поставлен на основании целого комплекса обследований – клинического, электрокардиографического и эхокардиографического, как метода, дополняющего все остальные. Существует, правда, и другая возможность диагностики ИБС, когда ЭхоКГ назначается не в состоянии покоя, а под нагрузкой – стресс‑ЭхоКГ. В этих случаях шансы диагностировать ишемию миокарда значительно возрастают.
И, напротив, такой диагноз, как пролапс митрального клапана, с которым к нам очень часто направляют молодых пациентов, мы, как правило, не подтверждаем. Это так называемый случай гипердиагностики. У многих пациентов его «находят» на первичном обследовании из‑за несовершенства ультразвуковых приборов. До сих пор в некоторых медицинских учреждениях используют одномерную кардиографию, которая дает очень большой процент ошибок.
Еще один ошибочный диагноз, с которым часто приходят пациенты, – это митральная недостаточность. Если врач услышал систолический шум, первое, что он пишет, – недостаточность митрального клапана. Причем может быть указана и 1‑я, и 3‑я степень… А правильно оценить степень клапанного порока чрезвычайно важно. От этого зависит дальнейшая тактика лечения – терапевтическая или хирургическая. И метод ЭхоКГ в этих случаях может предоставить врачу наиболее полную информацию. С его помощью можно точно оценить выраженность клапанного поражения не только трансторакально (через переднюю грудную стенку), но и из пищевода (чреспищеводная ЭхоКГ).
– В каких еще случаях используется метод чреспищеводной ЭхоКГ?
– Пациента направляют на чреспищеводную ЭхоКГ при фибрилляции предсердий. Для восстановления синусового ритма может быть использовано как медикаментозное лечение, так и абляция. Но перед этим следует убедиться в отсутствии тромбов внутри сердца и, в частности, внутри ушка левого предсердия. А это ушко видно только из пищеводного доступа.
Еще одним показанием для проведения чреспищеводной ЭхоКГ служит инфекционный эндокардит. Кроме того, доступ через пищевод необходим для оценки функции клапана или его протеза после хирургической операции. Существуют и еще некоторые виды патологий, для диагностики которых используется чреспищеводная ЭхоКГ, – диссекция аорты, патология межпредсердной или межжелудочной перегородки и др.
Оценка клапанных пороков у онкологических пациентов имеет такое же большое значение, как и фракции выброса левого желудочка
– Показана ли ЭхоКГ пациентам с сахарным диабетом или выраженным ожирением? Ведь очень часто сердечная недостаточность у таких больных выявляется в 3‑й или 4‑й стадии и служит поводом для госпитализации.
– На этот вопрос я всегда отвечаю положительно. Конечно, у всех пациентов с сахарным диабетом и преддиабетом должны быть исследованы морфология и функция сердечной мышцы, поскольку сахарный диабет – значительный фактор риска развития ИБС. Причем к ее особенностям относится бессимптомное течение, т. е. на ЭхоКГ мы тестируем сердечную недостаточность без предшествующего болевого синдрома.
– Онкологическим пациентам ЭхоКГ проводится для оценки кардиотоксичности терапии. Однако многие кардиологи считают, что изменение фракции выброса левого желудочка, оцениваемое с помощью ЭхоКГ, менее чувствительный показатель, нежели продольная деформация левого желудочка. Насколько широко распространено в России это исследование?
– Да, действительно, продольная деформация, или продольный стрейн, более точно характеризует дисфункцию левого желудочка по сравнению с фракцией выброса, хотя бы потому, что этот показатель менее зависим от оператора. Уже накоплено достаточно данных, которые свидетельствуют об этом. Однако, к сожалению, не все аппараты УЗИ снабжены этой опцией – программой, которая позволяет измерять деформацию желудочка по своеобразным маркерам на ультразвуковом изображении сердца.
Тем не менее и измерение фракции выброса левого желудочка позволяет достаточно точно оценить его систолическую функцию. Проблема возникает скорее из‑за того, что исследования проводятся на несовершенной аппаратуре. Во многих учреждениях еще используют одномерный режим для оценки фракции выброса. Это неправильно, особенно у пациентов, находящихся на химио – или лучевой терапии. При одномерном режиме мы не видим всех сегментов левого желудочка, которые должны быть оценены. А их на сегодняшний день должно быть 17. Чем больше оператор посмотрит сечений сердца, тем объективнее он оценит сократимость миокарда. Исследование продольной деформации не требует множества измерений, но при этом позволяет более точно оценить систолическую функцию.
Кроме того, говоря об онкологических больных, надо помнить, что сердечная недостаточность может быть и с нормальной фракцией выброса. Такая ситуация возникает у тех пациентов, у которых в первую очередь нарушается диастолическая функция. В этом случае может помочь тканевой допплер, фиксирующий скорость движения фиброзного кольца митрального клапана и самих сегментов левого желудочка. Этот вид исследования помогает поставить диагноз диастолической сердечной недостаточности при нормальной фракции выброса у пациентов на лучевой или химиотерапии.
Следует также помнить, что развитие сердечной недостаточности при химиотерапии может происходить не сразу, а отсрочено – через несколько лет. В этих случаях через три‑пять лет возникает синдром дилатационной кардиомиопатии, вследствие которой не только нарушается систолическая и диастолическая функция, но формируются клапанные пороки – стеноз устья аорты, недостаточность митрального клапана и ряд других. Поэтому оценка клапанных пороков у онкологических пациентов имеет такое же большое значение, как и фракции выброса левого желудочка.
Я убежден, что эхокардиографию должен делать именно кардиолог, а не врач функциональной или ультразвуковой диагностики
– Исходя из этого, пациенты, когда‑либо получавшие лучевую или химиотерапию, должны ежегодно делать ЭхоКГ?
– Да. Онкологические пациенты должны проходить исследование ЭхоКГ каждый год. Но не только они. Ультразвуковое исследование показано также больным с сердечной недостаточностью, даже с сохраненной фракцией выброса, лицам, страдающим многолетней артериальной гипертонией, перенесшим инфаркт миокарда с развитием сердечной недостаточности. К обязательной группе относятся также пациенты после протезирования клапанов, с дилатационной кардиомиопатией, с обструктивными формами гипертрофической кардиомиопатии.
– ЭхоКГ применяется как метод оценки неотложных состояний?
– Конечно, метод очень полезен для диагностики острого инфаркта миокарда или диагностики его осложнений. Их достаточно много – это перикардит, тампонада сердца, острая сердечная недостаточность, разрыв сердечной мышцы. Эти осложнения, как и масса других, нуждаются в правильном ультразвуковом обследовании, а главное, в правильной интерпретации того, что мы видим.
– Наверное, сейчас самая больная тема – это не наличие ультразвукового аппарата в медицинском учреждении, а наличие опытного оператора, который может адекватно оценить полученное изображение?
– Да, сейчас практически во всех лечебных учреждениях есть аппаратура и врач, который может смотреть сердце с помощью ультразвука. Однако организационно это сделано не совсем правильно – я убежден, что эхокардиографию должен делать именно кардиолог, а не врач функциональной или ультразвуковой диагностики.
Однако в любом случае такому специалисту необходимо постоянное повышение квалификации. Они не должны вариться в собственном соку, находясь в своем учреждении. Сейчас очень много конгрессов, симпозиумов, где обсуждается ультразвуковая диагностика патологий сердца и где можно почерпнуть полезную информацию. Это и российский кардиологический конгресс, и ежегодный конгресс лучевой диагностики в «Крокус‑Сити», и масса региональных симпозиумов.
Я придерживаюсь такого мнения, что каждый врач должен уметь правильно интерпретировать ультразвуковое исследование. Для этого совсем необязательно быть оператором. И в Сеченовском университете, где я преподаю и ординаторам, и студентам, такой взгляд признается правильным.
Читайте также:
