Тяжелый комбинированный иммунодефицит. Морфология тимической алимфоплазии
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Тяжёлый комбинированный иммунодефицит (ТКИД), (также известен как алимфоцитоз, синдром Глянцмана-Риникера, синдром тяжёлого комбинированного иммунодефицита, и тимическая алимфоплазия [1] ) - это генетическое заболевание, при котором повреждаются оба типа "оружия" (B-лимфоциты и T-лимфоциты) адаптивной иммунной системы в результате дефекта одного из нескольких возможных генов. ТКИД - это тяжёлая форма наследственного иммунодефицита. ТКИД также известен как синдром мальчика в пузыре, так как больные крайне уязвимы перед инфекционными болезнями и вынуждены находиться в стерильной среде. Одним из таких больных был Дэвид Веттер. ТКИД является результатом настолько сильного повреждения иммунной системы, что последняя считается практически отсутствующей.
Симптомами ТКИД могут являться хроническая диарея, ушные инфекции, возвратный пневмоцистоз, обильные кандидозы полости рта. Без лечения, в случае, если не было произведено успешной трансплантации гемопоэтических стволовых клеток, дети с ТКИД обычно умирают в течение первого года жизни от тяжёлых возвратных инфекций.
Содержание
Распространённость
Наиболее часто цитируемый показатель распространённости ТКИД составляет примерно 1 на 100,000 родившихся, хотя некоторыми такие данные рассматриваются как недооценка истинной распространённости [2] . В Австралии сообщается о такой частоте встречаемости, как 1 на 65,000 родившихся [3] .
Недавно проведённые исследования показали, что в популяции Навахо 1 ребёнок из каждых 2,500 наследует тяжёлый комбинированный иммунодефицит. Это является причиной значительного процента заболеваемости и смертности среди детей данной народности [4] . Текущие исследования выявили аналогичную картину у племён Апачи [5] .
| Тип | Описание |
|---|---|
| X-сцепленный тяжёлый иммунодефицит (X-ТКИД) | Наиболее распространённый тип ТКИД, возникающий из-за мутаций в гене, кодирующем общие гамма-цепи, белок которых является общим для рецепторов интерлейкинов IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21. Перечисленные интерлейкины и их рецепторы вовлечены в процессы развития T- и B-лимфоцитов. В результате мутаций происходят дисфункции общей гамма-цепи, и, как следствие, дефект распространяется на процесс сигнализации интерлейкина. Происходит почти полный отказ иммунной системы как со стороны развития, так и со стороны функционирования, с отсутствием или очень малым количеством T-лимфоцитов, NK-клеток и нефункциональными B-лимфоцитами. |
Общая гамма-цепь кодируется геном IL-2 рецепторов гамма, который находится на X-хромосоме. По этой причине иммунодефицит, вызванный мутациями в IL-2, известен как X-сцепленный ТКИД. Наследуется по рецессивному типу.
Эти ферменты участвуют в первом этапе V(D)J рекомбинации, в котором сегменты B-лимфоцитов или ДНК T-лимфоцитов перестраиваются, создавая новые T- или B-клеточный рецепторы.
Некоторые мутации RAG-1 или RAG-2 продотвращают процесс V(D)J рекомбинации, тем самым приводя к возникновения ТКТД [6] .
Обнаружение
В нескольких штатах США проводятся экспериментальные исследования для диагностики ТКИД у новорождённых при помощи иссечения рекомбинантных T-лимфоцитов. По состоянию на 1 февраля 2009 года, В Висконсине и Массачусетсе проводится скрининг новорожденных на предмет выявления ТКИД [8] , [9] . В Мичигане скрининг на ТКИД начался в октябре 2011 года [10] . Однако стандартизированное тестирование на ТКИД в настоящее время недоступно в связи с разнообразием генетического дефекта у новорожденных. Некоторые формы ТКИД могут быть обнаружены путём секвенирования ДНК плода, если есть основания подозревать данное заболевание. В противном случае, ТКИд не диагностируется примерно до 6 месяцев. Как правило, на его наличие могут указывать рецидивирующие инфекции. Задержка в обнаружении ТКИД обусловлена тем, что у новорожденных в течение первых нескольких недель жизни присутствуют антитела матери, и дети с ТКИД выглядят здоровыми.
Лечение
Наиболее распространённым методом лечения ТКИД является трансплантация гемопоэтических стволовых клеток, которая проходит успешно либо при участии неродственного донора, либо при участии полу-совместимого донора, которым может являться один из родителей. Последний вид трансплантации носит название "гаплоидентичной" и был усовершенствован в Мемориальном онкологическом центре им. Слоуна-Кеттеринга в Нью-Йорке, а также в Медицинском центре дьюкского университета, где в настоящее время проведено наибольшее количество подобных пересадок [11] . При гаплоидентичной пересадке костного мозга необходимо наличие донорского костного мозга, чтобы избежать гомологичной реакции при использовании всех зрелых T-клеток [12] . Следовательно, функциональность иммунной системы развивается дольше у пациента, получающего костный мозг. Дэвид Веттер, один из первых, кому была проведена подобная операция, в итоге умер от вируса Эпштейна-Барр, которым был заражён костный мозг, пересаженный от его сестры. Сегодня пересадка, сделанная в первые 3 месяца жизни ребёнка, умеет высокий уровень успешности. Также врачи успешно проводили внутриутробную трансплантацию, сделанную до рождения ребёнка, с использованием пуповинной крови, богатой стволовыми клетками. Внутриутробная трансплантация позволяет иммунной системе плода развиваться в стерильной среде матки [13] . Однако такое осложнение, как гомологичная болезнь, довольно сложно обнаружить [14] . Совсем недавно в качестве альтернативы пересадке костного мозга была предложена генотерапия. В 1990 году 4-летняя Ашанти де Сильва стала первой пациенткой, которая успешно прошла курс генной терапии. Исследователи собрали образцы крови Ашанти, изолировали некоторые белые кровяные клетки, а затем использовали вирус, чтобы вставить в них здоровые аденозиндезаминазы (АДА). Затем эти клетки вводились обратно и начинали производить нормальный фермент. Дефицит АДА компенсировался дополнительными еженедельными инъекциями [15] . Тем не менее испытания были остановлены. В 2000 году обнаружилось, что 2 из 10 пациентов в результате генотерапии заболели лейкозом в результате введения гена, несущего ретровирус, возле онкогена. В 2007 году у 4 из 10 пациентов также был диагностирован лейкоз [16] . В настоящее время работы в области генной терапии направлены на изменение вирусного вектора, чтобы уменьшить вероятность онкогенеза [17] .
Есть также некоторые нелечебные методы борьбы с ТКИД. Обратная изоляция предполагает использование ламинарного потока воздуха и механических барьеров (для избежания физического контакта с другими людьми), чтобы изолировать пациента от любых вредных патогенных микроорганизмов, присутствующих во внешней среде [18] .
Тяжелый комбинированный иммунодефицит. Морфология тимической алимфоплазии
Тяжелый комбинированный иммунодефицит. Морфология тимической алимфоплазии
Тяжелый комбинированный иммунодефицит (швейцарский тип иммунного дефицита, лимфопеническая агаммаглобулинемия, тимическая алимфоплазия, врожденная тимическая дисплазия), характеризующийся дефектом клеточного и гуморального иммунитета. Впервые описан Е. Glanzmann и P. Riniker в 1950 г. в Швейцари под названием «essential lymphocytophtisis» у двух братьев. Н. Cottier в 1957 г. описал изменения в тимусе при этом синдроме — отсутствие телец Гассаля.
Агаммаглобулинемия была обнаружена у этих пациентов в 1958 г. и заболевание было названо швейцарским типом агаммаглобулинемии. Этиология— наследование аутосомно-рецессивного типа. Однако встречаются спорадически возникающие случаи. Так, указывается на развитие врожденного иммунодефицита вследствие трансплацентарного проникновения материнских лимфоцитов, что приводит к развитию реакции трансплантат против хозяина с повреждением иммунной системы плода материнскими лимфоцитами. Патогенез неясен.
Считается, что имеет место дефект клетки-предшественницы лимфоидного ростка. Лимфопения и лейкопения непостоянны. Основными симптомами являются инфекционные заболевания, развивающиеся в первые месяцы жизни.
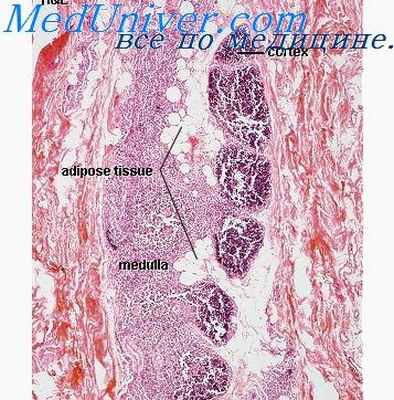
Кожные поражения носят характер множественных некрозов с воспалительной инфильтрацией, являющихся источником кожного сепсиса. Описаны дерматит в виде эритродермии типа Лейнера, эксфолиативная эритродермия типа Риттера. кроме того, встречаются случаи с изменениями кожи, напоминающие таковые при гистиоцитозе X. Мы наблюдали 2 сестер с комбинированным иммунодефицитом, умерших в возрасте 2,5 и 3 мес. У одной из них кожные изменения были типа эритродермии Лейнера, у другой наблюдались некрозы с воспалительной реакцией и кожный сепсис, обусловленный смешанной грамотрицатсльной флорой.
Бронхопневмонии носят, как правило, некротический характер. Часто встречается гнойный менингит. В большинстве случаев бактериальная инфекция сочетается с вирусной — генерализованной ветряной оспой, коревой гигантоклеточной пневмонией, генерализованной цитомегалией, аденовирусной инфекцией с поражением конъюнктивы и легких, а также сочетается с поражениями различными грибами. Встречаются случаи пневмоцистоза легких, при этом плазматические клетки в легких отсутствуют. Кроме инфекционных процессов, описывается сочетание тяжелых иммунных дефицитов с лимфомами, гемолитико-уремическим синдромом, гемолитической аутоиммунной анемией, муковисцидозом и гипотиреои-дизмом.
Исследования органов иммунной системы свидетельствуют о глубоких нарушениях гуморального и клеточного иммунитета. Лимфатическая ткань всюду в состоянии выраженной гипоплазии — фолликулы не развиты, зональность в лимфатических узлах неразличима, ткань узлов представлена ретикулярной стромой, миеловидными элементами и лимфоцитами в очень небольшом количестве, расположенными беспопорядочно. Имеется выраженный дефицит зрелых лимфоцитов. Электронно-микроскопически удается показать, что имеются незрелые лимфоциты, сходные с лимфобластами.
Плазматические клетки отсутствуют. Такие же изменения обнаруживаются в селезенке, костном мозге и других лимфоидных органах. Особенно типичными и диагностически важными являются изменения в тимусе. Тимус имеет выраженный железистый тип строения, состоит из ретикулоэпителия, не образующего или образующего немногочисленные тимические тельца. Лимфоцитов крайне мало, деление на корковое и мозговое вещество отсутствует, не бывает коллапса долек. Масса всех лимфоидных органов, как правило, уменьшена в 5—10 раз. Таким образом, тяжелый комбинированный тип иммунного дефекта характеризуется резко выраженной гипоплазией тимуса и всей лимфоидной ткани.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тяжелый комбинированный иммунодефицит (ТКИД)
Тяжелый комбинированный иммунодефицит характеризуется низким содержанием или отсутствием Т-лимфоцитов и низким, высоким или нормальным количеством В-лимфоцитов и натуральных клеток-киллеров. У большинства младенцев развиваются оппортунистические инфекции в течение 1–3 месяцев жизни. При постановке диагноза важна лимфопения, отсутствие или очень низкое количество Т-лимфоцитов, нарушение пролиферации лимфоцитов при воздействии митогена. Пациенты должны находиться в защищенной среде; единственный способ лечения – трансплантация гемопоэтических стволовых клеток.
Тяжелый комбинированный иммунодефицит (ТКИД) представляет собой первичное иммунодефицитное нарушение Первичные иммунодефициты Иммунодефицитные состояния связаны или предрасполагают пациентов к осложнениям различного рода, в том числе к инфекциям, аутоиммунным нарушениям, лимфомам и другим онкозаболеваниям. Первичные. Прочитайте дополнительные сведения , которое включает в себя комбинированные нарушения гуморального и клеточного иммунитетов Комбинированный гуморальный и клеточный иммунодефицит Иммунодефицитные состояния связаны или предрасполагают пациентов к осложнениям различного рода, в том числе к инфекциям, аутоиммунным нарушениям, лимфомам и другим онкозаболеваниям. Первичные. Прочитайте дополнительные сведения . Он вызван мутациями одного из многих различных генов (например, для аутосомно-рецессивных форм, янус-киназы 3 (Janus kinase 3) [JAK3], протеинтирозинфосфатазы, рецепторов С-типа (protein tyrosine phosphatase, receptor type, C) [PTPRC или CD45], активирующих рекомбинацию генов 1 (recombination activating genes 1) [RAG1] и 2 [RAG2]). Существуют различные формы ТКИД, являющиеся аутосомно-рецессивными дефектами, поэтому для того, чтобы у младенцев наблюдались проявления ТКИД, один и тот же ген должен иметь мутации на обеих хромосомах.
Существует 4 различных фенотипа аномальных лимфоцитов:
При большинстве форм ТКИД Т-лимфоциты отсутствуют (Т-); количество В-клеток и/или естественных клеток-киллеров (НК) может быть низким или отсутствовать (В-; НК-) или высоким или нормальным (В) + ; НК + ), в зависимости от формы ТКИД. Но даже если уровень В-лимфоцитов нормальный, то из-за отсутствия Т-лимфоцитов они не могут нормально функционировать. Функция естественных клеток-киллеров обычно ухудшается.
Наиболее часто встречается сцепленный с X- хромосомой тип наследования ТКИД. При этой форме повреждается gamma-цепь, общая субъединица рецепторов интерлейкина (ИЛ)-2 (данная цепь является компонентом по крайней мере 6 цитокиновых рецепторов) и это наиболее тяжелая форма; фенотип этой формы Т-, В + , НК-. Это происходит по причине мутаций гена гамма рецептора IL-2 (IL-2RG).
Две наиболее распространенные формы являются результатом недостаточности аденозин дезаминазы (АДА), что ведет к апоптозу предшественников В-, Т-лимфоцитов и естественных клеток-киллеров; фенотип этой формы Т-, В-, NK-.
Еще одна часто встречающаяся форма возникает вследствие недостаточности альфа -цепи в рецепторе ИЛ-7; фенотип Т- В + NК + .
Мутации гена 1-2, активирующего рекомбинацию (RAG1 или RAG2) представляют собой фенотип T-B-NK + SCID.
Синдром Оменна является еще одним фенотипом T-B-NK + SCID. Он, как правило, является результатом дефекта аллели RAG и, следовательно, его обычно относят к атипичным ТКИД. Это аутосомно-рецессивная форма тяжёлого комбинированного иммунодефицита (SCID). Часто уровни IgA, IgG и IgM низкие при повышенном IgE и эозинофилии. Эти пациенты, обычно, имеют различную степень лимфопении с низким количеством Т- и В-клеток, а также воспаление и лимфаденопатию.
Симптомы и признаки ТКИД
У большинства детей с ТКИД к 6 месяцам развиваются кандидоз Кандидоз (слизисто-кожный) Кандидоз – это инфекционное заболевание кожи и слизистых оболочек, вызванное видами Candida, чаще всего Candida albicans. Инфекция может поражать любые участки кожного покрова. Прочитайте дополнительные сведения Pneumocystis jiroveciiПневмония, обусловленная Пневмоциста Каринии Pneumocystis jirovecii – частая причина пневмонии у пациентов с иммунодефицитом, особенно у инфицированных вирусом иммунодефицита человека (ВИЧ) и получающих системные кортикостероиды. Прочитайте дополнительные сведенияБез ранней диагностики и правильного лечения все формы ТКИД заканчиваются смертью в младенческом возрасте.
Тяжелый комбинированный иммунодефицит (ТКИД)

Медицинский эксперт по заболеванию
Проф. Полина СтепенскиРуководитель отделения ТКМ и иммунотерапии у детей и взрослых клиники «Хадасса»
Стаж: более 24 лет
Запись на прием
Клиника «Хадасса» специализируется в лечении первичных иммунодефицитов (ПИД). При своевременом применении аллогенной трансплантации костного мозга здесь вылечивают 94% детей. Процессом диагностики и пересадки руководит всемирно известный специалист по ТКМ проф. Полина Степенски
Генетическую диагностику ТКИД проводят под наблюдением ведущего генетика Израиля проф. Орли Эльпелег. Команда проф. Эльпелег имеет в своем распоряжении самую полную в стране базу данных и инновационные технологии, такие как новейший секвенатор Novaseq 6000. Богатый опыт и передовое оборудование позволяют специалистом найти нужную мутацию в 65% случаев — это вдвое превышает средние показатели успеха в других странах.
В клинике Хадасса Габриелю из Грузии диагностировали тяжелый комбинированный иммунодефицит и вылечили с помощью ТКМ. На фото: мальчик с мамой Ирмой (2020 год).
Тяжелый комбинированный иммунодефицит (ТКИД) — это редкое, генетически обусловленное заболевание. Характеризуется нарушением выработки и функционирования В- и Т-лимфоцитов —клеток иммунного ответа, которые образуются в костном мозге и предотвращают от возникновения вирусных, грибковых и бактериальных поражений.
Тяжелый комбинированный иммунодефицит (также тимическая алимфоплазия, алимфоцитоз и синдром Глянцмана-Риникера) вызван мутациями различных генов. В основном заболевание развивается на фоне аутосомно-рецессивных дефектов, при которых проявления ТКИД у младенцев наблюдаются в том случае, если мутации будут на обеих хромосомах одного гена отца и матери. Если ТКИД имеет Х-сцепленный тип наследования, то болезнь проявляется только у мальчиков. При этом их мать здорова, но является носителем генного дефекта.
В результате значительного повреждения иммунной системы на генетическом уровне, дефицит клеточного и гуморального иммунитета приводит к развитию тяжелых рецидивирующих инфекций с самого рождения. У детей с тяжелым комбинированным иммунодефицитом наблюдаются пневмонии и диареи хронического характера, а также отмечается: задержка физического развития, аномалии костей, кандидоз, гипертермия. Симптоматика может быть вариабельной, в зависимости от типа ТКИД.
Чтобы получить более подробную информацию или консультацию специалиста по орфанным заболеваниям, заполните все поля формы. Наши консультанты будут рады Вам помочь.
Встречаемость тяжелого комбинированного иммунодефицита составляет приблизительно 1-2 случая на 100 тыс. нарожденных. Распространенность ТКИД в Австралии 1:65000 младенцев. Также по данным исследований, высокая частота встречаемости тяжелого комбинированного иммунодефицита была отмечена в индейских народностях США. В частности у меннонитов, племен Апачи, амишей и популяции навахо тяжелый комбинированный иммунодефицит выявляется в 1 случае на 2,5 тыс. младенцев.
В медицине выделяют несколько типов тяжелого комбинированного иммунодефицита:
- X-сцепленный тяжелый иммунодефицит — распространенная форма ТКИД, наследуемая по рецессивному признаку, поскольку дефектный ген находится в Х-хромосоме. При данном типе тяжелого комбинированного иммунодефицита мутации возникают в гене, который кодирует общие гамма-цепи. В результате мутации повреждаются рецепторы интерлейкинов, вовлеченных в процесс образования T- и B-лимфоцитов, что приводит к недостаточности иммунной системы.
- Дефицит аденозиндезаминазы(ADA) — вторая по распространенности форма ТКИД, развитие которой обусловлено дефектом аденозиндеаминазы, расщепляющей пурины. Дефицит фермента аденозиндеаминазы приводит к накоплению метаболита dATP, ингибирующего рибонуклеотидредуктазу. Нарушение функции рибонуклеотидредуктазы приводит к блокировке пролиферации лимфоцитов и подавлению иммунной системы.
- Синдром Оменна (Omenn syndrome) — аутосомно-рецессивная форма тяжелого комбинированного иммунодефицита, связанная с мутацией иммунологически релевантных генах T- и B-лимфоцитов (RAG1 и RAG2, ДНК-лигаза IV, IL7Rα и др.). Помимо диареи и оппортунистических инфекций, данный тип ТКИД у детей сопровождается эритродермией, гепатомегалией, увеличением лимфоузлов и селезенки.
- Синдром «голых» лимфоцитов — форма ТКИД, при которой лимфоциты не экспрессируют молекулы HLA-I, что блокирует Т-зависимый иммунный ответ. Наследуется по аутосомно-рецессивному типу.
Также существует еще 2 типа тяжелого комбинированного иммунодефицита, вызванного дефицитом фермента JAK3 и отсутствием гена DCLRE1C/Artemis. Второй тип ТКИД, связанный с гипоморфной мутацией в гене DCLRE1C, кодирующем ARTEMIS, часто встречается у детей индейских народностей Апачи и Навахо.
Диагностика
Первоначально проводится физикальное обследование на характерные проявления: нарушения скелета, сыпь, язвы в ротовой полости, увеличение печени и селезенки, микроцефалию, задержку физического развития, отставание в массе тела. Кроме обследования иммунолога и инфекциониста, обязателен осмотр лора и невролога, поскольку при ТКИД у детей нередко наблюдаются гнойные хронические отиты и энцефалопатии.
После этого врач получает подробную информацию о семейном анамнезе, обращая особое внимание на смерти детей в раннем возрасте, случаи повторных инфекций, близкородственный брак и т.д. Также изучает историю болезни ребенка на рецидивирующие инфекции, хроническую диарею, затяжные лихорадки, рвоту, длительный кашель и другие симптомы тяжелого комбинированного иммунодефицита.
На следующем этапе требуется лабораторная диагностика: общий и биохимический анализ крови, позволющий выявить лимфоцитопению, лейкопению, анемию, а также определить уровень иммуноглобулинов, мочевой кислоты в сыворотке, пролиферации Т-клеток и т.д. Кроме того, назначается общий анализ мочи, тесты ИФА и ПЦР, проточная цитометрия, миелограмма (пункция костного мозга) молекулярно-генетический анализ для определения типа генной мутации.
В инструментальное исследование для оценки вовлеченности в паталогический процесс внутренних органов входит: рентгенография и компьютерная томография грудной клетки, УЗИ вилочковой железы и брюшной полости. По показаниям проводят ЭХО-энцефалографию, ЭКГ, УЗИ лимфоузлов и органов малого таза, КТ головного мозга, сцинтиграфию костей. Тяжелый комбинированный иммунодефицит дифференцируют с затяжной пневмонией и длительной лихорадкой, пиодермией, другими видами иммунодефицитных состояний.
Лечение
Детям с тяжелым комбинированным иммунодефицитом необходима изоляция в стерильных боксах (асептический режим), чтобы исключить риски инфекционного заражения. Также для предотвращения развития инфекций применяют антибиотики и заместительную терапию иммуноглобулинами. При ТКИД с дефицитом аденозиндеаминазы назначают генную терапию, которая подразумевает введение генетических элементов в клетки пациента с помощью молекулярно-генетических технологий. Генотерапия позволяет восстановить недостаточную функцию генов, повысить иммунный ответ и стимулировать гибель патологических клеток. Кроме этого, в курс консервативной терапии включают дезинтоксикационную, нейропротекторную и заместительную ферментную терапию, а также использование местных антисептических, антимикотических, противовирусных и антибактериальных средств. В некоторых случаях показаны глюкокортикостероиды, муколитики, диуретики, бронхолитики и противосудорожные препараты.
Следует отметить, что подобные методы применяются с целью устранения симптомов, предотвращения осложнений и поддержания нормального состояния детей с тяжелым комбинированным иммунодефицитом. Единственным эффективным методом лечения ТКИД является трансплантация гемопоэтических стволовых клеток, которые берут у одного из родителей или неродственного HLA-идентичного донора. Пересадку костного мозга для восстановления иммунитета следует проводить в самом раннем возрасте ребенка, сразу после постановки диагноза. Если при тяжелом комбинированном иммунодефиците отсутствуют Т-лимфоциты, предимплантационная химиотерапия необязательна, поскольку организм с низким иммунитетом не способен отторгнуть трансплантат. Детям с АДА-дефицитом трансплантация гемопоэтических стволовых клеток не показана. В таких случаях вводят модифицированный АДА (полиэтилен-гликоль аденин дезаминаза).
Прогноз
Без своевременного и комплексного лечения дети с тяжелым комбинированным иммунодефицитом погибают в течение 1-2 лет или нескольких месяцев (при тяжелых формах ТКИД). После поддерживающей терапии и успешной трансплантации костного мозга складывается благоприятная прогностическая картина, более 85 % полностью выздоравливают.
Если вам необходима консультация специалиста по орфанным заболеваниям, заполнив все поля формы, и наши консультанты будут рады Вам помочь.
Тяжелый комбинированный иммунодефицит (T–B–NK+) у ребенка первых месяцев жизни
Е.Н. Охотникова, д.м.н., профессор, зав. кафедрой педиатрии № 1, Ю.И. Гладуш, к.м.н., генеральный директор, Т.П. Иванова, Е.И. Усова, О.Ф. Зарудняя, В.Т. Леуш, А.Ю. Денисенко Национальная медицинская академия последипломного образования имени П.Л. Шупика, Национальная детская специализированная больница «ОХМАТДЕТ», г. Киев

На современном этапе развития медицины становится очевидным, что первичные иммунодефициты (ПИД) – не столь редкое заболевание, как считалось раньше. Частота встречаемости ПИД в среднем составляет 1:10 000 населения. Ранняя диагностика и своевременно начатая адекватная терапия позволяют значительно увеличить продолжительность жизни таких больных и повысить ее качество. Низкая настороженность педиатров в отношении ПИД и невозможность в некоторых случаях провести иммунологическое исследование влекут за собой неоправданно высокий уровень ранней детской смертности, обусловленной инфекционными и другими осложнениями [3].
Тяжелые комбинированные иммунодефициты (ТКИД) – заболевания, при которых вследствие той или иной генетической патологии резко нарушена выработка и/или функционирование как В-, так и Т-лимфоцитов, что обусловливает повреждение гуморального и клеточного звеньев иммунитета. ТКИД (Т–В–NК+) – это ПИД, характеризующийся отсутствием Т- и В-лимфоцитов при нормальном содержании натуральных киллеров (NК-клеток).
Генетические дефекты, вызывающие ТКИД (Т–В–NК+)
Дефицит рекомбиназа-активирующих генов 1 и 2 (RAG1 и RAG2) впервые описан в 1996 г. Его частота составляет 10–20% всех случаев аутосомно-рецессивных форм ТКИД. Функция RAG1 и RAG2 незаменима для генерации вариабельности антигенных рецепторов Т- и В-лимфоцитов, которая осуществляется путем рекомбинации. Благодаря генерации вариабельности создается уникальный для каждого человека набор клеток, способных распознавать практически любые антигены. Мутации в этих генах приводят к нарушению процессов дифференциации клеток-предшественников Т- и В-лимфоцитов в ранних стадиях развития вследствие невозможности рекомбинации [3, 4].
Дефицит DCLRE1C (Artemis; DNA cross-link repair 1C protein (Protein artemis), Cernunnos/XLF и ДНК Ligase IV (LIG4) встречается крайне редко и имеет аутосомно-рецессивный тип наследования. Вышеуказанные гены, как и RAG1, RAG2, необходимы для развития антигенраспознающих рецепторов, а также считаются генами-кандидатами индивидуальной радиочувствительности человека [1], в связи с чем, помимо общих признаков иммунодефицита (ИД), этим больным свойственна повышенная чувствительность к ионизирующему излучению и склонность к развитию лейкозов и лимфом. Характерными клиническими особенностями дефицита Cernunnos/XLF и ДНК Ligase IV (LIG4) являются микроцефалия, лицевая дистрофия и задержка внутриутробного развития [8, 9].
Клинические проявления
Клинические проявления ТКИД (Т–В–NК+) в большинстве случаев соответствуют симптоматике других видов ТКИД.
Для этого варианта ТКИД характерно раннее (в первые недели и месяцы жизни) начало заболевания, которое чаще всего дебютирует развитием инфекционного синдрома, что может быть расценено как внутриутробное инфицирование, а вялотекущая, малосимптомная нейроинфекция может быть ошибочно трактована как перинатальное поражение нервной системы [3]. Поэтому следует помнить об особенностях инфекционного процесса при ИД, к которым относятся:
• рецидивирующее течение со склонностью к переходу в хроническую форму;
• неспособность организма ограничивать размножение микроорганизмов, что влечет за собой развитие более глубокого процесса (менингита, остеомиелита, сепсиса и т. д.);
• атипичное течение – отсутствие или низкий уровень острофазовых показателей, неинформативные серологические реакции в связи с нарушением антителообразования;
• характерная мультифокальность инфекционного процесса в отличие от рецидивирующей или хронической инфекции, обусловленной анатомическими дефектами;
• выделение при бактериологическом исследовании материала из очага инфекции, кроме патогенных микроорганизмов (Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Neisseria spp., Pseudomonas aeruginosa, анаэробные микроорганизмы), непатогенных или условно-патогенных микроорганизмов (Pneumocystis carinii, Serratia marcescens, Proteus spp., Citrobacter spp., Klebsiella spp., Candida albicans, Aspergillus fumigatus), способных стать возбудителями только в условиях ИД. Очень часто это проявляется стойким кандидозом кожи и слизистых оболочек, онихомикозом;
• несоответствие между интенсивностью инфекционного процесса и реакцией лимфоидной ткани: для пациентов с ТКИД характерна гипоплазия или аплазия лимфоидной ткани – миндалин, лимфатических узлов и тимуса;
• опасность развития регионарной и/или генерализованной БЦЖ-инфекции, если ребенку проводилась вакцинация против туберкулеза. В ответ на введение оральной полиовакцины может развиться паралич или парез.
Дети с ТКИД значительно отстают в физическом развитии в связи с постоянными затратами энергии на борьбу с инфекцией и хронической диареей при наличии таковой. Хроническая диарея относится к числу наиболее характерных проявлений ИД. Она может иметь как секреторный, так и инвазивный генез. Наиболее частой ее причиной являются следующие инфекционные агенты: бактерии (Escherichia coli), вирусы (Rotavirus, Adenovirus, Cytomegalovirus), простейшие (Giardia lamblia, Cryptosporidium). Также диарея может быть результатом нарушения пристеночного пищеварения, которое развивается вторично, на фоне инфекционного процесса [2, 4, 5, 12].
Повышается частота развития онкологических заболеваний (лимфомы, лейкозы); возможны нарушения строения скелета, в частности костей черепа, что наиболее характерно для дефицита DCLRE1C (Artemis), Cernunnos/XLF и ДНК Ligase IV (LIG4) [8, 9].
При любой форме ТКИД возможны псевдоаллергические реакции (токсикодермия, экзантема) на фоне лекарственной и пищевой непереносимости и псевдоаутоиммунные поражения (реактивные артриты, инфекционные цитопении, вирусные гепатиты) [10].
Диагностика
Необходим тщательный сбор анамнеза с построением генеалогического дерева. Следует обратить внимание на такие моменты: смерть предыдущих детей, особенно в раннем возрасте, в семье пробанда, семьях кровных родственников, а также наличие злокачественных лимфоретикулярных опухолей в семейном анамнезе. Необходимо уточнить акушерский анамнез матери, в котором должно вызвать настороженность наличие самопроизвольных абортов. Также анализируется течение беременности, закончившейся рождением больного ребенка, наличие заболеваний у матери во время беременности. Отягощенный анамнез в совокупности с характерной клинической картиной дает повод для проведения общего и специального лабораторного обследования.
При оценке результатов общего анализа крови выявляется снижение абсолютного количества лимфоцитов (
Комплексное иммунологическое исследование крови позволяет установить:
• содержание Т-лимфоцитов СD3+ • содержание сывороточных иммуноглобулинов IgG и IgA – меньше двух стандартных отклонений от нормы;
• пролиферативный ответ на митогены фитогемагглютинин, конканавалин А, митоген лаконоса, стафилококковый протеин А • отсутствие ответа (анергия) на постановку пробы Манту с 2 ТЕ и проведение кожных тестов определения гиперчувствительности замедленного типа с использованием кандидозного, столбнячного, дифтерийного антигенов;
• определение материнских лимфоцитов в циркуляции путем определения их HLA-фенотипа (по возможности) [2].
Молекулярно-генетическое исследование позволяет верифицировать генные дефекты и проводить генетическое консультирование семей и пренатальную диагностику. В США обсуждается вопрос введения программ скрининга всех новорожденных для раннего выявления больных с ПИД. Существует относительно простой анализ на наличие особых веществ (побочных продуктов созревания Т-лимфоцитов – так называемых TREC), перспективный с точки зрения диагностики ТКИД при рождении ребенка. Однако эта методика еще не полностью отработана [11].
Дифференциальная диагностика
Поскольку в клинической картине ТКИД ведущим является инфекционный синдром, следует исключить другие причины, которые могут вызвать подобную симптоматику, а именно:
• морфологические дефекты (пороки развития бронхолегочной системы, сердца и др.);
• нарушения микроциркуляции (диабет, васкулиты и др.);
• повреждение защитных барьеров (экзема, ожоги, нарушения мукоцилиарного барьера и др.);
• необычные инфекционные факторы (наличие хронических очагов инфекции при отсутствии адекватной терапии, источников постоянного реинфицирования: контаминированная вода и пища и т. д.);
• наличие инородных тел (венозные катетеры, аспирированное инородное тело и др.).
Также необходимо исключить врожденные TORCH-инфекции и причины, вызывающие вторичные ИД, в том числе ВИЧ-инфекцию. Кроме того, ТКИД (Т–В–NК+) следует дифференцировать от других видов ПИД.
Лечение
Последние десятилетия ХХ в. ознаменовались существенным прогрессом в лечении комбинированных ИД. Если раньше ТКИД относились к группе заболеваний, неминуемо заканчивающихся летальным исходом, то на данном этапе при своевременной диагностике многим детям удается обеспечить удовлетворительное качество жизни в течение многих лет.
В настоящее время наиболее эффективным методом лечения ТКИД считается пересадка стволовых клеток костного мозга. Оптимальные сроки проведения трансплантации – первые три месяца жизни. Положительный клинический эффект отмечается у 80% детей. Для успешной трансплантации необходима максимальная степень сходства между донором и реципиентом по главным комплексам гистосовместимости (МНС, HLA). Как правило, это родные братья, сестры или родители больного. Если никто из родственников не подходит, проводится трансплантация стволовых клеток от неродственного донора. Существуют международные центры, которые хранят стволовые клетки тысяч доноров, предварительно типированных по HLA-антигенам. К сожалению, в Украине практически отсутствует такая система, поэтому приходится прибегать к помощи зарубежных коллег. Также на этапах разработки находится пренатальная пересадка стволовых клеток, которая уже проводилась в США и некоторых странах Европы [7, 13].
Существуют также дополнительные методы лечения, направленные на профилактику и лечение инфекционных осложнений. В первую очередь это строгая изоляция пациентов для минимизации риска заражения от окружающих людей. В обязательном порядке применяются антибактериальные, противогрибковые и противовирусные препараты, действие которых направлено на угнетение наиболее опасных представителей внебольничной микрофлоры. Детям, которые были вакцинированы против туберкулеза, необходима профилактическая терапия изониазидом или рифампицином. Для профилактики пневмоцистной пневмонии применяется триметоприм-сульфаметоксазол, грибковых инфекций – нистатин, при орофарингеальном кандидозе и инвазивной форме кандидозной инфекции – флуконазол. Вторичная профилактика оппортунистических вирусных инфекций осуществляется ацикловиром.
Следует подчеркнуть, что с лечебной целью антибактериальная терапия проводится в максимальных дозах и до полного исчезновения клинической симптоматики; при этом длительность курса в 2–3 раза превышает обычную. Противопоказана вакцинация любыми живыми вакцинами.
При необходимости переливания препаратов крови для профилактики развития заболевания «трансплантат против хозяина», переливаемая кровь должна быть облучена в дозе 30 Гр.
В связи с отсутствием у пациентов с ТКИД В-лимфоцитов, продуцирующих иммуноглобулины, показана заместительная терапия внутривенными препаратами иммуноглобулинов [2].
На этапе разработки находится такой перспективный метод лечения, как генная терапия. В ее основе лежит введение здорового гена в изолированные клетки больных in vitro и реинфузии таких клеток больному. Этот метод терапии был использован в США в лечении таких форм комбинированных ИД, как недостаточность аденозиндезаминазы, Х-сцепленный ИД. Наиболее перспективным считается проведение генотерапии в антенатальный период, сразу после выявления ИД. В этом случае существуют шансы на рождение здорового ребенка. Можно предположить, что в будущем метод генотерапии станет основным в лечении ПИД [4, 6, 13].
В качестве иллюстрации приводим случай из собственной практики – ТКИД (Т–В–NК+) у ребенка грудного возраста, демонстрирующий особенности течения заболевания.
Мальчик М.В., 3,5 мес, поступил на обследование и лечение в инфекционно-боксированное отделение для детей младшего возраста НДСБ «ОХМАТДЕТ» из Луцкой областной детской больницы с предварительным диагнозом «Общий вариабельный иммунодефицит (Т/В)».
Из анамнеза жизни известно, что ребенок от молодых, здоровых родителей, II беременности, протекавшей на фоне ОРВИ в I триместре, II родов на 38–39-й неделе, проходящих с медикаментозной стимуляцией в связи со слабостью родовой деятельности. Родился с массой тела 3 100 г, ростом 52 см. Оценка по шкале Апгар – 8–9 баллов. В роддоме проведена плановая вакцинация против туберкулеза. Выписан на 4-е сутки. За 1-й месяц прибавка массы тела – 1 300 г, за 2-й – 500 г. Находится на грудном вскармливании.
Из анамнеза болезни: с 3-месячного возраста у ребенка отмечалось снижение аппетита и задержка прибавки массы тела. Участковым педиатром был диагностирован афтозный стоматит, назначена местная терапия (хлорофиллипт, метиленовый синий), но положительный эффект не наблюдался. Через 2 нед у ребенка развился гипертермический синдром, в связи с чем был госпитализирован по месту жительства с диагнозом «ОРВИ, ринофарингит, двусторонний отит». На фоне проводимого лечения (амикацин, ацикловир, флуконазол, 1 внутривенное введение иммуноглобулина), а также местной терапии стоматита (метиленовый синий, герпевир, метрогил дента) улучшения состояния не наступило: сохранялись лихорадка и явления афтозного стоматита. Тогда же в гемограмме впервые была зафиксирована лейкопения (минимальный уровень – 2,5х10 9 /л) с моноцитозом (до 30%), в связи с чем были проведены костномозговая пункция и иммунологическое исследование крови, выявлен дефицит Т- и В-звена иммунитета.
Для верификации диагноза и определения дальнейшей тактики лечения ребенок переведен в НДСБ «ОХМАТДЕТ».
При поступлении состояние ребенка средней тяжести: вялый, кожные покровы бледные, чистые, мышечный тонус снижен, на слизистой оболочке ротовой полости – белые налеты. Границы относительной сердечной тупости – в пределах возрастной нормы, тоны сердца достаточной звучности. Патологических перкуторных изменений над обоими легкими нет, аускультативно – везикулярное дыхание. Живот обычной формы, печень – +1,5 см, селезенка не пальпируется. Стул и диурез в норме.
Проведена дифференциальная диагностика между ПИД и ВИЧ-инфекцией, а также комплексное обследование.
Читайте также:
