Вагальная параганглиома - лучевая диагностика
Добавил пользователь Morpheus Обновлено: 29.01.2026
Параганглиомы головы и шеи или опухоли гломуса - это нейроэндокринные опухоли, источником которых являются параганглионарные клетки, мигрировавшие в период внутриутробного развития из нервного гребня и находящиеся в близких взаимоотношениях с ганглионарными клетками вегетативной нервной системы.
Их можно подразделить на 2 группы: симпатические и парасимпатические. Ранее они описывались как хемодектомы, или опухоли гломуса, однако термин «параганглиома» является более предпочтительным. В настоящее время параганглиомы классифицируются согласно их анатомической локализации, например, каротидная параганглиома, югулярная параганглиома, вагальная параганглиома и так далее.
В области головы и шеи параганглиомы, как правило, исходят из каротидного тельца, тимпанического сплетения, яремной луковицы, вагальных и симпатических ганглиев. Наиболее частым местом локализации параганглиом на голове и шее является бифуркация общей сонной артерии.
Каротидные параганглиомы обычно представляют собой опухолевидное образование в области шеи. Обычно параганглиомы характеризуются медленным ростом и бессимптомным течением, что является одной из причин их поздней диагностики (чаще после 50 лет).
Увеличиваясь в размерах, опухоль может распространяться вдоль сонных артерий с вовлечением в патологический процесс расположенных рядом нервов, включая блуждающий, подъязычный нервы, симпатический ствол. Именно с этим связана клиническая симптоматика заболевания: головные боли, боли в области шеи, головокружение, осиплость голоса, першение в горле, дисфагия, синдром Горнера-Клода Бернара, нарушение слуха.
Клиническое наблюдение
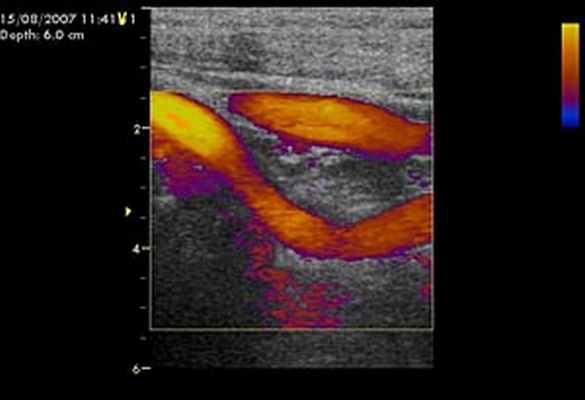
Рис. 1. Дуплексное сканирование сонных артерий.
Пациент Т., 36 лет, поступил в отделение сосудистой хирургии НМХЦ им. Н.И. Пирогова в июне 2007 г. с жалобами на наличие опухолевидного образования в левой половине шеи, дисфагию. Данное образование отмечалось у пациента в течение нескольких лет, при этом за последние несколько месяцев отмечено увеличение опухоли в размерах.
При физикальном обследовании определялось опухолевидное образование размером 6х4 см, с гладкой поверхностью, плотно-эластической консистенции, безболезненное, малоподвижное. По данным ультразвукового дуплексного сканирования внечерепных отделов брахиоцефальных артерий в левой подчелюстной области было выявлено округлое образование, в капсуле, размерами 62х41х37 мм, со слабой васкуляризацией по стенкам и в центре опухоли, не связанное с сонными артериями.
Образование принадлежит к латеральной стенке левой каротидной бифуркации и передне-латеральной стенке проксимальной порции левой внутренней сонной артерии. Также отмечалась С-образная извитость левой внутренней сонной артерии, вызванная механическим сдавлением объёмным образованием (рис.1).
При компьютерной томографии было подтверждено наличие объемного образования с участками повышенной (54 ед.) и пониженной (30 ед.) плотности (рис. 2). Образование раздвигает окружающие ткани и оттесняет левую подчелюстную слюнную железу кпереди.
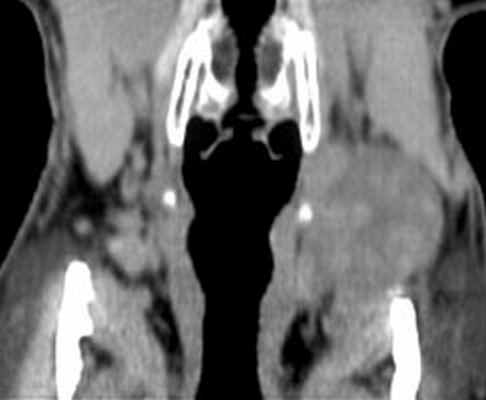
Рис. 2. Компьютерная томография мягких тканей шеи
С целью уточнения особенностей кровоснабжения опухоли, а также решения вопроса о возможной эмболизации питающих опухоль сосудов была выполнена ангиография дуги аорты и брахиоцефальных артерий. При ангиографическом исследовании было выявлено слабо васкуляризованное образование, вызывающее перегиб левой внутренней сонной артерии в первом сегменте (рис.3).
Учитывая отсутствие крупных питающих опухоль сосудов, селективная эмболизация не выполнялась.
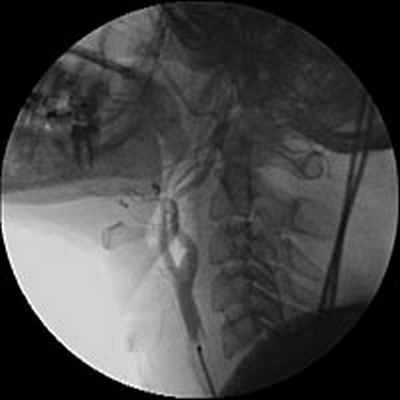
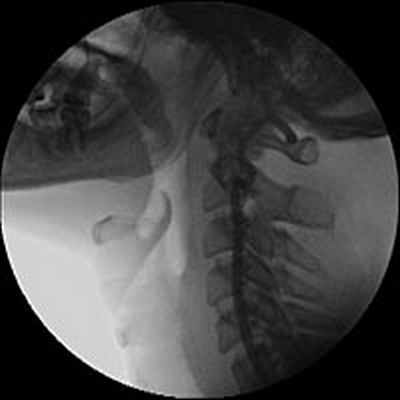
Рис. 3. Ангиография дуги аорты и брахиоцефальных артерий
Учитывая, что по данным литературы консервативное лечение параганглиом шеи неэффективно, пациенту была выполнена радикальная операция: удаление опухоли средней трети шеи слева.
Техника операции
В условиях общей анестезии был выполнен разрез по переднему краю грудинно-ключично-сосцевидной мышцы. Выделены и взяты на держалки общая, внутренняя и наружная сонные артерии.
Обнажены подъязычный и блуждающий нервы. При ревизии было установлено, что опухоль исходит из симпатического ствола и тесно связана с последним (рис. 4 А, Б).
После этого образование было выделено и удалено в пределах здоровых тканей с резекцией симпатического ствола. Опухоль имела хорошо выраженную капсулу и макроскопически напоминала невриному (рис. 5.). Следует отметить, что в до- и интраоперационном периоде проводилось определение толерантности больного к пережатию сонной артерии: транскраниальная допплерография, измерение ретроградного давления в общей сонной артерии.
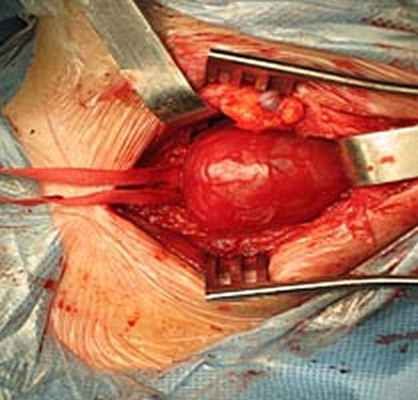
Рис.4. А. Интраоперационная картина.
Б. Схема расположения опухоли.
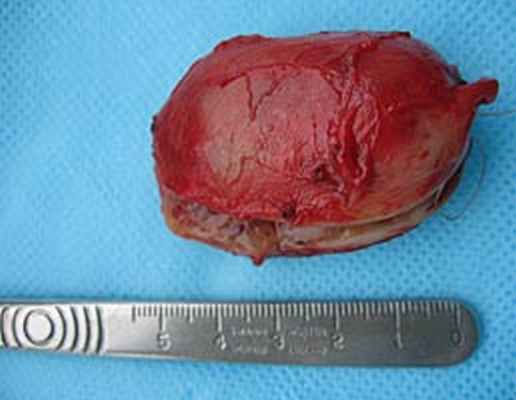
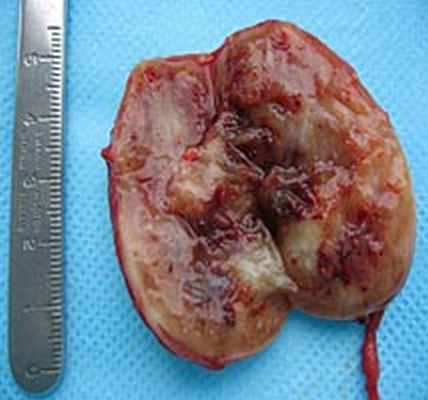
Рис. 5. Макропрепарат параганглиомы
При гистологическом исследовании опухоль была представлена вытянутыми веретеновидными клетками с обилием разнокалиберных сосудов.
При этом обращали на себя внимание гиперхромия и полиморфизм опухолевых клеток (рис. 6 А, Б). Таким образом, был подтвержден диагноз атипичной параганглиомы.
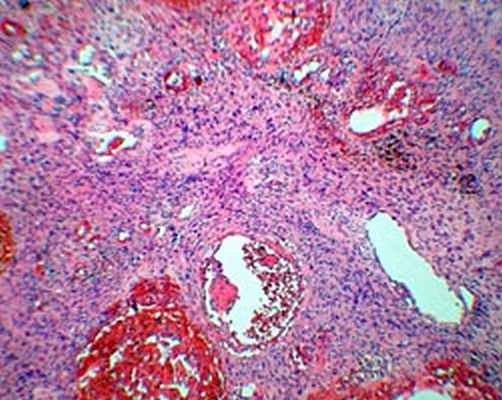
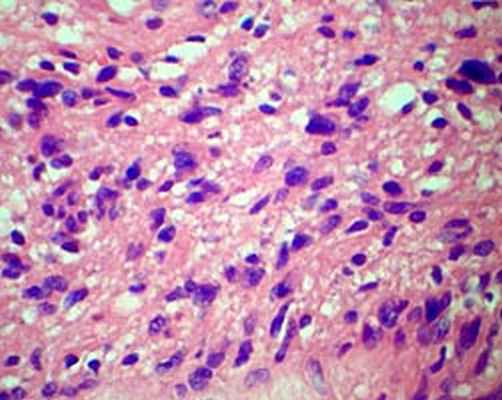
Рис. 6. А и Б. Микропрепарат параганглиомы
Послеоперационный период протекал без осложнений, и пациент был выписан на седьмые сутки после операции. К настоящему времени срок наблюдения за пациентом составляет более двух лет.
Рецидивирования симптоматики и опухолевого роста у пациента не отмечено.
© 2022 ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Использование материалов сайта полностью или частично без письменного разрешения строго запрещено.
Вагальная параганглиома - лучевая диагностика
Вагальная параганглиома - лучевая диагностика
а) Терминология:
• Параганглиома гломуса блуждающего нерва, вагальная параганглиома
б) Визуализация:
• Интенсивно накапливающее контраст новообразование, которое располагается в носоглоточной части сонного пространства, 2 см ниже яремного отверстия:
о Смещает сонную артерию вперед и в медиальную сторону
о Смещает яремную вену назад и в латеральную сторону
о Смещает жировую клетчатку окологлоточного пространства вперед и в латеральную сторону
о Смещает шиловидный отросток в латеральную сторону
• Точечные или извитые участки выпадения сигнала при МРТ («перец»)
• Гиперинтенсивное на Т2ВИ и STIR
(Слева) Схема аксиальной проекции, показана параганглиома блуждающего гломуса, которая находится в носоглоточной части сонного пространства. Новообразование расположено между внутренней сонной артерией и яремной веной, смещая их (врезка).
(Справа) КТ с КУ, аксиальная проекция. Рядом с основанием черепа расположено крупное округлое образование, интенсивно накапливающее контрастное вещество. Центральная часть опухоли расположена в верхнем отделе сонного пространства, медиальнее от шиловидного отростка. Обратите внимание, что внутренняя сонная артерия смещена вперед и в медиальную сторону, а жировая клетчатка окологлоточного пространства - вперед и в латеральную сторону. (Слева) МРТ Т1ВИ, коронарная проекция. В верхнем отделе сонного пространства имеется солидное изоинтенсивное образование. Небольшие точечные и извитые участки выпадения сигнала говорят о сосудистой природе опухоли. Обратите внимание, что жировая клетчатка окологлоточною пространства, прилежащая к сонному пространству, смещена в латеральную сторону.
(Справа) МРТ Т1ВИ FS с КУ, тот же пациент, коронарная проекция. Образование накапливает контраст интенсивно, однородно. Исключение составляют лишь крупные сосуды, которые, несмотря на введенный контраст, выглядят как участки выпадения сигнала.
в) Дифференциальная диагностика:
• Шваннома сонного пространства
• Нейрофиброма сонного пространства
• Менингиома сонного пространства
• Параганглиома сонного пространства
г) Патология:
• Происходит из гломусных телец узловатого ганглия
• В основе лежат различные генетические мутации (наследственные и спорадические):
о Синдромальная парагаглиома, множественная эндокринная неоплазия 2 типа, синдром фон Гиппеля-Линдау
д) Клинические особенности:
• Безболезненное, пульсирующее образование на латеральной поверхности шеи
• Чаще всего сопровождается нарушением функции блуждающего нерва
• При более крупных опухолях также страдают ЧН IX, XI и XII
• Множественные параганглиомы встречаются относительно часто
• Динамическое наблюдение или оперативное лечение?
о После операции функция блуждающего нерва будет в любом случае частично нарушена
е) Диагностическая памятка:
• Характерный внешний вид при КТ или МРТ
• При подозрении на вагальную параганглиому всегда следует помнить, что опухолей может быть несколько
• При наследственных формах необходимо МР-наблюдение
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ КОМПЛЕКСНАЯ ЛУЧЕВАЯ ДИАГНОСТИКА КАРОТИДНОЙ ПАРАГАНГЛИОМЫ (ХЕМОДЕКТОМЫ)
Представлен редкий клинический случай параганглиомы (хемодектомы) в области шеи. Отмечены трудности диагностики и дифференциальной диагностики, связанные со скудностью клинических проявлений. Показаны возможности лучевых методов исследования в определении наличия опухоли, локализации и распространенности процесса.
Ключевые слова
Об авторах
Список литературы
1. Soffer D. Paraganglioma // World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of the Nervous System / D. Soffer, B. W Scheithauer.- Geneva: IARC Press, 2000.
2. Lee K. Y. Noh Extraadrenal paragangliomas of the body: Imaging features. / K. Y. Lee, Y. W Oh, H. J. // Am. J. Roentgenol.- 2006.- Vol. 187.- P. 492-504.
3. Mulligan R. M. Chemodectoma in the dog / R. M. Mulligan // Am. J. Path.- 1950.- Vol. 26.- Р. 680-681.
4. Glenner G. G. Tumors of the extra-adrenal para-ganglion system, including chemoreceptors // Atlas of Tumor Pathology / G. G. Glenner, P. M. Grimley.- Washington, DC: U.S. Armed Forces Institute of Pathology, 1974.- Р. 13-33.
5. Пинский С. Б. Параганглиомы шеи / С. Б. Пинский и др. // Сибирский медицинский журнал.- 2009.- № 2.- С. 9-13.
6. Бородулин Ю. В. Современные методы диагностики в распознавании и оценке распространенности каротидных хемодектом / Ю. В. Бородулин, Б. И. Долгушин, Е. К. Колесникова, С. О. Подвизников // Советская медицина.- 1991.- № 8.- С. 74-77.
7. Константинов Б. А. Хирургическое лечение больных каротидной хемодектомой / Б. А. Константинов, А. В. Гавриленко, С. И. Скрылев, Р. Р. Степанов // Хирургия.- 2000.- № 2.- С. 4-8.
8. Атанасян Л. А. Хемодектома / Л. А. Атанасян.- М.: Медицина, 1967.- 92 с.
9. Стегайлов Р. А. Диагностика и лечение хемодектом / Р.А. Стегайлов, А. В. Гавриленко // Вопросы онкологии.- 1979.- № 9.- С. 7-11.
10. Shamblin W. Carotid body tumors (chemodectoma) / W. Shamblin, W. Remine, S. Sheps, E. Harrison // Amer. J. Surg.- 1971.- Vol. 122.- Р 732-739
11. Rao A. B. Paragangliomas of the head and neck: radiologic-pethologic correlation / A. B. Rao, K. K. Koeller, C. F. Adair // Radiographics.- 1999.- Vol. 19.- P. 1605-1632.
12. Москаленко Ю. Д. Реконструктивная хирургия сонных артерий при радикальном удалении каротидных хемодектом / Ю. Д. Москаленко, А. А. Спиридонов, Л. И. Клионер и др. // Клиническая хирургия.- 1985.- № 7.- С. 15-17.
13. Матякин Е. Г. Параганглиомы шеи (хемодектома) / Е. Г. Матякин, В. Н. Дан, А. Д. Шубин и др.- М.: Вердана, 2005.- 240 с.
14. Пачес А. И. Опухоли головы и шеи / А. И. Пачес.- М.: Медицина, 2000.- 480 с.
15. Габуния Р. И. Компьютерная томография в диагностике параганглиом шеи / Р. И. Габуния, Г. В. Фалилеев, Л. Б. Туманов, М. Г. Джумаев // Вестник оторинолариногол.- 1984.- № 5.- С. 46-49.
16. Втюрин Б. М. Клинико-морфологические сопоставления в оценке злокачественности хемодектом шеи / Б. М. Втюрин, Е. Ф. Лушников, Б. Я. Дроздовский и др. // Вестник оториноларингол.- 1983.- № 3.- С. 71-76.
17. Панасенко В. И. Хирургическое лечение опухоли каротидного гломуса / В. И. Панасенко, В. А. Покидкин, А. А. Лапин // Хирургия.- 1990.- №4.- С. 41-43.
Яремно-барабанная параганглиома
Яремно-барабанная параганглиома: некоторые вопросы диагностики и лечения больных
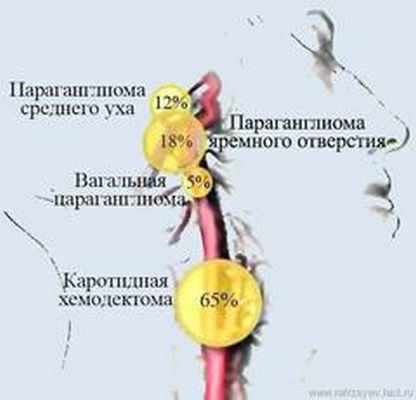
Яремно-барабанная параганглиома (ЯБП), исходя из общности анатомо-морфофизиологических особенностей, зачастую характеризуется совокупностью двух типов опухолей - гломусные опухоли или параганглиомы среднего уха (ПСУ) и параганглиомы яремного отверстия (ПЯО). Как правило, ЯБП имеют доброкачественную гистологическую структуру - в генезе их развития, доминирующее звено принадлежит гломусным тельцам (ГТ). Последние формируются из широко распространенных в организме нехромаффинных параганглий симпатической и парасимпатической нервной системы (Guild S.R., 1953, Schuknecht H.F., 1993). Скопление ГТ отмечается также в ряде областей и/или структур головы и шеи, в связи с чем, вопросы ЯБП зачастую рассматриваются в концепции параганглиом головы и шеи (ПГШ).
Так, к числу ПГШ, относятся опухоли, первично исходящие из ГТ, которые в виде небольших узелков васкуляризированной ткани (капилляры и прекапилляры), расположены на развилке общей сонной артерии -каротидная хемодектома (КХ – 65%), в области яремного отврстия (ПЯО – 85%), в среднем ухе (ПСУ – 12%), на блуждающем нерве - вагальная параганглиома (ВП – 5%) (рис.1), а также в ряде других структур головы и шеи. Скопление ГТ, также отмечается в глазнице, гортани, трахее, в органах средостения, забрюшинного пространства и желудочно-кишечного тракта.
ПГШ составляют 0,6 % всех новообразований этих областей. Частота встречаемости их в соотношение ГО других локализаций составляет 1:300000. Характерны как спорадические формы, так и семейное накопление. Предполагается аутосомно-доминантный тип наследования с преимущественным поражением лиц женского пола в соотношение 3,5:1– дебют заболевания обычно выпадает на пятую и шестую декады жизни (Zak F. , Lawson W. ,1982).
В настоящее время основным методом лечения больных с ЯБП является хирургический.
Впервые, попытка радикального удаления ЯБП бала произведена H.Rosenwasser (1945). С целью выполнения функционально-щадящей операции и обеспечения ее безопасности при удалении ЯБП, F.C.W. Capps (1952) впервые выполнил мобилизацию и смещение лицевого нерва, окклюзию сигмовидного синуса и лигирование внутренней яремной вены (ВЯВ) на шеи.
Впервые описание техники операции – удаления ЯБП, было сделано M.J. Shapiro и D.K. Neues (1964): операция включала мастоидэктомию, транспозицию лицевого нерва кпереди, лигирование ВЯВ и снабжающих опухоль артериальных разветвлений на шеи. Авторами подчеркнуты значимости управляемой гипотензии и гипотермии, которые признаны ими решающими факторами, предотвращающие смертность больных, возникших в результате неконтролируемого интраоперационного кровотечения.
В дальнейшем U. Fisch (1978) усовершенствовал эту операцию и разработал собственную методику удаления опухолей класса «С» и некоторых опухолей класса «D», доступом через подвисочную ямку.
Усовершенствование техники хирургического вмешательства за последние 2-3 десятилетия позволило получить удовлетворительные результаты у 85% больных, снизить частоту рецидивов до 5,5% и случаи смертности от 17-22% до 2,7% (Jackson B.W. et al., 2001).
Лучевая терапия как паллиативное лечение применяется при остаточной после операции опухоли и рецидиве заболевания.
Богатое кровоснабжение опухоли, критическое топографо-анатомическое соотношение ее с некоторыми черепными нервами (IX-XII) и сосудами (внутренней сонной артерией, луковицей яремной вены) на шеи, чрезвычайна сложная хирургическая анатомия с точки зрения операбельности распространенных ЯБП, отдают предпочтение выполнение операции, хирургам, имеющим квалификацию по микрохирургии основания черепа.
Параганглиома среднего уха (ПСУ)
Основным местом скопления ГТ в среднем ухе является промонториальная стенка, где как обычно развивается ПСУ (Вайшенкер П.Г., 1976, 1978; Barnes L., et al., 1985; Schuknecht H.F., 1993; Lo WWM, Solti-Bohman L.G., 1996). При этом скопление ГТ, чаще всего, отмечается вдоль ушного разветвления блуждающего нерва (нерв Арнольда) (Guild S.R., 1953; Schuknecht H.F., 1993; Lo WWM, Solti-Bohman L.G., 1996) и барабанное разветвление языкоглоточного нерва (нерв Якобсона) (Вайшенкер П.Г., 1976, 1978, Duckert L.G., 1993). Изредка опухоль, может развиваться из ГТ, расположенных вдоль сонно-барабанных канальцев или части лицевого канала (Donaldson J.A., et al., 1992; Schuknecht H.F., 1993; Duckert L.G., 1993).
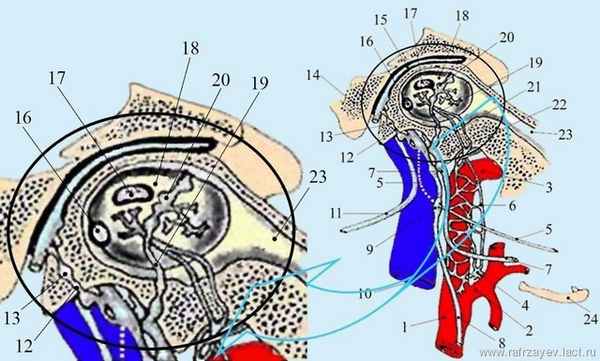
Одним из особенностей ГТ среднего уха является свойство, обеспечивающее выравнивание перепадов давления в морфологических и анатомических структурах среднего уха, благодаря работе рецепторов давления (Eden A., 1981, Eden A., Gannon P., 1987, Gannon P., Eden A., 1987, Rockley T.J., Hawke M. 1989, Ars B., Wuyts F.L., Van de Heyning P.H., 1997).
Обладая экспансивным ростом, ПСУ, зачастую приводит к патоморфологическим изменениям мягких тканей (барабанной перепонки) и деструкции костных структур – нижней стенки барабанной полости, задней поверхности пирамиды височной кости и наружной стенки канала внутренней сонной артерии (ВСА). При распространении опухоли на близлежащие анатомические области, могут наблюдаться, также поражение некоторых сосудистых и нервных структур. Следовательно, знание анатомо-топографических особенностей ПСУ, имеет большое значение, как для раннего распознавания опухоли, так и выбора адекватного метода лечения больных.
Оптимальным методом лечения больных с ГСУ, является хирургический, который обычно осуществляется путём отомикрохирургического вмешательства. При этом одни авторы, как метод выбора применяют эндомеатальный подход (Subha S.T. et al., 2005; Alaani A. et al., 2009; Sanna M. et al., 2010), другие для обеспечения подхода к опухоли, предварительно производят расширение костной части наружного слухового прохода проведением либо межхрящевого разреза по Heerman (Колесников В.Н. с соавт. 2012), либо заушного разреза (Антонив В.Ф., 1982; Рзаев Р.М. 2010; Рзаев Р.М. с соавт., 2012; Fisch U. et al., 1988; Sanna M. et al., 2010; Prasad S.C. et al., 2011), а некоторые, – отдают предпочтение трансмастоидальному подходу (Рзаев Р.М. 2010; Рзаев Р.М. с соавт., 2012; Fisch U. et al., 1988; O'Leary M.J. et all. 1991; Sanna M. et al., 2010; Prasad S.C. et al., 2011).
Несмотря на определенные успехи, достигнутые в хирургическом лечении больных с ПСУ, вопросы применения эффективного хирургического вмешательства при данной патологии не теряют своей актуальности .
В течение 25 лет (1986-2012 гг.) под нашим наблюдением находились всего 10 больных (8 женщин и 2 мужчин), ЯБП у 5 из которых была диагностирована ПЯО, а у других 5 больных – только ПСУ (средний возраст 53 года).
Всем больным наряду с общими клиническими обследованиями, производили исследование уха, которое включало отомикроскопию, аудио – и тимпанометрию, КТ и/или МРТ, а также ангиографию (у больных с ПЯО). Из радиологических методов исследований отдавали предпочтение КТ, данные которой обладают большей информативностью для распознавания раннего процесса развития опухоли и очагов деструкции костных структур (нижней стенки барабанной полости, задней поверхности пирамиды и/или наружной стенки канала ВСА) при распространении опухоли. Были программированы следующие параметры КТ: толщина томографического среза 5 мм, шаг стола томографа 1-1,5 мм. МРТ проводили при сомнении на опухолевую экспансию в анатомические структуры среднего уха и соседние с ней области.
В отличие больных ПЯО, у которых была применена субтотальная петрозэктомия (Р.М. Рзаев, 2010), при удалении ПСУ, почти во всех случаях была проведена операция с применением ретроаурикулярно-эндомеатального подхода. Только при распространении опухоли в сосцевидный отросток - инфралабиринтное пространство, а также при подозрении на деструкцию нижней стенки барабанной полости и/или наружной стенки канала ВСА, была произведена расширенная операция с применением ретроаурикулярно-эндомеатально-трансмастоидального подхода. Во всех случаях диагноз был подтвержден патогистологическим исследованием.
Оценка степени распространения опухоли проводилась по классификации U. Fisch, D. Mattox (1988) (рис.3).
Параганглиома шеи (хемодектома)
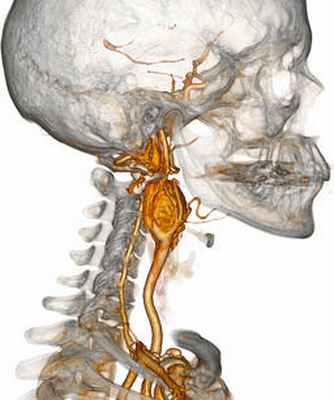
Параганглиома шеи – весьма редкий вид опухоли из ряда нейроэндокринных образований, исходящая из параганглиев (скопление гормонально активных клеток). В настоящее время данные нейроэндокринные опухоли классифицируются по локализации их «обитания» - каротидная параганглиома (или хемодектома), вагальная параганглиома, атипичная параганглиома, югулярная параганглиома, феохромацитома и т.п. Всех их можно подразделить, в том числе, и по тому, синтезируют ли они гормоны (являются ли гормоноактивными опухолями) или нет. Следовательно, выделяют симпатические и парасимпатические опухоли; синтетические параганглиомы продуцируют выработку катехоламинов (к которым, к примеру, относят такие нейромедиаторы, как адреналин, дофамин, норадреналин; к слову, симпатические параганглиомы будут отличаться от феохромацитом, так как вторые синтезируют только адреналин). Обычно параганглиомы располагаются вблизи крупных артериальных стволов, типичные места локализации – область черепа, шеи, грудной клетки, живота, таза, мочевого пузыря – чрезвычайно
неприхотливые в расположении опухоли, не считая близости к сосудам, обеспечивающим их питание. В области головы и шеи они произрастают из каротидного тельца (отсюда и одно из названий – гломусные опухоли), блуждающего нерва, расположенного вблизи сонных артерий, а так же из вагальных клеток, чаще всего их обнаруживают в области бифуркации (разветвления общей сонной артерии на наружнюю и внутреннюю артерии). Характеризуется данный вид опухоли медленным ростом, как у многих доброкачественных опухолей (однако, быстрый рост так же не будет говорить об озлокачествлении), а так же, зачастую, бессимптмным лечением, поэтому наиболее часто это случайные находки. Единственным проявлением может быть пальпаторное обнаружение самими пациентами безболезненного образования в области шеи, часто принимаемое за увеличенный лимфоузел, поэтому часто ему не придают значения. В случаях сдавления опухолью сонных артерий будет наблюдаться симптоматика, сходная с симптомами при стенозирующем атерослерозе брахиоцефальных артерий: головные боли, головокружения, снижение памяти, нарушение зрения и координации движения. При сдавлении нервных окончаний могут появляться дисфагия (ощущение инородного тела при глотании), а так же боли в области расположения самой опухоли.
Методы диагностики
Ультразвуковая диагностика сосудов в настоящее время включает в себя целый ряд различных режимов исследования: ультразвуковая допплерография (УЗДГ), ультразвуковое дуплексное сканирование (УЗДС), цветовое дуплексное сканирование (ЦДС) и другие. С помощью ультразвука проводится оценка состояния магистральных артерий и вен различных областей человеческого тела. Метод позволяет выявить наличие сужений (стенозов) в просвете сосуда, препятствующих нормальному кровотоку, а также диагностировать наличие тромботических масс и посттромботических изменений в артериальной и венозной системах. Такое жизнеугрожающее состояние, как аневризма аорты (самого крупного артериального сосуда) нередко являются случайными находками при плановых ультразвуковых исследованиях. При транзиторной ишемической атаке ультразвуковое исследование сонных артерий используют для определения их проходимости и поиска причины уменьшения кровоснабжения мозга, что позволяет предотвратить развитие инвалидизирующего инсульта. Последние десятилетия УЗДГ является стандартном диагностики варикозной болезни и методом оценки тромбоза глубоких и поверхностных вен верхних и нижних конечностей. Ультразвуковое исследование сосудов не требует специальной подготовки, выполняется в кратчайшие сроки и обладает высокой чувствительностью и информативностью, что позволяет с высокой точностью установить диагноз и назначить соответствующее лечение.
Ангиография – метод контрастного рентгенологического исследования сосудов, про котором в кровеносное русло вводится специальный рентген-контрастный препарат, облегчающий визуализацию артерий и вен различного калибра. Ангиографический метод позволяет наиболее точно выявить наличие сужений и окклюзий по ходу кровотока, а также оценить степень и протяженность подобных нарушений, причинами которых могут быть атеросклеротические бляшки, эмболы и тромбозы. Современные ангиографические катетеры способны окрасить сосуды интересующего нас органа, используя минимальное количество контраста, снижая нагрузку на выделительную функцию почек. В отличие от других контрастных методов исследования (КТ, МРТ), при обнаружении критических сужений кровеносных сосудов метод ангиографии позволяет в тот же момент выполнить лечебную процедуру, направленную на восстановление нормального просвета артерий и вен путем выполнения ангиопластики и/или стентирования. Несмотря на то, что ангиографическое исследование требует пребывания пациента в стационаре, современные рентген-установки позволяют с высочайшей точностью определить локализацию сосудистой патологии и принять наиболее точное решение о тактике дальнейшего лечения пациента.
Магнитно-резонансная ангиография (МР-ангиография, МРА) — метод получения изображения кровеносных сосудов при помощи явления ядерного магнитного резонанса, фиксируемого датчиками магнитного томографа. Метод ядерного магнитного резонанса позволяет изучать организм человека на основе насыщенности тканей организма водородом и особенностей его магнитных свойств. Современная МР-ангиография как метод визуализации сосудов по своей информативности становится в один ряд с методом рентгенконтрастной ангиографии. Метод позволяет оценить как анатомические, так и функциональные особенности кровотока. Для усиления четкости изображение могут применяться особые контрастные вещества. В настоящее время метод МР-ангиографии позволяет успешно диагностировать артериальные аневризмы, артериовенозные мальформации головного и спинного мозга, посттромботические поражения вен, стенозы и тромбозы сосудов различных локализаций, а также аномалии их развития. Одним из преимуществ МРА является возможность визуализации не только сосудистого русла, но и окружающих мягких тканей. В случае опухолевых поражений этот метод дает дополнительную информацию о дислокации опухолью магистральных артерий и вен, а в некоторых случаях позволяет визуализировать сосудистую сеть опухоли.
Мультиспиральная компьютерная томография (МСКТ) является одним из высокоточных методов диагностики заболеваний сердечно-сосудистой системы. В основе работы компьютерного томографа лежит рентгеновская установка, способная выполнять многосерийную съёмку тела пациента под различными углами. Полученные изображения впоследствии обрабатываются компьютером и совмещаются в единую картинку. Современные МСКТ-установки способны создавать трёхмерные реконструкции, позволяющие врачу виртуально поворачивать тело пациента и визуализировать наиболее труднодоступные участки. КТ-ангиография является альтернативой для пациентов, которым противопоказано выполнение МРТ из-за наличие различного рода металлических имплантов. Важно отметить, что современные компьютерные томографы, благодаря своей быстроте и высокой чувствительности, оказывают минимальную лучевую нагрузку на пациента. В отделении сосудистой хирургии НМХЦ им. Н.И. Пирогова с помощью метода МСКТ-ангиографии диагностируют самые различные патологии сосудистого русла, такие как аневризмы, атеросклеротические стенозы, патологические извитости, посттромботические изменения, венозные тромбозы и окклюзии и др.
Однофотонная эмиссионная компьютерная томография (ОФЭКТ) представляет собой новейший метод комплексного радиационно-радиологического исследования. Диагностическая ценность таких исследований заключается в высокой чувствительности данной методики, предоставляющей возможность получать клинические данные, отражающие процессы жизнедеятельности органов и тканей организма пациента в реальном времени на молекулярном уровне. Использование ОФЭКТ в группе пациентов с цереброваскулярной патологией позволяет выявлять наличие структурных изменений и функциональных нарушений головного мозга на стадии минимальных клинических проявлений заболевания. По данным отечественных авторов, перфузионная ОФЭКТ может служить адекватным способом оценки перфузии после выполнения реконструктивных операций на сонных артериях, а также для выявления хирургических осложнений. Благодаря короткому периоду полураспада радионуклидов, небольшой энергии гамма-излучения и быстрому выведению радиофармпрепаратов из организма пациент получает небольшую лучевую нагрузку, которая не выше, а в большинстве случаев даже ниже лучевой нагрузки, получаемой при обычных рентгенологических исследованиях. После проведения сцинтиграфии пациент не представляет опасности для окружающих и может вести обычный образ жизни.
Методы лечения
В данном случае консервативное лечение является малоэффективным, если не сказать, что вовсе неэффективным. Как правило, пациентам выполняется радикальное удаление опухоли, в ряде случаев перед ее выполнением осуществляют рентгенэндоваскулярную эмболизацию параганглиомы, а затем уже приступают к ее непосредственной резекции, так как опухоль является крайне высоко васкуляризированной (обильно кровоснабжаемой). В зависимости от типа ее отношения к сонным артериям существуют два типа оперативного вмешательства – с пластикой артерии, в случае ее интимной спаянности с сонной артерией, и без, когда операция заключается исключительно в удалении самой опухоли. Доступ осуществляется так же, как и при лечения атеросклероза сонных артерий, по переднему краю грудино-ключично сосцевидной мышцы, производят выделение сосудисто-нервного пучка шеи (яремная вена, сонная артерия, внутренняя сонная артерия, наружная сонная артерия, подъязычный нерв, блуждающий нерв, одна из ветвей шейного сплетения - anza cervicalis), а затем производят удаление самой опухоли, в случае плотной спаянности с сонной артерией – выполняют резекцию опухоли с часть артерии, которую в последующем протезируют.
Читайте также:
