ВИЧ-миопатия. Диагностика и лечение вич миопатии.
Добавил пользователь Дмитрий К. Обновлено: 24.01.2026
Идиопатические воспалительные миопатии являются гетерогенной группой заболеваний, среди которых главное место занимают дерматомиозит и полимиозит, традиционно относящиеся к диффузным заболеваниям соединительной ткани. Миопатический синдром разной степени выраженности характерен и для других нозологий этой группы (ревматоидный артрит, системная красная волчанка, склеродермия, синдром Шегрена), что нередко создает трудности в их дифференциальной диагностике. Это актуализирует изучение так называемых «перекрестных сндромов» («overlap-syndroms») в ревматологии. В приведенном клиническом примере мы делаем акцент на ряд особенностей, не вполне укладывающихся в классическую картину идиопатического полимиозита: острое начало заболевания у пациента мужского пола, лихорадка в дебюте, манифестация заболевания в виде симметричного артрита суставов кистей рук и лучезапястных суставов, длительное течение болезни под маской неинфекционного артрита, манифестация легочной симптоматики, произошедшая практически синхронно с миопатическим синдромом, дисфагия и дисфония и положительный стабильный лечебный эффект при использовании невысоких доз глюкокортикостероидов. Все изложенное выше требует наблюдения за пациентом и дифференциальной диагностики с другими болезнями соединительной ткани.
Ключевые слова: дерматомиозит, полимиозит, «overlap-syndroms», идиопатические миопатии.
Для цитирования: Булдакова Ю.Р., Головизнин М.В. К вопросу о дифференциальной диагностике идиопатических воспалительных миопатий. РМЖ. 2016;20:1385-1388.
Differential diagnosis of idiopathic inflammatory myopathies
Buldakova Yu.R., Goloviznin M.V.
A.I. Evdokimov Moscow State University of Medicine and Dentistry
Idiopathic inflammatory myopathies are heterogeneous group of disorders. Among them, dermatomyositis and polymyositis traditionally belonging to connective tissue disorders are of special importance. Myopathy of various severity is typical of other conditions (i.e., rheumatoid arthritis, systemic lupus erythematosus, scleroderma, Sjogren’s syndrome etc.) thus making differential diagnosis more difficult. Considering this, overlap syndromes in rheumatology become relevant. This clinical case highlights a number of features which are beyond classical signs of idiopathic polymyositis, i.e., acute disease onset with fever in a man, disease manifested as symmetric arthritis of wrist and radiocarpal joints, long-term disease course masked with non-infectious arthritis, pulmonary manifestations and myopathy occurred simultaneously, dysphagia and dysphonia, and stable therapeutic effect from low doses of corticosteroids. These aspects require careful follow-up and differential diagnosis with other connective tissue disorders.
Key words: dermatomyositis, polymyositis, overlap syndromes, idiopathic myopathies.
For citation: Buldakova Yu.R., Goloviznin M.V. Differential diagnosis of idiopathic inflammatory myopathies // RMJ. 2016. № 20. P. 1385–1388.
Статья посвящена вопросам дифференциальной диагностике идиопатических воспалительных миопатий
Идиопатические воспалительные миопатии (ИВМ), главное место среди которых занимают дерматомиозит (ДМ) и полимиозит, являются весьма гетерогенной группой заболеваний, относящихся к диффузным болезням соединительной ткани. Классификация D. Hilton-Jones (1998), наряду с ИВМ включает в себя и воспалительные миопатии другой этиологии:
Идиопатические воспалительные миопатии:
– дерматомиозит (М33 дерматополимиозит по МКБ-10);
– полимиозит (М33.2 по МКБ-10);
– миозит с включениями.
Воспалительные миопатии, сочетающиеся с заболеваниями соединительной ткани:
– системная красная волчанка (М32 по МКБ-10);
– склеродермия (М34 по МКБ-10);
– синдром Шегрена (М35.0 по МКБ-10);
– ревматоидный артрит (М05.3 по МКБ-10);
– другие заболевания соединительной ткани.
Инфекционные воспалительные миопатии:
– вирусные (вирус Коксаки, вирус гриппа, ВИЧ, HTLV I);
– паразитарные;
– бактериальные;
– грибковые.
Другие воспалительные миопатии:
– миозит;
– воспалительные миопатии, сочетающиеся с васкулитом;
– гранулематозные (например, при саркоидозе);
– орбитальный миозит;
– макрофагальный миофасциит.
Нозологическая очерченность ИВМ в настоящее время весьма условна. Если вынести за рамки рассмотрения воспалительные миопатии инфекционного генеза, то помимо ДМ и полимиозита в эту группу входят разнообразные «overlap-syndroms», представляющие собой сложные для дифференциальной диагностики случаи, один из которых представлен ниже.
Пациент Х., 1935 г. р., москвич, в прошлом испытатель авиационного оборудования, инвалид 2-й группы с 2000 г. по общему заболеванию (болезнь оперированного желудка, хроническая анемия смешанного генеза). Постоянно проживает с семьей в СЗАО г. Москвы. До 2010 г. подрабатывал – распространял районную газету. Заболел в конце августа 2010 г. Свое заболевание связывает с экологически неблагоприятными условиями – сильным задымлением района проживания летом 2010 г. Впервые обратился к ревматологу в ГП № 79 02.09.2010 г.
Заболевание началось с нарастающего выраженного отека кистей рук, сильных болей в кистях и предплечьях обеих верхних конечностей при движениях и в покое, особенно в лучезапястных суставах, тугоподвижности в суставах кистей, которая ежедневно прогрессировала. Беспокоили также боли при движении в суставах стоп и голеностопных суставах с небольшим отеком в них, а также появление на лице и верхних конечностях папулезных высыпаний с небольшим зудом. Отмечал также усилившиеся в последнее время зябкость в конечностях и побеление кончиков пальцев в холодной воде, которые иногда наблюдались и раньше (в течение нескольких лет).
При первом обращении к ревматологу в суставном статусе: отечность лучезапястных, пястно-фаланговых суставов обеих кистей, межфаланговых суставов II–IV пальцев обеих кистей. Движения резко болезненны, ограниченны в объеме. Конфигурация суставов нижних конечностей не изменена. Поперечное сжатие стоп болезненно. Кожа над голеностопными суставами и на стопах застойного оттенка. Предварительный диагноз: ранний ревматоидный артрит.
Рентгенография суставов кистей: начальные проявления артроза пястно-фаланговых и проксимальных межфаланговых суставов обеих кистей. Лучезапястные суставы интактны. Лабораторные данные: СОЭ, СРБ, РФ, АЦЦП – нормальные показатели. Выявлена гиперурикемия – 0,550 ммоль/л. Рекомендован диклофенак 100 мг/сут, согревающие мази. Несмотря на прием нестероидных противовоспалительных препаратов (НПВП), в течение 1-го мес. болезни болевой синдром сохранялся, а к артриту суставов кистей и лучезапястных суставов присоединилась лихорадка до 39°С с ознобами, потами, потерей аппетита и массы тела. Вновь обратился к ревматологу 21.09.2010 г. и был направлен в Институт ревматологии РАМН с диагнозом: «Ревматоидный артрит, полиартрит, серонегативный вариант». Диклофенак был заменен на нимесулид 0,1 г 2 р./сут.
07.10.2010 г. консультирован в Институте ревматологии РАМН, диагноз раннего ревматоидного артрита не был подтвержден, диагностирован деформирующий остеоартроз с поражением кистей и стоп с явлениями синовита, плечелопаточного периартрита, подтверждена небольшая гиперурикемия. Рекомендованы свечи мелоксикам 15 мг, аллопуринол 100 мг по 1 таблетке 2 р./сут с контролем биохимических показателей через 1 мес., консультация дерматолога для уточнения характера кожных симптомов.
21.10.2010 г. пациенту в связи с выраженным болевым синдромом, скованностью в кистях в течение суток, расстройством сна из-за болей в оба лучезапястных сустава амбулаторно введен бетаметазон 0,5 мл / 0,5 мл на 0,5% прокаине. После внутрисуставного введения глюкокортикостероидов лихорадка прекратилась, отек кистей несколько уменьшился, интенсивность болей в суставах снизилась, на первый план вышли онемение кистей и их тугоподвижность. В связи с развившимся синдромом карпального канала с 2-х сторон 27.10.2010 г. в оба запястных канала введен бетаметазон 0,5 / 0,5 мл на 0,5% прокаине, после чего боли и тугоподвижность в суставах уменьшились. Был назначен курс лазеротерапии на кисти (10 сеансов), не принесший облегчения. В связи с сохраняющимся отеком, скованностью и болевым синдромом во всех суставах и мышцах плечевого пояса 08.11.2010 г. в оба лучезапястных сустава введено 0,5 мл / 0,5 мл триамцинолона. Онемение в кистях стало значительно меньше, стал собирать кисти в кулак на 60%, бóльшую трудность представляло разгибание пальцев обеих кистей. В это же время стали прогрессировать боли в мышцах нижних конечностей (преимущественно в мышцах бедер), боли в стопах и голеностопных суставах при ходьбе. Эффект триамцинолона также оказался непродолжительным, 19.11.2010 г. ревматолог в связи с сильными болями в области правого I пястно-фалангового сустава и в мышцах – разгибателях пальцев кисти преимущественно правого предплечья заподозрила развитие стенозирующего тендовагинита сухожилий мышц – разгибателей пальцев (болезнь де Кервена). Прием НПВП результатов не давал, 24.11.2010 г. в запястный канал и сухожильное влагалище разгибателя 1 пальца правой кисти вновь введено по 0,5 мл бетаметазона.
К исходу 2-го мес. от начала заболевания пациент с трудом самостоятельно ел и передвигался по дому, не мог самостоятельно одеваться. В клиническом анализе крови от 03.11.2010 г. отмечались дальнейшее снижение уровня гемоглобина до 104 г/л, повышение СОЭ до 32 мм/ч. 23.12.2010 г. при УЗИ органов брюшной полости и почек не выявлено никакой патологии, за исключением небольшого диффузного повышения эхогенности ткани поджелудочной железы. Тогда же 23.12.2010 г. в сухожильные влагалища разгибателя 1 пальца обеих кистей было введено 0,5/0,5 мл бетаметазона.
В следующие недели состояние пациента не улучшалось, напротив, боли в мышцах захватили весь плечевой пояс, в кистях и лучезапястных суставах сохранялись отек и тугоподвижность, оставались также боли в мышцах тазового пояса и слабость в них. Прогрессировала общая симптоматика: отсутствие аппетита, нарушение сна, ознобы, слабость. Появились небольшой кашель и одышка, которые пациент принял за простудное заболевание и лечил народными средствами без эффекта в течение 1 мес.
В середине января 2011 г. пациент по собственной инициативе сделал флюорографию, на которой были выявлены изменения, подозрительные на инфильтративный туберкулез легких, в связи с чем был консультирован и взят под наблюдение в противотуберкулезном диспансере № 13.
На фоне респираторных симптомов гемоглобин и лейкоцитарная формула не изменились, а СОЭ выросла до 40–49 мм/ч. С учетом высокой СОЭ в поликлинике было начато обследование по онкопрограмме, а суставной синдром предположительно расценивался как паранеопластический. Однако онкопатология не была подтверждена, больной продолжал находиться под наблюдением фтизиатра, получал курс антибиотикотерапии. В биохимическом анализе крови пробы на СРБ, РФ, АСЛ-О оставались отрицательными, отмечались незначительный рост АСТ (до 48) и снижение содержания кальция до 1,97 ммоль/л.
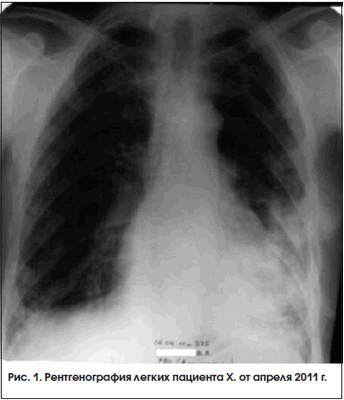
В конце января 2011 г. состояние пациента ухудшилось, прогрессировали мышечные боли и слабость в мышцах, озноб, появился субфебрилитет, сохранялись кашель и одышка, в биохимическом анализе крови было выявлено повышение КФК до 786 ммоль/л, ЛДГ – до 864 ммоль/л. На ЭКГ в начале февраля 2011 г. была отмечена отрицательная динамика, не исключавшая острую коронарную патологию, которая в дальнейшем не была подтверждена. На ЭКГ в этот период были выявлены признаки легочной гипертензии. Внутрисуставное введение ГКС было прекращено, дозы НПВП снижены. В начале марта 2011 г. при повторной рентгенографии тень, подозрительная на инфильтрацию, сохранялась без изменений, и пациент был направлен в туберкулезный стационар. В период с 15.03 по 22.04.2011 г. пациент находится в ПТКБ № 3 им. Захарьина с диагнозом «диссеминация неясного генеза» (рис. 1), там же была проведена операция – открытая биопсия левого легкого. При исследовании полученного материала выявлена неспецифическая пневмония с интраальвеолярным фиброзом. Схема лечения и рекомендации консультированы проф. И.П. Соловьевой. Пациент выписан с диагнозом «интерстициальная пневмония с интраальвеолярным фиброзом».
После выписки из стационара пациент вновь обратился к ревматологу с прежними жалобами на боли в суставах и мышцах как плечевого, так и тазового пояса, скованность в течение всего дня. При осмотре определялась болезненность при активных и пассивных движениях в суставах плечевого и тазового пояса, при пальпации мышц плеча и бедра с обеих сторон. Объем движений в суставах резко снижен из-за болей в мышцах. В начале мая 2011 г. с учетом остававшихся высокими показателей КФК и ЛДГ заподозрена ревматическая полимиалгия. Назначен бетаметазон 26.05.2011 г. 0,5/0,5 мл в плечевые суставы, пиридоксин + тиамин + цианокобаламин + лидокаин 2 мл №10, кетопрофен 0,05 г 3 р./сут после еды, тизанидин 2 мг 2 р./сут. 06.06.2011 г. в анализе крови крови Hb – 105 г/л, СОЭ – 51 мм/ч, КФК – 2411 ммоль/л, ЛДГ – 1598 ммоль/л. Назначен метилпреднизолон 2 табл./сут.
После назначения системных глюкокортикостероидов получен быстрый терапевтический эффект: болевой синдром значительно уменьшился, отечность кистей прошла, объем движений расширился, СОЭ снизилась до 33 мм/ч. Без динамики остались показатели КФК и ЛДГ, сохранялось ограничение движений в плечевых суставах. В то же время у пациента появились начальные проявления дисфагии в отношении жидкой пищи и небольшая осиплость голоса, а также неяркие пятнистые высыпания без зуда на коже голеней и предплечий, о которых он поначалу не считал нужным сообщить врачу. При контроле биохимических показателей в июле – августе 2011 г. СРБ и РФ оставались отрицательными, КФК достигала 2860 ммоль/л, КФК-МВ – 510 Ед/л. Пациент был направлен в ревматологический стационар ГКБ № 52 для уточнения диагноза.
По результатам биопсии кожно-мышечного лоскута с голени от 19.08.2011 г.: кожа покрыта атрофичным многослойным плоским эпителием, дистрофии базальных эпидермоцитов вокруг дермоэпидермального соединения, инфильтрация из лимфоидных и гистиоцитарных элементов. В отдельных мышечных волокнах исчезновение поперечной исчерченности, гиалиноз саркоплазмы с пролиферацией ядер, зернистая дистрофия мышечных волокон. Склероз и атрофия отдельных мышечных волокон. Заключение: изменения не противоречат клиническому диагнозу.
На основании морфологического исследования кожи был установлен диагноз: дерматомиозит, острый период, манифестный период, 3 степень активности, эритематозные папулы Готтрона, мышечная тетраплегия, поражение мышц глотки, дисфагия, поражение легких. Были назначены метотрексат 7,5 мг/нед. и преднизолон 15 мг/сут. В связи с прогрессированием осиплости голоса многократно обследован ЛОР и фониатром, однако связать дисфонию с воспалительным или объемным процессом в гортани не удалось.
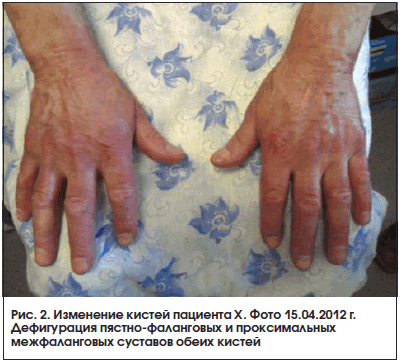
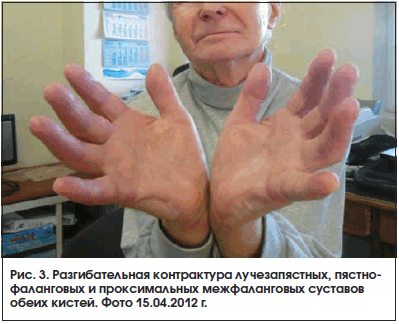
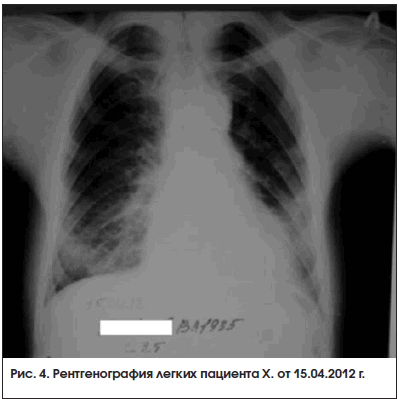
В период после назначения метотрексата и преднизолона до настоящего времени отмечается устойчивая положительная динамика состояния пациента. Он ведет активный образ жизни, исчезли кашель и одышка, нет ознобов и субфебрилитета, значительно уменьшились боли и отек в суставах, расширился объем движений. Несмотря на формирование контрактур в суставах кистей и лучезапястных суставах (рис. 2 и 3), обслуживает себя и выполняет работу по дому. При рентгенографии кистей в апреле 2012 г. суставные поверхности прослеживались, их контур четкий, кистообразной перестройки костной ткани нет. При рентгенографии легких от 15 апреля 2012 г. определялись двусторонний фиброз в нижних отделах легких с обеих сторон, формирование «сотового» легкого (рис. 4). В настоящее время получает метотрексат 10 мг/нед., преднизолон 10,125 мг/сут. Биохимические показатели снизились и составляют: КФК – 426 ммоль/л, КФК-МВ – 64 Ед/л, ЛДГ – 603 ммоль/л, СОЭ – 14 мм/ч.
Таким образом, несмотря на установленный диагноз дерматомиозита, подтвержденный морфологическим исследованием, в приведенном клиническом примере обращает на себя внимание ряд нетипичных особенностей: 1) острое начало заболевания у пациента мужского пола; 2) лихорадка в дебюте и длительное течение болезни под маской неинфекционного артрита; 3) манифестация легочной симптоматики практически синхронно с миопатическим синдромом; 4) дисфагия и дисфония; 5) положительный и стабильный лечебный эффект при использовании невысоких доз глюкокортикостероидов.
Сохранение суставной симптоматики в виде дефигурации мелких суставов кистей, разгибательной контрактуры лучезапястных, пястно-фаланговых и проксимальных межфаланговых суставов, несмотря на минимальные рентгенографические изменения, требует дальнейшего наблюдения за пациентом на предмет выявления ассоциации ДМ с другим заболеванием соединительной ткани – в первую очередь с серонегативным ревматоидным артритом. Дисфагия и «синдром сотового легкого» также требуют дифференциальной диагностики с заболеваниями склеродермической группы.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
ВИЧ-миопатия. Диагностика и лечение вич миопатии.
1. Течение вич миопатии. Миопатия у больных СПИДом может быть следствием токсического воздействия зидовудина (AZT), ВИЧ-полимиозита или в редких случаях обусловлена оппортунистической инфекцией. AZT-миопатия обычно развивается не ранее, чем через полгода лечения этим препаратом и считается результатом токсического поражения митохондрий. Точный патогенез ВИЧ-миопатии неясен. Заболевание может развиться на любой стадии инфекционного процесса.
2. Клиническая картина вич миопатии. Как ВИЧ-, так и AZT-миопатия характеризуется симметричной прогрессирующей проксимальной мышечной слабостью с повышением уровня креатинкиназы в сыворотке крови. Выраженность миалгий варьирует.

3. Диагностика вич миопатии. Диагностика основана на наличии характерных клинических данных и повышении уровня креатинкиназы в сыворотке. На ЭМГ регистрируются характерные для миопатии изменения: укорочение и снижение амплитуды потенциалов двигательной единицы (ПДЕ). Сопутствующая нейропатия нетипична. При биопсии мышц можно увидеть рассеянную дегенерацию мышечных волокон. Характерны патологические изменения митохондрий и включения, например, палочковидные немалиновые тельца. Часто наблюдаются диссеминированные воспалительные инфильтраты.
4. Лечение вич миопатии. Больные, принимающие AZT, должны прекратить лечение при развитии миопатии. Если в течение 1—2 месяцев нет положительной динамики, необходимо провести биопсию мышц. Это следует сделать раньше в случае острого появления сильных миалгий с целью исключения миозита, вызванного оппортунистической инфекцией. Если воспалительные изменения в мышцах появляются у пациента, не принимающего антиретровирусные средства, назначение AZT или другого антиретровирусного средства может вызвать значительное клиническое улучшение.
Если, несмотря на вышеизложенные меры, миозит прогрессирует, необходимо начать кортикостероидную терапию. Можно назначить преднизолон в начальной дозе 40—60 мг/сут. и постепенно снижать дозу или использовать схему приема через день. Однако следует помнить о том, что кортикостероиды повышают риск присоединения оппортунистических инфекций. Можно назначить человеческий иммуноглобулин по такой же схеме, как и при лечении воспалительной демиелинизирующей полинейропатии. Кроме присоединения оппортунистической инфекции к побочным эффектам кортикостероидов относятся гипергликемия, артериальная гипертензия, гиперлипидемия, прибавка массы тела, остеопороз, желудочно-кишечные расстройства.
Также нередко отмечается миопатия, геморрагические осложнения, психоз, эмоциональная лабильность, катаракта и плохое заживление ран.
5. Ожидаемый результат лечения вич миопатии. Большинство больных хорошо реагируют на отмену AZT или, в соответствующих случаях, на назначение антиретровирусной или стероидной терапии. Если вышеперечисленные меры не помогают, необходимо провести биопсию мышц для исключения воспалительного процесса и оппортунистического миозита прежде чем начать лечение кортикостероидами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ВИЧ-миелопатия. Диагностика вич миелопатии. Лечение вич миелопатии.
1. Течение заболевания вич миелопатии. По данным аутопсии миелопатия выявлена у 40% больных, умерших от СПИДа. У половины из них при жизни имели место клинические проявления с преимущественным поражением задних и боковых канатиков грудного отдела спинного мозга. Часто заболевание сопровождается энцефалопатией с медленным постепенным прогрессированием обоих процессов. Специфический возбудитель миелопа-тии не найден, т. к. острой ВИЧ-инфекции обычно не обнаруживается в спинном мозге. Признаком реакции сероконверсии может быть острый миелит, имеющий самоограничивающийся характер, но это нечастое явление.
2. Клиническая картина вич миелопатии. В клинической картине больных ВИЧ-миелопатией отмечается спастический парапарез и сенситивная атаксия. Заболевание развивается на стадии глубокого иммунодефицита и прогрессирует медленно — в течение нескольких месяцев. Выявляемые в спинном мозге изменения можно охарактеризовать как вакуольную миелопатию. Кроме вышеперечисленных признаков, у больных нередко нарушаются функции тазовых органов (преимущественно мочеиспускание), а также отмечается выпадение глубокой чувствительности — вибрационного и суставного-мышечно чувства, что является признаком вовлечения задних канатиков спинного мозга. Примерно 60% больных ВИЧ-миелопатией страдают одновременно ВИЧ-энцефалопатией.

3. Диагностика вич миелопатии. Диагностика ВИЧ-миелопатии основана на данных клинической картины, а также требует исключения других заболеваний, имеющих сходную симптоматику. К таким нарушениям относятся недостаточность витамина В12, сифилис, инфицирование HTLV*I (человеческим Т-лимфотропным вирусом I типа) и вялотекущие оппортунистические инфекции. Данные МРТ могут быть нормальными или отражать атрофические изменения. В ЦСЖ отмечается неспецифическое повышение уровня белка.
4. Лечение вич миелопатии. Не разработано методов лечения, которые бы могли остановить прогрессирование ВИЧ-миелопатии. Поэтому больным рекомендуется активно лечить сопутствующую ВИЧ-энцефалопатию по схеме, приведенной выше. Кроме того, пациентам требуется поддерживающее лечение. Для уменьшения спастичности назначается баклофен в дозе 5—20 мг 3—4 раза в сутки. При нарушениях мочеиспускания (повелительных позывах, неудержании и остаточной моче в пузыре менее 100 мл) показан оксибутинин в дозе 2,5—5,0 мг 3—4 раза в сутки. Больным, сохраняющим способность к самостоятельной ходьбе, требуется приобретение костылей и других вспомогательных средств передвижения. Пациентам с более выраженной слабостью в ногах необходимо кресло-коляска.
К побочным эффектам баклофена относятся желудочно-кишечные расстройства и токсическое поражение печени. При приеме высоких доз препарата может появиться слабость и сонливость. Нельзя резко прекращать прием баклофена, особенно если использовались высокие дозы, иначе существует риск развития синдрома отмены в форме припадков и энцефалопатии. Оксибутинин может вызвать нежелательные антихолинергические побочные эффекты, например, снижение перистальтики кишечника, сухость во рту, боли в животе, тошноту, задержки мочеиспускания и остаточную мочу в пузыре, подавление потоотделения. Реже наблюдается сонливость, делирий, а также тахикардия и расширение сосудов. Те антихолинергические средства, которые вызывают мидриаз, могут повышать внутриглазное давление.
5. Ожидаемый результат лечения вич миелопатии. У большинства больных ВИЧ-миелопатия прогрессирует, несмотря на проводимое лечение. У некоторых, однако, отмечается довольно длительная выживаемость при условии относительной сохранности других органов и систем. Больным требуется постоянное наблюдение невропатолога для назначения требуемой поддерживающей терапии. Острые изменения в состоянии пациента обычно указывают на присоединение оппортунистической инфекции.
Дистальная сенсорная ВИЧ-нейропатия. Диагностика и лечение сенсорной вич нейропатии.
1. Течение сенсорной вич нейропатии. Дистальная сенсорная нейропатия —самый частый тип нейропатии, встречающийся у больных СПИДом. Клиническими формами этого нарушения страдают не менее одной трети больных, а при вскрытии характерные изменения обнаруживают у 100% умерших от СПИДа. Этиология заболевания неизвестна. При биопсии нерва можно увидеть прогрессирующую аксональную дегенерацию с признаками воспаления эндоневрия и эпиневрия.
2. Клиническая картина сенсорной вич нейропатии. Дистальная сенсорная нейропатия характеризуется дистальным симметричным нарушением чувствительности, которое начинается со стоп и постепенно поднимается вверх. Позднее и в меньшей степени вовлекаются дистальные отделы верхних конечностей. Больные жалуются на сильные невралгические боли жгучего или стреляющего характера. Чувствительность в стопах нарушена; отмечаются парестезии в верхних и нижних конечностях.
Неврологический осмотр выявляет нарушение поверхностной (болевой) и глубокой (вибрационной) чувствительности в дистальных отделах конечностей, утрату или снижение ахилловых рефлексов (в меньшей степени и других) и сенситивную атаксию. В мышцах дистальных отделов может отмечаться слабость, которая не столь заметна на фоне выраженных сенсорных нарушений.

3. Диагностика сенсорной вич нейропатии. Дифференциальная диагностика дистальной сенсорной ВИЧ-нейропатии и токсической нейропатии, обусловленной приемом антиретровирусных средств группы дидезоксинуклеозидов, достаточно сложна. Возможно сочетание этих видов нейропатии. Кроме дидезоксинуклеозидов, токсическую нейропатию могут вызвать дапсон, INH и винкристин. У данной группы больных часто отмечается недостаточность витамина В!2. Невралгии могут беспокоить больных с лимфомой и быть следствием непосредственного сдавления нервов или паранеопластического эффекта.
Необходимо исключить алкогольную, диабетическую и другие типы нейропатии, которые по проявлением схожи с ВИЧ-нейропатией. Электрофизиологические исследования позволяют выявить снижение амплитуды и скорости проведения по n. suralis, a также нарушения амплитуды различной степени выраженности в других нервах при относительной сохранности проведений. Электромиография (ЭМГ) обычно указывает на симметричный денервационно-реиннервационный процесс.
4. Лечени сенсорной вич нейропатиие
- Непосредственная борьба с вирусом иммунодефицита не всегда оказывается эффективной в лечении дистальной сенсорной ВИЧ-нейропатии. Другие виды терапии направлены на устранении наиболее тяжелых сенсорных симптомов. Препараты, обладающие потенциальным токсическим воздействием на периферические нервы, должны быть по возможности исключены из схемы лечения больного. Известно, что токсические симптомы могут персистировать на протяжении 6—8 недель после прекращения влияния причинного фактора. Любые метаболические нарушения требуют коррекции.
- Для уменьшения невралгических болей назначается комбинированная терапия противосудорожными средствами, например, карбамазепином или дифенилгидантоином, и трициклическими антидепрессантами, например, амитриптилином. Лечение карбамазепином начинают со 100 мг 3-4 раза в сутки и постепенно дозу увеличивают на 200 мг в неделю, доводя до 800-1200 мг/сут., при условии хорошей переносимости. Дифенилгидантоин — это альтернативный препарат, который назначается больным, не переносящим карбамазепин.
Рекомендуемая дозировка составляет 100 мг 3—4 раза в сутки. Можно попытаться использовать габапентин в дозе 300—600 мг 3 раза в сутки. Прием амитриптилина следует начать с 25 мг на ночь. Постепенно увеличивая дозу на 25 мг в неделю, дозу доводят до 100 мг на ночь. Если вышеуказанные средства неэффективны, применяется мексилетин в дозе 150—300 мг 2 раза в сутки. Он назначается только после отмены противосудорожных средств и трициклических антидепрессантов. Если и этот препарат не снимает боль, приходится прибегать к наркотическим анальгетикам.
К побочным эффектам карбамазепина относятся сонливость, атаксия, желудочно-кишечные расстройства, которые обычно отмечаются при быстром увеличении дозы. Также могут наблюдаться спутанность сознания, нарушение аккомодации, двоение, головные боли, лейкопения и тромбоцитопения. В некоторых случаях отмечается апластическая анемия, нарушения ритма сердца, неадекватная выработка антидиуретического гормона и синдром Стивенса-Джонсона.
Прием дифенилгидантоина может сопровождаться развитием тромбоцитопении, токсического поражения печени, гирсутизма, гиперплазии десен, нистагма. При высоких концентрациях препарата в крови отмечаются атаксия, сонливость и спутанность сознания. Появление кожной сыпи указывает на гиперчувствительность к препарату и требует немедленной отмены из-за риска развития синдрома Стивенса-Джонсона. Более редкими побочными эффектами являются лихорадка, лимфаденопатия, волчаночный или псевдолимфоматозный синдром и инфильтрация легких.
При длительном приеме дифенилгидантоина может развиться остеомаляция и периферическая нейропатия. Побочные эффекты амитриптилина указаны в разд. II.A.4.d. Мексилетин может вызвать токсическое поражение сердечно-сосудистой системы с блокадой проведения, аритмией, артериальной гипотензией и обмороками, а также желудочно-кишечные расстройства, включая изъязвление слизистой, желудочно-кишечное кровотечение и дисфагию. Возможно токсическое поражение печени, и в редких случаях синдром Стивенса-Джонсона.
5. Ожидаемый результат лечения сенсорной вич нейропатии. Симптоматическое лечение улучшает качество жизни больного, но не способствует обратному развитию или остановке прогрессирования симптомов. Острые изменения состояния пациента иногда наблюдаются при активации цитомегаловирусной инфекции. Исключение последней необходимо при появлении соответствующих системных нарушений.
Ревматологические маски инфекции, вызванной вирусом иммунодефицита человека
В XXI в. инфекция, вызванная вирусом иммунодефицита человека (ВИЧ), стала важной медицинской и социальной проблемой. У ВИЧ-инфицированных пациентов развиваются поражения суставов и позвоночника, которые могут имитировать различные ревматические синдромы. Некоторые заболевания чаще развиваются при ВИЧ: ВИЧ-ассоциированный артрит, синдром Рейтера, псориаз, диффузный инфильтративный лимфоцитарный синдром, ВИЧ-ассоциированный полимиозит, другие варианты поражений мягких тканей и инфекции суставов. Артралгия развивается наиболее часто. Псориаз диагностируют у 1/3 больных, обычно на стадии СПИДа. Развитие псориаза является фактором неблагоприятного прогноза, считается предиктором рецидивирующих, угрожающих жизни инфекций (пневмоцистной пневмонии). У ВИЧ-инфицированных нередко развивается злокачественная форма псориатического артрита (ПА), когда на фоне эритродермии и генерализованного пустулезного псориаза возникает полиартрит, доминирующий в клинической картине. При ВИЧ-ассоциированном ПА происходит быстрое прогрессирование суставных проявлений, отмечается корреляция между выраженностью поражения кожи и суставов, часто терапия неэффективна. Достижения в лечении ВИЧ-инфекции позволили обсуждать применение инфликсимаба у больных с резистентными формами псориаза и синдрома Рейтера. Больные с тяжелой атакой псориаза или с псориазом, резистентным к терапии, должны быть обследованы для исключения ВИЧ-инфекции. Дебют полимиозита у взрослых требует исключения не только неоплазии, но и ВИЧ-инфекции.
Ключевые слова: ВИЧ-инфекция, ревматологические маски, суставной синдром, псориаз, болезнь Рейтера, диффузный инфильтративный лимфоцитарный синдром, суставные инфекции.
Для цитирования: Каневская М.З. Ревматологические маски инфекции, вызванной вирусом иммунодефицита человека. РМЖ. 2016;22:1502-1506.
Rheumatic masks of human immunodeficiency virus infection
Kanevskaya M.Z.
I.M. Sechenov First Moscow State Medical University
A.K. Eramishantsev City Clinical Hospital, Moscow
Human immunodeficiency virus (HIV) infection is an important medical and social challenge of the 21st century. Joint and spinal disorders developing in HIV-infected patients mimic various rheumatic syndromes. Some conditions are more common in HIV infection, i.e., HIV-associated arthritis, Reiter syndrome, psoriasis, diffuse infiltrative lymphocytosis syndrome, HIV-associated polymyositis, and other types of soft tissue disorders and joint infections. Arthralgia is the most common symptom. One-third of these patients (usually with AIDS) are diagnosed with psoriasis which is considered a factor of unfavorable outcome and a predictor of recurrent life-threatening infections (pneumocystis pneumonia). HIV-infected patients also suffer from severe psoriatic arthritis characterized by erythroderma, generalized pustular psoriasis, and polyarthritis (dominant clinical manifestation). HIV-associated psoriatic arthritis is characterized by rapid progression of joint manifestations and the correlation between skin lesions and joint damage and ineffective therapy as well. Progress in HIV treatment allows to prescribe infliximab for resistant psoriasis and Reiter syndrome. Patients with severe or resistant psoriasis should be tested for HIV. Patients with the debut of polymyositis should be examined for neoplasms and tested for HIV to exclude these conditions.
Key words: HIV infection, rheumatic masks, arthropathy, psoriasis, Reiter syndrome, diffuse infiltrative lymphocytosis syndrome, joint infections.
For citation: Kanevskaya M.Z. Rheumatic masks of human immunodeficiency virus infection // RMJ. 2016. № 22. P. 1502–1506.
В статье представлены ревматологические маски инфекции, вызванной вирусом иммунодефицита человека
Клинические проявления
Заключение
Предполагать обусловленность суставных и прочих ревматических синдромов ВИЧ-инфекцией необходимо прежде всего у пациентов из групп риска. Следует учитывать клинико-анамнестические и иногда лабораторные особенности, присущие ВИЧ-ассоциированным ревматическим синдромам и отличающие их от истинных ревматических заболеваний, такие как:
— тяжелый резистентный псориаз / ПА,
— недифференцированная и перекрестные спондилоартропатии,
— все случаи синдрома Рейтера, реактивных артритов,
— синдром Шегрена / ДИЛС с вовлечением внутренних органов и описанными серологическими особенностями,
— острый дебют РА-подобного серонегативного полиартрита у мужчин,
— внезапные ремиссии РА,
— отсутствие эффекта или ухудшение суставных симптомов при применении метотрексата, системной ГК-терапии,
— фибромиалгия,
— упорные артралгии,
— некоторые васкулиты (узелковый полиартериит, синдром Чарджа — Стросса, геморрагический, гиперсенситивный васкулиты, изолированный васкулит ЦНС).
Рутинные лабораторные исследования мало помогают при интерпретации ревматических синдромов: неспецифично увеличение СОЭ и содержания С-реактивного белка, часто выявляются HLA-B27, разнообразные антитела (особенно антинуклеарные, антикардиолипиновые) и циркулирующие иммунные комплексы. Кроме того, изменения общеклинических и биохимических показателей зависят также от стадии ВИЧ-инфекции, наличия и характера осложнений и сопутствующих заболеваний: например, вначале возможен лейкоцитоз крови со сдвигом формулы влево, а на стадии СПИДа возникает панцитопения. Наиболее важна серологическая диагностика ВИЧ-инфекции — выявление ее специфических маркеров.
Существует перечень клинических показаний, при которых пациенты подлежат рекомендованному медицинскому освидетельствованию на выявление заражения ВИЧ. Обследование проводится с согласия пациента или его законного представителя (для несовершеннолетних, нетрудоспособных). В этот перечень входят лихорадка неясного генеза, генерализованная лимфаденопатия, случаи выраженного похудения, длительных и рецидивирующих бактериальных инфекций и паразитарных инвазий, хронических воспалительных заболеваний женской половой сферы, случаи установленного туберкулеза, гепатитов В и С, ряда герпесвирусных, грибковых и паразитарных заболеваний, болезней крови и ряда лимфопролиферативных заболеваний, частых гемотрансфузий, случаи заболеваний, передающихся половым путем, а также наркомания, токсикомания, гомо- и бисексуальная активность, проституция. РЗ и синдромы в этом перечне не значатся, тем не менее знание описанных выше клинических особенностей поможет врачу предположить именно ВИЧ-инфекцию в качестве их истинной причины.
Читайте также:
- Височная кость и венозные пазухи. Взаимоотношения головного мозга и височной кости
- Косоглазие при параличе четвертого (IV) черепного нерва. Двусторонний паралич поднимателей и синдром Дуэйна
- Поражение сетчатки и сосудов глаза свинцом
- Влияние линдана, лития на плод и беременность
- Миотоническая дистрофия. Причины и признаки миотонической дистрофии.
