Вирилизация
Добавил пользователь Skiper Обновлено: 27.01.2026
Нюансы определения пола при адреногенитальном синдроме
По данным неонатальных скрининговых программ разных стран, популяционная распространенность сольтеряющей формы адреногенитального синдрома (АГС), когда вырабатывается избыток андрогенов, но мало глюкокортикоидов и минералокортикоидов, варьирует от 1 на 10 000 до 1 на 15 000 детей
Адреногенитальный синдром
По данным неонатальных скрининговых программ разных стран, популяционная распространенность сольтеряющей формы адреногенитального синдрома (АГС), когда вырабатывается избыток андрогенов, но мало глюкокортикоидов и минералокортикоидов, варьирует от 1 на 10 000 до 1 на 15 000 детей.
Высокая распространенность АГС, серьезные медицинские и социально-экономические последствия несвоевременной диагностики, наличие специфического лабораторного маркера — 17-ОНП (17-гидрокси-прогестерона) — обусловили внедрение массового неонатального скрининга во многих странах, в т. ч. в США, Франции, Германии, Италии, Швейцарии, Японии, Швеции, Индии и др. Он позволяет раньше выявить болезнь, правильно определить половую принадлежность ребенка и зарегистрировать паспортный пол, предотвратить развитие острого надпочечникового криза и летальность. Скрининг — единственно возможный метод доклинической диагностики вириальной формы болезни; в Беларуси он еще не используется.
Задача врача — установить пол, не ограничиваясь беглым осмотром; предупредить психологические проблемы и дополнительные терапевтические вмешательства, связанные с необходимостью перемены пола и выраженной низкорослостью пациента; исключить неоправданное назначение глюкокортикоидов.
Адреногенитальный синдром — это группа наследственных заболеваний с аутосомно-рецессивным типом наследования, имеющих клинические и метаболические проявления. В основе нарушений — дефекты ферментов, участвующих в биосинтезе гормона надпочечников — кортизола. Наиболее распространенная форма АГС (90–95% случаев) — дефицит фермента 21-гидроксилазы (21-ГД), который участвует в промежуточном этапе биосинтеза кортикостероидов. Из-за дефицита этого фермента надпочечники недостаточно вырабатывают кортизол и альдостерон. В крови больного значительно увеличивается уровень стероидов и андрогенов. Стабильное повышение концентрации последних отмечается у плода с 7-й недели беременности. У девочек наблюдается внутриутробная вирилизация (появление вторичных половых признаков по мужскому типу), у мальчиков — клиническая картина ложного преждевременного полового развития.
При рождении у девочек отмечается гипертрофия клитора, сращение мошоночного шва, формирование урогенитального синуса. В редких случаях внутриутробная андрогенизация выражена настолько, что наружные половые органы ребенка имеют полностью мужское строение (ложный женский гермафродитизм). При УЗИ органов малого таза видны внутренние гениталии (матка, фаллопиевы трубы и яичники).
Для исключения ложного женского гермафродитизма все новорожденные с фенотипическим мужским полом и не пальпируемыми в мошонке и по ходу паховых каналов яичками, а также дети, у которых бисексуальное строение гениталий, должны обследоваться с обязательным кариотипированием. Кариотип 46ХХ при гермафродитных наружных половых органах, высокий для данного срока гестации и массы тела ребенка уровень 17-ОНП, наличие матки при УЗИ с 95% вероятностью свидетельствуют об АГС у девочек.
Повышенный уровень надпочечниковых андрогенов у мальчиков внутриутробно не имеет принципиального значения, т. к. яички начиная с 1–2-го триместра беременности активно вырабатывают тестостерон. При рождении наружные половые органы сформированы правильно, соответственно мужскому типу. Часто наблюдается пигментация мошонки и сосков.
С возрастом избыток андрогенов надпочечников приводит к увеличению размеров клитора у девочек или полового члена у мальчиков, появлению оволосения с 2–3 лет, кратковременному ускорению физического развития (до 9–10 лет), быстрому закрытию зон роста и выраженной низкорослости ребенка. Окончательный рост пациентов с адреногенитальным синдромом ниже генетического на 1–2 стандартных отклонения.
При полной потере активности фермента 21-ГД в периоде новорожденности наблюдается недостаточность минералокортикоидов, развивается тяжелая сольтеряющая форма заболевания. Она проявляется кризом. На 2–3-й неделе жизни у ребенка появляются неспецифические симптомы: вялое сосание, частые срыгивания и рвота, диарея, потеря массы тела. Нарастание электролитного дисбаланса приводит к развитию гипонатриемической дегидратации, гиперкалиемии, метаболическому ацидозу и кардиогенному шоку. Эти клинико-биохимические нарушения бывают при многих состояниях периода новорожденности и связаны с гастроинтестинальными (гастроэнтерит, пилоростеноз) и ренальными (острый пиелонефрит, почечная дисплазия) потерями, патологией надпочечников (врожденными гипоплазией, псевдо- и гипоальдостеронизмом).
Неправильная или поздняя диагностика адреногенитального синдрома (АГС), отсутствие адекватной заместительной гормональной терапии приводят к гибели ребенка в неонатальном периоде.
Для лабораторной диагностики этой формы АГС есть надежный патогенетический маркер — уровень 17-ОНП в крови. Определение повышенных концентраций биохимического показателя у новорожденных помогает выявить заболевание до начала клинической манифестации. Исходный уровень 17-ОНП примерно в 100 раз превышает нормальные показатели для возраста и массы тела ребенка.+
У недоношенных и детей с родовыми травмами (или рожденных с низким весом) при нормальных сроках гестации концентрации 17-ОНП могут быть повышенными и при отсутствии дефицита этого фермента. В таких случаях рекомендуется повторное определение гормонального показателя через 5–7 дней. Снижение уровней 17-ОНП в динамике позволяет исключить 21-гидроксилазную недостаточность.
Раннее выявление гормональных нарушений, характерных для адреногенитального синдрома, делает обязательным обследование всех новорожденных с гермафродитными гениталиями и мальчиков с синдромом потери соли. У последних отправные моменты диагностического поиска — отсутствие увеличения массы тела, клинические и лабораторные признаки (гипонатриемия, гиперкалиемия, метаболический ацидоз) сольтеряющего компонента. Изолированная вирильная форма заболевания у мальчиков диагностируется только к 4–5 годам при манифестации признаков преждевременного полового развития.
Мы провели анализ своевременности установления диагноза у вновь выявленных больных с адреногенитальном синдромом, находившихся на лечении в Республиканском детском эндокринологическом центре (на базе 2-й ГДКБ Минска) в 2006–2009 гг. Оказалось, что сроки диагностики сольтеряющей формы адреногенитального синдрома для девочек составили 8,6±0,4 дня, для мальчиков — 26,7±17,9 дня. Во всех случаях диагноз ставился на фоне развивающегося сольтеряющего криза при уровнях калия 7,8±1,6 ммоль/л, натрия — 128,6±0,9 ммоль/л и декомпенсированном метаболическом ацидозе.
Вирильная форма заболевания определялась поздно: у девочек в возрасте 1,2±0,1 года, у мальчиков — 6,0±0,1 года. У 50–60% мальчиков она вообще не выявляется. Так, в группе детей с вирильным вариантом заболевания девочки составили 82%, мальчики — 18% (согласно аутосомно-рецессивному типу наследования АГС, их число должно быть почти равным). Результаты нашего исследования совпадают с литературными данными. Неонатальный скрининг на адреногенитальный синдром целесообразно внедрить в Беларуси.
Основной метод терапии классической формы адреногенитального синдрома основан на применении глюкокортикоидов, подавляющих гиперсекрецию кортикотропин-рилизинг гормона и АКТГ и нормализующих выработку андрогенов надпочечниками. Цель лечения — в замещении дефицита стероидов, секреция которых снижена из-за ферментативного дефекта, в оптимизации роста пациентов, обеспечении нормального полового созревания и потенциальной фертильности.
Препаратом выбора при терапии адреногенитального синдрома у детей с открытыми зонами роста является гидрокортизон. Обычно у новорожденных лечение начинают с массивной стартовой дозы 50–100 мг внутривенно (до 400 мг/м2 в сутки), что отражает высокую скорость секреции кортизола в этом возрасте. Но следует избегать длительного применения у ребенка ввиду негативного влияния на процессы роста. При переводе больного на таблетированный препарат суточная доза снижается до 15–20 мг/м2. Адекватная заместительная терапия глюкокортикоидами нормализует гормональные показатели за несколько недель.
Ребенку старше 2 лет гидрокортизон назначается из расчета 10–15 мг/м2 в сутки. Препарат дается 3 раза в день в равных частях или в пропорции 0,25:0,25:0,5. У пациентов с зонами роста, близкими к закрытию, применяют глюкокортикоиды длительного действия с более выраженным АКТГ-подавляющим эффектом (преднизолон или дексаметазон). Доза преднизолона составляет 2–4 мг/м2 в сутки, при этом 1/3 ее назначается утром, 2/3 — перед сном. Суточное количество дексаметазона (0,25–0,35 мг/м2) дается однократно в вечерние часы. Ранее популярный при заместительной терапии АГС кортизона ацетат проявляет активность только после конверсии в активный кортизол под действием печеночного фермента 11ß-гидроксистероиддегидрогеназы. В некоторых случаях этот механизм может иметь функциональный или частичный дефект, особенно в первые месяцы постнатальной жизни ребенка, или большую индивидуальную вариабельность. В связи с этим применение кортизона ацетата при лечении больных с дефицитом 21-гидроксилазы нежелательно.
Коррекция дозы глюкокортикоидов проводится под контролем сывороточных концентраций 17-OHП. У мальчиков в периоде допубертата и женщин дополнительно исследуют уровни тестостерона. Гормональные показатели определяют в соответствии с режимом назначения медикаментов, предпочтительно в 8 часов утра с учетом физиологического пика секреции АКТГ или на самом низком уровне кортизона в крови — непосредственно перед вечерним приемом глюкокортикоидов. Наблюдение больных с дефицитом 21-гидроксилазы должно включать обязательный ежегодный анализ динамики роста и контроль костного возраста.
Высокие дозы глюкокортикоидов, особенно в раннем возрасте, могут быть причиной снижения роста ребенка, развития ожирения, повышения артериального давления или других проявлений синдрома Кушинга.
Всем пациентам с классической сольтеряющей формой АГС после установления диагноза наряду с глюкокортикоидами назначается флюдрокортизона ацетат. Суточная доза для детей первого года жизни — 0,05–0,3 мг в зависимости от уровня электролитов. У старших ребятишек потребность в минералокортикоидах снижается до 0,05–0,15 мг в сутки с последующей отменой. Необходимость в препарате у ребенка определяется на основании оценки уровней ренина плазмы и артериального давления.
Из клинических наблюдений известно, что в пубертатный период у детей с АГС не удается достичь компенсации заболевания, несмотря на рекомендуемую оптимальную дозу глюкокортикоидных препаратов. Традиционно этот факт объяснялся психосоциальными причинами, характерными для подросткового возраста: отрицанием авторитетов, увеличением степени собственной свободы и независимости, снижением контроля со стороны родителей за приемом лекарств, нарушением режима введения и дозы глюкокортикоидов вплоть до полного прекращения заместительной терапии.
Но существенная причина — в изменении фармакокинетики кортизола в периоде пубертата: увеличение клиренса и укорочение периода жизни под влиянием повышения ростовых факторов, половых гормонов (эстрадиола). Изменение распределения кортизола в организме ведет к гипокортизолемии при неизменной дозе глюкокортикоидов.
У больных с адреногенитальным синдромом в периоде пубертата есть риск передозировки глюкокортикоидов из-за развития выраженной инсулинорезистентности смешанного генеза (физиологической и на фоне избыточной массы тела), что диктует увеличение кратности приема гидрокортизона при неизменной суточной дозе препарата.
Случай из практики
Девочка Е. от 2-й доношенной беременности, вес при рождении 3 370 г, рост 53 см. Выписана на 5-е сутки из роддома в удовлетворительном состоянии. Со слов матери, дома буквально на следующий день появились срыгивания после каждого кормления, вялое сосание, учащенный стул. Обратились в приемное отделение 2-й ГДКБ Минска, когда ребенку было 15 дней. При осмотре: состояние тяжелое, обусловленное дегидратацией; кожные покровы и слизистые сухие; гиперпигментация сосков. Потеря массы тела с момента рождения — 670 г. Наружные гениталии имели бисексуальное строение: отмечалось сращение больших половых губ, гипертрофия клитора с формированием головки, синус урогениталис. При лабораторном обследовании выявлены гиперкалиемия (калий — 7,06 ммоль/л), гипонатриемия (122,9 ммоль/л), гипохлоремия (91,8 ммоль/л), гипогликемия (2,8 ммоль/л). Показатели кислотно-основного состояния в норме. Уровень 17-ОНП повышен — 18 нг/мл (норма до 3,0). На основании данных обследования поставлен диагноз: адреногенитальный синдром, сольтеряющая форма, состояние клинико-метаболической декомпенсации, гипотрофия 2-й степени. Назначена заместительная терапия препаратами глюкокортикоидного ряда и минералокортикоидами.
Анжелика Солнцева, доцент 1-й кафедры детских болезней БГМУ, главный внештатный детский эндокринолог Минздрава
Медицинский вестник, 10 февраля 2011
Вирилизация
Вирилиза́ция (лат. virilis — мужской, свойственный мужчине) маскулиниза́ция или вири́льный синдро́м — симптомокомплекс, характеризующийся появлением мужских черт (тип телосложения, оволоcение, тембр голоса и других) у женщин в результате активации андрогенов — мужских половых гормонов (андрогениза́ция). Тем не менее, данный термин употребляют и при характеристике изменений, наступающих у мужчин [1] .
Неполная вирилизация при внутриутробном развитии может стать причиной гипоспадии.
Для активно занимающихся плаванием девочек в пубертатный период характерны широкие плечи.
Содержание
Нормальная вирилизация
Включает в себя обычные процессы полового созревания мальчиков, при которых тестостерон меняет тело: растёт пенис, скелет, мышечная масса, развиваются лобковые волосы, меняется голос, увеличивается челюсть, раздаются плечи.
См. также
Примечания
- ↑ Малая энциклопедия врача-эндокринолога / Ефимов А. С. — 1-е изд. — К. : Медкнига, ДСГ Лтд, Киев, 2007. — С. 55. — 360 с. — («Библиотечка практикующего врача»). — 5000 экз. — ISBN 966-7013-23-5
Ссылки
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Добавить иллюстрации.
- Половой диморфизм
- Эндокринные заболевания
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Вирилизация" в других словарях:
вирилизация — сущ., кол во синонимов: 1 • вирильность (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
вирилизация — (лат. virilis мужской, свойственный мужчине; син.: андрогенизация, маскулинизация) появление мужских черт у женщины, вызванное действием андрогенов … Большой медицинский словарь
вирилизация — (син. маскулинизация) появление мужских черт у женщин под действием андрогенов. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
вирилизация — вирильность появление мужских черт (тип телосложения, оволосения, тембр голоса и др.) у женщин под влиянием андрогенов (Источник: Краткий словарь сексопатологических терминов) … Сексологическая энциклопедия
вирилизация — вирилизация, вирилизации, вирилизации, вирилизаций, вирилизации, вирилизациям, вирилизацию, вирилизации, вирилизацией, вирилизациею, вирилизациями, вирилизации, вирилизациях (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Вирилизация — (лат. viris – мужской, свойственный мужчине). Проявление у женщины мужских черт. Наблюдается вследствие влияния андрогенных гормонов – при лечении гормональными препаратами, при опухолях надпочечников. Син.: маскулинизация … Толковый словарь психиатрических терминов
Вирилизация — Появление у женщин мужских черт под влиянием избытка андрогенов. * * * то же, что Андрогенизация … Энциклопедический словарь по психологии и педагогике
ВИРИЛИЗАЦИЯ — (virilwtion) проявление избыточного образования андрогена (гиперандрогенизма) в организме женщины. При этом у женщины отмечается выпадение волос на коже височных областей, увеличение мышечной массы и клитора, развитие гирсутизма; голос становится … Толковый словарь по медицине
Вирилизация (Virilwtion) — проявление избыточного образования андрогена (гиперандрогенизма) в организме женщины. При этом у женщины отмечается выпадение волос на коже височных областей, увеличение мышечной массы и клитора, развитие гирсутизма; голос становится более грубым … Медицинские термины
Вирильность, Вирилизация — появление мужских черт (тип телосложения, оволосения, тембр голоса и др.) у женщин под влиянием андрогенов. (Источник: Сексологический словарь) … Сексологическая энциклопедия
Вирилизация
Преднизолон 8,75 мг/сут; Флудрокортизон 50 мкг/сут
Коплексное уродинамическое исследование
Мочеиспускание от 5 до 11 раз в день, порциями по 150—200 мл. Ежедневно отмечает императивные позывы на мочеиспускание, подтекание мочи 1 раз в неделю, в том числе ночью, порциями 20—30 мл. При исследовании нормосенсорный, нормоконтактный мочевой пузырь с увеличением уретрального давления до 114 мм вод. ст., увеличением функциональной длины уретры до 10 см и необструктивным типом мочеиспускания
Мочеиспускание от 3 до 4 раз в день, порциями по 200—350 мл без императивных позывов и недержания мочи. При исследовании гиперсенсорный, нормоконтактный мочевой пузырь с увеличением уретрального давления до 320 мм вод. ст., увеличением функциональной длины уретры до 11 см и необструктивным типом мочеиспускания
Пациентка 2. Диагноз ВДКН заподозрен при рождении в связи с вирилизацией НПО по Prader IV степени. Однако дополнительное обследование не проведено. В течение 1-го месяца в связи с обильными срыгиваниями с 15-го дня жизни потеря массы тела составила 800 г. Девочка госпитализирована в стационар в возрасте 1 мес в тяжелом состоянии с признаками эксикоза. При обследовании выявлен нормальный женский кариотип 46,XX, определены повышенные значения 17-ОНП — 500 нмоль/л, ренина — 238 мЕд/л, гиперкалиемия и гипонатриемия. На основании результатов проведенного обследования установлен диагноз «ВДКН, дефицит 21-гидроксилазы, сольтеряющая форма» и назначена заместительная гормональная терапия минерало- и глюкокортикоидами, с положительным эффектом. Диагноз подтвержден молекулярно-генетическим исследованием: выявлена гомозиготная мутация 12spl в гене CYP 21, характерная для сольтеряющей формы заболевания. В возрасте 5 лет проведен первый этап феминизирующей пластики (клиторопластика, синусотомия). До 13 лет жизни отмечалось относительно стабильное течение заболевания. Однако в 13 лет девочка самостоятельно прекратила прием препаратов на 4 мес. В течение следующих 1,5 лет, несмотря на постоянную коррекцию проводимой терапии, не удалось добиться компенсации заболевания. Показатели гормонов в периоды декомпенсации представлены в табл. 1. На момент поступления в стационар в возрасте 16 лет: рост 165,4 см (SDS роста 0,47), масса тела 58 кг, телосложение гиперстеническое, маскулинное, голос низкий, хорошо выраженная мышечная система, половое развитие по Таннер (В3, P 4), менструации отсутствуют. Данные статуса НПО, лабораторных исследований и получаемая терапия при поступлении в стационар указаны в табл. 2.
С целью определения объема и тактики оперативного лечения в обоих случаях проведено магнитно-резонансное томографическое (МРТ) исследование органов малого таза без контрастирования в режимах Т1, Т2, DW, выполненное на оборудовании Optima MR450w №415449 («GE Healthcare», США). В области уретры, проксимальнее уретровагинального конфлюенса выявлена ткань ПЖ, имеющая небольшой объем и отсутствие зональной дифференцировки. На МР-изображениях ткань ПЖ располагается типично для мужской ПЖ в парауретральной области, за лобковым симфизом, книзу от мочевого пузыря, эллипсоидной формы, представлена преимущественно железистой тканью периферической зоны, однородной структуры с гиперинтенсивным гомогенным сигналом в режиме Т2-ВИ и изоинтенсивным сигналом в режиме Т1-ВИ (рис. 1, 2). Комплексное уродинамическое исследование (КУДИ) не выявило признаков инфравезикальной обструкции (см. табл. 2). При цистоуретровагиноскопии, проведенной непосредственно перед операцией, выявлены высокий уретровагинальный конфлюенс и признаки гранулярного цистита в области треугольника Льетто у обеих девочек. Особенностью патологического строения мочеполовых путей у пациентки 2 явилось резкое сужение входа во влагалище. Последний открывался отверстием диаметром 0,3 см, окруженным складкой слизистой (гименальным кольцом) над уровнем тазовой диафрагмы. Показания к проведению второго этапа феминизации у пациентки 1 обоснованы в связи с наступлением первой менструации и достаточной эстрогенизацией гениталий [3]. Пациентка 2 не достигла менархе. С учетом эндоскопической находки в виде резкого сужения входа во влагалище и риска развития клиники гематокольпос и гематометра при наступлении менархе в будущем вследствие нарушения оттока менструальных выделений принято решение о проведении второго этапа феминизации. Пациенткам проведена разобщающая мочевые и половые пути интроитопластика. Выполнена полная мобилизация общего мочеполового канала (ОМК) с формированием передней стенки искусственного входа во влагалище (ИВВ) слизистым лоскутом в модификации Passorini—Glasel. Задняя стенка ИВВ сформирована с помощью омега-образного кожного лоскута промежности. Неоуретра и неомеатус сформированы из участка ОМК. Пациентки выписаны из стационара в удовлетворительном состоянии на 9-е и 11-е сутки после операции. Рекомендовано следующее: гормональная терапия, получаемая пациентками на момент поступления (см. табл. 2); ежеквартальный контроль уровней 17-ОНП, тестостерона, АКТГ и ренина плазмы крови для оценки компенсации глюкокортикоидной и минералокортикоидной недостаточности; наблюдение гинеколога; контрольная МРТ малого таза; уродинамическое исследование через 6—12 мес для оценки результата операции и динамики роста ПЖ; ежегодный контроль уровня простатического специфического антигена (ПСА) и повторная МРТ в случае его увеличения.
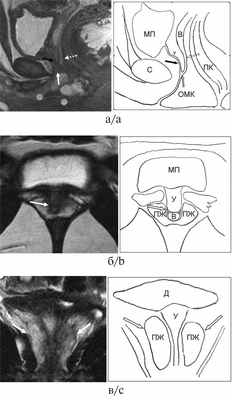
Рис. 1. Серия МРТ малого таза в режиме Т2-ВИ со скицами пациентки 1, 17 лет, с диагнозом «ВДКН, сольтеряющая форма».
а — сагиттальная плоскость; б — аксиальная плоскость; в — фронтальная плоскость. На изображениях визуализируются уретра (черная стрелка), влагалище (белая пунктирная стрелка) с наличием в просвете небольшого количества жидкости. Уретровагинальный конфлюенс (белая стрелка) определяется на уровне средней трети симфиза. Круглыми МРТ метками на рис. а обозначены наружное отверстие общего мочеполового канала, расположенное ближе к симфизу, и проекция входа во влагалище, расположенного ближе к прямой кишке. Визуализируется ткань предстательной железы (головки черных стрелок), эллипсоидной формы, без четкой зональной дифференцировки, размерами 34×15×32 мм (объем 8,4 см 3 ) без видимых очаговых изменений в структуре. МП — мочевой пузырь, С — симфиз, У — уретра, В — влагалище, ОМК — общий мочеполовой канал, ПК — прямая кишка, ПЖ — предстательная железа, Д — детрузор мочевого пузыря.
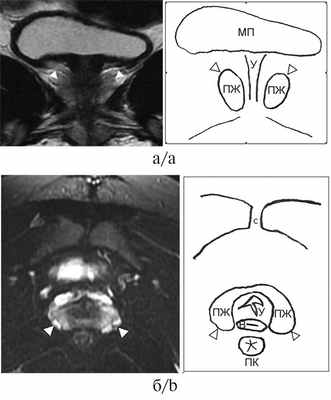
Рис. 2. Серия МРТ малого таза со скицами пациентки 2, 16 лет, с диагнозом «ВДКН, сольтеряющая форма».
а — корональная плоскость в режиме Т2-ВИ; б — аксиальная плоскость в режиме Т2-ВИ с подавлением сигнала от жировой ткани. Визуализируется ткань предстательной железы (белые головки стрелок), эллипсоидной формы, без четкой зональной дифференцировки, размерами 30×14×21 мм (объем 4,6 см 3 ). Структура предстательной железы представлена преимущественно железистой тканью периферической зоны, однородной структуры с гиперинтенсивным гомогенным сигналом без видимых очаговых изменений. МП — мочевой пузырь, С — симфиз, У — уретра, В — влагалище, ПК — прямая кишка, ПЖ — предстательная железа.
R. de Graaf, голландский физиолог и гистолог, впервые описал структуру и функцию парауретрального органа и присвоил ему термин «женская простата» в 1672 г. [4]. Спустя примерно 200 лет в 1880 г. американский гинеколог A. Skene описал женскую простату, состоящую из двух основных парауретральных протоков, открывающихся с обеих сторон уретрального отверстия [5]. Многочисленные исследования этого органа женской мочеполовой системы проведены в последующем. S. Tepper и соавт. в 1984 г. доказали с помощью гистохимического исследования гомологичную природу женских парауретральных желез (ПУЖ) и ПЖ [6]. M. Zaviacic и R. Ablin в 2000 г. в обзорной статье представили дополнительные доказательства идентичности ПУЖ и мужской простаты на клеточном и ферментативном уровнях [7]. Авторы, опираясь на исторические факты и собственные данные исследований, предложили утвердить термин «женская простата» для использования в литературе. Эмбриологические исследования, проведенные за длительный период, начиная с середины XX века, также подтвердили сходство ПЖ и ПУЖ. Эмбриологическая закладка желез начинается на 10—11-й неделе внутриутробного периода. На вентральной поверхности урогенитального синуса, который присутствует у эмбрионов обоих полов, появляются несколько рядов солидных выростов в окружающую мезенхиму. Под воздействием андрогенов, вырабатываемых яичками мужского плода, постепенно количество выростов увеличивается. Достигнув определенной глубины, выросты ветвятся и канализируются, приобретают железистый и мышечный компонент, создавая группы, соответствующие долям ПЖ. У женского плода ПУЖ приобретают типичное для них строение в виде нескольких протоков с железистой тканью [8, 9].
Закладка коры надпочечников происходит на 11-й неделе. В течение этого периода у женского плода с ВДКН избыток надпочечниковых андрогенов стимулирует вирилизацию НПО и, что подтверждено опытами на животных, рост ПУЖ [8]. У некоторых девочек с ВДКН при МРТ исследовании визуализируют ПЖ [10]. Как трактовать эти находки? Как ПЖ или как гипертрофированные ПУЖ? Ответ на этот вопрос остается неясным.
Если эмбриогенез и рост ПЖ/ПУЖ очевиден, почему она выявляется не у всех девочек с ВДКН? Этот вопрос также остается без ответа. Однако гипотеза об андрогензависимости этого органа у девочек с ВДКН упоминается в двух проспективных исследованиях. M. da C. Paulino и соавт. в 2009 г. в группе из 36 пациенток с ВДКН на фоне искусственно созданной гиперандрогении выявили ткань ПЖ у 15,6% [10]. Напротив, исследование P. Doherty и соавт., нацеленное на поиск ткани ПЖ, не выявило ее [11]. Однако малая выборка (всего 11 пациенток) и их однородный контингент (только женщины кавказского происхождения) делают данное исследование малоинформативным.
Благодаря своей способности к многоплоскостной визуализации и превосходному контрасту мягких тканей МРТ является наиболее чувствительным методом обнаружения доброкачественной и злокачественной патологии уретры. Нормально развитая ткань ПУЖ не визуализируется на МРТ [12]. Увеличение ее размера >5 мм может быть зафиксировано и трактоваться как ПЖ в связи с известной формой, структурой и положением, описанными у пациентов мужского пола. В наших случаях у пациенток с ВДКН ПЖ на МР изображениях имела характерную форму, локализацию и структуру объемом 8,4 и 4,6 см 3 . При этом выявленная железа не влияла на опорожнение мочевого пузыря. Данные КУДИ не выявили нарушения уродинамики нижних мочевых путей, что свидетельствовало об отсутствии патологического роста ПЖ.
В доступных источниках литературы мы не обнаружили рекомендации по ведению пациенток с ВДКН и ПЖ. Учитывая, что в литературе описаны 4 случая аденокарциномы простаты в возрасте от 60 до 88 лет [13—16] и 1 случай доброкачественной гиперплазии ПЖ в возрасте 60 лет [17], мы считаем необходимым наблюдение данной категории пациенток с целью своевременной коррекции терапии.
Заключение
Наличие ПЖ у девочек с кариотипом 46,XX и ВДКН является редким вариантом патологического развития мочеполовых путей. С учетом риска возникновения аденокарциномы и доброкачественной гиперплазии ПЖ таким пациенткам вместе с контролем компенсации заболевания следует проводить ежегодный контроль уровня простатического специфического антигена и в случае его увеличения — МРТ органов малого таза. Нет четких данных, которые позволили бы однозначно трактовать находки на МРТ у данного контингента пациенток — ПЖ это или гипертрофированные ПУЖ. Нет достаточных доказательств причины гипертрофии ПУЖ. Данные литературы указывают на гиперандрогению как причину увеличения ПУЖ, но есть и противоположные точки зрения. Непонятно, почему усиленная выработка андрогенов, обусловливающая вирилизацию наружных половых органов, характерная для врожденной дисфункции коры надпочечников, не приводит к увеличению ПУЖ у всех больных этой группы. Не разработаны рекомендации по ведению данных пациенток. Поскольку четко не разработаны аспекты, связанные с причинами развития ПЖ у девочек с ВДКН, частотой ее выявления и рекомендациями по ведению таких пациентов, данный вопрос требует дальнейшего изучения.
Согласие пациента
Медицинские данные опубликованы с письменного согласия пациентов.
Участие авторов:
Концепция и дизайн исследования — Андреева Е.Н.
Сбор и обработка материала — Аникиев А.В., Калинченко Н.Ю., Бабаева Д.М., Владимирова В.П.
Написание текста — Аникиев А.В., Калинченко Н.Ю., Бабаева Д.М., Владимирова В.П.
Вирилизация
Вирилизация представляет собой развитие гипертрофированных признаков мужского пола, как правило, у женщин, часто в результате чрезмерного синтеза надпочечниками андрогенов (мужских половых стероидных гормонов, таких как тестостерон).
Вирилизация вызвана избыточной выработкой андрогенов, обычно из-за опухоли в надпочечнике или его увеличения, либо из-за развития опухоли в яичнике или ненормальной выработке гормонов яичниками.
К симптомам относится усиленный рост волос на лице и теле, облысение, угревая сыпь, снижение тембра голоса, рост мышц и повышение сексуальной возбудимости.
Характерные изменения в организме позволяют врачам легко распознать вирилизацию, а тест подавления дексаметазоном тест может помочь определить причину ее развития.
Надпочечник, содержащий опухоль, удаляется хирургическим путем, хотя иногда избыточную выработку гормонов можно уменьшить путем приема лекарств.
Наиболее распространенной причиной вирилизации, вызванной половыми гормонами надпочечников, является:
Увеличение гормон-продуцирующих участков коры надпочечников (гиперплазия надпочечников).
Среди других причин:
Гормон-продуцирующая опухоль (аденома или раковая опухоль) в надпочечниках.
Раковая опухоль за пределами надпочечников, которая производит андрогены надпочечников.
Патология фермента (белка) в надпочечниках, присутствующая при рождении.
Опухоли вне надпочечников, которые вырабатывают андрогены, скорее всего, являются опухолями яичников. Вирилизация может развиться в результате увеличения яичников из-за определенных типов кист яичников Синдром поликистозных яичников (СПКЯ) Синдром поликистозных яичников характеризуется небольшим ожирением, нерегулярными менструациями или их отсутствием и симптомами, вызванными высоким уровнем мужских половых гормонов (андрогенов). Прочитайте дополнительные сведения (включая кисты при синдроме поликистозных яичников Синдром поликистозных яичников (СПКЯ) Синдром поликистозных яичников характеризуется небольшим ожирением, нерегулярными менструациями или их отсутствием и симптомами, вызванными высоким уровнем мужских половых гормонов (андрогенов). Прочитайте дополнительные сведения [СПКЯ]), но такие случаи практически никогда не бывают тяжелыми. В некоторых случаях повышенная секреция андрогенов яичниками может возникать в более позднем возрасте.
Ферментная аномалия надпочечников часто диагностируется в детстве или подростковом возрасте и называется врожденной гиперплазией коры надпочечников.
Симптомы вирилизации
Симптомы зависят от пола и возраста заболевшего.
К симптомам вирилизации относится усиленный рост волос на лице и теле (гирсутизм), облысение, угревая сыпь, снижение тембра голоса, рост мышц и повышение сексуальной возбудимости. У женщин уменьшаются размеры матки, увеличивается клитор, грудь становится меньше, прекращаются регулярные менструации.
У мужчин избыток гормонов надпочечников может подавлять функцию яичек и приводить к бесплодию.
У девочек младенческого возраста с врожденной гиперплазией коры надпочечников Врожденная гиперплазия надпочечников Пороки развития половых органов могут затрагивать пенис, мошонку или яички у мальчиков, влагалище и половые губы у девочек. Иногда половые органы не являются четко мужскими или женскими (двойные). Прочитайте дополнительные сведенияДиагностика вирилизации
Измерение уровня андрогенов в крови
Благодаря характерному сочетанию симптомов врачи относительно легко распознают вирилизацию. Анализы могут определить уровень андрогенов в крови, а также то, повышен ли их уровень, вырабатываются ли они половыми органами или надпочечниками.
При значительном повышении уровня андрогенов надпочечников с помощью теста подавления дексаметазоном можно определить, обусловлена ли проблема аденомой или гиперплазией надпочечников. Если проблема заключается в гиперплазии надпочечников, назначение препарата дексаметазона будет препятствовать выработке андрогенов надпочечниками. Если же у пациента аденома или рак, дексаметазон снизит выработку андрогенов лишь частично или не снизит вовсе.
Врачи могут назначить компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ), чтобы получить изображение надпочечников.
Вирилизация, индуцированная прогестогенами
Вирилизация индуцированная прогестогенами — маскулинизация наружных половых органов женского плода вызванная использованием матерью на определенных стадиях беременности андрогенов или высоких доз определенных слабо андрогенных синтетических прогестагенов (прогестинов), структурно связанных с тестостероном.
Маскулинизация женских наружных половых органов обычно случается из-за аномалий ферментов, участвующих в биосинтезе стероидов надпочечников, что приводит к врожденной гиперплазии надпочечников (ВГКН). Маскулинизация у плода женских наружных половых органов из-за использования матерями андрогенных стероидов происходит гораздо реже.
Маскулинизация женских наружных половых органов у плода из-за использования матерью андрогенных стероидов, как правило, менее заметна, чем при ВГКН и, в отличие от ВГКН, не вызывает прогрессирующую вирилизацию.
Дозировки
Степень маскулинизации внешних половых органов женского плода зависит от препарата и его дозы.
Андрогены
Единственный половой стероид, используемый в настоящее время женщинами, который может вызывать вирилизацию женских плодов — это андроген даназол, производное этистерона (этинилтестостерон).
Маскулинизация наружных половых органов у женского плода происходит уже при введении даназола в размере 200 мг / день, тогда как обычная начальная доза, когда даназол используется для лечения тяжелого эндометриоза — 800 мг / день.
Прогестагены
Обычно производные прегнана (например, прогестерон, дидрогестерон, гидроксипрогестерон капроат, медроксипрогестерона ацетат, мегестрол ацетат) не вирилизуют даже в высоких дозах; Производные тестостерона (этистерон) и 19-нортестостерон (норэтистерон, ацетат норэтистерона и т. д.), как правило, вирилизируют, но есть исключения (например, норэтинодрел, аллилестренол).
Единственные прогестагены, которые в настоящее время используются во время беременности (например, для поддержки лютеиновой системы в протоколах ЭКО или для предотвращения преждевременных родов у беременных с историей, по крайней мере, одних спонтанных преждевременных родов): прогестерон, гидроксипрогестерон капроат, дидрогестерон и аллилестренол.
Дозы 19-нортестостеронов, необходимые для вирилизации, составляют от 10 до 20 мг / день, что значительно превышает дозы, связанные с непреднамеренным контрацептивным воздействием во время беременности. Таким образом, маскулинизация наружных половых органов у женских плодов из-за воздействия прогестина во время беременности в основном встречалась лишь в прошлом.
История
Андрогены
Первыми лекарственными средствами, которые, как сообщалось, вызывали маскулинизацию плода, были андрогены метандриол и метилтестостерон в середине 1950-х годов.
21 июня 1976 года FDA одобрило андроген даназол (Данокрин), производное этистерона, для лечения эндометриоза с предупреждением о том, что его применение при беременности противопоказано из-за риска маскулинизации наружных половых органов у плодов женского пола.
Предупреждения против использования даназола постепенно усиливались в 1980-х годах. В 1991 году FDA потребовало предупреждения типа «Boxed warning» о том, что применение даназола во время беременности противопоказано, поскольку воздействие даназола в утробе матери может привести к андрогенному воздействию на плод женского пола, вызывая маскулинизацию наружных половых органов. Предупреждение типа «Boxed warning» рекомендует провести тест на беременность непосредственно перед началом терапии даназолом и использовать негормональный метод контрацепции во время терапии.
- 23 случая, связанных с даназолом (все от непреднамеренного использования в 1975–1990)
- 13 случаев, связанных с метандриолом (все из использования в 1950-х и 1960-х)
- 11 случаев, связанных с метилтестостероном (все из использования в 1950-х и 1960-х)
Прогестагены
Прошлое использование для предотвращения выкидыша
В 1940-х годах некоторые исследования показали, что прогестерон может предотвращать угрозу аборта, но биодоступность прогестерона через приём таблеток низка, а инъекции прогестерона могут быть болезненными, поэтому оральные активные прогестины пробовали начинать с этистерона, а затем другие прогестины, поскольку они стали доступны:
- норетинодрел (эновид) и норэтистерон (норлутин) в 1957 году,
- ацетат медроксипрогестерона (провера) в 1959 году,
- ацетат норэтистерона (норлутат) в 1961 году и дидрогестерон (дюфастон) в 1962 году.
В статье JAMA, опубликованной в марте 1960 года, детский эндокринолог Лоусон Уилкинс сообщил о 34 случаях маскулинизации наружных половых органов у младенцев, родившихся с 1950 по 1959 год, у матерей, получавших высокие дозы (20–250 мг / день) этистерона для профилактики аборта и 35 случаев маскулинизации у плода наружных половых органов младенцев женского пола, родившихся с 1957 по 1959 год, матерям, получавшим высокие дозы (10–40 мг / день) норэтистерона для предотвращения выкидышей.
В 1961 году Ciba и Parke-Davis добавили информацию о связи этистерона и норэтистерона с маскулинизацией наружных гениталий женского плода в раздел мер предосторожности в своих объявлениях врачам.
В клиническом исследовании, опубликованном в октябре 1962 года в Американском журнале акушерства и гинекологии, сообщалось о маскулинизации наружных половых органов у 14 из 59 младенцев женского пола (24%), родившихся у матерей, которые начали лечение норэтистероном в высоких дозах (10–40 мг / день) для профилактики выкидыш в первые 12 недель беременности (у 11 младенцев было небольшое увеличение клитора, у 1 было заметное увеличение клитора, у 2 младенцев отмечалось увеличение клитора и частичное слияние лабиоскротальных складок); Маскулинизация наружных половых органов у 1 из 23 новорожденных девочек, родившихся у матерей, которые начали лечение норэтистероном в высоких дозах (10–40 мг / день) для предотвращения выкидыша после 12-й недели беременности (1 ребенок с небольшим увеличением клитора родился у матери который начал лечение норэтистероном на неделе 13).
В 1964 году Parke-Davis пересмотрел информацию о назначении врачами норлинтина (норэтистерона) и норлутатата (ацетата норэтистерона), чтобы исключить их показания к применению при бесплодии и угрозах абортов, и добавил беременность в качестве противопоказания к их применению из-за возможности маскулинизации наружных гениталий женского плода.
В 1977 году FDA установило, что не было достаточных доказательств того, что прогестогены (включая прогестерон, дидрогестерон и 17α-гидроксипрогестерон капроат) были эффективными при лечении угроз прерывания беременности и отозвало одобрение на эти показания.
- 78 случаев, связанных с этистероном (все из использования в 1950-х и начале 1960-х годов для предотвращения выкидыша)
- 81 случай, связанный с норэтистероном (все из использования в конце 1950-х и начале 1960-х годов для предотвращения выкидыша)
Прошлые требования маркировки FDA
16 ноября 1999 года FDA опубликовало предупреждение, вступившее в силу 16 ноября 2000 года, которое отменило (после 22 лет) предупреждение для всех лекарств от прогестагена, поскольку оно не соответствовало самым последним данным о действии препарата.
Читайте также:
- Врожденный вывих лучевой кости. Врожденные деформации и косолапость
- Хронический тиреоидит Хасимото. Лимфатический зоб
- Физиология сокращения матки. Молекулярная регуляция гладкомышечного сокращения.
- Советы при врожденной диафрагмальной грыже
- Радиационный энтерит. Многократно рецидивирующая тонкокишечная непроходимость.
