Влияние болей при язве желудка на синтез глюкокортикоидов
Добавил пользователь Евгений Кузнецов Обновлено: 13.01.2026
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500–4000 мг внутривенно) или средними/высокими (25–150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80–200 мг) и неделями или месяцами в случае применения средних доз (25–60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Влияние болей при язве желудка на синтез глюкокортикоидов
Кора надпочечников при язвенной болезни желудка. Глюкокортикоидная функция при язве
Состояние глюкокортикоидной функции изучалось у 140 больных язвенной болезнью: 80 с локализацией язвы в двенадцатиперстной кишке и 60 — в желудке. В группу обследуемых были специально подобраны больные с различной локализацией язвенного поражения гастродуоденальной области (двенадцатиперстная кишка, пилорус, малая кривизна, кардия и субкардиальный отдел, большая кривизна), с неодинаковой давностью и тяжестью заболевания.
Среди обследованных больных с язвой в двенадцатиперстной кишке мужчин было 59, женщин — 21, с язвой желудка соответственно 34 и 21. Возрастной состав больных находился в пределах от 16 до 60 лет.
Глюкокортикоидная функция надпочечников оценивалась по уровню спонтанной экскреции 17-окси-кортикостероидов с мочой, определяемых по методу Redely, Jenkins, Thorn в модификации Ю. Н. Гурского и Г. В. Ордынец, а также по изменению данного показателя после внутримышечного введения 40 ЕД экс-АКТГ-ин производства венгерской фирмы «Гедеон-Рихтер» (указанная доза АКТГ установлена нами экспериментально). В качестве контроля использовались данные, полученные при обследовании 34 здоровых (Л.П.Гроховского).
У практически здоровых лиц средний уровень экскреции 17-оксикортикостероидов составлял 7,08±1,11 мг/сутки. После введения АКТГ происходило закономерное (почти двукратное) увеличение 17-оксикортикостероидов в моче.
Определение 17-оксикортикостероидов у больных производилось таким же образом, как и у здоровых. В первые дни пребывания больного в клинике на протяжении 2 суток до и 2 суток после нагрузки АКТГ устанавливалось выделение 17-оксикортикостероидов, в период обследования больные не получали никаких лекарственных препаратов, могущих повлиять на состояние гипофизарно-адреналовой системы.
В результате было установлено, что спонтанное выделение стероидных метаболитов колеблется в весьма широких пределах: от 0,4 мг до 13,4 мг/сутки. При этом у 50% обследованных данный показатель находился в пределах нормы, а у остальных оказался сниженным. Средняя же величина (М ± т) спонтанной экскреции глюкокортикоидов у больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке (5,0 ± 0,25 мг) по сравнению с контрольной группой была достоверно снижена.
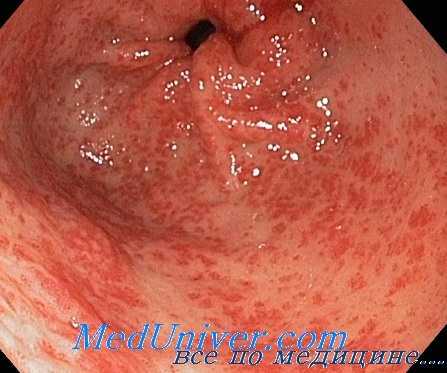
При сопоставлении изучаемого показателя у мужчин и женщин, а также у больных различных возрастных групп существенной зависимости его от пола и возраста установить не удалось. Зато имелась определенная связь спонтанной экскреции 17-оксикоргикостероидов с давностью болезни. У лиц с непродолжительным течением заболевания (до 5 лет) показатель экскреции 17-оксикортикостероидов нередко оставался нормальным, но был достоверно выше, чем у больных с длительным течением болезни. У больных, впервые заболевших язвенной болезнью (свежая язва двенадцатиперстной кишки), экскреция 17-оксикортикостероидов была аналогична таковой у здоровых (7,4 ± 0,5 мг).
У больных с частыми, ежегодными обострениями данный показатель оказался значительно ниже (4,1 ± 0,7мг), причем различия статистически существенны.
Таким образом, спонтанная экскреция глюкокортикоидов у больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке подвержена заметным колебаниям. Она может быть нормальной или сниженной, что во многом зависит от давности заболевания.
Изучение резервных возможностей коры надпочечников у рассматриваемой группы больных показало следующее. У 16 больных ответная реакция коры надпочечников на введение АКТГ по показателям экскреции 17-оксикортикостероидов оказалась нормальной: в ответ на нагрузку 40 ЕД АКТГ наблюдалось увеличение содержания 17-оксикортикостероидов в суточной моче на 50—200% по отношению к их исходному содержанию. У некоторых больных этой группы уровень экскреции 17-оксикортикостероидов повышался кратковременно и на второй день после введения АКТГ падал ниже исходного.
Еще у 16 больных с показателями спонтанной экскреции глюкокортикоидов, варьировавшими в пределах физиологических границ, ответная реакция на введение АКТГ была в той или иной степени повышена (в отдельных случаях прирост показателей экскреции 17-оксикортикостероидов достигал 300— 500% исходного уровня).
И, наконец, у 48 больных определялась явная недостаточность глюкокортикоидной функции коры надпочечников. По характеру наблюдаемых сдвигов здесь можно было выделить два варианта. У одних больных (23 человека) низкие показатели спонтанной экскреции глюкокортикоидов сменялись четким повышением (в абсолютных цифрах) после стимуляции надпочечников АКТГ. У других больных (25 человек) наряду с пониженной спонтанной экскрецией 17-оксикортикостероидов отсутствовала реакция надпочечников на введение АКТГ. Данная форма функциональной недостаточности, по-видимому, обусловлена снижением резервных возможностей коры надпочечников.
Таким образом, между клиническим течением рассматриваемой формы язвенной болезни и состоянием глюкокортикоидной функции коры надпочечников обнаруживалась взаимосвязь. Так, при небольшой давности болезни (1—2 года) экскреция 17-оксикортикостероидов до и после нагрузки АКТГ практически не отличалась от таковой у здоровых. Отмечалось лишь некоторое повышение чувствительности к введению АКТГ в момент выраженного обострения.
При длительном течении, когда клиническая симптоматика обострения была стертой (больные предъявляли много жалоб, связанных с общими расстройствами), появлялись признаки функциональной недостаточности коры надпочечников, выражавшиеся в снижении спонтанной экскреции 17-оксикортикостероидов, однако ответная реакция на АКТГ большей частью оставалась сохраненной.
Влияние течения язвенной болезни желудка на синтез глюкокортикоидов
Для изучения роли гипофизарно-надпочечниковой системы в развитии язвенной болезни была специально подобрана группа больных с различной локализацией язвы (малая кривизна, кардиа- и субкардиальный отдел, большая кривизна), давностью и тяжестью заболевания. Чаще всего язвы у больных данной формой болезни локализовались на малой кривизне желудка. Это наблюдалось в 48 из 60 случаев. У 12 больных язва обнаружена в кардиальном отделе или на большой кривизне тела желудка. Анамнестически выяснено, что 18 больных с язвой желудка в прошлом перенесли язву двенадцатиперстной кишки.
Заслуживает внимания тот факт, что клиническая картина у больных, перенесших в прошлом язву двенадцатиперстной кишки, отличалась длительным течением и своеобразной симптоматикой, в частности характером болевого синдрома. В большинстве случаев боли возникали так же, как у больных с язвой в двенадцатиперстной кишке, натощак, напоминая «голодные, ночные». В дальнейшем они сменялись постоянными, теряли четкую связь с приемом пищи и трудно поддавались терапии.
Спонтанная экскреция 17-оксикортикостероидов у больных язвой желудка находилась в пределах от 0,1 до 12,7 мг/сутки. У подавляющего большинства данный показатель был меньше нормального, достигая в ряде случаев крайне низких цифр. Приводим показатели спонтанной экскреции 17-оксикортикостероидов у больных язвой желудка.
Достоверность различий при сравнении с контрольной группой. Средние величины экскреции метаболитов стероидных гормонов у больных мужчин были несколько выше, чем у женщин, но при статистической обработке это различие оказалось недостоверным. При сопоставлении данного показателя с возрастом больных можно было отметить, что у лиц старшей возрастной группы чаще встречались более низкие цифры 17-оксикортикостероидов, нежели у больных относительно молодого возраста. Однако статистический анализ не установил значимости этих различий.
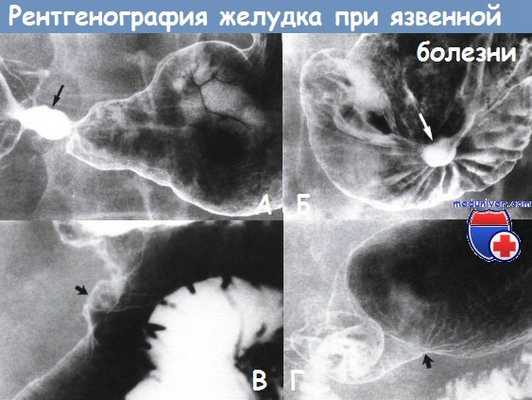
А - Обнаружен заполненный барием язвенный дефект в пилорическом отделе (обозначен стрелкой)
Б - Обнаружено скопление бария в доброкачественной язве (обозначено стрелкой) на задней стенке проксимального отдела антральной области. Складки желудка сходятся в радиальном направлении к краю язвы
В - Обнаружена доброкачественная язва тела желудка
Г - Видны радиальные складки и участок втяжения на большой кривизне в области проксимальной части антрального отдела (обозначено стрелкой), что связано с рубцовым процессом в результате хронической аспирин-ассоциированной гастропатии
Существенная взаимосвязь обнаруживалась между давностью заболевания и уровнем экскреции 17-оксикортикостероидов. Так, в группе больных, у которых анамнестически давность заболевания составляла 1—5 лет, у 15 из 21 отмечались сниженные показатели экскреции глюкокортикоидов. В то же время у больных с давностью заболевания свыше 5 лет и особенно свыше 10 лет уменьшенные показатели встречались чаще и были еще более низкими. Наиболее часто низкая глюкокортикоидная активность обнаруживалась у больных с тяжелой часто рецидивирующей формой болезни.
На степень и частоту снижения данного показателя определенное влияние оказывала продолжительность обострения заболевания. Так, например, из 16 обследованных в первый месяц обострения сниженные показатели были отмечены лишь у 8, тогда как при затянувшемся обострении длительностью примерно 3—6 месяцев из 28 больных низкие показатели экскреции 17-оксикортикостероидов были обнаружены у 25. У отдельных больных они достигали крайне низких цифр (0,1 мг в сутки).
Весьма показательны в этом отношении данные о ритме экскреции 17-оксикортикостероидов в течение суток. Как видно на рисунке, у больных с небольшой длительностью болезни в ранние периоды обострения содержание 17-оксикортикостероидов в моче в течение суток подвержено значительным колебаниям, причем периоды усиления болей сопровождаются изменением этого показателя. У больных с длительным сроком болезни (20 лет и выше) экскреция 17-оксикортикостероидов однотипна на протяжении всех суток независимо от болей.
Все сказанное свидетельствует о том, что у больных язвой желудка, так же как у больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке, спонтанная экскреция глюкокортикоидов определяется клиническими особенностями течения заболевания: давностью, частотой обострений и тяжестью клинической картины. Чем выраженнее эти признаки, тем заметнее снижение функции коры надпочечников.
Состояние глюкокортикоидной функции у больных язвой желудка находится в определенной зависимости от места расположения язвы. Так, например, из 43 обследованных с локализацией язвы на малой кривизне пониженные показатели были обнаружены у 28 больных, тогда как при расположении язвы на большой кривизне содержание 17-оксикортикостероидов было крайне низким у всех обследованных.
Клиника и симптомы стероидных язв желудка. Синтез глюкокортикоидов при язвенной болезни желудка
Стероидные язвы нередко протекают латентно и в таких случаях являются находкой при рентгенологическом обследовании больных, получающих стероидную терапию. Симптоматология стероидной язвы отличается нестойкостью и нередко исчезает после отмены гормонов и назначения соответствующей диеты.
Иными словами, стероидные язвы, так же как и резерпиновые, бутадионовые, атофановые представляются чисто лекарственными и далеко не равнозначны деструктивным изменениям слизистой оболочки желудка и кишечника при язвенной болезни.
В то же время некоторыми авторами стероидам отводится определенное место в формировании язвенной болезни, с той оговоркой, что эндогенные гормоны по своему действию на структуру и функцию желудочно-кишечного тракта существенно отличаются от экзогенных (С. М. Рысс и Е. С. Рысс). Более того, существует тенденция придать гормонам гипофизарно-надпочечниковой системы если не ведущее, то, по меньшей мере, весьма важное значение в патогенезе язвенной болезни.
В последнее время появился ряд работ (Л. М. Каскевич, О. С. Радбиль и С. Г. Вайнштейн, Grosa и др.), в которых развивается гипотеза Bojanowicz, согласно которой одним из основных механизмов патогенеза язвенной болезни является дискортицизм (повышение глюкокортикоидной и снижение минералокортикоидной функций коры надпочечников).
В этой связи уместно рассмотреть имеющиеся данные относительно характера изменений функции гипофизарно-надпочечниковой системы у больных язвенной болезнью.
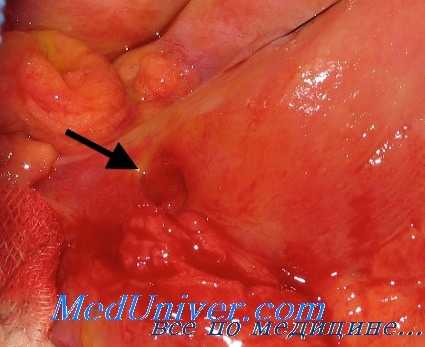
У больных, страдающих язвенной болезнью длительное время, и особенно при локализации язвы в желудке, функция коры надпочечников как по показателям андрогенной, так и глюкокортикоидной ее деятельности снижена (С. М. Рысс, А. А. Фишер, Л. М. Козлов, Biro с соавт., Turner, Sandweiss с соавт., Heteny, Faredin с соавт., Green и др.).
Некоторое расхождение данных встречается лишь у больных язвенной болезнью в начальной фазе заболевания, преимущественно у больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке. В этих случаях (приблизительно у 50% обследованных) одни авторы (Н. А. Дубровина, Н. П. Цизина, Ю. М. Полоус, Л. М. Каскевич) находят функцию надпочечников (андрогенную или глюкокортикоидную) повышенной, другие — нормальной (Г. П. Шульцев, Marinaccio с соавт., Sleisinger с соавт.).
Имеются работы (Sandweiss с соавт. и др.), в которых приводятся данные о снижении глюкокортикоидной и некотором повышении андрогенной функции.
Надо отметить, что большинство авторов, установивших повышенные показатели указанных функций коры надпочечников, связывают это явление с болевым синдромом. М. А. Алекперов специально изучал динамику выделения кортикостероидов с мочой у больных язвенной болезнью (язва 12-перстной кишки) в течение суток и показал определенную связь между болевым синдромом и экскрецией 17-кетостероидов и 17-оксикортикостероидов: при обострении заболевания наблюдалось повышение уровня выделения кортикостероидов.
Для выяснения зависимости экскреции глюкокортикоидов от выраженности болевого синдрома были проведены сопоставления клинического течения заболевания с результатами исследования функционального состояния гипофизарно-надпочечниковой системы. Тщательный анализ этих данных показал, что четкого параллелизма между интенсивностью болевого синдрома и величиной экскреции 17-оксикортикостероидов не имеется. Однако было замечено, что у больных со стойким и длительным болевым синдромом глюкокортикоидная функция по показателям экскреции 17-оксикортикостероидов до и после нагрузки АКТГ часто оказывалась пониженной.
В тех же случаях, когда боли были менее выражены и имели неопределенный характер как по времени возникновения, так и по интенсивности спонтанная экскреция глюкокортикоидов также была уменьшена, но ответная реакция на АКТГ оставалась положительной.
Для уточнения этого факта были проведены исследования ритма экскреции 17-оксикортикостероидов в течение суток у 10 больных язвенной болезнью с локализацией язвы в луковице двенадцатиперстной кишки. Определение данного показателя в отдельных шестичасовых порциях мочи показало, что у больных с непродолжительным заболеванием при наличии «голодных и ночных болей» ночная экскреция 17-оксикортикостероидов была выше дневной, а у лиц с длительным сроком болезни, когда боли носили почти постоянный характер, имели место обратные соотношения. В некоторых случаях повышение экскреции стероидных метаболитов совпадало во времени с усилением болей.
Вместе с тем наблюдались случаи, когда в период болей уровень экскреции 17-оксикортикостероидов понижался. По-видимому, реакция коры надпочечников на боль не всегда однотипна и является индивидуальной в зависимости от факторов, имеющих непосредственное отношение к механизму данного синдрома (нарушение моторики, воспалительной реакции и т. д.). Однако факт остается в силе: болевой синдром так или иначе отражается на глюкокортикоидной функции коры надпочечников.
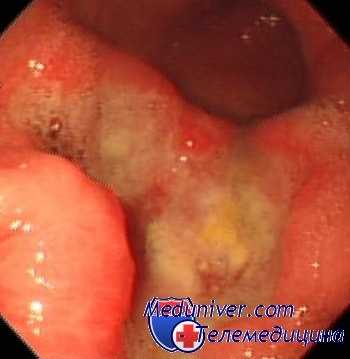
После проведения принятого в клинике курса комплексной противоязвенной терапии (диета, транквилизаторы, холинолитики, витамины, антациды и пр.), т. е. в фазу наступающей ремиссии, отмечалась определенная динамика функционального состояния гипофизарно-надпочечииковой системы. Из 80 обследованных у 55 ее функциональная способность восстановилась полностью, а у 25 — частично. У больных с низким исходным уровнем глюкокортикоидной функции происходило четкое статистическое достоверное увеличение до нормального уровня содержания 17-оксикортикостероидов в моче как до (5,7 ±1,41 мг), так и после нагрузки АКТГ (12,9 ±2,19 мг).
Таким образом, у большинства больных язвенной болезнью с локализацией язвы в двенадцатиперстной кишке выявлялись нарушения функции гипофизарно-надпочечииковой системы. Однако характер глюкокортикоидной недостаточности имел свои особенности. Анализируя результаты исследований, можно выделить три варианта рассматриваемой функции: нормальную (когда кортикоидогенез практически ничем не отличался от такового у здоровых, по крайней мере по изученным показателям), гипокор-тицизм, обусловленный недостаточной продукцией кортикотропина, и гипокортицизм надпочечного происхождения. Указанные формы гипокортицизма характеризуются пониженной спонтанной экскрецией глюкокортикоидов.
Отличительной чертой является то, что при центральном гипокортицизме пониженные показатели экскреции стероидов в покое значительно возрастают после нагрузки АКТГ. При надпочечниковой форме этого не наблюдается. Введение АКТГ не сопровождается повышением кортикостероидогенеза. Важным обстоятельством является то, что отмеченные нарушения функции надпочечников находятся в прямой зависимости от степени прогрессирования заболевания и носят транзиторный характер. Чем длительнее и тяжелее протекает заболевание, тем выраженнее расстройства со стороны гипофизарно-надпочечниковой системы. Положительная динамика заболевания способствует восстановлению данной функции.
Следовательно, нарушение функции гипофизарно-надпочечниковой системы не является предшественником язвенной болезни, а возникает вторично, как результат заболевания. Поэтому есть все основания полагать, что прямого отношения к генезу язвенной болезни, в частности ее пилородуоденальной форме, глюкокортикоидные гормоны, по-видимому, не имеют. Их роль возрастает по мере прогрессировапия болезни, когда в силу нарушений целого ряда биохимических процессов в организме и главным образом стойких расстройств нервной регуляции присоединяется функциональная недостаточность коры надпочечников. Однако, раз возникнув, она как отягощающий фактор способствует прогрессированию заболевания и развитию осложнений, в том числе функционально-морфологических изменений слизистой оболочки желудка. В этой связи представляло интерес изучить роль гипофизарно-надпочечниковой системы в развитии язв желудка.
Читайте также:
