Внутрилегочное смешивание газов. Диффузия Тейлора
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Касаясь последовательности транспорта электронов в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий, прежде всего, следует отметить, что от всех НАД – зависимых реакций дегидрирования восстановленные эквиваленты переходят к митохондриальной НАДН – дегидрогеназе, затем через ряд железосерных ферментов передаются на убихинон М цитохрому b. Далее электроны переходят последовательно на цитохромы С1 и С, затем на цитохромы аа 3 (цитохромоксидазу – медьсодержащий фермент). В свою очередь цитохромоксидаза передает электроны на кислород. Для того, чтобы полностью восстановить кислород с образованием 2-х молекул воды требуется 4 электрона и четыре Н+ .
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Анион бикарбоната составляет около 90% от общего содержания СО2 в артериальной крови: СО2+Н2О - Н++НСО-3.
Эта реакция медленно протекает в плазме крови, но чрезвычайно интенсивно происходит в эритроцитах при участии фермента карбоангидразы. Мембрана эритроцита относительно непроницаема для Н+, как и вообще для катионов, но в тоже время, проницаема для ионов НСО-3, выход которых из эритроцитов в плазму обеспечивается притоком Cl- из плазмы в эритроциты. Часть Н+ забуферивается гемоглобином с образованием восстановленного гемоглобина.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Hb NH2 + CO2 - Hb NH COOH > Hb NH COO + Н+
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Угарный газ (СО) – окись углерода обладает значительно большим сродством к гемоглобину, чем О2, с последующим образованием карбоксигемоглобина. СО входит в состав бытового газа, а также выделяется при работе двигателей внутреннего сгорания. При концентрации СО во вдыхаемом воздухе всего в количестве 7*10- 4 около 50% гемоглобина превращается в карбоксигемоглобин. В норме в крови содержится около 1% HbCO, у курильщиков – 3% . В крови водителей такси концентрация карбоксигемоглобина достигает 20%. Карбоксигемоглобин диссоциирует с отдачей О2 в 200 раз медленней оксигемоглобина и в то же время препятствует его диссоциации в тканях.
Внутрилегочное смешивание газов. Диффузия Тейлора
Альвеолярный газообмен при погружении. Региональная неоднородность газообмена
Сопротивление воздухоносных путей, влияние подводного погружения, препятствия, создаваемые дыхательным аппаратом, и все остальные затруднения должны быть преодолены в результате дыхательной работы, чтобы достичь «адекватной» вентиляции легких. К сожалению, вентиляция, которая обычно бывает адекватной, не всегда гарантирует достаточный газообмен О2 и СО2 внутри легких. Подобные случаи наблюдаются при заболеваниях легких. Вместе с тем, как известно, только немногие из возможных механизмов нарушения функции легких представляют интерес в отношении здоровых водолазов, находящихся на глубине, или считаются важными в достаточной степени, чтобы их стоило рассматривать.
Основная функциональная задача легких состоит в обеспечении крови возможности усваивать кислород из «альвеолярного» газа и доставлять избыток СО2 из крови в этот газ. Нетрудно заметить, что для достижения этой цели необходимо достаточно хорошее соответствие процессов альвеолярной вентиляции (VA) и кровотока (Q) в отдельных участках легких.
В идеале вентиляционно-перфузионное отношение Va/Q, видимо, близко к единице. Если рассмотреть в качестве примера крайние ситуации, то выяснится, что газообмен будет отсутствовать как на участке, который вентилируется, но не снабжается кровью, так и на участке, в котором осуществляется кровоток, но не происходит вентиляция (Va/Q = 0). В первом случае участок легких будет представлять собой дыхательное мертвое пространство, в котором вентиляция затрачивается впустую, во втором — шунт крови справа налево, когда неизмененная венозная кровь поступает в системный артериальный поток. Обычно только небольшая часть легких находится в одном из этих крайних состояний. Однако нарушенное отношение Va/Q, близкое к крайним значениям, способно вызвать очень серьезные последствия. Изменение отношения Va/Q является главной причиной при некоторых нарушениях функций легких.

Сила тяжести влияет на легочную ткань так же, как и кровь, находящаяся в легких. В вертикальном положении тела верхние участки легких могут изменять объем более свободно, а следовательно, и лучше вентилироваться. В то же время гораздо большая часть кровотока поступает в нижние отделы легких. В норме в состоянии покоя в положении стоя вентиляционно-перфузионное отношение в верхних отделах легких составляют 3,0, в нижних — всего лишь 0,5. Физическая нагрузка, как правило, улучшает равномерность распределения как вентиляции, так и перфузии.
Нет смысла ожидать, что погружение в воду устранит гравитационные явления внутри легких, потому что они направлены на взаимоотношение между газом и жидкостью, полностью ограниченное рамками грудной клетки. Вместе с тем антигравитационный эффект на периферии во время иммерсии, как было указано выше, стремится переместить кровь от конечностей в грудной клетке. Это помогает выравниванию перфузии в легких Вместе с тем у испытуемых, находящихся в воде в вертикальном положении, градиент внешнего давления и влияние плавучести стремятся поднять диафрагму. В определенной степени это дополнительно ограничит расширение нижних отделов легких при вдохе, что может способствовать нарушению Va/Q.
Изменение транспорта кислорода, проявляющееся при возросшей альвеолярно-артериальной разнице давления О2, представляет собой главную причину отклонений в вентиляционно-перфузионном отношении. West в 1972 г. установил, что накопление СО2 является также важным результатом этого отклонения.
До настоящего времени окончательно не выяснено, какое основное влияние на распределение вентиляции в легких оказывает изменение плотности газа. Логично предположить, что возросшая плотность дыхательной смеси будет способствовать поступлению большей части вдыхаемого газа в участки легких, с более низким сопротивлением воздухоносных путей, чем в остальных. Miller, Winsborough в 1973 г. сделали более оптимистический вывод. Они утверждали, что у молодых здоровых мужчин измененное VA/Q при тяжелой физической нагрузке на глубине было следствием скорее неадекватной общей вентиляции легких, чем увеличения местной неоднородности вентиляции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Для выяснения обычных процессов смешивания газов, которые должны происходить внутри легких, чтобы эффективно доставлять кислород и удалять СО2, было проведено большое число исследований. Проведенные в 1972 г. Knelson и сотрудниками и в 1973 г. Bondi, Van Liew эксперименты привлекли внимание к установленному факту, что инспираторная пауза увеличивает эффективность дыхания. С рассмотренных выше позиций увеличенную эффективность дыхания можно объяснить уменьшением дыхательного мертвого пространства Vd. Важное значение в этом случае имеет улучшенное перемешивание «свежего» газа дыхательного объема (Vt) и «старого» газа функциональной остаточной емкости (ФОЕ), который задерживается в легких между циклами дыхания.
Van Liew и соавт. (1981) представили подробный обзор состояния вопроса и экспериментальных данных. Наиболее легко, по-видимому, сконцентрировать внимание на транспорте О2 из окружающего воздуха до альвеолярно-капиллярной мембраны. Смешивание газа между Vt и ФОЕ должно проходить по крайней мере по трем этапам.
Наиболее очевидным из них является конвекция: вдыхаемый газовый поток переносит некоторое количество молекул кислорода прямо к ФОЕ. Однако есть повод полагать, что только 10—13% Vt смешиваются с ФОЕ подобным образом во время каждого спокойного респираторного цикла.
Engel и сотрудники в 1973 г. подчеркнули важную роль работы сердца в перемешивании газа. Они пришли к заключению, что сердцебиение приблизительно на 1/4 уменьшало мертвое пространство (Vd) в первые 10 с задержки дыхания. Исследователи предположили, что механизм воздействия сердца «заключается как в диффузии Тейлора, так и конвективном перемешивании вследствие турбулентных потоков и вторичных движений».
Принято считать диффузию Тейлора особенно важным явлением в воздухоносных путях среднего диаметра.

Продольная дисперсия газа является другим этапом этого процесса, в котором можно наблюдать комбинацию конвекции: с потоком по длине воздухоносных путей и радиальной диффузии, направленной от центра потока к стенкам дыхательного тракта. Когда поток имеет более или менее ламинарный характер, радиальная диффузия, по-видимому, способствует вымыванию кислорода из быстро движущегося слоя потока в центре воздухоносных путей. Если поток становится турбулентным, параболический фронт профиля скоростей ламинарного течения замещается тупым. Состав газа в турбулентном потоке почти; одинаков вдоль поперечного сечения воздухоносных путей, поэтому радиальная диффузия становится менее значимой.
Более быстрый слой в центре ламинарного потока газа, вероятно, играет существенную роль в доставке кислорода к альвеолам легких. Вместе с тем в любом случае кислород должен. еще поступить к альвеолярно-капиллярной мембране путем молекулярной диффузии газов.
Даже из этого упрощенного объяснения процесса очевидно, что диффузия происходит по крайней мере двумя путями. Диффузия внутри альвеол имеет большое значение для доставки кислорода в кровь. Кроме того, диффузия Тейлора внутри воздухоносных путей, по-видимому, уменьшает поступление кислорода к альвеолам в результате смешения большого количества кислорода со «старым» газом, остающимся в воздухоносных путях. Развитие турбулентности уменьшает роль диффузии Тейлора, но одновременно прекращает доставку кислорода более быстрыми центральными слоями потока газа.
Очевидно, что плотность газа в этом случае играет важную роль. Несомненно, что увеличение плотности газа будет снижать скорость молекулярной диффузии. Такое увеличение будет препятствовать проникновению кислорода в направлении альвеолярно-капиллярной мембраны, но наряду с этим будет также ослаблять роль диффузии Тейлора в рассеивании кислорода, прежде чем последний сможет достичь альвеол. Прогноз может быть либо благоприятным, либо неблагоприятным. Дальнейшее увеличение плотности газа может стать причиной турбулентности потока, развивающейся в определенных воздухоносных путях, и последствия этого, видимо, трудно предсказать.
В свете подобных противоречивых явлений не только увеличение плотности газа может оказать непредсказуемое, с точки зрения современных знаний, воздействие, но и наблюдаемые эффекты, вероятно, способны стать обратимыми при дальнейших изменениях условий. Пытаясь объяснить гипоксию Шуто, мы уже упоминали о необходимости учитывать бинарные диффузионные коэффициенты, кроме рассмотрения только величин плотности газа.
Теоретические вопросы, рассмотренные в наших статьях более чем вероятно станут жизненно важными при определении возможности человека проникать на большие глубины.
Внутрилегочная диффузия газов. Наслоенная неоднородность и гипоксия Шуто
«Наслоенная неоднородность» (stratified inhomogeneity) — термин, применяемый для описания неполного смешивания «нового» вдыхаемого газа (дыхательный объем, Vt) со «старым», содержащимся в конечных участках воздухоносных путей и альвеолах легких (ФОЕ). Очевидно, что основное перемешивание потока не является законченным, и процесс обновления газа в зоне альвеол должен включать смешивание путем диффузии. Этот фактор в обычных условиях не является препятствием для обмена газов, но в более плотном газе диффузия способна замедлиться. Поэтому имеется некоторый риск возможного нарушения процесса диффузии газов при нахождении водолаза на глубине.
Диффузионное мертвое пространство. Эксперименты по дыханию жидкостью, проведенные Kylstra и сотрудниками в 1966 г., привлекли внимание к явно крайней форме ограничения диффузии газов. Исследователи обнаружили очень высокую разницу Po2 и Рсо2 «альвеолярной» жидкости и артериальной крови. Такую разницу давлений можно было бы объяснить большим диффузионным мертвым пространством, обусловленным медленной диффузией газов через заполненные жидкостью пространства, расположенные между центральной частью порции свежей вдыхаемой жидкости и альвеолярно-капиллярной мембраной.

Гипоксия Шуто
В 1972 г. во Франции Шуто (Chouteau) и сотрудники сообщили о затруднениях, возникших при проведении глубоководных погружений коз в барокамере при дыхании почти нормоксической гелиево-кислородной смесью. У животных развился синдром, который был расценен как имеющий гипоксическую природу. Синдром удивительно быстро исчезал при относительно умеренном повышении РICO2 и вновь развивался, если окружающее давление повышали, опять исчезая вовремя очередного повышения PiО2. В одной серии опытов смену давления чередовали несколько раз до конечного абсолютного, давления, приблизительно равного 100 кгс/см2, при котором некоторые животные погибли, по-видимому, в результате кислородного повреждения легких. Berry в 1972 г. получил в экспериментах на свиньях карликовой породы, погружаемых без: осложнений на глубину до 1100 м, несколько противоположные данные.
Не вызывает сомнения, что гипоксия Шуто связана с нарушением диффузии газов. Несколько групп исследователей пытались воспроизвести опыты Шуто, помещая животных в атмосферу газа с эквивалентной плотностью, используя более тяжелые газы при более низких давлениях. По меньшей мере некоторые из этих исследователей не придавали значения тому, что критическим фактором в данной ситуации скорее всего будет не непосредственно плотность газа, а бинарный коэффициент диффузии кислорода в газе-разбавителе. Однако еще никто не установил бинарных коэффициентов, которые имели место в исследовании, проведенном Chouteau.
Попытки воспроизвести опыты Шуто постоянно давали результаты, противоположные ожидаемым. С увеличением плотности альвеолярно-артериальная разность давления О2 снижалась, словно повышенная плотность газовой смеси улучшала процесс диффузии, а не нарушала его. Поскольку это невозможно, причина, очевидно, заключается в чем-то другом.
У человека, подвергнутого действию давления, приближающегося по величине, рассмотренному Шуто, стало возможным прямое измерение артериального Ро2. Salzano и соавт. (1981) изучили газы в артериальной крови у испытуемых, находящихся в состоянии покоя, выполняющих физическую работу под абсолютным давлением 47 и 66 кгс/см2 и дышащих гелиоксом и тримиксом при абсолютном давлении О2 во вдыхаемой смеси, равном 0,5 кгс/см2. Они показали, что РаО2 всегда превышает общее артериальное насыщение. Величины альвеолярио-артериальной разности давления О2 было трудно определить вследствие повышенного PiО2, однако они, по-видимому, под действием давления значительно не изменялись. Вместе с тем при анализе полученных данных выявилось неожиданное увеличение объема мертвого пространства, рассчитанного на основании уравнения, предложенного Bohr, по СО2 этот объем увеличивался в 2—3 раза по сравнению с контрольными величинами, полученными при нормальном давлении. Различные рабочие гипотезы механизмов снижения эффективности газообмена рассмотрены в работе Salzano и соавт. (1981). Однако такое явление может указывать на существование для некоторых индивидуумов такой плотности газа, при которой адекватный газообмен не сможет поддерживаться во время выполнения физической работы. Оно может представлять новую форму респираторного ограничения во время глубоководного погружения.
7.1. Механизмы нарушения альвеолярного дыхания
Как известно, газообмен в легких происходит благодаря диффузии газов через альвеолярно-капиллярную мембрану по градиенту концентрации 02 и С02. Объемная скорость диффузии определяется по формуле:
(Р1 - Р2) - это трансмембранный градиент парциального давления газа. Для О2 он равен 60 мм рт.ст. (в альвеолярном воздухе давление О2 (Р1) равно 106 мм рт.ст.; в легочных капиллярах (Р2) - 46 мм рт.ст.) в начальном отрезке капилляра. Градиент парциального давления СО2 имеет противоположное направление (Р1 - 46 мм рт. ст. в легочных капиллярах, Р2- 40 мм рт. ст. в альвеолах) и равен 6 мм рт. ст. в начальном отрезке капилляра. Эти градиенты давлений служат движущей силой диффузии О2 и СО2, т.е. газообмена в легких;
α - растворимость газов в тканях. Поскольку, растворимость СО2 в мембране примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше;
К- константа диффузии;
S - площадь альвеол (или площадь газообмена, которая составляет 50-100 м2);
d - это толщина альвеолярно-капиллярной мембраны, которая препятствует диффузии газов. В организме здорового человека толщина альвеолярно-капиллярной мембраны варьирует от 0,3 до 2 мкм (рис.10).
Изнутри альвеолы выстланы сурфактантом. Сурфактант - это поверхностно-активное вещество (ПАВ), выстилающее альвеолы, продуцируется альвеолоцитами второго порядка и на 70-80% состоит из фосфолипидов (фосфатидилхолин, фосфатидилглицерол, дипальмитоилфосфатидилхолин и т.д.), а на 20-30% - из белков (апопротеины, сывороточные альбумины). В условиях нормы постоянно происходит обновление сурфактанта за счет фагоцитоза альвеолярными макрофагами и его синтеза альвеолоцитами 2-типа. Сурфактант выполняет следующие функции: снижает поверхностное натяжение альвеол и обеспечивает их стабилизацию, предупреждает спадение альвеол, обеспечивает несмачиваемость при вдохе, улучшает диффузию газов, увеличивает растяжимость легких, препятствует пенообразованию. В регуляции секреции сурфактанта участвуют различные гормоны, в частности, катехоламины, эстрогены, тироксин, глюкокортикоиды, которые усиливают выработку сурфактанта. В то же время инсулин, андрогены, а также атропин, белки и липиды сурфактанта угнетают его синтез. Уменьшение выработки сурфактанта наблюдается при гиповентиляции, хронической гипоксии, легочной гипертензии, при поражении альвеолоцитов 2-го типа, при вдыхании табачного дыма и чистого кислорода и т.д. При этом нарушается диффузия газов, развиваются ателектазы и отек легких, образуется пена.
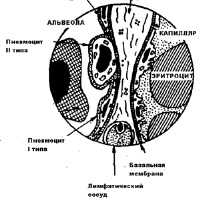
Рис.10. Схема альвеолярно- капиллярной мембраны ( Воложин А.И.,2000)
Недостаток внутрилегочного сурфактанта служит первопричиной развития респираторного дистресс-синдрома новорожденных у недоношенных детей.
Своеобразие патологии дыхательной системы у детей раннего возраста может быть обусловлено особенностями ее строения и функции. Наличие узких носовых ходов, а также длинных, узких и малоразветвленных бронхов, обилие межуточной ткани, кровеносных и лимфатических сосудов в легких способствуют возникновению разнообразных пневмопатий, которые лежат в основе синдрома дыхательных расстройств (СДР) у значительного числа новорожденных.
Наиболее частой и тяжелой формой пневмопатий являются гиалиновые мембраны, особенно у недоношенных детей, развивающихся в условиях патологического течения беременности и родов. В образовании гиалиновых мембран, состоящих из фибрина, сывороточных протеинов и клеточных элементов, патогенетическую роль играет недостаточность фибринолитической системы. К нарушению фибринолитических процессов и ретенции фибрина в альвеолах может предрасполагать дефицит плазминогена. Гиалиновые мембраны располагаются в просвете альвеолярных ходов, альвеол, легочных бронхов, лежат как уплотненные массы в просвете свободно или выстилают стенки дыхательных путей, способствуя их обтурации, нарушению легочной вентиляции, развитию гипоксемии, вазоконстрикции сосудов и гипоперфузии легких. В то же время возникают инактивация альвеолярного сурфактанта, ухудшение расправления легочной ткани и развиваются обструктивно-рестриктивные формы ДН у детей.
К не менее тяжелой разновидности пневмопатий относится отечно-геморрагический синдром. В легких отмечается резкое усиление кровенаполнения сосудов всех калибров, особенно капилляров. Просвет альвеолярных ходов и альвеолы заполнены отечной жидкостью и кровью; отечна межуточная ткань. Массивные легочные кровоизлияния могут быть обусловлены синдромом ДВС, развивающимся при асфиксии или внутриутробном инфицировании плода. В легких формируются ателектазы - от сегментарных до тотальных, сочетающиеся с отеком и другими гемодинамическими изменениями, а также признаками незрелости легких. У детей обнаруживаются одышка, хрипы, ослабление дыхания, респираторный или смешанный ацидоз.
Течение СДР может быть острым и подострым. В период восстановления исчезают признаки ДН и нарушения функции ЦНС, нормализуется кровообращение, исчезают отеки. Однако у детей, перенесших СДР, возможно развитие хронической легочной патологии. В ряде случаев развитие бронхолегочной дисплазии связано с незрелостью бронхоальвеолярной системы легких и изменениями, обусловленными гиалиновыми мембранами. К ним относятся бронхиолярный и интерстициальный фиброз, облитерирующий бронхиолит с интерстициальным некрозом. Возникающая при этом хроническая ДН сопровождается гипоксемией, гиперкапнией и гипоксией разных органов и тканей.
7.2. Респираторный дистрресс-синдром. Этиология и патогенез
В последние годы для оценки этиологии и патогенеза ДН используют термин острый респираторный дистресс-синдром (ОРДС), который может возникать у детей и взрослых.
Респираторный дистресс-синдром - патологический процесс, характеризующийся артериальной гипоксемией, резистентной к обычным методам кислородотерапии, первичным повреждением альвеолярно-капиллярной мембраны, интерстициальным отеком легких, микроателектазированием и образованием в альвеолах и бронхиолах гиалиновых мембран (рис.11).
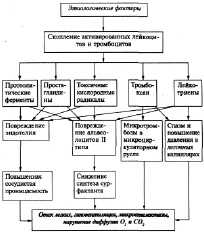
Рис.11. Патогенез РДСВ (А.Н. Окороков, 2005)
Он является завершающей фазой многообразных повреждений легких (инфекционными патологическими агентами, токсинами бактериального и небактериального происхождения, медиаторами альтерации. ОРДС может быть следствием травмы грудной клетки, ее длительного сдавления, аутоиммунных заболеваниях и т.д. Однако ОРДС клинически проявляется одышкой, кашлем, с выделением мокроты, имеющей примесь крови, мелкопузырчатыми влажными хрипами в легких, цианозом, не исчезающим даже при оксигенотерапии.
Первое описание клиники ОРДС было в 1946 году, однако название указанной патологии претерпело многочисленные изменения, включающие такие названия, как острое повреждение легких (ОПЛ), «мокрые легкие», «тяжелые легкие», «шоковые легкие», «фиброзирующий альвеолит», «некардиогенный отек легких». В 1967 Эсбахом было предложено название «острый респираторный дистресс синдром», характеризующийся крайне тяжелым острым повреждением легких. Отличительными признаками ОРДС являются:
1) острое начало;
2) снижение индекса оксигенации (PаO2/Fi O2 до 200 мм рт. ст., где Fi O2 - фракция кислорода во вдыхаемом воздухе);
3) двустороннее поражение легких на Ro;
4) давление заклинивания легочной артерии ≤ 18 мм. рт. ст.
ОРДС принято делить по степени тяжести, по величине индекса оксигенации (PаO2) на следующие формы:
– умеренное течение - PаO2/Fi O2 от 300 до 200 мм рт.ст.,
– течение средней тяжести - PаO2/Fi O2 от 200 мм.рт.ст.,
– тяжелый (критический) вариант патологии PаO2/Fi O2
Последний индекс оксигенации является достоверным показателем летального исхода.
Так, при умеренной степени ОРДС летальность достигает 30%, при средней степени возрастает до 34%, а при тяжелой – увеличивается до 45%.
Различают легочный, или первичный, ОРДС и внелегочный – неспецифический ОРДС.
Легочный или первичный ОРДС может развиться на терминальных стадиях первичных специфических поражений легких, в частности при астматическом статусе, остром респираторном синдроме, при пневмониях тяжелого течения, вызванных chlamidia, varicella, при системной красной волчанке, синдроме Гудпасчера. Одним из важных патогенетических факторов острого поражения легких при указанных формах патологии является искусственная вентиляция легких, вызывающая в ряде случаев перерастяжение альвеол, разрывы межальвеолярных перегородок, образование воздушных кист в легких, множественные микроателектазы. При этом повреждению в большей степени подвергаются менее поврежденные, сохранившие эластичность альвеолы.
Внелегочная форма ОРДС получила название «неспецифического поражения интактных легких», развивается на фоне длительных расстройств микроциркуляции в легких и тяжелой циркуляторной гипоксии.
Факторами риска развития внелегочной формы ОРДС являются:
1) различные по этиологии виды шока (травматический, геморрагический, септический, ожоговый);
2) синдром жировой эмболии;
3) острый деструктивный панкреатит;
4) длительное воздействие ряда лекарственных препаратов (сульфаниламиды, антибиотики, наркотики, кордарон);
5) длительная экстракорпоральная перфузия, массивная гемотрасфузия;
6) реперфузия ишемизированных тканей.
Развитие и тяжесть течения ОРДС зависит в определенной степени от характера генотипа, в частности от репликации гена FAAH, а также гена POPDC3.
Имеются данные, что у больных с одним из указанных факторов риска ОРДС развивается у 25% пациентов, а при наличии двух или более факторов риска частота развития ОРДС удваивается.
Для внелегочной формы ОРДС характерны следующие стадии развития:
1) экссудативная, острая, развивающаяся в течение 6 суток от начала процесса;
2) пролиферативная, подострая (4- 10 суток);
Различают три патоморфологических фазы РДСВ: острую, подострую и хроническую.
Острая фаза РДСВ длится 2-5 суток и характеризуется развитием интерстициального, а затем альвеолярного отека легких. В отечной жидкости содержатся белок, эритроциты, лейкоциты. Наряду с отеком выявляются поражение легочных капилляров и выраженное повреждение альвеолярного эпителия I и II типов. Повреждение альвеолоцитов II типа приводит к нарушению синтеза сурфактанта, вследствие чего развиваются микроателектазы. При благоприятном течении РДСВ через несколько дней острые явления стихают, отечная жидкость рассасывается. Однако такое благоприятное течение РДСВ наблюдается не всегда. У части больных РДСВ переходит в подострую и хроническую фазы.
Подострая фаза характеризуется интерстициальным и бронхоальвеолярным воспалением.
Хроническая фаза РДСВ — это фаза развития фиброзирующего альвеолита. В альвеолярно-капиллярной базальной мембране разрастается соединительная ткань, мембрана резко утолщается, уплощается, наблюдаются пролиферация фибробластов и усиленный синтез коллагена (его количество увеличивается в 2-3 раза). Выраженный интерстициальный фиброз может сформироваться уже через 2-3 недели. В хронической фазе имеют место изменения в сосудистом русле легких — запустевание сосудов, развитие микротромбозов. В конечном итоге развиваются хроническая легочная гипертензия и хроническая дыхательная недостаточность.
Читайте также:
