Врожденная гипофосфатазия
Добавил пользователь Дмитрий К. Обновлено: 08.01.2026
Краткое описание:
Щелочная фосфатаза – фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимических реакций в этих клетках (в кровеносном русле он не работает). При разрушении этих клеток их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность щелочной фосфатазы. Если гибнет много клеток, она может повышаться очень значительно. В костях щелочная фосфатаза образуется в специальных клетках – остеобластах, которые играют важную роль в формировании и обновлении костной ткани. Чем выше активность остеобластов, тем выше активность щелочной фосфатазы в крови, поэтому у детей и лиц, перенесших переломы костей, активность щелочной фосфатазы на высоком уровне.
Синонимы (rus): Фосфатаза щелочная.
Синонимы (eng): ALK PHOS, ALP, ALKP, alkaline phosphatase.
Метод: Кинетический колориметрический.
Единицы измерения: Ед/л (единица на литр).
Подготовка к исследованию:
• Не принимать пищу в течение 12 часов перед исследованием.
• Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
• Не курить в течение 30 минут до сдачи крови.
Тип биоматериала: Венозная кровь.
Тип пробирки: пробирка вакуумная с активатором свертывания и разделительным гелем (красная крышка с желтым кольцом).
Цена услуги:62 руб.
Сроки выполнения: один рабочий день.
Возраст, пол Референсные значения
3 мес – 1 год 122 – 469 Ед/л
1-10 лет 142 - 335 Ед/л
10-13 лет 129 - 417 Ед/л
13-15 лет женский 57 - 254 Ед/л
мужской 116 - 468 Ед/л
15-17 лет женский 50 - 117 Ед/л
мужской 82 - 331 Ед/л
17-19 лет женский 45 - 87 Ед/л
мужской 55 - 149 Ед/л
> 19 лет женский 35 - 105 Ед/л
мужской 40 - 130 Ед/л
Если показатели, полученные в результате других анализов, таких как тест на билирубин, аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ), тоже повышены, то увеличение активности щелочной фосфатазы в крови, возможно, связано с повреждением печени. Если изменены уровни кальция и фосфора, наиболее вероятная причина повышения щелочной фосфатазы – патология костной ткани.Повышение активности щелочной фосфатазы почти всегда означает поражение или вовлечение в патологический процесс печени, желчевыводящих путей или костей.Повышенные активности гамма-глутамилтранспептидазы (ГГТ) и 5-нуклеотидазы указывают на то, что повышение ЩФ обусловлено повреждением желчевыводящих путей.
Причины повышения активности щелочной фосфатазы:
1. Поражение печени и желчевыводящих путей.
• Механическая желтуха, связанная с непроходимостью желчевыводящих протоков.
o Камни желчных протоков, рубцы желчных протоков после хирургических вмешательств.
o Опухоли желчных протоков.
o Рак головки поджелудочной железы, рак желудка при механическом сдавливании общего желчного протока, через который желчь попадает в 12-перстную кишку.
• Рак печени, метастазы опухолей других органов в печень.
• Цирроз печени – патологический процесс, в ходе которого происходит замещение нормальной печеночной ткани рубцовой, что угнетает все функции печени.
• Гепатит любого происхождения (обычно ЩФ из-за него становится в 3 раза больше нормы).
• Инфекционный мононуклеоз – острая вирусная инфекция, проявляющаяся повышением температуры, воспалением зева и увеличением лимфоузлов. При этом в патологический процесс часто вовлекается печень.
• Первичный билиарный цирроз и первичный склерозирующий холангит – это редкие заболевания, которые встречаются у взрослых людей и связаны с аутоиммунным повреждением желчных ходов. Сопровождаются крайне высокой активностью щелочной фосфатазы и гамма-глутамилтрансферазы.
2. Поражение костей.
• Особенно высокая активность ЩФ (15-20 норм) отмечается при болезни Педжета. Это заболевание, которое сопровождается патологическим ростом костей и нарушением их структуры в определенных местах.
• Остеосаркома.
• Метастазы других опухолей в кости.
• Остеомаляция – размягчение костей, вызванное недостатком кальция.
3. Другие причины.
• Гиперпаратиреоз – гормональное заболевание, связанное с избыточным образованием паратгормона околощитовидными железами, что приводит к вымыванию кальция из костей.
• Инфаркт миокарда.
• Язвенный колит, перфорация кишечника (так как щелочная фосфатаза содержится в том числе и в клетках кишечника).
Причины понижения активности щелочной фосфатазы:
• Тяжелая анемия.
• Массивные переливания крови.
• Гипотиреоз – состояние, при котором снижена функция щитовидной железы.
• Недостаток магния и цинка.
• Гипофосфатазия – редкое врожденное заболевание, приводящее к размягчению костей.
• Выраженное снижение щелочной фосфатазы у беременных – признак недостаточности плаценты.
Гипофосфатазия: как заподозрить заболевание у ребенка? Клинические наблюдения
Цель статьи: описать особенности дифференциальной диагностики гипофосфатазии с рахитоподобными заболеваниями на примере нескольких клинических случаев.
Основные положения. Причиной гипофосфатазии является снижение активности щелочной фосфатазы (ЩФ), приводящее к поражению всех органов и тканей различной степени тяжести с многообразными проявлениями. Неспецифическая клиническая картина редкого наследственного метаболического заболевания, низкая осведомленность врачей о проблеме определяют трудности диагностики гипофосфатазии. Единственный метод патогенетического лечения гипофосфатазии — пожизненная ферментная заместительная терапия препаратом асфотаза альфа. В статье приведены клинические случаи перинатальной (более тяжелой) и детской формы заболевания.
Заключение. Наличие гипофосфатазии следует проверять у всех пациентов с признаками гипоминерализации костей в сочетании с полиорганными нарушениями и/или судорожным синдромом, патологией зубочелюстного аппарата и снижением активности ЩФ. Важно отметить, что показатели активности ЩФ имеют возрастные особенности, следовательно, лечащий врач должен убедиться, что сообщаемые лабораторией результаты отражают нормальный для пациента конкретного возраста уровень ЩФ.
Вклад авторов: Храмова Е.Б. — разработка дизайна статьи, проверка критически важного содержания, написание текста рукописи, утверждение рукописи для публикации; Левитина Е.В., Романенко Е.С. — обследование и лечение пациентов, написание текста рукописи; Супрунец С.Н., Гуркина Е.Ю. — обследование и лечение пациентов; Кучкина А.Ю. — обзор публикаций по теме статьи, написание текста рукописи.
Конфликт интересов: авторы заявляют об отсутствии возможного конфликта интересов.
В отечественных и зарубежных научных публикациях подробно описаны классификация, разнообразие клинических симптомов, принципы лабораторной диагностики и результаты молекулярно-генетических исследований при гипофосфатазии [1–4] . Очевидно, что гипофосфатазия является прогрессирующим наследственным метаболическим заболеванием, вызванным дефицитом щелочной фосфатазы (ЩФ), который возникает из-за мутации в гене ALPL , картированном на 1 хромосоме (1p36.12), кодирующем изофермент тканенеспецифичной ЩФ (ТНЩФ).
Патогенез гипофосфатазии достаточно хорошо изучен. В норме фермент ТНЩФ непосредственно влияет на отщепление фосфатной группы от неорганического пирофосфата, высвобождающийся неорганический фосфат связывается с кальцием, формируя кристаллы гидроксиапатита, необходимые для минерализации костного матрикса. В результате дефицита активности ТНЩФ неорганический пирофосфат не расщепляется и кристаллы гидроксиапатита не образуются, что, безусловно, приводит к нарушению минерализации костной ткани. В свою очередь, накапливающийся в плазме и тканях неорганический пирофосфат соединяется с аморфным фосфатом кальция с образованием кристаллов пирофосфата кальция, это вызывает нефрокальциноз или становится причиной артрита [5] .
Еще одной крайне важной функцией ТНЩФ является отщепление фосфора от пиридоксаль-5-фосфата, что делает возможным проникновение пиридоксаля через клеточные мембраны в ЦНС, где происходит повторное присоединение фосфата к пиридоксалю. Вновь образованный пиридоксаль-5-фосфат выступает в роли кофактора многих нейротрансмиттеров, а его дефицит в ЦНС приводит к развитию пиридоксин-зависимых судорог [6] .
В зависимости от возраста дебюта гипофосфатазии выделяют перинатальную форму (появление симптомов уже внутриутробно или сразу после рождения); младенческую, или инфантильную (появление симптомов в первые 6 месяцев жизни); детскую и взрослую формы (появление клинических симптомов соответственно до 18 лет и позже). Форма заболевания во многом определяет и тяжесть его течения — от 100% летальной (в отсутствие терапии) перинатальной формы до относительно легкого течения при взрослой форме.
Тяжелые формы гипофосфатазии развиваются, как правило, при наличии гомозиготной или компаунд-гетерозиготной мутации в гене ALPL . ЩФ экспрессируется на поверхности клеток как гомодимер, поэтому некоторые гетерозиготные мутации могут снижать активность всего гомодимера, приводя к доминантно негативному эффекту. Вследствие этого наличие мутации даже в одной аллели может провоцировать развитие заболевания.
У носителей одинаковой мутации в семье возможна различная степень тяжести заболевания, что указывает на наличие модулирующих факторов.
В некоторых случаях гипофосфатазии не удается обнаружить мутации в гене ALPL , поэтому для верификации диагноза ведущими критериями являются клинические признаки заболевания и снижение активности ЩФ ниже нормы для данного возраста и пола [7] .
Единственный метод патогенетического лечения гипофосфатазии — пожизненная ферментная заместительная терапия препаратом асфотаза альфа, которая представляет собой человеческий рекомбинантный тканенеспецифический химерный Fc-дека-аспартатный гликопротеин ЩФ. По данным литературы, применение асфотазы альфа при перинатальной форме гипофосфатазии способствует лучшей выживаемости пациентов по сравнению с таковой в группе контроля: 95% против 42% в возрасте 1 года, 84% против 27% в возрасте 5 лет соответственно (р < 0,0001 в модели Каплана — Мейера, оценивающей долю пациентов, проживших какое-либо время после приема некого лекарственного препарата) [7] .
Приводим описание клинических случаев гипофосфатазии у детей.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1
Мальчик Ч. переведен из ГБУЗ ТО «Перинатальный центр» (г. Тюмень) в отделение патологии новорожденных ГБУЗ ТО ОКБ № 2 (г. Тюмень) в возрасте 5 дней с диагнозом: Транзиторное тахипноэ у новорожденного. Врожденный порок развития — дефект костей черепа, аплазия теменных и височных костей. Гипофосфатазия? — для верификации диагноза и определения тактики терапии.
Из анамнеза жизни и заболевания известно, что ребенок родился от первых самостоятельных родов в сроке 38,3 недели, в головном предлежании, с оценкой по шкале Апгар 7–7 баллов. При рождении масса тела — 3570 г, длина — 54 см, окружность головы — 35 см, окружность грудной клетки — 34 см.
При УЗИ плода в сроке 29,6 недели диагностирована гипоплазия костей носа. При рождении обращали на себя внимание скелетные диспропорции, укорочение и деформация конечностей; грудная клетка уплощена, отсутствуют кости мозгового черепа (мембранозный череп). Через 2 часа после рождения отмечено тахипноэ, потребовавшее кратковременной респираторной поддержки.
На момент поступления в отделение патологии новорожденных состояние ребенка среднетяжелое, сознание ясное. Конечности укорочены, деформированы за счет внутриутробных переломов трубчатых костей, мембранозный череп, грудная клетка уплощена, обе половины грудной клетки симметрично участвуют в акте дыхания. Респираторных нарушений нет, частота дыхательных движений — 42 в мин. Сатурация кислородом — 98%. Диффузная мышечная гипотония, гипорефлексия, снижена двигательная активность. ЧСС — 148 в мин. Вскармливание грудное, объем питания по возрасту, усваивает.
Наиболее значимые для диагностики заболевания результаты обследования
Уровень фосфора — 2,21 ммоль/л (норма — 1,45–2,16 ммоль/л), кальция общего — 2,36 ммоль/л (норма — 2,2–2,5 ммоль/л), ЩФ — 28 Ед/л (норма — 53–128 Ед/л). Отмечаются стойкое повышение содержания фосфора и снижение уровня ЩФ в динамике, нарастание концентрации кальция в сыворотке до 3,1 ммоль/л, ионизированного кальция — до 1,7 ммоль/л. Содержание паратгормона, витамина D — в пределах референсных интервалов.
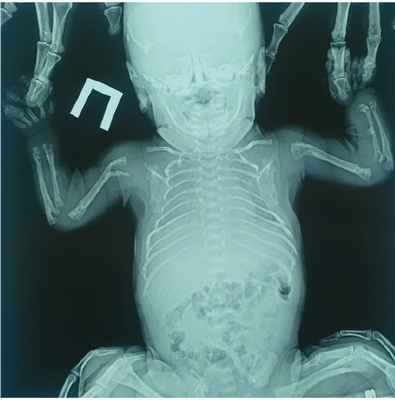
Рентгенография костей скелета: лобная кость представлена двумя пластинами, две пластины височных костей, множественные переломы ребер с обеих сторон, перелом грудинной трети правой ключицы без смещения, переломы дистальной и проксимальной третей плечевой, лучевой и локтевой кости справа и слева, переломы проксимального и дистального метаэпифиза обеих костей правой и левой голени. Деформированные седалищные кости, крылья и тело подвздошных костей. Трубчатые кости деформированы, со слабой периостальной костной реакцией, с грубой кистовидной перестройкой структуры. Ростковые зоны костей не определяются ( рис. 1 ).
Рис. 1. Рентгенография костей скелета и черепа пациента Ч. Фото авторов
Пациенту выполнено молекулярно-генетическое исследование (метод секвенирования нового поколения и секвенирование по Сэнгеру), выявлен вариант нуклеотидной последовательности c.1171delC в 10 экзоне гена ALPL (chr1:g.21902393AC>A; rs779683021) в гетерозиготном состоянии, также вариант нуклеотидной последовательности в 5 экзоне c.314C>T (chr1:g.21889619C>A; rs768348242) в гетерозиготном состоянии.
На основании клинико-лабораторного и молекулярно-генетического обследования верифицирован диагноз: Гипофосфатазия, перинатальная форма. Аплазия теменных костей, гипоплазия лобных, височных и затылочных костей. Множественные патологические переломы трубчатых костей, ребер, ключиц.
При обследовании матери пациента определен низкий уровень ЩФ — 32 Ед/л, аналогично и у отца — 20 Ед/л (норма — 40–150 Ед/л). Родители не имеют клинических проявлений метаболического заболевания, брак не родственный.
При молекулярно-генетическом обследовании матери пробанда выявлен патогенный вариант c.1171delC (p.Arg391ValfsTer12) в гетерозиготном состоянии в гене ALPL; у отца пробанда найден, вероятно, патогенный вариант c.302A>G (p.Ala105Val) в гетерозиготном состоянии в гене ALPL .
Обследование ребенка и родителей выполнялось в генетической лаборатории сектора клинико-генетических исследований Организационно-методического отдела по медицинской реабилитации ГБУЗ «Городская больница № 40» (начальник сектора — к. б. н. Глотов О.С.), г. Санкт-Петербург.
Пациенту назначена фермент-заместительная терапия препаратом асфотаза альфа в дозе 2 мг/кг подкожно 3 раза в неделю, переносит терапию удовлетворительно, нежелательные явления не отмечаются. Продолжено динамическое наблюдение.
КЛИНИЧЕСКИЙ СЛУЧАЙ 2
Девочка У. с 5 месяцев наблюдалась у невролога с мышечной слабостью, проходила курсы массажа и физиотерапии с незначительным положительным эффектом. Из анамнеза жизни: голову удерживает с 3 месяцев, сидит с 10 месяцев, ползает с 12 месяцев, ходит с поддержкой с 1 года 3 месяцев, к 18 месяцам ходит самостоятельно неуверенно, балансируя.
В связи с отставанием в формировании статико-моторных функций на фоне умеренной мышечной гипотонии с целью исключения рахитоподобного заболевания в возрасте 1 года 2 месяцев впервые определено содержвание ЩФ: оно оказалось сниженным до 98 Ед/л (при норме 156–369 Ед/л). Повторно обследована в 1 год 5 месяцев: уровень ЩФ — 102 Ед/л (норма — 108–317 Ед/л), кальция общего — 2,7 ммоль/л (норма — 1,9–2,6 ммоль/л), кальция ионизированного — 1,33 ммоль/л (норма — 1,12–1,32 ммоль/л), фосфора — 1,9 ммоль/л (норма — 1,29–2,26 ммоль/л), 25(ОН)D — 50 нг/мл (норма — 30–70 нг/мл), пиридоксина — 18,8 мкг/л (норма — 2,2–27,9 мкг/л), остеокальцина — 46,4 нг/мл (норма — 8,4–33,9 нг/мл).
Рентгенография трубчатых костей, кистей рук с захватом лучезапястных суставов: отставание костного возраста на один эпикризный срок с нарушением порядка окостенения, определяются псевдоэпифизы пястных костей, умеренный остеопороз костей голеней. УЗИ органов мочевой системы: утолщение паренхимы почек, большое количество мелкодисперсной взвеси в просвете мочевого пузыря.
Ребенку выполнено молекулярно-генетическое исследование — выявлен вариант нуклеотидной последовательности g.21902399del в гене ALPL в гетерозиготном состоянии (исследование производилось в лаборатории молекулярной генетики и клеточной биологии ФГБУ «НМИЦ здоровья детей» Минздрава России, заведующий лабораторией — к. б. н. Савостьянов К.В.). При обследовании родителей аналогичная мутация найдена у матери ребенка. Таким образом, у пациентки У. диагностирована гипофосфатазия, детская форма.
При осмотре в возрасте 2 лет 5 месяцев сохранялись умеренное снижение мышечного тонуса, неуверенная ходьба, незначительная деформация черепа. Ребенок не бегает, быстро устает, может подниматься по лестнице с поддержкой. Улучшилась мелкая моторика — берет в руку карандаш, стала работать с мелкими предметами.
Речь практически отсутствует, общается с помощью мимики, жестов, ведет за руку. Игровая деятельность не развита, активной сюжетной игры нет, иногда эпизоды вокальных реакций с эмоциональной окраской. Общение не активное, обычно играет одна, реагирует на контакты с близкими людьми, со сверстниками в игру не вступает. Инструкции понимает избирательно, большинство выполняет, чаще действует по подражанию.
Получает симптоматическую терапию. Решение вопроса о назначении фермент-заместительной терапии — при ухудшении состояния в динамике. Прогноз для жизни благоприятный.
КЛИНИЧЕСКИЙ СЛУЧАЙ 3
На момент обращения к детскому эндокринологу пациент Р. (возраст — 6 лет 4 месяца) и пациент А. (возраст — 1 год) имели однотипные жалобы: раннее выпадение молочных зубов без резорбции корня, быстрая утомляемость.
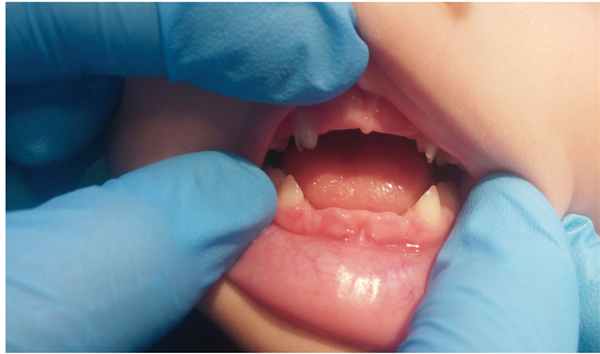
Данные анамнеза жизни и заболевания пациента Р.: ребенок от первой беременности, срочных оперативных родов (ягодичное предлежание плода). Масса при рождении — 3490 г, длина — 51 см, окружность головы — 36 см, оценка по шкале Апгар — 8–8 баллов. С возраста 1 месяца ребенок наблюдался ортопедом по поводу дисплазии тазобедренных суставов. С 12 месяцев у мальчика стали выпадать молочные зубы, появились боли в конечностях и быстрая утомляемость, неустойчивая походка и частые падения. Осмотрен стоматологом в возрасте 13 месяцев, заключение: Генерализованный пародонтит тяжелой степени. В течение второго года жизни продолжалась потеря молочных зубов ( рис. 2 ).
Рис. 2. Выпадение зубов без резорбции корня у пациента Р. в возрасте 2 лет. Фото авторов
К четырем годам пациент неоднократно перенес двусторонний экссудативный средний отит, имел двустороннюю кондуктивную тугоухость 1-й степени, хронический аденоидит. У ребенка сохранялись боли в конечностях, неустойчивая походка и частые падения, сформировалось нарушение осанки.
В 2018 г. в семье родился второй мальчик. Пациент А. от второй беременности, вторых срочных самостоятельных родов, масса тела — 3240 г, длина — 52 см, окружность головы — 36 см, оценка по шкале Апгар — 7–8 баллов. С возраста 1 месяца ребенок наблюдается по поводу врожденного стридора. По данным медицинской документации, в возрасте 3 месяцев у младенца диагностирован рахит легкой степени, назначены курс общего массажа и прием витамина D в дозе 3000 МЕ/сут в течение 1 месяца.
В 11 месяцев ребенок упал с высоты собственного роста, при этом у него выпали 2 нижних резца. Родители обратились к детскому эндокринологу для исключения наследственного заболевания у детей.
Пациентам выполнено комплексное обследование в рамках дифференциальной диагностики нарушений фосфорно-кальциевого обмена, основные результаты представлены в таблице .
Таблица
Результаты обследования пациентов Р. и А., имеющие непосредственное отношение к диагностике заболевания
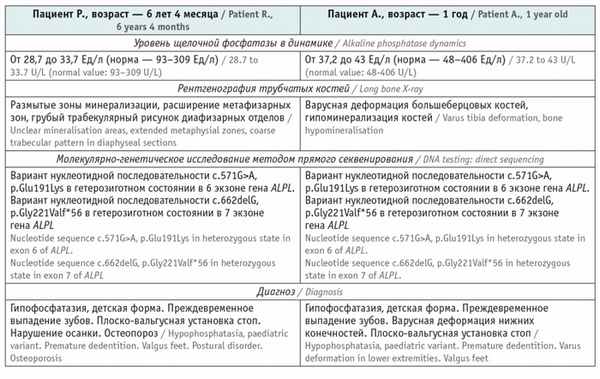
У матери пробандов уровень ЩФ — от 28,4 до 36 Ед/л (норма — 30–120 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования определен вариант нуклеотидной последовательности c.662delG, p.Gly221Valf*56 в гене ALPL в гетерозиготном состоянии. У отца пробандов концентрация ЩФ — 38 Ед/л (норма — 53–128 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования выявлен вариант нуклеотидной последовательности c.571G>A, p.Glu191Lys в гене ALPL в гетерозиготном состоянии. Родители пациентов Р. и А. не имеют клинических проявлений гипофосфатазии. Брак не родственный.
Больным Р. и А. рекомендовано проведение фермент-заместительной терапии препаратом асфотаза альфа в дозе 2 мг/кг массы тела путем подкожной инъекции 3 раза в неделю пожизненно. Продолжено динамическое наблюдение. Прогноз для жизни благоприятный.
Диагностика перинатальной формы гипофосфатазии не представляет особых затруднений. Наличие множественных внутриутробных переломов, деформации скелета, гипоминерализации костей, пиридоксин-зависимых судорог, дыхательной недостаточности и гипоплазии легких в сочетании с низким уровнем ЩФ при нормальных значениях паратгормона, витамина D, нормальном или повышенном уровне кальция в крови позволяют верифицировать диагноз, исключить другие формы хондродисплазий и несовершенный остеогенез.
Определение низкого уровня ЩФ будет отправной точкой в дифференциальной диагностике младенческой и детской форм гипофосфатазии с другими вариантами рахитоподобных заболеваний. Следует помнить, что преждевременное выпадение молочных зубов иногда является первым и даже единственным признаком гипофосфатазии. При этом выпадение зубов происходит без рассасывания корня, сопровождается уменьшением высоты альвеолярной кости и расширением корневых каналов.
Непрогрессирующая проксимальная миопатия может быть ранним признаком гипофосфатазии. Считается, что симптомы могут возникать в результате повышения уровня пирофосфата или из-за других, пока неизвестных факторов, которые способны ингибировать мышечную функцию. У детей с гипофосфатазией может быть «утиная» (ковыляющая) и замедленная походка [5] .
В описанных клинических случаях 2 и 3 признаки гипофосфатазии определялись уже в первом полугодии жизни, в дальнейшем появлялись новые симптомы, однако верификация диагноза произошла только в дошкольном возрасте. Нельзя исключить наличие младенческой формы заболевания в этих случаях.
Следует обратить внимание врачей на обязательную оценку уровня щелочной фосфатазы (ЩФ) как основополагающего лабораторного теста для подтверждения диагноза гипофосфатазии при дифференциальной диагностике метаболических заболеваний костей. Важно отметить, что показатели активности ЩФ имеют возрастные особенности, следовательно, лечащий врач должен убедиться, что сообщаемые лабораторией результаты отражают нормальный для пациента конкретного возраста уровень ЩФ.
Гипофосфатазия
Гипофосфатазия (ГФФ) – тяжелая прогрессирующая болезнь наследственного характера, характеризующаяся низким содержанием щелочной фосфатазы в сыворотке крови.

ГФФ наследственное заболевание, вследствие мутации гена (ALPL), который регулирует функцию синтеза щелочной фосфатазы (ЩФ), наблюдается низкое содержание ЩФ в крови.
ЩФ играет ключевую роль в образование костной ткани и сохранение постоянной минеральной плотности костей.
В норме, ЩФ способствует связыванию кальция и фосфора для образования минеральной части костной ткани.
У людей с ГФФ, уровень ЩФ очень низкий, поэтому наблюдается нарушение минерализации костной ткани.
Отмечается связывание и накопление кальция и фосфора в других участках организма, что ведет к разрушению костей и повреждению органов.
ЩФ играет важную роль в превращении ниже перечисленных субстратов, в другие продукты метаболизма, но вследствие нарушения данного процесса, происходит их накопление в костях и в органах:
- Пиридоксаль-5′-фосфат (либо витамин В6)
- Неорганические пирофосфат
- Фосфоэтаноламин
- Тяжесть проявлений гипофосфатазии различна. В одних случаях ее признаки видны уже при рождении, а рентгенологическое исследование плода позволяет диагностировать заболевание даже внутриутробно.
КЛАССИФИКАЦИЯ
- Пренатальная форма с мембранозным черепом, дефектами скелета и респираторным дистресс-синдромом, летальная в 100 % случаев.
- Ранняя инфантильная форма с рахитоподобными костными аномалиями, дистрофией, краниостенозом, нефрокальцинозом, смертность около 40 %.
- Инфантильно-ювенильная форма характеризуется преждевременным выпадением молочных зубов, рахитоподобными изменениями скелета и низким ростом. Летальность около 1 %.
- Взрослая форма имеет хороший прогноз и часто остается недиагностированной. Основными симптомами являются боли в костях и псевдопереломы.
КЛИНИЧЕСКИЕ СИМПТОМЫ
Хотя у людей с ГФФ обычно первыми симптомами являются поражение костей и зубов, но у них могут появиться проблемы и с головным мозгом, мышцами, суставами, легкими и почками.
В связи с обилием различных симптомов, люди с ГФФ могут даже не подозревать, что наличие всех имеющихся симптомов относятся одному всего лишь заболеванию.
- ломкие/хрупкие кости;
- рахит вследствие ГФФ;
- частые переломы костей;
- неправильное или замедленное сращение костей;
- деформации нижних конечностей;
- постоянные боли в костях.
- ранняя потеря зубов (до 5 лет), обычно выпадение целого зуба полностью с корнем;
- заболевания десен.
Мышцы и суставы:
- мышечная слабость;
- длительные и постоянные боли в мышцах и суставах;
- артрит (у взрослых и детей);
- псевдоподагра, в результате отложений кальция в суставах;
- Потеря самостоятельной ходьбы, передвижение с помощью вспомогательных устройств, таких как костыли, ходунки или на инвалидной коляске;
Легкие и грудная клетка:
- рахитическая деформация грудной клетки, которая (в зависимости от степени) может привести к недоразвитию легких;
- тяжелая дыхательная недостаточность, которая может потребовать вспомогательного дыхательного устройства (особенно у детей);
- пневмония.
- краниостеноз – преждевременное заращение швов между костями черепа, нарушает формирование черепа, и он приобретает неправильную форму. Данное состояние может потребовать хирургическую
- коррекцию;
- внутричерепные кровоизлияния;
- энцефалопатии;
- судороги (в особенности у детей раннего возраста).
У детей раннего возраста Судороги могут быть жизнеугрожающим состоянием. Если у Вашего ребенка наблюдаются судороги, которые связаны вследствие заболевания ГФФ, необходимо срочно связаться с Вашим лечащим врачом.
- Вследствие нарушение минерализации костной ткани, происходит гиперкальциемия и гиперфосфатемия, что в свою очередь может привести к нефрокальцинозу и последующему почечной недостаточности.
ДИАГНОСТИКА
Пациенты с Гипофосфатазией (ГФФ), часто неправильно диагностируется, так как клинические проявления ГФФ могут напоминать симптомы других, более часто встречающихся заболеваний костей.
Низкий активность щелочной фосфатазы (ЩФ) и высокая концентрация субстратов ЩФ, поможет дифференцировать ГФФ от других расстройств и может помочь обеспечить точный диагноз.
ЛЕЧЕНИЕ
В настоящее время единого установленного лечение при Гипофосфатазии не существует.
Не следует назначать:
- Высокие дозы витамина D, препараты кальция и бисфосфонаты, так как они могут привести к обострению симптомов.
Основная цель лечения является предотвращение развития осложнений или замедлить их прогрессирование.
- назначение витамина B6 у пациентов с судорогами;
- купирование болевого синдрома, назначением препаратов из группы НПВС;
- стоматологическое лечение;
- хирургическое лечение (при краниостенозе, при тяжелых деформациях костей конечностей).
Если у вас возникли вопросы по данной теме, Вы можете написать на электронный адрес врачей (указаны в разделе контакты отделения) или позвонить, мы постараемся ответить на все ваши вопросы.
Врожденная гипофосфатазия
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 125412 Москва, ул. Талдомская, 2
Референтные интервалы активности щелочной фосфатазы у детей в сыворотке крови. Лабораторная диагностика гипофосфатазии
Журнал: Лабораторная служба. 2015;4(1): 35‑41
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, 125412 Москва, ул. Талдомская, 2
Настоящие клинические рекомендации устанавливают диагностические и прогностические возможности измерения активности щелочной фосфатазы в сыворотке (плазме) крови человека и ее клиническую интерпретацию в соответствии с наличием различных клинических симптомов.
1. Методология
Методы, использованные для сбора/селекции доказательств
Доказательной базой для составления рекомендаций явился поиск в электронных базах данных PubMed и Mеdline. Данные клинические рекомендации подготовлены на основании международных и российских обзорных статей, рандомизированных исследований и опубликованных справочников. Глубина поиска составила 15 лет.
Методы, использованные для оценки качества и силы доказательств:
— оценка значимости в соответствии с рейтинговой системой.
Гипофосфатазия относится к редким наследственным заболеваниям, что исключает возможность проведения больших когортных и рандомизированных контролированных исследований, и для создания протоколов диагностики и терапии используются лишь тематические исследования экспертов, опубликованные в последние два десятилетия.
Клиническая информативность лабораторных исследований
Клиническая информативность лабораторных исследований определятся путем расчета операционных характеристик теста (диагностической чувствительности и специфичности — ДЧ и ДС, предсказательной ценности положительных и отрицательных результатов, отношения правдоподобия положительных и отрицательных результатов — ОППР и ОПОР) и с помощью ROC-анализа. Наиболее полезными являются лабораторные тесты с ОППР >5 и ОПОР 2 и ≤5, ОПОР >0,2 и ≤0,5; не имеющими пользы — с ОППР ≤2 и ОПОР >0,5.
Индикаторы доброкачественной практики (Good Practice Points — GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ
Экономический анализ не проводился, и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
— внешняя экспертная оценка;
— внутренняя экспертная оценка.
2. Введение
Аналитически надежное и клинически выверенное определение биологических маркеров патофизиологических процессов является основой развития лабораторной медицины, при этом важную роль играет стратификация референтных интервалов, которые позволяют правильно интерпретировать результаты лабораторных исследований. Данные лабораторной диагностики могут оказывать значительное влияние на принятие клинического решения и качество лечения. Поэтому очень важно, чтобы медицинские лаборатории проводили согласование полученных значений с референтными интервалами, используемыми в популяции пациентов, так как это является условием обеспечения надлежащей пользы применения лабораторных исследований в целом. К сожалению, в настоящее время существуют проблемы в части точности определения и применения референтных интервалов, что затрудняет интерпретацию результатов лабораторных тестов. Такие критические пробелы, без сомнения, могут являться причиной неточной или ошибочной диагностики многих заболеваний, особенно у детей и подростков.
Вышеуказанная проблема становится особенно актуальной, когда ошибочная интерпретация всего одного показателя может повлиять на постановку диагноза заболевания, связанного с патологией определяемого метаболита. В частности, именно такая ситуация наблюдается в настоящее время с заболеванием гипофосфатазией, основным биохимическим маркером которого является низкая активность щелочной фосфатазы.
3. Описание проблемы
Щелочная фосфатаза (ЩФ) человека — семейство изоферментов, кодируемых 4 различными генами. Три из 4 генов кодируют по одному изоферменту ЩФ, специфичному для тонкого кишечника (IAP), плаценты (PLAP) и зародышевых клеток (GCAP) соответственно [1]. Четвертый ген, TNSALP, кодирует изофермент тканенеспецифической ЩФ (ТНЩФ), экспрессирующийся во всех тканях. Различия каталитической активности ТНЩФ в печени, почках и костях возникают вследствие неодинакового посттрансляционного гликозилирования [1]. Ген TNSALP располагается на коротком плече хромосомы (1p36.1−34) и состоит из 12 экзонов, занимающих 50 тыс. нуклеотидов [2, 3]. В настоящий момент с ГФФ связывают 267 различных мутаций и 16 полиморфизмов гена TNSALP [4]. Большинство (74,5%) мутаций относится к миссенс-мутациям.
ЩФ — это фермент, связанный с клеточной мембраной якорем в виде гликофосфатидилинозитола, и представляющий собой Zn 2+ -металлопротеиназу, физиологически активную в димерной форме, которая расщепляет несколько фосфорилированных соединений, в том числе неорганический пирофосфат (НПФ), пиридоксаль-5’-фосфат (ПЛФ) и фосфоэтаноламин (ФЭА) [1]. Обязательным кофактором данного процесса служит Mg 2+ . Недостаточная активность ЩФ приводит к накоплению в организме указанных субстратов, что ведет к нарушению минерализации костей, зубов и другим системным осложнениям [5].
ЩФ имеет оптимум pH в довольно высоком диапазоне >9. Щелочной pH характерен для поверхности двенадцатиперстной кишки и, возможно, для поверхности остеокластов в компартментах костной ткани [6]. Синтетический препарат p-нитрофенил фосфата стал наиболее часто используемым субстратом для кинетических исследований ЩФ из-за простого спектрофотометрического анализа (A) [7].
ЩФ присутствует в изобилии в сыворотке крови. Источником примерно 95% циркулирующей ЩФ у здоровых людей являются кости и печень [8]. Многочисленные исследования подтверждают клиническую значимость ЩФ в качестве маркера для различных заболеваний, включая патологии костей и болезни печени [9, 10].
Соответственно при таких заболеваниях и состояниях, как недоедание, глютеновая болезнь, дефицит фолатов/злокачественная анемия, цинк/магний дефицит, гипотиреоидизм/гипопаратиреоидизм, дефицит витамина С, избыток потребления витамина Д, ахондроплазия и кретинизм, при повторяющихся энтеритах, избыток глюкокортикоидов, недостаточность витамина В 6 , во время беременности при недостаточности развития плаценты, а так же при генетическом заболевании — гипофосфатазии, может снижаться активность ЩФ [11, 12].
Повышение ЩФ может быть при таких состояниях, как опухоли костной ткани, саркома, метастазы рака в кости, гиперпаратиреоз, миеломная болезнь, лимфогранулематоз с поражением костей, инфекционный мононуклеоз, рахит, заболевания печени и желчных протоков, «холестатические» состояния (цирроз, рак, инфекционный гепатит, туберкулез, опухоли желчевыводящих путей), инфаркт легкого, инфаркт почки. Повышение Щ.Ф. происходит в последнем триместре беременности, после менопаузы, при недостатке кальция и фосфатов в пище, от передозировки витамина С, а так же как следствие приема некоторых лекарственных препаратов (оральных контрацептивов, содержащих эстроген и прогестерон, антибиотиков и других) [18, 19].

Таблица 1. Рейтинговая схема для оценки силы рекомендации Примечание. РКИ — рандомизированное контролируемое исследование.
Помимо патологических состояний, уровень ЩФ в плазме крови сильно отличается у здоровых людей в зависимости от возраста и пола (А). Американской ассоциацией клинической химии (AACC) были отработаны и представлены референтные значения ЩФ в зависимости от возраста и пола, начиная с новорожденных детей (табл. 2) (А) [13].

Таблица 2. Интервалы активности ЩФ в сыворотке крови в зависимости от возраста и пола, Ед/л*
Однако основной проблемой при измерении и интерпретации активности ЩФ в отечественной лабораторной службе является частое отсутствие нижней границы референтного интервала активности Щ.Ф. Зачастую происходит сравнение полученных показателей ЩФ только с верхним значением референтного интервала, то есть внимание специалиста акцентировано на патологии, связанной с повышенным уровнем активности Щ.Ф. Такое возможно не только при недостаточной компетенции самих работников лаборатории, но и в результате не предоставления информации самими производителями диагностических наборов для определения активности Щ.Ф. Часто в инструкции к диагностическому набору указана только верхняя референтная граница, что автоматически предполагает отсутствие патологических низких значений Щ.Ф. Следствием этого является возможность пропуска патологии, связанной с низким уровнем ЩФ, например, такого тяжелого заболевания, как гипофосфатазия, где именно низкая активность ЩФ является причиной всех клинических проявлений, что указано в самом названии болезни.
4. Описание заболевания «Гипофосфатазия»
Гипофосфатазия (ГФФ) — это редкое врожденное метаболическое заболевание, проявляющееся нарушением минерализации костей и зубов, а также системными осложнениями, включая нарушение дыхания, судороги, мышечную слабость, боль в костях и нефрокальциноз (табл. 3) [14, 15]. Причиной ГФФ служат инактивирующие мутации в гене ТНЩФ, в результате которых снижается ее активность [14].
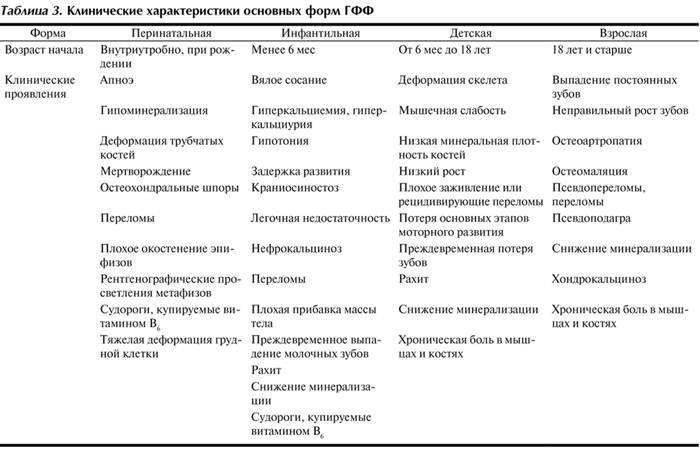
Таблица 3. Клинические характеристики основных форм ГФФ
Тяжесть заболевания чаще всего обратно пропорциональна возрасту начала заболевания, в наиболее тяжелых случаях смерть наступает внутриутробно или вскоре после рождения [14]. Поэтому клинические формы ГФФ разделены по возрасту проявления клинических симптомов, что привело к разделению ГФФ на перинатальную, инфантильную, детскую и взрослую формы. Дополнительно выделяют еще одну форму заболевания — одонтогипофосфатазию, которую расценивают как наименее тяжелую форму ГФФ, поражающую зубы; при этом признаки патологии скелета отсутствуют. Данная форма ГФФ проявляется спонтанным выпадением молочных зубов с неповрежденными корнями или сильным кариесом, увеличением пульповых камер и корневых каналов [16].
Основной диагностический критерий ГФФ — низкий уровень ЩФ в сыворотке [14]. В большинстве случаев диагноз можно поставить по низкой̆ активности ЩФ сыворотки в сочетании с физикальными и рентгенографическими признаками, характерными для ГФФ [14]. При оценке уровня ЩФ сыворотки необходимо учитывать возрастные и половые особенности (степень рекомендации A).
Возможность использования альтернативных биохимических маркеров при снижении активности ЩФ
Недостаточная активность ЩФ приводит к накоплению в организме указанных ниже субстратов, что ведет к нарушению минерализации костей, зубов и другим системным осложнениям [14].
Неорганический пирофосфат (НПФ)
При ГФФ высокая концентрация НПФ во внеклеточном пространстве приводит к накоплению вещества вокруг мембранных везикул, где происходит его поглощение как аморфным фосфатом кальция (что предотвращает формирование нового гидроксиапатита), так и существующими кристаллами гидроксиапатита (предотвращает рост и отложение гидроксиапатита), т. е. подавляет минерализацию скелета, вызывая рахит или остеомаляцию, несмотря на нормальный или повышенный уровень циркулирующего кальция и неорганического фосфата [17]. Доказательство того факта, что повышение уровня НПФ в плазме и моче у пациентов с ГФФ возникает как прямое следствие недостаточной активности ЩФ, помогло объяснить нарушение минерализации скелета у пациентов с ГФФ [5]. Рутинное клиническое определение НПФ недоступно, в настоящее время оно применяется только в научных исследованиях.
Пиридоксаль-5’-фосфат (ПЛФ)
ПЛФ — основная циркулирующая форма витамина В 6 , необходимый компонент многих ферментативных процессов в клетках. После попадания в организм различные формы витамина В 6 (такие как пиридоксин, пиридоксаль, пиридоксамин) подвергаются всасыванию из желудочно-кишечного тракта и превращаются в печени в ПЛФ, высвобождающийся в кровоток [1, 14]. Для попадания в ткани и проникновения через гематоэнцефалический барьер ПЛФ необходимо пройти дефосфорилирование до пиридоксаля с помощью ЩФ, после чего происходит обратное рефосфорилирование до ПЛФ или конвертация в пиридоксамин-5-фосфат. Каждое из данных веществ выступает кофактором различных внутриклеточных ферментативных реакций, включая активность глутамата декарбоксилазы и синтез нейротрансмиттеров серотонина и γ-аминомасляной кислоты (ГАМК). Купируемые витамином В 6 судороги, наблюдаемые у наиболее тяжелых больных ГФФ, чаще всего становятся результатом дефицита ПЛФ в ЦНС. Тот факт, что у наиболее тяжелых пациентов с ГФФ наблюдается нормальная или немного повышенная концентрация пиридоксаля в плазме, отсутствуют существенные нарушения статуса витамина В 6 , а также редкость возникновения судорог, свидетельствует о другом механизме дефосфорилирования ПЛФ во внеклеточном пространстве [14, 18, 19]. ПЛФ измеряется при рутинном клиническом исследовании, которое чаще всего называют определением витамина В 6 .
Фосфоэтаноламин (ФЭА)
При ГФФ часто наблюдается повышение уровня ФЭА в плазме и моче [18]. ФЭА — компонент фосфатидилинозитолгликанового якоря, связывающего белки с клеточной поверхностью. Следовательно, ФЭА может накапливаться из-за деградации якоря. При другом варианте за избыток ФЭА отвечает печень, которая в норме метаболизирует ФЭА в реакции, контролируемой О-фосфорилэтаноламинфосфолипазой; при этом требуется ПЛФ в качестве кофактора [5, 14]. Определение ФЭА в моче доступно для большинства лабораторий.
5. Рекомендации по дифференциальной диагностике ГФФ и заболеваний костной системы
В результате представленного описания биохимических маркеров, связанных с активностью ЩФ, к типичным биохимическим признакам ГФФ относятся низкая активность ЩФ в сыворотке, повышение уровня ПЛФ в плазме, НПФ в сыворотке и ФЭА в сыворотке или моче (табл. 4) (A). Интересно отметить, что в отличие от других форм рахита или остеомаляции повышение уровня ПЛФ наблюдается только при ГФФ [14]. Специфические изменения, связанные с ГФФ, и доступность в качестве рутинного клинического анализа (чаще называемого уровнем витамина B 6 ) делают повышение уровня ПЛФ наряду с низким уровнем ЩФ в сыворотке наиболее простым тестом для лабораторной диагностики ГФФ (B).

Таблица 4. Лабораторная диагностика заболеваний костной системы (A) [20]
Как правило, чем тяжелее форма ГФФ, тем ниже концентрация ЩФ в сыворотке и выше концентрация ПЛФ в плазме. Повышение уровня ФЭА в сыворотке или моче также подтверждает диагноз ГФФ; однако определение уровня ФЭА вне специализированных лабораторий не проводится; повышение уровня ФЭА может наблюдаться и при других заболеваниях, включая иные метаболические заболевания костей. Лабораторное определение уровня НПФ в настоящее время применяют только в научных исследованиях.
В отличие от практически всех других рахитоподобных заболеваний уровень кальция и неорганического фосфата (НФ) сыворотки при ГФФ не снижается. Это можно использовать при проведении дифференциальной диагностики. При инфантильной форме ГФФ нередко отмечается гиперкальциемия и гиперкальциурия, сопровождаемые нефрокальцинозом; наблюдается снижение уровня паратиреоидного гормона (ПТГ) в сыворотке, что сопровождается гиперфосфатемией. При детской форме ГФФ часто наблюдается гиперкальциурия, иногда сопровождающаяся низким уровнем циркулирующего ПТГ; уровень 25-гидрокси- и 1,25-дигидроксихолекальциферола остается без изменений. Гиперкальциемия при детской форме ГФФ встречается редко, однако при возникновении данного симптома также отмечается низкий уровень ПТГ и 1,25-дигидроксихолекальциферола в сыворотке. При детской и взрослой формах ГФФ уровень НФ ЩФ в сыворотке может повышаться относительно средних показателей у здорового человека того же возраста; гиперфосфатемия наблюдается приблизительно в 50% случаев. У пациентов с детской или взрослой формой ГФФ уровень кальция обычно не изменен.
Генетическое исследование
Выявление мутаций в гене ЩФ однозначно определит вовлеченность ЩФ в развитие патологического процесса у пациента. Рекомендуется проведение полного анализа гена ALPL (ген, кодирующий фермент НТИЩФ) методом прямого секвенирования. Данное исследование является важным при постановке диагноза «гипофосфатазия», поскольку присутствует несогласованность в использовании референтных значений по активности ЩФ, а также разнообразие состояний, при которых происходит снижение ее активности, поэтому генетическое тестирование поможет поставить окончательно верный диагноз и подтвердить или опровергнуть заболевание (В). Дополнительно анализ мутаций может помочь при постановке диагноза у пациентов с легкими формами ГФФ, у которых лабораторные показатели биохимических маркеров не могут его подтвердить. Генетическое исследование может помочь при консультации родителей больных детей, которых необходимо информировать о возможном типе наследования на случай, если пара планирует рождение следующего ребенка.
Заключение
Референтные интервалы позволяют получить ценную информацию, используемую медицинскими экспертами для интерпретации результатов количественных лабораторных тестов, следовательно, референтные интервалы критически важны для оценки здоровья пациентов и принятия клинического решения. Референтный интервал для анализируемого вещества соответствует статистическим границам значений, устанавливаемых при проведении исследования референтных интервалов, где учитываются 95% показателей, расположенных в центре кривой распределения, при этом в качестве данных используют результаты анализов здоровых представителей референтной популяции (степень рекомендации A) [21]. На основании полученных данных делается вывод, что результат, выпадающий за пределы референтного интервала, может представлять собой отклонение от нормы. Следовательно, референтный интервал является «стандартом» здоровья, с которым необходимо сравнивать результат теста пациента (степень рекомендации A).
6. Рекомендации по измерению активности ЩФ
Поскольку референтные интервалы активности ЩФ уже определены, а актуальность заболевания ГФФ как никогда высока, то становится очевидным использование двух основных положений, которые нужно соблюдать при измерении активности ЩФ, помимо правильного выполнения самого исследования:
1. Использовать референтные интервалы с нижним и верхним пределами (степень рекомендации A).
2. Применять соответствующие референтные интервалы согласно возрастным и половым характеристикам пациента (степень рекомендации A).
Врожденная гипофосфатазия
Детская форма гипофосфатазии в реальной клинической практике
Гипофосфатазия (ГФФ) — редкое врожденное рахитоподобное заболевание, обусловленное снижением активности тканенеспецифической щелочной фосфатазы (ЩФ). Для ГФФ характерны нарушение минерализации скелета, костные деформации, выпадение зубов в раннем детском возрасте, дыхательные расстройства и неврологические нарушения. В зависимости от времени манифестации заболевания выделяют перинатальную (первые проявления во внутриутробном периоде или при рождении), инфантильную (манифестация до 6 мес.), детскую (с 6 мес. до 18 лет) и взрослую (18 лет и старше) формы ГФФ. Степень тяжести проявлений обычно обратно пропорциональна возрасту дебюта болезни.
Целью работы стало описание клинического случая ГФФ, манифестировавшего в детском возрасте, и выявление клинических симптомов, наиболее типичных для детской формы ГФФ.
Описание клинического случая
Пациент — мальчик 2016 года рождения, от беременности, протекавшей на фоне хронической внутриутробной гипоксии. Появился на свет после срочных самостоятельных родов с нормальными массо-ростовыми показателями (3800 г, 52 см), оценка по шкале Апгар — 8/9 баллов. На грудном вскармливании до 3 месяцев. Профилактические прививки по национальному календарю, без реакций. Травм и операций не было. Аллергоанамнез не отягощен. Родители среднего роста (мать — 160 см, отец — 170 см). Эндокринные заболевания у ближайших родственников не выявлены.
Ребенок с рождения наблюдался ортопедом по поводу врожденной левосторонней косолапости, в связи с чем проводилось консервативное лечение с положительной динамикой. Кроме этого, пациент был неоднократно осмотрен неврологом по поводу диффузной мышечной гипотонии, на фоне которой отмечалась задержка моторного развития. На первом году жизни также обращали на себя внимание частые респираторные инфекции и бронхиты, в 1 год 1 месяц ребенок перенес пневмонию.
В 2,5 года ребенка впервые проконсультировал детский эндокринолог в Детской городской поликлинике № 6 г. Калининграда, выявлено снижение уровня ЩФ, и по совокупности клинических, рентгенологических и лабораторных данных диагностирована ГФФ. В дальнейшем диагноз был подтвержден молекулярно-генетически: в гене ALPL найдена компаунд-гетерозиготная мутация с.571 G>A/с.144_148dup.
Повторное обследование, проведенное в детском эндокринологическом отделении Университетской детской клинической больницы ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» в возрасте 3,5 года, подтвердило выраженную задержку роста — рост 87 см соответствует –2,55 стандартного отклонения (SD), масса тела соответствует верхней границе нормы — 14 кг (ИМТ — 18,5 кг/м 2 или +2,04 SD). При осмотре обращает на себя внимание отсутствие 7 зубов.
Заключение.
Характерными проявлениями детской формы гипофосфатазии являются задержка роста и мышечная гипотония, которая может приводить к задержке моторного развития и нарушению походки; боли в мышцах и выраженная утомляемость, ограничивающие время ходьбы; рахитические деформации, в том числе вальгусные деформации нижних конечностей; раннее выпадение молочных зубов с неизмененным корнем, дыхательные расстройства и частые бронхолегочные заболевания.
Диагноз может быть установлен на основании данных анамнеза, характерной клинической картины, результатов рентгенологического и лабораторного исследований (выраженное снижение уровня щелочной фосфотазы (ЩФ) и подтвержден данными молекулярно-генетического исследования.
Тяжесть состояния пациента в описанном клиническом случае обусловлена снижением уровня ЩФ, олигодонтией (с момента манифестации заболевания выпали 7 молочных зубов), задержкой роста, выраженными рахитическими деформациями грудной клетки, которые повышают риск рецидивирующих респираторных заболеваний; деформацией нижних конечностей, мышечной гипотонией, ограничивающими возможность самостоятельного передвижения ребенка (нарушение походки по парапаретическому типу, самостоятельно проходит не более 10 метров), тяжелым нарушением минерализации костной ткани, согласно рентгенографии.
Опираясь на данные литературы, можно предположить, что назначение патогенетической фермент-заместительной терапии препаратом асфотазы альфа позволит улучшить качество жизни ребенка благодаря регрессу симптомов заболевания.
Читайте также:
