Врожденные гемолитические анемии. Нарушения захвата билирубина у новорожденного
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Гемолитическая болезнь плода и новорожденного (ГБН) – изоиммунная гемолитическая анемия, возникающая в случаях несовместимости крови матери и плода по эритроцитарным антигенам, при этом антигены локализуются на эритроцитах плода, а антитела на них вырабатываются в организме матери. [1,2]
Название протокола: Гемолитическая болезнь плода и новорожденного
Код протокола:
Код(ы) МКБ-10:
Р55 Гемолитическая болезнь плода и новорожденного
Р 55.0 Резус – изоиммунизация плода и новорожденного
Р 55.1 АВО - изоиммунизация плода и новорожденного
Р 55.8 Другие формы гемолитической болезни плода и новорожденного
Р 55.9 Гемолитическая болезнь плода и новорожденного неуточненная
Р 56 Водянка плода, обусловленная гемолитической болезнью.
Р56.0 Водянка плода, обусловленная изоиммунизацией
Р56.9 Водянка плода, обусловленная другой и неуточненной гемолитической болезнью
Р 57 Ядерная желтуха
Р 57.0 Ядерная желтуха, обусловленная изоиммунизацией
Р 57.8 Другие уточненные формы ядерной желтухи
Р 57.9 Ядерная желтуха неуточненная.
Сокращения, используемые в протоколе:
Аг – антиген
Ат – антитело
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ВИЧ – вирус иммунодефицита человека
Ht – гематокрит
ГБН – гемолитическая болезнь новорожденного
Г6ФДГ – глюкозо-6-фосфат-дегидрогеназа
ГГТ – гаммаглутамилтрансфераза
ДВС – диссеминированное внутрисосудистое свертывание
Жкт – желудочно-кишечный тракт
Ig – иммуноглобулин
КТГ – кардиотокография плода
НБ – непрямой билирубин
ОБС – общий билирубин сыворотки
ОЗПК – операция заменого переливания крови
ОЦК – объем циркулирующей крови
ОПН – отделение патологии новорожденных
ПБ – прямой билирубин
СЗП – свежезамороженная плазма
ТКБ – транскутанная билирубин метрия
ЩФ – щелочная фосфатаза
ЭМ – эритроцитарная масса
Дата разработки протокола: 2014 год.
Категория пациентов: новорожденные.
Пользователи протокола: неонатологии, анестезиологи-реаниматологи (детский), гематологи, трансфузиологии, педиатры, врачи общей практики, врачи скорой и неотложной медицинской помощи.
Примечание: в данном протоколе используются следующие классы рекомендаций и уровни доказательств
Классы рекомендаций
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и/или общепризнаны
Класс II - противоречивые данные и/или расхождение мнений по поводу пользы/эффективности лечения
Класс II а – имеющиеся данные свидетельствуют о пользе/эффективности лечебного воздействия
Класс II б – польза-эффективность менее убедительны
Класс III - имеющиеся данные или общее мнение свидетельствуют о том, что лечение неполезно/неэффективно и, в некоторых случаях может быть вредным
Уровни доказательства эффективности:
А – результаты многочисленных рандомизированных клинических исследований или мета-анализа
В - результаты одного рандомизированного клинического исследования или крупных нерандомизированных исследований
С – общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Врожденные гемолитические анемии. Нарушения захвата билирубина у новорожденного
Лечение гемолитической болезни новорожденных. Показания к фототерапии при высоком билирубине
При антенатальной диагностике тяжелой формы гемолитической болезни новорожденных (ГБН) возможно заменное переливание крови внутриутробному плоду (кордоцентез; как правило, после рождения проводится повторное ЗПК).
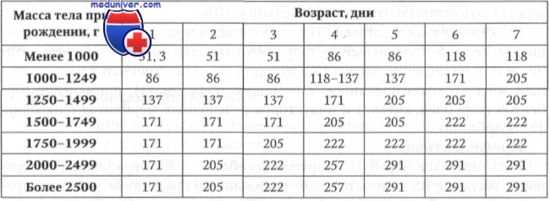
Постнатальная терапия тяжелых форм гемолитической болезни новорожденных (ГБН) предполагает обязательное проведение операции заменного переливания крови. Показания для проведения заменного переливания в зависимости от массы тела при рождении, возраста ребенка и уровня непрямого билирубина представлены в таблице 2.1.3, иногда вместо ЗПК используется гемосорбция или плазмаферез. Абсолютным показанием для ЗПК у доношенных детей является уровень билирубина в пуповинной крови выше 60 мкмоль/л и почасовой его прирост более 6 мкмоль/л/час, а также анемия при рождении (НВ менее 100 г/л). При резус-конфликте используется одногруппная резус-отрицательная кровь, заготовленная не ранее чем за 2-3 дня до переливания, в количестве 170-180 мл на кг массы ребенка. При АВО-конфликте переливают кровь O(I) группы.
Таблица для определения показаний к обменному переливанию крови разработана в Медицинском центре университета штата Кентукки в помощь неонатологам для решения вопроса о сроках проведения обменного переливания крови новорожденным первых 7 дней жизни.
Таблица для определения показаний для фототерапии при высоком билирубине разработана в Медицинском центре университета штата Кентукки в помощь неонатологам для решения вопроса о сроках проведения фототерапии новорожденным первых 7 дней жизни.
Показания к проведению фототерапии при высоком билирубине у новорожденного:
• Все формы тяжелых конъюгационных гипербилирубинемий (в т. ч. у недоношенных детей).
• Нетяжелые формы ГБН, при уровне билирубина = 221 в 1-2 день жизни у доношенных и 85-170 у недоношенных, далее 250-360 мкмоль/л у здоровых, причем для недоношенных 250 мкмоль/л.
• После 1-го ОПК в течение 24-48 часов при пост, контроле уровня билирубина.
• Предупреждение повторных ОПК при тяжелых ГБН.
• Профилактическое облучение всех недоношенных новорожденных с массой тела до 1250 г.
Окончание фототерапии у новорожденного:
1. Уровень билирубина низкий для исключения риска развития ЯЖ (для недоношенных 85-136 ммоль/л).
2. Нет факторов риска для новорожденного.
3. Ребенок достиг возраста, при котором способен самостоятельно метаболизировать Б.
Из побочных эффектов фототерапии: диарея, лактазная недостаточность, гемолиз, ожоги кожи, дегидратация, кожная сыпь и загар.
При легких формах и средней тяжести гемолитической болезни новорожденных (ГБН) проводится консервативная терапия — наиболее широко используемый способ консервативного лечения ГБН в настоящее время — это фототерапия (лампы зеленого, голубого и дневного света). Показания к фототерапии и алгоритм ее использования представлены в таблицах 4 и 5. У детей с тяжелыми формами ГБН фототерапия может быть использована дополнительно к ЗПК.
Консервативная терапия гемолитической болезни новорожденных (ГБН) предполагает также инфузионную коррекцию (в/венно 5-процентный раствор глюкозы, альбумин), достаточное питание и питье (введение жидкости в желудок через постоянный назогастральный зонд —пролонгированное, с помощью инфузомата), применение сорбентов (карболен, смекта) и индукторов печеночных ферментов (зиксорин, фенобарбитал).
Профилактика гемолитической болезни новоорожденных включает борьбу с абортами (особенно у Rh-отрицательных женщин), введение Rh-отрицательным родильницам сразу после родов антирезус-глобулина; беременным с высокими титрами антител проводят подсадку кожи мужа, плазмаферез, досрочное родоразрешение.
Желтухи новорожденных при повышенной продукции билирубина. Гемолитическая болезнь новорожденных (ГБН)
Наиболее частое заболевание из этой группы — гемолитическая болезнь новорожденных вследствие несовместимости крови плода и матери по резус-или групповым антигенам АВО, очень редко по другим антигенным системам крови (Kell, Duffi, Kidd и др.).
Гемолитическая болезнь новорожденных (ГБН) развивается лишь в 3-5% случаев несовместимости плода и матери (резус-отрицательная мать и резус-положительный ребенок, 0-группа у матери и А или В у ребенка). Имеет значение предыдущая сенсибилизация (предшествующие беременности, осложнения настоящей беременности, гемотрансфузии.
Патогенез гемолитической болезни новорожденных запускается проникновением эритроцитов плода трансплацентарно в кровоток матери, что приводит к продукции ею антирезус- или антигрупповых антител, которые перед рождением ребенка и в родах попадают в его кровоток и вызывают избыточный гемолиз его эритроцитов — развивается гипербилирубинемия за счет непрямого (неконъюгированного) билирубина.
Если антиэритроцитарные антитела массивно проникали к плоду задолго до наступления родов, плод может погибнуть внутриутробно и подвергнуться мацерации, или развивается крайне тяжелая форма ГБН (отечная). Наиболее часто антитела поступают к плоду во время родов, когда барьерные функции плаценты резко нарушаются. Поэтому ребенок рождается без желтухи, но на протяжении первых часов жизни желтуха появляется и нарастает. Антиэритроцитарные антитела могут находиться и в материнском молоке, поэтому прикладывание ребенка к груди может усилить желтуху.

Снижение конъюгационной функции печени, характерное для всех новорожденных и особенно для недоношенных детей, усугубляет гипербилирубинемию. Высокая концентрация билирубина оказывает токсическое влияние на все органы и системы ребенка, но ведущее клиническое значение имеет поражение ЦНС (прокрашивание базальных ганглиев, ядер зрительного бугра и некоторых других подкорковых структур (т. н. «ядерная желтуха»). У доношенных детей риск развития ядерной желтухи появляется при уровне билирубина сыворотки свыше 400 мкмоль/л, у маловесных недоношенных — иногда уже при 170 мкмоль/л.
Токсическим действием на нервную систему обладает непрямой билирубин, в указанных областях мозга его повышенная концентрация вызывает нейрональный некроз и процессы демиелинизации. Начальные стадии билирубинового поражения ЦНС могут быть обратимыми. Клинические формы ГБН: отечная, желтушная и анемическая — выделяются в зависимости от выраженности гипербилирубинемии и анемии и включают оценку степени тяжести ГБН. Наиболее тяжелая форма — отечная, сопровождается нарушениями жизнедеятельности всех систем, гепатоспленомегалией, асцитом, геморрагическим синдромом, тяжелой анемией, легочно-сердечной недостаточностью.
Летальность при этой форме достигает 50 %, у выживших детей развивается тяжелое органическое поражение головного мозга, иногда — цирроз печени.
Наиболее часто встречается желтушная форма гемолитической болезни новорожденных: при Rh-конфликте желтуха появляется в первые 6-12 часов жизни, при АВО-несовместимости — на 2-3 день жизни. В зависимости от массивности гемолиза могут наблюдаться гепатоспленомегалия, нарушения общего состояния ребенка (вялость, адинамия). В первые дни жизни ребенка гипербилирубинемия обусловлена за счет непрямого билирубина, с 5-7 дня жизни в связи с вторичными нарушениями функции печени и синдромом «сгущения желчи» нарастает уровень прямого билирубина. В анализе крови выявляется анемия, могут отмечаться: лейкоцитоз, тромбоцитопения, ретикулоцитоз.
Билирубиновая энцефалопатия при поражении подкорковых структур обычно начинает проявляться на 3-6 день жизни. Вначале отмечается общая вялость, мышечная гипотония, монотонный крик, затем появляются основные признаки ядерной желтухи — общая напряженность, ригидность затылочных мышц, опистотонус, периодическое возбуждение, тремор, судороги, грубый симптом Грефе, нарушения дыхания и гемодинамики. Клиническая картина неврологических нарушений преимущественно формируется на 3-5 месяцах жизни (ДЦП, хореоатетоз, глухота, задержка интеллектуального развития).
Анемическая форма гемолитической болезни новорожденных — отмечается у 10-20% детей с ГБН, характеризуется преобладанием анемии при незначительном или умеренном повышении уровня непрямого билирубина.
При тяжелой внутриутробно стартующей форме гемолитической болезни новорожденных диагноз ее может быть установлен антенатально по нарастанию титра Rh- или групповых антител у беременной и с помощью амниоцентеза (определение уровня билирубина в околоплоднь х водах). Своевременная постнатальная диагностика ГБН предполагает определение группы крови и резус-принадлежности ребенка при рождении (пуповинная кровь), динамическое определение билирубина (пуповинная кровь, почасовой прирост), динамический контроль гемоглобина, подсчет количества ретикулоцитов, прямую и непрямую реакцию Кумбса.
Гемолитическая анемия у детей
Гемолитические анемии у детей – это группа разных по патогенезу заболеваний, главным признаком которых является уменьшение продолжительности жизни эритроцитов, развитие их гемолиза. Клиническая картина имеет общие симптомы: возникновение желтухи, спленомегалии, реже гепатомегалии, тёмное окрашивание мочи. Для лабораторных исследований характерно снижение гемоглобина, ретикулоцитоз, повышение уровня билирубина (в основном за счет непрямой фракции), повышение ЛДГ, уробилиногена мочи. Метод лечения зависит от этиологии анемии: возможна медикаментозная терапия, проведение гемотрансфузий, спленэктомия при гиперспленизме.
МКБ-10
Общие сведения
Гемолитические анемии – это эритроцитопатии, при которых имеет место стойкое или массированное преобладание разрушения эритроцитов над их образованием. Среди всех анемий у детей встречаются в 11,5% случаев, в 5,3% ‒ от общего числа заболеваний крови. В числе больных незначительно преобладают лица мужского пола. Чаще диагностируются наследственные формы (76,6%) и особенно – наследственная сфероцитарная гемолитическая анемия (56,4%). Некоторые формы связывают с этнической принадлежностью: талассемия характерна для азиатов, жителей Кавказский республик, побережья Средиземного моря; серповидноклеточная анемия – для лиц негроидной расы, дефицит Г-6-ФД – для представителей еврейской национальности. Гемолитическая болезнь плода на территории РФ встречается у 0,6% новорожденных.
Причины
Этиология у наследственных и приобретенных гемолитических анемий различна. При наследственных анемиях патологии в строении эритроцитов запрограммированы на генетическом уровне: известно 16 вариантов с аутосомно-доминантным типом наследования, 29 – с рецессивным, 7 разновидностей – с Х-сцепленным. Все причины, которые приводят к гемолизу, разделяются на внеклеточные и внутриклеточные.
Внеклеточные причины типичны для анемий приобретенного характера. В этом случае эритроциты дефектов не имеют, а разрушаются под воздействием внешних факторов: ретикулоэндотелиальной гиперактивности (гиперспленизм), механических и химических нарушений целостности эритроцитов, иммунологических отклонений (под воздействием антител), паразитарной инвазии, витаминодефицита, некоторых инфекций. Внутриклеточные причины гемолиза – это нарушение структуры и функций эритроцитов, такие как дефекты эритроцитарного метаболизма, строения гемоглобина, мембран клеток.
Патогенез
В патогенезе наследственных гемолитические анемии главную роль играет внесосудистый гемолиз – разрушение эритроцитов происходит в клетках ретикулоэндотелиальной системы. Высвобождаемый гем распадается до несвязанного билирубина. В печени такое количество билирубина не может полностью связаться с глюкуроновой кислотой, развивается гипербилирубинемия. Клинически проявляется нарастанием желтухи, формированием у детей в раннем возрасте камней желчного пузыря, содержащих билирубинат кальция. В кишечнике билирубин метаболизируется в уробилин, избыток которого окрашивает мочу в темный цвет. Гиперактивность селезенки приводит к увеличению ее размеров с развитием гиперспленизма.
Внутрисосудистый гемолиз возникает при приобретенных гемолитических анемиях. Происходит распад эритроцитов в кровотоке, высвободившееся количество гемоглобина не связывается полностью с гаптоглобином в плазме, вследствие чего развивается гемоглобинурия. Избыток гемосидерина, который образуется в селезенке, почках, печени, способствует развитию гемосидероза данных органов и нарушению их функции. Компенсаторное усиление эритропоэза вызывает ретикулоцитоз. Гиперплазия костного мозга ведет к деформации черепа и скелета у детей.
Классификация
Общепринятая классификация гемолитических анемии у детей предложена Идельсоном Л.И. в 1975 году. Согласно ей выделяются две основные группы: наследственные и приобретенные, в каждой из которых обозначаются этиопатогенетические формы. Наследственные анемии классифицируются по локализации генетической аномалии, которая приводит к неполноценности эритроцитов. К ним относятся:
- Мембранопатии. Гемолитические анемии связаны с дефектами белковых и липидных комплексов мембран эритроцитов: врожденная эритропоэтическая порфирия, наследственные эллиптоцитоз и сфероцитоз – болезнь Минковского-Шоффара.
- Ферментопатии. Гемолиз обусловлен дефицитом эритроцитарных ферментов, которые обеспечивают пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов, обмен нуклеотидов и глютатиона.
- Гемоглобинопатии. Патологические состояния, вызванные структурными нарушениями гемоглобина и изменением синтеза его цепей: талассемия, серповидноклеточная анемия, эритропорфирия.
Приобретенные гемолитические анемии связаны с влиянием различных факторов, которые способствуют гемолизу в сосудистом русле и в органах ретикулоэндотелиальной системы. Среди них выделяют:
- Иммунные формы. Причиной гибели эритроцитов является выработка к ним антител. При изоиммунном варианте в организм проникают антиэритроцитарные антитела (гемолитическая болезнь новорожденных) или попадают красные кровяные клетки, к которым у больного есть сенсибилизация (посттрансфузионные анемии). Для гетероиммунных форм характерна фиксация на эритроцитах медикаментозных препаратов (пенициллины, сульфаниламиды, хинидин) или вирусов, что делает их антигеном. Аутоиммунные анемии вызваны образованием антител к собственным нормальным эритроцитам при онкологических заболеваниях, лимфолейкозе, миеломной болезни, системной красной волчанке, а также выработкой тепловых и холодовых антител.
- Механические формы. Гемолиз вызван механическим разрушением эритроцитов. Прямое повреждение возможно искусственными сердечными клапанами, паразитарной инвазией (малярийный плазмодий, токсоплазма), бактериальными токсинами (β-гемолитический стрептококк, менингококк), ядами змей, насекомых. При маршевой гемоглобинурии и анемии спортсменов после длительной интенсивной нагрузки гемолиз происходит в капиллярах нижних конечностей. Гиперспленизм является причиной разрушения нормальных эритроцитов в селезенке.
Симптомы
Клиническая картина, развивающаяся при разных типах гемолиза, имеет общие черты. Для приобретенных гемолитических анемий характерно острое нарастание симптоматики. Большинство наследственных анемий протекает хронически с периодическими гемолитическими кризами. Для развития криза необходимо воздействие триггера: переохлаждения, употребления токсичных препаратов, инфекционного заболевания. Первыми симптомами являются общая слабость, лихорадка, диспепсические расстройства, головная боль. В дальнейшем нарастают признаки билирубиновой интоксикации: иктеричность слизистых оболочек и желтушность кожи; появляются тяжесть, дискомфорт в верхних отделах живота из-за гепато- и спленомегалии, потемнение мочи - от розового до почти черного цвета. На фоне анемизации нарастает бледность с восковидным оттенком, появляются ощущения сердцебиения и перебоев в работе сердца. В тяжелых случаях развивается олигурия (уменьшение количества выделяемой мочи) и анурия, вплоть до шока.
Для наследственных форм характерно выявление стигм дизэмбриогенеза: челюстных и зубных деформаций, гиперхромии радужки, «башенного» черепа, западения переносицы, «готического» нёба; в анамнезе есть указания на гемолитические состояния у родственников, отягощена наследственность по желчнокаменной болезни. Клиническая картина изоиммунных анемий при конфликте «мать-плод» зависит от причины конфликта (резус-фактор, группа крови и другие). Высокий титр антител и их непосредственное влияние на плод на 20-29 неделе гестации приводят к водянке плода, попадание к плоду антител антенатально (после 29 недели) или в момент родов – к развитию гемолитической болезни.
Осложнения
При разных гемолитических анемиях возможны типичные только для них осложнения. Новорожденные с тяжелой гипербилирубинемией, вызванной наследственными формами, угрожаемы по развитию ядерной желтухи. К трем-четырем годам есть риск возникновения холестаза, хронического гепатита, цирроза печени. Большое количество гемотрансфузий у лиц с тяжелым течением способствует гемосидерозу селезенки, костного мозга, печени. Инфицирование парвовирусом В19 больных талассемией, серповидно-клеточной анемией ведет к фатальным последствиям – развитию арегенераторного криза. Для всех гемолитических состояний грозными осложнениями являются диссеминированное внутрисосудистое свертывание, острая сердечная и почечная недостаточность, анемическая кома.
Диагностика
Диагностика гемолитических анемий в педиатрии имеет некоторые особенности. После 12 месяцев в крови ребенка исчезают черты, характерные для неонатального типа кроветворения: макроцитоз, фетальный гемоглобин, пониженная минимальная осмотическая стойкость эритроцитов, нестабильность уровня ретикулоцитов. Поэтому точное типирование гемолитической анемии возможно только после этого возраста. В диагностике принимают участие педиатр и детский гематолог. В план обследования должны быть включены:
- Сбор анамнеза и общий осмотр. Выясняется этническая принадлежность, наличие у родственников гемолитических анемий, желчнокаменной болезни, история беременности и родов матери, группа крови, резус-фактор родителей. Педиатр осматривает ребенка на предмет выявления желтухи, типичной бледности, стигм дизэмбриогенеза; проводит пальпацию живота для выявления гепато-, спленомегалии, аускультацию сердца с целью выслушивания систолического шума на верхушке сердца, учащения сердцебиения.
- Клинические анализы. Общий анализ крови проводится с определением морфологии эритроцитов, лейкоцитов и тромбоцитов. При исследовании выявляются снижение гемоглобина, атипичные формы эритроцитов (при мембранопатиях и гемоглобинопатиях), наличие ретикулоцитов (как признака напряжения эритропоэза), тельца Гейнца-Эрлиха (при дефиците Г6ФД), повышение СОЭ. В общем анализе мочи отмечается повышение уробилина, гемоглобинурия.
- Биохимия крови. Для биохимического анализа типичны гипербилирубинемия, повышение ЛДГ, при внутрисосудистом гемолизе – гипергемоглобинемия, гипогаптоглобинемия. Прямая проба Кумбса (прямой антиглобулиновый тест) положительна при наличии аутоантител к поверхности эритроцитов, характерных для иммунных гемолитических анемий. Но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, проба может быть отрицательной.
- Инструментальные методы. УЗИ либо КТ органов брюшной полости с высокой точностью определяют увеличения размер печени, селезенки, их структуру, состояние желчевыводящей системы. Трепанобиопсия костного мозга проводится с целью определения типа эритропоэза (нормо-, мегало- или сидеробластный), а также исключения патологии со стороны костного мозга (апластическая анемия, лейкоз, метастатическое поражение при злокачественных образованиях).
Специфические методы исследования. Определение длительности жизни эритроцитов может проводиться методами дифференциальной агглютинации, продукции угарного газа, проточной цитометрией (клеточное биотинилирование и др.), прямыми радиоизотопическими исследованиями. Генетические исследования и определение мутаций уточняют причины наследственного гемолиза.
Лечение
Лечение гемолитической анемии проводится в стационарных условиях, под наблюдением педиатра, гематолога, при переливаниях крови – трансфузиолога. Лечебный подход зависит от тяжести состояния пациента, периода заболевания (гемолитический криз или ремиссия), причины возникновения гемолиза. Методы терапии можно объединить в следующие группы:
- Медикаментозная терапия. Назначается как этиотропно, так и симптоматически. При увеличении селезенки и гепатомегалии применяют глюкокортикоидные гормоны. Аутоиммунные анемии требуют назначения цитостатиков, эритропоэтина. При дефиците фолатов назначают цианокобаламин и фолиевую кислоту. Гемолитический криз требует инфузионной терапии, снятия симптомов интоксикации. Для выведения избытка железа больным проводятся курсы хелаторной терапии (десферал). Во многих случаях с профилактической целью используются желчегонные средства.
- Гемотрансфузии. Переливание компонентов крови проводят в стационарных условиях при выраженной анемии по жизненным показаниям. Трансфузия эритроцитарной массы осуществляется строго по индивидуальному подбору, предпочтительно использовать отмытые и размороженные эритроциты. Длительная гемотрансфузионная терапия может осложниться избыточным отложением железа в тканях.
- Хирургическое лечение. Спленэктомия – хирургическое удаление селезенки – используется при спленомегалии, если лекарственная терапия не имеет эффекта. Метод особенно эффективен при гиперспленизме, когда секвестрация эритроцитов происходит в селезенке. При гемолитических анемиях часто развивается холелитиаз, который требует оперативного удаления желчного пузыря (холецистэктомии) или экстракции конкремента из желчных путей.
Прогноз и профилактика
Прогноз при гемолитических анемиях у детей зависит от этиологического фактора. Приобретенные формы и большинство наследственных имеют благоприятный исход при своевременно начатом лечении и соблюдении мер профилактики. В качестве системы питания используется диета №5 по Певзнеру, предназначенная для снижения нагрузки на билиарный тракт. Необходим охранительный режим: избегание перегрева и переохлаждений; исключение контактов с инфекционными больными; ознакомление со списком препаратов и веществ, которые могут вызвать гемолиз (хинин, сульфаниламиды, левомицетин, аспирин, нитрофураны и прочие); определение показаний и строгих противопоказаний к вакцинации (при дефиците глюкозо-6фосватдегидрогеназы, аутоиммунных анемиях иммунизация запрещена, при сфероцитозе – рекомендована).
3. Классификация и диагностика анемий у детей/ Румянцев А.Г.// Вопросы современной педиатрии. - 2011 - Т.10, №1.
Гемолитическая болезнь плода
Гемолитическая болезнь плода – внутриутробный иммунологический конфликт, обусловленный несовместимостью крови плода и матери по ряду антигенов, что приводит к гемолизу эритроцитов ребенка под влиянием материнских антител, преодолевающих плацентарный барьер. Гемолитическая болезнь плода может протекать в отечной, желтушной, анемической форме и даже приводить к внутриутробной гибели плода. В диагностике проводится исследование околоплодных вод (амниоцентез), пуповинной крови, билирубина и гемоглобина у новорожденного. Лечение гемолитической болезни плода требует проведения фототерапии, внутривенной инфузии растворов, обменного переливания крови.
Патогенетическую основу гемолитической болезни составляют процессы, вызванные иммунологической (антиген-антитело) несовместимостью крови плода и матери. В этом случае имеющиеся в крови у плода антигены наследуются от отца, а в крови матери отсутствуют. Чаще всего (1 случай на 250 беременностей) гемолитическая болезнь плода развивается при конфликте по резус-фактору; также может возникнуть при групповой несовместимости крови и другим менее изученным антигенам. Гемолитическая болезнь плода в 3,5% случаев приводит к перинатальной смертности.
При гемолитической болезни плода под влиянием материнских антител, образующихся к антигенам плода и проникающих через плаценту, у ребенка развивается гемолиз эритроцитов и угнетение гемипоэза. Токсическое воздействие продуктов распада эритроцитов на организм плода (новорожденного) приводит к развитию анемии, увеличению билирубина и бластных (незрелых) эритроцитов.
Причины гемолитической болезни плода
Иммунологический конфликт, приводящий к гемолитической болезни плода, чаще всего развивается при изосерологической несовместимости крови по системе Резус (Rh), когда у матери имеется Rh-отрицательная кровь, а у плода – Rh-положительная. В таком случае он носит название резус-конфликт. Изоиммунизация при этом может происходить двумя путями: ятрогенным (при сенсибилизации женщины переливаниями Rh(+) крови в прошлом) или при плодово-материнском трансплацентарном переносе эритроцитов плода в материнский кровоток в процессе беременности и родов. В случае Rh-несовместимости гемолитическая болезнь плода редко бывает сопряжена с первой беременностью; чаще развивается от 2-ой или 3-ей беременности с возрастанием рисков с каждой последующей гестацией.
Другой возможной причиной гемолоитической болезни служит несовместимость крови плода и матери по системе АВ0, т. е. при группе крови матери 0 (I), а у плода любой другой. При этом антигены А и В от плода проникают через плаценту в материнский кровоток и вызывают выработку иммунных α- и β- антител с последующим конфликтом «антиген-антитело». Гемолитическая болезнь плода при АВО-несовместимости имеет более легкое течение, чем при Rh-несовместимости. При АВ0-несовместимости гемолитическая болезнь плода может развиться уже в течение 1-ой беременности.
В относительно редких случаях гемолитическая болезнь плода может быть связана с иммунологическими конфликтами по системам Даффи, Келл, MNSs, Кидд, Лютеран и др. или антигенам P, S, N, М.
Проявления гемолитической болезни плода
У беременных специфической картины патологии не наблюдается; иногда нарастание внутриутробных реакций может вызывать у женщины симптомокомлекс, сходный с гестозом. Гемолитическая болезнь плода может проявляться следующими вариантами: внутриутробной гибелью плода в период с 20 по 30 неделю беременности; отечной, желтушной или анемической формах. Общими проявлениями, характерными для всех форм гемолитической болезни плода, служат наличие нормохромной анемии с увеличением в крови эритробластов, гепатомегалии и спленомегалии.
При отечном варианте гемолитической болезни у плода увеличиваются размеры селезенки, печени, сердца, желез, нарастает гипоальбуминемия. Эти изменения сопровождаются выраженным отеком подкожно-жировой клетчатки, асцитом, перикардитом, плевритом, увеличением массы ребенка в 2 раза по сравнению с нормой. При отечном варианте гемолитической болезни плода отмечается резко выраженная анемия (Er -1-1,5 x 1012/л, Нb 35-50 г/л), эритробластемия, увеличение и отечность плаценты. Тяжелые нарушения обмена могут вызывать внутриутробную гибель плода или смерть ребенка вскоре после родов. Отечную форму гемолитической болезни плода отличает крайне тяжелое течение, что в большинстве случаев приводит к летальному исходу.
При желтушном варианте гемолитической болезни плода ребенок чаще рождается от срочных родов, доношенным, чаще с нормальным цветом кожи. В этом случае гемолитическая болезнь плода проявляется спустя несколько часов после рождения – у ребенка стремительно нарастает желтушная окраска кожи; реже желтуха бывает врожденной. У новорожденных с желтушной формой гемолитической болезни увеличены селезенка, печень, лимфоузлы, иногда сердце, отмечается интенсивный прирост непрямого билирубина в крови.
Гипербилирубинемия опасна возможностью повреждения гепатоцитов, кардиомиоцитов, нефронов, нейронов с развитием билирубиновой энцефалопатии. При ядерной желтухе (билирубиновой интоксикации) ребенок вялый, плохо сосет, часто срыгивает, у него развивается гипорефлексия, рвота, судороги. Критический уровень непрямого билирубина, опасный в плане поражения ЦНС, - более 306-340 мкмоль/л у доношенных и 170-204 мкмоль/л у недоношенных. Следствием билирубиновой энцефалопатии может являться гибель ребенка или последующее отставание в психическом развитии.
При анемической форме гемолитической болезни повреждающее воздействие на плод, как правило, невелико. На первый план выходят анемия, бледность кожи, гепатомегалия и спленомегалия. Тяжесть проявлений гемолитической болезни плода определяется титром антител у беременной и степенью зрелости новорожденного: тяжелее заболевание протекает у недоношенных детей.
Диагностика гемолитической болезни плода
В настоящее время акушерство и гинекология придает важное значение своевременному выявлению и правильному ведению беременности, угрожаемой по развитию гемолитической болезни плода. При постановке беременной на учет у нее определяют группу крови и Rh-фактор, выясняют аналогичные данные отца ребенка, интересуются гемотрансфузионным анамнезом, наличием в прошлом мертворожденных детей, самопроизвольных выкидышей или детей с гемолитической болезнью плода. При угрозе развития гемолитической болезнью плода у женщины в динамике контролируют титр специфически антител.
Пренатальная диагностика гемолитической болезни плода включает проведение акушерского УЗИ, допплерографии маточно-плацентарного кровотока и максимального кровотока в средней мозговой артерии с оценкой функционального состояния развивающегося ребенка. Характерными ультразвуковыми критериями гемолитической болезни плода являются плацентомегалия, многоводие, расширение пуповинной вены; сплено- и гепатомегалия, кардиомегалия, наличие перикардиального выпота, гидроторакса.
Учитывая, что гемолитическая болезнь часто сопровождается гипоксией, проводится кардиотокография с оценкой сердечной деятельности плода. В случае получения данных за гемолитическую болезнь плода требуется проведение инвазивных исследований – кордоцентеза и амниоцентеза под контролем УЗИ. При рождении ребенка сразу определяется его резус и групповая принадлежность, исследуется содержание Hb и билирубина в пуповинной крови.
Лечение гемолитической болезни плода
Лечебными задачами при гемолитической болезни плода служат быстрое выведение из крови ребенка токсических факторов гемолиза – непрямого билирубина и антител, а также повышение функций страдающих систем и органов. Выбор способа родоразрешения женщин с изоиммунизацией определяется состоянием плода, сроком беременности, подготовленностью родовых путей. В случае отсутствия данных за тяжелую форму гемолитической болезни плода, на сроке беременности свыше 36 недель, зрелости шейке матки возможны естественные роды. При тяжелом состоянии плода предпочтительнее кесарево сечение за 2-3 недели до ожидаемого срока.
У новорожденных с гемолитической болезнью плода ежедневно контролируется показатели Hb, Ht, билирубина. При необходимости проводится коррекция анемии эритроцитарной массой, инфузионная дезинтоксикационная терапия. Важной составляющей лечения гемолитической болезни плода служит фототерапия, способствующая разрушению непрямого билирубина в коже ребенка. Светолечение проводится в импульсном или непрерывном режиме с помощью ламп дневного или синего света.
При более тяжелых проявлениях гемолитической болезни плода показано проведение капельного внутрижелудочного введения жидкости и заменного переливания крови. При гемолитической болезни плода, обусловленной Rh-конфликтом, при заменном переливании используется одногруппная Rh (-) кровь. В случае несовместимости по ABO переливается эритроцитная масса 0(I) группы в соответствии с Rh-принадлежностью новорожденного и одногруппная плазма. Развитие отека легких и выраженной дыхательной недостаточности требует проведения ИВЛ; наличие асцита диктует необходимость выполнения лапароцентеза под УЗИ-контролем.
Профилактика гемолитической болезни плода
Заключается в предупреждении Rh-иммунизации женщин – внимательном переливании крови с учетом Rh-принадлежности. Женщинам с Rh(-) кровью категорически не рекомендуется прерывание беременности, наступившей впервые. Методом специфической профилактики Rh-конфликта у женщин с Rh(-) кровью служит введение иммуноглобулина антирезус Rho человека после абортов, родов Rh(+) плодом, внематочной беременности, а также после инвазивной пренатальной диагностики - биопсии хориона, амниоцентеза, кордоцентеза.
Читайте также:
