Лечение и прогноз мембранозной нефропатии
Добавил пользователь Алексей Ф. Обновлено: 10.01.2026
Мембранозная нефропатия - эпидемиология, патогенез
Мембранозная нефропатия — это невоспалительное поражение клубочков почек, при котором в базальной мембране или вдоль стенки клубочковых капилляров (субэпителиально) откладываются иммунные комплексы, состоящие обычно из IgG и компонента комплемента С3.
Основное проявление мембранозной нефропатии — протеинурия, однако причиной нефротического синдрома у детей это заболевание становится нечасто (в Северной Америке около 1% случаев). Если у взрослых мембранозная нефропатия чаще идиопатическая, то у детей примерно в половине случаев удается установить провоцирующий фактор.
Нефротический синдром при мембранозной нефропатии обычно не поддается лечению преднизоном. Когда при биопсии выявляются признаки мембранозной нефропатии, следует предпринять тщательный поиск ее причины. Дальнейшая тактика основана на устранении этой причины: лечении основного заболевания или отмене нефротоксичных лекарственных средств.
Причины вторичной мембранозной нефропатии у детей:
1. Аутоиммунные заболевания:
- СКВ
- Смешанное заболевание соединительной ткани
- Хронический лимфоцитарный тиреоидит
2. Инфекции:
- Гепатит В
- Врожденный сифилис
- Малярия
3. Лекарственные средства:
- Пеницилламин
- Препараты золота
4. Новообразования:
- Хронический лимфолейкоз
- Лимфомы
- Нейробластома
- Рак
5. Прочие:
- Серповидноклеточная анемия
- Мембранозная нефропатия в пересаженной почке
Эпидемиология мембранозной нефропатии
У детей мембранозная нефропатия встречается редко, но может возникнуть в любом возрасте, в том числе до года. Описаны случаи заболевания у однояйцовых близнецов и у родных братьев и сестер.
Подробных эпидемиологических исследований среди детей не проводилось.
Патогенез мембранозной нефропатии
Идиопатическую мембранозную нефропатию, по всей видимости, следует считать иммунокомплексным заболеванием, хотя антигены, к которым образуются антитела, еще не установлены. Скорей всего, иммунные комплексы формируются уже в клубочках, между базальной мембраной и подоцитами. Антигены, экзогенные или эндогенные, попадают туда из кровотока.
В модели гломерулонефрита на крысах (модель Хеймана) из эпителия клубочка выделяли антигенный комплекс, который вводили животным в кровь. В результате против него вырабатывались антитела и их реакция с антигеном приводила к образованию иммунных комплексов, откладывающихся в окаймленных ямках вблизи базальной мембраны.
У человека, несмотря на активные поиски, подобных антигенов пока не обнаружено. Что касается вторичной мембранозной нефропатии, то помимо заболеваний, перечисленных в выше, она изредка развивается на фоне сахарного диабета типа 1, болезни Крона, первичного билиарного цирроза печени, что предполагает существование и других аутоантигенов, играющих роль в ее патогенезе.
Само по себе воспаление в клубочках не объясняет протеинурию — скорее, ее запускает мембраноатакующий комплекс, состоящий из компонентов комплемента C5b—С9.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Мембранозный гломерулонефрит ( Экстрамембранозная нефропатия )
Мембранозный гломерулонефрит – это заболевание, характеризующееся поражением клубочков нефрона с развитием нефротического синдрома и почечной недостаточности. На начальных этапах течение бессимптомное, в дальнейшем возникают боли в области поясницы, олигурия, отеки подкожной жировой клетчатки. Диагностику производят посредством лабораторных исследований (общие анализы крови и мочи, функциональные почечные пробы), УЗИ, гистологического изучения тканей почек. Лечение включает прием ингибиторов АПФ, коррекцию реологических свойств крови, иммуносупрессивную терапию.
Общие сведения
Мембранозный гломерулонефрит (МГ), или экстрамембранозная нефропатия, является достаточно распространенным состоянием. Более 40% всех случаев нефротического синдрома у взрослых обусловлено данной патологией. Среди заболеваний почек воспалительного характера доля МГ, по разным оценкам специалистов в сфере практической урологии, составляет от 3 до 15%.
Подавляющее большинство пациентов относятся к средней возрастной группе (20-35 лет), лишь 1% заболевших – дети. Женщины и мужчины поражаются примерно с равной долей вероятности, однако у лиц женского пола гломерулонефрит протекает легче, а осложнения выявляются реже. Выраженная почечная недостаточность развивается медленно, регистрируется примерно у 40% пациентов в среднем через 15 лет после постановки диагноза.
Причины
Установлена четкая взаимосвязь между развитием мембранозного гломерулонефрита и наличием ряда патологий различного характера. В то же время, часть случаев заболевания возникает без всякой видимой причины. С учетом этого выделяют первичный (идиопатический) и вторичный варианты болезни. Пусковыми факторами вторичной формы выступают следующие обстоятельства:
- Инфекционные заболевания. Наиболее распространенная причина мембранозной нефропатии. У больных данной формой гломерулонефрита в анамнезе нередко имеются эпизоды вирусного гепатита (В, С), туберкулеза, сифилиса, шистосомоза.
- Злокачественные новообразования. Опухоли способны запускать ряд аутоиммунных реакций, в том числе против антигенов почек. Особенно часто мембранозный гломерулонефрит наблюдается при хроническом лимфолейкозе, раке легкого и кишечника, некоторых лимфомах.
- Прием лекарственных препаратов. Сравнительно редко становится причиной развития заболевания. К числу медикаментов, способных спровоцировать патологию, относят НПВС, препараты золота, каптоприл, D-пеницилламин.
Причины идиопатической экстрамембранозной нефропатии пока неизвестны. Предполагается наличие генетических аномалий, затрагивающих некоторые звенья иммунитета, вследствие чего возникает поражение мембран клубочков нефрона. Косвенно это подтверждается более частым обнаружением у больных с МГ сахарного диабета и иных патологий аутоиммунного генеза – системной красной волчанки, псориаза.
Патогенез
При развитии мембранозного гломерулонефрита наблюдается аномальная иммунная реакция на некоторые белки клубочков. Конкретный антиген пока не выявлен, но установлено, что он располагается преимущественно на стенках капилляров и на гломерулярной базальной мембране. Из-за нарушения иммунитета против данных протеинов вырабатываются антитела, которые накапливаются в нефроне, формируя иммунные комплексы.
Это приводит к утолщению стенок капилляров и базальной мембраны, диффузия жидкости через них затрудняется. Как следствие, падает скорость клубочковой фильтрации, функциональность нефрона резко снижается. В дальнейшем пораженные клубочки становятся неспособными удерживать белки плазмы крови, которые начинают переходить в мочу и покидать организм. Отмечается протеинурия с гипоальбуминемией и гиперлипидемией.
Реологические свойства крови ухудшаются – снижается ее онкотическое давление, в результате возникают отеки подкожной клетчатки. По мере «выключения» все большего количества нефронов начинает страдать выделительная функция почек, развивается их недостаточность. У части больных на этом этапе возможно раздражение юкстагломерулярного аппарата, приводящее к росту уровня артериального давления.
Симптомы мембранозного гломерулонефрита
Чаще всего заболевание развивается через несколько недель после перенесенной инфекции, на фоне онкологической патологии, после длительного курса приема лекарственных средств. Первоначально выраженных симптомов не определяется – на данном этапе МГ может быть обнаружен случайно при выполнении анализа мочи. В дальнейшем больные могут жаловаться на слабость, разбитость, головные боли, потерю аппетита.
Кожные покровы становятся бледными, у некоторых пациентов отмечаются приступы лихорадки (до 39-40 градусов) и артериальная гипертензия. Зачастую эти проявления остаются незамеченными, теряются на фоне симптомов основного заболевания. По мере прогрессирования мембранозного гломерулонефрита возникает болезненность в пояснице, отеки тканей лица, конечностей. Отечность обычно асимметричная, мягкая на ощупь, в редких случаях кожные покровы напряжены. Суточное выделение мочи несколько снижается (олигурия), моча становится мутной, в ней легко образуется осадок. Иногда наблюдается накопление жидкости в полостях тела, увеличение живота говорит об асците, кашель и затрудненное дыхание – о гидротораксе.
Для МГ характерны спонтанные ремиссии с почти полным исчезновением симптомов, нередко сменяющиеся рецидивами. При продолжительном течении гломерулонефрита и частых обострениях могут появляться признаки хронической почечной недостаточности. Помимо олигурии и отеков в таких случаях выявляется запах аммиака от кожных покровов и изо рта, возможна спутанность сознания, обмороки. При тяжелом течении также развивается иммунодефицит из-за потери иммуноглобулинов с мочой.
Осложнения
Наиболее распространенным осложнением мембранозного гломерулонефрита является почечная недостаточность, обусловленная гибелью и склерозированием большого количества нефронов. Вероятность появления такого состояния выше у мужчин, лиц старше 50 лет и больных с массивной протеинурией (свыше 15-20 г/сут). На фоне данной нефропатии могут возникать или обостряться иные системные патологии – СКВ, псориаз, аутоиммунный тиреоидит, сахарный диабет. Повышается риск тромботических осложнений – тромбозов почечных сосудов и глубоких вен нижних конечностей, тромбоэмболии легочной артерии. При вторичном характере МГ из-за нарушения функции почек может затрудняться лечение основного заболевания – инфекции или опухоли.
Диагностика
Выявлением мембранозного гломерулонефрита занимается врач-нефролог, зачастую требуются консультации других специалистов – иммунолога, онколога, фтизиатра, что обусловлено преимущественно вторичным характером патологии. Без ряда специальных исследований данную нефропатию трудно отличить от схожих состояний – например, липоидного нефроза. План обследования включает в себя следующие методики:
- Осмотр и сбор анамнеза. В большинстве случаев определяются отеки в области лица, шеи и конечностей, кожа бледная, сухая. При расспросе больные жалуются на слабость, боль в пояснице, утомляемость. В анамнезе зачастую выявляются перенесенные инфекционные заболевания либо пациент состоит на учете в онкологическом диспансере.
- Лабораторные исследования. Общий анализ крови обнаруживает умеренный лейкоцитоз и увеличение СОЭ, БАК – гипоальбуминемию, гиперлипидемию с резким ростом уровня холестерина, фосфолипидов и креатинина. Исследование мочи подтверждает протеинурию (до 20-30 г/сут), могут определяться единичные лейкоциты и эритроциты.
- Гистологическое изучение. При микроскопии тканей почек отмечается увеличение толщины или удвоение базальной гломерулярной мембраны, дистрофия эпителия канальцев. Иммуногистохимическое исследование выявляет отложения иммунных комплексов в области клубочка и в канальцах. Клеточная пролиферация мезангия отсутствует или выражена очень слабо.
- Ультразвуковая диагностика. На начальных этапах развития мембранозного гломерулонефрита изменения по данным УЗИ почек обычно отсутствуют. При длительном течении патологии возможно увеличение органов в размере, нарушение дифференцировки мозгового и коркового слоя, появление склеротических процессов.
В рамках определения нефропатии могут назначать и другие исследования, направленные на выявление основного заболевания, в том числе – разнообразные серологические, биохимические, рентгенологические и иные методики. Дифференциальную диагностику производят с липоидным нефрозом и другими типами гломерулонефрита. Особенностью МГ, отличающей его от данных состояний, является наличие иммунных комплексов на мембране нефрона при одновременном отсутствии клеточной пролиферации.
Лечение мембранозного гломерулонефрита
Большинство специалистов склоняются к необходимости проведения иммуносупрессивной терапии. Важную роль играет этиотропное лечение заболевания, выступающего в качестве предрасполагающего фактора. Показаны симптоматические мероприятия, направленные на восстановление нормальной картины крови и улучшение фильтрующей способности почек. Базовая программа лечения мембранозной нефропатии включает следующие компоненты:
- Иммуносупрессивная терапия. Чаще всего применяют глюкокортикостероиды – высокими дозировками во время обострения и поддерживающими в периоды ремиссии. При тяжелом течении (высокая протеинурия, нарастающая недостаточность почек) стероиды совмещают с алкилирующими цитостатическими иммунодепрессантами.
- Ускорение СКФ. Назначают нефропротекторы преимущественно из группы ингибиторов АПФ. Дополнительным эффектом при их использовании является устранение артериальной гипертензии почечного генеза, иногда возникающей при МГ.
- Инфузионная терапия. Больным необходимо восстановить уровень белков в крови, тяжелым пациентам для этого могут проводить переливания донорской плазмы. Для уменьшения отеков при необходимости применяют диуретические средства и растворы электролитов.
Проводятся общережимные мероприятия – в период обострений показан строгий постельный режим, высокобелковая диета (для восстановления протеинов плазмы), исключаются жареные или пряные блюда. Необходимо ограничить потребление поваренной соли (не более 2-х грамм в сутки) – ее чрезмерные количества способствуют сохранению отеков и увеличивают уровень артериального давления. В периоды между обострениями рекомендуется курортное лечение в специализированных санаториях.
Прогноз и профилактика
Прогноз мембранозного гломерулонефрита неоднозначный, у одних пациентов регистрируются продолжительные спонтанные ремиссии, тогда как у других патология приводит к развитию ХПН. По статистике, десятилетняя выживаемость при отсутствии лечения составляет 60-65%. Значительное влияние на перспективы МГ оказывает наличие сопутствующих заболеваний и осложнений – инфекций, онкологических процессов, аутоиммунных нарушений. При полноценной комплексной терапии возможна длительная компенсация патологии.
Специфической профилактики не существует, рекомендуется не затягивать с лечением заболеваний, способных спровоцировать поражение почек. Больные в состоянии ремиссии должны регулярно посещать нефролога для контроля своего состояния и своевременного обнаружения осложнений.
Лекарственная нефропатия
Лекарственная нефропатия — это острое или хроническое поражение почечных гломерул, канальцев, интерстиция, обусловленное приемом медикаментов. Проявляется полиурией, олигоанурией, никтурией, гематурией, болями в пояснице, астеническим, отечным и гипертензивным синдромами. Диагностируется на основании данных общего и биохимического анализов крови, мочи, УЗИ, УЗДГ, КТ, МРТ почек, экскреторной урографии, нефросцинтиграфии, биопсии почечных тканей. Лечение включает детоксикационную терапию, кортикостероиды, лекарственные инфузии, антикоагулянты, антиагреганты, гипотензивные средства, ЗПТ. При стойкой хронической дисфункции требуется трансплантация почки.
МКБ-10
По наблюдениям отечественных и зарубежных специалистов-урологов, в последние годы возрастает частота лекарственных поражений почек, проявляющихся различными вариантами острых и хронических нефропатий. В первую очередь это связано с расширением арсенала медикаментозных средств, применяемых в терапии различных заболеваний, и потенциальной нефротоксичностью большинства препаратов. У 10-11% пациентов с болезнями почек, требующими проведения заместительной терапии, нефрологическая патология связана именно с приемом медикаментов.
В группу повышенного риска входят больные старшей возрастной группы, которые длительно получают поддерживающее комбинированное лечение по поводу хронических соматических заболеваний и подвергаются диагностическим процедурам с применением нефротоксичных лекарственных препаратов. Их доля в числе нефрологических пациентов достигает 66%.
Лекарственная нефропатия с употреблением фармацевтических и парамедицинских препаратов, обладающих нефротоксическим действием. Обычно предпосылками к развитию поражения почек становятся неконтролируемый прием медикаментов без учета противопоказаний (самолечение), побочные эффекты при необоснованном назначении или неправильном комбинировании лекарственных средств, наследственная предрасположенность, наличие сопутствующей патологии (сахарного диабета, гипертонической болезни, нефрологических заболеваний и пр .). Повреждение почечной ткани могут вызывать:
- Официнальные лекарственные средства. Ренальная дисфункция возникает при приеме антибактериальных препаратов (пенициллинов, цефалоспоринов, аминогликозидов, тетрациклинов, фторхинолонов, сульфаниламидов, противотуберкулезных средств), анальгетиков, НПВС, диуретиков, барбитуратов, цитостатиков, блокаторов H2-гистаминовых рецепторов, ингибиторов АПФ, фенотиазинов и др. При использовании рентгеновского контраста возможно развитие контраст-индуцированной нефропатии.
- Вакцины и сыворотки. До 23% случаев лекарственной нефрологической патологии вызвано введением противостолбнячной, противокоревой, антистафилоккоковой сывороток, АДС, АДС-М, АКДС, гоновакцины. Риск поствакцинальных или сывороточных нефропатий возрастает при проведении иммунизации или введении готовых антител пациентам с отягощенным аллергологическим анамнезом, гиперчувствительностью к компонентам иммунопрепарата.
- Парамедицинские препараты. По данным наблюдений, до 80% населения использует средства нетрадиционной медицины. При этом зачастую недоучитываются вазоконстрикторный, цитопатический, кристаллурический, дисметаболический эффекты лекарственных растений. Как сообщает FDA, до 32% аюрведических препаратов содержат ртуть, мышьяк, свинец, аристолохиевую кислоту, признанную одной из вероятных причин балканской эндемической нефропатии, другие нефротоксичные ингредиенты.
Основой развития лекарственной нефропатии служит сочетание нескольких патогенетических механизмов. Часть медикаментов оказывает прямое повреждающее воздействие, приводящее к первичному повреждению клеток проксимальных канальцев, реабсорбирующих нефротоксичное химическое соединение. Канальцевый эпителий также может разрушаться при преципитации кристаллов на фоне употребления сульфаниламидных препаратов, обструкции миоглобином при рабдомиолизе вследствие приема статинов, ингибиторов моноаминоксидазы, производных фенотиазина, некоторых анестетиков.
Возникающая канальцевая дисфункция провоцирует вторичное нарушение фильтрационной способности. Самостоятельным или усугубляющим деструкцию фактором становятся ишемические изменения тканей, вызванные анафилактическим шоком, тромботической микроангиопатией, ингибированием простагландинов и ренин-ангиотензиновой системы с последующим сосудистым спазмом.
Отдельным звеном патогенеза является повреждение гломерулярных и канальцевых базальных мембран иммунными комплексами, в состав которых в качестве антигена входит принимаемое лекарственное средство или его метаболиты. Гломерулопатия и тубулопатия могут развиться как при осаждении циркулирующих в крови иммунных комплексов, так и при реакции антител на химические вещества, связавшиеся со структурными почечными элементами.
При иммунном механизме возникновения нефропатии ведущей является гиперергическая реакция с нарушением ренальной микроциркуляции, выделением гистамина и других медиаторов воспаления. Длительная ишемия тканей в сочетании с альтерацией клеточных элементов потенцирует коллагеногенез и склероз тканей с замещением функциональных элементов соединительнотканными волокнами.
Классификация
В отечественной урологии принята систематизация клинических форм лекарственных нефропатий на основе патоморфологических изменений почечных тканей с учетом динамики развития заболевания и этиопатогенетических факторов. Такой подход обеспечивает наиболее точное прогнозирование возможных осложнений и исхода, позволяет подобрать оптимальную схему ведения пациента. Выделяют семь основных клинических вариантов медикаментозной нефропатии:
- Острый некроз канальцев. Представлен симптоматикой острой почечной недостаточности. Связан с повреждением канальцевого эпителия, нарушением реабсорбции, вторичным ухудшением фильтрации. Выявляется у 5-20% больных, принимающих аминогликозидные препараты. Возможен при назначении цефалоспоринов, хинина, ампициллина, введении рентгеновского контраста.
- Острый кортикальный некроз. Сопровождается клиникой ОПН. Является вторичным состоянием. Развивается на фоне системных изменений, возникших при приеме лекарственных средств. Чаще всего становится результатом анафилактического шока, вызванного иммунизацией при наличии противопоказаний или индивидуальной гиперчувствительностью к фармпрепаратам.
- Острый интерстициальный нефрит. При тяжелом течении характерна симптоматика ОПН, свидетельствующая о вторичном повреждении гломерул, при стертом преобладает клиника тубулопатии с полиурией. До 72% острых форм интерстициального нефрита имеют лекарственный генез, осложняют прием антибиотиков, сульфаниламидов, ингибиторов протонной помпы, НПВС.
- Хронический интерстициальный нефрит. Длительное время протекает бессимптомно, у половины пациентов диагностируется на стадии ХПН. Преобладает разрастание межуточной ткани, некроз сосочков, атрофия эпителия канальцев. Провоцируется приемом анальгетиков (анальгетическая нефропатия), ингибиторов кальциневрина, препаратов лития, фитосредств с аристохолиевой кислотой.
- Острый лекарственный гломерулонефрит. Проявляется нефритическим синдромом. Морфологически при гломерулонефрите превалирует поражение базальных мембран клубочков циркулирующими иммунными комплексами (мембранозный гломерулонефрит). Возникает вследствие дозонезависимой аллергической реакции на прием НПВС, препаратов золота, антибиотиков, диуретиков, противовирусных средств.
- Хронический гломерулонефрит. Характеризуется выраженным нефротическим синдромом, реже изолированным мочевым синдромом вследствие прогрессирующего аутоиммунного разрушения гломерулярного аппарата, склероза ренальной паренхимы, ХПН. Хронический гломерулонефрит зачастую является исходом острых форм лекарственного нефрита. Развивается при терапии солями ртути, анестетиками.
- Электролитно-гемодинамические расстройства. Преобладают экстраренальные нарушения (повышение АД, водно-электролитный дисбаланс). При кратковременном поступлении лекарственных средств нефропатия обычно обратима. Как правило, ее формирование обусловлено изменением почечной гемодинамики за счет ингибирования синтеза простагландинов при лечении индометацином.
Более редкими формами медикаментозных нефропатий являются расстройства, вызванные выпадением отдельных ренальных функций. Заболевания этой группы представлены преимущественно дисметаболическими нарушениями вследствие тубулопатий — приобретенными вариантами синдрома Фанкони, несахарного почечного диабета, калийпенической почки.
Симптомы лекарственной нефропатии
Клиническая картина полиморфна и зависит от особенностей патогенеза заболевания. Острые формы обычно развиваются в течение 1-3 недель после начала приема НПВС, антибиотиков, сульфаниламидов, диуретиков, других нефротоксичных препаратов. Острые нефропатии характеризуется интенсивной болью в пояснице, увеличением или резким ограничением суточного количества мочи вплоть до полной задержки. Часть пациентов отмечает наличие крови в моче. Возможны общие симптомы, обусловленные интоксикацией организма азотистыми соединениями: повышение температуры тела, головные боли, слабость, сонливость, бледность кожи и слизистых, тахикардия, жажда, сухость во рту, кожный зуд.
В клинической картине хронических нефропатий превалирует картина нарастающей почечной недостаточности. Характерны утренние отеки лица, которые в последующем распространяются на другие части тела. Часто отмечается полиурия и преобладание ночного диуреза. У некоторых больных развивается стойкая, терапевтически резистентная артериальная гипертензия. При возникновении сопутствующей анемии пациенты жалуются на быструю утомляемость, слабость, головокружения. Кожные покровы и видимые слизистые становятся бледными. Возможно сочетание почечной симптоматики с признаками лекарственных поражений других органов: диспепсией, мышечно-скелетными болями, рецидивирующим стоматитом, нарушением менструальной функции.
Острое токсическое действие медикаментов на клетки клубочков и почечных канальцев приводит к резкому снижению фильтрации с развитием клиники ОПН, которая в 50-70% случаев становится причиной летального исхода. При прогрессировании лекарственной нефропатии происходит гибель большинства нефронов, вследствие чего без лечения у пациента через 3-4 года болезни развивается хроническая почечная недостаточность. Патологические колебания показателей водно-электролитного обмена, возникающие при снижении процессов фильтрации и реабсорбции мочи, могут провоцировать появление или усугубление кардиальной патологии (аритмии, ишемической болезни сердца), нарушение кальциевого обмена с последующим остеопорозом.
При возникновении острой почечной дисфункции, связанной по времени с приемом потенциально нефротоксичных лекарственных средств, постановка диагноза медикаментозной нефропатии обычно не представляет сложностей. Более тщательный диагностический поиск требуется при постепенном нарастании почечной симптоматики у пациента, длительное время принимающего определенный фармацевтический препарат. Для диагностики лекарственных нефропатий рекомендованы лабораторно-инструментальные методы, позволяющие оценить морфологическую структуру и функциональную способность почек:
- Общий анализ мочи. При разных вариантах патологического состояния в материале может определяться снижение или значительное повышение относительной плотности, эритроциты, лейкоциты, цилиндры, кристаллы солей. Для оценки реабсорбционной функции канальцев исследование часто дополняют пробой Зимницкого.
- Биохимический анализ крови. О снижении фильтрационной функции свидетельствует повышение уровней креатинина, мочевой кислоты, мочевины, изменение содержания калия, кальция, натрия, фосфора. Дисбаланс ионов возможен при нарушении их реабсорбции. При протеинурии возникает гипо- и диспротеинемия.
- Нефрологический комплекс. Определение работоспособности органа базируется на данных о содержании креатинина, мочевины, мочевой кислоты, макроэлементов. Показательным является появление в моче белка, глюкозы, микроальбумина. В качестве дополнительного метода рекомендована геморенальная проба Реберга, тест Сулковича.
- Сонография. УЗИ почек выявляет увеличение или уменьшение размеров органа, диффузные и очаговые изменения в паренхиме и мозговом веществе. Ультразвуковое сканирование дополняют УЗДГ, позволяющим оценить ренальный кровоток, при необходимости — томографией (МРТ, КТ).
- Внутривенная урография. По данным о выведении контрастного вещества оцениваются особенности кровоснабжения почек и их функциональная активность. Экскреторная урография может быть дополнена нефросцинтиграфией. Из-за возможного усугубления симптоматики обследование пациентов с ОПН проводится ограниченно.
- Пункционная биопсия почек. Гистологическое исследование биоматериала дает возможность наиболее точно оценить состояние гломерул, канальцев, интерстициальной ткани, капилляров, артериол. Результаты биопсии почек являются особо ценными для выбора врачебной тактики у больных с хроническими медикаментозными нефропатиями.
В общем анализе крови возможно умеренное ускорение СОЭ, повышение уровня эозинофилов, снижение содержания эритроцитов и гемоглобина. Дифференциальная диагностика проводится с острым и злокачественным гломерулонефритом, нефропатией при подагре, волчанке, аутоиммунных васкулитах, мочекаменной болезнью, туберкулезом почек, идиопатическим интерстициальным нефритом. Кроме уролога или нефролога к консультированию пациента может привлекаться анестезиолог-реаниматолог, токсиколог, ревматолог, иммунолог, фтизиатр, инфекционист, онколог.
Лечение лекарственной нефропатии
Врачебная тактика ведения больных с медикаментозной нефрологической патологией учитывает клинико-морфологическую форму и особенности патогенеза заболевания. В любом случае лечение начинается с отмены лекарственного средства, вызвавшего нефропатию. При острых процессах оправданы методы, направленные на элиминацию повреждающего соединения, — прием антидотов (при наличии), промывание желудка, гемосорбция, плазмаферез, ускорение экскреции (назначение сорбентов, слабительных средств). Терапия проводится с учетом фильтрующей и реабсорбционной функций. В зависимости от клинической ситуации могут применяться:
- Кортикостероиды. Глюкокортикоидная терапия средними и высокими дозами оправдана при иммунном патогенезе нефропатии, осуществляется для быстрого купирования аутоиммунных и аллергических реакций. Иммуносупрессорный эффект включает уменьшение отека интерстиция, подавление функций макрофагов, ограничение лейкоцитарной миграции в воспаленных тканях, угнетение синтеза медиаторов воспаления и антител. Глюкокортикостероиды эффективно стабилизируют клеточные и лизосомальные мембраны.
- Симптоматические средства. Почечная дисфункция сопровождается возникновением органных и системных расстройств, требующих экстренной коррекции. Для восстановления водно-электролитного баланса, гемодинамики, микроциркуляции, тканевой перфузии применяется инфузионная терапия с введением коллоидных, кристаллоидных растворов, антиагрегантов, антикоагулянтов. При нарушении ренин-ангиотензиновой регуляции обычно требуется прием антигипертензивных препаратов.
- Заместительная почечная терапия. Экстраренальное очищение крови назначается для предупреждения тяжелых уремических осложнений при выраженной функциональной недостаточности. Гемодиализ, перитонеальный диализ, гемофильтрация, гемодиафильтрация могут проводиться в интермиттирующем режиме до восстановления почечных функций или постоянно при тяжелой ХПН. При хроническом течении медикаментозной нефропатии может потребоваться трансплантация почки.
Исход болезни зависит от своевременности лечения и степени повреждения почечной паренхимы. Если при острой нефропатии не происходит необратимых изменений в анатомической структуре органа, прогноз благоприятный. Возникновение массивной деструкции и ОПН при отсутствии адекватной терапии существенно повышает риск летального исхода. У пациентов с хроническими нефрологическими заболеваниями и отягощенным преморбидным фоном зачастую наблюдается стойкое снижение фильтрационных возможностей почек, которое можно несколько замедлить назначением медикаментозной терапии.
Для профилактики лекарственной нефропатии необходима коррекция доз препаратов, которые метаболизируются в почках, в соответствии со значениями клиренса креатинина, отказ от применения нефротоксичных лекарств при наличии факторов риска (пожилой возраст, женский пол, интеркуррентные заболевания, снижение ОЦК), исключение полипрагмазии.
2. Лекарственная нефропатия/ Лозинский Е.Ю., Шмыкова И.И., Лозинская Л.М., Елисеева Е.В.// Тихоокеанский медицинский журнал – 2005 - №2.
4. Лекарственные поражения почек: учебное пособие/ Калимуллина Д.Х. и др. под общ. ред. Бакирова А.Б. – 2016.
Болезнь Берже ( IgA-нефропатия , Идиопатическая возвратная гематурия , Очаговый пролиферативный гломерулонефрит , Синфарингитная гематурия )
Болезнь Берже – это форма гломерулонефрита инфекционно-аутоиммунного характера, характеризующаяся мезангиопролиферативным воспалением с отложением иммунных комплексов. Клиническое течение сопровождается периодической макрогематурией вскоре после инфекционных заболеваний дыхательных путей, органов ЖКТ, изредка возможна постоянная микрогематурия, протеинурия, нефротический синдром с перемежающейся ОПН. Диагностика основывается на результатах лабораторных исследований мочи, иммунограммы крови, гистологического изучения биоптата почки. В лечении патологии используют симптоматическую терапию, иммуносупрессивные средства, антигипертензивные препараты.
Болезнь Берже (IgA-нефропатия) также известна под названиями очаговый пролиферативный гломерулонефрит, синфарингитная гематурия или идиопатическая возвратная макрогематурия. Синонимические названия отражают разные черты патологии – пролиферативный характер воспаления почек, рецидивирующее развитие гематурии и ее связь с заболеваниями верхних дыхательных путей (фарингитом). Считается самым распространенным вариантом гломерулонефрита в мире – средняя частота встречаемости составляет 5 случаев на 100 тысяч населения, в азиатских странах регистрируется в 5-6 раз чаще, колеблется от 5 до 30% всех случаев воспаления почек. Мужчины страдают от синдрома Берже в несколько раз чаще женщин, среди заболевших преобладают лица в возрасте от 15 до 30 лет. Наблюдается некоторая сезонность обострений (увеличение в осенне-зимний период), что связано с большей частотой простудных заболеваний в холодное время года.
Болезнь Берже является патологией со сложной и многофакторной этиологией, включающей в себя ряд инфекционных, иммунологических и генетических особенностей организма. Достоверно доказана взаимосвязь заболевания с рядом бактериальных и вирусных инфекций, некоторыми аутоиммунными патологическими состояниями и определенными генетическими мутациями. Роль генетики в патогенезе состояния косвенно доказывают также особенности этнического и расового распространения болезни. Таким образом, выделяют следующие группы этиологических факторов:
- Инфекционные факторы. К ним относят разнообразные бактериальные и вирусные инфекции дыхательных путей, ЖКТ, кожи. У многих больных в анамнезе часто обнаруживаются ангины, гастрит, вирусный гепатит, герпесвирусная инфекция. Считается, что поражение почечной ткани при этих инфекциях обусловлено нетипичной иммунологической реакцией на антигены возбудителя.
- Иммунологические факторы. Патогенетическим субстратом состояния считается появление иммунных комплексов, которые не могут элиминироваться печенью и почками. Причиной их образования являются нарушения синтеза разных форм иммуноглобулина А, нетипичная реакция иммунитета на экзогенные (инфекционные, реже аллергенные) и эндогенные (опухолевые, клеточные) антигены.
- Генетические факторы. Этнические особенности распределения синдрома Берже обусловлены генетическими факторами. В частности, у больных обнаружены нетипичные мутации на 6-й хромосоме, изменения в генах, контролирующих синтез цепей главного комплекса гистосовместимости и рецепторов гепатоцитов. Выявлена повышенная частота развития патологии у лиц, имеющих некоторые наследственные заболевания – целиакию, галактоземию и ряд других.
Роль влияния внешних факторов является предметом обсуждения – возможно, они выступают причиной полиморфной клинической картины состояния. Употребление некоторых продуктов питания, характерных для азиатского региона (неочищенный рис, морепродукты), может усугублять течение нефропатии, что наряду с генетическими особенностями становится причиной более частой регистрации заболевания на этой территории. Роль сопутствующих патологий (артериальной гипертензии, воспалений мочевыводящих путей) в развитии болезни на сегодняшний момент не установлена.
В настоящее время известно несколько основных патогенетических сценариев развития IgA-нефропатии. При заболевании в крови возникают иммунные комплексы, содержащие полимерные формы иммуноглобулина А, которые обычно выделяются на слизистых оболочках и в ничтожном количестве встречаются в кровотоке. Выделение повышенных количеств полимерных разновидностей IgA обусловлено аномалиями их синтеза в костном мозге и нарушениями элиминации через печень по причине дефектов в рецепторах гепатоцитов. В конечном итоге единственным путем выведения иммуноглобулинов и связанных с ними антигенов становятся почки, но размер молекул слишком велик, поэтому они могут откладываться в клубочках нефронов.
Отложения иммунных комплексов в тканях почек активируют лейкоцитарную реакцию и систему комплемента, из-за чего возникает вялое диффузное воспаление с попаданием в мочу эритроцитов и незначительных количеств белка. Влияние факторов, активирующих синтез иммуноглобулинов (воспалительные реакции, инфекционные заболевания), приводит к попаданию больших количеств IgA в выделительную систему и усиливает иммунные реакции. Именно с этим связаны обострения IgA-нефропатии вскоре после перенесенных ангин, ларингитов, заболеваний ЖКТ, вирусных инфекций. Выраженность воспалительных проявлений в период обострения может быть высокой, способна приводить к преходящей острой острой почечной недостаточности. Скрытее и вялотекущие формы могут протекать бессимптомно длительное время, развитие ХПН в большинстве случаев занимает десятки лет.
Болезнь Берже подразделяют на несколько клинических форм, которые характеризуются разной тяжестью проявлений, прогностическими данными и подходами к лечению. Разделение является условным – разновидности состояния могут перетекать одно в другое. Это дает повод некоторым исследователям рассматривать их как стадии развития единого патологического процесса, прогрессирующего под действием внешних и внутренних факторов. Значительные различия в скорости прогрессирования приводят к видимости существования различных форм нефропатии. В урологии и нефрологии выделяют три основные формы заболевания:
- Синфарингитная форма. Считается самой распространенной, проявляется периодическими обострениями, которые связаны с воспалительными заболеваниями дыхательных путей или желудочно-кишечного тракта (кишечная инфекция). Пик проявлений возникает через 1-2 дня после инфекционной патологии, их выраженность колеблется от макрогематурии и болей в пояснице до преходящей ОПН. В период между обострениями никаких клинических или лабораторных симптомов нефропатии не определяется.
- Латентная форма. Регистрируется примерно у трети больных, характеризуется менее выраженными симптомами, но считается более серьезной в прогностическом отношении. Обычно никаких субъективных проявлений не обнаруживается, признаки синдрома Берже выявляются при лабораторном исследовании мочи в виде слабой протеинурии и микрогематурии. Количество выделяемого с мочой белка постепенно увеличивается, фильтрующая способность почек уменьшается, что создает условия для развития ХПН.
- Нефротическая форма. Диагностируется у небольшого процента больных с IgA-нефропатией, сопровождается выраженной протеинурией, макрогематурией, онкотическими отеками, гиповолемией и гиперлипидемией. Крайне редко возникает первично, обычно становится осложнением синфарингитных и латентных форм заболевания.
Симптомы болезни Берже
Клинические проявления зависят от формы данного состояния. Самая распространенная синфарингитная гематурия характеризуется резким началом на 2-3 сутки после инфекционного заболевания – фарингита, ларингита, кишечной инфекции. Иногда пусковым фактором болезни Берже могут выступать вакцинации, тяжелые физические нагрузки, длительные инсоляции (солнечный загар, посещение солярия). Пациенты жалуются на боль и дискомфортные ощущения в области поясницы, моча становится красноватого оттенка (макрогематурия), ее количество уменьшается. В редких случаях регистрируются признаки ОПН – задержка мочи с последующей полиурией, нарушения водно-солевого обмена. У некоторых пациентов приступ сопровождается повышением уровня артериального давления. Чаще всего при синфарингитной форме IgA-нефропатии почечная функция полностью восстанавливается через несколько дней или недель.
Латентная разновидность болезни характеризуется скрытым течением с практически полным отсутствием симптомов поражения почек. В анализе мочи определяются патологические изменения – выделение белка и небольших количеств крови. У ряда больных имеются жалобы на боли в мышцах, суставах, периодические отеки. Со временем при отсутствии лечения такая форма заболевания ведет к развитию хронической почечной недостаточности. Нефротическая форма, напротив, характеризуется выраженной клинической картиной – нефротическим синдромом с резкими отеками тела, развитием асцита, признаками обезвоживания по причине потери жидкости с мочой.
Основным и самым распространенным осложнением IgA-нефропатии является почечная недостаточность. Острые формы (ОПН) могут возникать при приступе синфарингитных разновидностей и иногда при нефротическом типе заболевания. Хроническая почечная недостаточность развивается медленно, регистрируется в течение 15 лет примерно у половины больных. Среди прочих осложнений нефропатии выделяют риски развития гиповолемического шока, нефротического криза, тромбозов на высоте приступа болезни. Отсутствие комплексного лечения во много раз повышает риск возникновения почечной недостаточности и других осложнений нефропатии.
В нефрологии определение патологии Берже производится на основании результатов общего осмотра пациента, сбора анамнеза, лабораторных данных (общих, биохимических и иммунологических показателей крови и мочи). Кроме того, в спорных случаях может быть назначено гистологическое исследование почек, цистоскопия, рентгенографические методы диагностики – в основном, для исключения других заболеваний. Осложняют диагностику патологии такие обстоятельства, как рецидивирующее течение синфарингитных форм (в период ремиссии проявления нефропатии практически не обнаруживаются) и отсутствие явной симптоматики при наличии латентных разновидностей. Все диагностические мероприятия при нефропатии разделяют на группы:
- Физикальный осмотр и сбор анамнеза. При расспросе пациента обращают внимание на частоту аллергических и инфекционных состояний в прошлом, пытаются найти их взаимосвязь с почечными проявлениями (гематурией, болью в пояснице). Нефротические типы нефропатии характеризуются наличием отеков, увеличением живота из-за асцита, симптомами почечной недостаточности.
- Лабораторные исследования крови. Изменения в общем анализе крови незначительные – при остром приступе возможно увеличение СОЭ, нерезко выраженный лейкоцитоз, повышение гематокрита. Биохимические показатели изменяются сильнее – увеличивается уровень глобулинов крови, креатинина (из-за нарушенной фильтрации в почках), при развитии нефротического синдрома возникает гипоальбуминемия и гиперлипидемия. Иммунологическое исследование крови указывает на рост уровня IgA и небольшое снижение фракций комплемента.
- Лабораторные исследования мочи. При синфарингитном типе патологии в моче отмечается макрогематурия, протеинурия до уровня 1-2 г/л, иммунологическое исследование обнаруживает наличие комплексов на основе IgA и незначительное количество компонентов комплемента (С3). Латентный вариант болезни Берже проявляется слабо выраженной протеинурией (до 0,3 г/л), наличием выщелоченных эритроцитов в моче.
- Инструментальная диагностика. УЗИ почек часто не выявляет специфических изменений на начальных этапах заболевания, лишь при длительном течении можно обнаружить незначительное уменьшение размеров органа. В основном УЗИ и УЗДГ почек применяются для дифференциальной диагностики. Экскреторная урография указывает на задержку контраста по причине пониженной фильтрационной способности.
- Гистологическое изучение.Биопсия почек с гистологическим исследованием материала является наиболее точным методом диагностики IgA-нефропатии. Обнаруживаются признаки воспаления в мезангиальном пространстве, гистохимическими методами в нем выявляются отложения иммунных комплексов.
Дифференциальную диагностику IgA-нефропатии проводят с другими формами нефропатии, мочекаменной болезнью, онкологическими поражениями органов мочевыделительной системы. Для этого больным назначают цистоскопию, рентгенологические и ультразвуковые исследования, определяют уровень уратов в биохимическом анализе крови. Вспомогательную роль в диагностике нефропатии играет выявление заболеваний, способных спровоцировать поражение почек – воспаления миндалин, гепатитов, кишечных инфекций.
Лечение болезни Берже
Этиотропное специфическое лечение не разработано, врачами-нефрологами используется симптоматическая, нефропротективная и поддерживающая терапия. При развитии почечной недостаточности показано назначение гемодиализа по показаниям. Трансплантация почек, применяющаяся в исключительных случаях, не является эффективным методом лечения – примерно у каждого второго больного в пересаженном органе развиваются аналогичные изменения. Это говорит о преимущественно экстраренальных причинах патологии. Наиболее часто при лечении заболевания используют следующие методы:
- Нефропротективная терапия. Применяют препараты, снижающие артериальное давление (ингибиторы АПФ, блокаторы ангиотензиновых рецепторов) и антиагреганты (дипиридамол). Помимо лекарственных средств для снижения нагрузки на выделительную систему рекомендуют поддержание оптимального водного режима, ограничение потребления поваренной соли.
- Антибактериальная терапия. Назначается в тех случаях, когда точно доказана взаимосвязь между нефропатией и наличием очага бактериальной инфекции (при синфарингитных формах). Выбор антибиотика и схема его приема зависят от характера возбудителя, что определяется при дополнительной диагностике. Иногда применяют метод удаления инфекционного очага (тонзиллэктомию).
- Противовоспалительная терапия. С этой целью назначают глюкокортикостероидные средства (преднизолон и его аналоги). Их используют при всех формах данной нефропатии, дозировка зависит от выраженности протеинурии, которая отражает степень повреждения почек.
- Иммуносупрессивная терапия. Применение цитостатиков и других иммуносупрессоров показано при тяжелых случаях и выраженном иммунологическом повреждении органов выделительной системы. Их включают в комплексную терапию нефротических форм болезни Берже.
В зависимости от наличия других симптомов повреждения почек и экстраренальных проявлений больным также показана инфузионная терапия, статины (для уменьшения уровня липидов крови), гипотензивные средства. Важен отказ от вредных привычек – курения, употребления алкоголя. Во избежание провоцирования приступа гематурии следует избегать физических нагрузок, длительного нахождения под солнцем.
Прогноз болезни Берже неопределенный, зависит от показателей конкретного больного. По статистике, в течение 16-20 лет приблизительно у 30-50% пациентов развивается ХПН, но ее прогрессирование крайне медленное и доброкачественное. При правильном соблюдении предписаний врача и поддерживающей терапии качество жизни больных сохраняется на высоком уровне. Методы профилактики патологии не разработаны, некоторые специалисты рекомендуют своевременное полноценное лечение хронических инфекций (воспаления миндалин и других), но достоверных данных, что эти меры позволяют избежать синфарингитной нефропатии, нет. Профилактические мероприятия (водный режим, ограничение соли, исключение вредных привычек) дают возможность существенно замедлить прогрессирование повреждения почек.
Мембранозный гломерулонефрит (мембранозная нефропатия)
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
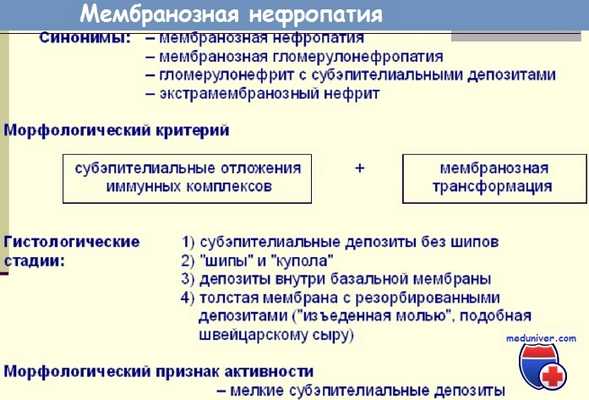
Мембранозный гломерулонефрит (мембранозная нефропатия) характеризуется диффузным утолщением стенок капилляров клубочков, связанным с диффузным субэпителиальным отложением иммунных комплексов, расщеплением и удвоением ГБМ. Клеточной пролиферации нет или она минимальна. Антиген, ответственный за образование иммунных комплексов при первичной мембранозной нефропатии, не известен.
Код по МКБ-10
Эпидемиология
Частота мембранозной нефропатий среди всех морфологических типов нефрита составляет, по данным различных авторов, 3-15%. По данным P. Zucchelli и S. Pasquali (1998), среди 4060 биопсий, выполненных в течение 25 лет, мембранозная нефропатия была найдена в 319 случаях (7,8%).
Мембранозный гломерулонефрит (мембранозная нефропатия) развивается в любом возрасте, чаще у взрослых (особенно в возрасте 30-50 лет), чем у детей. У мужчин бывает чаще, чем у женщин, и протекает тяжелее. У взрослых мембранозная нефропатия - самая частая причина нефротического синдрома (20-40% случаев), у детей с нефротическим синдромом наблюдается менее чем в 1% случаев.
У большинства больных основные симптомы мембранозного гломерулонефрита (мембранозной нефропатии)- это нефротический синдром, реже протеинурия без нефротического синдрома. У 25-40% больных возможна микрогематурия. Макрогематурия и гипертензия в начале заболевания наблюдаются редко, в дальнейшем гипертензия развивается у 20-50% больных. Содержание сывороточного комплемента почти всегда в норме, редко снижено (например, в случаях, этиологически связанных с вирусным гепатитом В или с системной красной волчанкой).
При этом типе нефрита часто (у 30-35% больных) удаётся установить связь с известными антигенами - HBV, опухолевыми, лекарственными.
В связи с этим в клинической практике следует особенно тщательно обследовать больных с мембранозной нефропатией с целью возможного выявления в первую очередь опухоли (особенно лёгких, почек), инфицирования вирусами гепатита и др.
Другой особенностью является частая связь с различными системными и другими заболеваниями: системной красной волчанкой, аутоиммунным тиреоидитом, синдромом Шегрена, сахарным диабетом, псориазом и др.
У больных с мембранозной нефропатией с нефротическим синдромом чаще, чем при других морфологических вариантах гломерулонефрита, развиваются тромботические осложнения.
R.C. Atkins и R. Bellomo (1993) на основе своих наблюдений и данных литературы приводят следующие цифры частоты тромбозов у больных с мембранозной нефропатией: тромбоз почечных вен - у 29%, лёгочные эмболии - у 17% и глубокие тромбозы конечностей - у 17%.
Причины мембранозного гломерулонефрита (мембранозной нефропатии)
Рак почки, лёгких, кишечника
Мембранозная нефропатия рецидивирует в трансплантате примерно у 10% больных, а также может развиться в трансплантате почки de novo.
Где болит?
Что нужно обследовать?
Как обследовать?
Какие анализы необходимы?
К кому обратиться?
Лечение мембранозного гломерулонефрита (мембранозной нефропатии)
Лечение мембранозного гломерулонефрита (мембранозной нефропатии) будет разным у больных без и с нефротическим синдромом.
Больные без нефротического синдрома с нормальной функцией почек не нуждаются в иммунодепрессивной терапии, так как риск развития почечной недостаточности у них минимален и нет опасности осложнений, связанных с нефротическим синдромом. Эти больные должны находиться под регулярным наблюдением, чтобы своевременно выявлять повышение уровня артериального давления, протеинурии, креатинина.
При протеинурии более 1,5-2,0 г/сут показаны ингибиторы АПФ, снижающие протеинурию и замедляющие профессирование болезни, а при повышенном уровне холестерина - гиполипидемические препараты.
У больных с нефротическим синдромом и сохранной функцией почек терапевтические подходы различны.
Общепринято проведение этим больным адекватной симптоматической терапии: диуретики, ингибиторы АПФ - для снижения протеинурии и замедления профессирования, при необходимости - другие антигипертензивные, гиполипидемические препараты, антикоагулянты для предупреждения тромботических осложнений (о последнем эффекте мнения неоднозначны).
Необходимость применения иммунодепрессантов - наиболее спорный вопрос в лечении мембранозного гломерулонефрита (мембранозной нефропатии).
Ряд исследователей считают, что МН имеет вполне благоприятный прогноз, поэтому не следует подвергать больных опасной терапии, за исключением тех ситуаций, когда развиваются нарушение функции почек, выраженная протеинурия (>10 г/сут) или тяжёлые проявления НС, ухудшающие состояние больного.
Сторонники иммунодепрессивной терапии высказываются в пользу раннего лечения, поскольку у определённой части больных могут развиться почечная недостаточность и тяжёлые осложнения нефротического синдрома (особенно тромбозы и другие сердечно-сосудистые катастрофы). Позднее начало терапии, когда возникают почечная недостаточность и тубулоинтерстициальные изменения, менее эффективно; кроме того, у больных с почечной недостаточностью выше риск осложнений иммунодепрессивной терапии. Мы считаем активную терапию показанной всем больным МН с нефротическим синдромом.
Данные последних крупных исследований свидетельствуют о том, что 10-летняя почечная выживаемость нелеченых больных МН с нефротическим синдромом составляет 60-65%. У 38% нелеченых больных развиваются спонтанные (полные или частичные) ремиссии нефротического синдрома, но в большинстве случаев они появляются только после 2 лет течения нефротического синдрома и крайне нестабильны.
Установлены основные факторы, в определённой степени предсказывающие почечный прогноз: наибольший риск развития профессирующей почечной недостаточности имеют пожилые мужчины, больные с высокой и персистирующей протеинурией (>1 г/сут), исходным снижением функции почек, фокальным гломерулосклерозом и тяжёлыми тубулоинтерстициальными изменениями. В то же время нельзя с определённостью предсказать, у кого из больных разовьётся спонтанная ремиссия.
Результаты различных методов лечения мембранозного гломерулонефрита (мембранозной нефропатии)
В отношении методов активной (иммунодепрессивной) терапии преимущество отдают цитостатикам (алкилирующие препараты) или сочетанию глюкокортикоидов и цитостатиков.
Наилучшие результаты получены в 10-летнем итальянском многоцентровом исследовании: 6-месячное лечение с ежемесячным чередованием метил-преднизолона и хлорбутина (схема С. Ponticelli) по сравнению с симптоматическим лечением в 2 раза повысило частоту ремиссий нефротического синдрома (соответственно 62% и 33%) и снизило частоту хронической почечной недостаточности (через 10 лет 8% и 40%).
За исключением двух неконтролируемых исследований на малом числе больных, нет данных, подтверждающих эффективность азатиоприна.
Возможная альтернатива комбинации преднизолона и хлорбутина - лечение мембранозного гломерулонефрита (мембранозной нефропатии) только кортикостероидами или циклоспорином.
Кортикостероиды как монотерапию применяют реже. У 5-10% больных ремиссия может развиться уже через короткий срок, но у большинства для её достижения кортикостероиды необходимо применять в высоких дозах длительно.
Предлагают приём преднизолона через день (200 мг каждые 48 ч) в течение 6-12 мес.
Внутривенные пульсы метилпреднизолоном (1 г в течение 3 дней - в 1-й, 3-й и 5-й месяц) на фоне приёма преднизолона через день (0,5 мг/кг каждые 48 ч) - другой хорошо переносимый режим, хотя менее эффективный, чем сочетание преднизолона с хлорбутином.
Циклоспорин в неконтролируемых клинических испытаниях в 20% случаев вызывал полные ремиссии нефротического синдрома и ещё в 25% - частичные, однако после отмены циклоспорина у большинства больных быстро развивались рецидивы. У некоторых больных ремиссия может длительно поддерживаться относительно низкими дозами [3,0-3,5 мгДкгхсут)], и при медленной отмене препарата риск обострения значительно снижается.
Лечение мембранозного гломерулонефрита (мембранозной нефропатии) у больных пожилого возраста
Почечный прогноз у лиц старше 65 лет обычно хуже, чем у более молодых. Однако в наблюдениях P. Passerini (1993) и С. Rollino (1995) результаты 6-месячной терапии МП и хлорбутином у лиц старше и моложе 65 лет существенно не различались. В то же время побочные эффекты у пожилых были чаще и тяжелее, поэтому при иммунодепрессивной терапии дозы препаратов должны быть меньше у пожилых, чем у молодых.
Подходы к лечению больных с почечной недостаточностью те же, что и больных с нормальной функцией почек. Однако из-за высокой чувствительности этих больных к побочному действию иммунодепрессантов начинать лечение следует только при реальных шансах на успех.
Пульсы метилпреднизолоном с последующим пероральным приёмом преднизолона в умеренной дозе у части больных с почечной недостаточностью способствуют транзиторному снижению уровня креатинина. Более обнадёживающие результаты получили при длительном (1-2 года) приёме циклофосфамида или 6-месячном лечении метилпреднизолоном и хлорбутином, но для снижения токсичности доза МП должна быть уменьшена до 0,5 г внутривенно, а хлорбутина - 0,1 мг/кгхсут).
При противопоказаниях к активной иммунодепрессивной терапии или при её неэффективности показано лечение ингибиторами АПФ, гиполипидемическими препаратами, дипиридамолом; возможно, гепарином.
Показания к лечению больных с мембранозной нефропатией с медленно прогрессирующей почечной недостаточностью
Читайте также:
