Введение в нарушения менструального цикла
Добавил пользователь Alex Обновлено: 28.01.2026
Для цитирования: Саидова Р.А. Нарушения менструального цикла в периоде полового созревания. РМЖ. 1999;18:886.
Кафедра акушерства и гинекологии ММА им. И.М. Сеченова
9-10 лет – появляются гиперемия и пигментация ареол молочных желез;
10-11 лет – нагрубание молочных желез (ареола, субареолярный узелок, затем рост ткани молочной железы), начальное оволосение лобка, созревание слизистой влагалища;
11-12 лет – рост внутренних и наружных гениталий, изменение соотношения тело матки/шейка матки с 1:3 до 1:1, рост молочных желез. появление подмышечного оволосения;
12-13 лет – пигментация сосков, первая менструация – менархе, ановуляторные циклы, рост тела в длину, увеличение размеров молочных желез, развитие половых путей – формирование многослойного эпителия влагалища;
13-14 лет – овуляция, обычно устанавливается через 1-2 года после менархе, маточные трубы – расширение просвета, дифференциация структуры стенки, образование ворсинок и секрета, появление перистальтики;
14-15 – акне, снижение тембра голоса;
16-17 – прекращение роста скелета.
Реализация индивидуальной генетически обусловленной фенотипической программы формирования и развития половых органов и вторичных половых признаков обеспечивается продукцией половых гормонов (стероидов) и чувствительностью тканей в органах-мишенях к эстрогенам и андрогенам. Эстрогены обеспечивают развитие молочных желез, матки (до соотношения тело матки/шейка матки 2:1 и длины в 7см), жировой клетчатки по женскому типу (в области ягодиц, молочных желез, на бедрах). Среднее содержание эстрадиола в возрасте 12-16 лет варьирует от 7 до 105 пг/мл (25,7-385 пмоль/л). Развитие вторичных половых признаков и внутренних половых органов реализуется монотонным воздействием эстрогенов до формирования овуляторых циклов, поскольку в последующем ежемесячное повышение концентрации эстрадиола на фоне развития преовуляторного фолликула блокируется последующей комбинацией с повышенной концентрацией прогестерона.
Андрогены обеспечивают лобковое и подмышечное оволосение, акне. Средний уровень тестостерона составляет 0,2-2,0 нмоль/л. Взаимодействие андрогенов и эстрогенов обеспечивает рост костей скелета, формирование наружных гениталий, закрытие эпифизарных зон роста.
Уровень гонадотропных гормонов (ГТ) в препубертатном периоде ниже базального уровня репродуктивного периода. К возрасту менархе уровень фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) достигает нижней границы уровня взрослых женщин, причем концентрация гонадотропинов у менструирующих девочек выше, чем у неменструирующих сверстниц. От раннего пубертата до среднего повышается амплитуда и, возможно частота импульсов ЛГ при ночном сне. В позднем пубертате повышается амплитуда импульсов ЛГ и в дневное время, но до достижения уровня секреции ГТ взрослой женщины амплитуда ночных импульсов больше дневных.
Формирование нормального менструального цикла в периоде полового созревания связано с развитием секреции ЛГ под действием гонадолиберина (ГТРГ), а также уменьшением отрицательного обратного влияния яичника на гипоталамус, приводящим к повышению уровней ЛГ и ФСГ, причем ФСГ повышается быстрее ЛГ. Отрицательная связь, возможно, имеет место перед рождением, в перинатальном и препубертатном периодах, и характеризуется высокой чувствительностью, так как уровень половых стероидов в циркуляции ничтожно мал; обусловливает взаимосвязь эстрогены – ФСГ и формирует менструальный цикл.
Положительная обратная связь, обусловливающая взаимосвязь эстрогены ЛГ, формируется постепенно в течение нескольких лет практически до окончания пубертата; существует предположение, что необходимо длительное воздействие эстрогенов на передний гипофиз для формирования зрелых механизмов регуляции репродуктивной системы. L. Neinstein установил, что через 5 лет после менархе овуляторный цикл имеют 80% девушек.
Функционирование репродуктивной системы по зрелому репродуктивному типу – это зрелость механизмов взаимодействия всех звеньев на всех уровнях репродуктивной системы.
При становлении менструальной функции у девочек постепенно стабилизируется выделение ГТРГ, обусловливает появление сначала олигоменореи, затем ановуляторых циклов с недостаточностью лютеиновой фазы, а затем адекватных овуляторных циклов с полноценным желтым телом.
Период полового созревания является критическим периодом постнатального развития женского организма, когда формируются связи, обеспечивающие взаимодействие пяти основных уровней репродуктивной системы; на протяжении этого периода происходит дальнейший рост и развитие женского организма. В процессе созревания репродуктивной системы происходит активация периферических эндокринных желез, роль которых определяет ускорение созревания или "растормаживания" центральных гипоталамических структур и целый ряд процессов в центральной нервной системе, конечным итогом которых является поступление в гипофиз потоков импульсов гонадолиберина.
Среди факторов, приводящих к развитию тех или иных нарушений менструальной функции, можно выделить средовые и генетические, которые тесно связаны между собой. При определении роли генетических и иммунных факторов в формировании нарушений репродуктивной системы центрального генеза было показано, что у 47% обследованных имеются семейные "накопления" отклонений по I , II и III степеням родства как по материнской, так и по отцовской линиям. Среди кариотипов у больных девушек чаще, чем в контрольной группе, встречаются варианты со сниженным содержанием гетерохроматина и мозаицизмом.
Таким образом, девушки, у которых в пубертате формируются отклонения менструальной функции, уже генетически представляют собой особую группу с высокой склонностью к аномальному функционированию репродуктивной системы. Извращения стрессорной реакции, появившиеся в пубертате, сохраняются и в репродуктивном периоде при некоторых заболеваниях, например, при синдроме поликистозных яичников.
Наиболее частыми заболеваниями периода полового созревания являются гипоталамический синдром периода полового созревания (ГСППС), задержка полового развития (ЗПР), нарушения менструального цикла, в том числе ювенильные маточные кровотечения (ЮМК) и олигоменорея.
Гипоталамический синдром и задержка полового развития
ГПСС представляет собой комплекс симптомов полигландулярной дисфункции с нарушениями обменных, трофических процессов, менструального цикла и нарушениями сердечно-сосудистой и нервной системы. Патогномоничным для синдрома является наличие стрий, свидетельствующее об эпизодах гиперкортицизма. Данное заболевание считается наиболее распространенной формой нарушений в периоде полового созревания, его частота в популяции достигает 4,5-5,9%.
ЗПР определяется как недоразвитие или отсутствие вторичных половых признаков в 13-14 лет и отсутствие менструаций в 15 лет. Выделяются наследственные, органические и функциональные формы. Частота центральных форм ЗПР составляет 14-20% среди всех форм задержек полового развития.
Нарушение менструального цикла
К нарушениям менструального цикла в периоде полового созревания могут приводить дисфункции других эндокринных желез (надпочечники, щитовидная железа), хронические инфекции (тонзиллит, холецистит). Нарушения менструальной функции разделяются на:
l меноррагии – увеличение объема менструального кровотечения более 80 мл за весь период и/или продолжительности менструации более 7-8 суток, при этом сохранена регулярность менструального цикла;
l метроррагии – кровянистые выделения, которые не связаны с менструацией, появляются как при сохраненном менструальном цикле, так и при его отсутствии.
Ювенильными маточными кровотечениями (ЮМК) принято называть маточные кровотечения при исключении органической патологии внутренних половых органов (миома матки, аденомиоз, эндометрит, гиперпластические процессы эндометрия) и системных заболеваний (заболевания крови, печени и т.п.). Уровень ФСГ, ЛГ и эстрадиола при ЮМК представлены на рисунках 1 и 2.
Характеристикой функционально полноценного эндометрия является возможность имплантации оплодотворенной яйцеклетки и полноценная реакция отторжения в менструацию, которая развивается только после резкого спада гормонов овуляторного цикла. По уровню эстрогенов все кровотечения обычно разделяют на гипоэстрогенные, нормоэстрогенные и гиперэстрогенные – такое деление весьма условно, поскольку картина маточного кровотечения обычно разворачивается на фоне спада гормонов. Следует учитывать предшествующий кровотечению уровень эстрогенов, оценивая по данным ультразвукового сканирования величину эндометрия, объем яичников, состояние фолликулярного аппарата в яичниках.
ЮМК классифицируются по двум группам:
l Первая группа – овуляторные кровотечения: по типу гиполютеинизма, по типу гиперлютеинизма, с укорочением первой фазы менструального цикла. По гормональным параметрам данные кровотечения расцениваются как нормоэстрогенные, вызванные спадом прогестерона. В периоде полового созревания наблюдаются редко.
l Вторая группа – ановуляторные кровотечения: по типу персистенции зрелого фолликула (гиперэстрогенные), по типу персистенции незрелых фолликулов (гиперандрогенные), по типу атрезии фолликулов (гипоэстрогенные). Кровотечение определяется как вызванное спадом эстрогенов. Ановуляторные кровотечения наиболее часто наблюдаются в периоде полового созревания.
Диагностика и лечение
Обязательным является исследование системы гемостаза с определением общего коагуляционного потенциала крови, поскольку уменьшение способности к тромбообразованию приводит к увеличению объема и длительности менструального кровотечения. При обнаружении нарушений в системе гемостаза (микроциркуляторно-тромбоцитарном или прокоагулянтном звене) целесообразно проведение коррекции гемостаза, а при отсутствии эффекта от гемостатической терапии решить вопрос о гормонотерапии.
Больные с нарушениями менструального цикла и ЮМК нуждаются в проведении динамического обследования (УЗИ, определение уровня пептидных и стероидных гормонов крови).
При определении концентрации пептидных гормонов следует рассчитывать коэффициент соотношения ЛГ/ФСГ. При величине индекса равном 0,6-0,7 прогноз гемостатической терапии является благоприятным. При величине индекса ЛГ/ФСГ менее 0,5 или более 1,0 прогноз гемостатической терапии неблагоприятный.
Больным с нарушениями менструального цикла по типу меноррагии и метроррагии, а также ЮМК при толщине эндометрия менее 0,5-0,7 см; величине индекса ЛГ/ФСГ=0,6-0,7; концентрации пролактина менее 400 мМЕ/л и показана гемостатическая терапия в режиме перорального введения: глюконат кальция 1,5 г/сут, этамзилат 1,5 г/сут, транексамовая кислота 250 мг 2-3 раза/сут.
Больным с нарушениями менструального цикла по типу меноррагии, метроррагии или ЮМК, при толщине эндометрия более 0,8 см и менее 1,1 см; индексе ЛГ/ФСГ=0,6–0,7; концентрации пролактина менее 405 мМ Е/л; концентрации кортизола менее 400 нмоль/л и показана комплексная гемостатическая терапия в режиме парентерального введения (кальция хлорид 10% 10,0 1-2 раза/сут, этамзилат 12,5% по 2,0-4,0 3-4 раза/сут, транексамовая кислота 5,0 2 раза/сут).
Больным с нарушениями менструального цикла по типу меноррагии и метроррагии, а также ЮМК, при толщине эндометрия 1,1-1,35 см; индексе ЛГ/ФСГ менее 0,5 или более 1,0; показана гормональная терапия препаратами с содержанием этинилэстрадиола не менее 50 мкг с расчетом 150-200 мкг/сут с целью остановки маточного кровотечения, учитывая прогнозируемую неэффективность проводимой гемостатической терапии.
Больным с ЮМК при толщине эндометрия более 1,35 см; индексе ЛГ/ФСГ менее 0,5 или более 1,0; концентрации пролактина более 400 мМЕ/Л; показано инструментальное выскабливание эндометрия (кюретаж) с целью остановки маточного кровотечения и последующего гистологического исследования биоптата.
В последующем обязательна терапия с целью нормализации менструальной функции и профилактики рецидивов маточных кровотечений. При гиперэстрогенных ановуляторных нарушениях показана терапия гестагенами во вторую фазу цикла или стимуляция овуляции у девочек в возрасте старше 15 лет (норэтистерон по 5 мг/сут с 16 дня цикла по 10 дней).
При гипоэстрогенных ановуляторных нарушениях показана терапия комбинированными эстроген-гестагенными препаратами по 10-21-дневной схеме, предпочтительнее препаратами последнего поколения, а также циклическая гормонотерапия.
При гиперандрогенных нарушениях рекомендуется назначение препаратов, содержащих ципротерон ацетат.
При нарушениях, вызванных дисфункцией центральных регулирующих механизмов показана центральная терапия: циклическая витаминотерапия (глютаминовая и фолиевая кислота в первую фазу цикла, токоферол и аскорбиновая кислота – во вторую фазу регулируемого менструального цикла, а также ноотропные препараты (пирацетам), а в зависимости от данных ЭЭГ – фенитоин по 0,17 2 раза/сут.
Обследование и лечение пациенток периода полового созревания должен проводить специалист по гинекологии детского и подросткового возраста, поскольку приемы, используемые во взрослой гинекологии, не всегда приемлемы для девочек и девушек.
Нарушение процесса становления менструальной функции в периоде полового созревания оказывает неблагоприятное влияние на репродуктивную систему женщины во все последующие периоды ее жизни.
Профилактика и лечение гинекологических заболеваний, связанных с гормональным дисбалансом, должны начинаться в пубертате, а при проведении их в репродуктивном периоде следует учитывать как возрастные параметры, так и особенности патологического процесса, во многом обусловленные характером нарушений репродуктивной системы в периоде полового созревания.
1. период новорожденности до 28 дней;
2. нейтральный период до 7 лет;
3. препубертатный период с 7 лет до менархе;
4. пубертатный период с менархе до 15 лет;
5. подростковый период – 16-18 лет.
| Рисунок 1. Уровни ЛГ и ФСГ у больных ювенильными маточными кровотечениями |
| Рисунок 2. Уровень эстрадиола у больных ювенильными маточными кровотечениями |
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Нарушения менструального цикла
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Нарушения менструального цикла: причины появления, при каких заболеваниях возникают, диагностика и способы лечения.
Определение
Нарушения менструального цикла (НМЦ) – это не патология, а лишь симптом неполадок в женском организме. Физиологически нормальным проявлением протекающего овариально-менструального цикла считается возникновение менструаций с индивидуальной для каждой женщины периодичностью и длительностью. Менструациями называют повторяющиеся маточные кровотечения, во время которых вместе с менструальной кровью из организма выходят неоплодотворенная яйцеклетка, частички эндометрия и слизистые выделения шейки матки. В норме они не сопровождается выраженной кровопотерей вследствие быстрого сокращения сосудов, и их объем составляет около 150 мл.
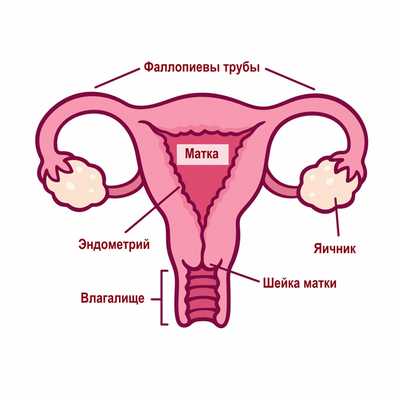
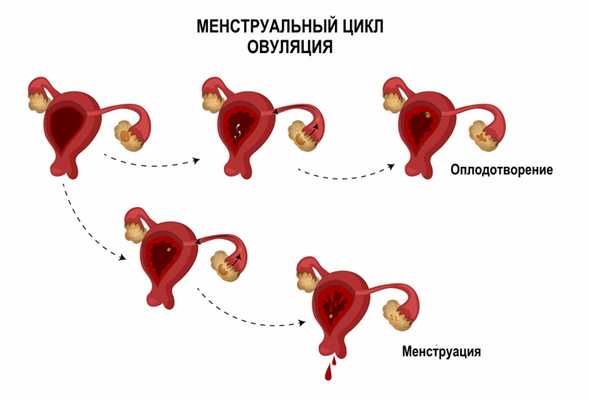
Менструальный цикл – это не только менструация, но и созревание яйцеклетки в яичнике, овуляция и разрастание эндометрия для потенциального внедрения в него оплодотворенной яйцеклетки.
У здоровой женщины репродуктивного возраста могут наблюдаться ановуляторные менструальные циклы, во время которых оплодотворение не происходит вследствие отсутствия выхода яйцеклетки. С возрастом количество таких циклов увеличивается.
Менархе (первые менструации) обычно развивается к 11-15 годам и говорит о готовности репродуктивной системы женщины к оплодотворению. Время появления менархе у всех индивидуально и зависит от множества факторов, например, веса, рациона питания с достаточным количеством жиров, наследственности и т.д.
Разновидности нарушения менструального цикла
Менструальный цикл зависит от слаженной работы эндокринной системы, поэтому наиболее частой причиной его нарушений является гормональный дисбаланс.
- Нарушения, связанные с патологией головного мозга (гипоталамо-гипофизарных структур), которые влекут за собой сбой нейроэндокринной регуляции половой функции.
- Патология матки и/или яичников.
- Врожденные патологии, в том числе хромосомные.
- Заболевания других эндокринных органов, например, гипо- и гипертиреоз.
Нарушения менструального цикла после 40 лет могут быть связаны с угасанием репродуктивной функции женского организма, при этом закономерно уменьшается количество эстрогенов, нарастает число ановуляторных циклов, могут возникать дисфункциональные маточные кровотечения.
Неравномерность менструального цикла у девочек пубертатного возраста объясняется как незавершенным формированием репродуктивной системы, так и с распространенным в этом возрасте увлечением диетами, при которых организм недополучает необходимые для синтеза половых гормонов жиры.
Симптомы нарушения менструального цикла:
- Изменение длительности цикла в сторону уменьшения (менее 21 дня) или увеличения (более 35 дней).
- Задержка менструации при нормальной периодичности предыдущих.
- Аменорея – отсутствие менструаций у женщины репродуктивного возраста более 6 месяцев (может быть первичной и вторичной; вторичная характерна для девочек пубертатного периода).
- Изменение объема менструальной кровопотери в сторону увеличения или уменьшения.
- Изменение продолжительности менструации в сторону уменьшения или увеличения.
- Появление межменструальных выделений различной степени выраженности.
- Клинически выраженный болевой синдром (альгоменорея, альгодисменорея).
При увеличении объема и длительности менструального кровотечения, появлении ацикличных кровотечений существует риск развития железодефицитной анемии.
У многих женщин с нарушениями менструального цикла связано бесплодие – отсутствие наступления беременностей в течение 1 года регулярной половой жизни без использования контрацепции. При этом наличие ановуляторных циклов зачастую не проявляется ничем, кроме как отсутствием зачатия, поэтому женщина считает себя репродуктивно здоровой.
Нарушения менструального цикла в разные возрастные периоды жизни женщины
Ювенильный период (до 21 года). Характерны задержки менструаций, пубертатные кровотечения, нарушение оволосения, недостаточность или избыточность массы тела. Провоцирующим фактором могут быть стресс, изменения цикла сон–бодрствование.
Репродуктивный период (до 45–50 лет). Следует различать патологические причины нарушений менструального цикла и физиологические.
К физиологическим причинам относят изменения менструального цикла на фоне наступившей беременности, при грудном вскармливании, при использовании внутриматочных контрацептивов.
Одной из частых патологических причин является формирование фолликулярной кисты: яйцеклетка не оплодотворяется, отмечается чрезмерный рост фолликула, что ведет к разрастанию эндометрия. Этот процесс может длиться до 6–8 недель, напоминая развитие беременности, но затем следует обильная менструация, являющая собой дисфункциональное маточное кровотечение. Патологические кровотечения могут развиваться в овуляторный период, что связано с недостаточностью лютеиновой фазы (то есть гормональным дисбалансом). Изменений менструального цикла в сторону увеличения следует ожидать после аборта (самопроизвольного (выкидыша) или медицинского, в том числе и лекарственного). Восстановление менструального цикла обычно занимает около трех месяцев, при наличии осложнений процесс приобретает затяжной характер.
Менопаузальный период и пременопауза. Во время пременопаузы изменение гормонального фона в условиях угасания репродуктивной функции ведет к сбою цикличности, обильным менструациям. Кроме того, женщины жалуются на необъяснимые смены настроения, вегетативные нарушения (так называемый климактерический синдром).
Маточные кровотечения в период менопаузы являются тревожным симптомом и требует незамедлительного обращения к врачу.
Беременность при нарушенном менструальном цикле возможна, но ее наступление зависит от степени выраженности расстройств. Зачастую нарушение менструаций ведет к самопроизвольному прерыванию беременности на ранних сроках.
К каким врачам обращаться при нарушении менструального цикла
Любое нарушение менструального цикла требует обращения к врачу-гинекологу. В большинстве случаев эти нарушения имеют благоприятный исход, но около 10% приходится на онкогинекологические заболевания. При необходимости гинеколог может назначить консультацию эндокринолога.
Диагностика нарушений менструального цикла
Ведущую роль в диагностическом поиске играет сбор анамнеза с обязательным уточнением множества факторов: наличия беременностей и особенностей их протекания, методов контрацепции, перенесенных заболеваний, оперативных вмешательств, определение индекса массы тела.
Для исключение воспалительных заболеваний органов малого таза, чаще всего вызванных такими инфекциями, как гонококк, генитальный герпес, уреаплазма, микоплазма, хламидия, гарднерелла, бледная спирохета, трихомонада, цитомегаловирус берется мазок на микрофлору с определением чувствительности возбудителя к антимикробным препаратам.
Определение ДНК возбудителя гонореи (Neisseria gonorrhoeae) в секрете простаты, эякуляте методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального време�.
Категории МКБ: Аномальное маточное и влагалищное кровотечение неуточненное (N93.9), Другие уточненные аномальные кровотечения из матки и влагалища (N93.8), Обильные, частые и нерегулярные менструации (N92)
Общая информация
Краткое описание
Утверждено на Экспертной комиссии
по вопросам развития здравоохранения
Министерства здравоохранения Республики Казахстан
протокол № 10 от «04» июля 2014 года
Аномальное маточное кровотечение ( АМК) – это любое отклонение менструального цикла от нормы, включающее изменения регулярности и частоты менструаций, продолжительности кровотечения или количества теряемой крови [1]. АМК могут быть подразделены на различные виды в зависимости от объема кровопотери, регулярности, частоты, продолжительности менструации, хронического течения и в связи с репродуктивным возрастом.
Понятие АМК включает в себя такие термины, как тяжелое менструальное кровотечение (heavy menstrual bleeding, HMB), подразумевающее более обильную по объему или длительности менструацию, а также нерегулярные (irregular menstrual bleeding) и длительные менструальные кровотечения (prolonged menstrual bleeding). При этом анемия не является обязательным критерием тяжелого МК [1].
I. ВВОДНАЯ ЧАСТЬ
Название протокола: Нарушения менструального цикла
Код протокола:
Код(ы) МКБ-10:
N92 Обильные, частые и нерегулярные менструации
N92.0 Обильные, частые менструации при регулярном цикле
N92.1 Обильные, частые менструации при нерегулярном цикле
N92.2 Обильные менструации в пубертатном периоде
N92.3 Овуляторные кровотечения
N92.4 Обильные кровотечения в предменопаузальном периоде
N92.5 Другие уточненные формы нерегулярных менструаций
N92.6 Нерегулярные менструации неуточненные
N 93 Другие аномальные кровотечения из матки и влагалища
N93.8 Другие уточненные аномальные кровотечения из матки и влагалища
N93.9 Аномальное маточное и влагалищное кровотечение неуточненное
Сокращения, используемые в протоколе:
АД – артериальное давление
АлАТ – аланинаминотрансфераза
АМК – аномальное маточное кровотечение
АМК-О – овуляторная дисфункция
АcАТ – аспартатаминотрансфераза
АЧТВ – Активированное частичное тромбопластиновое время
ВИЧ – кровь на вирус иммунодеффицита человека
ВОЗ – Всемирная организация здравоохранения
ВТЭ – венозная тромбоэмболия
ДМПА – депанированный медроксипрогестерон ацетат
ДНГ – диеногест
ИМТ - индекс массы тела
ИФА – иммунноферментный анализ
КОК – комбинированные оральные контрацептивы
ЛНГ – ВМС – левоногестрел – внутриматочная спираль-левоногестрел
МК – маточное кровотечение
МРТ – магнитно-резонансная томография
НПВП – нестероидные противовоспалительные препараты
ОАК – общий анализ крови
ОАМ – общий анализ мочи
ТВУЗИ – трансвагинальное ультразвуковое исследование
УД – уровень доказательности
ЦОГ – циклооксигеназа
FIGO – International Federation of Gynecology and Obstetrics (интернациональная федерация акушеров-гинекологов)
NICE – National Institute of Health and Care Excellence – национальный институт здравоохранения и социального обеспечения передового опыта
RW – сифилис
SIS (saline infusion sonography) - сонография с введением физиологического раствора
PALM - Polyp/ Adenomyosis/ Leiomyoma/ Malignancy (Полип/Аденомиоз/Лейомиома/Малигнизация)
COEIN – Coagulopathy/ Ovulatory dysfunction/ Endometrial/ Iatrogenic /Not yet classified (Коагулопатия/Овуляторная дисфункция/Эндометриальное/Ятрогенное/Еще не классифицировано)
Дата разработки протокола: 2014 год.
Категория пациентов: пациентки с различными видами нарушения менструальной функции.
Пользователи протокола: акушеры – гинекологи, врачи общей практики, терапевты, врачи скорой и неотложной помощи, фельдшеры.
Критерии, разработанные Канадской Целевой группой Профилактического Здравоохранения(Canadian Task Force on Preventive Health Care) для оценки доказательности рекомендаций
I: Доказательность основана, по крайней мере, на данных одного рандомизированного контролируемого исследования
Гормональная коррекция нарушений менструальной функции
Для цитирования: Саидова Р.А. Гормональная коррекция нарушений менструальной функции. РМЖ. 2002;7:346.
ММА имени И.М. Сеченова
Р епродуктивная система представляет собой суперсистему, функциональное состояние которой определяется обратной афферентацией составляющих ее подсистем. Функциональная состоятельность репродуктивной системы проявляется прежде всего в стабильности менструального цикла и эффективной генеративной функции с высокой степенью фертильности. Основной формой функционирования репродуктивной системы по зрелому фертильному типу является овуляторный, гормонально обеспеченный менструальный цикл.
В популяции здоровых женщин, имеющих регулярный менструальный цикл продолжительностью в 26–30 дней, число ановуляторных циклов минимально и составляет около 1,8–2,0%. Тогда как в популяции женщин с вариабельным менструальным циклом (от 23 до 35 дней) увеличивается число циклов с недостаточностью лютеиновой фазы (НЛФ), а число ановуляторных циклов возрастает до 7,7%. Лабильность менструального цикла связана главным образом с возрастом женщины и наиболее выражена в первые годы после менархе и в последние годы перед менопаузой. С возрастом продолжительность менструального цикла имеет тенденцию к укорочению.
Результаты обследования большого числа женщин 20–35 летнего возраста свидетельствуют о том, что примерно у 90% женщин менструальные циклы регулярные и имеют продолжительность в среднем 29,4±3,2 дня.
Регуляция менструального цикла
Согласно современным представлениям о регуляции менструального цикла, органом, обеспечивающим как становление циклического характера функционирования репродуктивной системы, так и поддержание его на протяжении репродуктивного периода женщины, является гипоталамус. В гипоталамусе вырабатывается рилизинг–гормон (ГТ–РГ), который инициирует синтез и высвобождение гонадотропинов (ГТ) – фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) специализированными клетками аденогипофиза – гонадотрофами.
Между секрецией гормонов у половозрелой репродуктивно здоровой женщины функционируют как отрицательные, так и положительные обратные связи. Примером отрицательной связи является усиление выделения ФСГ в ответ на снижение уровня эстрадиола. Пример положительной обратной связи – выброс ЛГ и ФСГ в ответ на овуляторный пик эстрадиола в периферической крови. По механизму отрицательной обратной связи увеличивается образование ГТ–РГ при снижении уровня ЛГ в клетках передней доли гипофиза.
Секреция ФСГ, как известно, активно возрастает в начале менструального цикла, так что значения базальной секреции гормона в несколько раз превышают таковую в лютеиновой фазе цикла. ФСГ стимулирует пролиферацию клеток гранулезы и способствует трансформации окружающей фолликул стромальной ткани в слой тека–клеток, регулируя таким образом дифференцировку и организацию стероидопродуцирующих тканей фолликула. Адекватное развитие фолликула и реализация его стероидогенной активности являются необходимой предпосылкой для реализации овуляции. В предовуляторном периоде под действием возрастающего уровня эстрадиола (Е2) развивающегося фолликула концентрация ФСГ снижается.
Частота и амплитуда импульсов ЛГ изменяется в соответствии с фазой менструального цикла. Секреция ЛГ достаточно высока и остается таковой на протяжении всей фолликулиновой фазы цикла. В сроки, близкие к овуляции, регистрируются пиковые значения ЛГ и ФСГ, которые синхронизированы во времени, но степень увеличения концентрации этих гормонов различна. В преовуляторный период выброс ЛГ становится высокочастотным и высокоамплитудным. После овуляции и формирования желтого тела частота импульсов ЛГ уменьшается до сравнимых с ранней фолликулиновой, а амплитуда при этом удваивается.
Экспериментальные и клинические данные позволили дать подробную характеристику динамики параметров положительной обратной связи, согласно которой стимулом для овуляторного пика ГТ является поддержание пороговой концентрации Е2 на уровне 200 пг/мл (735 пмоль/л) в течение 4–6 суток, т.е. периода, равного по времени фазе активной секреции гормона в нормальном овуляторном менструальном цикле (Keye W., Jaffe R.B., 1975).
Желтое тело является основной стероидопродуцирующей структурой яичника, определяющей концентрацию Е2 и прогестерона (Р) на протяжении лютеиновой фазы цикла. Структурное формирование желтого тела завершается в среднем к 7–8 дню после овуляции, при этом наблюдается непрерывное нарастание концентрации половых стероидов в периферической крови.
Определение концентрации Р применяется в настоящее время для верификации состоявшейся овуляции. 10–кратное увеличение уровня Р в крови во вторую фазу менструального цикла по сравнению с базальной продукцией свидетельствует о произошедшей овуляции (Vihko R., Apter D.,1981).
При регрессе желтого тела концентрация половых стероидов постепенно снижается, что сопровождается увеличением частоты и снижением амплитуды секреторных импульсов. Подобный характер выделения ГТ обеспечивает преимущественное увеличение в периферической крови ФСГ (по сравнению с ЛГ), что является стимулом к развитию очередного пула антральных фолликулов.
Исследования характера секреции гонадотропинов у женщин в постменопаузе и после овариэктомии, а также у овариэктомированных обезьян показывают, что выделение гонадотропинов из гипофиза происходит у них с постоянной амплитудой и частотой, составляющей примерно 1 импульс в час («цирхоральный» режим секреции ГТ – Dierschke D.J., Knobil E., 1970). Близкий по частоте к цирхоральному ритм секреции ГТ прослеживается и на протяжении большей части фолликулиновой фазы менструального цикла у женщин и у обезьян.
В лаборатории Knobil (Knobil E., Nakai G., Plant T.M., 1978) впервые в экспериментах на обезьянах, а позже Leyendecker G. и соавт. (1980, 1983) в клинических исследованиях была доказана физиологическая значимость цирхорального ритма работы гипоталамо–гипофизарной системы для реализации полноценного овуляторного менструального цикла.
Введение постоянной дозы рилизинг–гормона (1 инъекция в час) животным с поврежденными аркуатными ядрами гипоталамуса приводит к восстановлению полноценного овуляторного менструального цикла. Аналогичный ритм введения люлиберина неполовозрелым обезьянам вызывает у них появление овуляторного цикла (Wildt L. и соавт., 1980). Crowley J. и соавт. (1980), Leyendecker G. и Wildt L. (1983) и ряд других исследователей наблюдали при введении ЛГ–РГ в цирхоральном режиме восстановление овуляции у всех пациенток с гипоталамической формой аменореи.
E. Knobil считал, что эстрадиол способен изменять гонадотропную реакцию на режим выброса гонадолиберина через систему обратных связей исключительно на уровне переднего гипофиза. Правильность предложенной E. Knobil модели нейроэндокринной регуляции менструального цикла в цирхоральном режиме была подтверждена несколькими экспериментальными работами.
В фолликулярной фазе ритм выделения гонадотропинов близок к цирхоральному, в лютеиновой – снижается до 1 импульса в 3–5 часов (Santen R.J.,1973; Yen S.S.C. и соавт., 1974). Прослеживается обратная зависимость между частотой и амплитудой импульсов. Наблюдаемая вариабельность режима выделения ГТ обусловлена регулирующим влиянием половых гормонов. Большой серией клинических и экспериментальных работ убедительно доказана ведущая роль эстрадиола (Е2) и прогестерона в поддержании ритма секреции гонадотропинов, характерного для циклического функционирования репродуктивной системы.
Действие Е2 при этом выражается в подавлении амплитуды импульсов ГТ без изменения их частоты, а введение Р ведет к снижению импульсов и увеличению их амплитуды. Иными словами, воспроизводится ритм секреции ГТ, характерный для двухфазного овуляторного менструального цикла (Goodmann R.L. и Karsch F., 1980; Liu T.C. et Jackson G.L., 1984).
Нарушения менструального цикла
На основе многочисленных экспериментальных данных Leyendecker G., Wildt L. (1983) представили выводы о гипоталамическом происхождении факторов, лежащих в основе первичных и вторичных нарушений менструального цикла. Согласно предложенной схеме, половое созревание есть процесс становления ритма секреции люлиберина от полного его отсутствия в пременархе с последующим постепенным нарастанием частоты и амплитуды импульсов вплоть до установления ритма фертильной зрелой женщины. При этом организм проходит несколько стадий, при которых уровень секреции ГТ недостаточен первоначально для овуляции, а в последующем для формирования полноценного желтого тела.
В свою очередь, и вторичные формы нарушений менструального цикла, протекающие по типу недостаточности желтого тела, ановуляции, олигоменореи, аменореи, рассматриваются, как стадии одного патологического процесса, степень проявления которого зависит от характера нарушений в режиме секреции гонадолиберинов.
Недостаточность лютеиновой фазы расценивается, как наиболее простая и легкая форма нарушений репродуктивной системы. Характеризуется снижением стероидной активности желтого тела. Диагностическими критериями являются укорочение второй фазы цикла по данным базальной термометрии (менее 10 дней), уменьшение желтого тела по данным ультразвукового мониторинга на 21–23 день цикла, снижение концентрации прогестерона и эстрадиола на 7–8 день после овуляции. Лечение проводится чистыми прогестагенами во вторую фазу менструального цикла с целью достижения общей продолжительности лютеиновой фазы цикла в 10–14 дней.
Ановуляция является самой частой и более сложной формой нарушения репродуктивной системы. Чаще всего проявляется нарушениями менструального цикла (нерегулярный цикл с тенденцией к задержкам очередной менструации от нескольких дней до нескольких месяцев). Диагностическими критериями являются монофазная ректальная термограмма, отсутствие динамических изменений фолликулярного аппарата при ультразвуковом мониторинге, низкий уровень прогестерона в предполагаемую вторую фазу цикла (уровень прогестерона менее 15 нмоль/л или 5 нг/мл).
Аменорея проявляется отсутствием менструаций сроком более 6 месяцев при отсутствии беременности у женщин в возрасте от 15 до 45 лет при наличии матки и яичников. При развитии аменорея расценивается, как наиболее тяжелая форма нарушений репродуктивной системы.
По характеру стероидной активности ановуляция и аменорея могут быть гипоэстрогенной, гиперэстрогенной, гиперандрогенной. Суммарные эффекты эстрогенов условно могут быть оценены по характеристике эндометрия (толщина эндометрия более 8–10 мм – гиперэстрогенные; 5–7 мм – гипоэстрогенные; 2–4 мм – гиперандрогенные). Проводится также оценка фолликулярного аппарата яичников (определение числа и размеров фолликулов).
Принципы гормональной коррекции
При наличии разнообразных нарушений репродуктивной системы в виде, прежде всего, нарушений менструальной функции, адекватная гормональная терапия позволяет провести коррекцию имеющихся нарушений. Принципы гормональной коррекции основаны на проведении заместительной гормональной терапии. При недостаточности лютеиновой фазы, гиперэстрогенных формах хронической ановуляции или аменореи назначаются чистые прогестагены условно во вторую фазу менструального цикла или комбинированные оральные контрацептивы по общепринятой 21-дневной схеме. При гиперандрогенных состояниях рекомендуются препараты с антиандрогенными свойствами (ципротерон ацетат). При гипоэстрогенных состояниях рекомендуется проведение циклической гормональной терапии (эстрогены по 10–14 дней, прогестагены по 10–12 дней) или готовые формы трехфазного или двухфазного режима применения (Фемостон).
Прогестагены
В клинической практике используются различные прогестагены, обладающие индивидуальными свойствами. Лекарственные формы прогестагенов разнообразны и включают таблетки, депо–формы, препараты трасндермального применения, гели, вагинальные свечи, т.е. применяются препараты перорального, парентерального, трансдермального и вагинального действия.
При оценке того или иного биологического действия прогестагенов за основу принимаются 2 основных параметра: адекватная секреторная трансформация эндометрия и блокировка овуляции.
Обращает на себя внимание тот факт, что производные прогестерона оказывают преимущественное периферическое (тканевое) действие, в отличие от производных 19–норстероидов, которые оказывают выраженные антигонадотропные и метаболические эффекты.
Дюфастон (дидрогестерон) является мощным, перорально активным прогестагеном, который по молекулярной структуре и фармакологическому действию аналогичен эндогенному прогестерону. В отличие от большинства синтетических прогестагенов, производных 19 – норстероидов, дюфастон не обладает эстрогенной, андрогенной, анаболической и другой нежелательной активностью.
Молекулярная структура дидрогестерона почти идентична структуре природного прогестерона (рис. 1). Однако в молекуле дидрогестерона атом водорода, связанный с атомом углерода в 9 положении, находится в b –позиции, а метильная группа, связанная с атомом углерода в 10 положении, находится в a –положении, что противоположно структуре натурального прогестерона. Кроме того, в молекуле дидрогестерона имеется двойная связь между атомами углерода в 6 и 7–м положении (конфигурация 4,6–диен–3–она). Преимуществами структуры дюфастона являются более высокая биодоступность препарата после перорального введения и отсутствие метаболитов с эстрогенной и андрогенной активностью.
Рис. 1. Химическая структура прогестерона, дидрогестерона и тестостерона
Основным метаболитом дюфастона – 20 a –дигидроксидидрогестерон, который также обладает прогестагенной активностью. После перорального введения дидрогестерона, меченного радиоактивным изотопом, 63% введенной дозы элиминируется (в виде метаболитов) с мочой, причем 85% от этого количества выводится в течение 24 часов. Практически полная почечная экскреция введенной дозы заканчивалась через 72 часа. Средний период полувыведения дидрогестерона варьирует от 5 до 7 часов, а дигидроксидидрогестерона – от 14 до 17 часов.
Общим признаком всех метаболитов является сохранение конфигурации 4,6–диен–3–она, которая метаболически стабильна. Благодаря этой стабильности препарат не подвергается ароматизации, а из-за устойчивости к 17 a –гидроксилированию не обладает андрогенной активностью.
Для коррекции нарушений менструальной функции назначаются прогестины перорального применения по циклической или непрерывной схеме, а также в форме депо–препаратов. Существует несколько механизмов действия прогестинов, благодаря которым становятся возможными профилактика и лечение гиперпластических процессов эндометрия при синдроме хронической ановуляции:
- снижение действия инсулиноподобного фактора роста (ИФР–1) на эндометрий путем увеличения активности белков, связывающих ИФР–1;
- изменение активности 17–гидроксистероидной дегидрогеназы или активации гена подавления опухоли.
Благоприятный эффект при лечении меноррагий и метроррагий достигается при применении циклической схемы приема прогестагенов на протяжении 10–15 дней во вторую фазу цикла. Препарат назначают по 5–20 мг в день с 16 по 25 или с 11 по 25 день цикла. Прогестагены оказывают действие, обратное влиянию эстрогенов, суммарные эффекты которых на эндометрий оказываются весьма преувеличенными.
Обычно применяют следующие схемы: 15 мг норэтистерона, либо 300 мг прогестерона парентерально (натуральный), перорально или вагинально в сутки, либо 20 мг дидрогестерона в сутки.
Кроме того, для контроля гиперплазии эндометрия может быть использована схема, предложенная Druckmann R. (1995): в случае доминирования эстрогенов предложено начинать лечение прогестагенами с 5 по 25 день цикла с добавлением эстрадиола в конце цикла.
Циклическая гормональная терапия
При проведении циклической гормональной терапии предпочтение целесообразно отдавать препаратам, содержащим в своем составе близкие к натуральным эстрогенные и прогестагенные компоненты. Особенно этот факт следует учитывать у девушек в периоде полового созревания (15–20 лет) и у женщин старшего возраста (более 35–40 лет).
Фемостон представляет собой комбинированный препарат, предназначенный для заместительной гормональной терапии, в состав которого входят 17 b –эстрадиол (эстроген, идентичный натуральному эстрадиолу), и дидрогестерон – чистый прогестаген, активный при приеме внутрь. Биологическое значение подобной комбинации заключается в том, что дидрогестерон, не имея сродства к андрогенным, эстрогенным и минералокортикоидным рецепторам, не уменьшает биологических тканевых эффектов 17 b –эстрадиола.
Степень всасывания 17 b –эстрадиола зависит от размера частиц. Микронизированный 17 b –эстрадиол легко всасывается из желудочно–кишечного тракта. После достижения равновесной концентрации средний уровень 17 b –эстрадиола, вводимого 1 раз в день в дозе 2 мг, остается стабильным и составляет от 58 до 67 пг/мл (212–245 пмоль/л). Соотношение эстрон/эстрадиол составляет 5–6. При пероральной дозе 1 мг 1 раз в сутки средняя концентрация в крови достигает 28 пг/мл (103 пмоль/л), соотношение между эстроном и эстрадиолом составляет 7.
Концентрация 17 b –эстрадиола в плазме крови остается стабильной при его приеме 1 раз в день. Эстрон и эстрона сульфат являются главными конъюгированными и неконъюгированными метаболитами эстрадиола и обладают эстрогенными свойствами. 17 b –эстрадиол выводится главным образом с мочой в виде глюкуронидов 17 b –эстрадиола и эстрона. Полная элиминация эстрогенов происходит в течение 72 часов после введения.
Комбинированные исследования, посвященные изучению фармакологиии многократных доз, показали, что фармакокинетическое поведение дидрогестерона после достижения равновесной концентрации не меняется при одновременном применении 17 b –эстрадиола (1 или 2 мг/сутки). Кроме того, дидрогестерон, применяемый одновременно с 17 b –эстрадиолом, не оказывает клинически значимого влияния на кинетику и равновесную концентрацию 17 b –эстрадиола и его метаболитов.
Дидрогестерон в дозе 10–20 мг/сутки каждые 12 дней месяца противодействует стимулирующему влиянию на эндометрий конъюгированных эстрогенов (1,25 или 0,625 мг) и обеспечивает секреторную трансформацию, предупреждая развитие атипической гиперплазии эндометрия.
Тщательно подобранная индивидуальная гормональная терапия позволяет добиться коррекции имеющихся нарушений менструальной функции и стабилизации репродуктивной системы, что является профилактикой развития патологических гормональнозависимых состояний в последующем.
Читайте также:
