Взаимодействие белков с гистонами при образовании гетерохроматина
Добавил пользователь Morpheus Обновлено: 28.01.2026
Молекула ДНК огромна. Трудно себе представить, но в каждой клетке человеческого организма содержится ДНК длиной приблизительно 2м. Для того, чтобы уместить такое количество генетической информации необходима упаковка ДНК в хромосомы. Она осуществляется в том числе и с помощью гистонов.Гистоны- это нуклеопротеины, основная составляющая хроматина. Известно 5 классов гистонов: H1, H2A, H2B, H3 и H4. Гистоны- эволюционно-консервативные белки, все они имеют структурный мотив "спираль поворот спираль поворот спираль" (трехспирального домена), что способствует их димеризации. Каждый из них имеет 2 аминокислотных "хвоста", которые являются мишенью для последующей эпигенетической модификации и регуляции.
H2A, H2B, H3 и H4 формируют core - гистоновый октамер, структуру из 8 молекул гистонов (тетрамер (Н3)2-(Н4)2 и два димера Н2А-Н2В ), на которую наматывается ДНК. H1 (Linker histone) способствует правильному наматыванию ДНК на кор. Каждая нуклеосома состоит из H2A-H2B-димера и H3-H4-тетрамера. На одну нуклеосому(гистоновый октамер, обмотанный нитью ДНК) приходится 146 парнуклеотидов ДНК, оплетающей нуклеосому в виде лево-закрученной спирали. В дальнейшем "бусы" из нуклеосом сворачиваются, в конце концов образуя хромосому.

Гистоны, образуя нуклеосому, вступают во взаимодействие с ДНК:
1) положительно заряженные спирали H2B, H3, и H4 взаимодействуют с отрицательно заряженными фосфатными группами молекулы ДНК
2) Водородные связи между остовом ДНК иамидными группами цепей гистонов
3) Неполярные связи между гистонами идезоксирибозой ДНК
4) Водородные связи между боковыми цепями основных аминокислот гистонов (в основном лизинаи аргинина) и кислородом фосфатных групп ДНК
5) Неспецифическое взаимодействие N-концевых "хвостов" H3 и H2B гистонов с малой бороздкой молекулы ДНК.
Взаимодействуя с ДНК, гистоны выполняют свои функции. Кроме рассмотренной выше структурной функции (участие в компактизации), гистоныучаствуют в регуляции активности генов,репликации, репарации, рекомбинации ДНК. Гистоны подвергаются посттрансляционной модификации, что изменяет их взаимодействие с ДНК и ядерными белками. В основном модифицируются "хвосты", но могут модифицироваться и основные части белков (H2A и H3). Комбинация модификаций составляет " гистоновый код ".
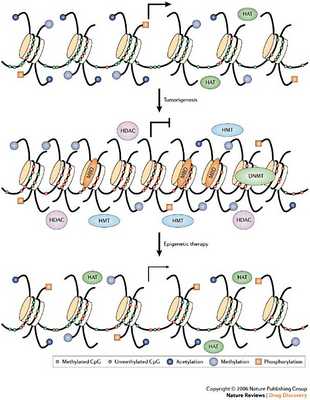
Как осуществляется регуляция активности генов? Рассмотрим схему: В верхней части схемы- ДНК неметилирована, "хвосты" гистонов ацетилированы- это позволяет транскрипционным факторам и РНК-полимеразе "сесть" на нить ДНК и начать транскрипцию.
Средняя часть схемы- в результате действия метилтрансферазы ДНК метилируется (а следовательно не может транкрибироваться, т.к не может связаться с транскрипционными факторами). Это может активировать деацетилазу гистонов.
Нижняя часть схемы- метилирование ДНК и деацетилирование гистонов приводит к конденсации хроматина и невозможности связывания транскрипционных факторов.
N- концевые "хвосты" гистонов содержат остатки аминокислоты лизина. Аминокислотная последовательность "хвостов", особенно местоположение остатков лизина, строго консервативна в эукариотических клетках, от дрожжей до человека. Лизин имеет положительно заряженную аминогруппу на эпсилон- атоме углерода (эпсилон- аминогруппа). Она ацетилируется гистоновой ацетилтрансферазой (HAT). Обратная реакция проходит под действием деацетилазы (HDA). Положительный заряд на амино- группе лизина взаимодействует с отрицательным зарядом фосфатных групп ДНК и отрицательно- заряженными фрагментами гистонового октамера. Нейтрализация основного заряда гистоновых "хвостов" ацетилированием снижает их сродство с ДНК и меняет гистон- гистоновые взаимодействия между соседними нуклеосомами, а также взаимодействия гистонов с др. регуляторными белками. Это делает возможной транскрипцию.
Активные гены обычно локализованы в гиперацетилированном хроматине, неактивные- в гипоацетилироанном. Транскрипционные факторы, активирующие транскрипцию, активируют HAT, факторы, ингибирующие (подабляющие) транскрипцию, активируют HDA.
При онкологических заболеваниях и некоторых вирусных инфекциях нарушается свойственный нормальной клетке баланс между ацетилированием и деацетилированием гистонов. Так,аденовирусный онкобелок Е1А ингибирует активность гистоновой ацетилтрансферазы, и, следовательно, гистоны остаются без ацетильной метки. В результате невозможно действие деацетилазы, а ведь от ее взаимодействия с определенным белком зависит подавление роста клеток раковой опухоли. Еще один пример касается ретинобластомного белка (RB), который в норме синтезируется в сетчатке и многих других тканях. Если ген этого белка поврежден, образуется измененный RB, неспособный связываться с транскрипционным комплексом, а тот, будучи без RB, не может взаимодействовать с гистоновой деацетилазой. В результате молчащие в нормальной клетке гены начинают работать, что и приводит к развитию онкологических заболеваний. Такой ход событий выявлен при многих раковых заболеваниях. Более того, некоторые вирусные онкобелки способны целенаправленно блокировать взаимодействие нормального ретинобластомного белка с гистоновой деацетилазой.
В проблеме связи ацетилирования/деацетилирования гистонов и старения существует много неясного. Известно, что с возрастом снижается уровень ацетилирования гистонов, в частности H4 гистона. Также выявлено, что от уровня ацетилирования гистонов зависит уровень активности генов супероксиддисмутазы, а следовательно, и защита клетки от оксидативного стресса, который, согласно некоторым теориям, и является фактором старения. Все эти вопросы требуют детального изучения.
Фосфорилирование гистонов осуществляется по сериновым остаткам. Фосфорилирование серина10 гистона H3 коррелирует с активацией генов в клетках млекопитающих и с индукцией транскрипции во время шоковой реакции у Drosophila. Покоящиеся фибробласты, обработанныефактором роста эпидермиса, быстро фосфорилируются по серину 10, что совпадает с индукцией раннего ответа генов, таких как c-fos. Это фосфорилирование катализируется с помощью Rsk-2-киназы, а клетки от пациентов с Rsk-2-дефицитом (Coffin-Lowry Syndrome) не подвергаются фосфорилированию по серину 10 или индукции c-fos в ответ на фактор роста эпидермиса.
Добавление негативно заряженных фосфатных групп в хвосты гистонов нейтрализует их базовый заряд и снижает их сродство к ДНК. Более того, некоторые ацетилтрансферазы обладают повышенной HAT- активностью на серин 10-фосфорилированном субстрате, а мутации серина 10 снижают активацию регулируемых Gcn5 генов (генов ацетилтрасферазы HAT). Таким образом, фосфорилирование может участвовать в активации транскрипции, стимулируя HAT активность того же самого гистонового "хвоста". Так, фосфоацетилирование гистона H3 влияет на процесс активации транскрипционных факторов c-fos- и c-jun, модифицируя тем самым экспрессию различных генов.
Фосфорилирование H2A коррелирует с конденсацией митотических хромосом. Мутация серина 10 в гистонах Tetrahymena обусловливает аномальную конденсацию хромосом и неправильное разделение хромосом в анафазе митоза.
Фосфорилирование H3 происходит после активации сигнального пути в ответ на повреждение ДНК. Например, эволюционно консервативный мотив (ASQE, in the single-letter amino-acid code) , обнаруживаемый на С-конце дрожжевого H2A и варианта H2A млекопитающих, H2A.X , быстро фосфорилируется в ответ на действие ДНК-повреждающего агента. Идентифицирован серин 139 как место для такой модификации, его фосфорилирование в ответ на повреждение зависит от фосфатидилинозитол-3-OH киназы Mec1 у дрожжей. Mec1-зависимое фосфорилирование серина 139, по-видимому, необходимо для эффективной негомологичной репарации ДНК.
гены-мишени пролиферативного транскрипционного фактор E2F. Предполагается, что образование транскрипционно- неактивного гетерохроматина в местах локализации генов, ответственных за пролиферацию, приводит к необратимой остановке клеточного цикла, характеризующей процесс старения. Возможно это связано с фосфорилированием гистонов, например фосфорилирование серина 93 в H1 гистоне.
Известно, что интенсивность метилирования гистонов меняется в течении клеточного цикла. Метилирование гистонов наблюдается во время перехода клеток из S в G2 - фазу. В период митоза происходит также метилирование богатых аргинином гистонов, что свидетельствует о наличии корреляции между метилированием белков хроматина и скоростью роста клеток. При этом необходимо подчеркнуть, что метилтрансферазы зрелых, эмбриональных и неопластических тканей имеют различную активность. Эти данные являются подтверждением того, что метилирование принимает участие в процессах дифференциации клеток, а метилирование белков хроматина является одним из параметров, которые характеризуют функциональное состояние клетки.
Модификации гистонов могут служить как cis-действующие связывающие места для вспомогательных факторов, таких как гетерохроматиновый белок 1, который связывается с гистоном H3 за счет метилирования по остатку лизина 9, что является основным биомолекулярным взаимодействием в гетерохроматине и контролируется Suv39h1 и Suv39h2гистоновой метилтрансферазой. Метилирование гистонов также происходит в гистоне H3 в позиции лизина 4, но в этом случае метилирование коррелирует с транскрипционной активностью. Сама ДНК может метилироваться в основном по остаткам цитозина в CpG динуклеотидах. Здесь также метилирование способствует биомолекулярным взаимодействиям между гетрохроматином и вспомогательными белками, такими, как MeCP2, and MBD1, 2 и 3(Писаржевский). Таким образом, метилирование лизина 9 в гистоне-3 и метилирование ДНК взаимозависимы. Иными словами, СН3-модификация ДНК определяется ее эпигенетическим выключением (т.е. метилированием гистоновых "хвостов") в составе хроматина (Карпов, 2005).Выключение генов, продукты которых подавляют раковые опухоли, и активация генов, необходимых для их роста, происходят одновременно. Расшифровка специфического эпигенетического "ракового кода" и "кода старения" на уровне метилирования ДНК имеет огромное практическое значение и уже сейчас может использоваться для диагностики онкологических заболеваний. Более того, правильно подобрав препараты, в идеале можно изменить "раковый код" и вернуть клетку к нормальному состоянию.
Для того, чтобы решить эти задачи, необходимо точно определить сайты метилирования и соответствующие им метилтрансферазы, механизмы функционирования метилтрансфераз.
Убиквитинирование- присоединение к белку небольшого белка убиквитина с помощью убиквитин-лигаз, осуществляется посттрансляционно для инициирования деградации, а также для регуляции локализации и функционирования белка. Потеря сайтов убиквитинирования приводит к дефектам мейоза и митоза.
Гистон H2B убиквитинируется с помощью Rad6 по лизину 123. Убиквитинирование гистонов служит сигналом для фактора COMPASS, который метилирует гистон H3 по лизину 4. В результате инактивируются располагающиеся рядом гены.
Кроме того, моноубиквитинирование H2A может останавливать элонгацию транскрипции с помощью ингибирования РНК-полимеразы II, а деубиквитинирование активирует транскрипцию.
Несомненно, что между процессами убиквитинирования гистонов и процессами старения и канцерогенеза есть связь, но этот вопрос еще малоизучен. Убиквитинирование так или иначе влияет на все этапы экспрессии генов, а значит его нарушение может приводить к патологическим изменениям в функционировании клетки, к раковому перерождению, старению. Необходимы исследования в этой области, т.к. механизмы этого процесса, его регуляции и возможные его изменения неизучены.
Сумоилирование схоже с убиквитинированием, оно представляет собой присоединение небольших убиквитин-подобных белков (Small Ubiquitin-like Modifier -SUMO). Также, как и убиквитинирование, сумоилирование важно для многих внутриклеточных процессов- внутриклеточном транспорте, регуляции транскрипции, апоптозе, ответе на стресс и прохождении клеточного цикла. В отличие от убиквитина, SUMO не направляют белок на деградацию.
Сейчас исследуется связь между сумоилированием гистонов и канцерогенезом, обсуждаются перспективы создания лекарств против рака, эффект которых основывается на воздействии на системы модификации гистонов, в том числе сумоилироание.
В лаборатории под руководством Филипа Брантона в McGill University,Montréal проводятся исследования связи сумоилирования гистонов с процессами старения и канцерогенеза. Было выяснено, что RBP1 (белок, ассоциированный с ретинобластомой) подавляет транскрипцию и клеточный рост (процессы, схожие со старением) , изменяя сумоилирование гистонов.
Модификации гистонов играют огромную роль в регуляции экспрессии генов, а следовательно, во всех внутриклеточных процессах. При нарушении процессов модификации изменяется экспрессия генов, что ведет за собой развитие различных заболеваний и старение. Эти вопросы еще недостаточно исследованы. внимание основной части ученых сконцентрировано на ацетилировании гистонов, тогда как другие, не менее важные процессы, вниманием обделены. Перспективы исследований огромны, потому что 21 век-это не столько век генетики, а в ек эпигенетики- изучения регуляции экспрессии генов . Возможно в будущем будут созданы лекарства от рака, мишенью которых будут ферменты, модифицирующие гистоны. Пора переходить от слов к действиям. Есть несколько вопросов, на которые необходимо ответить:
1) Как повлиять на ацетилирование гистонов для защиты от оксидативного стресса и старения?
2) Как повлиять на ацетилирование гистонов для борьбы с онкологическими заболеваниями?
3) Каков точный механизм участия фосфорилирования гистонов в возникновении онкологических заболеваний и старении?
4) Расшифровка специфического "ракового кода" и "кода старения" на уровне метилирования гистонов.
5) Подробности механизма убиквитинирования гистонов.
6) Как именно убиквитинирование связано с онкологическими и возрастассоциированными заболеваниями?
7) Как убиквитинирование гистонов участвует в процессе старения?
8) Как происходит сумоилирование гистонов?
9) Как сумоилирование связано с процессом старения?
10) Какова роль сумоилирования в возникновении онкологических заболеваний?
11) Как можно повлиять на механизмы модификации гистонов с целью достижения терапевтического эффекта при лечении возрастассоциированных заболеваний?
Ответы на эти вопросы необходимы для победы над старением.
Взаимодействие белков с гистонами при образовании гетерохроматина
• Гетерохроматин формируется на специфических последовательностях, и неактивная структура распространяется по фибрилле хроматина
• Гены в области гетерохроматина находятся в неактивном состоянии
• Поскольку длина неактивного региона варьирует от клетки к клетке, инактивация генов в этой области обусловливает эффект положения мозаичного типа
• Аналогичные эффекты распространения проявляются на теломерах и на молчащих кассетах, контролирующих тип спаривания у дрожжей
Интерфазное ядро содержит как эу-, так и гетерохроматин. Степень конденсации гетерохроматина почти такая же, как в митотических хромосомах. Гетерохроматин не проявляет активности. В интерфазе он остается в конденсированном состоянии, транскрипция в нем подавлена, репликация приходится на позднюю S-фазу, и чаще всего он локализован на периферии ядра. Гетерохроматин центромеры обычно содержит сателлитную ДНК.
Однако образование гетерохроматина не зависит от первичной структуры ДНК. Когда ген перемещается за счет хромосомной транслокации или трансфекции и интегрируется в другое положение, ближе к гетерохроматину, в результате попадания на новое место он может инактивироваться. При этом предполагается, что он приобретает черты гетерохроматинового гена.

Мозаичный эффект положения, проявляющийся в изменении цвета глаз,
возникает, когда белый ген интегрируется рядом с гетерохроматиновым участком.
Клетки, в которых белый ген неактивен, образуют бляшки белоглазости, а клетки с активным белым геном образуют красные бляшки.
Выраженность эффекта определяется близостью интегрированного гена к гетерохроматиновой области.
Такая инактивация является результатом эпигенетического эффекта. Для отдельных клеток эукариот он может проявляться по-разному и приводить к эффекту положения мозаичного типа (PEV), при котором генетически идентичные клетки обладают различным фенотипом. Этот эффект хорошо изучен у Drosophila. иллюстрирует эффект положения на примере окраски глаза дрозофилы, некоторые фасетки которого не имеют окраски, в то время как другие окрашены в красный цвет.
Это объясняется тем, что белая окраска вызвана геном, который в некоторых клетках инактивировался под действием примыкающего гетерохроматина, в то время как в других остался активным.
На рисунке ниже представлено схематическое объяснение этого эффекта. Инактивация распространяется на разное расстояние от гетерохроматина в примыкающие области. В одних клетках она заходит достаточно далеко для того, чтобы инактивировать соседний ген, в других клетках этого не наблюдается. Это происходит в определенный момент эмбрионального развития, после чего состояние гена передается всем клеткам-потомкам. Потомки, произошедшие от клеток с инактивированным геном, образуют фасетки с фенотипом, отражающим выпадение признака (в данном случае неокрашенные, т. е. белого цвета).

Чем ближе располагается ген к гетерохроматиновой области, тем выше вероятность того, что он будет инактивирован. Это позволяет предполагать, что образование гетерохроматина представляет собой двухэтапный процесс: вначале на специфической последовательности происходит нуклеация, а затем неактивное состояние распространяется по фибрилле хроматина.
Расстояние, на которое оно распространяется, точно не известно; скорее всего, процесс имеет стохастическую природу, и на него влияют такие параметры, как количество белковых компонентов, играющих ограничительную роль. К числу факторов, влияющих на процесс распространения, относится активация промоторов в определенной области; активный промотор может ингибировать распространение гетерохроматина.
Гены, расположенные поблизости от гетерохроматиновых областей, находятся в неактивном состоянии и поэтому в большинстве клеток неактивны. Эта модель предполагает, что границы гетерохроматиновой области могут меняться в зависимости от присутствия необходимых белков.
У дрожжей известен т. н. эффект теломерного молчания, аналогичный эффекту положения мозаичного типа у Drosophila: гены, локализованные в области тело-меры, в различной степени инактивированы. Это объясняется эффектом распространения гетерохроматина от теломеры.
Для дрожжей характерна еще одна форма эффекта молчания. Тип спаривания у них определяется активностью одного локуса (МАТ), однако в геноме содержатся две копии таких последовательностей (HML и HMR), которые находятся в неактивной конфигурации. Молчащие локусы HML и HMR имеют много общего с гетерохроматином, и их можно рассматривать как его небольшие области.
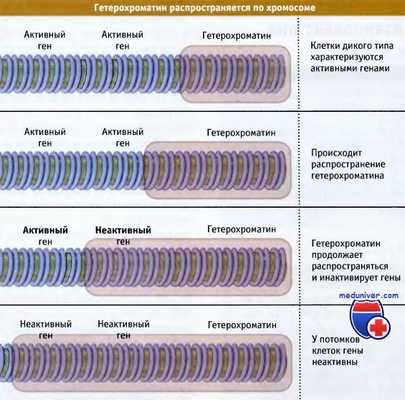
Распространение участка гетерохроматина приводит к инактивации генов.
Вероятность инактивации гена определяется его расстоянием от гетерохроматиновой области.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• НР1 представляет собой ключевой белок, образующий гетерохроматин. Он действует, связываясь с метилированным гистоном Н3
• Белок RAP1 инициирует образование гетерохроматина у дрожжей, связываясь со специфическими последовательностями ДНК
• Мишенями для RAP1 служат теломерные повторы и молчащие последовательности, расположенные в HML и HMR
• RAP1 участвует в отборе белков SIR3/SIR4, которые взаимодействуют с N-терминальными участками Н3 и Н4
Инактивация хроматина происходит вследствие добавления белков к фибрилле нуклеосом. Она может быть вызвана многими причинами, например конденсацией хроматина, в результате которой он становится недоступным для аппарата генной экспрессии, присоединением белков, непосредственно блокирующих доступ к регуляторным сайтам, или же непосредственно ингибирующих транскрипцию.
Известны две системы инактивации хроматина: НР1 у млекопитающих и комплекс SIR у дрожжей. Хотя белки, входящие в их состав, различаются, процесс осуществляется по общему механизму: точками контакта в хроматине служат N-терминальные участки молекул гистонов.
Белок НР1 (гетерохроматиновый белок 1) был идентифицирован в составе гетерохроматина при окрашивании политенных хромосом соответствующими антителами. У дрожжей 5. pombe гомолог этого белка кодируется геном swi6. Белок, первоначально идентифицированный как НР1, в настоящее время называется HP1а, поскольку в дальнейшем были обнаружены еще два близких белка, НР1b и НР1y.
Белок НР1 содержит область, которая называется хромодомен и располагается вблизи N-концевого участка молекулы, а также связанный с ней другой домен, который называется хромотеневым и располагается на карбоксильном участке молекулы. О важности хромодомена свидетельствует тот факт, что в нем локализовано большинство мутаций, нарушающих функционирование белка НР1. Хромодомен состоит из 60 аминокислот. Он обнаружен в белках, принимающих участие как в активации, так и в репрессии хроматина, что позволяет предполагать его роль в белок-белковых взаимодействиях. Хромодомен(ы) обеспечивают взаимодействие белков с гетерохроматином за счет узнавания метилированных остатков лизина в гистоновых «хвостах».
Мутации по ацетилазе, затрагивающие H3Ac-14Lys, предотвращают метилирование 9 Lys. Гистон Н3, который метилируется по 9 Lys, связывает белок НР1 через хромодомен. На рисунке ниже представлена модель образования гетерохроматина. Вначале происходит удаление ацетильной группы с 14 Lys с помощью деацетилазы. Затем при участии метил азы в «хвосте» гистона Н3 создается метилированный сайт, к которому присоединяется белок НР1. На рисунке ниже показано, что между хромодоменом и метилированным лизином происходит взаимодействие, которое служит событием, запускающим процесс формирования неактивного хроматина. Как показано на рисунке ниже, в дальнейшем неактивная область может распространяться по хроматину, за счет способности все новых молекул НР1 к взаимодействию между собой.
Существование общего механизма формирования молчащих последовательностей у дрожжей подтверждается зависимостью их активации от общего набора генетических локусов. Мутации по любому из этих генов вызывают активацию двух молчащих локусов (HML и HMR), а также ослабляют степень инактивации генов, расположенных поблизости от теломерного гетерохроматина. Поэтому продукты этих генов ответственны за поддержание неактивного состояния обоих типов гетерохроматина.
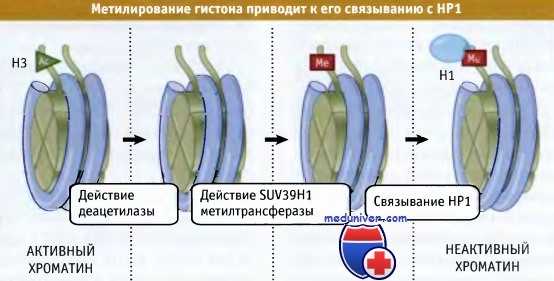
Фермент SUV39H1 представляет собой гистон метилтрансферазу,
которая метилирует Lys-9 в гистоне Н3.
НР1 связывается с метилированным гистоном.
На рисунке ниже представлена модель, описывающая механизм действия этих белков. Лишь один из них способен связываться со специфической последовательностью ДНК. Это белок RAP1, который связывается с С1-3А повторами в теломерной области и присоединяется к цис-элементу сайленсинга, необходимому для подавления активности HML и HMR. Белки SIR3 и SIR4 реагируют с RAP1 и друг с другом (они могут функционировать как гетеромультимер). SIR3/SIR4 взаимодействуют с N-терминальными «хвостами» гистонов Н3 и Н4. (Фактически первое свидетельство в пользу непосредственного участия гистонов в формировании гетерохроматина было получено при исследовании мутаций, активирующих локусы HML и HMR, которые расположены в области генов, кодирующих синтез Н3 и Н4.)
Критическую роль в узнавании последовательностей ДНК, участвующих в формировании участков гетерохроматина, играет белок RAP1. Он обеспечивает взаимодействие белков SIR3/SIR4 с гистонами Н3 и Н4. Когда они связались с гистонами, образование комплекса может продолжаться и распространяться по хроматину дальше. Это может приводить к инактивации участка хроматина либо из-за ингибирующего эффекта SIR3/SIR4, либо из-за того, что связывание с гистонами НЗ/Н4 вызывает дальнейшие изменения в структуре хроматина. Мы не знаем, какие факторы ограничивают распространение комплекса. С-концевой участок молекулы SIR3 по составу близок к ядерным ламинам (компонентам ядерного матрикса) и может участвовать в фиксации гетерохроматина на периферии ядра.
Сказанное также справедливо для молчащих локусов HMR и HML. В образовании комплекса участвуют три фактора, проявляющих специфичность к определенным последовательностям ДНК: RAP1, ABF1 (фактор транскрипции) и ORC (комплекс начала репликации). В этом случае белок SIR1 взаимодействует с фактором, связанным с определенной последовательностью, и запускает процесс образования репрессорной структуры, состоящей из белков SIR2, SIR3 и SIR4. Белок SIR2 представляет собой деацетилазу гистонов. Реакция деацетилирования необходима для поддержания связывания белка SIR с хроматином.
Каким образом комплекс сайленсинга подавляет активность хроматина? Этот комплекс может вызвать такую конденсацию хроматина, что регуляторные белки окажутся не в состоянии найти свои мишени. Проще всего было бы предположить, что присутствие комплекса несовместимо с факторами транскрипции и РНК-полимеразой. Возможно, что комплексы блокируют ремоделирование хроматина (и таким образом предотвращают связывание этих факторов) или же непосредственно блокируют сайты связывания, тем самым предотвращая присоединение к ним факторов транскрипции.
Впрочем, все может быть не так просто, поскольку факторы транскрипции и РНК-полимеразу можно обнаружить в промоторной области неактивного хроматина. Это позволяет считать, что комплекс сайленсинга предотвращает функционирование факторов, а не их связывание с хроматином. Фактически может наблюдаться конкуренция между активаторами генов и репрессорами хроматина, за счет которой при активации промотора распространение комплекса сайленсинга по хроматину ингибируется.
Образование особой структуры хроматина на центромерных участках может быть связано с образованием гетерохроматина в определенной области. В клетках человека в области центромеры содержится специфический белок, CENP-B, необходимый для запуска модификации гистона Н3 (деацетилирование 9 Lys и 14 Lys, с последующим метилированием 9 Lys), необходимой для связывания с белком Swi6, которое приводит к формированию гетерохроматина в данном участке.
В результате метилирования гистона Н3 на нем создается сайт связывания для НР1. В результате связывания НР1 с метилированным Н3 гистоном образуется триггер,
способный запускать инактивацию генов, поскольку присоединение дополнительных молекул НР1 приводит к их агрегации на нуклеосомной цепи. Связывание RAP1 с ДНК приводит к образованию гетерохроматина.
SIR3/SIR4 связывается с RAP1 и с гистонами Н3/Н4.
Комплекс полимеризуется вдоль хроматина и может связывать теломеры с ядерным матриксом.
• Структура хроматина меняется с участием комплексов ремоделирования, использующих энергию гидролиза АТФ
• SWI/SNF, RSC и NURF представляют собой большие комплексы, которые характеризуются наличием общих субъединиц
• Сам по себе комплекс ремоделирования не обладает специфичностью по отношению к определенному сайту, однако сборка его должна проходить с участием компонентов транскрипционного аппарата
• Комплексы ремоделирования собираются на промоторах под действием активаторов, специфичных по отношению к определенной нуклеотидной последовательности
• После связывания комплекса ремоделирования с хроматином, фактор может высвобождаться
Геном клетки характеризуется нуклеосомной организацией, однако если промоторная область содержит нуклеосомы, то инициации транскрипции обычно не происходит. При этом гистоны функционируют как репрессоры транскрипции (такое представление известно довольно давно). Процесс активации гена требует изменений в структуре хроматина: существенный момент состоит в том, каким образом аппарат транскрипции получает доступ к ДНК промоторной области.
Способность гена к экспрессии зависит как от локальной структуры хроматина (в промоторном сайте), так и от структуры окружающей области. Структура регулируется за счет местных процессов активации или же изменений, затрагивающих более обширную область хромосомы. К числу наиболее локальных относятся изменения в пределах индивидуального гена, когда изменения в структуре и организации нуклеосом происходят в непосредственной близости от промотора. Более обширные изменения могут затрагивать столь большие регионы, как целая хромосома.
Изменения, затрагивающие большие регионы, контролируют генную экспрессию. Для обозначения зарепрессированного гена в какой-либо области хромосомы используют термин молчащий ген. Под гетерохроматином понимают большие участки хромосом, под микроскопом характеризующиеся более компактной структурой. Молчащие гены и гетерохроматин характеризуются общей особенностью: в обоих случаях с хроматином связаны дополнительные белки, которые прямо или косвенно препятствуют факторам транскрипции и РНК-полимеразе активировать промоторы в определенной области.
Изменения того или иного промотора контролируют транскрипцию определенного гена. Эти изменения могут оказывать или активирующее, или репрессирующее действие.
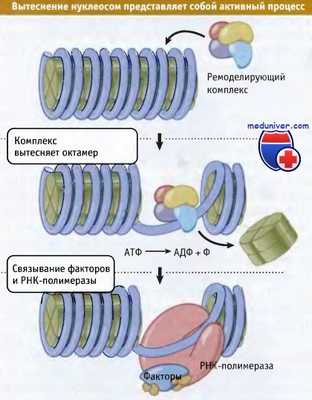
Динамическая модель транскрипции хроматина основывается на существовании факторов,
способных использовать энергию гидролиза АТФ для вытеснения нуклеосом с участков специфических последовательностей ДНК.
Изменения локальной структуры хроматина представляют собой составную часть процесса контроля генной экспрессии. Гены могут существовать в одном из двух структурных состояний. Гены находятся в «активном» состоянии только в клетках, в которых они экспрессируются. Изменения их структуры предшествуют транскрипции и указывают на то, что ген является «транскрибируемым». Это позволяет предполагать, что приобретение геном «активной» структуры должно быть первым шагом на пути его экспрессии. Активные гены находятся в доменах эухроматина, обладающих повышенной чувствительностью к нуклеазам. Гиперчувствительные сайты создаются на промоторах до момента активации гена.
Между инициацией транскрипции и структурой хроматина существует тесная и постоянная связь. Некоторые активаторы процесса транскрипции непосредственно модифицируют гистоны; в особенности с активацией генов связан процесс их ацетилирования. Напротив, некоторые репрессоры транскрипции деацетилируют гистоны. Таким образом, экспрессия генов контролируется структурным состоянием гистонов поблизости от промотора. Это может представлять собой часть механизма, посредством которого ген поддерживается в активном или неактивном состоянии.
Механизм поддержания локальных участков хроматина в неактивном (молчащем) состоянии связан с механизмом репрессии индивидуального промотора. Белки, ответственные за образование гетерохроматина, действуют на хроматин через гистоны, и модификация гистонов может быть важным этапом его образования.
Суммарный процесс реализации изменений структуры хроматина называется ремоделированием хроматина. Он включает в себя механизмы удаления гистонов, которые зависят от поступления энергии. Для удаления гистонов из хроматина необходимо разрушение многих белок-белковых и ДНК-белковых связей. Это не так просто: для диссоциации этих связей требуется энергия. На рисунке ниже представлен принцип динамического ремоделирования хроматина с участием фактора, гидролизующего АТФ. Когда из хроматина высвобождается октамер гистонов, с ДНК могут связываться другие белки (в данном случае факторы транскрипции и РНК-полимераза).
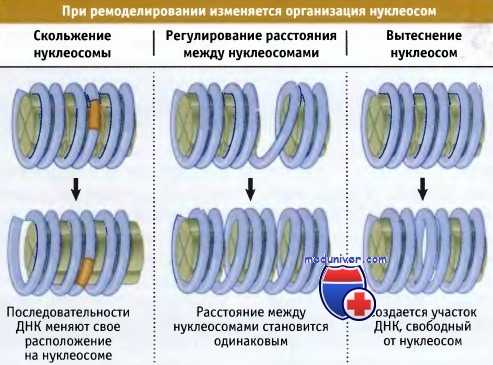
На рисунке ниже суммированы типы изменении, происходящих при ремоделировании хроматина, которые могут быть охарактеризованы in vitro:
• Октамеры гистонов могут продвигаться по ДНК, изменяя соотношение между нуклеиновой кислотой и белком. Это приводит к изменению положения определенных последовательностей ДНК на поверхности нуклеосомы.
• Расстояние между октамерами гистонов может изменяться, что приводит к изменению положения определенных последовательностей по отношению к белку.
• Наиболее радикальные изменения состоят в том, что октамеры гистонов могут полностью удаляться с ДНК, образуя участки, не содержащие нуклеосом. Наиболее часто ремоделирование хроматина происходит при изменении организации нуклеосом в области промотора транскрибируемого гена. Это необходимо для обеспечения доступа аппарата транскрипции к промотору. Однако ремоделирование хроматина также необходимо для обеспечения протекания других процессов, таких как репарация повреждений в ДНК.
Наиболее часто при ремоделировании удаляется один или более октамеров гистонов. Это может быть обнаружено по изменениям характера деградации ДНК хроматина под действием микрококковой нуклеазы: наблюдается утрата сайтов, защищенных от расщепления. Часто при этом возникают сайты, характеризующиеся повышенной чувствительностью к действию ДНКазы I. Иногда наблюдаются менее выраженные изменения, например касающиеся положения отдельной нуклеосомы; это можно определить по утрате лесенки через 10 пн, которая образуется после обработки ДНКазы I. Таким образом, изменения в структуре хроматина варьируют от изменения положения нуклеосом до полного их удаления.
Ремоделирование хроматина осуществляется с участием больших комплексов, которые используют АТФ в качестве источника энергии, необходимой для осуществления этого процесса. Центральным компонентом комплекса является субъединица АТФазы. Обычно комплексы классифицируют в соответствии с типом этой субъединицы — комплексы с близким типом обычно причисляют к одному типу (обычно они содержат также другие общие субъединицы). В таблице на рисунке ниже даны названия этих субъединиц. Два основных типа комплексов представлены SWI/SNF и ISW (ISW заменяет SWI). Дрожжи содержат два комплекса каждого типа. Комплексы обоих типов также находятся у дрозофилы и человека. Каждый тип комплекса может проявлять различную активность при ремоделировании хроматина.
SWI/SNF представляет собой первый из идентифицированных комплексов, участвующих в ремоделировании хроматина. В его названии отражен факт, что многие субъединицы кодируются генами, идентифицированными в экспериментах на клетках 5. cerevisiae с помощью мутаций SWI и SNF. Эти мутации генетически взаимодействуют с мутациями в генах, кодирующих компоненты хроматина. Это гены SIN1 и SIN2, кодирующие негистоновый белок и гистон Н3 соответственно. Гены SWI и SNF требуются для экспрессии различных индивидуальных локусов (включая -120 генов или 2% генома S. cerevisiae). Для экспрессии этих локусов может оказаться необходимым, чтобы комплекс SWI/SNF обеспечил ремоделирование хроматина в области соответствующих промоторов.
Ремоделирующий комплекс может вызывать скольжение нуклеосом вдоль ДНК,
вытеснять нуклеосомы или изменять расстояние между ними.
В экспериментах in vitro SWI/SNF проявляет каталитическое действие, и в дрожжевой клетке содержится только 150 копий комплексов. Все гены, кодирующие субъединицы SWI/SNF, не являются абсолютно необходимыми, что позволяет предполагать, что у дрожжей должны существовать другие пути ремоделирования хроматина. Комплекс RSC представлен большим количеством копий и, вероятно, является более необходимым. Он действует на -700 локусов-мишеней.
Комплексы SWI/SNF могут ремоделировать хроматин in vitro или без потери всех гистонов, или с удалением их октамеров. Для обоих процессов характерно общее промежуточное состояние, при котором структура нуклеосомы — мишени меняется, приводя или к повторному образованию (ремоделированию) нуклеосомы на той же ДНК, или к перемещению октамера гистонов на другую молекулу ДНК. Комплекс SWI/SNF меняет чувствительность нуклеосомной ДНК к ДНКазе I и изменяет ДНК-белковые контакты, которые сохраняются после ее высвобождения из нуклеосом. Субъединица SWI2 представляет собой АТФазу, которая обеспечивает энергией процесс ремоделирования, осуществляемый с помощью SWI/SNF.
Между ДНК и октамером гистонов существует много точек связывания — по результатам исследования кристаллической структуры их насчитывается 14. Для того чтобы октамер сместился на новую позицию или же полностью потерял связь с ДНК, должны разорваться связи во всех точках контакта ДНК с белком. Каким образом это происходит? Некоторые механизмы можно исключить, поскольку мы знаем, что при ремоделировании однонитевая ДНК не образуется (и комплексы не обладают хеликазной активностью). Согласно современному представлению, комплексы, относящиеся к классам SWI и ISW, используют энергию гидролиза АТФ для раскручивания ДНК на поверхности нуклеосомы. Некоторые косвенные данные свидетельствуют о том, что при этом создается механическое усилие, которое позволяет небольшому участку ДНК отсоединиться от поверхности и занять новую позицию.
Одним из важных процессов, катализируемых комплексами ремоделирования, является скольжение нуклеосом. Сначала оказалось, что комплекс группы ISW изменяет положение нуклеосомы, но не вызывает отрыва коровой частицы от ДНК. Это достигается за счет скольжения, при котором октамер перемещается вдоль ДНК. Удаление N-терминального участка гистона Н4 предотвращает скольжение, однако мы достоверно не знаем, каким образом эта часть молекулы гистона участвует в перемещении. Комплексы SWI/SNF обладают такими же свойствами; процесс блокируется при создании барьера на ДНК. Это позволяет считать, что мы имеем дело с реакцией скольжения, при которой октамер гистонов более или менее непрерывно движется вдоль ДНК, не теряя с ней контакта.
Одна из загадок функционирования комплекса SWI/SNF заключается в его размере. Комплекс состоит из 11 субъединиц и обладает суммарной молекулярной массой 2 х 106. Он должен мешать функционированию РНК-полимеразы и нуклеосом. Кроме того, непонятно, каким образом все компоненты комплекса взаимодействуют с ДНК, которая удерживается на поверхности нуклеосомы. Однако обнаружен транскрипционный комплекс, обладающий полной активностью, который называется РНК-полимераза II холофермент. Он содержит саму РНК-полимеразу, все TFII факторы, за исключением TBP и TFIIA, и комплекс SWI/SNF, который связан с CTD концевым участком молекулы полимеразы. Фактически препараты холофермента могут содержать весь комплекс SWI/SNF. Это позволяет предполагать, что ремоделирование хроматина и узнавание промоторов являются скоординированными процессами и осуществляются с участием одного комплекса.
Каким образом комплексы присоединяются к определенным сайтам хроматина при ремоделировании? Сами по себе они не содержат субъединиц, связывающихся со специфическими последовательностями в ДНК. Поэтому предложена модель, согласно которой функционирование комплексов зависит от активаторов или (иногда) от репрессоров. Модель функционирует по механизму «hit and run», при котором после связывания комплекса ремоделирования активатор или репрессор удаляется.
Ремоделирование хроматина достигается за счет изменений в состоянии гистонов, в особенности модифицирования N-терминальных участков гистонов Н3 и Н4. Эти участки включают 20 N-терминальных аминокислот и отходят от нуклеосомы, располагаясь между витками ДНК. Они могут быть модифицированы по нескольким сайтам за счет метилирования, ацетилирования или фосфорилирования. При модификации гистонов создаются сайты связывания для негистоновых белков, в результате чего изменяются свойства хроматина.
Количество нуклеосом, белки которых подвергаются модификации, различно. Модификация может быть локальной и, например, ограничиваться нуклеосомами, расположенными в области промотора. Она может представлять собой более общий процесс и затрагивать хромосому целиком. Рисунок ниже иллюстрирует положение, согласно которому ацетилирование связано с активацией хроматина, а метилирование вызывает его инактивацию. Впрочем, это простое правило выполняется не всегда, и важную роль играет характер модифицируемого сайта, а также сочетание различных модификаций. Поэтому известны исключения, когда, например, в активном хроматине находятся гистоны, метилированные в определенных положениях.
О специфичности модификаций свидетельствуют данные о том, что для многих ферментов на отдельных гистонах существуют специфические сайты. В таблице на рисунке ниже перечислены некоторые модификации. Большинство сайтов подвергается только одному типу модификации. В некоторых случаях модификация одного сайта может оказывать активирующее или ингибирующее действие на модификацию другого. Представление о том, что комбинация сигналов может быть использована для определения типа хроматина, иногда называется гистоновый код.
Ремоделирующие комплексы подразделяются на типы в зависимости от природы АТФазных субъединиц. Ремоделирующий комплекс связывается с хроматином посредством активатора (или репрессора). Ацетилирование гистонов Н3 и Н4 характерно для активного хроматина,
в то время как метилирование для неактивного. Большинство сайтов в гистонах подвержены одному, определенному типу модификации,
однако некоторые из них могут модифицироваться разными ферментами.
С некоторыми из этих модификаций могут быть связаны определенные функциональные изменения.
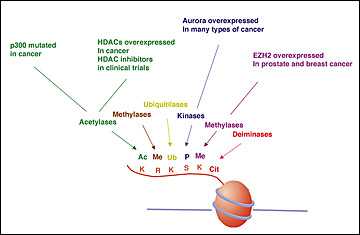
Биологическая роль гистондеацетилаз и перспективы использования их ингибиторов
Гистондеацетилазы — группа ферментов, которые участвуют в регуляции огромного количества клеточных процессов. Отщепляя от гистоновых белков ацетильные радикалы, деацетилазы вызывают конденсацию хроматина и прекращение экспрессии содержащихся в нем генов. Кроме того, у различных представителей данного семейства есть и свои уникальные функции.
В серии исследований было продемонстрировано, что гистондеацетилазы могут принимать участие в различных патологических процессах, вследствие чего были синтезированы ингибиторы данных ферментов, которые уже находятся в двух шагах от применения в клинической медицине (большей частью это касается онкологии).
Биологическая роль HDAC
Итак, гистондеацетилазы (HDAC) представляют собой целое суперсемейство, чья прямая функция заключается в деацетилировании гистоновых белков, что влияет на экспрессию тех или иных генов. Основная сложность при изучении функционирования HDAC состоит в том, что роль данных белков вовсе не ограничена их ферментативной активностью. Начав изучать эти деацетилазы, исследователи с удивлением обнаружили, что знание биохимических свойств HDAC in vitro совершенно не предсказывает работу этих ферментов in vivo [1].
Суперсемейство HDAC — обширный комплекс очень древних белков, которые появились еще у прокариот. Для млекопитающих количество «классических» гистондеацетилаз ограничено одиннадцатью пептидами, которые принято делить на 4 класса: I, IIa, IIb и IV (рис. 1). К HDAC III класса относят особую группу деацетилаз — сиртуины. Они обладают несколько другими свойствами, поэтому по обыкновению сиртуины рассматриваются отдельно от «классических» HDAC [2].
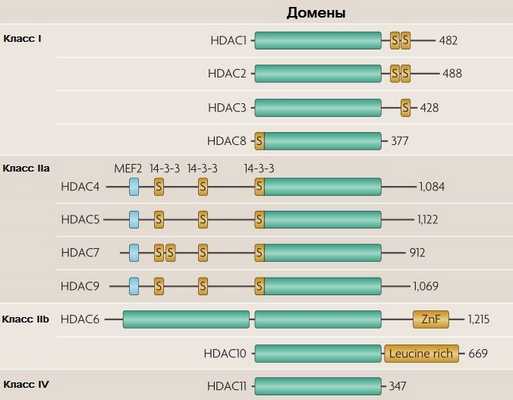
Зелеными прямоугольниками показаны высококонсервативные домены HDAC; число в конце обозначает количество аминокислотных остатков. Голубые прямоугольники — сайты взаимодействия с миоцитарным энхансерным фактором 2 (MEF2), также указаны участки связывания с шапероном 14-3-3.
S — участки с аминокислотными остатками серина, сайты связывания со специфическими киназами;
ZnF — цинковый палец (zinc finger);
«Leucine rich» — т. н. «лейцин-богатый» мотив, участок из 20–30 остатков лейцина, имеющий пространственную конформацию в виде подковы [2].
В целом деацетилазы работают следующим образом. Ацетилированные гистоновые белки дают возможность хроматину находиться в деконденсированном состоянии — в виде эухроматина. Считывание генетической информации происходит свободно. Гистондеацетилазы «отрезают» от пептида ацетильные радикалы, гистоны меняют свою конформацию — происходит конденсация и образование гетерохроматина (спирализованного и неактивного). Однако мы уже заметили, что функций у HDAC гораздо больше, нежели просто участие в конденсации хроматина.
Рассмотрим общепринятую классификацию данного семейства:
Класс I.
К нему относят HDAC1, 2, 3 и 8. Эти белки называют гомологичными к Rpd3 (последний — регулятор транскрипции дрожжей). Их можно найти в самых разных клетках, они локализуются рядом с ядром и обладают высокой каталитической активностью в отношении гистонов.
Генетический дефект любого представителя этих HDAC оказывается летальным.
Класс IIa.
Включает в себя HDAC4, 5, 7 и 9. У всех представителей данного класса на N-конце имеется особый домен для связывания с MEF2 — миоцитарным энхансерным фактором 2 (транскрипционный фактор-репрессор) и белком-шапероном 14-3-3. Работает это все следующим образом. HDAC в неактивном состоянии связаны с MEF2. Когда протеинкиназа фосфорилирует эти HDAC (например, протеинкиназа D — PKD, или кальций/кальмодулин-зависимая протеинкиназа — CaMK), данные ферменты связываются с белком 14-3-3 и переносятся из ядра в цитоплазму. Диссоциация MEF2 и HDAC позволяет еще одному белку — HAT p300 — занять место деацетилазы. MEF2 под действием HAT p300 превращается из репрессора в активатор. Экспрессия генов изменяется.
В отличие от HDAC I класса, деацетилазы класса IIa представлены в органах и тканях крайне неоднородно. HDAC5 и 9 находятся в основном в мышцах, сердце и мозге, 4 — в мозге, 7 — в тимоцитах и эндотелии. Также особенностью ферментов этого класса является крайне низкая каталитическая активность.
Класс IIb.
Его представители — HDAC6 и 10. Сведений о последнем достаточно мало, зато HDAC6 известен как главная цитозольная деацетилаза. Мишенями этого фермента являются белки цитоскелета: α-тубулин, контрактин, трансмембранные рецепторы (например, рецептор интерферона-α) и шапероны.
Класс IV представлен всего одним белком — HDAC11. О нем пока ничего особенного не известно; обнаруживается в мозге, мышцах, сердце, почках и яичках [2].
Необходимо отметить, что дефект хотя бы одного из HDAC у мышей приводил к летальным порокам развития.
HDAC в качестве мишеней для терапии различных заболеваний
Поскольку данные белки задействованы во множестве разнообразных процессов (в том числе патологических), очень любопытна идея попробовать ингибировать работу данных регуляторов. Прежде чем рассмотреть имеющиеся по этому вопросу данные, следует разобраться с парадоксом: почему делеция гена любого из HDAC зачастую летальна, а их фармакологическое ингибирование может принести пользу?
Авторы данной работы [2] приводят три возможные гипотезы, которые могут и не исключать друг друга:
- Генетическая делеция приводит к полному отсутствию фермента, тогда как фармакологическое ингибирование может не угнетать работу ферментов на все 100 %;
- Делеция генов HDAC носит постоянный характер, а ингибиторы действуют какое-то время, после чего возможно возобновление работы ферментов;
- Делеция генов HDAC нарушает работу не только самих гистондеацетилаз, но также и всех комплексов, которые ассоциированы с деацетилазами. Ингибирование же ферментативной активности HDAC совершенно не обязательно будет влиять на другие белки (например, MEF2).
Последнюю гипотезу исследователи считают наиболее достоверной.
Противоопухолевое действие ингибиторов гистондеацетилаз
Традиционно ведущей ролью в развитии опухоли наделяются генетические дефекты — делеции, транслокации и т. д., которые приводят к снижению функции противоопухолевых регуляторов или к гиперэкспрессии онкогенов. Однако в последнее время мы получаем все больше свидетельств о важной роли в онкогенезе и эпигенетических факторов, основным из которых является ремоделирование хроматина.
Перевод хроматина в конденсированное состояние — прямая функция HDAC. Вместе с гистонацетилтрансферазами они регулируют, какие участки ДНК будут считываться, а какие — нет.
HDAC действуют как ингибиторы экспрессии различных генов, и, согласно одной из гипотез, если среди таких генов окажется противоопухолевый фактор, это повысит риск развития опухоли [3]. Поэтому разработка ингибиторов HDAC (HDACi) — достаточно интересный и перспективный подход в лечении онкологических заболеваний.
Вспомним немного строение нуклеосомы. Она состоит из пар гистоновых белков H2A, H2B, H3 и H4, формирующих кору, на которую «наматываются» 146 пар оснований нуклеотидов. Гистон H1 также принимает важное участие в формировании нуклеосомы (связывает линкерные ДНК), но не регулируется ацетилированием, а потому выходит за рамки нашей темы.
Коровые гистоны богаты положительно заряженными лизином и аргинином, концевые их участки называют «хвостами». N- и С-хвосты участвуют в посттрансляционных модификациях гистоновых белков. Ацетилирование/деацетилирование происходит на N-концевом «хвосте».
Итак, HDAC, удаляя с N-концевого участка гистонов ацетильный радикал, приводят к конденсации хроматина. Это может способствовать развитию опухоли. Например, онкогенные белки PML-RARα, PLZF-RARα и AML1-ETO являются индукторами лейкемии. Происходит это с помощью особого белкового комплекса (который содержит HDAC), который препятствует экспрессии специфических противоопухолевых генов.
Также при различных видах онкологических заболеваний можно наблюдать повышенную экспрессию индивидуальных HDAC. Например, уровень HDAC1 повышается при раке простаты, желудка, толстого кишечника, раке груди; HDAC2 — при колоректальном, раке груди и шейки матки. Однако точные молекулярные механизмы такой корреляции пока не установлены [3].
Несмотря на множество пробелов в нашем понимании о работе HDAC, разработка различных HDACi показала себя достаточно перспективной. При исследованиях in vitro было выяснено, что HDACi обладают рядом противоопухолевых свойств: они тормозят клеточный цикл на G1 (и/или G2) фазе и инициируют апоптоз. Практически во всех типах трансформированных клеток применение HDACi снижало рост опухолей (исследовались в том числе лейкемия, миелома, карциномы различного вида) [4].
В последнее время обсуждается вопрос о разработке селективных ингибиторов конкретных HDAC, так как функции последних могут быть крайне разнообразны. Например, они обладают довольно противоречивым эффектом в отношении аутофагии: HDAC6 инициирует аутофагию, когда убиквитин-протеасомная система не справляется; дефект HDAC2 приводит к отсутствию аутофагии в кардиомиоцитах. Совершенно другим влиянием обладает HDAC1: при нокдауне этого белка в клетках HeLa, наоборот, начинают образовываться аутофагосомы [5].
В целом же HDACi влияют на множество разнообразных процессов: инициируют апоптоз, тормозят клеточный цикл, способствуют аутофагии, тормозят ангиогенез в опухоли и даже способны модулировать иммунный ответ [3, 5].
Перспективы использования ингибиторов гистондеацетилаз в лечении воспалительных и других заболеваний
HDAC конденсируют самые разнообразные гены, в числе которых могут оказаться не только регуляторы клеточного цикла. Изменение экспрессии различных генов может быть полезным в том числе в терапии воспалительных заболеваний.
Действие HDACi на клетку довольно неоднозначно. Различные препараты могут оказать как про-, так и противовоспалительный эффект. К примеру, трихостатин А (один из HDACi) усиливал синтез ЦОГ-2 в макрофагах у мышей и вместе с тем ингибировал синтез провоспалительных медиаторов (TNFα, IL-6) [6].
Представители ряда HDACi могут быть полезны при терапии артритов (ревматоидного и/или остеоартрита). Предполагается, что также возможно применение HDACi для лечения и профилактики остеопороза, воспалительных заболеваний кишечника (например, при болезни Крона), нейродегенеративных заболеваний, сердечной недостаточности, диабета и бронхиальной астмы [1, 6, 7]. Для всего этого спектра самых разных заболеваний существуют определенные предпосылки, однако, пока данные не будут подкреплены серией РКИ, сделать какие-то выводы не представляется возможным.
Читайте также:
- Обструкция протезированного клапана сердца. Регургитация через протезированный клапан сердца
- Перелом анатомической шейки (эпифиза) плечевой кости. Диагностика и лечение
- Острый язвенно-некротический гингивит. Актиномикотический гингивит. Ограниченный гингивит прорезывания.
- Признаки болезни Меньера. Характер понижения слуха при болезни Меньера
- Селективные противовоспалительные препараты - лечим воспаление без опасности для желудка
