Яичник. Хирургическая анатомия яичников.
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Кафедра акушерства и гинекологии лечебного факультета Московского государственного медико-стоматологического университета
ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
Изменения функционального состояния яичников и кровообращения матки и яичников при различных видах хирургического лечения миомы матки
Журнал: Эндоскопическая хирургия. 2017;23(4): 47‑50
Кафедра акушерства и гинекологии лечебного факультета Московского государственного медико-стоматологического университета
Цель исследования — проведение сравнительного изучения репродуктивного потенциала пациенток путем исследования продукции гонадотропных и стероидных гормонов, показателей допплерометрического исследования кровотока матки и яичников до и после операции миомэктомии, произведенной лапароскопическим путем и после ЭМА. Материал и методы. В исследование были включены 42 больных миомой матки, которым была проведена миомэктомия и 23 пациентки после ЭМА. Показано, что в течение 1 мес после операции в обеих группах пациентов происходят изменения изучаемых показателей, которые приходят к нормальным показателям к 6-му месяцу после миомэктомии и к 10-му месяцу после ЭМА. Вывод. На основании полученных данных сделан вывод о том, что ЭМА оказывает большее влияние на репродуктивную функцию по сравнению с миомэктомией, произведенной лапароскопическим доступом.
Кафедра акушерства и гинекологии лечебного факультета Московского государственного медико-стоматологического университета
ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
Миома матки — самая распространенная доброкачественная гормонзависимая опухоль у женщин репродуктивного возраста, причем в последние годы прослеживается тенденция к выявлению миомы матки и необходимости ее лечения в более молодом возрасте. Рост частоты миомы матки можно объяснить, во-первых, расширением возможностей диагностики заболевания и, во-вторых, ухудшением здоровья населения, в том числе женщин репродуктивного возраста. Развитие миомы матки занимает в среднем 5 лет, и примерно у 84% пациенток опухоль имеет множественный характер [1, 2]. В настоящее время миома матки все чаще встречается у пациенток, планирующих беременность, хотя раньше считалось, что это заболевание — удел женщин позднего репродуктивного и пременопаузального возраста. Наряду с молодыми женщинами зачастую возникает необходимость сохранения репродуктивной функции и у пациенток после 35 лет, когда риск заболевания миомой матки возрастает. Настойчивое желание пациенток даже в позднем репродуктивном возрасте прибегнуть к варианту органосберегающей операции, например консервативной миомэктомии, ставит перед лечащим врачом вопрос выбора методики органосберегающей операции на матке [3]. Каждая из таких операций имеет свои плюсы и минусы. Так, имеются работы, указывающие на преимущества миомэктомии перед эмболизацией маточной артерии (ЭМА) в плане сохранения репродуктивного здоровья. Отмечается, что частота наступления беременности после ЭМА составляет 50%, в то время как после лапароскопической миомэктомии — 64—75% [4].
Следует отметить, однако, что миомэктомия не устраняет причину заболевания и частота рецидива миомы составляет 2,5—23% [5]. Частота повторных операций достигает 5% в год [6]. Вместе с тем именно эндоскопическая хирургия стала сейчас ведущим методом оперативного вмешательства в гинекологии. Лапароскопия обеспечивает возможность сохранения репродуктивной функции, результативность операции, благоприятное течение послеоперационного периода, минимальную частоту осложнений, нарушающих детородную функцию [7].
Для оценки репродуктивного потенциала женщин используются различные методы, к которым относится, в частности, понятие овариального, или функционального резерва яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. Овариальный резерв отражает количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) и зависит от физиологических и патофизиологических факторов. Для оценки овариального резерва и репродуктивного потенциала используется показатель антимюллерова гормона (АМГ), или MIS-фактор (Mullerian Inhibiting Substance), который вырабатывается клетками гранулезы малых антральных и преантральных фолликулов. АМГ обеспечивает переход покоящихся примордиальных фолликулов в фазу активного роста [8, 9]. Отмечено, что органосохраняющие оперативные вмешательства на органах малого таза (на матке и яичниках) приводят к снижению фолликулярного пула яичников [10].
Цель работы — сравнительное изучение репродуктивного потенциала пациенток после консервативной лапароскопической миомэктомии и после ЭМА.
Материал и методы
В исследование были включены 59 пациенток, которым было проведено оперативное лечение миомы матки, имевших соответствующую клиническую картину, требующую оперативного вмешательства. У 42 больных миомой матки была проведена консервативная миомэктомия лапароскопическим доступом и у 17 — ЭМА. Контрольную группу составили 20 здоровых женщин детородного возраста. У всех пациенток исследован гормональный статус, проведено УЗИ матки и яичников. Из полученных нами данных следует, что после операции миомэктомии, произведенной лапароскопическим доступом, наблюдаются изменения продукции гонадотропных и стероидных гормонов, которые выражаются в снижении уровня эстрадиола, прогестерона и АМГ и повышении уровня лютеинизирующего гормона (ЛГ) и ФСГ при неизменном уровне соотношения ЛГ/ФСГ. Так, уровень эстрадиола снижается в течение месяца после операции на 38,0% (с 305,45±28,31 до 189,34±32,41 пмоль/л). Такая же закономерность прослеживается и в отношении прогестерона, уровень которого снижается в послеоперационном периоде на 28,9% (с 2,01±1,32 до 1,43±1,29 нмоль/л) и также остается сниженным в течение 6 мес. Показатель АМГ снижается на 34,2% (с 3,68±0,41 до 2,42±0,19 нг/мл) и приходит к нормальным показателям также к 6-му месяцу послеоперационного периода. В ответ на снижение стероидных гормонов по принципу обратной связи происходит повышение уровня гонадотропных гормонов. Так, продукция ЛГ увеличивается на 36,7% (с 5,28±1,21 до 7,22±1,33 МЕ/л) и вполне закономерно держится на повышенном уровне параллельно со стероидными гормонами. Аналогичные изменения наблюдаются в продукции ФСГ, уровень которого увеличивается на 38,6% (с 7,28±1,17 до 9,32±1,32 МЕ/л). Практически все показатели продукции гонадотропных и стероидных гормонов нормализуются в 6-му месяцу послеоперационного периода.
Нами были проанализированы основные допплерометрические показатели у пациенток после операции лапароскопической миомэктомии. Из полученных данных видно, что после операции миомэктомии наблюдаются изменения кровообращения матки, которые выражаются в снижении максимальной скорости кровотока (МСК) маточных артерий: в левой на 21,9% и в правой на 23,9%. При этом пульсационный индекс (ПИ) увеличивается соответственно на 15,8 и 20,6%, индекс резистентности (ИР) — на 13,1 и 12,0%, а систолодиастолическое отношение (СДО) — на 48,7 и 50,2%. Данные изменения длятся вплоть до 6-го месяца послеоперационного периода, когда происходит нормализация показателей. Также после операции миомэктомии наблюдаются изменения кровотока в яичниковой артерии и в сосудах стромы яичников. Эти изменения выражаются в снижении МСК в яичниковой артерии (на 18,8%) и в артериях стромы яичников (на 21,7%) и соответственно в увеличении показателей ПИ (на 24,8% в яичниковой артерии и на 21,9% в артериях стромы яичников), ИР (на 20,8 и 23,2% соответственно) и СДО (на 38,1 и 36,2% соответственно). Кровоток в сосудах, питающих яичник, также остается сниженным до 6-го месяца послеоперационного периода, после чего все изучаемые показатели яичникового кровотока приходят к величинам, статистически не отличающимся от дооперационного уровня. Данные изменения гемодинамики матки и яичников являются, по-видимому, результатом операционной травмы, наличия послеоперационного шва на матке, удаления миоматозного узла, т. е. части органа. Изменения кровотока в яичниковой артерии, которая в ходе операции не затрагивается при любых размерах и локализации узла, и также предположительно является рефлекторной реакцией на изменения в яичниковой ветви маточной артерии, гемодинамика в которой может быть непосредственно затронута в ходе миомэктомии. Результатом изменения кровообращения в яичнике, особенно в его внутренней части, служит изменение его функции, т. е. синтеза стероидных гормонов. Изменения кровообращения в матке и яичниках, безусловно, обратимы, во всяком случае именно это наблюдалось у изучаемого нами контингента пациенток репродуктивного возраста и наблюдаемых у них локализации и размерах миоматозных узлов. Кровообращение в матке и яичниках и функции яичников восстанавливаются без какой-либо гормональной терапии к 6-му месяцу послеоперационного периода.
Чтобы сравнить влияние различных методов оперативного лечения миомы матки на репродуктивную функцию, нами было изучено функциональное состояние яичников у пациенток после ЭМА.
Под нашим наблюдением находились 17 пациенток с миомой матки, которым была проведена операция ЭМА. До операции всем пациенткам было проведено клиническое обследование. У всех больных имелась соответствующая клиника, требующая оперативного лечения. Исходя из того, что пациентки были репродуктивного возраста, методом выбора явилась ЭМА с учетом размера и локализации опухоли. У всех пациенток исследовался гормональный профиль до операции и в послеоперационном периоде. В течение первого месяца после ЭМА мы наблюдали выраженное снижение продукции стероидных гормонов. Так, продукция эстрадиола снизилась на 61,4% (с 307,66±47,80 до 118,98±24,61 пмоль/л), продукция прогестерона — на 29,2% (с 2,05±1,28 до 1,46±1,49 нмоль/л). При этом продукция гонадотропных гормонов увеличилась: ФСГ — на 58,1% (с 7,21±1,23 до 11,40±1,29 МЕ/л), ЛГ — на 55,5% (с 5,26±1,38 до 8,18±1,28 МЕ/л) при неизменном показателе соотношения ЛГ/ФСГ. Показатель АМГ снизился на 64,7% (с 3,66±0,39 до 1,30±0,21 нг/мл). К 6-му месяцу послеоперационного периода происходит достоверное увеличение продукции стероидных гормонов, к нормальным, дооперационным показателям они возвращаются лишь через 10 мес после операции.
У всех пациенток, перенесших ЭМА, проведено УЗИ тела матки, миоматозных узлов и яичников до и после ЭМА.
В среднем объем матки к 6-му месяцу после ЭМА сократился в 2,5 раза по сравнению с дооперационным периодом. При этом объем миоматозных узлов уменьшился в 3,5 раза, их диаметр — в 1,3 раза. В 86,9% случаев у наблюдаемых пациенток редукция узлов происходила путем транслокации в более глубокие слои миометрия. Также наблюдалось уменьшение деформации полости матки и асимметрии ее стенок. ЭМА проводилась на фоне соответствующей обезболивающей, спазмолитической, седативной, антибактериальной терапии, профилактики тромбоэмболических осложнений. Несмотря на проводимые мероприятия, развитие постэмболизационного синдрома в виде болевой формы мы наблюдали у 7 (41,2%) пациенток.
Исследование показателей кровотока маточной и яичниковой артерий в динамике после ЭМА показало, что кровоток в маточных артериях в течение первого месяца после ЭМА снижается, о чем свидетельствует снижение МСК в обеих маточных артериях на фоне повышения ИР, ПИ и СДО. При этом МСК в левой маточной артерии снижается на 17,5%, в правой маточной артерии — на 21,9%. Это связано с уменьшением объема матки и узлов. В результате снижения МСК в маточных артериях увеличивается ИР и П.И. Кровообращение в матке остается сниженным вплоть до 10-го месяца послеоперационного периода. За счет уменьшения маточного кровотока и происходит ишемия и регресс миоматозных узлов.
При изучении кровообращения в яичниках мы не нашли каких-либо изменений в яичниковой артерии в послеоперационном периоде после ЭМА. В то же время отмечалось снижение внутрияичникового кровотока, о чем свидетельствует уменьшение МСК и увеличение ПИ и ИР, которые также наблюдается до 10-го месяца послеоперационного периода. С нашей точки зрения, это объясняется тем, что кровоток в яичниках снижается за счет уменьшения кровоснабжения яичника из яичниковой ветви маточной артерии, так как кровоток по маточной артерии в целом снижается. Следствием снижения кровоснабжения яичников является отмеченное нами изменение функциональной активности яичников в течение первого месяца послеоперационного периода, выражающееся в снижении продукции стероидных гормонов и АМГ. В результате снижения концентрации стероидных гормонов по принципу обратной связи наблюдается уменьшение продукции гонадотропных гормонов. Данные изменения держатся достаточно долго, вплоть до 10-го месяца послеоперационного периода.
Таким образом, полученные нами в ходе исследования данные свидетельствуют о том, что ЭМА оказывает большее воздействие на функциональное состояние яичников по сравнению с консервативной миомэктомией, выполненной лапароскопическим доступом. Эти изменения наблюдаются в среднем в течение 10 мес после ЭМА, тогда как после миомэктомии изменения длятся лишь 6 мес. Это следует учитывать при выборе метода хирургического лечения миомы матки у пациенток репродуктивного возраста, и посвящать этому разъяснительную беседу с пациентками перед операцией. После ЭМА показано проведение реабилитационных мероприятий с включением гормональной терапии и предохранение от беременности в течение примерно одного года после операции.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Высоцкий Максим Маркович — профессор, рук. курса эндохиругии в гинекологии
Невзоров Олег Борисович — к.м.н., доцент кафедры акушерства и гинекологии
Яичник: его топография, строение, отношение к брюшине, кровоснабжение, иннервация.
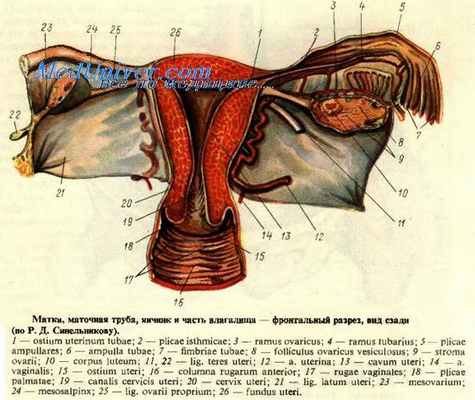
Яичник, ovarium (рис. 178), парный орган, является женской половой железой, аналогичной мужскому яичку. Он представляет плоское овальное тело длиной 2,5 см, шириной 1,5 см, толщиной 1 см. В нем различают два конца: верхний, несколько закругленный, конец обращен к маточной трубе и носит название трубного конца, extremitas tubaria; противоположный нижний, более заостренный, конец, extremitas uterina, соединен с маткой особой связкой (lig. ovarii proprium). Две поверхности, facjes lateralis et medialis, отделены друг от друга краями: свободный задний край, margo liber, выпуклый, другой же, передний край, брыжеечный, margo mesovaricus, прямой, прикрепляется к брыжейке. Этот край называют воротами яичника, hilus ovarii, так как здесь в яичник входят сосуды и нервы (см. рис. 178).
Латеральной поверхностью яичник прилежит к боковой стенке таза между vasa iliaca externa и m. psoas major сверху, lig. umbilicale laterale спереди и мочеточником сзади. Длинник яичника расположен вертикально. Медиальная сторона обращена в сторону тазовой полости, но на значительном протяжении покрыта трубой, которая идет сперва вверх по брыжеечному краю яичника, затем на его трубном конце заворачивается и направляется вниз по свободному краю яичника. С маткой яичник связан посредством собственной связки, lig. ovarii proprium, которая представляет круглый тяж, заключенный между двумя листками широкой связки матки и состоящий в основном из непроизвольных мышечных волокон, продолжающихся в мускулатуру матки; собственная связка яичника тянется от маточного конца яичника к латеральному углу матки. Яичник имеет короткую брыжейку, mesovarium, представляющую собой дупликатуру брюшины, посредством которой он по своему переднему краю прикреплен к заднему листку широкой связки матки. К верхнему трубному концу яичника прикрепляются fimbria ovarica (наиболее крупная из бахромок, окружающих брюшной конец трубы), а также треугольной формы складка брюшины – lig. suspensorium ovarii, спускающаяся к яичнику сверху от linea terminalis pelvis и заключающая яичниковые сосуды и нервы.
Яичник содержит просвечивающиеся на свежем препарате везикулярные яичниковые фолликулы, folliculi ovarici vesiculosi, в каждом из которых находится развивающаяся женская половая клетка – ооцит. Фолликулы находятся в строме, stroma ovarii, в которой проходят сосуды и нервы. В зависимости от стадии развития фолликулы имеют различную величину – от микроскопических размеров до 6 мм в диаметре. Когда зрелый фолликул лопается (овуляция) и выделяется заключенный в нем ооцит, стенки его спадаются, полость выполняется кровью и клетками желтоватой окраски – получается желтое тело, corpus luteum. Ооцит превращается в зрелую яйцеклетку уже после овуляции в маточной трубе.
В случае наступления беременности желтое тело увеличивается и превращается в крупное, около 1 см в диаметре, образование, corpus luteum graviditatis, следы которого могут сохраняться годами; желтое же тело, образующееся при отсутствии оплодотворения вышедшего из фолликула яйца, отличается меньшими размерами и через несколько недель исчезает. Вместе с атрофией клеток желтого тела последнее теряет свой желтый цвет и получает название белого тела, corpus albicans. С течением времени corpus albicans совершенно исчезает. Обыкновенно в течение 28 дней достигает зрелости один фолликул. Вследствие того, что фолликулы периодически лопаются (овуляция), поверхность яичника с возрастом покрывается морщинками и углублениями (о роли желтого тела см. «Эндокринные железы»).
Яичник не покрыт брюшиной, которая здесь редуцировалась, а вместо нее он покрыт зародышевым эпителием. Благодаря этому яйцеклетка, после того как фолликул лопнул, может сразу попасть на поверхность яичника и далее в маточную трубу.
Сосуды и нервы: яичник получает питание из a. ovarica и ramus ovaricus a. uterinae. Вены – vv. ovaricae соответствуют артериям. Начинаясь от plexus pampiniformis (лозовидное сплетение), они идут через lig. suspensorium ovarii и впадают в нижнюю полую вену (правая) и в левую почечную вену (левая). Лимфатические сосуды отводят лимфу в поясничные лимфатические узлы.
Иннервация: яичник имеет симпатическую (от plexus coeliacus, plexus ovaricus и plexus hypogastrics inferior) и парасимпатическую иннервацию. Последняя некоторыми авторами оспаривается, однако категорически отрицать ее нельзя.
Яичник. Хирургическая анатомия яичников.
Яичник. Хирургическая анатомия яичников.
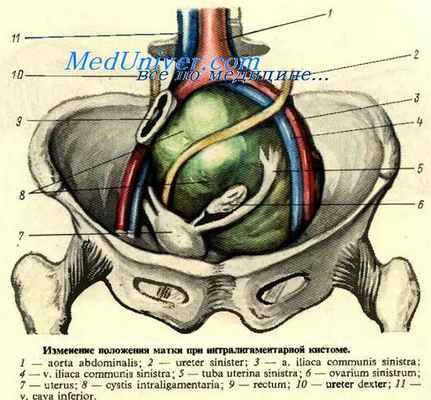
Яичник (ovarium, oophoron) — парный орган, являющийся половой железой внутренней секреции. Располагается обычно на боковой стенке таза в углублении париетальной брюшины, у места деления общей подвздошной артерии на наружную и внутреннюю — в так называемой яичниковой ямке (fossa ovarica). Одна сторона яичников обращена в полость таза и называется внутренней поверхностью (facies medialis), другая — кнаружи (facies lateralis); верхний конец яичника обращен к воронке маточной трубы и называется трубным (extremitas tubaria), нижний направлен к матке — маточный конец (extremitas uterina); передний край, брыжеечный (margo mesovaricus), более прямой; он фиксирован посредством брыжейки яичника (mesovarium) к заднему листку широкой связки матки; задний край, свободный (margo liber), — более выпуклый и обращен в прямокишечно-маточное пространство.
На большей части поверхности яичник не имеет серозного покрова и покрыт зародышевым (зачатковым) эпителием. Лишь незначительная часть брыжеечного края в области прикрепления брыжейки яичника имеет брюшинный покров в виде небольшого беловатого ободка, резко отграниченного от остальной, лишенной серозного покрова, поверхности (так называемая белая, или пограничная, линия — linea limitans mesovarii), или кольцо Фарра—Вальдейера.
С широкой связкой матки яичник связан посредством упоминавшейся дупликатуры брюшины, отходящей от заднего листка широкой связки, — брыжейкой яичника (mesovarium).
Кроме mesovarium, различают следующие связки яичника.
Подвешивающая связка яичника (lig. suspensorium ovarii), раньше обозначавшаяся как яичнико-тазовая (lig. ovaricopelvicum) или воронкотазовая связка (lig. infundibulopelvicum). Эта связка представляет собой складку брюшины с проходящими в ней кровеносными сосудами (а. et v. ovarica), лимфатическими сосудами и нервами яичника, натянутую между боковой стенкой таза, поясничной фасииеи (в области деления общей подвздошной артерии на наружную и внутреннюю) и верхним (трубным) концом яичника.
Собственная связка яичника (lig. ovarii proprium), представленная в виде плотного фиброзно-гладкомышечного шнурка, проходит между листками широкой маточной связки, ближе к заднему ее листку, и соединяет нижний конец яичника с боковым краем матки. К матке собственная связка яичника фиксируется в области между началом маточной трубы и круглой связки, кзади и кверху от последней. В толще связки проходят гг. ovarii, являющиеся концевыми ветвями маточной артерии.
Аппендикулярно-яичниковая связка Кладо (lig. appendiculoovaricum Clado) тянется от брыжейки червеобразного отростка к правому яичнику или широкой связке матки в виде складки брюшины, содержащей волокнистую соединительную ткань, мышечные волокна, кровеносные и лимфатические сосуды. Связка непостоянна и наблюдается у 1/2-1/3 женщин.
Кровоснабжение яичников осуществляется за счет аа. et vv. ovaricae et uterinae.
От располагающихся в брыжейке яичника артериальных ветвей I порядка (яичниковой или маточной артерии) к яичнику подходит от 2 до 10 артерий II порядка, которые постепенно делятся, обычно по рассыпному типу. Венозная система значительно превышает артериальную, Внутриорганное сосудистое русло яичников весьма обильно, с большим количеством внут-риорганных анастомозов.
Внутриорганные лимфатические сосуды яичника начинаются в корковом слое, постепенно увеличиваются в диаметре и вливаются в сосуды ворот яичника, из которых лимфа оттекает в отводящие сосуды.
Лимфатическая система правого яичника связана с лимфатической системой илеоцекального угла и червеобразного отростка (частое наличие связки Кладо).
Лимфоотток от яичников осуществляется через лимфатические сосуды, особенно обильные в области ворот органа, где выделяют подъяичниковое лимфатическое сплетение (plexus lymphaticus subovaricus). Затем лимфа отводится по ходу яичниковых лимфатических сосудов к парааортальным лимфатическим узлам.
Иннервация яичников: симпатическая — обеспечивается постганглионарными волокнами из чревного (солнечного) сплетения (plexus celiacus), верхнебрыжеечного (plexus mesentericus superior) и подчревного (plexus hypogastricus, superior et inferior); парасимпатическая -~- за счет внутренностных крестцовых (или тазовых) нервов (nn. splanchnici sacrales s. pelvini).
Учебное видео анатомии яичника
Редактор: Искандер Милевски. Дата последнего обновления публикации: 23.07.2021
77. Яичники, их топография, строение, отношение к брюшине; кровоснабжение, иннервация. Возрастные особенности яичника;
Яичник, ovarium (греч. oophoron),— парный орган, женская половая железа, располагается в полости малого таза (рис. 13). В яичниках развиваются и созревают женские половые клетки (яйцеклетки), а также образуются поступающие в кровь и лимфу женские половые гормоны. Яичник имеет овоидную форму, несколько уплощен в переднезаднем направлении. Цвет яичника розоватый. На поверхности яичника рожавшей женщины видны углубления и рубцы — следы овуляции и преобразования желтых тел. Масса яичника равна 5—8 г. Размеры яичника составляют: длина 2,5—5,5 см, ширина 1,5—3,0 см и толщина — до 2 см. В яичнике различают две свободные поверхности: медиальную, fades medialis, обращенную в сторону полости малого таза, и латеральную, fades lateralis, прилежащую к стенке малого таза. Поверхности яичника переходят в выпуклый свободный (задний) край, margo liber, спереди — в брыжеечный край, margo mesova-ricus, прикрепляющийся к брыжейке яичника. На этом крае ор гана находится желобовидное углубление, получившее название ворот яичника, hilum ovarii, через которые в яичник входят артерия, нервы, выходят вены и лимфатические сосуды. Длинник яичника относится также связка, подвешивающая яичник, lig. верхний трубный конец, extremitas tubaria, обращенный к маточной трубе, и нижний маточный конец, extremitas uterina, соединенный с маткой собственной связкой яичника, lig. ovarii proprium. Эта связка в виде круглого тяжа идет от маточного конца яичника к латеральному углу матки, располагаясь между двумя листками широкой связки матки. К связочному аппарату яичника относится также связка, подвешивающая яичник, lig. suspensorium ovarii, являющаяся складкой брюшины, идущей от стенки малого таза к яичнику, и содержащая внутри сосуды яичника и пучки фиброзных волокон. Яичник фиксирован также короткой брыжейкой, mesovarium, которая представляет собой дупликатуру брюшины, идущую от заднего листка широкой связ ки матки к брыжеечному краю яичника. Сами яичники брюшиной не покрыты. К трубному концу яичника прикрепляется наиболее крупная яичниковая бахромка маточной трубы. Топография яичника зависит от положения матки, ее величины (при беременности). Яичники относятся к весьма подвижным органам полости малого таза.
Строение яичника. Поверхность яичника покрыта однослойным зародышевым эпителием. Под ним залегает плотная соединительнотканная белочная оболочка, tunica albuginea. Соединительная ткань яичника образует его строму, stroma ovarii, богатую эластическими волокнами. Вещество яичника, его паренхиму, делят на наружный и внутренний слои. Внутренний слой, лежащий в центре яичника, ближе к его воротам, называют мозговым веществом, medulla ovarii. В этом слое в рыхлой соединительной ткани располагаются многочисленные кровеносные и лимфатические сосуды, нервы. Наружный слой яичника, его корковое вещество, cortex ovarii, более плотный. В нем много соединительной ткани, в которой располагаются везикулярные яичниковые [зрелые] фолликулы (граафовы пузырьки), folliculi ovarici vesiculosi, и созревающие первичном яичниковые фолликулы, folliculi ovarici primdrii. Зрелый яичниковый фолликул достигает в диаметре 1 см, имеет соединительнотканную оболочку — теку. В ней выделяют наружную теку, theca externa, состоящую из плотной соединительной ткани, и внутреннюю теку, theca interna, в которой залегают многочисленные кровеносные, лимфатические капилляры и интерстициальные клетки. К внутренней оболочке прилежит зернистый слой, stratum granulo-sum, — зернистая мембрана [membrana granulesa]. В одном месте этот слой утолщен и образует яйценосный холмик, cumulus oophorus, в котором залегает яйцеклетка — овоцит, ovocytus. Внутри зрелого фолликула яичника имеется полость, содержащая фолликулярную жидкость, liquor follicula-ris. Яйцеклетка расположена в яйценосном холмике, окружена прозрачной зоной, zona pellucida, и лучистым венцом, corona radiata, из фолликулярных клеток. По мере созревания фолликул постепенно достигает поверхностного слоя яичника. Во время овуляции стенка такого фолликула разрывается, яйцеклетка вместе с фолликулярной жидкостью поступает в брюшинную полость, где попадает на бахромки трубы, а затем в брюшное (брюшинное) отверстие маточной трубы.
На месте лопнувшего фолликула остается заполненное кровью углубление, в котором формируется желтое тело, corpus luteum. Если оплодотворения яйцеклетки не происходит, то желтое тело имеет небольшие размеры (до 1,0—1,5 см), существует недолго и называется циклическим (менструальным) желтым телом, corpus luteum ciclicum (menstruationis). В дальнейшем оно прорастает соединительной тканью и получает название беловатого тела, corpus albicans, которое через некоторое время рассасывается. Если яйцеклетка оплодотворяется и наступает беремен ность, то желтое тело беременности, corpus luteum graviditatis, разрастается и становится крупным, достигает 1,5—2,0 см в диаметре и существует весь период беременности, выполняя внутрисекреторную функцию. В дальнейшем оно также замещается соединительной тканью и превращается в беловатое тело. На местах лопнувших фолликулов на поверхности яичника остаются следы в виде углублений и складок; их количество с возрастом увеличивается.
Апоплексия яичника
Апоплексия яичника – кровоизлияние из сосуда яичника при его разрыве. Данный разрыв может сопровождаться обильным кровотечением в брюшную полость, которое несет большую опасность для организма женщины. Выделяют две формы апоплексии яичника: без кровотечения и с кровотечением в брюшную полость.
Причинами апоплексии яичника служат, как правило, воспалительные заболевания половых органов, которые приводят к повреждениям сосудов яичника. Такой процесс нарушает нормальную циркуляцию крови, в результате чего происходит апоплексия – разрыв капсулы яичника и может начаться брюшное кровотечение.
Заболевание чаще всего обнаруживается у женщин 20–35 лет. Наиболее часто возникает в середине менструального цикла, примерно на 12–15 день, или же во второй половине цикла.Следует отметить, что апоплексия в несколько раз чаще возникает в правом яичнике, чем в левом. Причина этой особенности заключается в большей интенсивности кровообращения в правом яичнике, потому как правая артерия яичника отходит от аорты, а левая – от почечной артерии. Вне зависимости от диагностики апоплексии в правом или левом яичнике необходимо скорейшее лечение заболевания.
Влияют на разрыв яичника и воспаления, протекающие в органах малого таза. Именно они приводят к процессам склеротического характера, которые происходят и в яичниковых тканях, и в сосудах.
Симптомы апоплексии яичника
Правильная диагностика того, что причина заболевания относится к сфере гинекологии при апоплексии яичника составляет всего около 5%. Сложность определения этого заключается в том, что клиническая картина заболевания развивается по аналогии со многими другими патологиями брюшной полости.
Различают 3 основные формы апоплексии яичника в зависимости от преобладающих симптомов: Болевая форма с ярко выраженным болевым синдромом, но без признаков внутрибрюшного кровотечения.
Анемическая форма, при которой на первый план выходят симптомы внутреннего (внутрибрюшного) кровотечения.
Смешанная форма является сочетанием болевой и анемической форм апоплексии яичника. Эта классификация на сегодняшний день считается неполноценной, поскольку разрыв яичника невозможен без появления кровотечения.
Более актуально подразделение данной патологии на несколько степеней тяжести: легкую, среднюю и тяжелую (в зависимости от величины кровопотери).
Симптомы заболевания апоплексия яичника – резкая боль в области левого или правого яичника. Данная боль может отдавать в поясничную область, задний проход, наружные половые органы, на ногу со стороны поражения.
При наличии формы апоплексии с кровотечением наблюдается резкое снижение давления, учащение пульса, сильная слабость, головокружение, бледность кожных покровов. Боль при апоплексии яичника может быть настолько сильной, что возникает сердечная недостаточность.
При развитии средней и тяжелой форм апоплексии яичников все симптомы проявляются более остро. Нередко развитие болезни связано с какими-либо внешними факторами, например, чрезмерным физическим напряжением, половой актом, травмой и другими. Степень выраженности симптомов напрямую зависит от объема внутреннего кровотечения.
Без принятия экстренных мер по устранению кровотечения при апоплексии яичника, оно может прогрессировать и создать весьма серьезную угрозу жизни. Необходима срочная госпитализация пациентки.
Лечение апоплексии яичника
Лечение апоплексии яичника напрямую зависит от формы заболевания и тяжести внутреннего кровотечения.
Консервативное лечение возможно лишь в случае легкой формы апоплексии яичника.
Данные большинства исследований показывают, что при консервативном лечении в 85,7% случаев в малом тазу образуются спайки, а в 42,8% случаев в дальнейшем появляется бесплодие. Помимо этого, у каждой 2-й пациентки после консервативного лечения велика вероятность рецидива (повторной апоплексии яичника). Вероятность последствий такого лечения апоплексии яичника обоснована тем, что кровь и сгустки после разрыва не вымываются, как при лапароскопии, а остаются в брюшной полости, что способствуют образованию спаечного процесса в малом тазу. Таким образом, консервативное лечение может быть рекомендовано только пациенткам, уже реализовавшим свою репродуктивную функцию в случае диагностики у них легкой болевой формы апоплексии яичника. Если женщина находится в репродуктивном возрасте и в дальнейшем планирует беременность, то лечение даже легкой формы апоплексии яичника должно склоняться в сторону лапароскопии.
Апоплексия яичника – острое показание к экстренному хирургическому вмешательству – остановке кровотечения (в месте кровотечения яичник прошивается хирургическими нитями). При слишком больших повреждениях яичника приходится прибегать к его удалению.
При апоплексии яичника показана лапароскопия. Операция при апоплексии яичника проводится максимально щадящим способом с сохранением яичника без последствий. Во время хирургического вмешательства тщательно промывается брюшная полость, удаляются сгустки и кровь, что необходимо для профилактики образования спаек и бесплодия.
В дальнейшем важно не допускать повторения апоплексии яичника. Необходимо проводить его профилактику – исключите факторы и заболевания, которые были причиной разрыва яичника.
Лапароскопия при апоплексии яичника
Показаниями к операции при апоплексии яичника являются потеря более 150 мл крови в брюшной полости, неэффективность консервативной терапии на протяжении 1–3 дней, обнаружение у пациентки острой патологии.
Проведение лапароскопии возможно во всех случаях и формах проявления апоплексии. Единственным противопоказанием к проведению процедуры является геморрагический шок (большая кровопотеря с потерей сознания).
Операцию лапароскопии при апоплексии следует проводить максимально щадящим способом с сохранением яичника. Как правило, при такой процедуре производится удаление капсулы кисты, коагуляция либо ушивание яичника. В редких случаях при слишком обильном кровоизлиянии требуется удаление яичника. Для профилактики образования спаечных процессов или бесплодия, во время проведения процедуры необходимо тщательное промывание брюшной полости и удаление сгустков.
Читайте также:
