Заболевание спектра нейромиелита зрительного нерва
Добавил пользователь Валентин П. Обновлено: 31.01.2026
Иммуносупрессоры широко используются для профилактики рецидива у пациентов с заболеванием спектра нейромиелита зрительного нерва (NMOSD). Однако какова оптимальная терапия первой линии для таких пациентов не известно.
В исследовании сравнили эффективность и частоту серьезных инфекций на фоне иммуносупрессивных препаратов у пациентов с заболеванием спектра нейромиелита зрительного нерва.
Методы
В ретроспективный анализ включили 136 французских пациентов с заболеванием спектра нейромиелита зрительного нерва (положительные антела к аквамарину 4 или антитела к гликопротеину миелина олигодендроцитов). Иммуносупрессивная терапия первой линии была начата в течение 3 лет после появления симптомов.
46% пациентов получали ритуксимаб, 31% получали микофенолата мофетил,17% пациентов получали азатиоприн.
Конечной точкой исследования являлся рецидив заболевания.
Результаты
Заключение
Применение ритуксимаба в качестве терапии первой линии при заболевании спектра нейромиелита зрительного нерва, более эффективно, чем применение микофенолата мофетил, вне зависимости от статуса антител.
Источник: Julien Poupart, Jonathan Giovannelli, Romain Deschamps, et al. Neurology 2020.

Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Оптикомиелит
Оптикомиелит (болезнь Девика) — демиелинизирующая патология, отличающаяся избирательным поражением спинного мозга и зрительных нервов. Клиническая картина характеризуется сочетанием зрительных расстройств с симптомами миелита (пара- или тетрапарез, нарушения чувствительности, тазовая дисфункция). Диагностика оптикомиелита осуществляется при помощи исследования ликвора, МРТ спинного и головного мозга, определения в крови специфичных антител. Лечится оптикомиелит комбинацией иммуносупрессивной (кортикостероиды, цитостатики) и симптоматической (миорелаксанты, анальгетики, антидепрессанты) терапии. Альтернативным является иммуномодулирующее лечение.
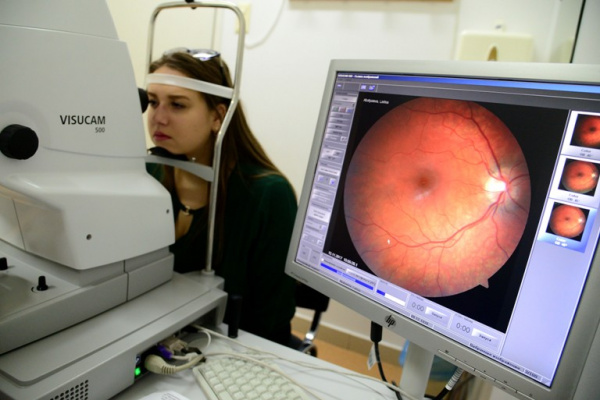
Общие сведения
Впервые сходная с оптикомиелитом симптоматика была описана в 1870 г. К 1894 г. французский врач Девик описал 16 случаев оптикомиелита и предложил выделить это заболевание в качестве отдельной нозологии. Однако длительный период в клинической неврологии болезнь Девика считалась одним из тяжелых вариантов рассеянного склероза. Лишь к концу ХХ века достижения в исследовании патогенеза демиелинизирующих заболеваний позволили считать оптикомиелит самостоятельной нозологической формой. Наиболее распространен оптикомиелит в Юго-Восточной Азии. Основной контингент заболевших составляют женщины среднего возраста. Хотя возрастной диапазон манифестации первых клинических признаков варьирует от 1 года до 77 лет, в большинстве случаев дебют оптикомиелита приходится на возраст 35-47 лет. Женщины более подвержены заболеванию, по различным данным на 1 заболевшего мужчину приходится 2-8 женщин.
Причины оптикомиелита
В настоящее время оптикомиелит относят к аутоиммунным заболеваниям, хотя его патогенез не полностью ясен. Специфические для оптикомиелита антитела NMO-IgG были определены в 2004 г. Они выявляются у 65-73% больных и отсутствуют у пациентов с другой аутоиммунной патологией, типичными формами рассеянного склероза, РЭМ или иными воспалительными поражениями ЦНС. В 2005 г. был найден белковый канал аквапорин-4, являющийся мишенью для антител NMO-IgG. Аквапорин-4 располагается преимущественно в тканях спинного мозга, в головном мозге — перивентрикулярно и в области гипоталамуса. Он локализуется в отростках астроцитов и стенке сосудов, формирующих гематоэнцефалический барьер. Повреждение белковых каналов антителами NMO-IgG приводит к повышению проницаемости гематоэнцефалического барьера, свободному проникновению через него других иммунных комплексов с развитием аутоиммунного воспаления.
Морфологически оптикомиелит сопровождается некрозом белого и серого мозгового вещества, образованием зон демиелинизации. Патологические изменения затрагивают спинной мозг, зрительные нервы, гипоталамус и хиазму. В зонах демиелинизации и периваскулярно при оптикомиелите обнаруживаются отложения IgG. Хронические спинальные воспалительные очаги представляют собой кистозную дегенерацию, атрофию и глиоз. В ряде случаев наблюдается формирование полостей, характерных для сирингомиелии. Одним из компонентов морфологических изменений при оптикомиелите практически во всех случаях выступает аутоиммунный васкулит.
Симптомы оптикомиелита
Базовыми проявлениями, характеризующими оптикомиелит, являются оптический неврит и воспалительное поражение спинного мозга (миелит). В 80% наблюдений неврит зрительного нерва предшествует развитию миелита, который появляется не позже, чем через 3 месяца от дебюта зрительных нарушений. В 20% случаев оптикомиелит манифестирует симптомами миелита, а затем присоединяется оптический неврит. В литературе по неврологии описан ряд случаев оптикомиелита Девика, при которых появлению неврологических проявлений предшествовали лихорадка, ОРВИ или другие инфекции. В отдельных случаях оптикомиелит развивался на фоне других аутоиммунных заболеваний (ревматоидного артрита, СКВ, синдрома Шегрена, антифосфолипидного синдрома, аутоиммунного тиреоидита, НЯК, тромбоцитопенической пурпуры).
Оптикомиелит, как правило, протекает с двусторонним поражением зрительных нервов. В дебюте заболевания пациенты отмечают нарушение четкости изображения, появление «пелены» перед глазами. Возможны болевые ощущения в орбитах. Известны случаи субклинического течения оптического неврита, диагностируемые при проведении офтальмоскопии. После затихания острого воспалительного процесса может наблюдаться некоторое восстановление зрительной функции, в других случаях наступает полная атрофия зрительного нерва и слепота.
Сопровождающие оптикомиелит Девика спинальные поражения могут носить полный поперечный, распространенный продольный или частичный поперечный характер. Клинически они проявляются нижним парапарезом или тетрапарезом, спастической мышечной гипертонией, атаксией и дискоординацией в конечностях, расстройством чувствительности ниже уровня спинального поражения, вегетативными нарушениями, тазовой дисфункцией (недержанием кала и задержкой мочи). Примерно у 35% пациентов с оптикомиелитом наблюдается симптом Лермитта — идущий в каудальном направлении резкий «прострел» в позвоночника, иррадиирующий в ноги. Возможны крампли, периодически возникающие в ногах. Отличительной особенностью оптикомиелита является распространение патологических изменений на 3 и более спинальных сегмента.
Оптикомиелит может иметь монофазное или ремиттирующее течение. Последнее составляет до 85-90% случаев. Оно характеризуется периодами обострения и относительной ремиссии. При этом возможно как совместное обострение неврита и миелита, так и раздельное появление их атак с временным интервалом до нескольких месяцев или даже лет. В первый год заболевания рецидив отмечается у 55% пациентов, в первые 3 года — у 78%, в первые 5 лет — у 99%. Монофазный оптикомиелит отличается прогрессирующим развитием одновременно миелита и неврита без последующих рецидивов.
Диагностика оптикомиелита
В ходе диагностического поиска наряду с анализом клинической картины невролог опирается на данные исследования спинномозговой жидкости и магнитно-резонансной томографии. Необходимо дифференцировать оптикомиелит от острого рассеянного энцефаломиелита, рецидивирующего ретробульбарного неврита, миелопатии, рецидивирующего миелита.
С целью забора цереброспинальной жидкости (ликвора) проводится люмбальная пункция. В острой фазе заболевания анализ ликвора выявляет плеоцитоз свыше 50 клеток в 1 мм3. Типичные для рассеянного склероза олигоклональные антитела определяются менее чем у 20% пациентов. Проводится также исследование крови на антитела NMO-IgG. Кроме того, в крови у пациентов с оптикомиелитом Девика могут выявляться антитиреоидные и антинуклеарные антитела. Офтальмолог осуществляет проверку остроты зрения и осмотр глазного дна (офтальмоскопию). Последняя даже при отсутствии клиники оптического неврита может выявлять стушеванность, бледность и отек диска зрительного нерва. Более точно диагностировать поражение зрительного нерва позволяет исследование зрительных ВП.
МРТ позвоночника визуализирует очаги поражения, охватывающие 2 и более спинальных сегментов и обычно имеющие некротический характер. При этом МРТ головного мозга выявляет демиелинизацию зрительных трактов. В некоторых случаях патологические изменения могут визуализироваться в области гипоталамуса. Другие церебральные структуры, как правило, остаются интактны. МРТ-картина в виде распространенного спинального поражения и отсутствия очагов в головном мозге позволяет дифференцировать оптикомиелит от рассеянного склероза и РЭМ.
Абсолютными диагностическими критериями оптикомиелита выступают: оптический неврит, острый миелит, отсутствие клиники иных поражений вне спинальных структур и зрительных нервов. Диагноз подтверждается наличием 1 из «больших» подтверждающих критериев: интактность церебральных структур по данным МРТ, патологические спинальные очаги протяженностью более 2-х сегментов, плеоцитоз ликвора свыше 50 клеток в 1 мм3. Новым дополнительным критерием оптикомиелита является наличие NMO-IgG антител.
Лечение и прогноз оптикомиелита
Симптоматическое лечение оптикомиелита включает применение миорелаксантов (дантролена, толперизона), интратекальной инфузии баклофена, антидепрессантов (имипрамина, амитриптилина), центральных анальгетиков (прегабалина), физиотерапии (электрофореза, СМТ, озокерита, парафинотерапии, массажа). С целью восстановления двигательной и чувствительной функции конечностей, улучшения координации, уменьшения спастичности показана лечебная физкультура.
Среди исходов оптикомиелита Девика может наблюдаться полное выздоровление, остаточные парезы и расстройства зрения (в наихудшем варианте — амавроз), ремиссия, в тяжелых случаях — летальный исход. Причиной последнего зачастую выступает тяжелый миелит шейных сегментов спинного мозга, приводящий к развитию дыхательной недостаточности. Прогностически более неблагоприятным считается оптикомиелит с монофазным течением, стойким двигательным дефицитом, атрофией зрительных нервов.
Ишемическая нейропатия зрительного нерва
Ишемическая нейропатия зрительного нерва – поражение зрительного нерва, обусловленное функционально значимым расстройством кровообращения в его интрабульбарном или интраорбитальном отделе. Ишемическая нейропатия зрительного нерва характеризуется внезапным снижением остроты зрения, сужением и выпадением полей зрения, монокулярной слепотой. Диагностика ишемической нейропатии требует проведения визометрии, офтальмоскопии, периметрии, электрофизиологических исследований, УЗДГ глазных, сонных и позвоночных артерий, флюоресцентной ангиографии. При выявлении ишемической нейропатии зрительного нерва назначается противоотечная, тромболитическая, спазмолитическая терапия, антикоагулянты, витамины, магнитотерапия, электро- и лазерстимуляция зрительного нерва.
Ишемическая нейропатия зрительного нерва обычно развивается в возрасте 40-60 лет, преимущественно у лиц мужского пола. Это серьезное состояние, которое может вызывать значительное снижение зрения и даже слепоту. Ишемическая нейропатия зрительного нерва не является самостоятельным заболеванием органа зрения, а служит глазным проявлением различных системных процессов. Поэтому проблемы, связанные с ишемической нейропатией, изучаются не только офтальмологией, но и кардиологией, ревматологией, неврологией, эндокринологией, гематологией.
Классификация
Поражение зрительного нерва может развиваться в двух формах – передней и задней ишемической нейропатии. Обе формы могут протекать по типу ограниченной (частичной) или тотальной (полной) ишемии.
При передней ишемической нейропатии зрительного нерва патологические изменения обусловлены острым расстройством кровообращения в интрабульбарном отделе. Задняя нейропатия развивается реже и связана с ишемическими нарушениями, возникающими по ходу зрительного нерва в ретробульбарном (интраорбитальном) отделе.
Причины
Передняя ишемическая нейропатия патогенетически обусловлена нарушением кровотока в задних коротких ресничных артериях и развивающейся вследствие этого ишемией ретинального, хориоидального (преламинарного) и склерального (ламинарного) слоев ДЗН. В механизме развития задней ишемической нейропатии ведущая роль принадлежит расстройству кровообращения в задних отделах зрительного нерва, а также стенозам сонных и позвоночных артерий. Локальные факторы острого нарушения кровообращения зрительного нерва могут быть представлены как функциональными расстройствами (спазмами) артерий, так и их органическими изменениями (склеротическими поражениями, тромбоэмболиями).
Этиология ишемической нейропатии зрительного нерва мультифакторная; заболевание обусловлено различными системными поражениями и связанными с ними общими гемодинамическими нарушениями, локальными изменениями в сосудистом русле, расстройствами микроциркуляции. Ишемическая нейропатия зрительного нерва наиболее часто развивается на фоне общих сосудистых заболеваний – атеросклероза, гипертонической болезни, височного гигантоклеточного артериита (болезни Хортона), узелкового периартериита, облитерирующего артериита, сахарного диабета, дископатий шейного отдела позвоночника с нарушениями в вертебробазилярной системе, тромбоза магистральных сосудов. В отдельных случаях ишемическая нейропатия зрительного нерва возникает вследствие острой кровопотери при желудочно-кишечных кровотечениях, травмах, хирургических вмешательствах, анемии, артериальной гипотонии, болезнях крови, после наркоза или гемодиализа.
Симптомы
При ишемической нейропатии зрительного нерва чаще поражается один глаз, однако у трети больных могут наблюдаться двусторонние нарушения. Нередко второй глаз вовлекается в ишемический процесс спустя некоторое время (несколько дней или лет), обычно в течение ближайших 2-5 лет. Передняя и задняя ишемическая нейропатия зрительного нерва часто сочетаются между собой и с окклюзией центральной артерии сетчатки.
Оптическая ишемическая нейропатия, как правило, развивается внезапно: часто после сна, физического усилия, горячей ванны. При этом резко снижается острота зрения (вплоть до десятых долей, светоощущения или слепоты при тотальном поражении зрительного нерва). Резкое падение зрения происходит в период от нескольких минут до часов, так что пациент четко может указать время ухудшения зрительной функции. Иногда развитию ишемической нейропатии зрительного нерва предшествуют симптомы-предвестники в виде периодического затуманивания зрения, боли за глазом, сильной головной боли.
При данной патологии в том или ином варианте всегда нарушается периферическое зрение. Могут отмечаться отдельные дефекты (скотомы), выпадения в нижней половине поля зрения, выпадения височной и носовой половины поля зрения, концентрическое сужение полей зрения.
Период острой ишемии продолжается в течение 4-5 недель. Затем постепенно спадает отек ДЗН, рассасываются кровоизлияния, наступает атрофия зрительного нерва различной степени выраженности. При этом дефекты полей зрения сохраняются, но могут значительно уменьшаться.
Диагностика
Для выяснения характера и причин патологии пациенты с ишемической нейропатией зрительного нерва должны быть обследованы офтальмологом, кардиологом, эндокринологом, неврологом, ревматологом, гематологом.
Комплекс офтальмологического обследования включает проведение функциональных тестов, осмотра структур глаза, ультразвуковых, рентгенологических, электрофизиологических исследований.
Проверка остроты зрения выявляет его снижение от незначительных величин до уровня светоощущения. При обследовании полей зрения определяются дефекты, соответствующие повреждению тех или иных участков зрительного нерва.
При офтальмоскопии выявляется бледность, ишемический отек и увеличение ДЗН, его проминация в стекловидное тело. Сетчатка вокруг диска отечна, в макуле определяется «фигура звезды». Вены в зоне сдавления отеком узкие, на периферии, напротив, полнокровные и расширенные. Иногда выявляются очаговые кровоизлияния и экссудация.
Ангиография сосудов сетчатки при ишемической нейропатии зрительного нерва выявляет ретинальный ангиосклероз, возрастной фиброз, неравномерный калибр артерий и вен, окклюзию цилиоретинальных артерий. При задней ишемической нейропатии зрительного нерва офтальмоскопия в остром периоде не выявляет никаких изменений в ДЗН. При УЗДГ глазных, надблоковых, сонных, позвоночных артерий нередко определяются изменения кровотока в данных сосудах.
Электрофизиологические исследования (определение критической частоты слияния мельканий, электроретинограмма и др.) демонстрируют снижение функциональных порогов зрительного нерва. При исследовании коагулограммы обнаруживаются изменения по типу гиперкоагуляции; при определении холестерина и липопротеидов выявляется гиперлипопротеинемия. Ишемическую нейропатию зрительного нерва следует отличать от ретробульбарного неврита, объемных образований орбиты и ЦНС.
Лечение
Терапия ишемической нейропатии зрительного нерва должна быть начата в первые часы после развития патологии, поскольку длительное нарушение кровообращение вызывает необратимую гибель нервных клеток. Неотложная помощь при резко развившейся ишемии включает немедленное внутривенное введение раствора эуфиллина, прием нитроглицерина под язык, вдыхание паров нашатырного спирта. Дальнейшее лечение ишемической нейропатии зрительного нерва проводится стационарно.
Последующее лечение направлено на снятие отека и нормализацию трофики зрительного нерва, создание обходных путей кровоснабжения. Важное значение имеет терапия основного заболевания (сосудистой, системной патологии), нормализация показателей свертывающей системы и липидного обмена, коррекция уровня АД.
При ишемической нейропатии зрительного нерва назначается прием и введение мочегонных препаратов (диакарба, фуросемида), сосудорасширяющих и ноотропных средств (винпоцетина, пентоксифилина, ксантинола никотината), тромболитических препаратов и антикоагулянтов (фениндиона, гепарина), кортикостероидов (дексаметазона), витаминов групп В, С и Е. В дальнейшем проводится магнитотерапия, электростимуляция, лазерстимуляция волокон зрительного нерва.
Прогноз и профилактика
Прогноз ишемической нейропатии зрительного нерва неблагоприятен: несмотря на лечение, часто сохраняется значительное снижение остроты зрения и стойкие дефекты периферического зрения (абсолютные скотомы), обусловленные атрофией зрительного нерва. Повышения остроты зрения на 0,1-0,2 удается добиться лишь у 50% пациентов. При поражении обоих глаз возможно развитие слабовидения или тотальной слепоты.
Для профилактики ишемической нейропатии зрительного нерва важное значение имеет терапия общих сосудистых и системных заболеваний, своевременность обращения за медицинской помощью. Пациентам, перенесшим ишемическую нейропатию зрительного нерва одного глаза, необходимо диспансерное наблюдение офтальмолога и проведение соответствующей профилактической терапии.
Оптическая нейропатия Лебера ( Атрофия зрительного нерва Лебера )
МКБ-10

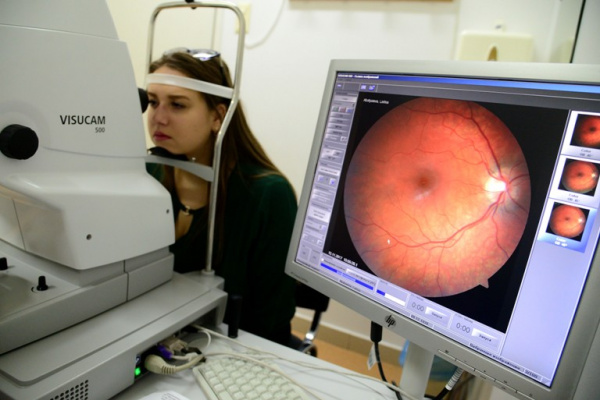
Заболевание названо в честь немецкого офтальмолога Теодора Лебера, который впервые описал 15 случаев внезапной потери зрения у пациентов из четырех семей. Молекулярно-генетические основы заболевания были установлены американским биохимиком Д. Уоллесом в 1988 году. Наследственная оптическая нейропатия Лебера (НОНЛ) встречается с частотой 1 случай на 50 тыс. населения, однако носителями мутации является каждый десятитысячный житель планеты. В России заболевание чаще встречается среди жителей Сибири. Мужчины болеют оптической нейропатией в 5 раз чаще, чем женщины.
Заболевание развивается вследствие мутаций в митохондриальной ДНК, которые приводят к нарушению энергообеспечения зрительных нервов и вызывают их гибель. До 95% случаев связано с 3 видами генетических аномалий: 3460G>A в гене ND1, 11778GC (ND6). Мутация гена ND4 встречается наиболее часто в клинической практике. Оптическая нейропатия Лебера может быть вызвана и другими вариантами аномалий, которые недостаточно изучены из-за их редкости.
Для мутаций митохондриальной ДНК характерна неполная пенетрантность, поэтому у одних людей с аномальным геном возникает яркая клиническая картина, а другие всю жизнь остаются бессимптомными носителями. В развитии заболевания играют роль внешние триггеры. Наиболее значимыми из них признаны:
- курение;
- воздействие производственных токсинов;
- лекарственные препараты (противотуберкулезные антибиотики, глюкокортикостероиды, интерфероны).
Риск манифестации нейропатии повышается после ЧМТ, сильного стресса, острого соматического заболевания.
Патогенез
При нарушении последовательности нуклеотидов в митохондриальной ДНК изменяется структура белков, которые кодируются данными генами. Поскольку при оптической нейропатии Лебера поражаются ND-гены, кодирующие протеины комплекса I (NADH-убихинон редуктаза), патология возникает на этапе образования молекул АТФ. Клетки нервной системы чувствительны к недостатку энергетических молекул, что и обуславливает поражение зрительного нерва.
Молекулярной основой заболевания считается снижение транспорта АТФ к дистальным участкам аксонов, из-за чего на периферии запускаются процессы апоптоза. Нехватка АТФ наиболее заметна в тонких безмиелиновых волокнах, которые составляют зрительный нерв, поэтому при нейропатии Лебера первично страдает зрение. Развитию патологии способствует врожденный избыток аксонов в диске зрительного нерва и особое строение решетчатой пластины.

В течении оптической нейропатии Лебера выделяют 3 последовательные стадии: доклиническую, острую, хроническую (атрофическую). Первая стадия протекает бессимптомно, однако при обследовании пациента у офтальмолога по другому поводу обнаруживают отек зрительного нерва и появление на нем телеангиэктазий. Длительность этого этапа не регламентирована, поскольку болезнь крайне редко выявляется на доклинической стадии.
Острая стадия оптической нейропатии Лебера чаще всего возникает у молодых мужчин в возрасте от 18 до 30 лет. Пациенты жалуются на резкое снижение зрения по типу центральной скотомы. В течение 1-1,5 месяцев человек утрачивает способность различать мелкие предметы, иногда недоступен даже счет пальцев у лица, и остается лишь светоощущение. Патология поражает оба глаза одновременно или последовательно с интервалом 6-8 недель.
Спустя 6 месяцев болезнь переходит в хроническую стадию, когда острота зрения составляет несколько тысячных. В этот период продолжается атрофия нерва, после завершения которой функцию глазного яблока уже невозможно вернуть. Офтальмологическая картина представлена побледнением зрительного диска. Однако существуют случаи обратного развития симптоматики, когда спустя время пациенты частично восстанавливают зрение.
При оптической нейропатии возможны экстраокулярные проявления. Поражение нервов может затрагивать не только зрительный тракт, поэтому у части пациентов наблюдается периферическая нейропатия, миопатия, мышечная дистония. При манифестации болезни в раннем детском возрасте есть риск развития подострой некротизирующей энцефаломиопатии (синдрома Лея). Изредка наблюдаются перекрестные симптомы НОНЛ и MELAS-синдрома.
Осложнения
Основная проблема нейропатии Лебера заключается в утрате зрения, которая особенно тяжело переносится молодыми больными. На фоне слепоты развиваются тяжелые депрессии, которые могут завершаться суицидальными попытками. Поскольку даже частичное восстановление зрения происходит не у всех, в будущем пациенты получают инвалидность и вынуждены проходить реабилитацию для адаптации к новым условиям жизни.
У некоторых женщин нейропатия Лебера протекает по типу рассеянного склероза с чередованием периодов обострений и ремиссий. У таких пациентов потеря зрения чередуется с эпизодами неполного восстановления способности видеть. Характерно вторичное прогрессирование неврологических симптомов в сочетании со слепотой, известное как болезнь Хардинга. Патология сопровождается очагами демиелинизации в головном мозге, которые отягощают клиническое течение.
Прогрессирующее снижение зрения – повод для всестороннего обследования пациента у врача-офтальмолога. Диагностически значимыми критериями являются: центральная скотома, отсутствие болевого синдрома, наличие подобных симптомов у ближайших родственников по материнской линии. Чтобы подтвердить оптическую нейропатию Лебера, используют следующие исследования:
- Офтальмоскопия. При осмотре глазного дна определяется отек и восковидная бледность зрительного диска. Экскавация центральной части диска в пределах нормы. При обследовании на раннем этапе заболевания визуализируются точечные кровоизлияния в сетчатку.
- Визометрия. Оценка остроты зрения по стандартным таблицам невозможна, поскольку этот показатель не превышает 0,001. На практике это соответствует способности «счета пальцев у лица» и различения силуэтов. Дополнительно проводят периметрию, которая подтверждает выпадение центральных полей зрения.
- Оптическая когерентная томография. Прицельное исследование макулы сетчатки показывает истончение и слабую дифференцировку всех слоев, сглаживание фовеолярного контура, уплотнение внутренней пограничной мембраны. ОКТ – наиболее информативный способ диагностики атрофии ЗН.
- Исследование ЗВП. Электрофизиологическая диагностика зрительных вызванных потенциалов показывает снижение проводимости по нерву на участке до перекреста. Выраженность этих изменений коррелирует со степенью снижения зрения.
- Молекулярно-генетическое тестирование. Выделение митохондриальной мутации необходимо для верификации диагноза нейропатии Лебера. Пациентам назначают таргетное тестирование на 3 самые распространенные точечные аномалии, по показаниям проводят мультигенную панель или полное секвенирование мтДНК.
В остром периоде НОНЛ необходимо отличать от воспалительных заболеваний зрительного нерва: ретробульбарного неврита, оптикомиелита Девика, оптического неврита при ревматических заболеваниях. Обязательно исключают ишемическую оптическую нейропатию, типичную для повышения внутриглазного давления. Хроническую стадию болезни дифференцируют с компрессией зрительного нерва опухолями орбиты и хиазмально-селлярной области.

Лечение оптической нейропатии Лебера
Консервативная терапия
В практической офтальмологии нет эффективной схемы лечения, которая могла бы улучшить зрительную функцию пациентов. В качестве вспомогательной и патогенетической терапии назначаются препараты коэнзима Q10, левокарнитина и цитохрома. Зачастую их комбинируют в «митохондриальные коктейли» для усиления лечебного действия. Однако даже длительный прием медикаментов не оказывает существенного влияния на клинические показатели.
Экспериментальное лечение
Поскольку медикаментозная терапия не позволяет восстановить зрение, ученые возлагают большие надежды на генно-инженерные технологии. Их суть основана на изменении мутантной митохондриальной ДНК на нормальную, чтобы повысить содержание АТФ в аксонах зрительного пути и предотвратить атрофию нерва. На сегодня такие методы находятся на стадии экспериментов, некоторые проходят первую стадию клинических испытаний.
Реабилитация
Для людей с инвалидностью по зрению первостепенную важность приобретает социально-психологическая адаптация. Программа реабилитации предполагает обучение навыкам самостоятельного передвижения, ориентации в пространстве и самообслуживания. Все пациенты проходят изучение шрифта Брайля, что позволяет им читать и продолжать образование. По желанию человека проводится трудовая реабилитации и обучение навыкам (резьба, музыка, скульптура).
Прогностически благоприятным считается НОНЛ с мутацией 14484T>C, при которой пациенты имеют шансы на полное восстановление зрения. Мутация 3460G>A протекает крайне неблагоприятно и быстро приводит к слепоте. Аномалия 11778G
1. Наследственная оптическая нейропатия Лебера/ И.О. Мазунин, Н.В. Володько// Вестник офтальмологии. – 2018. – №2.
2. Harding-синдром-наследственная оптическая нейропатия Лебера и рассеянный склероз: клинический случай и обзор литературы/ Е.В. Попова, В.В. Брюхов, М.В. Коротенкова// Международный неврологический журнал. – 2017. – №7.
3. Оптическая нейропатия Лебера/ Е.А. Руина, О.И. Чадаева, Е.В. Паршина, А.А. Смирнов// Медицинский альманах. – 2017. – №5.
4. Наследственная оптическая нейропатия Лебера/ С.В. Копишинская, С.Н. Светозаров, А.В. Густов// Современные технологии медицины. – 2014. – №2.
Эффективность нового биологического препарата сатрализумаба при заболевании спектра нейромиелита зрительного нерва
Заболевание спектра нейромиелита зрительного нерва представляют собой аутоиммунную болезнь центральной нервной системы и ассоциировано с развитием антител против анти-аквапорина-4 (AQP4-IgG) примерно у 2/3 пациентов.
Интерлейкин-6 вовлечен в патогенез данного заболевания.
Сатрализумаб представляет собой человеческое моноклональное антитело, мишенью которого является рецептор интерлейкина-6.
В новом исследовании оценивали эффективность и безопасность сатрализумаба в дополнение к иммуносупрессивной терапии у пациентов с заболеванием спектра нейромиелита зрительного нерва.
В 3 фазу рандомизированного двойного слепого плацебо-контролируемого исследования были рандомизированы больные с заболеванием спектра нейромиелита зрительного нерва. Пациенты были серопозитивными или серонегативными по AQP4-IgG.
Больные получали или сатрализумаб в дозе 120 мг или плацебо подкожно на неделе 0, 2 и 4, и затем каждые 4 недели в дополнение к иммуносупрессивной терапии.
Первичной конечной точкой эффективности был выбран первый рецидив. Ключевыми вторичными конечными точками являлось изменение к 24 неделе интенсивности боли по визуальной аналоговой шкале (от 0 до 100 баллов) и слабости по Functional Assessment of Chronic Illness Therapy–Fatigue (FACIT-F) (от 0 до 52 баллов, чем выше балл, тем больше выражена слабость).
Результаты
У пациентов с заболеванием спектра нейромиелита зрительного нерва использование ингибитора рецептора к интерлейкину-6 сатрализумаба ассоциировано со снижением риска рецидива, но не превосходит плацебо в снижении интенсивности боли и слабости.
Источник: Takashi Yamamura, Ingo Kleiter, Kazuo Fujihara, et al. N Engl J Med 2019; 381:2114-2124.
Читайте также:
- Пролимфоцитарная лейкемия - диагностика, лечение
- Рентгенограмма, КТ, МРТ при аплазии, гипоплазии зубовидного отростка
- Талассоотиты или мареотиты. Механизмы развития мареотитов
- Медикаментозно-обусловленная патология миокарда. Лекарственная патология сердца.
- Обидоксим (Toxogonin) для лечения отравления нервно-паралитическими веществами
