Злокачественная лейомиома. Озлокачествление лейомиомы.
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Редкое заболевание, локализуется чаще в коже. Встречается у людей с нарушенным липидным обменом, обычно множественное. Локализуется также в сухожилиях. Представлено мелкими узелками, частью типа ксантелазм.
Юношеская ксантогранулема
Небольшой узелок в толще дермы или подкожной клетчатке. Исчезает спонтанно.
Фиброзная гистиоцитома
Чаще встречается в среднем возрасте, локализуется преимущественно на нижних конечностях. Обычно имеет форму плотного узла до 10см, растет медленно. После хирургического удаления рецидивы редки.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ЖИРОВОЙ ТКАНИ
Липома
Одна из самых частых доброкачественных опухолей (30—40%). Может возникнуть всюду, где есть жировая ткань. При локализации в дерме обычно инкапсулированная, в других участках тела слабо отграничена. Озлокачествляться могут опухоли, локализованные в забрюшинном пространстве, другие локализации практически не озлокачествляются. Липомы нередко бывают множественными, иногда развиваются симметрично. Рост их не связан с общим состоянием организма. Опухоль имеет форму узла дольчатого строения. При длительном существовании в липоме могут развиваться дистрофические изменения, обызвествление, оссификация.
Существуют многочисленные варианты зрелых жировых опухолей, которые отличаются от классической липомы как клиническими проявлениями, так и некоторыми морфологическими особенностями.
Миелолипома
Редкая опухоль, чаще встречается в забрюшинном пространстве, клетчатке малого таза, надпочечниках. Не озлокачествляется.
Подкожная ангиолипома
Многочисленные болезненные узлы. Встречается чаще в молодом возрасте у мужчин на передней стенке живота, на предплечье.
Веретеноклеточная липома
Наблюдается чаще у взрослых мужчин (90%). Узел округлой формы, плотный, медленно растущий, чаще локализован в области плечевого сустава, спины. Рецидивы и метастазы после иссечения не описаны, несмотря на тот факт, что опухоль может инфильтрировать окружающие ткани.
В хондро- и остеолипомах выявляют метапластические участки костной и хрящевой ткани.
Доброкачественный липобластоматоз
Подразделяется на узловатую (добр. липобластома) и диффузную (добр. липобластоматоз) формы. Болеют чаще мальчики до 7 лет (88%). Опухоль локализуется на нижней конечности, в области ягодиц и на верхней конечности — надплечье и кисть. Описаны также поражение шеи, средостения, туловища. Опухолевый узел инкапсулированный, дольчатый, шаровидной формы, может достичь 14 см. После хирургического лечения возможны рецидивы, иногда повторные. Метастазы не описаны.
Гебернома (фетальная липома)
Липома из липобластов, псевдолипома — исключительно редкая опухоль, локализуется в местах, где имеется бурый жир (шея, аксилярная область, сина, средостение). Представлен дольчатым узлом обычно маленького размера. Не рецидивирует и не метастазирует.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ МЫШЕЧНОЙ ТКАНИ
Опухоли мышечной ткани делят на опухоли гладких мышц — лейомиомы, и поперечно полосатых — рабдомиомы. Опухоли встречаются достаточно редко.
Лейомиома
Зрелая доброкачественная опухоль. Возникает в любом возрасте у лиц обоих полов. Нередко бывает множественной. Опухоль может озлокачествляться. Лечение хирургическое.
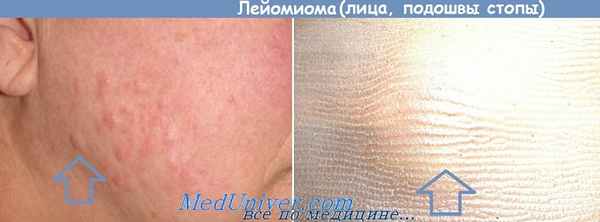
Лейомиома, развивающаяся из мышечной стенки мелких сосудов — небольшие, часто множественные нечетко отграниченные и медленно растущие узлы, часто с изъязвленной кожей, клинически очень напоминает саркому Капоши.
Генитальная лейомиома образуется из мышечной оболочки мошонки, больших половых губ, промежности, сосков молочной железы. Может быть множественной. В опухоли нередко отмечается клеточный полиморфизм. Гормонозависимая. Лечение хирургическое.
Ангиолейомиома из замыкающих артерий
Клинически резко болезненная опухоль, которая при внешних воздействиях или эмоциях может менять размеры. Размеры обычно маленькие, чаще встречается у пожилых людей, на конечностях, вблизи суставов. Характеризуется медленным ростом и доброкачественным течением.
Рабдомиома
Редкая зрелая доброкачественная опухоль, имеет в своей основе поперечно полосатую мышечную ткань. Поражает сердце и мягкие ткани. Представляет собой умеренно плотный узел с четкими границами, инкапсулированная. Метастазов рабдомиомы не описано. Рецидивы крайне редки. Микроскопически различают 3 субтипа — миксоидный, феталный клеточный и взрослый. Выделяют также рабдомиому женских гениталий. Рецидивирует в основном взрослый тип.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ КРОВЕНОСНЫХ И ЛИМФАТИЧЕСКИХ СОСУДОВ
Эти поражения включают в себя различные процессы, значительное число из них рассматриваются в дерматологии. Часть из них относится к порокам развития сосудистой системы опухолевидного характера, часть к истинным опухолям.
Капиллярная ангиома
Истинное новообразование с пролиферацией эндотелиальных клеток.
Доброкачественная гемангиоэндотелиома
Врожденная патология, встречается у новорожденных и грудных детей, чаще у девочек, с локализацией в области головы.
Капиллярная гемангиома
После липомы наиболее частая опухоль мягких тканей, часто бывает множественной, максимальной величины достигает к 6 месячному возрасту, при множественном поражении возможны локализации во внутренних органах
Кавернозная гемангиома
Образование, состоящее из причудливых полостей типа синусоид различной величины. Локализуется в коже, мышцах, внутренних органах. Имеет доброкачественное течение.
Старческая гемангиома
Истинная опухоль, характеризуется пролиферацией капилляров с последующей их кавернизацией с вторичными изменениями.
Гемангиома
Зрелая доброкачественная опухоль сосудистого происхождения, встречается часто. Поражает чаще людей среднего возраста, локализуется на слизистой оболочке носа, губы, на коже лица, конечностей, в молочной железе. Представляет собой четко отграниченный узел серовато-розового цвета 2—3 см. Опухоль нередко может озлокачествляться и перейти в ангиосаркому.
Артериальная ангиома
Конгломерат порочно развитых сосудов, не имеет признаков опухоли.
Гломангиома (гломусная опухоль, опухоль Барре—Массона)
Встречается в виде изолированной опухоли или в виде множественной диссеминированной семейной гломусангиомы. Опухоль доброкачественная, встречается у пожилых людей, в кистях и стопах, чаще в зоне ногтевого ложа. Может поражать кожу голени, бедра, лица, туловища. В единичных наблюдениях отмечена в почках, влагалище, костях. При локализации в коже опухоль резко болезненная. Не рецидивирует и не метастазирует.
Гемангиоперицитома
Встречается редко, может возникнуть в любом возрасте. Локализуется в коже, реже в толще мягких тканей. Имеет вид отграниченного плотного узла красного цвета. Опухоль может озлокачествляться — давая рецидивы и метастазы, считается потенциально злокачественным процессом. Озлокачествление до 20% случаев описано у взрослых. Процесс у детей имеет доброкачественный характер.
Лимфангиома
Наблюдается чаще у детей как порок развития лимфатических сосудов, однако может встречаться в любом возрасте. Чаще локализуется на шее, слизистой полости рта.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ И ОПУХОЛЕПОДОБНЫЕ ЗАБОЛЕВАНИЯ СИНОВИАЛЬНОЙ ТКАНИ (СУСТАВОВ)
Доброкачественная синовиома без гигантских клеток
Существование доброкачественных синовиом обсуждается. Большинство авторов склоняется к тому, что все синовиомы являются злокачественными независимо от степени зрелости. Опухоль поражает главным образом коленный сустав, в виде небольших плотных узлов. Лечение хирургическое, однако больные должны наблюдаться в течение 5—9 лет. Болезнь может дать рецидивы и метастазы.
Доброкачественная гигантоклеточная синовиома (нодулярный тендосиновиит)
Псевдоопухолевый процесс, встречается достаточно часто. В 15% процесс возникает в области синовиальной оболочки суставов, в 80% — в сухожильных влагалищах, в 5% — в слизистых сумках. Представляет собой узловатое образование, чаще локализованное на пальцах кистей, реже стоп и еще реже в области крупных суставов. Излюбленная локализация — межфаланговые суставы. Чаще встречается у женщин 30—60 лет. При длительном существовании может вызвать атрофию окружающих тканей, в том числе и кости. Процесс часто рецидивиреут, большая часть рецидивов связана с неполным удалением. Метастазов не дает.
Пигментный виллонодулярный синовит
Располагается внутри оболочки суставов, чаще в зоне коленного локтевого и плечевого суставов. Встречается в среднем возрасте. Этиология не ясна.
ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПЕРИФЕРИЧЕСКИХ НЕРВОВ
Травматическая или ампутационная неврома
Возникает как результат посттравматической гиперрегенерации нерва. Представляет собой небольшой болезненный узел.
Нейрофиброма
Одиночная, медленно растущая доброкачественная опухоль мезенхимальной оболочки нервного ствола любой локализации, но чаще всего развивается на седалищном нерве и межреберных нервах. Возникает у людей любого возраста. Клинически определяется в виде небольших размеров плотно-эластической консистенции с гладкой поверхностью опухолевого узла, при пальпации которого боль иррадирует по ходу нерва. Некоторые опухоли могут достигать больших размеров. Рост опухоли может происходить как к периферии от нерва, так и в толще нервного ствола, что выявляется при ее морфологическом исследовании.
Лечение хирургическое. Прогноз хороший. Особое заболевание — множественный нейрофиброматоз (болезнь Реклингхаузена), которое относится к группе диспластических процессов. Описаны случаи озлокачествления одной из множественных нейрофибром при этом заболевании.
Неврилеммома (невринома, шваннома)
Доброкачественная опухоль шванновской оболочки. Образуется по ходу нервных стволов. Бывает одиночной. Прогноз благоприятный.
Злокачественная лейомиома. Озлокачествление лейомиомы.
Злокачественная лейомиома. Озлокачествление лейомиомы.
Злокачественная лейомиома (лейомиосаркома, метастазирующая лейомиома, мносаркома) локализуется аналогично лейомиоме. Протекает крайне злокачественно. Обычно возникают ранние обильные гематогенные метастазы, рецидивы после удаления редки. Имеет форму узла, который может достигать в диаметре 15—20 см и более. Инфильтрирующий рост очевиден не всегда. Некоторые авторы рекомендуют выделять типичные злокачественные лейомиомы и атипичные, или полиморфноклеточные лейомиосаркомы. Типичные злокачественные лейомиомы характеризуются большим сходством с лейомиомами. Лишь при исследовании периферических отделов становится очевидным инфильтрирующий рост опухоли. Однако ложная картина инфильтративного роста может наблюдаться и в зрелых «молодых» лейомиомах. Атипичные злокачественные лейомиомы характеризуются резкой катаплазией опухолевых клеток, которые могут достигать больших размеров, отличаются полиморфизмом. Цитоплазма теряет ацидофилию; в ней иногда обнаруживают мнофибриллы, чаще только при электронной микроскопии. У детей встречается редко. При локализации под кожей может изъязвляться, кровоточить, растет экзофитно. Чаще локализуется забрюшинно, в органах желудочно-кишечного тракта, обычно содержит аморфные кальцификаты.
Микроскопически представлена полиморфными веретенообразными клетками, складывающимися в нечетко контурироваиные пучки. Содержит многочисленные гигантские клетки с причудливыми гиперхромиыми ядрами и базофильной цитоплазмой 6 последней при окраске фосфорно-вольфрамовокислым гематоксилином выявляются миофибриллы. Митозы атипичные, многочисленные.
Лейомиосаркому следует дифференцировать от доброкачественных гладкомышечных опухолей; решающим признаком служит обилие атипичных митозов. Ее трудно отличить от шванном и нейросарком, только центральное расположение ядер, особенно четко видное на поперечных срезах, более упорядоченный характер аргирофильной стромы помогают при дифференцировке ее от фибро- и липосарком.
Отмечают частую связь опухолевого узла с сосудами, возможен внутрисосудистый рост опухолевых клеток, что позволяет данные случаи трактовать как ангиомиосаркомы. Наблюдают частоту возникновения опухолей в бедренном треугольнике вблизи сосудистого пучка, в приводящем канале, подколенной ямке, медиальной борозде бицепса. Опухоль часто рано и бурно метастазирует гематогенно, иногда по типу подкожной диссеминации с последующими отдаленными гематогенными метастазами.
Строма в отличие от миом представлена неравномерной, рыхлой, сгущающейся вокруг сосудов сетью аргирофильных волокон, сосуды синусоидиого и капиллярного типа, часто с гиалинозом стенок. Мышечные опухолевые клетки складываются в пучки неодинакового размера, располагающиеся беспорядочно, нередко с образованием ритмичных структур ядер. Наряду с этим на обширных участках атипия достигает такой степени, что клетки становятся крайне полиморфными. Нередки многоядериые клетки.
Выяснение тканевой принадлежности злокачественных лейомиом крайне затруднено и возможно лишь тогда, когда удается найти менее катаплазированные участки с ясной мышечной дифференцировкой. Обнаружение в клетках опухоли некоторых тинкториальных особенностей, свойственных миозину и связанных, по мнению Р. Masson (1956), с наличием в цитоплазме особого белкового вещества, неструктурированного в миофибрнллы ацидофилия цитоплазмы, темное окрашивание ее железным гематоксилином, сине-фиолетовое или пурпурное — гематоксилином Мэллори помогает при дифференцировке. Следует принимать во внимание и наличие многоядерных симпластов, характерных для опухолей мышечного происхождения.
Озлокачествление лейомиомы наблюдается редко, однако возможны исключения. На общем фоне типично построенной лейомиомы микроскопически удается выявить множественные очаги выраженного полиморфизма опухолевых клеток с гиперхроматозом ядер, гигантскими клетками, наличием фигур деления ядер и т. д.
При подкожной локализации лейомиосаркомы исходными для этой опухоли могут быть полярная или ангиолейомиома. Отмечают трудности в ряде случаев определения в опухоли наличия злокачественного превращения и отличия от лейомиомы, для чего приходится исследовать многочисленные препараты аз различных участков узла опухоли.
Отмечают, что все гладкомышечные опухоли, в которых возникают очагн с активизацией митотической активности и которые достигают диаметра 0,5 см, должны расцениваться как злокачественные.
Для прогнозирования важно выделять опухоли в соответствии с Grading Так, G1,2,3 могут быть установлены на основании только частоты встречаемости атипичных митозов до 2—40 в поле зрения, следует иметь в виду фрагментарность подобных участков в опухоли G3 характеризуется возрастающей клеточной катаплазией, обилием сосудов с образованием вокруг них клеточных палисадов и структур, напоминающих гемангиоперицитому. G3 отличается также высокой степенью клеточной атипии, утратой пучкового строения опухоли, иногда появлением многочисленных гигантских клеток, что в совокупности дает сходство с гистологическим строением рабдомиосаркомы. Такие опухоли следует дифференцировать от полиморфной рабдомиосаркомы, злокачественной шванномы, фиброзной злокачественной гистноцитомы, фибросаркомы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лейомиома матки
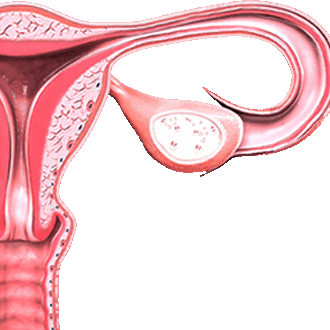
Лейомиома матки – это разновидность доброкачественной опухоли, при которой миоматозные узлы состоят из клеток гладкой мускулатуры (в отличие от фибромы, которая представлена плотной фиброзной тканью).
О заболевании
Лейомиомы тела матки встречаются в 95% случаев, и только в 5% случаев опухоль располагается в шейке матки. Заболевание коварно своими осложнениями. На фоне обильных менструаций повышается риск анемии, которая у некоторых женщина бывает тяжелой. Наличие деформаций матки может негативно влиять на возможность зачатия.
Лейомиома матки может быть также причиной острых состояний. Ножки субсерозных узлов способны перекручиваться, что приводит к клинике «острого живота». В этом случае женщину беспокоят интенсивные боли в нижних отделах брюшной полости, которые приводят к рефлекторному напряжению мышц передней стенки. Может даже повышаться температура тела. Аналогичная картина развивается при ишемии миоматозного узла, когда нарушается его кровоснабжение. Подслизистые узлы могут «рождаться», что проявляется кровянистыми выделениями и интенсивными схваткообразными болями внизу живота.
Риск злокачественной трансформации патологических очагов при лейомиоме матки очень низкий – не превышает 1%. Однако при этой опухоли все равно сохраняется онкологическая настороженность. И в первую очередь это объясняется дисбалансом половых гормонов. Это повышает риск развития атипической гиперплазии эндометрия и, соответственно, рака эндометрия.
Лейомиомы матки по характеру роста миоматозного узла делятся на следующие разновидности:
- интерстициальные – патологическая зона располагается в межмышечном слое;
- субсерозные – узел растет в сторону брюшной полости, при этом может располагаться на широком основании или на тонкой ножке;
- подслизистые – патологическая зона деформирует полость матки;
- интралигаментарные – узлы растут между листками связочного аппарата матки.
Данная классификация в общих чертах описывает характер роста узлов и не всегда дает исчерпывающую информацию относительно того, какая тактика ведения показана пациентке. Поэтому международная организация FIGO ее значительно дополнила, выделив 8 типов лейомиомы матки.
Миоматозные узлы могут быть мелкими или крупными. О последнем варианте говорят, если их диаметр составляет более 5 см.
Симптомы лейомиомы матки
Продолжительное время лейомиома матки может никак себя не проявлять, и женщина, как правило, впервые узнает о наличии заболевания в ходе планового гинекологического осмотра.
Однако у 1/3 пациенток симптомы присутствуют практически с самого начала. Основными проявлениями заболевания являются:
- нарушения менструального цикла – обильные и длительные менструации;
- кровотечения в межменструальные дни;
- боли в нижних отделах живота;
- нарушения функции тазовых органов (мочевого пузыря, прямой кишки) – учащенное мочеиспускание, задержка мочеиспускания, затруднение акта дефекации;
- бесплодие, в развитии которого играют роль узлы, деформирующие полость матки.
Причины лейомиомы матки
На сегодня выделены факторы риска, которые повышают вероятность развития данного заболевания. К ним относятся:
- ранее начало менструации (в 9–10 лет);
- отсутствие родов в анамнезе;
- возраст старше 40 лет;
- ожирение;
- принадлежность к негроидной расе;
- прием фитоэстрогенов и препаратов для менопаузальной гормонотерапии;
- генетические поломки;
- болезненные менструации.
В ходе продолжительных экспериментов обнаружен и фактор защиты. Это адекватная физическая активность, которая снижает риски развития миомы матки.
Считается, что механизм доброкачественной гиперплазии при миоме матки связан со сверхчувствительностью миометрия к половым гормонам. У таких женщин повышено содержание в крови как фракции эстрогенов, так и фракции прогестерона. Одновременно с этим увеличено также количество рецепторов к этим гормонам и отмечается ускоренное превращение тестостерона в эстрогены.
Происходящие изменения повышают активность клеточного деления и увеличивают риск мутаций в клетках. Прогестерон делает ткани мышечного слоя матки более чувствительными к факторам роста и менее чувствительными к факторам запрограммированной клеточной гибели. В итоге рано или поздно происходит формирование миоматозных узлов.
Получить консультацию
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья.
Узнать подробности о заболевании, цены на лечение и записаться на консультацию к специалисту Вы можете по телефону:
Саркома матки
Саркома матки лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
Что такое саркома матки?
Саркома матки - это злокачественная неэпителиальная опухоль, которая развивается из стромы слизистой оболочки, мышечной и соединительной ткани миометрия, незрелых клеточных элементов, мезенхимальных клеток, гетеротопических эмбриональных зачатков.
Саркомы матки составляют 2 – 6 % злокачественных новообразований матки и менее 1 % злокачественных опухолей гениталий.
В течение последних 30 лет заболеваемость саркомой матки не менялась. По статистике, в мире на 1 млн. женщин выявляется 8 случаев заболевания. В США – 17,1 на 1 млн. женского населения.
В структуре сарком женских половых органов преобладают гладкомышечные опухоли – лейомиосаркомы - 41,4%, на долю эндометриальных стромальных сарком приходится 15%.
Методов ранней диагностики сарком нет.
Существующие в настоящее время методы позволяют установить диагноз саркомы до операции лишь у трети больных.
Саркомы матки, так же как и рак эндометрия, чаще встречаются в климактерическом периоде. Средний возраст больных саркомами – 50 лет.
Эндометриальная стромальная саркома (далее ЭСС) составляет 0,2% злокачественных новообразований матки, 10-45% сарком матки. Этиология и патогенез не установлены.
Факторы риска возникновения ЭСС
- позднее наступление менструаций, первых родов;
- наличие в анамнезе спонтанных абортов и многочисленных искусственных абортов;
- поздняя менопауза,
- проведение ЛТ на область малого таза.
У больных ЭСС низкой степени злокачественности миома отмечалась в 58% случаев, нарушения углеводного и жирового обмена выявлены у 32% пациентов.
Пациентки с недифференцированной ЭСС не имеют обычных факторов риска рака эндометрия. 5 - летняя выживаемость при недифференцированной саркоме матки составляет 25-30%. При ЭСС с НЗ – 85,8%. Отдаленные метастазы недифференцированной саркомы матки наблюдаются у 20-30% больных. Метастазы в забрюшинных лимфатических узлах, яичниках, большом сальнике (20%, 19,6%, 22%).
Лейомиосаркома
Лейомиосаркома (далее ЛМС) составляет 1 – 1,3% злокачественных новообразований матки, 25 – 60% сарком матки. В среднем 5 – летняя общая выживаемость колеблется от 18,8 до 65% для всех стадий, от 52 до 85% - для I стадии.
Невысокая частота возникновения ЛМС матки затрудняет проведение рандомизированных исследований, поэтому многие вопросы прогноза и лечения до сих пор остаются открытыми. Методы лечения, направленные только на первичную опухоль не предупреждают гематогенное метастазирование. Прогрессирование наблюдается у 45 – 73 % больных ЛМС матки. Более 80% рецидивов и метастазов локализуются вне малого таза.
Чем саркома отличается от рака тела матки?
Рак тела матки – это злокачественная опухоль, развивающаяся из поверхностного цилиндрического эпителия желез эндометрия, саркома развивается из неэпителиальных элементов стромы, мышечных и соединительнотканных элементов матки.
Как классифицируется саркома?
Согласно морфологической классификации 2003 года саркомы матки подразделяются:
- Эндометриальные стромальные опухоли
1.1 Эндометриальная стромальная саркома – злокачественная опухоль, состоящая из неопластических клеток, напоминающих строму эндометрия в фазе пролиферации;
1.2 Стромальный узелок;
1.3 ЭСС низкой степени злокачественности;
1.4 Недифференцированная саркома матки. - Гладкомышечные опухоли с неопределенным злокачественным потенциалом;
- Лейомиосаркома;
- Смешанные: эндометриальная стромальная саркома и гладкомышечные опухоли;
- Недифференцированная эндометриальная саркома;
- Другие мягкотканые опухоли.
По степени дифференцировки делятся:
- низкодифференцированные (состоят из незрелых клеток, в строме большое количество сосудов). К ним относятся кругло-, веретено-, гиганто-, полиморфноклеточные саркомы и редко встречающиеся лимфосаркома, альвеолярная саркома, меланосаркома;
- умереннодифференцированные;
- высокодифференцированные (состоят из более зрелых клеток. К ним относятся мышечно-клеточные и фибропластические саркомы).
По классификации NCCN 2008 года саркомы тела матки подразделяются:
- эндометриальная стромальная саркома (ESS);
- недифференцированная саркома (HGUD) (включена high-grade эндометриальная стромальная саркома, и группа редких опухолей;
- фиброзная гистиоцитома, рабдомиосаркома, ангиосаркома, липосаркома, хондросаркома и т.д.);
- лейомиосаркома (LMS).
Классификацию сарком тела матки по стадиям 2009 года (FIGO) см. раздел "Алгоритмы диганостики и лечения злокачественных новообразований".
Какие симптомы должны насторожить женщину или когда необходимо внеочередное обращение к гинекологу?
Клинические проявления заболевания зависят от локализации и скорости роста опухоли.
При субмукозных узлах (опухоль растет в полость матки) появляются патологические, межменструальные кровянистые выделения, вплоть до кровотечения, боли внизу живота, бели.
При интрамуральном (внутристеночном) расположении опухоль может протекать бессимптомно, реже отмечаются боли внизу живота, ациклические кровотечения.
При субсерозном росте опухоли (в направлении брюшной полости) клинические проявления могут отмечаться со стороны соседних с маткой органов: при давлении на стенку мочевого пузыря – дизурические расстройства, вплоть до острой задержки мочи, при давлении на стенку прямой кишки – запоры, чувство неполного опорожнения при акте дефекации.
Развитие опухолевого процесса может сопровождаться общими симптомами:
- слабостью;
- потерей массы тела;
- анемией;
- длительным субфебрилитетом.
Могут ли вышеуказанные симптомы встречаться при доброкачественных заболеваниях матки?
Да. Большинство вышеперечисленных симптомов характерны так же для фибромиомы матки, занимающей среди новообразований женских половых органов первое место по частоте.
Лейомиома матки
Лейомиома матки – наиболее часто встречающаяся мезенхимальная доброкачественная опухоль у женщин.
Для большинства больных миомой характерна гиперэстрогения. Опухоль развивается из гладкомышечных клеток, характеризуется увеличением матки, ее деформацией миоматозными узлами, меноррагией и т.д.
Встречается у 25 – 30 % женщин старше 35 лет, у 30 – 35 % женщин, достигших пременопаузального возраста.
Миоматозные узлы могут располагаться субсерозно (под серозным покровом матки), интерстициально (в толще мышцы) и субмукозно (под слизистой оболочкой).
Лейомиома состоит из гладких мышечных волокон, при преобладании соединительной ткани, называется фибромиомой, при атрофии мышечных волокон называется фибромой.
Кровотечения, расстройства менструального цикла наблюдаются чаще при субмукозных и интрамуральных миоматозных узлах.
Обильные и длительные менструации приводят к вторичной анемии. Боли возникают при быстром росте узлов, некрозе, перекруте ножки узла. При "рождении" субмукозного узла боли могут быть схваткообразными. Миомы больших размеров так же могут оказывать давление на тазовые органы, вызывая учащение мочеиспускания и затруднение опорожнения прямой кишки.
Миомы могут протекать и бессимптомно, достигая больших размеров. Такие опухоли выявляются самостоятельно женщиной в виде опухоли внизу живота или врачом при профосмотре.
Диагностика миомы
Для первичной диагностики миомы используются:
- гинекологическое исследование;
- трансвагинальное и трансабдоминальное УЗИ;
- гистероскопия;
- раздельное диагностическое выскабливание;
- в последующем осуществляется диспансерное наблюдение в динамике.
Какие методы диагностики сарком используются?
Установить диагноз саркомы матки на основании анамнеза, клинических данных не представляется возможным. Заподозрить данную опухоль можно на основании cовокупности следующих симптомов:
- рост опухоли в менопаузе;
- кровотечения или кровянистые выделения в пре- и постменопаузе в сочетании с увеличением размеров матки;
- кахексия, анемия не связанная с маточным кровотечением, нарастающая слабость;
- быстрый рост опухоли матки в любом возрасте;
- развитие опухоли в культе шейки матки после надвлагалищной ампутации матки.
Сбор анамнеза и физикальное обследование, включающее осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, бимануальное влагалищное исследование позволяют заподозрить злокачественную опухоль гениталий. Гинекологический осмотр позволяет определить наличие увеличенной бугристой матки, рождающихся фиброматозных узлов, метастатических образований во влагалище.
Ультразвуковое исследование при миоме
Наиболее распространенный метод диагностики и последующего наблюдения при миоме матки, который позволяет определить локализацию, величину узлов, деформацию полости матки, патологические изменения эндометрия.
Роль УЗИ в распознавании сарком ограничена, поскольку четких акустических признаков саркома не имеет. Однако увеличение размеров опухоли при контрольном исследовании (увеличение опухоли за год на величину, соответствующую 5-недельному сроку беременности, считается быстрым ростом опухоли), изменение структуры фиброматозного узла в сочетании с клиническими проявлениями в перименопаузе и в постменопаузе является показанием к хирургическому лечению. УЗИ исследование так же позволяет оценить состояние соседних органов и регионарных лимфоузлов.
Аспирационная биопсия с цитологическим исследованием отделяемого из полости матки, отторгнувшихся фрагментов опухоли.
Гистероскопия при миоме
В зависимости от локализации патологических изменений (в мышце или слизистой оболочке матки) выявляются различной величины и формы опухолевые образования с ровными или прерывистыми неправильными очертаниями. Возможно выполнение прицельной биопсии опухоли.
Гистологическое исследование при миоме
Установить диагноз саркомы на дооперационном этапе удается по данным раздельного диагностического выскабливания слизистой полости матки при субмукозном росте опухоли с прорастанием эндометрия, при стромальной эндометриальной саркоме. При субсерозном и интрамуральном расположении саркоматозных узлов каких-либо изменений эндометрия не выявляется.
Хирургическое лечение миом
При хирургическом лечении миом в репродуктивном возрасте, когда планируется органосохранный объем вмешательства, необходима тщательная ревизия удаленных опухолевых узлов. При выявлении макроскопически отека, некроза, кровоизлияний в узле целесообразно проводить срочное гистологическое исследование.
Это позволит выполнить операцию в адекватном объеме. В морфологической диагностике сарком используется так же иммуногистохимический анализ. Опухолевые клетки ЭСС позитивны к виментину (95,8 %) CD – 10, локально к актину. К маркерам мезенхимальной дифференцировки относят десмин, актин, виментин, коллаген IV типа, цитокератины.
Дополнительные методы исследования выполняются по показаниям с целью уточнения степени распространенности опухолевого процесса:
- общий анализ крови (может определяться ускорение СОЭ, низкое содержание гемоглобина);
- исследование мочевыводящих путей;
- ректосигмоскопия или колоноскопия;
- рентгенография органов грудной клетки;
- КТ органов брюшной полости и таза;
- МРТ таза и т.д.
Окончательный диагноз устанавливают после гистологического исследования удаленной опухоли.
Какие существуют методы лечения сарком?
Основным методом лечения сарком гениталий у женщин является хирургический.
Операция позволяет уточнить стадию заболевания и удалить основную массу опухоли (при распространенном опухолевом процессе). Оптимальным объемом хирургического вмешательства является расширенная экстирпация матки с придатками, при недифференцированной саркоме матки сопровождается оментэктомией, тазовой и забрюшинной ЛАЭ. Подробно лечение см. раздел "Алгоритмы диагностики и лечения злокачественных новообразований".
При ЭСС эффективна ЛТ. Проводится при остаточной опухоли в малом тазу или рецидиве опухоли. При недифференцированной саркоме матки проводится адьювантная ЛТ. При рецидивах и метастазах ЭСС применяют и хирургическое, и лучевое, и цитостатическое лечение. Выбор метода лечения индивидуален.
ЭСС с НЗ содержит большое число стероидных рецепторов и ряд исследователей считают ее гормонозависимой опухолью.
При рецидивах эффективна ЛТ и гормонотерапия прогестагенами.
Лечение больных с лейомиосаркомой и саркомой на фоне малигнизации миоматозного узла всегда начинается с операции. Экстирпация матки с придатками является операцией выбора.
На сегодняшний день наиболее значимым фактором прогноза жизни больных саркомами следует считать гистологическую структуру опухоли. Имеют так же значение локализация опухоли, размер и глубина инвазии в подлежащие ткани, степень злокачественности и дифференцировки опухоли, число митозов и наличие некрозов в опухоли.
Практически у половины больных саркомами в разные сроки после первичного лечения возникают местные рецидивы и отдаленные метастазы. Локализация метастазов сарком зависит от гистологической структуры.
ЛМС чаще метастазируют в легкие, на втором месте по частоте метастазирования лимфатические узлы таза и поясничной области, затем брыжейки тонкой и толстой кишки. Так же метастазы по париетальной и висцеральной брюшине. Реже наблюдается поражение большого сальника.
Для ЛМС и ЭСС характерно относительно медленное прогрессирование процесса.
Нередко сроки появления метастазов опухоли исчисляются годами. Наличие солитарных или единичных метастазов ЛМС без признаков диссеминации по брюшине является показанием к их хирургическому удалению.
Лекарственное лечение и ЛТ применяются при лечении метастазов и рецидивов ЭСС. Иногда комбинируют оба вида лечения.
Злокачественная лейомиома. Озлокачествление лейомиомы.
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава РФ;
ГБОУ ДПО "Российская медицинская академия последипломного образования", Москва
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
"Доброкачественная метастазирующая лейомиома" тела матки
Журнал: Архив патологии. 2012;74(6): 38‑42
Андреева Ю.Ю., Данилова Н.В., Шикеева А.А., Кекеева Т.В., Завалишина Л.Э., Франк Г.А. "Доброкачественная метастазирующая лейомиома" тела матки. Архив патологии. 2012;74(6):38‑42.
Andreeva YuYu, Danilova NV, Shikeeva AA, Kekeeva TV, Zavalishina LÉ, Frank GA. Benign metastatic leiomyoma of the corpus uteri. Arkhiv Patologii. 2012;74(6):38‑42. (In Russ.).
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
"Доброкачественная метастазирующая лейомиома" (ДМЛ, код ICD.0-8898/1) - редкий феномен, характеризующийся множественными доброкачественными гладкомышечными опухолями (метастазами) в органах и тканях у пациенток с лейомиомой матки при отсутствии данных за другой опухолевый процесс. Подобную опухоль необходимо дифференцировать от лейомиосаркомы, причем следует учитывать, что морфологические критерии не всегда эффективны. Более точным способом, позволяющим достоверно дифференцировать лейомиому от лейомиосаркомы, является молекулярно-генетическое исследование. Генетическое исследование применяется для определения потери гетерозиготности и микросателлитной нестабильности, характерных только для лейомиосаркомы. Представлен клинический пример ДМЛ у пациентки 54 лет с лейомиомой матки и метастазом в тазовом лимфатическом узле. Молекулярно-генетическое исследование проводилось на материале первичной лейомиомы матки, морфологически неизмененной ткани яичника и метастазе в лимфатическом узле для определения единого происхождения опухоли в матке и лимфатическом узле и выявления доброкачественной или злокачественной природы этих новообразований. Несмотря на то что термин ДМЛ широко принят в мировой литературе, ни данные опухоли, ни метастазы не имели морфологических или генетических признаков злокачественности, поэтому мы считаем, что термин "системный лейомиоматоз" лучше отражает суть данного процесса.
ГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава РФ;
ГБОУ ДПО "Российская медицинская академия последипломного образования", Москва
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Лейомиома тела матки — самая распространенная гинекологическая опухоль у женщин репродуктивного возраста [1]. Доброкачественная метастазирующая лейомиома (ДМЛ, код ICD.0-8898/1) — редкий феномен, характеризующийся множественными доброкачественными лейомиомами (метастазами) в органах и тканях у пациенток, имеющих лейомиому матки, при отсутствии данных о другом опухолевом процессе [2].
Чаще всего очаги ДМЛ встречаются в легких [3], но могут выявляться в забрюшинном пространстве, полости малого таза [4], сердце [5], нижней полой вене [6], лимфатических узлах забрюшинного пространства и малого таза [7], большом сальнике, правом предсердии, мышцах конечностей [8], черепе [9], молочной железе [10]. Однако множественные очаги опухоли в лимфатических узлах при ДМЛ встречаются редко и в литературе имеются крайне скудные данные о прогнозе и лечении больных с метастазами ДМЛ в лимфатических узлах.
ДМЛ характеризуется низкой митотической активностью, отсутствием ядерного полиморфизма и признаков инвазии, за исключением множественных отдаленных поражений (метастазов), длительным течением. Метастазы представляют собой активно растущие опухоли, чаще всего возникающие у женщин репродуктивного возраста, имеющих лейомиому матки на момент их обнаружения или в анамнезе [11]. Поскольку локализация данных опухолей различна, то терминология варьирует от диссеминированного перитонеального лейомиоматоза (при лейомиомах в брюшной полости и полости малого таза) до интравенозного лейомиоматоза (при лейомиомах в полостях сосудов и сердца).
Факторы риска определены нечетко, однако имеются данные о том, что большинство пациенток до обнаружения метастазов подвергались диагностическому выскабливанию, миомэктомии или гистерэктомии, которые рассматриваются как предрасполагающий фактор к развитию ДМЛ. Другим подтверждением теории метастазирования является то, что лейомиома легких встречается крайне редко и, кроме того, при ДМЛ в легких опухоли имеют рецепторы эстрогенов и регрессируют под воздействием лечения [2].
Патогенез ДМЛ остается неясным, однако предполагается, что он сходен с патогенезом эндометриоза [12]. Данное заболевание часто возникает у женщин репродуктивного возраста и тесно связано с гормональной стимуляцией. Поэтому такие звенья патогенеза эндометриоза, как гормональная стимуляция, лимфогенное и гематогенное распространение, целомическая метаплазия и интраперитонеальная имплантация, можно применить для объяснения ДМЛ.
Гормональная стимуляция. В части случаев ДМЛ в опухоли были обнаружены рецепторы не только эстрогенов, но и прогестерона, и лютеинизирующего гормона [11, 13, 14]. Отмечается увеличение распространенности ДМЛ при воздействии эстрогенов или повышенном эндогенном уровне эстрогенов [15, 16], во время беременности описан регресс опухоли [17]. Регрессия опухоли наблюдалась после оофорэктомии [11], в менопаузе [18], при использовании агонистов гонадотропин- и рилизинг-гормона [19], мегестрола [20], ингибиторов ароматазы Р-450 и селективных модуляторов эстрогенов [11]. Однако в редких случаях ДМЛ возникала у женщин репродуктивного возраста, не получавших заместительную гормональную терапию [21]. Таким образом, теория гормональной стимуляции не может объяснить все случаи возникновения ДМЛ.
Лимфогенное и гематогенное распространение. Возможно, фрагменты лейомиомы попадают в венозное русло или лимфатические сосуды в процессе хирургической операции и в дальнейшем распространяются в другие органы [7, 22].
Целомическая метаплазия. Диссеминированный перитонеальный лейомиоматоз может быть представлен поражениями, происходящими из субмезотелиальной мезенхимы [4]. Вероятно, данные опухоли возникают из субцеломических мезенхимальных клеток, которые дифференцируются в миобласты под влиянием гормональных факторов [22].
Клиническая характеристика
ДМЛ часто протекает бессимптомно и обнаруживается случайно при лапаротомии, лапароскопии, ультразвуковом исследовании или рентгенографии. Пациентки редко предъявляют жалобы на дискомфорт в области живота, кровянистые выделения из половых путей, некоторые самостоятельно обнаруживают объемные образования в брюшной полости. Большинство пациенток имеют в анамнезе лейомиому матки, миомэктомию или гистерэктомию по поводу лейомиомы [3, 22].
Гистологическая характеристика
Для подтверждения диагноза ДМЛ необходима биопсия. Размер узлов, как правило, варьирует от 0,5 до 50 мм. Опухоли плотные, четко отграничены от окружающих тканей, на разрезе белесоватого цвета, волокнистого вида [14]. Гистологически ДМЛ представляет собой типичную или клеточную лейомиому, для которой характерна пролиферация гладкомышечных клеток, иногда с единичными митозами, минимальной ядерной атипией, отсутствием очагов некроза [23]. В составе узлов могут встречаться фибробласты, децидуальные клетки и редко — эндометриальные стромальные клетки [15].
При иммуногистохимическом исследовании выявляются маркеры гладкомышечных клеток — десмин, гладкомышечный актин, мышечно-специфический актин, кальдесмон, а также виментин, рецепторы эстрогенов, прогестерона и лютеинизирующего гормона [13, 24].
Рецидивирование и малигнизация
ДМЛ является доброкачественной опухолью, характеризуется медленным ростом, однако имеет потенциальный риск рецидива и озлокачествления. Иногда рецидив возникает в менопаузе, несмотря на предыдущую оофорэктомию [15]. Описаны случаи выполнения повторной лапаротомии по поводу рецидива ДМЛ [25]. Во всех случаях ДМЛ прогрессирование или рецидив в течение 1-го года должен рассматриваться как возможный признак малигнизации [15]. При адекватном лечении ДМЛ имеет благоприятный прогноз [26].
Дифференциальная диагностика
ДМЛ необходимо дифференцировать от лейомиосаркомы — крайне агрессивной опухоли, которая составляет до 5% всех злокачественных новообразований матки [27—29]. Основными критериями для постановки диагноза лейомиосаркомы матки является высокая митотическая активность (не менее 6 митозов в 10 полях зрения), наличие очагов некроза, клеточная атипия. Однако эти показатели не являются достаточно специфичными [30]. Поэтому морфологические критерии не всегда эффективны при дифференциальной диагностике ДМЛ с лейомиосаркомой. Некроз и клеточная атипия нередко наблюдаются в доброкачественных опухолях, а подсчет фигур митоза требует тщательной вырезки материала и высокого качества препаратов. Кроме того, возникают сложности в оценке характера процесса при «пограничном» числе митозов (4—5 в 10 полях зрения). Оценка пролиферативной активности опухоли (индекс Ki-67) может служить лишь вспомогательным методом. Более точным способом, позволяющим достоверно дифференцировать лейомиому и лейомиосаркому, является молекулярно-генетическое исследование.
Лейомиосаркому относят к опухолям, имеющим многочисленные хромосомные аномалии [31]. Для данного типа сарком характерны аллельные делеции — потеря гетерозиготности и микросателлитная нестабильность локусов 3p, 9p, 10p, 10q [32—38], которые могут являться как чувствительным маркером опухолевых клеток, так и внешним проявлением дестабилизации генома, характерного для опухолевых клеток. В хромосомных районах 3p, 9p, 10p, 10q располагаются гены-супрессоры опухолевого роста FHIT, PTEN, P16 ink4a . Возможно, нестабильность микросателлитов этих регионов приводит к инактивации этих генов. Описанные повреждения в лейомиоме не встречаются [39].
В отделении патологической анатомии МНИОИ им. П.А. Герцена разработана молекулярно-генетическая тест-система для дифференциальной диагностики пролиферирующей клеточной лейомиомы и лейомиосаркомы матки, которая использовалась в качестве дополнительного метода [40]. Тест-система состоит из 6 высокополиморфных микросателлитных маркеров: D10S1146, D10S1213, D10S218, D10S24, D9S942, D3S1295, расположенных в хромосомных районах 10q22.1, 10q26.13, 10q22.1, 10p13, 9p21.3, 3p14.3 соответственно. Специфичность и чувствительность разработанной тест-системы составляет 96 и 95% соответственно.
Для генетического исследования используют образцы опухолевой и нормальной тканей пациента. На гистологическом препарате опухолевые клетки должны составлять более 70% всех клеток. При отсутствии гистологического препарата нормальной ткани используют образец периферической венозной крови пациента. ДНК для анализа выделяют из материала, фиксированного в формалине с последующей парафинизацией, с помощью коммерческого набора ДНК-Сорб (В/АМ) («ИнтерЛабСервис», Россия) и/или набора QIAamp DNA FFPE Tissue kit («QIAGEN», Германия) в соответствии с инструкциями производителя. Идентификацию потери гетерозиготности и/или микросателлитной нестабильности проводят путем микросателлитного анализа, представляющего собой полимеразную цепную реакцию с соответствующими праймерами.
Потерю гетерозиготности оценивают как ослабление или отсутствие полосы одного из аллелей на электрофореграмме относительно нормальной ткани/периферической венозной крови пациента. Микросателлитная нестабильность устанавливается как появление дополнительной полосы на электрофореграмме относительно нормальной ткани/периферической венозной крови пациента.
Описанная методика позволяет значительно повысить точность диагностики высокодифференцированной лейомиосаркомы матки. Однако до настоящего времени мы применяли данный метод в сомнительных случаях, при наличии клеточной лейомиомы с «пограничным» числом митозов (4—5 в 10 полях зрения). Особый интерес представляло исследование метастазирующей лейомиомы без морфологических признаков малигнизации.
Приводим наше наблюдение.
Пациентка 54 лет, поступила в МНИОИ им. П.А. Герцена 30 января 2012 г. с диагнозом: лейомиома тела матки, двусторонняя цистаденома яичников. При клиническом обследовании патологических очагов в других органах, в том числе легких, не обнаружено. В анамнезе — диагностическое выскабливание полости матки по поводу простой гиперплазии эндометрия 2 года назад. Выполнено хирургическое лечение в объеме лапароскопической экстирпации матки, двусторонней аднексэктомии с удалением уплотненного увеличенного лимфатического узла тазовой клетчатки.
При макроскопическом исследовании операционного материала матка увеличена до 27×26×20 см, полость матки щелевидная, деформирована извне, эндометрий сероватого цвета. Миометрий серо-розовый с субсерозным узлом, диаметром 25 см. На разрезе — опухоль белесовато-розового цвета, волокнистого вида с крупными очагами некроза, миксоматоза, кровоизлияний. В миометрии имеются другие опухолевые узлы размером 1—15 см, один из которых с полостью диаметром 10 см. Узлы белесоватого цвета, волокнистого вида. Лимфатический узел диаметром 1,5 см, плотный.
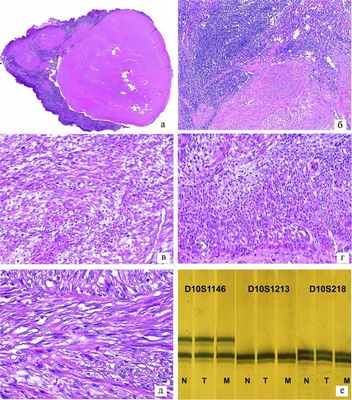
Гистологическое исследование: в матке — множественные узлы пролиферирующей лейомиомы, некоторые с обширными участками некроза, до 4—5 митозов в 10 полях зрения (см. рисунок, г, д). Рисунок 1. Доброкачественная метастазирующая лейомиома матки: гистологическое и молекулярно-генетическое исследование. а — очаг опухоли в лимфатическом узле. ×20; б — тот же очаг. ×100; в — тот же очаг в лимфатическом узле, аналогичный по строению первичной опухоли матки. ×400; г — клеточная лейомиома первичной опухоли тела матки. ×400; д — первичная опухоль с большим количеством клеток, без признаков атипии. ×630; е — электрофореграмма без изменений в локусах D10S1146, D10S1213 и D10S218 в нормальной и опухолевой тканях и метастазе, микросателлитный анализ на примере локусов D10S1146 (10q22.1), D10S1213 (10q26.13), D10S218 (10q22.1). а—д — окраска гематоксилином и эозином. Эндометрий фазы секреции. В одном исследованном тазовом лимфатическом узле обнаружен очаг опухоли аналогичного строения (см. рисунок, а—в). В шейке матки — наботовы кисты. Маточные трубы обычного строения. В яичниках — атретические тела, фолликулярные и простые серозные кисты. Для заключения о потенциале злокачественности опухоли нами было предпринято молекулярно-генетическое исследование.
По данным молекулярно-генетического исследования материала парафиновых блоков опухоли, смежной нормальной ткани яичника и метастаза в лимфатическом узле, в локусах D3S1295, D9S942, D10S1213, D10S1146, D10S24, D10S218 потери гетерозиготности и микросателлитной нестабильности, характерных для лейомиосаркомы матки, не обнаружено (см. рисунок, е).
Таким образом, с учетом данных морфологического и молекулярно-генетического исследований диагностирована метастазирующая лейомиома (код ICD.0-8898/1).
ДМЛ — редкая опухоль с неясным патогенезом. Несмотря на доброкачественные гистологические характеристики, ДМЛ имеет потенциальный риск рецидивирования и малигнизации. В настоящее время наиболее достоверным методом, позволяющим провести дифференциальную диагностику между ДМЛ и лейомиосаркомой матки, является генетическое исследование потери гетерозиготности и микросателлитной нестабильности в опухоли.
В приведенном клиническом наблюдении молекулярно-генетическое исследование проводилось не только на опухолевом материале и морфологически неизмененной ткани яичника, но и на материале, полученном из метастаза в лимфатическом узле, для определения единого происхождения опухоли в матке и лимфатическом узле и выявления доброкачественной или злокачественной природы этих новообразований.
Несмотря на то что термин ДМЛ широко принят в мировой литературе, ни данные опухоли, ни метастазы не имели морфологических или генетических признаков злокачественности, поэтому мы считаем, что термин «системный лейомиоматоз» лучше отражает суть процесса.
Читайте также:
