Антитела при вич к щитовидной
Проведение тестирования на вирус иммунодефицита человека показывает, инфицирован ли пациент. При проведении исследования в сыворотке крови ищут антитела к ВИЧ. При проникновении ретровируса внутрь организма иммунной системой начинают вырабатываться антитела и белки-антигены. Для здоровых, не инфицированных людей наличие таких антител в сыворотке крови нехарактерно. Однако они могут появляться у новорожденных младенцев, мать которых заражена вирусом иммунодефицита. У таких детей до полуторагодовалого возраста могут сохраняться антитела, которые попали через гематоплацентарный барьер от матери к ребенку.
Характеристика заболевания
ВИЧ-инфекция – патологическое состояние, представляющее собой заболевание, возбудитель которого длительное время развивается в организме человека. На данный момент не существует эффективных средств борьбы с болезнью. Кроме невозможности вылечить заболевание после инфицирования, на данный момент можно только предотвратить заражение за счет ведения профилактических мероприятий. После попадания возбудителя патологии в кровь начинается быстрое разрушение клеток иммунной защиты – лейкоцитов. Инфекция характеризуется быстрым распространением и снижением защиты организма к внешним воздействиям. Микроорганизмы способны проникать в полость тела через клеточные мембраны и пустые пространства межклеточной жидкости, препятствуя выполнению ее функций. В результате этого человеческое тело со временем практически полностью теряет барьерную функцию, что полностью исключает возможность победы над инфекционным заболеванием. Процесс заражения и снижения иммунитета очень длительный. Вирус способен разрушать тело человека более десяти лет. При этом в его крови появляются антитела к ВИЧ 1 и 2 группы.
Пути передачи
Источником заражения является человек. Однако носителями болезни также могут быть высшие приматы. Особо высокое количество микроорганизмов обитает во влажных средах организма: крови, сперме и серозном секрете частей матки. Поэтому пути передачи заболевания разнообразны.
Вирус иммунодефицита человека чаще всего передается половым путем, особенно если не использовать средства индивидуальной защиты. При этом микроорганизм проникает внутрь тела здорового человека через трещинки и царапины в слизистых оболочках половых органов. Кроме СПИДа, незащищенные половые контакты приводят к появлению различных ЗППП (заболеваний, передающихся половым путем).
Инфицирование возможно при прямом контакте с кровью больного. Так, передача возможна при использовании личных средств гигиены: бритв и ножниц, медицинского инструментария, шприцов. Кроме того, передача может произойти при инъекциях наркотиков в вену и в косметических салонах при использовании нестерильных инструментов.
Возможна передача от больной ВИЧ-инфекцией матери ребенку. При этом во время вынашивания передача маловероятна из-за гематоплацентарного барьера. Заражение чаще всего происходит в момент рождения.
Развитие заболевания
Течение заболевания продолжительное. В зависимости от количества микроорганизмов в теле человека и пораженных Т-лимфоцитов признаки могут быть не обнаружены длительный период. Даже если иммунная система выделяет антитела к ВИЧ, то симптоматика заболевания чаще всего также не проявляется. Фактически развитие заболевания разделяют на такие периоды.
- Инкубационный период представляет собой промежуток времени, который начинается со времени инфицирования и заканчивается, когда в сыворотке крови появляются антитела и антигены к ВИЧ.
- Второй период характеризуется первичной симптоматикой. Он начинается после появления антигенов к ВИЧ и характеризуется очень высокой скоростью размножения вирусов в сыворотке крови. Количество частиц, отвечающих на инфекцию, сильно возрастает. В этот период можно диагностировать патологическое состояние. У большинства больных при этом не проявляются симптомы заболевания. Однако может проявляться гипертермия, увеличение размеров лимфоузлов, сильные боли в разных участках головы, слабость мышц. Возможны болевые ощущения при движении и общее недомогание.
- Третьему периоду присуще отсутствие симптоматики. Течение очень длительное. В этот период постепенно наносится огромный вред организму, снижается активность лимфоцитов Т-группы. Количество патогенных микроорганизмов в полостях тела и сыворотке крови значительно возрастает. Также характеризуется период появлением проявлений сопутствующих заболеваний, передающихся половым путем. Могут возникать новообразования различной природы.
- Последняя стадия заболевания – синдром приобретенного иммунодефицита. Этот период сопровождается значительным количеством вторичных заболеваний, передающихся половым путем, диагностирование которых не является затруднительным. Со временем начинают поражаться остальные системы организма: дыхательная, нервная, гуморальная. Это приводит к летальному исходу.
Что делать, если антитела были обнаружены?
После проведенной диагностики при обнаружении антител и антигенов к вирусу иммунодефицита человека необходимо следить за общим состоянием здоровья человека. Нужно регулярно проводить диагностические мероприятия, направленные на установление сопутствующих заболеваний. На данный момент фармакологами не были найдены лекарства против вируса иммунодефицита, поэтому необходимо поддерживать состояние иммунной системы человека на достаточном уровне. При этом нужно обследоваться на предмет заболеваний, что передаются половым путем, проявления которых очень четко выражены на фоне иммунной депрессии организма.
Показания к проведению диагностических мероприятий
Проведение обследования на предмет инфицирования вирусом иммунодефицита может осуществлять несколькими различными способами. При этом для уточнения диагноза может потребоваться пройти поэтапно несколько исследований. Обычно первым исследованием является иммуноферментный анализ содержимого сыворотки крови. Проводится исследование для обнаружения экзоферментов, которые выделяются вирусом. При неопределенном результате или в случае неточности после получения результатов пациент может быть направлен на дополнительное обследование. Сдача анализов на антитела к ВИЧ требуется в следующих ситуациях:
- Во время планирования беременности.
- При беременности.
- После полового контакта с малоизвестным партнером.
- При появлении у пациента беспричинной лихорадки.
- Если вес обследуемого резко снизился.
- При воспалительных процессах лимфатических узлов в нескольких областях тела.
- При подготовке к оперативному вмешательству.
Относительно детей или новорожденных, мать которых инфицирована, то диагностирование, что проводится для них, не является точным. Отсутствие антител у детей не может точно доказывать отсутствие заражения. Поэтому потребуется регулярно проводить диагностические мероприятия в период роста.
СПИД-индикаторные заболевания
С учетом сниженного иммунного ответа на другие заболевания Всемирной Организацией Охраны Здоровья некоторые заболевания были определены как СПИД-маркерные или СПИД-индикаторные. Болезни разбивают на две группы. К первой относят патологии, которые появляются только при тяжелом иммунодефиците (уровень Т-лимфоцитов в крови не выше 200). Ко второй группе принадлежат заболевания, которые могут возникнуть без синдрома повышенного иммунодефицита.
К первой группе принадлежат:
- Грибковые заболевания внутренних органов: кандидоз, криптококкоз.
- Инфекции, вызванные вирусом простого герпеса, с появлением язв, которые длительное время не заживают.
- Саркома Капоши у взрослых и молодых пациентов
- Лимфома головного мозга у больных до 60 лет.
- Токсоплазмоз ГМ у детей.
- Пневмоцистная пневмония.
Вторая группа включает:
- Инфекции, спровоцированные бактериальными микробами, у детей младше 13 лет при их частом появлении.
- Кокцидиоз, сопряженный с микозом.
- Микозы.
- Сальмонеллезная септицемия.
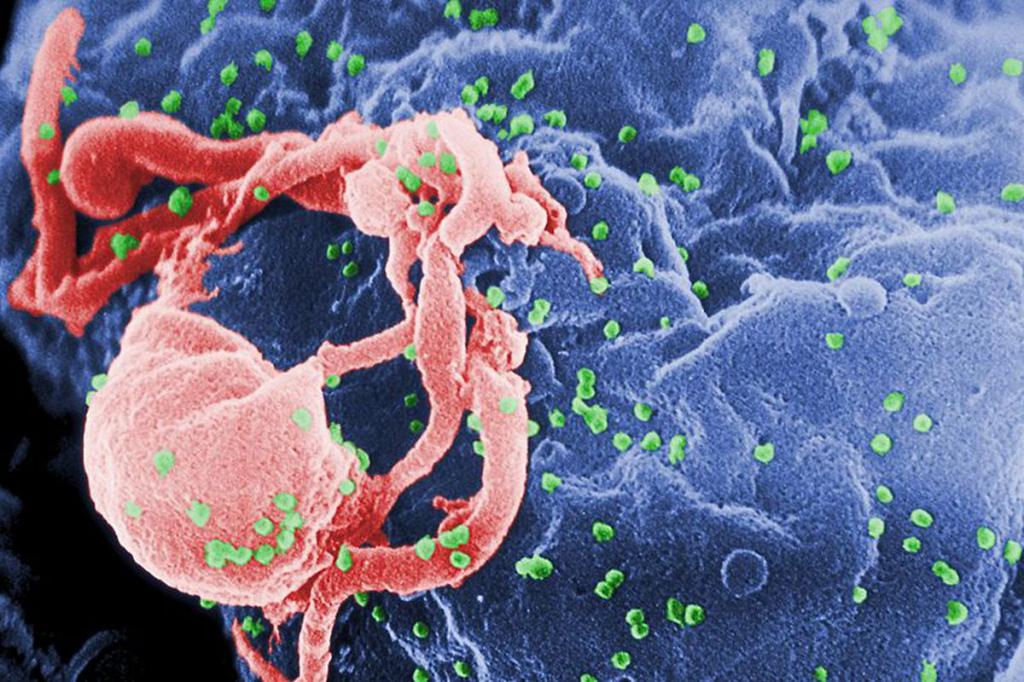
Антитела к ВИЧ 1 и ВИЧ 2
Такое явление может возникнуть после заражения. Когда обнаруживаются антитела к ВИЧ, что это значит? Обычно белки антигенной природы появляются после заражения. В нормальном состоянии белки-антигены в сыворотке крови не обнаруживаются. Определение антител к ВИЧ является основным способом диагностики заболевания. Для ее проведения используют иммуноферментный анализ, который чувствительный практически ко всем белкам. Поиск индикаторных белков к ВИЧ происходит на 4-й неделе после вероятного заражения у большинства реципиентов. Кроме того, наличие антител к ВИЧ может обнаруживаться у 10 % обследуемых через 6 месяцев после заражения. На последней стадии заболевания количество антител в крови практически нулевое.
Результат
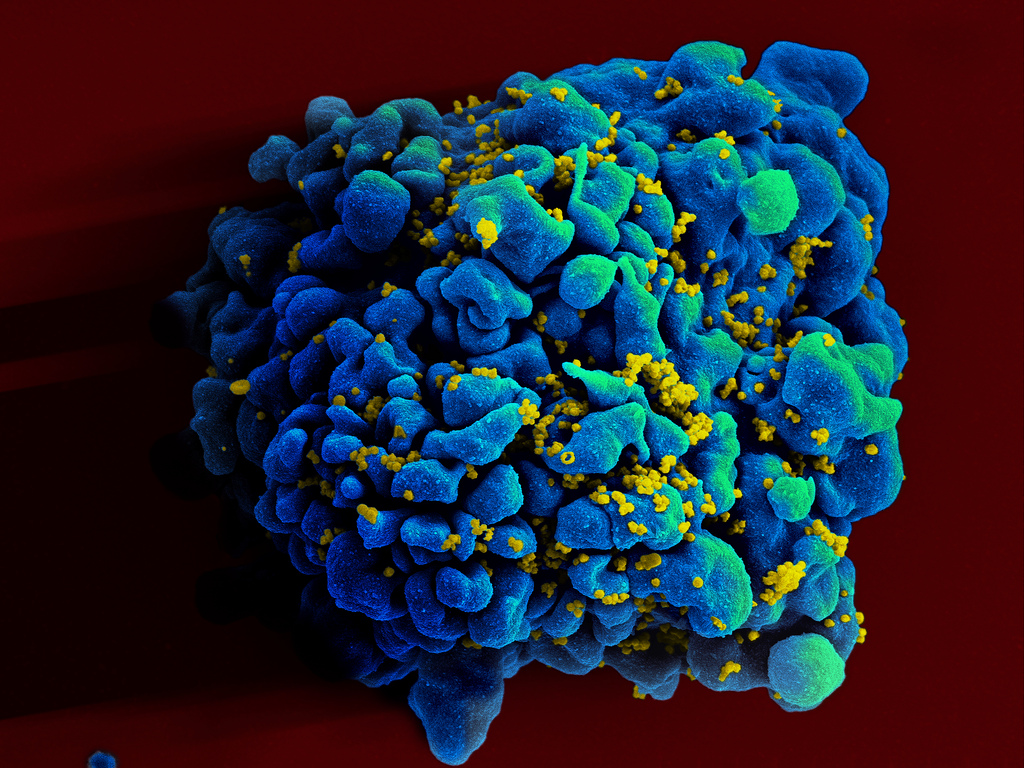
Обследование крови на антитела к ВИЧ проводится при помощи качественных реакций. Поэтому результат определяется как положительный или отрицательный. При негативном результате считается, что антитела к вирусу иммунодефицита в крови пациента отсутствуют. Такой результат анализа на антитела к вирусу ВИЧ выдается на руки сразу после получения.
При получении положительного результата нужно провести дополнительные обследования. На том же материале проводятся дополнительные два анализа. Это происходит для исключения ложных результатов.
Дальнейшие действия
При положительном результате необходимо будет отправить данные о пациенте и пробы крови в региональный центр здравоохранения. Там подтверждается положительный результат либо производится уточнение недостоверного. При этих обстоятельствах ответ на обследование выдается региональным центром синдрома приобретенного иммунодефицита.
Дополнительные обследования
Если антитела к ВИЧ не обнаружены при проведении метода иммуноферментного анализа, могут быть назначены дополнительные обследования на антигены определенной категории. Обследования на наличие белков, противостоящих ВИЧ, включают:
- Диагностирование на р24.
- Диагностирование методом полимеразной реакции.
Анализ на р24
Белок представляет собой протеин стенки генетического материала вируса. Его наличие в крови является свидетельством начала деления вирусов. Может появиться примерно через 2 недели после заражения. Проверка при помощи иммуноферментного анализа даст результат в период с месяца до двух. По прошествии 8 недель антиген полностью исчезает из крови. Второе образование антигена р24 приходится на последние этапы развития заболевания, перед формированием синдрома иммунодефицита человека.
Анализ на полимеразу
Реакция проводится для уточнения неточных результатов предварительных обследований или для раннего обнаружения заражения. Кроме того, можно проводить его для обнаружения текущей стадии заболевания. Методика позволяет находить генный материал вируса в сыворотке крови через 2 недели после заражения. При этом можно получить качественный результат:
- Положительное значение обследования показывает наличие рибонуклеиновой кислоты, специфической для вируса иммунодефицита человека, в крови.
- Отрицательный итог свидетельствует об отсутствии генного материала в сыворотке крови реципиента.
Таким образом, реально проверить наличие заражения у больного. Кроме качественной реакции, выявление антител к ВИЧ осуществляется при помощи количественной. Это используется для определения количества Т-лимфоцитов в крови, затем можно сделать прогноз относительно дальнейшего развития болезни и состояния пациента. Снижение количества клеток напрямую связано с увеличением количества патогенных микроорганизмов.
Гипотиреоз
Гипотиреоз наблюдают сравнительно часто — приблизительно у 2-3% всего населения, он обусловлен уменьшением содержания в циркулирующей крови одного или обоих гормонов щитовидной железы. Гипотиреоз может быть связан с первичным поражением непосредственно щитовидной железы (первичный гипотиреоз), нарушением регуляции её функции гипоталамо-гипофизарной системой (третичный и вторичный гипотиреоз), а также вследствие нарушения транспорта, метаболизма и действия гормонов (периферический). В подавляющем большинстве случаев (90-95%) гипотиреоз обусловлен патологическим процессом в щитовидной железе, нарушающим продукцию гормонов (первичный гипотиреоз).
Определение сT4 и тиреотропного гормон в сыворотке крови — наилучшая комбинация тестов для диагностики гипотиреоза. При гипотиреозе базальный уровень тиреотропного гормон повышен вследствие первичного поражения щитовидной железы (первичный гипотиреоз) и понижен при первичной недостаточности гипофиза (вторичный, центральный гипотиреоз) или гипоталамуса (третичный, центрально-гипоталамический гипотиреоз), при которых нарушения функции щитовидной железы вторичны.
Характерная особенность вторичного гипотиреоза — низкая концентрация в крови тиреотропного гормон на фоне сниженных концентраций сT4, T4, T3. При третичном гипотиреозе концентрации тиреотропного гормон, сT4, T4, T3 в крови также снижены. Содержание в крови ТРГ при третичном гипотиреозе, в отличие от вторичного, снижено.
Повышение концентрации тиреотропного гормон на фоне нормального содержания гормонов щитовидной железы (сT3, сT4) в крови называют субклиническим гипотиреозом. Выделяют 3 степени (стадии) развития субклинического гипотиреоза.
- I степень — минимальная тиреоидная недостаточность (субклинический гипотиреоз, гипотиреоз с тиреотропным гормоном на верхней границе нормы, компенсированный вариант субклинического гипотиреоза) — самая лёгкая форма, для которой характерны отсутствие симптомов у пациентов, концентрация тиреотропного гормона в пределах референтных величин (2-5 мМЕ/л) или несколько повышенная (но менее 6 мМЕ/л) и гиперэргическая реакция тиреотропного гормона на стимуляцию ТРГ.
- II степень подобна I, но повышение базальной концентрации тиреотропного гормона в крови прогрессирует (6-12 мМЕ/л); вероятность клинической манифестации гипотиреоза значительно возрастает.
- III степень характеризуется значениями концентрации тиреотропного гормона в крови выше 12 мМЕ/л, появлением стёртой клинической картины гипотиреоза, которая прогрессирует параллельно гиперпродукции тиреотропного гормона, а также высоким риском развития явного гипотиреоза, как правило, в течение ближайших 10-20 лет.
Гипертиреоз (тиреотоксикоз)
Гипертиреоз развивается при избыточном образовании гормонов щитовидной железы (T3 и T4). В настоящее время выделяют три формы тиреотоксикоза: диффузный токсический зоб (болезнь Грейвса, базедова болезнь), токсический узловой зоб и автономную аденому щитовидной железы.
При диффузном токсическом зобе у больных, не получавших антитиреоидного лечения, в крови повышена концентрация T4, сT4, тиреоглобулина, снижена концентрация Гипертиреоз. У этих больных тест с ТРГ отрицательный, что свидетельствует о резком угнетении тиреотропной функции и отсутствии резервов Гипертиреоз при этом заболевании.
При (много)узловом токсическом зобе T3-токсикоз наблюдают у 50% больных (при диффузном токсическом зобе — у 15%), поэтому в крови часто выявляют повышение концентрации T3. Одной из причин нарушения соотношения T4 и T3 в щитовидной железе может быть недостаток йода, ведущий к компенсаторному синтезу наиболее активного гормона. Другой причиной изолированного повышения уровня T3 может быть ускоренный переход T4 в T3 в периферических тканях. Почти у всех больных с выраженной клинической картиной заболевания выявляют повышение концентрации сT4.
Тиреотропинсекретирующие опухоли гипофиза
ТТГ-продуцирующая аденома гипофиза развивается очень редко. Аденома гипофиза секретирует избыточные количества тиреотропного гормона, который стимулирует щитовидную железу. В результате в крови повышается концентрация сT4, T4, T3 и развиваются симптомы гипертиреоза. Основные признаки тиреотропинсекретирующей опухоли гипофиза — резкое повышение концентрации тиреотропного гормона в крови (в 50-100 раз и более по сравнению с нормой) и отсутствие реакции тиреотропного гормона на ТРГ.
Тиреоидиты
Подострый тиреоидит де Кервена, или гранулематозный тиреоидит, — одна из наиболее распространённых форм заболевания. Этиологические факторы тиреоидита де Кервена включают вирусы кори, инфекционного паротита, аденовирусной инфекции, гриппа. Тиреоидит развивается через 3-6 нед после перенесённых вирусных инфекций.
В течении подострого тиреоидита выделяют 4 стадии.
- Стадия I — тиреотоксическая: воспалительная деструкция фолликулярных клеток щитовидной железы приводит к высвобождению избыточного количества T4 и T3 в кровь, что может вызвать тиреотоксикоз.
- Стадия II — промежуточный период (1-2 нед) эутиреоза, наступает после выведения избыточного количества T4 из организма.
- Стадия III — гипотиреоидная, развивается в тяжёлых случаях заболевания.
- Стадия IV — восстановительная (эутиреоидное состояние).
При подостром тиреодите концентрация в крови тиреотропного гормона в норме или снижена, T4 и T3 — высокие или выше нормы, затем они нормализуются. Изменение уровня тиреоидных гормонов в крови при тиреоидите де Кервена зависит от стадии заболевания. Так, в I стадии (длительность 1-1,5 мес) наблюдается повышение концентрации сT4 (T4 и T3) в крови и нормальный или сниженный уровень тиреотропного гормона. Клинически наблюдают симптомы тиреотоксикоза. Эти изменения обусловлены избыточным поступлением в кровь ранее синтезированных гормонов и тиреоглобулина, вследствие повышенной проницаемости сосудов на фоне воспаления. Через 4-5 нед нарушение синтеза гормонов в воспалённой щитовидной железе ведёт к нормализации их содержания в крови, а затем и к понижению (3-4 мес заболевания). Снижение образования T4 и T3 активирует выброс тиреотропного гормона гипофизом, его концентрация в крови увеличивается и может быть повышенной 4-6 мес. Приблизительно к концу 10-го месяца с момента заболевания концентрации тиреотропного гормона, T4 и T3 в крови нормализуются. Содержание тиреоглобулина в крови повышено в течение длительного времени. Заболевание склонно к рецидивам, что требует длительного контроля за функцией щитовидной железы. При развитии рецидива концентрация тиреоглобулина в крови вновь повышается.
Хронический лимфоцитарный тиреоидит (тиреоидит Хашимото) — заболевание, обусловленное генетическим дефектом иммунокомпетентных клеток (Т-супрессоров), приводящим к инфильтрации щитовидной железы макрофагами, лимфоцитами, плазматическими клетками. В результате этих процессов в щитовидной железе происходит образование антител к тиреоглобулину, тиреопероксидазе, рецепторам тиреотропному гормону. Взаимодействие антител с антигеном ведёт к появлению иммунных комплексов, выделению биологически активных веществ, что в конечном счёте вызывает деструктивные изменения в тиреоцитах и ведёт к снижению функции щитовидной железы.
В процессе развития хронического аутоиммунного тиреоидита функция щитовидной железы претерпевает стадийные изменения с практически обязательным исходом в гипотиреоз. По мере прогрессирования недостаточности железы концентрации в крови T4, а затем и T3 снижаются, а содержание тиреотропного гормона постепенно нарастает. В дальнейшем развивается гипотиреоз с характерными лабораторными проявлениями. У части больных аутоиммунным тиреоидитом в дебюте заболевания возможны признаки гипертиреоза (снижение концентрации тиреотропного гормона и увеличение сT4), что обусловлено процессами деструкции ткани щитовидной железы.
Рак щитовидной железы
Папиллярная карцинома составляет 60% всех случаев рака щитовидной железы и поражает наиболее молодых людей (50% больных моложе 40 лет). Новообразование состоит из цилиндрических клеток и имеет тенденцию к медленному росту.
Фолликулярная карцинома составляет 15-30% всех случаев рака щитовидной железы, гистологически напоминает нормальную ткань щитовидной железы. Опухоль часто функционирует как нормальная ткань щитовидной железы, захватывая йод по ТТГ-зависимому типу. Фолликулярная карцинома более злокачественна, чем папиллярный рак, часто даёт метастазы в кости, лёгкие и печень.
Недифференцированная карцинома составляет 10% рака щитовидной железы, поражает больных старше 50 лет и чрезвычайно злокачественна. Характерен быстрый рост опухоли с обширными метастазами, что приводит к смерти в течение нескольких месяцев.
В большинстве случаев рака щитовидной железы концентрация тиреотропного гормона и гормонов щитовидной железы (T4, T3) остаётся в пределах нормы. Однако при метастазах рака щитовидной железы, продуцирующих тиреоидные гормоны, их содержание в крови может быть повышенным, а концентрация тиреотропного гормона сниженной, при этом развиваются клинические признаки гипертиреоза. В крови повышена концентрация тиреоглобулина. При раке щитовидной железы существует прямая связь между концентрацией тиреоглобулина в крови и риском метастазирования (чем больше уровень тиреоглобулина, тем выше вероятность наличия метастазов).
После хирургического удаления опухоли щитовидной железы и лечения радиоактивным йодом больным с фолликулярным или папиллярным раком назначают пожизненное лечение высокими дозами левотироксина натрия для подавления секреции тиреотропного гормона. Задача супрессивной терапии — снижение концентрации тиреотропного гормона в крови до уровня менее 0,1 мМЕ/л. При наличии метастазов дозировку препарата не снижают, концентрация тиреотропного гормона должна оставаться в пределах 0,01-0,1 мМЕ/л.
Определение концентрации тиреоглобулина в динамике позволяет оценивать эффективность хирургического лечения опухолей щитовидной железы. Стойкое и неуклонное снижение тиреоглобулина в крови в послеоперационный период свидетельствует о радикальности хирургического лечение. Временное снижение концентрации тиреоглобулина в крови в послеоперационный период и повышение концентрации в дальнейшем свидетельствует о нерадикальности удаления опухоли или наличии метастазов. Определение концентрации тиреоглобулина в крови в послеоперационный период необходимо проводить каждые 4-6 нед. Его исследование заменяет обычное радионуклидное сканирование у таких больных.
Медуллярная карцинома составляет 5-10% случаев рака щитовидной железы. Опухоль возникает из парафолликулярных клеток (С-клетки) секретирующих кальцитонин.
При проведении провокационного теста с внутривенным введением кальция определяют повышение как базальной (выше 500 пг/мл), так и стимулированной концентрации кальцитонина в сыворотке крови. Прослеживается сильная корреляция между степенью повышения концентрации кальцитонина в крови после введения кальция и размером опухоли.
Единственный метод лечения медуллярной карциномы — оперативное удаление всей щитовидной железы. Стойкое повышенное содержание кальцитонина в крови после удаления опухоли у больных с медуллярным раком щитовидной железы может указывать на нерадикальность операции или на наличие отдалённых метастазов. Снижение, а затем быстрый подъём уровня кальцитонина после операции свидетельствуют о рецидиве заболевания. После оперативного лечения кальцитонин необходимо исследовать у всех пациентов не реже 1 раза в год, а также провести обследование родственников (включая детей от 2 лет) для ранней диагностики возможной семейной формы рака щитовидной железы.

В эпоху комбинированной антиретровирусной терапии (КАРВТ) клинически значимые нарушения функций щитовидной железы у ВИЧ-инфицированных больных, находящихся в стабильном состоянии, встречаются относительно редко.
В одном из исследований среди 372 больных были выявлены только субклинические формы гипо- и гипертиреоза (соответственно в 3,5% и 0,3% случаев).
Показатели функции щитовидной железы
У ВИЧ-инфицированных больных могут наблюдаться изменения лабораторных показателей функции щитовидной железы. Некоторые из этих изменений типичны для классического синдрома эутиреоидной патологии, другие характерны именно для ВИЧ-инфекции. Как и при синдроме эутиреоидной патологии, при СПИДе наблюдается снижение уровней тиреоидных гормонов — трийодтиронина (Т3) и тироксина (Т4). При этом снижение уровня Т3 соответствовало тяжести состояния больных, что характерно для синдрома эутиреоидной патологии. В снижении уровней Т3 и Т4 может играть роль и недостаточное питание больных, так как между уровнями тиреоидных гормонов и альбумина в сыворотке существует тесная корреляция. При синдроме эутиреоидной патологии снижение уровня Т3 обусловлено нарушением периферической конверсии Т3 в Т4 под действием 5 1 -дейодиназы. У ВИЧ-инфицированных больных снижение уровней Т3 и Т4 может быть связано также с изменением концентрации связывающих белков в сыворотке и/или снижением секреции ТТГ. В отличие от синдрома эутиреоидной патологии, при тяжелом течении ВИЧ-инфекции уровень реверсивного Т3 обычно не возрастает.
Особенностью ВИЧ-инфекции является повышенное содержание тироксинсвязывающего глобулина (ТСГ) в сыворотке, пропорциональное степени иммунодепрессии. Между уровнем ТСГ и количеством СВ4 + -лимфоцитов наблюдается обратная корреляция, и раньше о тяжести ВИЧ-инфекции судили именно по уровню ТСГ. Повышение его уровня, по-видимому, не является следствием общих изменений в синтезе белка, его сиалировании или клиренсе, а также изменения концентрации эстрогенов. Причина и клиническое значение такого повышения остаются неясными, но оно должно сказываться на уровне Т4 и Т3.
У ВИЧ-инфицированных больных, находящихся в стабильном состоянии, концентрации ТТГ и свТ4 в сыворотке сохраняются в пределах нормальных колебаний, но при сравнении со здоровыми людьми содержание ТТГ оказывается существенно повышенным, а свТ4 — сниженным. Кроме того, у таких больных обнаруживается большая амплитуда (но не частота) секреторных выбросов ТТГ в течение суток, а также более высокий подъем уровня этого гормона в ответ на стимуляцию тиреоторопин-рилизинг гормоном (ТРГ).
Все это свидетельствует о легком, компенсированном гипотиреозе, механизмы развития которого неизвестны.
Оппортунистические инфекции и опухоли
Оппортунистические инфекции и опухоли, развивающиеся у ВИЧ-инфицированных больных, обычно не приводят к нарушению функции щитовидной железы. При аутопсии 100 больных СПИДом (до эры КАРВТ) из щитовидной железы в 23% случаев высевались Mycobacterium tuberculosis, в 17% — цитомегаловцрусы (ЦМВ), в 5% — Cryptococcus, в 5% — Mycobacterium avium, в 4% — Pneumocystis carinii и в 7% — другие бактерии или грибы.
Некоторые из этих возбудителей могут вызывать гипо- или гипертиреоз. Так, из 11 случаев тиреоидита, вызванного P. carinii, у 7 больных имел место гипотиреоз, у 3 — гипертиреоз, а у 1 функция щитовидной железы оставалась нормальной. Антитиреоидные антитела в сыворотке отсутствовали. Пораженные доли щитовидной железы почти не накапливали изотоп. У 2 больных с гипертиреозом после лечения этой инфекции функция щитовидной железы нормализовалась. В 1 случае была обнаружена инфильтрация железы саркомой Капоши, сопровождавшаяся гипотиреозом. В 2 случаях увеличение размеров щитовидной железы было обусловлено ее инфильтрацией клетками лимфомы.
Влияние медикаментозного лечения
Ряд препаратов, применяющихся для лечения ВИЧ-инфекции, могут изменять клиренс тиреоидных гормонов за счет индукции печеночных микросомных ферментов цитохрома Р450. К ним относятся рифампицин, фенитоин и кетоконазол. У больных с исходно нормальной тиреоидной функцией клинически значимых ее нарушений при таком лечении не наблюдалось, хотя отмечалось некоторое снижение уровня Т4 в сыворотке. Однако при исходном гипотиреозе у таких больных присоединение ВИЧ-инфекции должно сопровождаться повышением потребности в тироксине, а при исходно сниженных резервах щитовидной железы субклинический гипотиреоз может становиться явным. При лечении саркомы Капоши и гепатита С (часто сопутствующих ВИЧ-инфекции) интерферономос наблюдались аутоиммунные заболевания щитовидной железы, сопровождающиеся как гипер-, так и гипотиреозом.
При использовании КАРВТ также были описаны случаи развития аутоиммунных заболеваний, в том числе болезни Грейвса, тиреоидита Хашимото и гнездной алопеции. В одном из исследований болезнь Грейвса развилась у 5 больных через 14-22 месяца после начала КАРВТ. До начала такого лечения у всех больные антитиреоидные антитела отсутствовали, но КАРВТ обусловливала их появление. При обследовании 1523 больных СПИДом аутоиммунные заболевания щитовидной железы (в основном болезнь Грейвса) были обнаружены у 17 больных (в основном у женщин африканского происхождения с запущенными стадиями заболевания). Аутоиммунные заболевания развивались у них в интервале от 8 до 32 месяцев после начала КАРВТ. Возможные причины включают регенерацию тимуса или пролиферацию периферических Т-лимфоцитов, что приводит к срыву иммунологической толерантности.
Читайте также:


