Правила отбора сыворотки для вич
Взятие, доставку и оформление материалов для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД - индикаторные заболевания, для проведения лабораторных исследований методом ПЦР на ВИЧ - инфекцию, вирусные гепатиты В и С, а также для иммунологических исследований в КДЛ ГБУЗ РЦПБ СПИД и ИЗ производить строго в соответствии с правилами (приложение 1, 2, 3).
Наиболее частыми нарушениями указанных правил являются следующие:
1) при оформлении сопроводительной документации не указывается наименование диагностической тест-системы, ее серия, срок годности
2) не полностью указываются паспортные данные обследуемых, а также дата и место взятия материала
3) зачастую в лабораторию ГБУЗ РЦПБ СПИД и ИЗ доставляется материал, уже непригодный для исследования: сыворотки, хранившиеся дольше установленного срока хранения (для разных методов исследования сроки хранения составляют от 3 до 48 часов); проросшие, гемолизированные сыворотки, в недостаточном для исследования количестве (в зависимости от метода минимально необходимый объем материала составляет от 2 до 5 мл);
4) номера, проставленные на флаконах, не соответствуют указанным в направлении; количество проб крови не соответствует количеству, указанному в направлении;
5) неправильно производится взятие материала, в пробах крови, доставляемых для исследований методом ПЦР и для иммунологические исследований, обнаруживаются сгустки,
6) при заборе материала не всегда медицинский персонал ЛПУ обращает внимание на сроки годности пробирок.
Правила взятия и доставки крови для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД-индикаторные заболевания.
Взятие крови производится из локтевой вены в чистую сухую пробирку в количестве 3-5 мл. У новорожденных можно брать пуповинную кровь с указанием об этом в направлении. Полученный материал не рекомендуется хранить более 12 часов при комнатной температуре и более 1 суток в холодильнике при +4-8 0С. Наступающий гемолиз может повлиять на результаты анализа. В случае невозможности доставки материала в течение суток следует сразу после взятия крови отобрать из нее сыворотку. Сыворотка отделяется центрифугированием. Отделенная сыворотка переносится в чистую (лучше стерильную) пробирку, флакон или пластиковый контейнер, и в таком виде она может храниться до 7 дней при температуре +4-8 0С. На пробирке следует указать порядковый номер, фамилию и инициалы пациента, в строгом соответствии с направлением. Для транспортировки в КДЛ диагностики ВИЧ штативы с пробирками помещают в термоконтейнер, легко подвергающийся дезинфекции. Полученный материал в КДЛ диагностики ВИЧ доставляет медицинский персонал, прошедший специальный инструктаж в установленном порядке.
Утв. МЗ СССР от 05.09.1988 г. №690
Направление №__________________
на исследование образца крови в ИФА на ВИЧ-инфекцию
В_________________________________________________________
(наименование учреждения)
Должность лица, направляющего материал___________________________________
Взятие материала для исследования производить только при предъявлении пациентами паспорта или иного документа, удостоверяющего его личность (кроме анонимного обследования).
Коды контингентов
Наименование кода
код
Доноры (крови, биологических жидкостей, органов и тканей)
Медицинский персонал, работающий с ВИЧ - инфицированными лицами и инфицированным материалом
Гомо- и бисексуалисты
Больные заболеваниями, передающимися половым путем
Лица, находящиеся в местах лишения свободы
Обследованные по клиническим показаниям
Беременные (доноры плацентарной и абортной крови)
Обследованные при эпидемиологическом расследовании
Для лабораторий диагностики ВИЧ-инфекции в обменном журнале и направлении обязательно дополнительно указываются результаты исследования (ОП сыворотки, ОП критическое), а также дата постановки, название, серия, срок годности используемой тест-системы.
Правила взятия, хранения и доставки материала для проведения исследований методом полимеразной цепной реакции (ПЦР).
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, точное время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Правила взятия и доставки материала для проведения иммунологических исследований.
Материал должен быть доставлен в лабораторию сразу после взятия. Недопустимо замораживание биологического материала. Флаконы должны быть четко промаркированы с указанием фамилии пациента, даты и времени взятия. Маркировка флаконов должна строго соответствовать данным, указанным в направлении.
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Приложение N 6
к приказу
от 27 января 2006 г. N 16/9
Правила забора, хранения и транспортировки
крови для исследования на ВИЧ
1. Для исключения ложных результатов при исследовании на антитела к ВИЧ рекомендуется неукоснительно выполнять следующие правила забора и транспортировки сывороток крови:
1.1. Кровь для первичной серодиагностики в ИФА берется из локтевой вены в количестве 3-5 мл, желательно натощак, в чистую сухую пробирку.
Допускается пальцевая проба у детей. При невозможности взятия крови из вены, кровь может быть взята из пальца в количестве до 1 мл.
1.2. Пробирки герметично закрывают резиновыми или ватно-марлевыми, обернутыми полиэтиленовой пленкой, пробками и помещают в штатив, который доставляется в лабораторию в специальном контейнере или биксе с маркировкой "Осторожно, AIDS". Не допускается перевозка материала в сумках, портфелях и других предметах личного пользования, а также запрещается доставка биоматериала на исследование больными или родственниками пациентов. При перевозке на транспорте требуется доставлять исследуемый материал для проведения скрининговых исследований в сумках-холодильниках (термоконтейнерах) при температуре +4 +8. При необходимости возможно использование уплотнителей (вата, поролон), которые в последующем в лаборатории подлежат обеззараживанию и утилизации. Запрещается перевозка на общественном транспорте.
1.3. Срок хранения крови, забранной для анализа на ВИЧ, - не более 12 часов при комнатной температуре и не более 1 суток в холодильнике при +4 +8 град. Наступающий гемолиз может повлиять на результат анализа. По этой причине цельная кровь должна быть доставлена в диагностическую лабораторию в день забора.
1.4. Предпочтительнее сразу после взятия крови и наступления ретракции кровяного сгустка после ценрифугирования (или отстаивания) отобрать сыворотку. Отдельная сыворотка переносится в чистую (лучше стерильную) пробирку, пластиковый контейнер. Если сыворотка не может быть сразу же доставлена в СПИД - лабораторию, то в таком виде она может храниться до 3 дней при температуре +4 +8 С.
Категорически запрещается переливание сыворотки через край пробирки, пипетирование сыворотки ртом. Отсасывание сыворотки производит лаборант с помощью груши, лучше автоматическими пипетками с одноразовыми наконечниками, при этом необходимо обеспечить, чтобы каждый образец сыворотки отбирался индивидуальным наконечником. Стеклянные палочки и пипетки должны быть индивидуальными для каждой сыворотки. Ни в коем случае нельзя использовать повторно палочки и пипетки в процессе отделения сыворотки из разных образцов, т.к. это может привести к перекрестной контаминации отрицательных сывороток.
1.5. Пробирки маркируют карандашом по стеклу. Не рекомендуется использовать для этой цели этикетки из лейкопластыря. Номера пробирок в штативе должны соответствовать номерам в направлениях и в общем списке. Зачеркивать, вносить изменения, поправки категорически запрещается.
1.6. Сопроводительная документация составляется в 2-х экземплярах. Лечебно-профилактические учреждения при первичном (скрининговом) лабораторном исследовании пациентов на антитела к ВИЧ заполняют направление по форме N 264/у-88. Зачеркивания, внесение изменений, поправки категорически запрещены. Направления помещают в полиэтиленовые пакеты и доставляют в лабораторию вне контейнера.
1.7. В случае поступления в лабораторию биоматериалов на исследование с направлением в виде свободной таблицы-списка, необходимо одновременно предоставить заполненный бланк направления отдельно на каждого обследуемого по форме N 264/у-88 (см. Приложение N 7).
1.8. С целью обеспечения полноты обследования на ВИЧ, особенно в условиях работы стационаров, необходимо осуществлять забор крови на ВИЧ ежедневно, включая выходные и праздничные дни. После отстаивания или получения сыворотки путем центрифугирования рекомендуется отделить сыворотку от кровяного сгустка (лучше в стерильную пробирку) и доставить в СПИД-лабораторию в день транспортировки, сохраняя сыворотку в холодильнике при температуре +4 +8 С.
1.9. Лаборатории диагностики ВИЧ-инфекции/СПИД перекладывают присланный материал в штативы или другие емкости диагностической лаборатории, помещенные на эмалированные или металлические подносы, и переносят в комнату разборки и подготовки материала для серологических исследований. Контейнеры, в которых доставлен материал, после разгрузки обрабатывают дезраствором.
1.10. Лаборатория в обмен выдает пробирки, обработанные согласно МУ 3.5.1/3.5.4.001-98, в полиэтиленовые мешки учреждений. Штативы и биксы возвращают только после дезинфекции.
1.11. Термоконтейнеры или биксы с биоматериалом доставляет в лабораторию персонал, прошедший инструктаж. Выполнение этими лицами данных функциональных обязанностей должно быть предусмотрено приказом по ЛПУ.
2. В случае положительного скринингового теста на антитела к ВИЧ проводится дальнейшая серологическая диагностика с целью подтверждения специфичности полученного результата в референс-лаборатории.
2.1. С целью окончательного лабораторного подтверждения ВИЧ-инфекции забор крови осуществлять лучше в стерильную пробирку, желательно натощак, свежеприготовленная сыворотка доставляется в референс-лабораторию в день забора крови.
2.2. При повторном взятии крови необходимо предупредить все возможные ошибки обусловленные неточностью маркировки пробирок и заполнения бланков направлений, которые могут привести к подмене сывороток от разных пациентов.
2.3. При отправке в референс-лабораторию второй порции сыворотки для проведения подтверждающей серологической диагностики ВИЧ-инфекции заполняется сопроводительная документация, составленная по форме N 265/у-88 (Приложение N 8), заверенная подписью врача, направившего материал на референс-исследование.
2.4. Сыворотка упаковывается в соответствии с правилами транспортировки инфекционного материала и доставляется в штативе, отдельном от других образцов, с собой маркировкой пробирок красным карандашом по стеклу.
2.5. Прием контейнера с сывороткой, предназначенной для проведения подтверждающих тестов, регистрируется в отдельном журнале с указанием должности, фамилии лица, ответственного за транспортировку сыворотки, направленной на перепроверку или постановку иммуноблота.
3. При проведении повторных исследований на антитела к ВИЧ, при сомнительных результатах первичного исследования сыворотки крови, (через 3 месяца и при сохранении неопределенных результатов - через 6 месяцев) - забор крови и транспортировка проводится в соответствии с п.п. 2.1.-2.5. с обязательной отметкой в ф. N 265/у-88 (Приложение N 8).
| > N 8. Направление N_____ на исследование крови на СПИД в референс-лабораторию |
| Содержание Приказ Министерства здравоохранения Самарской области от 27 января 2006 г. N 16/9 "Об улучшении работы по выявлению ВИЧ-инфицированных. |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
ПРИЛОЖЕНИЕ № 1
к приказу Минздравмедпрома РФ от 16.08.1994 г. № 170
Методические указания по организации лечебно-диагностической помощи и диспансерного наблюдения за больными ВИЧ-инфекцией и СПИДом
Основным методом лабораторной диагностики ВИЧ-инфекции является обнаружение антител к вирусу с помощью иммуноферментного анализа.
Антитела к ВИЧ появляются у 90-95% зараженных в течение 3-х месяцев после заражения, у 5-9% — через 6 месяцев от момента заражения и у 0,5-1% — в более поздние сроки. Наиболее ранний срок обнаружения антител — 2 недели от момента заражения. В терминальной фазе СПИД количество антител может значительно снижаться, вплоть до полного их исчезновения.
Серологическая диагностика инфекции ВИЧ на первом этапе строится на выявлении суммарного спектра антител против антигенов ВИЧ с помощью твердофазного иммуноферментного анализа. На втором этапе методом иммунного блоттинга (Western blot) проводится определение антител к отдельным белкам вируса.
Забор крови производится из локтевой вены в чистую сухую пробирку в количестве 3-5 мл. У новорожденных можно брать пуповинную кровь. Полученный материал не рекомендуется хранить более 12 часов при комнатной температуре и более 1 суток в холодильнике при +4-8° С. Наступающий гемолиз может повлиять на результаты анализа. Лучше всего сразу после взятия крови отобрать из нее сыворотку. Сыворотка отделяется центрифугированием или обводкой крови по стенке пробирки пастеровской пипеткой, либо стеклянной палочкой. Отделенная сыворотка переносится в чистую (лучше стерильную) пробирку, флакон или пластиковый контейнер, и в таком виде она может хранится до 7 дней при температуре +4-8° С.
При работе следует соблюдать правила техники безопасности, приведенные в "Инструкции по противоэпидемическому режиму в лабораториях диагностики СПИД" № 42-28/38-90 от 5 июля 1990 года.
Для проведения лабораторных исследований с помощью ферментных методов необходимо иметь следующее оборудование:
- спектрофотометр;
- отмыватель планшетов;
- термостат;
- автоматические пипетки;
- наконечники к автоматическим пипеткам;
- центрифуги;
- холодильники;
- тест-системы.
В настоящее время в России рекомендовано к применению достаточное количество тест-систем для выявления антител к ВИЧ. Все они основаны на общем принципе иммуноферментного анализа.
Нагрузка на бригаду иммуноферментного анализа должна составлять до 400 исследований в смену, при условии оснащения современным автоматическим оборудованием и до 180-200 исследований, оснащенных отечественным рутинным оборудованием.
Принцип иммуноферментного анализа основан на выявлении комплекса антиген-антитело с помощью фермента (пероксидаза, щелочная фосфатаза и др.) по изменению окраски специфического субстрата. Основной компонент твердофазных иммуноферментных тест-систем — полистироловый планшет с лунками или полистироловые шарики, на поверхности которых сорбирован антиген: вирусный лизат, рекомбинантные белки или синтетические антигенные детерминанты. Из всех модификаций твердофазного иммуноферментного анализа для диагностики инфекции, вызываемой ВИЧ, наиболее широко применяются непрямой и конкурентный варианты.
Предварительно приготовленный согласно инструкции, прилагаемой к набору, исследуемый материал (сыворотка, плазма) вносится в лунку планшета. Если этого требует методика, планшет предварительно отмывается. Несколько лунок планшета заполняются контрольными сыворотками, содержащими и не содержащими антитела к ВИЧ. При работе с контрольными сыворотками необходимо строго соблюдать инструкции по применению диагностической тест-системы, т.к. интерпретация результатов зависит от значений оптической плотности контрольных сывороток. Планшет с внесенными контрольными сыворотками и исследуемым материалом инкубируется при условиях, указанных в инструкции, прилагаемой к диагностическому набору.
Если специфические антитела присутствуют в сыворотке, они образуют комплекс с антигеном, сорбированным на поверхности лунок планшета. Несвязавшиеся с антигеном антитела удаляются при отмывке планшета.
Затем во все лунки планшета вносят конъюгат-антитела против иммуноглобулинов человека, меченые ферментом (пероксидаза, щелочная фосфатаза и др.). При последующей инкубации происходит образование комплекса антиген-антитело-конъюгат. Несвязавшийся конъюгат удаляется во время отмывки планшета. Наиболее широко применяемым индикаторным ферментом для иммуноферментного анализа является пероксидаза хрена. Субстратом для нее является перекись водорода. Эта реакция протекает без видимых проявлений. Изменение окраски раствора происходит при окислении красителей (ортофенилендиамина или др.), который входит в состав субстратного раствора.
Краситель из восстановленной формы переходит в окисленную окрашенную форму. Таким образом, происходит окрашивание только тех лунок, в которых присутствует комплекс антиген-антитело-конъюгат. Иногда окрашивание может быть результатом неспецифического связывания иммуноглобулинов с антигенами ВИЧ. Учет реакции проводят на спектрофотометре (ридере) при длине волны, указанной в инструкции, прилагаемой к диагностическому набору. Длина волны зависит от красителя, используемого в тест-системе.
При конкурентном методе иммуноферментного анализа в лунки планшета с нанесенным антигеном одновременно вносятся исследуемые сыворотки и конъюгат. Конъюгат в данном случае — это антитела против ВИЧ, меченые ферментом. При последующей инкубации антитела, содержащиеся в сыворотке, и конъюгат вступают в конкурентное взаимодействие с иммобилизированными на твердом носителе антигеном. Если сыворотка содержит антитела, они взаимодействуют с антигеном, блокируя образование комплекса антиген-конъюгат. При отсутствии антител в сыворотке происходит образование комплекса антиген-конъюгат. Оставшиеся несвязанные компоненты после инкубации отмываются и в систему добавляется соответствующий субстрат. При наличии антител в сыворотке цветная реакция не развивается.
| № п/п | Типы дефекта | Видимые проявления | Возможные причины дефекта |
|---|---|---|---|
| 1. | Высокий фон | Значение оптической плотности в лунках с отрицательным результатом превышает 0,2 ед. |
|
| 2а. | Слабый сигнал | Значение оптической плотности положительного контроля ниже минимального значения оптической плотности, указанного в инструкции, значение оптической плотности положительных сывороток не превышает 0,4 ед. |
|
| 2б. | Слабый сигнал положительного контроля | Значение оптической плотности положительного контроля не превышает 0,4 ед. |
|
| 3. | Отсутствие сигнала | В лунках с позитивным контролем не произошло окрашивание |
|
При постановке иммуноферментного анализа в случае получения положительного результата анализ проводится еще 2 раза (с той же сывороткой). При получении хотя бы еще одного положительного результата сыворотка направляется в референс-лабораторию.
В настоящее время для подтверждения специфичности первичного положительного результата чаще всего используется метод иммунного блоттинга — Western blot. Принцип метода заключается в выявлении антител к определенным белкам вируса, иммобилизованным на нитроцеллюлозную мембрану. В организме человека образуются антитела к ряду компонентов вируса, данные об этих антигенах приводятся в таблице.
| Группа белков | ВИЧ-1 | ВИЧ-2 |
|---|---|---|
| Белки оболочки вируса (env) | гп 160 кд, 120 кд, 41 кд | гп 140 кд, 105 кд, 36 кд |
| Белки сердцевины вируса (gag) | п 55 кд, 24 кд, 17 кд | п 56 кд, 26 кд, 18 кд |
| Ферменты вируса (pol) | п 66 кд, 51 кд, 31 кд | п 68 кд |
| Примечание: Молекулярный вес белков выражается в килодальтонах - кд, гп - гликопротеины, п - протеины. | ||
Подготовка нитроцеллюлозных мембран для тест-системы производится следующим образом. На первом этапе производят разделение белков вируса иммунодефицита человека по молекулярному весу с помощью электрофореза в полиакриламидном геле. Белки мигрируют в слоях геля при наложении электрического потенциала: белки с низким молекулярным весом проходят через поры в полиакриламидном геле легче, чем белки с высоким молекулярным весом и быстрее достигают конца геля. В результате этого происходит разделение белков на отдельные полосы по молекулярному весу. Затем осуществляется электрофоретический перенос из полиакриламидного геля на поверхность нитроцеллюлозной мембраны. После этого мембрана обрабатывается блокирующим раствором во избежание неспецифического связывания иммуноглобулинов сывороток крови, затем отмывается, высушивается и разрезается на отдельные полоски, которые вкладываются в набор. Перенесенные таким образом белки выявляются на нитроцеллюлозной реплике (блоке) с помощью непрямого анализа, а именно: сыворотка или плазма инкубируются с блотом; если исследуемый материал содержит антитела к белкам ВИЧ, они связываются с антигеном, перенесенным на нитроцеллюлозную мембрану, после отмывки полоски блота инкубируются с конъюгатом; при образовании комплекса антиген-антитело, конъюгат присоединяется к нему, после отмывки от конъюгата и инкубации с субстратом происходит окрашивание тех участков нитроцеллюлозы, где произошло образование комплекса антиген-антитело-конъюгат. Полученный результат сравнивается с результатами тестирования положительной и отрицательной контрольных сывороток.
Результаты, полученные в иммунном блоттинге интерпретируются как положительные, сомнительные и отрицательные.
| Название центров | Положительный результат | Сомнительный результат | Отрицательный результат |
|---|---|---|---|
| 1. ВОЗ | Сочетание полос к гп 41 и гп 120, или гп 41 и гп 160, или гп 120 и гп 160 | Полосы к другим антигенам ВИЧ | Отсутствие полос к какому-либо из антигенов ВИЧ |
| 2. Российский центр по профилактике и борьбе со СПИД | Полосы хотя бы к одному из белков гп 41, гп 120, гп 160 в сочетании с другими полосами или без них | Полосы к другим антигенам ВИЧ | Отсутствие полос к какому-либо из антигенов ВИЧ |
| Примечание: Рекомендации Российского центра учитывают опыт работы с сывороткам детей из внутрибольничных очагов, у которых часто определялись антитела только к одному из белков оболочки вируса. Своевременная постановка диагноза у таких детей позволила быстро начать противоэпидемические мероприятия и специфическую терапию. | |||
Вопросы стандартизации и интерпретации результатов иммунного блоттинга были рассмотрены на совещании экспертов ВОЗ в Женеве 22-23 апреля 1990 г.
Согласно этим рекомендациям при наличии реакции только из белков оболочки (гп 160, гп 120, гп 41) в сочетании или без реакции с другими белками результат считается сомнительным и рекомендуется повторное исследование, с использованием набора другой серии или другой фирмы. Если и после этого результат остается сомнительным, рекомендуется наблюдение в течение 6 месяцев (через 3 месяца). Наличие положительной реакции с п 24 может указывать на период сероконверсии. В этом случае рекомендуется, в зависимости от клинических и эпидемиологических данных, повторить исследование с образцом сыворотки, взятой через 2 недели.
Положительные реакции с белками gag и pol без наличия реакции с белками env могут отражать стадию ранней сероконверсии, либо указывать на ВИЧ-2 инфекцию или на неспецифическую реакцию. Лица с такими результатами после тестирования на ВИЧ-2 должны повторно исследоваться через 3 месяца (в течение 6 месяцев). Если через 6 месяцев вновь будут получены неопределенные результаты (отсутствие реакции с белками env ВИЧ-1 и ВИЧ-2), а также не будут выявлены факторы риска и клинические симптомы иммунодефицита, можно сделать вывод о неспецифической реакции. Наличие неспецифической реакции не дает основания для постановки диагноза ВИЧ-инфекции, но доноров, имеющих такой результат, от донорства необходимо отстранить.
Результаты серологических исследований используются эпидемиологами и практическими врачами для ранней диагностики ВИЧ-инфекции, своевременного выявления источника инфекции, скорейшего проведения противоэпидемических мероприятий и оказания помощи зараженным лицам. На основании только лабораторного анализа диагноз не может быть выставлен . Для вынесения диагностического заключения необходимо учитывать данные эпидемиологического анамнеза, иммунологических тестов и результатов клинического обследования.
1. Методические указания по организации лечебно-диагностической помощи и диспансерного наблюдения за больными ВИЧ-инфекцией и СПИДом.
Постконтактная профилактика инфицирования ВИЧ при профессиональных контактах.
- Повреждение кожи (укол иглой или порез острым инструментом). При контакте с ВИЧ-инфицированной кровью (при уколе или порезе) риск заражения в среднем составляет около 0,3% .
- Попадание биологических жидкостей на слизистые оболочки или поврежденную кожу. Заболевания кожи и слизистых также повышают риск заражения ВИЧ при попадании на них инфицированного материала. Риск инфицирования при попадании ВИЧ-инфицированной крови на неповрежденные слизистые составляет примерно 0,09%.
Под профессиональным контактом понимают любой прямой контакт слизистых, подкожный или внутривенный контакт с потенциально инфицированными биологическими жидкостями, при исполнении профессиональных обязанностей (т.е. работников сферы здравоохранения и санитарии, лиц, обеспечивающих общественную безопасность и сотрудников лабораторных учреждений).
Постконтактная профилактика (ПКП) – представляет короткий курс антиретровирусных препаратов с целью снижения риска ВИЧ – инфекции после возможного инфицирования (произошедшего при исполнении служебных обязанностей или других обстоятельствах).
- Повреждение кожи острым предметом, загрязненным кровью, жидкостью с видимой примесью крови или другим потенциально инфицированным материалом, или иглой из вены больного.
- Укушенная рана, если укус сделал ВИЧ-инфицированным с заметным источником кровотечения во рту.
- Попадание крови, жидкости с видимой примесью крови или другого потенциально инфицированного материала на слизистые оболочки (рот, нос, глаза).
- Попадание крови, жидкости с видимой примесью крови или другого потенциально инфицированного материала на поврежденную кожу (например, при наличии дерматита, участков обветренной кожи, потертостей или открытой раны).
«…проводится при попадании большого количества крови или биологической жидкости на раневую поверхность или слизистые и состоит в приеме ретровира (зидовудина, азидотимидина – АЗТ) или его аналогов в дозе 200 мг каждые четыре часа в течение 3 дней, затем 200 мг каждые шесть часов в течение 25 дней.
Алгоритм оценки степени риска инфицирования ВИЧ
(CDC Antiretroviral postexposure prophylaxis after sexual, injection drug use, or other nonoccupational exposure to HIV in the United States):
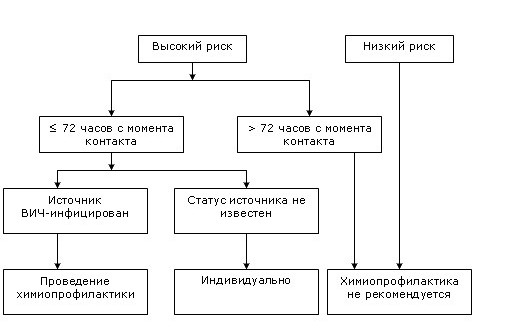
Контакт слизистой влагалища, прямой кишки, глаза, полости рта и других слизистых, повреждённой кожи или подкожный контакт с кровью, спермой, секретом влагалища и прямой кишки, грудным молоком или другими биологическими жидкостями, контаминированными видимыми включениями крови, если известно, что источник ВИЧ-инфицирован.
Контакт слизистой влагалища, прямой кишки, глаза, полости рта и других слизистых, повреждённой кожи или подкожный контакт с мочой, секретом слизистой полости носа, слюной, потом или слезами, не контаминированными видимыми включениями крови, при подозрении или если известно, что источник ВИЧ-инфицирован.
Профилактика передачи ВИЧ от матери ребенку (ПМР).
Частота ПМР составляет 20-40% при естественном течении инфекции. При использовании современных схем профилактики частота ПМР составляет менее 2%. В рамках программы профилактики ВИЧ/СПИДа в Беларуси поставлена задача снижения частоты вертикальной передачи ВИЧ до 2% и менее к 2010 году.
Схемы профилактики ПМР включают в себя компоненты:
| во время беременности |
|
| в родах |
|
| у новорожденного |
|
Медикаментозная профилактика у ВИЧ-позитивных беременных является основным мероприятием ПМР и имеет целью подавление репликации ВИЧ в организме женщины. При оптимальном подавлении репликации ВИЧ вирусная нагрузка у беременной в крови минимальна, что и обусловливает резкое снижение риска передачи ВИЧ ребенку, а также резкое снижение риска передачи ВИЧ при профессиональном контакте во время проведения акушером планового кесарева сечения.
Необходимая длительность медикаментозной профилактики для достижения оптимального подавления репликации ВИЧ – не менее 1-2 месяцев, поэтому рутинно рекомендуемый срок начала медикаментозной профилактики у беременной – с 28 недель гестации.
Необходимая эффективность медикаментозной профилактики достигается только при высокой приверженности беременной к приему препаратов (не более 5% пропущенных приемов от их общего числа). Беременную следует консультировать по приверженности к приему препаратов, как перед назначением медикаментозной профилактики, так и во время ее проведения при каждом визите к врачу.
А. ВИЧ-инфицированные беременные, при обследовании которых определено, что они не нуждаются в АРТ (1-2 клинические категории по классификации ВОЗ 2006 г. и СD4 >350 клеток/мкл)
А.1. При ВН А.2. При ВН >10 000 копий в мл, или если нет возможности определить ВН на фоне беременности, или если женщина ранее получала зидовудин
Схема: зидовудин 300 мг + ламивудин 150 мг + ингибитор протеазы внутрь 2 раза в сутки.
Сроки проведения: с 28 недель беременности (для беременных, впервые обследованных в более позднем гестационном сроке – с момента установления диагноза ВИЧ-инфекции) до родов и в родах, сразу после родов все три препарата одновременно отменяются.
В. ВИЧ-инфицированные беременные, при обследовании которых определено, что они нуждаются или могут нуждаться в АРТ (3-4 клинические категории по классификации ВОЗ 2006 г. или СD4 В.1. При СD4 В.2. При СD4 200-350 клеток/мкл:
Схема: зидовудин 300 мг + ламивудин 150 мг + ингибитор протеазы внутрь 2 раза в сутки. При анемии вместо зидовудина — абакавир 300 мг внутрь 2 раза в сутки.
Сроки проведения: с момента обследования и формулировки показаний к лечению до родов и в родах, после родов решение о продолжении АРТ принимается инфекционистом после повторной оценки клинических и иммунологических (СD4) данных.
С. ВИЧ-инфицированные беременные, которые начали получать АРТ еще до наступления беременности.
Продолжать текущую схему, если она не содержит ифавиренц или комбинацию ставудина и диданозина.
Если схема содержит ифавиренц: заменить ифавиренц на ингибитор протеазы или на абакавир; при СD4 D. Беременные, которые впервые обращаются за помощью к моменту родов: ВИЧ-инфицированные или с неизвестным ВИЧ-статусом (когда нет возможности провести экспресс-тест на ВИЧ).
- зидовудин 300 мг внутрь каждые 3 ч до рождения ребенка + ламивудин 150 мг внутрь в начале родов и затем каждые 12 ч до рождения ребенка + невирапин 200 мг внутрь однократно в начале родов;
- невирапин 200 мг внутрь однократно с началом родовой деятельности или за 4-6 часов до проведения родоразрешения методом кесарева сечения.
После родов: зидовудин 300 мг + ламивудин 150 мг внутрь 2 раза в сутки в течение 7 суток (чтобы предупредить риск развития резистентности к препаратам класса ННИОТ).
Медикаментозная профилактика у новорожденных
А. Новорожденные от матерей, которые во время беременности и родов получали медикаментозную профилактику, не включающую невирапин (зидовудин или зидовудин + ламивудин или зидовудин + ламивудин + ингибитор протеазы).
- зидовудин (сироп) 4 мг/кг внутрь 2 раза в сутки; или
- зидовудин (сироп) 4 мг/кг + ламивудин (раствор) 2 мг/кг внутрь 2 раза в сутки.
Сроки проведения: начать прием препаратов следует в первые 8 часов после рождения, длительность приема – в течение 4-6 недель.
В. Новорожденные от матерей, которые во время родов получали экстренную медикаментозную профилактику невирапином.
Схемы и сроки проведения:
- [зидовудин (сироп) 4 мг/кг + ламивудин (раствор) 2 мг/кг внутрь 2 раза в сутки] в течение 4-6 недель + невирапин (раствор) 2 мг/кг внутрь однократно; начать прием препаратов следует в течение 48-72 часов после рождения; или
- невирапин (раствор) 2 мг/кг внутрь однократно между 48 и 72 часам жизни; или
- невирапин (раствор) 2 мг/кг внутрь двукратно: первую дозу – сразу после рождения, вторую – через 72 часа.
Читайте также:


