Редактирование генома человека с вич инфекцией

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.
19 октября 2016
- 6818
- 5,6
- 1
- 8
Система CRSIPR/Cas9 удалит вирусную информацию в геноме человека, зараженного ВИЧ

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
CRISPR/Cas9
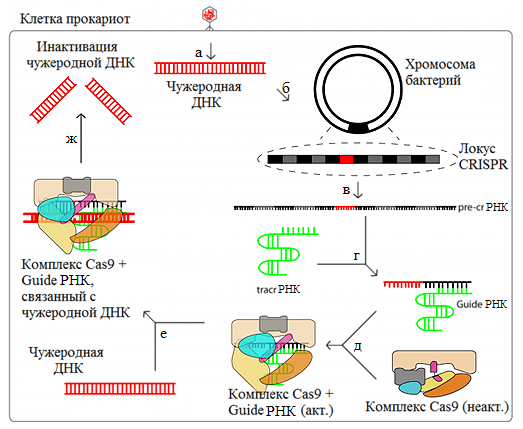
Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера. в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК. ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.
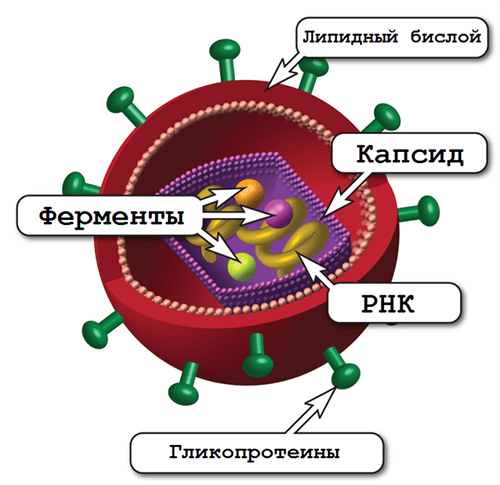
Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].
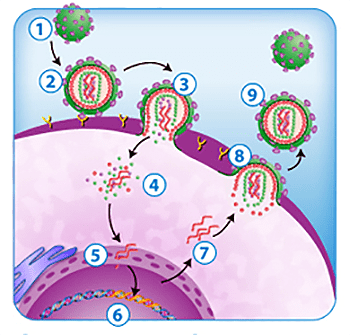
Рисунок 3. Жизненный цикл ВИЧ. 1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
Терапия ВИЧ

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 10 6 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].
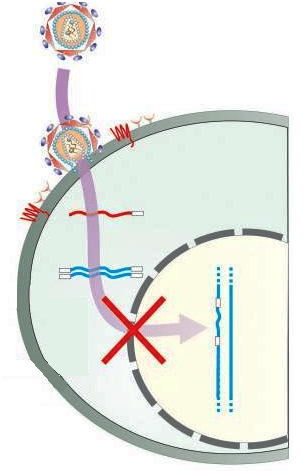
Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
Не все так просто

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
11 ноября Роспотребнадзор заявил, что разработал новый подход в лечении ВИЧ-инфекции с помощью изменений в генетическом аппарате клеток пациента. Отечественная платформа, разработанная ведомством, поможет создать новые диагностические наборы и препараты для лечения заболевания.
В заявлении Роспотребнадзора есть два компонента. Первый — диагностика. Об этой работе НИИ эпидемиологии я хорошо знаю и знаком с коллективом, который разрабатывал платформу по диагностике. Они пытаются сделать платформу для идентификации эффективности применения антиретровирусной терапии (АРВТ) для конкретных вирусов, которыми инфицирован человек.
В коктейль АРВТ входят комбинации трех-четырех ингибиторов, которые подавляют отдельные компоненты вируса. Прежде чем назначать терапию, предлагается протестировать, будет ли у пациента резистентность к компонентам коктейля из-за определенных мутаций в геноме вируса. Это гораздо более осмысленно, это то, как сейчас проводят терапию в Америке. Там сначала тестируют на резистентность, а потом назначают коктейль в соответствии с выявленной или невыявленной резистентностью.
На данный момент в России применяется самый дешевый коктейль без предварительной диагностики. Насколько я знаю, у нас, к сожалению, большинство [ВИЧ-положительных] людей не лечится до тех пор, пока титр вируса не начнет расти. Считается, что если организм контролирует вирусную инфекцию, то такому человеку не следует прописывать АРВТ. В других странах считается, что таким пациентам лучше прописывать терапию сразу, чтобы предотвратить распространение [вируса].
Но это не так страшно, как второй момент — назначение терапии, когда количество вируса начинает увеличиваться, а количество CD4-клеток падать, без предварительного тестирования. Это, скорее всего, способствует приобретению вируса, который уже частично обладает резистентностью к одному или нескольким компонентам терапии и последующей резистентностью к остальным и до некоторой степени провоцирует получение супервируса, который был бы резистентен к нескольким компонентам терапии.
До сих пор мы были достаточно консервативны в диагностике и прописывании терапии. Ее назначали только после того, как выявляется, что один или несколько компонентов терапии первого обращения — универсальной — неэффективны.
Второй компонент — про CRISPR/Cas для вырезания вируса из генома инфицированных клеток. Предполагается таргетирование инфицированных клеток у пациента и вырезание провируса из генома. Я считаю, что это недостаточно целесообразно. Об этом есть ряд статей с разной эффективностью. Все охотно обсуждают эту тему, но сейчас данные в пользу использования этого подхода неубедительны.
Любой процесс с точки зрения физики не обладает 100%-ным коэффициентом полезного действия. Доставить систему CRISPR/Cas в каждую инфицированную клетку просто невозможно. Из-за этого получается, что будут сохраняться клетки с интегрированным вирусом. Более того, лимфоциты, циркулирующие или находящиеся в лимфатических узлах, — это одни клетки, инфицированные ВИЧ. Но есть еще тканевые макрофаги , доставить куда систему редактирования просто не представляется возможным. Ряд ученых, в том числе и я, оценивают такую терапию крайне скептически.
Но я считаю правильным то, что нужно пытаться разрабатывать прогрессивную терапию, основанную не только на ингибиторах, но и на чем-то, что могло бы вылечить.
Каждый день мы пишем о самых важных проблемах в нашей стране. Мы уверены, что их можно преодолеть, только рассказывая о том, что происходит на самом деле. Поэтому мы посылаем корреспондентов в командировки, публикуем репортажи и интервью, фотоистории и экспертные мнения. Мы собираем деньги для множества фондов — и не берем из них никакого процента на свою работу.
Пожалуйста, подпишитесь на любое пожертвование в нашу пользу. Спасибо.
На Ваш почтовый ящик отправлено сообщение, содержащее ссылку для подтверждения правильности адреса. Пожалуйста, перейдите по ссылке для завершения подписки.
Исключительные права на фото- и иные материалы принадлежат авторам. Любое размещение материалов на сторонних ресурсах необходимо согласовывать с правообладателями.
По всем вопросам обращайтесь на mne@nuzhnapomosh.ru
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
- ВКонтакте
- Telegram
- Youtube
- Дзен
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
(Протокол № 1 от 20.01.2020 г.)
Благотворительный фонд помощи социально-незащищенным гражданам "Нужна помощь"
Адрес: 119270, г. Москва, Лужнецкая набережная, д. 2/4, стр. 16, помещение 405
ИНН: 9710001171
КПП: 770401001
ОГРН: 1157700014053
Номер счета получателя платежа: 40703810238000002575
Номер корр. счета банка получателя платежа: 30101810400000000225
Наименование банка получателя платежа: ПАО СБЕРБАНК РОССИИ г. Москва
БИК: 044525225
Персональные данные обрабатываются Фондом для целей исполнения договора пожертвования, заключенного между Вами и Фондом, для целей направления Вам информационных сообщений в виде рассылки по электронной почте, СМС-сообщений. В том числе (но не ограничиваясь) Фонд может направлять Вам уведомления о пожертвованиях, новости и отчеты о работе Фонда. Также Персональные данные могут обрабатываться для целей корректной работы Личного кабинета пользователя Сайта по адресу my.nuzhnapomosh.ru.
Персональные данные будут обрабатываться Фондом путем сбора Персональных данных, их записи, систематизации, накопления, хранения, уточнения (обновления, изменения), извлечения, использования, удаления и уничтожения (как с использованием средств автоматизации, так и без их использования).
Передача Персональных данных третьим лицам может быть осуществлена исключительно по основаниям, предусмотренным законодательством Российской Федерации.
Персональные данные будут обрабатываться Фондом до достижения цели обработки, указанной выше, а после будут обезличены или уничтожены, как того требует применимое законодательство Российской Федерации.


Ученым удалось удалить ВИЧ-инфекцию из ДНК мышей. С помощью долгосрочной лекарственной терапии и инструмента для редактирования генома исследователи смогли избавить клетки от вируса.
Как сообщает Университет Темпл из штата Пенсильвания в США, вирусологам из Медицинской школы Каца и Медицинского центра университета Небраски удалось успешно удалить ДНК ВИЧ-инфекции из генома зараженных мышей. Исследование проводилось на гуманизированных грызунах - специально выведенные животные способны производить Т-лимфоциты человека, восприимчивые к ВИЧ. Побороть инфекцию ученым удалось с помощью антиретровирусной терапии (АРТ) длительного действия и технологии для редактирования генома CRISPR-Cas9.


Ранее ученым уже удалось устранить геном ВИЧ из культивируемых клеток человека - для этого использовалась технология CRISPR-Cas9. Исследование показало, что такая система позволяет вырезать большие фрагменты вирусного ДНК из инфицированных клеток. Новая технология объединена с антиретровирусной терапией длительного действия - LASER ART. Это новый, модифицированный препарат, который приостанавливает репликацию ВИЧ на длительный период. Лекарство "упаковывают" в нанокристалы, которые доставляю его в ткани со "спящим" вирусом. Оказавшийся в нужном месте препарат остается там на несколько недель, медленно высвобождая активное вещество, подавляющее активность ВИЧ.
- Мы хотели посмотреть, сможет ли LASER ART подавлять репликацию ВИЧ достаточно долго для того, чтобы CRISPR-Cas9 полностью избавил клетки от вирусной ДНК, - рассказал один из создателей CRISPR-Cas9 доктор Камель Халили.
В ходе эксперимента к гуманизированным мышам, зараженным ВИЧ, применяли препарат LASER ART, после чего вводили им CRISPR-Cas9. Как только технология удаляла вирусную ДНК из генома животных, подопытных обследовали. В результате полная элиминация вируса была обнаружена у трети мышей, инфицированных ВИЧ. В ходе дальнейших исследований выяснилось, что после лечения ВИЧ не обнаруживается ни в крови, ни в лимфоидной ткани, ни в костном мозге и головном мозге.


В течение года исследователи планируют испытать новую технологию борьбы ВИЧ на приматах и, если это будет возможно, на людях. Пока результаты исследований являются предварительными - ученым до сих пор не удалось понять, почему некоторым зараженным мышам не удалось избавиться от вируса.
На данный момент лечение ВИЧ-инфекции основано на применении антиретровирусных препаратов. Они не избавляют от вируса полностью, но не дают ему распространяться в организме. АРТ требует постоянного применения на протяжении всей жизни зараженного пациента. В случае приостановки терапии ВИЧ возобновляет репликацию, что впоследствии приводит к конечной стадии развития вируса - СПИДу. АРТ значительно снизила смертность от ВИЧ, однако побороть распространение вируса до конца пока не удалось.
На данный момент существует лишь два человека, полностью излечившихся от ВИЧ. Это так называемые "берлинский пациент" Тимоти Браун, избавившийся от вируса в 2008 году в ходе лечения рака крови, и "лондонский пациент", имя которого пока не сообщается - о нем миру стало известно в марте 2019 года. Оба ВИЧ-инфицированных перенесли трансплантацию костного мозга, после чего медики обнаружили у них отсутствие инфицированных клеток.
СПИД и ВИЧ-инфекция до сих пор остаются неизлечимыми заболеваниями, с которыми в мире живут 35 миллионов человек. Современная терапия, направленная в основном на ингибирование ферментов ВИЧ, никак не влияет на провирус – то есть на ДНК вируса, встроенную в наш геном. Избавиться от вируса у нас в геноме возможно благодаря революционной системе CRISPR/Cas9, которая позволит вырезать гены ВИЧ.

Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а – Внедрение чужеродной ДНК в клетку бактерии. б – Приобретение спейсера. в – Транскрипция CRISPR-локуса. г – Образование guideРНК. д – Образование активного комплекса Cas9 + guideРНК. е – Связывание чужеродной ДНК. ж – Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте. Рисунок из [6].
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена – в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ – возбудитель синдрома приобретенного иммунодефицита (СПИДа) – относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.

Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов. Рисунок с сайта agscientific.com.
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы – LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8, 9].

Рисунок 3. Жизненный цикл ВИЧ. 1 – зрелая вирусная частица; 2 – связывание с клеткой благодаря рецепторам; 3 – слияние мембран вируса и клетки; 4 – высвобождение вирусной РНК; 5 – превращение РНК в ДНК (обратная транскрипция); 6 – интеграция в геном клетки; 7 – считывание вирусной информации; 8 – сборка и выход вирусной частицы; 9 – новая вирусная частица. Рисунок с сайта dentalcare.com.

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса. Рисунок из [11].
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 106 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].

Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном. Рисунок из [11].
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них – разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR – это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно – почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
Не все так просто
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы. Рисунок из [6].
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 – ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
Китайские двойняшки

Хе Цзянькуй (He Jiankui), китайский ученый из Южного университета науки и технологий в Шэньчжэне, рассказал в середине ноября о рождении девочек-близняшек с измененным геномом. Геном был отредактирован на стадии эмбрионального развития для защиты детей от ВИЧ.
Китайский ученый-генетик Хе Цзянькуй
Около 1% населения Северной Европы, в том числе в России, имеют иммунитет к ВИЧ с рождения.
Попытки научиться переносить эту невосприимчивость от одного человека к другому ученые предпринимают уже давно. На этой идее основывался и эксперимент Хе Цзянькуя. Но несмотря на окрыляющие результаты, к истории с редактированием генома эмбрионов много вопросов.
Из-за отсутствия доказательств безопасности редактирования генома подсаживать измененные эмбрионы женщинам запрещено в большинстве стран. Поэтому выпускник Стэнфорда и университета Райса Хе Цзянькуй и поставил эксперимент в Китае. Кстати, в этом ему помогал профессор биоинженерии Майкл Дим, с которым Хе познакомился во время обучения.
Более того, китайский ученый не смог или отказался ответить на несколько важных вопросов, в том числе о том, кто финансировал исследование и как он удостоверился, что подопытные знали о возможных последствиях. Смутило ученых и то, что данные о начале эксперимента в государственный реестр клинических испытаний были внесены лишь 8 ноября 2018 года — почти через год после его начала.

Берлинский пациент
Американец Тимоти Рей перенес в немецкой больнице две операции по трансплантации костного мозга от донора, невосприимчивого к ВИЧ. Они происходили в 2007 и 2008 годах. Вылечить медики пытались его от рака крови. А в результате удалось справиться не только с лейкозом, но и снять пациента с антиретровирусной терапии — лекарств, которые принимают ВИЧ-положительные, чтобы замедлить развитие вируса.
Говорить об излечении Рея от ВИЧ специалисты не спешат: сколько еще 52-летний пациент сможет продержаться без терапии, неизвестно.
Испанские больные
После заражения ВИЧ человек может не чувствовать симптомов до 10–12 лет. То есть ученые искусственно пробуждали спящий вирус. Делалось это потому, что справиться с неактивным вирусом с помощью существующих лекарств невозможно.
В результате у 10 из 13 пациентов количество вирусов в крови увеличилось, и они стали проходить антиретровирусную терапию. Но у остальных вирус либо не обнаружился вообще, либо — в незначительном объеме. И в таком состоянии без терапии они провели до 30 недель. Отчитались ученые о работе с 13 пациентами, но на самом деле их было больше — не все вошли в финальную выборку по разным причинами.
После публикации результатов многие СМИ писали о создании вакцины от ВИЧ, однако говорить об этом было преждевременно. Тем более что новых заявлений испанских ученых по поводу состояния подопытных найти не удалось.

Российские инфицированные
Подобные случаи, когда зараженные ВИЧ не нуждаются в замедляющей развитие вируса терапии, встречаются не только в Германии и Испании. По крайней мере об одном ВИЧ-положительном с 20-летним стажем, который без проблем для здоровья отказался от терапии, известно в России. Однако экстраполировать этот опыт на других пациентов так, чтобы состояние улучшалось в 100% случаев, пока не удается.
Поэтому люди с ВИЧ-положительным статусом постоянно принимают лекарства. Антиретровирусная терапия — единственный способ борьбы с вирусом, чья эффективность, пусть и временная, доказана. Кроме того, она исключает возможность передачи вируса от человека к человеку, в том числе от ВИЧ-положительных матерей детям.
Во-вторых, терапия дорогая. В России за счет бюджета в прошлом году удалось обеспечить лекарствами 340 тыс. пациентов, в этом — 412 тыс.
По данным Министерства здравоохранения РФ на ноябрь 2018 года, у 808 тыс. россиян ВИЧ.
Пусть это меньше, чем 1,2 или 1,5 млн, о которых говорят другие организации, в том числе негосударственные, которые ведут свою статистику. В любом случае, количество людей, которых удается лечить за счет бюджета, существенно меньше количества больных. В прошлом году Россия стала первой страной в Европе по числу новых случаев заражения — 71,1 случай на 100 тыс. населения.

Инфицированным остается ждать попадания в бюджетную программу или лечиться самостоятельно. Ко второму варианту подталкивает и то, что некоторые новые зарубежные препараты запрещено покупать за государственный счет.

Дело нескольких лет
Несмотря на то, что пока что все новости о якобы изобретении вакцины и/или лекарства от ВИЧ — в лучшем случае преувеличение, в целом профессиональное сообщество сходится в том, что до появления настоящего работающего препарата осталось недолго.
И хотя испытания российского препарата были удачными, о выпуске его на рынок речь пойдет, только когда медики получат доказательства отсутствия непредсказуемых последствий вмешательства в геном клеток. Тех самых доказательств, которых не стал дожидаться Хе Цзянькуй.
Читайте также:



